UNIVERSIDADE DA BEIRA INTERIOR
Ciências da Saúde
Métodos de Avaliação do risco de Pré-Eclâmpsia
no primeiro trimestre
Sílvia Raquel Ribeiro Almeida
Dissertação para obtenção do Grau de Mestre em
Medicina
(ciclo de estudos integrado)
Orientador: Prof. Doutor José Alberto Fonseca Moutinho
iii
Dedicatória
v
Agradecimentos
Ao professor Doutor José Moutinho pelo entusiasmo com que pegou neste projeto e por toda a orientação para finalizá-lo.
Aos meus pais, por serem o meu porto seguro, por sempre me terem incentivado a não desistir dos meus sonhos e por serem a melhor claque durante toda a minha vida.
À minha irmã, por dizer as coisas certas na altura certa.
À Ema, por me fazer querer ser um exemplo para ela.
Ao Pardal, por toda a paciência, apoio e carinho.
Ao 6º esquerdo, pelo constante incentivo, pela força e ajuda, não só na tese, mas em todos os momentos ao longo destes anos! Sem vocês não teria sido (de todo) possível!
À Cat, que mesmo longe continua a ser um exemplo a seguir e o maior dos apoios!
Aos meus amigos, por fazerem da Covilhã a perfeita segunda casa, a que levo no coração com o maior dos carinhos e com uma saudade sufocante!
À C’a Tuna aos Saltos, por me ter proporcionado os melhores momentos deste percurso e por me ter ensinado muito para além da Medicina.
À FCS-UBI, pela sabedoria que levo deste curso.
vii
Prefácio
“I value screening so that I can appropriately contextualise my risk and plan accordingly. Not for anything, but with other children at home, knowing at 12 weeks that I am higher risk for complications would give me much better lead time to look finding a childcare provider and to budget for it even if I wound up not ultimately needing more advanced care.”
ix
Resumo
Introdução| A pré-eclâmpsia, caracterizada pelo desenvolvimento de hipertensão de novo em
gestantes previamente normotensas, afeta 2 a 8% de todas as gestações, sendo mais frequente após as 20 semanas de gestação. Nestes casos, a hipertensão pode acompanhar-se de proteinúria, de disfunção de órgãos maternos ou de disfunção uteroplacentária. O seu diagnóstico ocorre tradicionalmente em consulta de rotina do 2º ou 3º trimestres. Contudo, em 2011 assistiu-se a uma mudança de paradigma do diagnóstico e tratamento da pré-eclampsia, sendo que as atenções se focaram na sua prevenção e na identificação precoce de grávidas em risco de desenvolverem complicações, com especial foco no 1º trimestre.
Objetivos| Para a realização desta dissertação foram estipulados como objetivos a análise
descritiva da evidência científica atual sobre os métodos de avaliação do risco de desenvolvimento de pré-eclâmpsia que podem ser aplicados durante o 1º trimestre e as medidas preventivas da pré-eclâmpsia neste mesmo trimestre.
Metodologia| Para a elaboração desta revisão bibliográfica foi realizada uma vasta pesquisa
desde setembro de 2018 a abril de 2019, cujas fontes foram a PubMED e o UpToDate. Foram utilizadas as guidelines da Sociedade Portuguesa de Hipertensão, recomendações da American College of Obstetricians and Gynecologists, da National Institute for Health and Care Excellence, da International Society for the Study of Hypertension in Pregnancy e da Organização Mundial de Saúde e ainda normas de orientação clínica da Sociedade Portuguesa de Obstetrícia e Medicina Materno-Fetal.
Discussão| À luz da evidência científica atual as alterações fisiopatológicas da pré-eclâmpsia
precedem as suas manifestações clínicas. Nos últimos anos têm aumentado os estudos acerca da utilidade de marcadores moleculares para a identificação precoce do risco de pré-eclâmpsia no 1º trimestre. Esta identificação permitiria não só a redução da prevalência da doença através da implementação atempada de medidas preventivas, mas também de outras complicações perinatais. Desta forma, será possível individualizar a vigilância obstétrica, determinar o momento apropriado para o parto, e melhorar o prognóstico materno-fetal.
Conclusão| De acordo com a Fetal Medicine Foundation a utilização de marcadores
moleculares e biofísicos em combinação com os fatores maternos recolhidos, permite identificar gravidezes em alto risco de desenvolvimento de pré-eclâmpsia no 1º trimestre, principalmente a de início precoce, que é a que mais contribui para as complicações materno-fetais. Esta identificação possibilita uma melhor alocação de recursos de acordo com o risco individual da grávida, uma vigilância obstétrica personalizada e dirigida e uma intervenção farmacológica com aspirina em baixa dose e suplementação de cálcio, a fim de reduzir a prevalência da doença e das suas complicações.
xi
Palavras-chave
xiii
Abstract
Introduction| Preeclampsia is characterized by the development of hypertension in newly
pregnant females, who previously had normotension. It affects 2 to 8% of all pregnancies and it is more frequent after the twenty week mark of a pregnancy. In Preeclampsia, hypertension can coincide with proteinuria, the dysfunction of maternal organs, or uteroplacental dysfunction. This diagnosis was usually detected in routine consultations within the 2nd or 3rd trimester. However, a paradigm shift in the diagnosis and treatment of preeclampsia was observed in 2011, focusing on its prevention and in the early identification of pregnant women at risk of developing complications. As a result, more emphasis is placed on the 1st trimester to promptly detect risks in women who are prone to such complications.
Objectives | The objective of this dissertation is a descriptive analysis of the current scientific
evidence on the methods used to evaluate the risks of developing preeclampsia in the 1st trimester and the process in which it can be prevented.
Methodology | Since September 2018 up until April 2019 a wide search for credible sources
occurred in order to develop this dissertation. Such sources include: PubMed and UpToDate. There were also used the guidelines from Sociedade Portuguesa de Hipertensão, recommendations from American College of Obstetricians and Gynecologists, National Institute for Health and Care Excellence, International Society for the Study of Hypertension in Pregnancy, World Health Organization, and also the clinical practice guidelines of Sociedade Portuguesa de Obstetrícia e Medicina Materno-Fetal.
Discussion | There has been an increase in studies centered on the usefulness of molecular
markers that identify risks of preeclampsia in the first trimester due to found evidence that changes in pathophysiology of preeclampsia precede clinical manifestations. As a result, this information would help reduce the prevalence of the disease through the implementation of timely preventive measures. It would also reduce other perinatal complications. Ultimately, this would allow individual obstetric observation, therefore, indicating the appropriate time for labor and how to improve maternal-fetal prognosis.
Conclusion | According to Fetal Medicine Foundation the utilization of biochemical and
biophysics markers along with other collected maternal factors, identify pregnancies with a high risk of preeclampsia during the 1st trimester, especially during the earliest stages which contribute most to maternal-fetal complications. Therefore, this enables a more effective resource allocation that focuses on each individual, a personalized obstetric surveillance, and a pharmacological intervention with low doses of aspirin and calcium supplementation. As a result, the presence of the illness and its complications are decreased.
xv
Keywords
xvii
Índice
Dedicatória ... iii Agradecimentos ... v Prefácio ... vii Resumo ... ix Palavras-chave ... xi Abstract... xiii Keywords ... xv Índice ... xviiLista de Figuras... xix
Lista de Tabelas ... xxi
Lista de Acrónimos... xxiii
1. Introdução ... 1
1.1. Contextualização da Pré-Eclâmpsia ... 1
1.1.1. Classificação das Doenças Hipertensivas da Gravidez ... 1
1.1.2. Definição de Pré-Eclâmpsia ... 1 1.1.3. Epidemiologia ... 1 1.1.4. Fatores de Risco ... 2 1.1.5. Fisiopatologia ... 3 1.1.6. Apresentação Clínica ... 4 1.2. Diagnóstico da Pré-Eclâmpsia ... 5
1.3 Complicações da Pré-Eclâmpsia de características severas ... 8
1.3.1 Complicações Agudas ... 8
1.3.2 Complicações a longo prazo ... 9
1.3.3 Complicações fetais/neonatais ... 10
1.4 Tratamento da Pré-Eclâmpsia ... 10
2. Objetivos da Dissertação ... 13
3. Metodologia ... 15
4. Métodos de avaliação do risco de Pré-Eclâmpsia no 1º Trimestre ... 17
4.1 Considerações Gerais ... 17
xviii
4.3 Marcadores moleculares ... 20
4.3.1 Fatores angiogénicos ... 20
4.3.2 Fatores anti-angiogénicos ... 20
4.3.3 Proteína A plasmática associada à gravidez ... 21
4.3.4 Proteína 13 placentária ... 21
4.3.5 Inibina A ... 22
4.3.6 Magnésio sérico ... 22
4.4 Marcadores biofísicos ... 23
4.4.1 Ecografia com Doppler das artérias uterinas ... 23
4.4.2 Pressão arterial média ... 23
4.5 Marcadores combinados ... 26
4.5.1 PAM + Fatores maternos... 26
4.5.2 IP média + PAM + PAPP-A + PIGF + Fatores maternos ... 26
4.5.3 IP média + sEng + PIGF + Fatores maternos ... 27
4.5.4 IP média + PP-13 ... 27
4.5.5 IP média + Inibina A + Fatores maternos ... 27
4.5.6 Magnésio + creatinina séricos ... 27
5. Prevenção da Pré-Eclâmpsia ... 29 5.1 Aspirina ... 29 5.1.1 Mecanismo de ação ... 29 5.1.2 Efeitos na Pré-Eclâmpsia ... 29 5.1.3 Cronobiologia da Aspirina ... 29 5.1.4 Contra-indicações ... 29 5.1.5 Efeitos adversos ... 29
5.1.6 Estudos acerca da aspirina como medida preventiva de Pré-Eclâmpsia ... 30
5.2 Suplementação com Cálcio ... 31
5.3 Outros ... 32
6. Conclusão ... 35
xix
Lista de Figuras
Figura 1 – Fisiopatologia da PE. Adaptada de (16) ... 4 Figura 2 – Distribuição da idade gestacional no parto para PE. Adaptado de (43) ... 19
xxi
Lista de Tabelas
Tabela I – Fatores de risco para PE de acordo com as guidelines da ACOG e da NICE. Adaptado
de (4,15) ... 3
Tabela II - Escala de Goodwin Modificada. Adaptada de (20) ... 6
Tabela III – Critérios diagnósticos de PE. Adaptado de (2,4) ... 7
Tabela IV – Tratamento da PE. Adaptado de (2,4,33) ... 12
Tabela V - Performance da NICE, ACOG e FMF na predição de PE durante o 1º trimestre. Adaptado de (40) ... 18
Tabela VI – Biomarcadores isolados e taxa da predição de PE de cada um deles ... 25
Tabela VII - Biomarcadores combinados e taxa de predição de PE ... 28
Tabela VIII – Recomendações para a implementação da profilaxia de aspirina no âmbito da prevenção de PE, segundo várias entidades ... 31
xxiii
Lista de Acrónimos
ACOG American College of Obstetricians and Gynecologists ALT Alanina Aminotransferase
ASPRE Aspirin for Evidence-Based Preeclampsia Prevention AST Aspartato Aminotransferase
CID Coagulação intravascular disseminada COX Ciclo-oxigenase
DELFIA Dissociation-Enhanced Lanthanide Fluorescent Immunoassay ELISA ensaio de imunoabsorção enzimática
FMF Fetal Medicine Foundation
HELLP Hemolisys, Elevated Liver Functions tests, Low platelet counts IGF Fator de crescimento semelhante à insulina
IM Intramuscular
IMC Índice de Massa Corporal IP Índice de pulsatilidade
ISSHP International Society for the Study of Hypertension in Pregnancy IV Intravenoso
LDH Lactato desidrogenase LES Lúpus Eritematoso Sistémico LIG Leves para a idade gestacional Mg Magnésio
NCCWCH National Collaborating Centre for Women’s and Children’s Health NHFA National Heart Foundation of Australia
NICE National Institute for Health and Care Excellence OMS Organização Mundial de Saúde
PA Pressão arterial
PAM Pressão arterial média
PAPP-A Proteína A plasmática associada à gravidez PE Pré-Eclâmpsia
PGI2 Prostaciclina
PIGF Fator de crescimento placentário PP-13 Proteína 13 placentária
QSD Quadrante superior direito
RCIU Restrição do crescimento intrauterino SAAF Síndrome do Anticorpo Antifosfolipídico sEng Endoglina solúvel
sFlt-1 Tirosina quinase 1 fms-like solúvel TXA2 Tromboxano A2
1
1. Introdução
1.1. Contextualização da Pré-Eclâmpsia
1.1.1. Classificação das Doenças Hipertensivas da Gravidez
Engloba-se na doença hipertensiva da gravidez a hipertensão crónica, a Pré-eclâmpsia (PE) e a Pré-eclâmpsia sobreposta à hipertensão crónica. A hipertensão na gravidez pode ser classificada como crónica ou de novo:
▪ A hipertensão crónica define-se pelo surgimento desta previamente à gravidez ou quando o seu diagnóstico é efetuado antes das 20 semanas de gestação. Cerca de 25% de grávidas com doença hipertensiva da gravidez desenvolve PE sobreposta à hipertensão crónica. Este diagnóstico é feito nas mulheres que têm como antecedente pessoal a Hipertensão Crónica e desenvolvem disfunção de órgão materno compatível com PE (2,3).
▪ A hipertensão de novo pode ser classificada como PE ou hipertensão gestacional, ambas diagnosticadas após as 20 semanas de gestação; a grande diferença entre as duas recai no facto de na hipertensão gestacional não existir proteinúria, disfunção de órgãos maternos ou restrição do crescimento intra-uterino (RCIU), apresentando por isso um prognóstico mais favorável que a PE. Um quarto das grávidas com hipertensão gestacional desenvolve características de PE, evoluindo para esta doença (2,4).
1.1.2. Definição de Pré-Eclâmpsia
A PE é um distúrbio multi-sistémico e progressivo, que se caracteriza pelo desenvolvimento de hipertensão de novo em gestantes previamente normotensas, mais frequentemente após as 20 semanas de gestação. A hipertensão pode acompanhar-se de proteinúria, de disfunção de órgãos maternos ou de disfunção uteroplacentária, sendo predominantemente uma patologia da primigesta (2–6).
Esta patologia constitui a principal causa de internamento materno na unidade de cuidados intensivos com um custo social elevado e com possibilidade de gerar sequelas. Posto isto, é considerada um problema de saúde pública a nível mundial que deve ser explorado (7–9).
1.1.3. Epidemiologia
A PE afeta 2 a 8% de todas as gestações, constituindo uma das principais causas de morbimortalidade perinatal e materna com cerca de 100 mil mortes estimadas em diversos países do mundo. Nos países em desenvolvimento, devido aos cuidados pré-natais precários, à dificuldade de acesso a cuidados hospitalares, falta de profissionais com competências clínicas apropriadas e escassez de recursos, as percentagens são mais elevadas entre as mulheres em
2
idade reprodutiva, podendo atingir cerca de 25% da mortalidade materna. Na Europa, afeta 1% da população geral, incluindo 1.5% de nulíparas. Embora apresente uma baixa incidência nos países desenvolvidos, contribui para 15% dos partos pré-termo, 12% de recém-nascidos leves para a idade gestacional (LIG), 9% a 42% de mortalidade materna e 10% de nados-mortos. A PE de início precoce constitui aproximadamente 0.3 a 1.5% de todas as gravidezes, e a de início tardio cerca de 1.3%. Apresenta ainda 12 a 27% de taxa de recorrência numa gravidez subsequente (5–13).
Nos últimos anos a sua incidência tem vindo a aumentar devido à idade materna avançada, à obesidade, às técnicas de reprodução medicamente assistida, bem como às comorbilidades que aumentam o risco de PE como a diabetes, a hipertensão e as doenças renais (14).
1.1.4. Fatores de Risco
A existência de vários fatores de risco para PE culminou no desenvolvimento de guidelines por parte de diversas entidades de diferentes países. A American College of Obstetricians and Gynecologists (ACOG) inclui apenas fatores de risco que podem ser obtidos através da história clínica como: nuliparidade, gestações múltiplas, PE prévia, pré-diabetes ou diabetes gestacional, antecedentes pessoais de hipertensão crónica, trombofilia, lúpus eritematoso sistémico (LES), síndrome do anticorpo antifosfolipídico (SAAF), doença renal, síndrome da apneia obstrutiva do sono ou um índice de massa corporal (IMC) ≥ 30 kg/m2, idade materna ≥ 35 anos e recurso a reprodução medicamente assistida. . De forma a orientar a implementação de medidas preventivas de PE, a ACOG divide estes fatores em moderado ou alto risco. A National Institute for Health and Care Excellence (NICE) difere da ACOG em alguns valores, nomeadamente na idade materna e no IMC, e em certos fatores de risco, embora mantenha os mesmos princípios. A International Society for the Study of Hypertension in Pregnancy (ISSHP) menciona ainda outros fatores, ainda que menos associados com PE, como: curta duração do relacionamento sexual (< 6 meses) antes da gravidez e a primipaternidade em multíparas (2,4,15).
3
Tabela I – Fatores de risco para PE de acordo com as guidelines da ACOG e da NICE. Adaptado de (4,15)
ACOG NICE
Alto Risco Risco Moderado Alto Risco Risco Moderado
PE em gravidez anterior (especialmente quando acompanhada de complicações); Gestação múltipla; Hipertensão crónica; Doença renal; Doença auto-imune (LES ou SAAF); Diabetes tipo I ou II.
Nuliparidade; Idade materna avançada (≥ 35 anos); Obesidade (IMC ≥ 30 kg/m2); Características sociodemográficas (Raça Afro-Americana ou baixo estado económico); Antecedentes familiares de PE; Intervalo entre gravidezes > 10 anos; Antecedentes pessoais de baixo peso ao nascimento ou LIG. PE em gravidez anterior; Hipertensão crónica; Doença renal crónica;
Doença auto-imune (LES ou SAAF); Diabetes tipo I ou II.
Nuliparidade; Idade materna avançada (≥ 40 anos); Intervalo entre gravidezes > 10 anos; Obesidade (IMC ≥ 35 kg/m2); Antecedentes familiares de PE; Gravidez múltipla.
1.1.5. Fisiopatologia
A etiologia da PE permanece uma incógnita, tendo sido caracterizada como a “doença das teorias”. O conceito mais defendido, e que parece estar no cerne da doença, é a diminuição da perfusão placentária com a consequente libertação de fatores anti-angiogénicos [endoglina solúvel (sEng) e tirosina quinase 1 fms-like solúvel (sFlt-1)] para a circulação materna. Estes fatores levam a uma diminuição do fator de crescimento vascular endotelial (VEGF) e do fator de crescimento placentário (PIGF), que são essenciais para uma normal placentação. Assim, todas as alterações fisiológicas que seriam expectáveis numa gravidez normal a fim de suprir o feto com oxigénio e nutrientes não se processam de maneira correta (14,16).
A fisiopatologia da PE parece estar dividida em duas fases. Na primeira fase, até as 12 semanas de gestação, a grávida encontra-se assintomática. Ocorre a diferenciação dos trofoblastos, a invasão da decídua e o remodelamento das artérias espiraladas de forma defeituosa, resultando numa placentação inadequada, com comprometimento da perfusão da placenta e dos tecidos fetais. Na segunda fase, durante o 2º e 3º trimestres, a placenta isquémica liberta citocinas, fatores anti-angiogénicos e radicais livres de oxigénio para a circulação materna, conduzindo a disfunção endotelial sistémica da mãe com uma resposta inflamatória e stress oxidativo associados, precedendo a síndrome clínica. Adicionalmente, a disfunção endotelial promove o desenvolvimento de um desequilíbrio entre agentes vasoativos como a prostaciclina (PGI2) e o
4
óxido nítrico (potentes vasodilatadores), o tromboxano A2 (TXA2) e as endotelinas (potentes vasoconstritores) culminando num intenso vasoespasmo sistémico da grávida (4,14,16,17).
Figura 1 – Fisiopatologia da PE. Adaptada de (16)
1.1.6. Apresentação Clínica
A PE pode ter apresentação insidiosa, surgindo em grávidas que se apresentam inicialmente assintomáticas mesmo após o diagnóstico de hipertensão, ou fulminante, na qual a grávida desenvolve sintomas graves logo de início. Pode também ser classificada de acordo com o início das manifestações clínicas, como de início precoce, ocorrendo antes das 34 semanas de gestação, ou de início tardio, após as 34 semanas ou até mesmo após o parto. Pode ainda ser classificada como PE pré-termo ou termo quando o parto ocorre antes ou após as 37 semanas de gestação, respetivamente, como consequência do desenvolvimento de PE. Grávidas com apresentação precoce de PE apresentam pior prognóstico, com maior percentagem de mortalidade perinatal e complicações. De acordo com as manifestações clínicas pode ser classificada como moderada ou como de características severas (antiga PE severa) (3,14,18). A PE de características severas tende a progredir para a deterioração da condição materno-fetal. Nestes casos ocorre aumento dos valores de pressão arterial (PA), acompanhado de diversos sinais e sintomas. De entre estes últimos destacam-se as cefaleias persistentes que não cedem à medicação, edema da face, mãos e pés, dor epigástrica ou no quadrante superior direito (QSD) com lesão hepática associada, trombocitopenia, insuficiência renal, dispneia associada ao desenvolvimento de edema pulmonar e alterações visuais como visão turva ou
Remodelamento defeituoso das artérias espiraladas
Hipoperfusão
placentária Isquémia placentária
Fatores anti-angiogénicos (sFlt-1 e sEng) Diminuição de VEGF e PIGF Disfunção endotelial sistémica materna Hipertensão, Proteinúria e Disfunção orgânica materna
5 escotoma persistente. Além disto, podem surgir outros sintomas não específicos como náuseas, vómitos e a diminuição dos movimentos fetais ou do tamanho fetal. No entanto, estes últimos não devem ser ignorados, uma vez que predizem o desenvolvimento de complicações maternas e fetais (2,4,14,15,19).
Perante uma apresentação clínica sugestiva de PE numa idade gestacional inferior a 20 semanas outros diagnósticos devem ser considerados, como: púrpura trombocitopénica trombótica, síndrome hemolítico-urémico, gravidez molar, doença renal ou doença autoimune (4).
1.2. Diagnóstico da Pré-Eclâmpsia
A primeira consulta pré-natal é extremamente importante para detetar precocemente o risco de a grávida desenvolver PE. Perante isto, as recomendações da ACOG e da NICE apontam para a colheita de uma história clínica e exame físico completos, a fim de avaliar os potenciais fatores de risco para o desenvolvimento da doença (3).
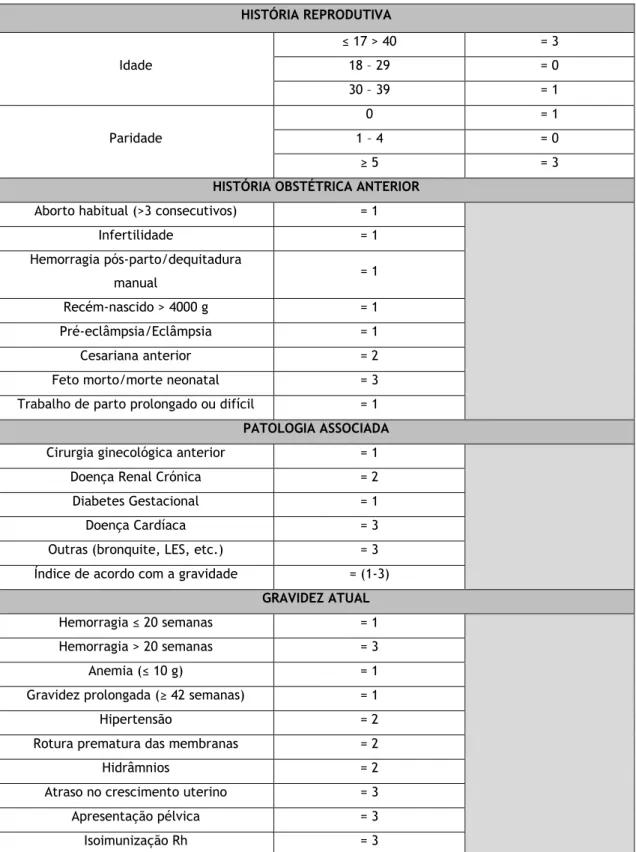
A escala de Goodwin modificada é utilizada em Portugal e permite estratificar a grávida como de baixo, médio ou alto risco obstétrico geral, ou seja, avalia o risco de a grávida vir a desenvolver complicações durante a gravidez, parto ou puerpério. Segundo a escala de Goodwin modificada e de acordo com os fatores de risco enumerados na secção 1.1.3, uma grávida nulípara, com idade materna avançada, antecedentes pessoais de PE, eclâmpsia, doença renal, cardíaca ou LES, apresenta uma gravidez de alto risco de complicações obstétricas incluindo a PE (20).
Nesta primeira consulta é ainda necessário realizar a primeira ecografia obstétrica com o intuito de - avaliar o número de fetos, confirmar a idade gestacional através do comprimento crânio-caudal do feto, medir a translucência nucal e excluir defeitos major, estimar o peso fetal, a quantidade de líquido amniótico e avaliar a placentação (3,21).
Embora o diagnóstico da PE normalmente só se faça a partir das 20 semanas de gestação, é fundamental a medição da PA em todas as consultas de modo a estabelecer o seu valor basal. Na presença de uma grávida com hipertensão de novo, a proteinúria deve ser avaliada através de exame de urina de 24 horas, relação proteína/creatinina ou por tira teste, embora este último tenha evidência de vários falsos-positivos sendo apenas apropriado quando os restantes métodos não estão disponíveis. Na prática clínica a relação proteína/creatinina substitui a urina de 24 horas, diminuindo o tempo de espera pelo resultado e as dificuldades inerentes à avaliação em 24 horas. Um valor de proteinúria > 5 g/24h está associado a um pior prognóstico neonatal e a complicações (2,4).
Em grávidas assintomáticas com hipertensão de novo e sem proteinúria, análises adicionais devem ser obtidas, como: hemograma completo com contagem das plaquetas; creatinina e ácido úrico séricos; enzimas hepáticas [aspartato aminotransferase (AST) e alanina aminotransferase (ALT)] em que a AST eleva-se mais que a ALT, o que permite distinguir de
6
outras lesões hepáticas; perfil hemolítico [lactato desidrogenase (LDH)]; estudo da coagulação (tempo de protrombina, tempo de tromboplastina ativada e fibrinogénio); bilirrubinas totais e as suas frações; haptoglobina; um esfregaço de sangue periférico; deteção do grupo sanguíneo e rastreio de anticorpos irregulares. Estes parâmetros permitem não só diagnosticar, como avaliar a gravidade da PE e a propensão para o desenvolvimento de complicações (2,4,19,22).
Tabela II - Escala de Goodwin Modificada. Adaptada de (20)
HISTÓRIA REPRODUTIVA Idade ≤ 17 > 40 = 3 18 – 29 = 0 30 – 39 = 1 Paridade 0 = 1 1 – 4 = 0 ≥ 5 = 3
HISTÓRIA OBSTÉTRICA ANTERIOR
Aborto habitual (>3 consecutivos) = 1
Infertilidade = 1 Hemorragia pós-parto/dequitadura manual = 1 Recém-nascido > 4000 g = 1 Pré-eclâmpsia/Eclâmpsia = 1 Cesariana anterior = 2 Feto morto/morte neonatal = 3 Trabalho de parto prolongado ou difícil = 1
PATOLOGIA ASSOCIADA
Cirurgia ginecológica anterior = 1 Doença Renal Crónica = 2 Diabetes Gestacional = 1
Doença Cardíaca = 3
Outras (bronquite, LES, etc.) = 3 Índice de acordo com a gravidade = (1-3)
GRAVIDEZ ATUAL
Hemorragia ≤ 20 semanas = 1 Hemorragia > 20 semanas = 3
Anemia (≤ 10 g) = 1
Gravidez prolongada (≥ 42 semanas) = 1
Hipertensão = 2
Rotura prematura das membranas = 2
Hidrâmnios = 2
Atraso no crescimento uterino = 3 Apresentação pélvica = 3
Isoimunização Rh = 3
7 Após o diagnóstico de PE, a grávida deverá ser acompanhada por uma equipa multidisciplinar envolvendo um obstetra, um anestesista, um pediatra e especialistas em hipertensão e nefrologia, assim como pela medicina materno-fetal (14,22).
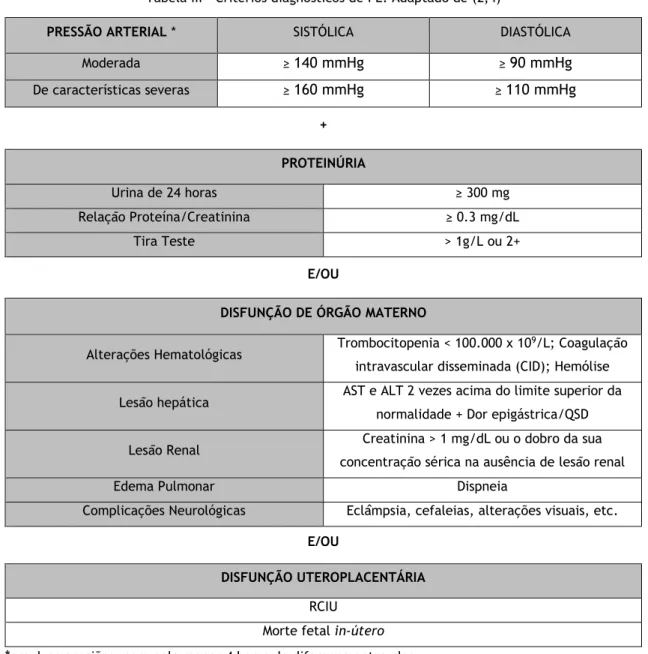
Tabela III – Critérios diagnósticos de PE. Adaptado de (2,4)
PRESSÃO ARTERIAL * SISTÓLICA DIASTÓLICA
Moderada ≥ 140 mmHg ≥ 90 mmHg De características severas ≥ 160 mmHg ≥ 110 mmHg + PROTEINÚRIA Urina de 24 horas ≥ 300 mg Relação Proteína/Creatinina ≥ 0.3 mg/dL Tira Teste > 1g/L ou 2+ E/OU
DISFUNÇÃO DE ÓRGÃO MATERNO
Alterações Hematológicas Trombocitopenia < 100.000 x 10
9/L; Coagulação
intravascular disseminada (CID); Hemólise Lesão hepática AST e ALT 2 vezes acima do limite superior da
normalidade + Dor epigástrica/QSD Lesão Renal Creatinina > 1 mg/dL ou o dobro da sua
concentração sérica na ausência de lesão renal
Edema Pulmonar Dispneia
Complicações Neurológicas Eclâmpsia, cefaleias, alterações visuais, etc.
E/OU
DISFUNÇÃO UTEROPLACENTÁRIA
RCIU Morte fetal in-útero
8
1.3 Complicações da Pré-Eclâmpsia de características severas
Os sistemas orgânicos maternos suscetíveis à inflamação e ao dano endotelial que ocorrem na PE são, principalmente: o sistema nervoso central, o sistema cardiorrespiratório, o fígado, os rins, a vasculatura sistémica, o sistema de coagulação sanguínea e a placenta. O feto também se encontra em risco (19).As complicações maternas podem dividir-se em agudas ou de longa duração (5).
1.3.1 Complicações Agudas
A eclâmpsia refere-se ao desenvolvimento de convulsões tónico-clónicas generalizadas de novo, na ausência de outras etiologias, correspondendo a uma das mais severas complicações da PE, principalmente em países em desenvolvimento. Ocorre em 3.2% das grávidas com PE de características severas e em 1.9% das grávidas com PE moderado, podendo ocorrer antes, durante ou após o parto. É mais comum em grávidas com idade superior a 30 anos, afroamericanas e naquelas sem acesso a cuidados pré-natais. A sua etiologia tem como base a hipertensão desenvolvida na PE que leva à vasoconstrição autorregulatória dos vasos cerebrais, com uma consequente hipoperfusão e isquemia local. Com isto ocorre uma progressiva disfunção endotelial e desenvolvimento de edema vasogénico/citotóxico, levando ao episódio convulsivo. As grávidas podem ser assintomáticas ou apresentar sinais premonitórios de irritação cerebral algumas horas antes do episódio, como: cefaleia frontal ou occipital lancinante, alterações visuais (escotoma, perda de visão temporária, visão turva ou fotofobia) e alteração do estado mental. Após a convulsão, é comum que o feto apresente bradicardia devido à hipoxia e hipercapnia materna, podendo ainda evoluir para taquicardia com algumas desacelerações transitórias. Contudo, após a estabilização materna, o feto volta à homeostasia. Ao exame físico, a grávida pode apresentar défices de memória, cognição e visão e alteração do estado mental. A maioria das grávidas com eclâmpsia desenvolve outras complicações como pneumonia de aspiração, edema pulmonar, descolamento da placenta, CID, acidente vascular cerebral ou paragem cardiorrespiratória. Podem ainda desenvolver síndrome encefalopática reversível posterior, quando a PE ou a eclâmpsia se encontram associadas a cefaleias, distúrbios visuais ou alterações da consciência. O dano cerebral decorrente de hemorragia ou isquemia é a causa mais frequente de morte nas grávidas com eclâmpsia (4,5,23).
A síndrome Hemolisys, Elevated Liver Functions tests, Low platelet counts (HELLP) é uma complicação grave da PE e não um distúrbio independente, caracterizando-se por hemólise microangiopática com enzimas hepáticas elevadas e trombocitopenia. Esta síndrome pode complicar 10 a 20% dos casos de PE de características severas e desenvolve-se mais frequentemente entre as 28 e as 36 semanas de gestação, podendo também ocorrer no 2º trimestre ou no pós-parto. A sua etiologia ainda não foi esclarecida, mas parece estar relacionada com uma placentação anormal e com uma maior inflamação hepática e ativação do sistema de coagulação. Tem como sintomas comuns a dor abdominal e sensibilidade
9 aumentada no epigastro e QSD, com hipertensão e proteinúria associadas na maioria dos casos. Podem também apresentar náuseas, vómitos e mal-estar geral. Os critérios para o diagnóstico da síndrome e que predizem a evolução para complicações são: anemia hemolítica microangiopática com presença de esquistócitos no sangue periférico; a bilirrubina indireta que pode estar elevada e a concentração de haptoglobina diminuída, sugerindo hemólise; a bilirrubina total que deve ser ≥ 1.2 mg/dL; a trombocitopenia que deve ser ≤ 100 000 cel/microL; LDH ≥ 600 IU/L; AST e ALT aumentadas duas vezes acima do limite superior do normal. As complicações mais frequentemente associadas a esta síndrome, e que podem mesmo ser fatais são: a CID, o descolamento prematuro da placenta, lesão renal aguda, edema pulmonar, síndrome de dificuldade respiratória aguda, hematoma hepático subcapsular ou descolamento da retina (2,4,14,19,24).
As complicações agudas podem ainda manifestar-se com o desenvolvimento de acidente vascular cerebral isquémico ou hemorrágico. A maioria das mortes maternas é devida a hemorragia intracraniana e o risco é maior no puerpério (5,14).
1.3.2 Complicações a longo prazo
A PE não apresenta gravidade apenas no momento do diagnóstico, mas também a longo prazo, constituindo um sinal de alarme para o desenvolvimento de várias complicações. Grávidas com início precoce de PE, com historial de parto pré-termo, PE recorrente, morte fetal in-útero ou atraso do crescimento fetal, são consideradas como de maior risco para o desenvolvimento de complicações (5,25).
A etiologia das complicações tardias parece estar relacionada com alterações fisiológicas da PE como: disfunção endotelial; resistência à insulina; atividade simpática aumentada; atividade pró-inflamatória e um perfil lipídico anormal que se mantém após o parto. Estas alterações parecem resultar em futuras complicações cardiovasculares, neurológicas, renais, metabólicas ou até em morte (16,26).
A Sociedade Portuguesa da Hipertensão e a ACOG afirmam que a PE constitui um indicador precoce de hipertensão e de outras doenças cardiovasculares como enfarte agudo do miocárdio e insuficiência cardíaca congestiva. O risco de desenvolvimento de doença isquémica, acidente vascular cerebral e eventos venosos trombo-embólicos nos 5 a 15 anos após uma gravidez com PE é de aproximadamente o dobro da população obstétrica saudável (3,5,25).
As grávidas com antecedentes de PE apresentam ainda um risco aumentado de sofrerem depressão pós-parto, de diabetes, de diminuição da função tiroideia e de doença renal crónica (13,27–29).
Por fim, mulheres com história de PE de características severas e de início precoce, apresentam maior risco de desenvolver complicações obstétricas em gestações futuras como nova PE, principalmente se durante a primeira ocorrência apresentaram síndrome HELLP, eclâmpsia ou um parto pré-termo (30,31).
10
1.3.3 Complicações fetais/neonatais
As doenças maternas associadas a má perfusão uteroplacentária, como a PE e a eclâmpsia, são responsáveis por prematuridade, descolamento prematuro da placenta, asfixia intrauterina, RCIU, oligohidrâmnio ou até, morte fetal (4,32).
Um parto prematuro apresenta possíveis complicações neonatais associadas como: síndrome de dificuldade respiratória, apneia, icterícia, kernicterus, dificuldades na amamentação, hipoglicemias, convulsões, leucomalácia periventricular e hospitalização prolongada (13). Outra complicação fetal importante é a displasia broncopulmonar. Esta patologia desenvolve-se devido ao estado anti-angiogénico característico da PE, em que ocorre um anormal desenvolvimento da vasculatura pulmonar do feto (16).
Os filhos de pacientes com antecedentes de PE têm ainda uma maior probabilidade de desenvolver doenças cardiovasculares (como hipertensão arterial ou insuficiência cardíaca), diabetes ou intolerância à glicose na idade adulta. O risco destas doenças aumenta com o aumento do seu IMC (13,16).
1.4 Tratamento da Pré-Eclâmpsia
O tratamento da PE tem como principal objetivo prevenir as complicações supracitadas (14). Nos casos de PE moderada, o tratamento se necessário pode ser feito em ambulatório, com avaliações semanais da vitalidade fetal através da ecografia e de exames laboratoriais, a partir do momento do diagnóstico. Se não se verificarem alterações do líquido amniótico ou RCIU, a grávida pode ser avaliada a cada duas semanas. A gestante tem indicação de recorrer ao hospital se surgirem sintomas indicativos de gravidade (2,4,14).
Nos casos de PE de características severas, o tratamento visa a prevenção dos efeitos adversos da PA elevada e a prevenção de eclâmpsia. A hospitalização é recomendada, assim como uma avaliação clínica, laboratorial e ecográfica semanal para avaliar uma possível deterioração do bem-estar materno-fetal. No caso de desenvolvimento de síndrome HELLP, a ACOG preconiza a realização de avaliação laboratorial a cada 12 horas (4,25).
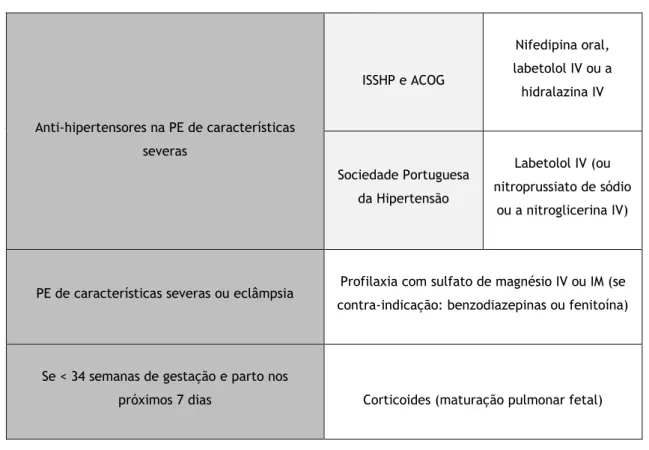
O tratamento farmacológico anti-hipertensivo só é necessário na PE de características severas persistentes, permitindo melhorar o prognóstico materno-fetal ao prolongar a duração da gestação, diminuir o risco de complicações e diminuir o tempo de internamento hospitalar. A ISSHP e a ACOG recomendam a nifedipina oral, o labetolol intravenoso (IV) ou a hidralazina IV, sendo que a PA diastólica deve diminuir para valores que rondem os 85 mmHg e a sistólica para valores < 160 mmHg, embora não se verifique um consenso entre as várias entidades. Os anti-hipertensores devem ser reduzidos ou mesmo cessados se a PA diastólica for < 80 mmHg, uma vez que a hipotensão pode ser perigosa para o feto. Segundo a Sociedade Portuguesa da Hipertensão, o medicamento eleito para o tratamento anti-hipertensivo da PE é o labetolol IV,
11 e como alternativas existem o nitroprussiato de sódio ou a nitroglicerina em infusão IV (2,14,22,25).
O único tratamento curativo da PE é o parto, sendo que a decisão de o realizar deve ter em conta a idade gestacional, a estimativa do peso fetal e a sua posição, o estado cervical e a gravidade da PE. O parto é ponderado quando: não é possível controlar a PA usando mais de 3 anti-hipertensores nas doses apropriadas; ocorre deterioração progressiva da função hepática, pulmonar, renal, hematológica ou neurológica; ocorre descolamento da placenta; ocorre morte fetal in-útero; a cardiotocografia ou a ecografia doppler não asseguram a viabilidade do feto (2,4).
Se diagnóstico de PE moderada for efetuado após as 37 semanas não há vantagens em adiar o parto vaginal. Por outro lado, em grávidas com PE de características severas diagnosticadas às 34 semanas, deve ser feita a indução do trabalho de parto após estabilização materna e, naquelas com menos de 34 semanas e em condições estáveis, deve ser tomada uma atitude expectante a fim de melhorar o prognóstico neonatal. Caso haja indícios de deterioração da condição materna ou fetal que coloque em risco a vida de ambos, deve ser realizado o parto imediatamente. Nos partos que estejam indicados antes das 34 semanas de gestação e que serão realizados nos 7 dias seguintes, devem ser administrados corticoides a fim de acelerar a maturação pulmonar do feto. Em grávidas de 24 semanas de gestação e com o feto nos limites da sua viabilidade, deve ser aconselhada a interrupção da gravidez. O diagnóstico de PE de características severas antes das 28 semanas de gestação preconiza a realização de uma cesariana. Contudo, a decisão deve ser individualizada e baseada na progressão da PE. Durante o parto devem ser administrados os anti-hipertensores que a grávida já tinha iniciado (2,4,15). As grávidas com PE de características severas podem evoluir para eclâmpsia, sendo necessário aplicar medidas preventivas. Por conseguinte, é feita a profilaxia com sulfato de magnésio IV ou intramuscular (IM) para prevenir convulsões recorrentes e as suas consequências. No caso de contra-indicação ao uso de sulfato de magnésio, podem ser administradas benzodiazepinas ou fenitoína (4,5,33).
As mulheres que iniciaram anti-hipertensores durante o período pré-natal, devem continuar o tratamento nos três a seis dias pós-parto, a não ser que a PA < 110/70 mmHg. A monitorização da PA deve ser feita, pelo menos, nos três dias pós-parto com um intervalo de quatro a seis horas e requer avaliação laboratorial até estabilização. Após três meses do parto, deve voltar a avaliar-se a PA e a realizar-se exames laboratoriais (2,33).
12
Tabela IV – Tratamento da PE. Adaptado de (2,4,33)
Anti-hipertensores na PE de características severas ISSHP e ACOG Nifedipina oral, labetolol IV ou a hidralazina IV Sociedade Portuguesa da Hipertensão Labetolol IV (ou nitroprussiato de sódio ou a nitroglicerina IV)
PE de características severas ou eclâmpsia Profilaxia com sulfato de magnésio IV ou IM (se contra-indicação: benzodiazepinas ou fenitoína)
Se < 34 semanas de gestação e parto nos
13
2. Objetivos da Dissertação
O objetivo desta dissertação é a análise descritiva da evidência científica atual sobre:
▪ os métodos de avaliação do risco de desenvolvimento de PE que podem ser aplicados durante o 1º trimestre;
15
3. Metodologia
Para a elaboração desta revisão bibliográfica foi realizada uma pesquisa desde setembro de 2018 a abril de 2019. Foram utilizadas as bases de dados, PubMED e UpToDate, bem como as guidelines da Sociedade Portuguesa de Hipertensão, recomendações da ACOG, da NICE, da ISSHP, da Organização Mundial de Saúde e as normas de orientação clínica da Sociedade Portuguesa de Obstetrícia e Medicina Materno-Fetal.
As palavras-chave utilizadas foram: Gravidez; Pré-Eclâmpsia; Primeiro Trimestre; Métodos de avaliação; Hipertensão.
Não houve limitação temporal na pesquisa, apesar de ter sido atribuída maior importância a artigos mais recentes. Estes artigos foram restringidos a dois idiomas: português e inglês.
17
4. Métodos de avaliação do risco de
Pré-Eclâmpsia no 1º Trimestre
4.1 Considerações Gerais
O diagnóstico da PE ocorre tradicionalmente nas consultas de vigilância do 2º (14 às 28 semanas) e 3º trimestres (29 às 40 semanas), dado ser nesta fase que ocorrem a maioria das consultas pré-natais e se diagnosticam mais complicações. Contudo, em 2011 foi proposta a mudança da pirâmide de cuidados pré-natais em vigor há 80 anos, e que dava mais importância ao tratamento da doença no 2º e 3º trimestres, para a sua versão invertida, que visa a identificação precoce de grávidas em risco de desenvolverem PE e as suas complicações no 1º trimestre (< 13 semanas) para que seja possível implementar uma prevenção atempadamente (20,34,35). Assim, e à luz da evidência atual que demonstra que as alterações fisiopatológicas da PE precedem as suas manifestações clínicas, têm aumentado os estudos acerca dos possíveis marcadores para a identificação precoce do risco de PE no 1º trimestre. Esta identificação permitiria não só a redução da prevalência da doença através da implementação atempada de medidas preventivas, mas também de outras complicações perinatais. Deste modo, seria possível individualizar a vigilância obstétrica, determinar o momento apropriado para o parto, e melhorar o prognóstico materno-fetal. Ainda que o tema permaneça controverso, várias entidades de diversos países têm emitido recomendações ao longo dos últimos anos acerca da avaliação do risco de PE no 1º trimestre (36–39).
Em 2004, a Organização Mundial de Saúde (OMS) descreveu que não existiam testes de rastreio clinicamente aceitáveis para predizer o desenvolvimento de PE, tanto em gravidezes de baixo como de alto risco. Adiantou ainda que um teste preditivo de PE ideal deveria ser simples, inócuo, rápido, não invasivo, reproduzível e barato. Uma vez que a incidência de PE, tanto em países desenvolvidos como em desenvolvimento, é relativamente baixa, o teste deve ter uma alta sensibilidade, para aumentar a probabilidade de PE entre as mulheres com o resultado do teste positivo, e uma alta especificidade para, com alto grau de confiança, excluir a doença com um resultado negativo (39).
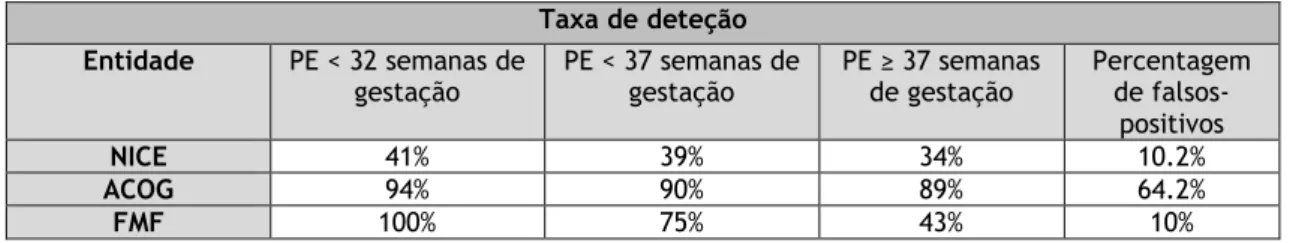
Em 2011, a NICE do Reino Unido, emitiu guidelines que sublinhavam a importância da existência de fatores de risco específicos para o aumento da probabilidade de desenvolvimento de PE, e com ela a elaboração de um plano controlado de visitas pré-natais. A deteção de PE segundo as suas guidelines seria de 41% dos partos com PE < 32 semanas de gestação, 39% de PE < 37 e 34% de PE ≥ 37, para uma percentagem de falsos-positivos de 10.2% (21,40).
Em 2015, a ACOG emitiu a recomendação de que não se deve fazer rastreio para a predição de PE no 1º trimestre, pois considera ser mais prejudicial do que benéfico, uma vez que aumenta
18
a ansiedade parental tendo por base testes com um valor preditivo positivo muito diminuído. Recomenda que se faça uma colheita minuciosa da história clínica da grávida, a fim de avaliar os seus fatores de risco. Um estudo avaliou a taxa de deteção de PE através das suas recomendações, e verificou a identificação de 94% de PE < 32 semanas, 90% < 37 semanas e 89% ≥ 37 semanas de gestação, com uma percentagem de falsos positivos de 64.2%, e, portanto, dois terços das grávidas seriam classificadas como de alto risco e com propensão positiva para desenvolvimento de PE (40,41).
A Fetal Medicine Foundation (FMF) conduziu um estudo alternativo, que permitiu estimar o risco específico e individual de cada grávida desenvolver PE, através do teorema de Bayes, que combina o risco a-priori dos fatores maternos recolhidos na história clínica, com marcadores biofísicos e moleculares avaliados entre as 11 e as 13 semanas e 6 dias de gestação, no âmbito de uma avaliação obstétrica de rotina. O rastreio baseado no algoritmo da FMF permitiu predizer 100% dos partos com PE < 32 semanas de gestação, 75% de PE < 37 e 43% de PE ≥ 37, para uma percentagem de falsos-positivos de 10% (40,42).
Tabela V - Performance da NICE, ACOG e FMF na predição de PE durante o 1º trimestre. Adaptado de
(40)
Taxa de deteção Entidade PE < 32 semanas de
gestação PE < 37 semanas de gestação PE ≥ 37 semanas de gestação Percentagem de falsos-positivos
NICE 41% 39% 34% 10.2%
ACOG 94% 90% 89% 64.2%
FMF 100% 75% 43% 10%
Dada a complexidade da doença, vários estudos foram conduzidos para a avaliação da capacidade individual de certos marcadores, ou a sua combinação, na previsão e prevenção do desenvolvimento de PE. No entanto, ainda nenhuma entidade conseguiu comprovar quais os métodos mais esclarecedores e passíveis de avaliação no 1º trimestre para este fim (18,21,40).
4.2 Fatores maternos
Em 2008, a National Collaborating Centre for Women’s and Children’s Health (NCCWCH) defendia que cada fator de risco devia funcionar como um marcador isolado para o rastreio de PE. Contudo, isso iria classificar falsamente dois terços da população obstétrica como em risco de desenvolver PE e com necessidade de monitorização apertada. Assim, Leona C Y Poon et al. sugeriram uma abordagem alternativa que consistia na realização de um questionário contendo a combinação das características maternas e da história clínica da grávida (fatores maternos). Este questionário era realizado no 1º trimestre e incluía a idade materna, altura e peso (com o cálculo do IMC), a raça, os hábitos tabágicos e o abuso de substâncias na gestação, o método de conceção (espontâneo ou assistido), os antecedentes pessoais, a medicação habitual, história obstétrica, intervalo de tempo entre a primeira e a segunda gravidez e antecedentes
19 familiares de PE. Desta maneira, seria possível avaliar o risco específico e individual da grávida desenvolver PE em um terço das gravidezes (11,21).
Num estudo levado a cabo por D. Wright et al. foi adotado um modelo de risco baseado na idade gestacional aquando do parto desencadeado por PE. Esta abordagem pressupõe que se a gravidez continuasse indefinidamente, todas as mulheres desenvolveriam PE. Assim, as variáveis dos fatores maternos permitem uma modificação na média da distribuição da idade gestacional no parto com PE para que, em gestações de baixo risco, a distribuição da idade gestacional seja deslocada para a direita com a implicação de que, na maioria das gestações, o parto realmente ocorrerá antes do desenvolvimento da PE. Nas gestações de alto risco, a distribuição é deslocada para a esquerda, e quanto menor a idade gestacional média, maior é o risco de PE (43).
Figura 2 – Distribuição da idade gestacional no parto para PE. Adaptado de (43)
Vários estudos permitiram determinar que o risco de PE era mais elevado em grávidas com excesso de peso, com idade materna avançada (> 40 anos), em afro-americanas ou sul asiáticas, em mulheres que tinham recorrido à reprodução medicamente assistida ou com um intervalo entre gravidezes maior que 10 anos, em nulíparas ou multíparas com antecedentes pessoais de PE, naquelas com antedecentes familiares de PE e em mulheres com hipertensão arterial, diabetes, LES e SAAF pré-existentes. Em multíparas sem historial de PE, o risco decrescia 60-70%. O fator que mais consensualmente contribuiu para um risco aumentado de PE foi a hipertensão arterial crónica (11,43,44).
Baixo risco
20
A combinação da avaliação das características maternas e história clínica, entre as 11 e as 13 semanas de gestação, permitem identificar 40% de PE total, 48% de PE com parto < 37 semanas de gestação e 54% de PE com parto < 34 semanas de gestação, com uma percentagem de falsos positivos de 11%. Outro estudo mais recente por Neil O’Gorman et al. revelou percentagens mais elevadas com 49% de PE pré-termo e 38% de PE termo, com falsos-positivos de 10% (18,43).
4.3 Marcadores moleculares
4.3.1 Fatores angiogénicos
Os fatores responsáveis por uma normal angiogénese e desenvolvimento placentário são o VEGF e o PIGF. O primeiro encontra-se indetetável no 1º trimestre, não sendo passível de avaliação. Já o segundo, encontra-se em concentrações que o permitem detetar e avaliar, levando a que seja o marcador angiogénico mais relatado em estudos (44,45).
O PIGF é uma glicoproteína, membro da família dos fatores de crescimento vasculares endoteliais, e está implicado na angiogénese placentária e na invasão trofoblástica das artérias espiraladas maternas. Durante a gravidez normal, estas artérias convertem-se de vasos com alta impedância em vasos não musculares com baixa resistência, a fim de suprir as necessidades do feto. Assim, é expectável que o nível sérico de PIGF aumente linearmente no decorrer do 1º trimestre. Quando em concentrações progressivamente elevadas, este marcador permite excluir o diagnóstico de PE em mulheres em que se suspeite desta doença, uma vez que tem um valor preditivo negativo elevado comparado com a avaliação de fatores de risco isolada. Esta constatação possibilita uma monitorização menos apertada e previne hospitalizações e gastos de recursos desnecessários. Contudo, a sua diminuição abaixo de 100 pg/ml, sugere disfunção e hipoxia placentária, com o aumento do risco de desenvolvimento de PE e de parto pré-termo com recém nascidos LIG. O PIGF funciona, portanto, como biomarcador de doença placentária (21,46–49).
A avaliação deste marcador requer uma colheita sanguínea, entre as 11 e as 13 semanas e 6 dias de gestação, para posterior análise e quantificação plasmática pelo teste Dissociation-Enhanced Lanthanide Fluorescent Immunoassay (DELFIA) Xpress PIGF 1-2-3 (47,48,50).
Um estudo concluiu que o PIGF isolado permitiu predizer 41-52% de PE de início precoce e 33% de PE de início tardio, tendo sido considerado um marcador com resultados persistentes e promissores (44).
4.3.2 Fatores anti-angiogénicos
Uma placentação anormal conduz ao desenvolvimento de isquemia, com a consequente libertação aumentada de fatores anti-angiogénicos, como a sFlt-1 e o sEng, para a circulação materna. Estas proteínas antagonizam o funcionamento da VEGF e do PIGF, levando a uma disfunção endotelial sistémica que aumenta o risco de PE de início precoce. O sFlt-1 encontra-se em concentrações plasmáticas elevadas em grávidas com elevado risco de deencontra-senvolver PE
21 nas 5 a 10 semanas anteriores ao diagnóstico clínico, e permanece constante no 1º trimestre, podendo até atingir valores sobreponíveis aos das grávidas com placentação normal. Pensa-se que o sFlt-1 aumenta em locais específicos da própria placenta e interfere com a migração trofoblástica e com a pseudovasculogénese, porém essas mudanças não são refletidas na circulação materna durante o 1º trimestre da gravidez. Assim, este fator não auxilia na avaliação do risco de PE neste trimestre (44,45,51).
Já o sEng, parece estar aumentado desde o 1º trimestre, segundo um estudo levado a cabo por Foidart et al.. Os seus níveis estão elevados 2 a 10 vezes mais do que em grávidas normotensas na PE de início precoce, e mantidos na PE de início tardio. A avaliação do sEng isolado permitiu estimar 30 a 46.7% de PE de início precoce, com percentagens de 5 a 10% de falsos-positivos, respetivamente (52).
4.3.3 Proteína A plasmática associada à gravidez
A proteína A plasmática associada à gravidez (PAPP-A) é uma metaloproteinase derivada dos trofoblastos placentários em desenvolvimento, que regula e aumenta a função mitogénica dos fatores de crescimento semelhantes à insulina (IGF), na interface da placenta com a decídua. Estes, desempenham um papel significativo na regulação autócrina e parácrina da invasão trofoblástica na decídua sendo, portanto, necessários para que ocorra uma placentação normal (10,21,44).
Assim, uma diminuição da PAPP-A no 1º trimestre, embora usualmente associada às aneuploidias cromossómicas, pode indicar outras complicações obstétricas, como a PE, no caso de nos encontrarmos perante um cariótipo normal. Estudos demonstraram que os níveis de PAPP-A na PE de início precoce eram mais baixos e mais significativos que os da de início tardio (21,44).
A medição da PAPP-A é feita através de uma colheita sanguínea entre as 11 e as 13 semanas e 6 dias de gestação, com posterior análise e deteção das suas concentrações plasmáticas pelo ensaio de imunoabsorção enzimática (ELISA). O seu valor permite avaliar o risco de alterações cromossómicas e, uma vez que ele já foi medido para este fim, a sua concentração pode ser contemplada para prever o risco de PE. Um estudo permitiu predizer que o risco de PE através da medição isolada de PAPP-A era de aproximadamente 22 a 41% na de início precoce (44,50,53).
4.3.4 Proteína 13 placentária
A proteína 13 placentária (PP-13) é um dímero produzido exclusivamente pelos trofoblastos placentários que se liga a proteínas da matriz extracelular entre a placenta e o miómetrio, estando envolvida na placentação normal. Tem como função facilitar a invasão trofoblástica e aumentar a libertação de prostaglandinas, necessárias para o remodelling vascular materno. Pode ainda apresentar funções imunológicas e hemostáticas, uma vez que se demonstrou que
22
agregados de PP-13 estão associados a acumulação de neutrófilos, macrófagos e células T. Durante uma gravidez normal, os seus níveis vão aumentando de forma a que as alterações necessárias a uma placentação normal ocorram. Contudo, uma desregulação da PP-13, nomeadamente a diminuição da sua concentração sérica, pode contribuir para uma disfunção placentária, e conduzir ao desenvolvimento de PE (54–56).
Akolekar et al. verificou que a deteção estimada de PE de início precoce através da medição isolada de PP-13 era de 20.8 e 37.5%, com percentagens de falsos positivos de 5 e 10%, respetivamente. Quanto à PE de início tardio, o PP-13 não se demonstrou significativamente diferente do grupo controlo e, portanto, não teria valor na avaliação do seu risco. O estudo concluiu que o valor sérico de PP-13, encontra-se significativamente diminuído no 1º trimestre em grávidas que no futuro desenvolveram PE de início precoce (55).
Outro estudo, verificou que casos de recém-nascidos LIG decorrentes de gravidezes que desenvolveram PE, tinham valores séricos de PP-13 inferiores aos verificados com PIGF (54,56).
4.3.5 Inibina A
A inibina A é uma hormona glicoproteica dimérica produzida por vários tecidos, em especial pela placenta. Tem funções autócrinas e parácrinas afetando a invasão trofoblástica. Vários estudos verificaram que os seus níveis plasmáticos estariam aumentados 1.5 a 8.5 vezes em grávidas com PE, devido a uma hiperplasia reativa das células citotrofoblásticas que conduz a um aumento da sua produção ou, devido a alterações na função dos sinciciotrofoblastos que levam a um aumento da libertação de proteínas placentárias para a circulação materna. Assim, a inibina A como biomarcador permitiu detetar 23.1% e 30.8% de PE de início precoce e 13.7% e 16.8% de PE de início tardio, com percentagens de falsos-positivos de 5% e 10%, respetivamente (57).
4.3.6 Magnésio sérico
O magnésio (Mg) é um mineral e um cofator significativo em várias reações bioquímicas, nomeadamente no stress oxidativo. Tem como funções importantes a regulação da PA através da estimulação da produção de PGI2, que induzem vasodilatação e inibem a agregação plaquetária, e a regulação de cálcio, potássio e sódio séricos através do seu transporte pelas membranas celulares. Assim, um défice de Mg aumenta o risco de disfunção endotelial, hipertensão e, em última instância, de doenças cardiovasculares (58).
Um estudo recente levado a cabo por Čabarkapa et al. constatou que grávidas com concentrações de Mg abaixo de 0.81 mmol/L no 1º trimestre, têm uma probabilidade 2.71 vezes maior de desenvolverem PE, com uma sensibilidade de 77% e uma especificidade de 71.6%. Esta baixa concentração contribui para o aumento da PA, para a redução da proliferação celular da placenta e do feto e para um aumento do stress oxidativo, com uma consequente diminuição
23 da perfusão placentária e possível perda embrionária ou RCIU. Assim, a sua concentração sérica poderia auxiliar a avaliação do risco de PE no 1º trimestre (58).
4.4 Marcadores biofísicos
4.4.1 Ecografia com Doppler das artérias uterinas
A ecografia com doppler das artérias uterinas é um exame não invasivo, transabdominal ou transvaginal, que permite avaliar precocemente a perfusão do leito vascular placentário. Para a sua realização, a grávida deve permanecer em decúbito dorsal e com a cabeceira ligeiramente elevada (59).
Embora a etiologia da PE seja ainda desconhecida, pensa-se que a sua origem assente numa disfunção placentária com uma velocidade de fluxo anormal e aumento da resistência por parte dos vasos placentários, com um consequente aumento da impedância do fluxo das artérias uterinas. Desta maneira, vários estudos têm avaliado o índice de pulsatilidade (IP) média das artérias uterinas em grávidas com fatores de risco clínicos já conhecidos, e têm concluído que este se encontra aumentado no 1º trimestre de grávidas que desenvolvem PE (21,35,37,44). Uma vez que a avaliação deste marcador é operador dependente, é necessário um médico com treino específico para assegurar a qualidade e fiabilidade da medição deste índice. A ecografia é realizada das 11 às 13 semanas e 6 dias de gestação, com obtenção de uma imagem sagital do útero e do canal cervical. A sonda percorre este território com recurso ao doppler com cor a fim de identificar cada artéria uterina. Após a sua identificação, recorre-se ao doppler pulsátil para obter 3 formatos de onda consecutivas e sobreponíveis para por fim, medir o IP e calcular a média das artérias uterinas esquerda e direita. Valores deste índice acima de 2.36 correspondendo ao percentil 95, são considerados anormais (18,37,60,61).
Nos países desenvolvidos, a grande maioria das grávidas têm acesso à realização de uma ecografia de vigilância no 1º trimestre com o objetivo de confirmar a viabilidade fetal, determinar o número de fetos, a corionicidade, quantificar a idade gestacional, diagnosticar malformações major e contribuir para a avaliação do risco de aneuploidias. Um estudo realizado no Reino Unido, levado a cabo pela FMF, referiu que o mesmo ecógrafo que procede à avaliação referida, poderá também avaliar o IP média, para possível rastreio de PE. Desta forma, seria possível minimizar os custos e o tempo adicionais (com um acréscimo de 5 minutos relatado) (18,35,60,62).
Um IP média isolado acima do percentil 95, permitiu detetar 33 a 83% de PE de início precoce e 21 a 62% de PE de início tardio (44).
4.4.2 Pressão arterial média
A medição da pressão arterial média (PAM) mostrou-se superior na previsão de PE em relação à avaliação da PA sistólica, diastólica ou ao aumento da PA isolados (8).
24
A realização desta medição requer a utilização de um protocolo específico, atualmente baseado na informação da National Heart Foundation of Australia (NHFA). Esta entidade recomenda que a sua avaliação seja feita em ambos os braços com um mínimo de 2 medições em cada um, e com um intervalo de 1 minuto entre elas de forma a evitar a possível ansiedade do paciente perante um profissional de saúde. Os dispositivos devem ser automatizados, calibrados e manuseados por médicos experientes, com recurso a uma braçadeira apropriada à circunferência dos braços da grávida. Esta deve estar sentada em repouso de pelo menos 5 minutos antes da medição e com os braços apoiados ao nível do coração. As últimas duas medições estáveis de ambos os braços, devem ter uma diferença entre elas inferior a 10 mmHg de sistólica e 6 mmHg de diastólica. Para calcular a PAM é utilizada a média dos últimos 2 valores para cada braço. O rastreio não deve privilegiar nenhum braço e é mais fiável quando a média é calculada através de pelo menos 4 medições, duas em cada braço. Assim, uma PAM superior a 88 mmHg estaria relacionada com um aumento do risco de PE (12,40,63).
Um estudo realizado por Leona C Y Poon et al. permitiu identificar que com uma percentagem de 10% de falsos-positivos, a PAM isolada contribui com 37.5% para a deteção de PE (64).
25
Tabela VI – Biomarcadores isolados e taxa da predição de PE de cada um deles
Referência Biomarcador avaliado Predição de PE
D. Wright et al. 2015 (43)
Fatores maternos
PE total : 40% ; PE com parto < 37 semanas de gestação :48%; PE com parto < 34 semanas de
gestação: 54%, com uma percentagem de falsos positivos
de 11%
Neil O’Gorman et al. 2016 (18)
PE pré-termo: 49%; PE termo: 38%, com uma percentagem de
falsos-positivos de 10%
Wortelboer et al. 2011 (44) PIGF PE de início precoce: 41 a 52%;
PE de início tardio: 33%
Foidart et al. 2010 (52) sEng
PE de início precoce: 30 a 46.7%, com percentagens de 5 a
10% de falsos-positivos, respetivamente. PE de início
tardio sem valor
Wortelboer et al. 2011 (44) PAPP-A PE de início precoce: 22 a 41%
Akolekar, Syngelaki, et al. 2009
(55) PP-13
PE de início precoce: 20.8% e 37.5%, com percentagens de falsos positivos de 5% e 10%, respetivamente. PE de início
tardio sem valor
Akolekar, Minekawa, et al. 2009
(57) Inibina A PE de início precoce: 23.1% e 30.8%; PE de início tardio: 13.7% e 16.8%, com percentagens de falsos-positivos de 5% e 10%, respetivamente Čabarkapa et al. 2018 (58) Mg
Probabilidade 2.71 vezes maior de desenvolvimento de PE
Sensibilidade: 77% ; Especificidade: 71.6%;
Wortelboer et al. 2011 (44) IP média PE de início precoce: 33 a 83%;
PE de início tardio: 21 a 62%
Leona C Y Poon et al. 2008 (64) PAM
PE total: 37.5%, com uma percentagem de 10% de
26
4.5 Marcadores combinados
4.5.1 PAM + Fatores maternos
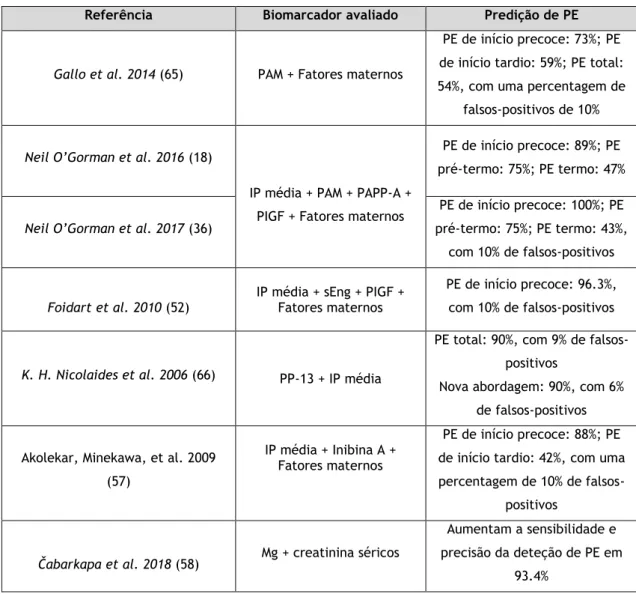
A recolha da história clínica da grávida e das suas características juntamente com a medição da PAM constituem as ferramentas mais baratas a realizar na primeira consulta pré-natal (64). Um estudo desenvolvido por Gallo et al. estimou que o rastreio realizado das 11 às 13 semanas e 6 dias de gestação utilizando estes marcadores detetaria 73% das gravidezes que iriam desenvolver PE de início precoce, 59% de PE de início tardio e 54% de PE total, com uma percentagem de falsos-positivos de 10%. Os fatores maternos que mais influenciaram o valor de PAM foram o excesso de peso e os antecedentes pessoais de hipertensão arterial crónica, com aproximadamente 14% e 12% acrescidos à PAM, respetivamente. Desta maneira, a PAM aliada à história clínica constituem bons marcadores para o rastreio da PE (38,65).
4.5.2 IP média + PAM + PAPP-A + PIGF + Fatores maternos
Um estudo desenvolvido por Neil O’Gorman et al. pretendeu desenvolver um modelo para o rastreio de PE no 1º trimestre, que permitisse utilizar o teorema de Bayes para calcular o risco a-priori baseado nos fatores maternos juntamente com os resultados de vários marcadores moleculares e biofísicos. Assim, este modelo combinou os fatores maternos ao IP média, à PAM, à PAPP-A e ao PIGF (18).
Em gravidezes que desenvolveram PE, os valores do IP média e da PAM estavam aumentados, enquanto que os de PAPP-A e PIGF estavam diminuídos. Para todos os biomarcadores, o desvio da normalidade é maior na PE de início precoce do que na de início tardio, concluindo que o risco é inversamente proporcional à idade gestacional na qual é necessário realizar o parto (18). A combinação dos biomarcadores aos fatores de risco maternos mostrou-se superior em relação à avaliação do risco apenas com fatores maternos, sendo que a única exceção foi o PAPP-A sérico, que embora melhore o rastreio quando combinado com fatores maternos ou marcadores biofísicos, não revelou melhorar nenhuma combinação que já tivesse incluído o PIGF. Assim, a combinação do IP média, PAM, PIGF e fatores maternos permitiu predizer 89% de PE de início precoce, 75% de casos de PE pré-termo e 47% de PE termo. Portanto, nas mulheres em que o rastreio foi positivo, o risco de desenvolver PE era maior do que naquelas em que o rastreio foi negativo (18).
Um estudo mais recente validou a informação do anterior e permitiu predizer 100% de PE de início precoce, 75% de PE pré-termo e 43% de PE termo, com 10% de falsos-positivos. Conclui-se que estes biomarcadores identificam uma alta proporção de casos de PE antes das 37 semanas de gestação, mas não tanto após estas semanas (36).
27
4.5.3 IP média + sEng + PIGF + Fatores maternos
Comparativamente com os grupos controlo, a PE de início precoce, apresenta valores de sEng plasmática e de IP média elevados, enquanto que o PIGF se encontra diminuído. Já na PE de início tardio, o sEng não apresenta valores diferentes dos controlos, não contribuindo para o rastreio. Assim, a combinação destes biomarcadores prediz 96.3% dos casos destinados a desenvolver PE de início precoce, com 10% de falsos-positivos (52).
4.5.4 IP média + PP-13
Estes dois biomarcadores combinados permitem predizer 90% de PE que requer o parto antes das 34 semanas de gestação, com uma percentagem de falsos-positivos de 9%. Um estudo elaborou uma nova abordagem que permitiria detetar os mesmos 90% de grávidas em risco de PE, em que todas as grávidas mediriam o PP-13 plasmático, mas apenas 14% das consideradas de alto risco fariam a ecografia doppler com avaliação do IP média. Esta abordagem apresentaria apenas 6% de falsos-positivos e traria uma maior probabilidade de ser aplicada à população obstétrica geral por apresentar menos custos associados (66).
4.5.5 IP média + Inibina A + Fatores maternos
Um estudo com a combinação destes biomarcadores aos fatores maternos, permitiu predizer 88% de PE de início precoce e 42% de PE de início tardio, com uma percentagem de 10% de falsos-positivos (57).
4.5.6 Magnésio + creatinina séricos
Um estudo dirigido por Čabarkapa et al. verificou que a avaliação simultânea de magnésio (<0.81 mmol/L) e creatinina (>53 µmol/L) séricos durante o 1º trimestre, aumenta a sensibilidade e precisão da deteção de PE em 93.4% (58).