“ESTUDO DE ADSORÇÃO EM SOLUÇÃO AQUOSA DE DOIS
CORANTES CATIÔNICOS E DE UMA ETERAMINA USANDO
BAGAÇOS DE CANA MODIFICADOS QUIMICAMENTE”
Karla Aparecida Guimarães Gusmão
Universidade Federal de Ouro Preto
Programa de Pós-Graduação Engenharia ambiental
Mestrado em Engenharia Ambiental
Karla Aparecida Guimarães Gusmão
“
ESTUDO DE ADSORÇÃO EM SOLUÇÃO AQUOSA DE DOIS
CORANTES CATIÔNICOS E DE UMA ETERAMINA USANDO
BAGAÇOS DE CANA MODIFICADOS QUIMICAMENTE”
Dissertação apresentada ao Programa de Pós-Graduação em Engenharia Ambiental, Universidade Federal de Ouro Preto, como parte dos requisitos
necessários para a obtenção do título: “Mestre em
Engenharia Ambiental – Área de Concentração: Tecnologias Ambientais”
Orientador: Prof. Dr. Laurent Frédéric Gil
Catalogação: sisbin@sisbin.ufop.br
G982e Gusmão, Karla Aparecida Guimarães.
Estudo de adsorção em solução aquosa de dois corantes catiônicos e de uma eteramina usando bagaços de cana modificados quimicamente
[manuscrito] / Karla Aparecida Guimarães Gusmão – 2011. xiii, 90 f. : il., color.; graf.; tabs.
Orientador: Prof. Dr. Laurent Frédéric Gil.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas e Pós-graduação em
Recursos Hídricos. Programa de Pós-graduação em Engenharia Ambiental. Área de concentração: Tecnologias Ambientais.
1. Adsorção - Teses. 2. Corantes - Teses. 3. Resíduos industriais - Teses. 4. Cinética química - Teses. I. Gil, Laurent Frederic. II. Universidade Federal de Ouro Preto. III. Título.
CDU: 628.161.2
I
Dedico este trabalho primeiramente a Deus, pela saúde, fé e perseverança que tem me dado. A meus pais, a quem honro pelo esforço. Os meus familiares e amigos pelo incentivo na busca de
II
Agradecimentos
Agradeço primeiramente a Deus por ter me permitido chegar aqui, com saúde e sem fraquejar pelo caminho.
Agradeço a Deus pelos meus pais, José e Alda, que sempre me apoiaram e mesmo de longe estiveram sempre presentes com suas orações e todo amor. Aos meus irmãos, Fabiano, Kelly e Kamila pelo carinho.
Agradeço aos meus Tios Sonia e Farah, e toda família: Jamilly, André, Lucas, Maria e Dany, pela acolhida, cuidado e incentivo.
Agradeço meu orientador, Prof. Dr. Laurent Frédéric Gil, pelos dois anos de orientação, amizade e carinho.
A Professora Tânia, pelo carinho e por estar sempre presente e disposta a ajudar. Ao Leandro, pela co-orientação e por todas as dúvidas esclarecidas.
Aos meus ajudantes, que me auxiliaram durante todo o projeto: Francine, Diego, Wallace e Leonardo.
Aos meus companheiros de batalha, que me apoiaram e sempre acreditaram em um final feliz: Kisla, Thaísa, Jussara, Bruno, Nilda, Luide e Carlúcio.
Aos amigos de Ouro Preto, Belo Horizonte e Itamarandiba pelos momentos de descontração, mesmo que tenham sido poucos nestes dois anos. Em especial a Naty, Vá e Simone que estiveram sempre presentes e escutando minhas lamentações e as dificuldades encontradas pelo caminho!
A todos os professores do DEQUI, em especial aos Professores Sérgio e Cornélio pela colaboração no decorrer do projeto.
A todos que torceram e torcem por mim,
III
“No fim tudo dá certo, e se não deu certo é porque ainda não chegou ao fim."
IV
Conteúdo
Índice de Figuras... VII Índice de Tabelas ...IX Lista de Abreviações e Símbolos ... X Resumo...XII Abstract ... XIII
1 Introdução ...1
2 Revisão bibliográfica ...4
2.1 Contaminação dos recursos hídricos por compostos orgânicos ...4
2.2 O Problema dos corantes...4
2.2.1 Classificação dos corantes ...6
i) Corantes ácidos ...7
ii) Corantes Básicos...7
iii) Corantes Diretos ...8
iv) Corantes Dispersos...8
v) Corantes Reativos ...9
vi) Corantes Pré- Metalizados ...9
vii) Corantes Sulfúricos ... 10
viii) Corantes à Cuba ... 10
2.2.2 Remoção de corantes ... 11
2.2.3 Adsorventes alternativos na remoção de corantes ... 14
2.3 As eteraminas ... 16
2.3.1 Processo de flotação e as eteraminas ... 16
2.3.2 Custo e impacto ambiental ... 19
2.4 Bagaço de cana ... 20
2.4.1 Composição ... 20
2.4.2 Utilização do bagaço de cana como adsorvente ... 24
2.5 Adsorção ... 26
2.5.1 Modelos cinéticos ... 26
2.5.1.1 Modelo cinético de pseudo-primeira ordem ... 27
2.5.1.2 Modelo cinético de pseudo-segunda ordem... 28
2.5.1.3 Modelo cinético Elovich... 28
2.5.1.4 Modelo de difusão intraparticula ... 29
V
2.5.2.1 Langmuir ... 30
2.5.2.2 Freundlich ... 31
2.5.2.3 Tempkim ... 32
3 Materiais e Métodos ... 33
3.1 Materiais ... 33
3.1.1 Reagentes ... 33
3.1.2 Matéria prima para materiais adsorventes ... 34
3.1.3 Adsorvatos ... 34
3.2 Métodos ... 34
3.2.1 Materiais adsorventes ... 34
3.2.1.1 Pré- tramento ... 34
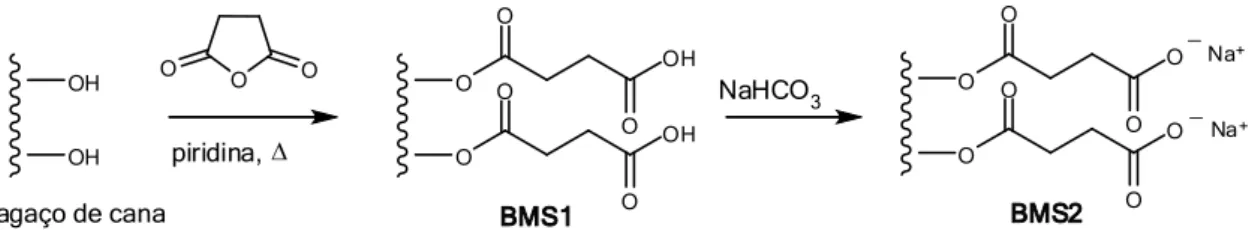
3.2.1.2 Modificação química com anidrido succínico (BMS2) ... 35
3.2.1.3 Modificação química com dianidrido do EDTA (BME) ... 36
3.2.2 Caracterização dos materiais ... 37
i) Espectroscopia no infravermelho com transformada de Fourier (FTIR) ... 37
ii) Análise elementar ... 37
iii) Determinação do ponto de carga zero (pHPCZ) ... 38
iv) Determinação das áreas superficiais ... 38
3.3 Ensaios de adsorção dos corantes ... 38
3.3.1 Estudos cinéticos... 39
3.3.2 Estudos do pH ... 39
3.3.3 Isoterma de adsorção ... 40
3.3.4 Quantificação dos corantes ... 41
3.4 Adsorção da eteramina ... 41
3.4.1 Estudo cinético ... 41
3.4.2 Estudo pH ... 42
3.4.3 Isotermas de adsorção ... 42
3.4.4 Quantificação da eteramina ... 42
4 Resultados e Discussão... 44
4.1 Síntese e caracterização dos materiais ... 44
4.1.1 Caracterização de BMS2: ... 44
4.1.1.1 Ganho de massa e concentração de funções introduzidas: ... 44
4.1.1.2 Espectroscopia na região do infravermelho ... 44
VI
4.1.2.1 Análise elementar, ganho de massa e concentração de funções introduzidas: ... 46
4.1.3 Espectrocopia na região do infravermelho ... 47
4.1.4 Área superficial, volume e largura dos microporos ... 47
4.1.5 Ponto de carga zero (pHPZC) ... 48
4.2 Adsorção dos corantes Azul de Metileno e Violeta Cristal por BMS2 e BME ... 49
4.2.1 Estudo cinético ... 49
4.2.2 Estudo em função do pH ... 59
4.2.3 Isoterma de adsorção ... 60
4.3 Adsorção de eteramina em BMS2 e BME ... 69
4.3.1 Estudo cinético ... 69
4.3.2 Influencia do pH ... 75
4.3.3 Isotermas de adsorção ... 76
5 Conclusão ... 81
VII
Índice de Figuras
Figura 1.1: Estrutura dos bagaços de cana modificados, dos corantes básicos Azul de Metileno e
Violeta Cristal e da eterdiamina Flotigam 2835. ...3
Figura 2.1: Estrutura química característica de um azo corante. ...6
Figura 2.2: Estrutura química do corante Índigo blue. ...6
Figura 2.3: Estrutura química do corante 9,10-Antraquinona. ...6
Figura 2.4: Estrutura dos corantes básicos Azul de Metileno e Violeta Cristal...8
Figura 2.5 Exemplo de corante direto (I - corante Vermelho Congo) contendo grupos diazo como grupos cromóforo (Guaratini e Zanoni, 2000). ...8
Figura 2.6: Exemplo de corante dispersivo Corante Vermelho de Lonamina KA (Guaratini e Zanoni, 2000). ...9
Figura 2.7: Exemplo do processo de tintura de algodão com corante contendo o grupo sulfatoetilsufona como centro reativo da molécula (Guaratini e Zanoni, 2000) ...9
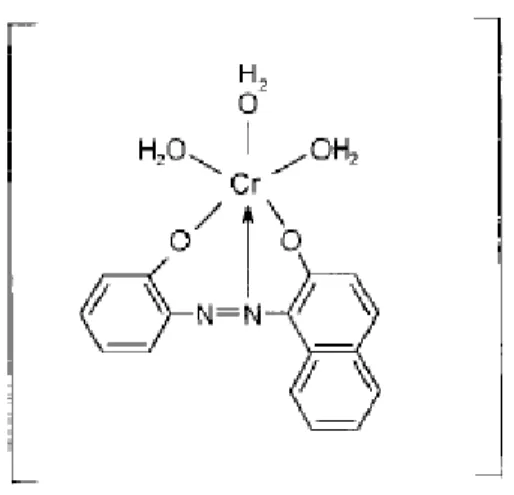
Figura 2.8: Exemplo de tintura da lã com o corante pré-metalizado cromo/corante 1:1(Guaratini e Zanoni, 2000). ... 10
Figura 2.9: Exemplo da reação de corantes contendo grupo tiossulfato com íon sulfeto e subsequente formação dos corantes com pontes de dissulfeto (Guaratini e Zanoni, 2000). ... 10
Figura 2.10: Estrutura geral de um corante à cuba (Guaratini e Zanoni, 2000)... 11
Figura 2.11: Classificação das aminas ... 18
Figura 2.12: Estrutura geral de uma eterdiamina e uma eteramina... 18
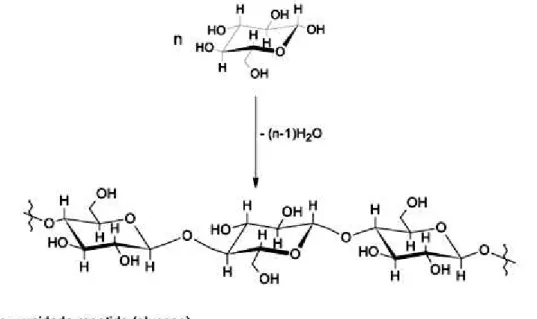
Figura 2.13: Formação da cadeia de celulose pela união de unidades β-D-glucose. ... 21
Figura 2.14: Estrutura dos principais componentes da poliose... 22
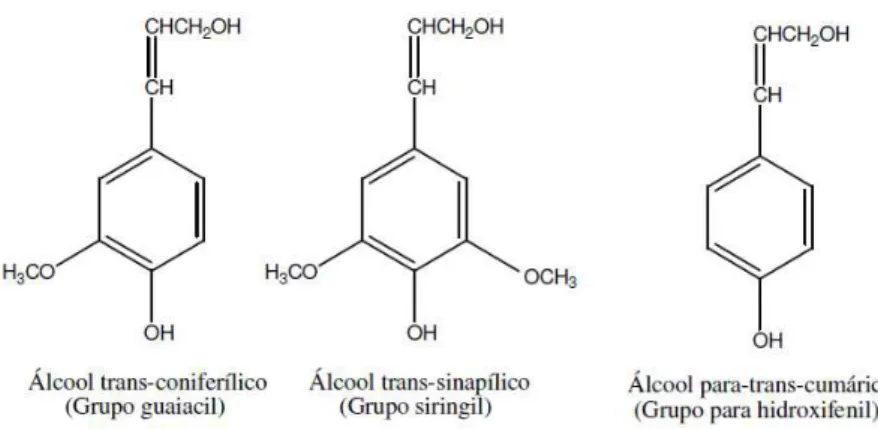
Figura 2.15: Precursores básicos da lignina ... 23
Figura 2.16: Estrutura proposta por Nimz para a lignina. ... 23
Figura 2.17: Rota de síntese do material adsorvente BMS2. ... 25
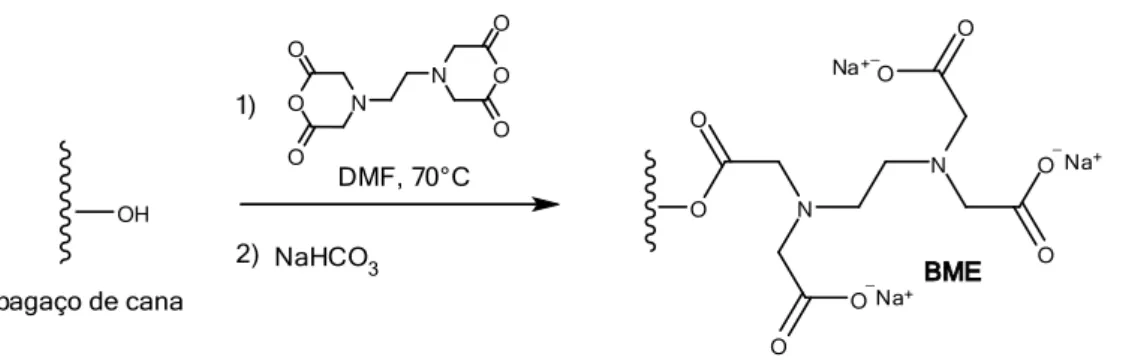
Figura 2.18: Rota de síntese do material adsorvente BME. ... 25
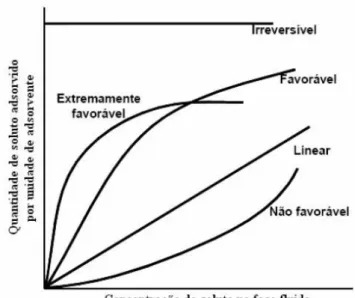
Figura 2.19: Isotermas de adsorção ... 30
Figura 3.1: Rota sintética da modificação química do bagaço de cana com anidrido succínico. ... 36
Figura 3.2: Rota sintética da modificação química do bagaço de cana com dianidrido de EDTA ... 37
Figura 4.1: Rota de síntese dos materiais BMS1 e BMS2. ... 44
Figura 4.2: Espectro FTIR do bagaço de cana B e bagaço de cana modificado BMS1 ... 45
Figura 4.3: Rota de síntese dos materiais BME. ... 46
Figura 4.4: Espectro FTIR para bagaço de cana B e bagaço de cana modificado BME ... 47
Figura 4.5: Determinação do pHPCZ dos materiais (a) BMS2 e (b) BME. ... 49
Figura 4.6: Variação da adsorção de AM e VC em BMS2 em função do tempo. ... 50
Figura 4.7: Variação da adsorção de AM e VC em BME em função do tempo. ... 50
Figura 4.8: Modelos cinéticos da adsorção do corante AM em BMS2, (a) PPO, (b) PSO e (c) EE. ... 52
Figura 4.9: Modelos cinéticos da adsorção do corante VC em BMS2, (a) PPO, (b) PSO e (c) EE. ... 53
VIII Figura 4.11: Modelos cinéticos da adsorção do corante VC em BME, (a) PPO, (b) PSO e (c) EE.
... 55
Figura 4.12: Modelo de DIP dos corantes AM e VC em BMS2. ... 58
Figura 4.13 Modelo de DIP dos corantes AM e VC em BME. ... 58
Figura 4.14: Variação da adsorção dos corantes AM e VC por BMS2 em função do pH. ... 59
Figura 4.15: Variação da adsorção dos corantes AM e VC por BME em função do pH. ... 60
Figura 4.16: Isotermas de adsorção para remoção de AM por BMS2, Modelos de (a) Langmuir, (b) Freundlich e (c) Tempkim. ... 62
Figura 4.17: Isotermas de adsorção para remoção de VC por BMS2, Modelos de (a) Langmuir, (b) Freundlich e (c) Tempkim. ... 63
Figura 4.18: Isotermas de adsorção para remoção de AM por BME, Modelos de Langmuir, Freundlich e Tempkim. ... 64
Figura 4.19: Isotermas de adsorção para remoção de VC por BME, Modelos de ... 65
Figura 4.20: Cinética de adsorção da eteramina em BMS2 e BME como tempo. ... 70
Figura 4.21: Modelos cinéticos da adsorção da eteramina em BMS2, (a) PPO, (b) PSO e (c) EE. 71 Figura 4.22: Modelos cinéticos da adsorção da eteramina em BME, (a) PPO, (b) PSO e (c) EE. . 72
Figura 4.23: Modelo de difusão intraparticula da eteramina em BMS2 e BME. ... 74
Figura 4.24: Variação da adsorção da eteramina por BMS2 e BME em função do pH. ... 75
Figura 4.25: Isotermas de adsorção para remoção de eteramina por BMS2, Modelos de ... 77
IX
Índice de Tabelas
Tabela 4.1: Análise elementar, concentração de unidade de EDTA introduzida e ganho de
massa. ... 46
Tabela 4.2: Características superficiais dos materiais BMS2 e BME. ... 48
Tabela 4.3: Parâmetros cinéticos para a adsorção de AM e VC em BMS2. ... 56
Tabela 4.4: Parâmetros cinéticos para a adsorção de AM e VC em BME. ... 56
Tabela 4.5: Parâmetros cinéticos do modelo de DIP para adsorção de AM e VC em BMS2. ... 58
Tabela 4.6: Parâmetros cinéticos do modelo de DIP para adsorção de AM e VC em BME. ... 59
Tabela 4.7: Parâmetros das isotermas para a adsorção de AM e VC em BMS2. ... 66
Tabela 4.8: Parâmetros das isotermas para a adsorção de AM e VC em BME. ... 66
Tabela 4.9: Materiais adsorventes listados na literatura e suas capacidades de adsorção para AM. ... 68
Tabela 4.10Materiais adsorventes listados na literatura e suas capacidades de adsorção para VC. ... 69
Tabela 4.11: Parâmetros cinéticos para a adsorção da eteramina em BMS2 e BME. ... 73
Tabela 4.12: Parâmetros cinéticos do modelo de Difusão Intrapartícula para adsorção de eteramina em BMS2 e BME. ... 74
X
Lista de Abreviações e Símbolos
BMS2– Bagaço de cana modificado com anidrido succínico
BME– Bagaço de cana modificado com dianidrido do EDTA
FTIR – Espectroscopia na região do infravermelho com transformada de Fourier
RL– Fator de separação, constante adimensional
Qmax– Quantidade máxima adsorvida (mg/g)
Ce- Concentração de equilibrio (mg/L)
C0– Concentração antes da adsorção
b– Constante de Langmuir (L/mg)
kf– Constante de Freundlich
n– Fator de heterogeneidade da isoterma de Freundlich
At e Bt– Parâmetros da isoterma de Tempkin
R2– Coeficiente de correlação
qe - Quantidade adsorvida no equilíbrio (mg/g)
λmax– Comprimento de onda de absorbância máxima (nm)
rpm – Rotações por minuto
PPO – Modelo de pseudo-primeira ordem
PSO - Modelo cinético de pseudo-segunda ordem
DIP – Modelo de difusão intraparticula
EE – Equação de Elovich
k1 - Constante de velocidade de pseudo-primeira ordem (min
-1)
XI
α - Taxa de adsorção inicial da Equação de Elovich (mg/g h)
β– Constante da Equação de Elovich (g/mg)
kid - Constante de velocidade de difusão intrapartícula (mg/g min1/2)
CCOOH– Concentração de funções ácido carboxílico (mmol/g)
XII
Resumo
Neste trabalho, a adsorção de corantes e de eteramina em bagaços de cana quimicamente modificados foi estudada a fim de caracterizar os processos de adsorção, destacando a análise de parâmetros cinéticos e de equilíbrio. O bagaço de cana que é um resíduo da indústria agrícola foi modificado quimicamente e avaliado quanto a sua capacidade de
adsorção (ou remoção) dos corantes catiônicos Azul de Metileno (AM) e Violeta Cristal
(VC), e de uma eteramina (eterdiamina Flotigam 2835) utilizada na flotação do minério de
ferro, em soluções aquosas. Os matériais adsorventes foram obtidos por meio de
modificações químicas do bagaço com anidrido succínico (BMS2) e com dianidrido do
EDTA (BME) e foram caracterizados para confirmação das funções introduzidas e para
determinação das características superficiais, através de análise FTIR, análise elementar,
BET e pHPZC. Posteriormente os materiais foram aplicados nos testes de adsorção, em
sistemas de batelada. Os dados cinéticos foram avaliados pelos modelos de Pseudo-primeira ordem, Pseudo-segunda ordem, Equação de Elovich e Difusão intrapartícula. Nos estudos de cinética de adsorção dos corantes e da eteramina, os resultados apresentaram um melhor ajuste ao modelo de Pseudo-segunda ordem, apresentando os maiores coeficientes de correlação entre os modelos. O modelo de Difusão intraparticula, apresentou multilineriadade, indicando que duas ou mais etapas podem ocorrer, envolvendo mais de uma única cinética por processo. Foram utilizados os modelos de Langmuir, Freundlich e Tempkin para avaliar a capacidade de adsorção dos corantes e da
eteramina pelos bagaços modificados, BMS2 e BME. . O modelo de Langmuir mostrou-se
o mais adequado para todos os estudos de adsorção, com valores de Qmax de 478,47 e
202,43 mg/g para AM, 1273,16 e 327,87 mg/g para VC e 869,56 e 1203,45 mg/g para a
eteramina em BMS2 e BME, respectivamente.
XIII
Abstract
In this work the adsorption of dyes and etheramine in chemically modified bagasse was studied. The results emphasize the kinetic and equilibrium parameters of this process. Sugarcane bagasse is an industrial waste that has been chemically modified and evaluated
for their capacity of adsorption (or removal) of the cationic dye, Methylene Blue (MB) and
Crystal Violet (CV), and a etheramine (etherdiamine Flotigam 2835) used in reverse
flotation, in aqueous solutions. The materials adsorbent were obtained through chemical
modification of bagasse with succinic anhydride (BMS2) and EDTA dianhydride (BME)
and were characterized to confirm the functions introduced and to determine the
characteristics of the surface, by FTIR analysis, elemental analysis, BET and pHPZC.
Subsequently the materials were applied in tests of adsorption in batch systems. The kinetic models were evaluated by the pseudo-first order, pseudo-second order, Elovich equation and intraparticle diffusion. In kinetic studies of adsorption of dyes and etheramine, the results showed a better fit to the model of Pseudo-second order. The
intraparticle diffusion model presented multilinerities, indicating that two or more steps
may occur, involving more than one per process kinetics. The adsorption capacity of
BMS2 and BME for dyes and etheramine had been evaluated using Langmuir, Freundlich
and Tempkin adsorption isotherms. The Langmuir’s model gave best results for all
adsorption studies, with values of Qmax of 478,47 e 202,43 mg/g for AM, 1273,16 and
327,87 mg/g for VC and 869,56 and 1203,45 mg/g for the etheramine of BMS2 and BME,
respectively.
1
1
Introdução
A contaminação dos recursos hídricos pode ser apontada como um dos grandes problemas dos países desenvolvidos e em desenvolvimento. Dentre as várias fontes de contaminação, os processos industriais contribuem significativamente, devido à grande geração de efluentes com elevada carga poluente. Os rejeitos gerados pelas indústrias tais como os metais pesados, os corantes e os compostos orgânicos são, em geral, espécies químicas altamente tóxicas para os solos, águas e o homem. O descarte inapropriado destes materiais causa grande preocupação devido às alterações que provocam nas condições naturais do meio ambiente onde são descartados (Paulino, 2008).
Neste contexto, os processos têxteis têm grande importância, pois são grandes consumidores de água e de corantes sintéticos, gerando grandes volumes de efluente com elevada carga orgânica e forte coloração devido à presença de corantes que não são fixados às fibras. Pela própria natureza, os corantes são facilmente detectados a olho nu, sendo visíveis mesmo em concentrações bastante baixas. Por este motivo, qualquer quantidade utilizada e lançada, após o seu uso, pode causar uma mudança na coloração da água, gerando um comprometimento do sistema aquoso (Royer, 2008). Lançamento de tais efluentes dá cor e afeta o valor estético dos córregos. A cor interfere na penetração da luz solar no meio aquático, retarda a fotossíntese, inibe o crescimento da biota aquática e
interfere na solubilidade de gases em corpos d’água. Além disso, descargas diretas dos
efluentes urbanos e/ou de águas residuais em ambiente natural podem causar a formação
de repartições tóxicas e cancerígenas a partir dos corantes sintéticos (Garg et al., 2004)
Vários métodos têm sido testados para a remoção de cor dos efluentes industriais, a fim de diminuir seu impacto sobre o meio ambiente. Estes métodos incluem adsorção em matrizes inorgânicas ou orgânicas, descoloração por catálise ou processos de foto-oxidação, degradação microbiológica, oxidação química, ozonização e coagulação. A adsorção é um dos mais eficazes processos utilizados para a remoção de corantes, e o carvão ativado é o adsorvente mais empregado, com grande sucesso, devido à sua grande área superficial, estrutura microporosa e elevada capacidade de adsorção. Contudo o uso em grande escala de carvão ativado como adsorvente eleva o custo do processo tornando-o inviável. O custo da adsorção como método para remoção de corantes de efluentes pode
ser reduzido se o adsorvente utilizado for de baixo custo (Forgacs et al., 2004; Lata et al.,
2
A mineração também consome uma grande quantidade de água, e seu uso vem tornando-se cada vez mais objeto da preocupação das empresas do segmento. A área de beneficiamento consome grande parte das águas utilizadas nas indústrias minerais e metalúrgicas.
A variedade de produtos químicos utilizados nas diversas etapas do beneficiamento de minérios cresceu com a necessidade de aumentar a eficiência dos processos e, dentre estes, ressaltam-se os produtos orgânicos, que são utilizados em elevadas concentrações, como depressores, dispersantes, floculantes, coletores, espumantes, auxiliares de filtração, dentre outros ( da Silva, 2009).
O processo de flotação é um dos métodos de concentração mais utilizados, e destaca-se pelo alto consumo de água na mineração. Para cada tonelada de minério de ferro
processada utiliza-se, em média, 4m3 de água. Quantidades significativas de aminas
utilizadas como reagentes na flotação de minérios acabam ficando contidas na polpa do rejeito. Esta polpa é descartada para as barragens de rejeito, e consequentemente, é uma forma de contaminação de águas (Leal, 2010). A remoção destes produtos permite aumentar a percentagem de água de recirculação e diminuir a contaminação nas barragens de rejeito (da Silva, 2009).
A possibilidade de reutilização das aminas resultaria em considerável redução de custos operacionais, além da diminuição da quantidade de reagentes liberados para o meio ambiente. Estima-se que aproximadamente 5500 toneladas de derivados de amina sejam
usadas anualmente no Brasil em processos de flotação (Araujo et al., 2008).
Neste contexto, o presente trabalho objetivou estudar a adsorção de corantes catiônicos e de eteramina em bagaços de cana quimicamente modificados, buscando uma possível aplicação da adsorção em efluentes provenientes de indústrias têxteis e da flotação reversa de minério de ferro.
Os objetivos específicos são:
Avaliar a capacidade de dois bagaços de cana modificados quimicamente, BME e
BMS2, quanto à remoção de dois corantes catiônicos, o Azul de Metileno e o
Violeta Cristal, e de uma eteramina (eterdiamina Flotigam 2835) em soluções aquosas (Figura 1.1);
Estudar o mecanismo de adsorção envolvido nos processo de adsorção, com base
em estudos cinéticos e de equilíbrio;
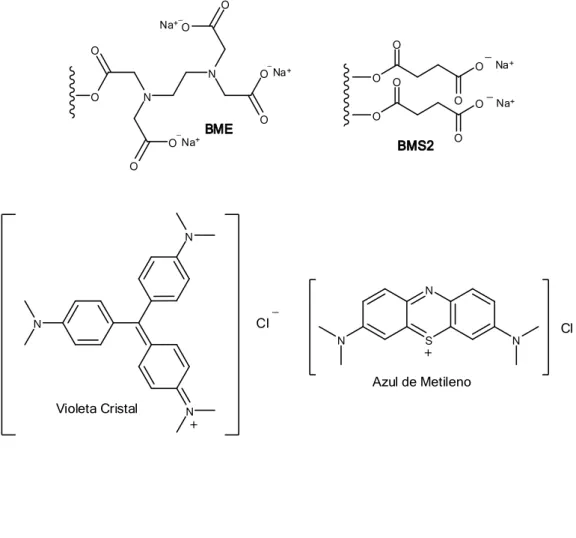
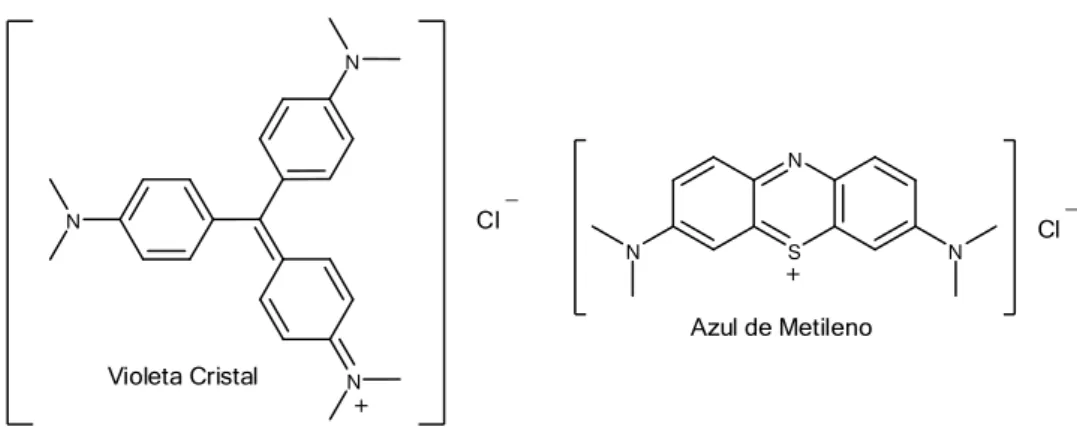
3 BME O N O O N O O O O O Na+ Na+ Na+ _ _ _ O O O O O O O O _ _ Na+ Na+ BMS2 N S N N + Cl _
Azul de Metileno
Violeta Cristal N N N + Cl _
Figura 1.1: Estrutura dos bagaços de cana modificados, dos corantes básicos Azul de Metileno e Violeta Cristal e da eterdiamina Flotigam 2835.
[R-O-(CH2)3-NH-(CH2)3-NH4)+ CH3COO-
4
2
Revisão bibliográfica
2.1
Contaminação dos recursos hídricos por compostos orgânicos
Ao longo de décadas, a atividade industrial tem produzido rejeitos gasosos, líquidos e sólidos nocivos ao meio ambiente. Os processos industriais que utilizam grandes volumes de água contribuem significativamente com a contaminação dos corpos d'água,
principalmente pela ausência de sistemas de tratamento (Freire et al., 2000).
Um dos graves problemas da sociedade brasileira é decorrente das diferentes fontes de poluição, que atuam sobre a qualidade da água utilizada pela população, bem como sobre a qualidade das águas necessárias à conservação ambiental dos sistemas hídricos brasileiros.
Atualmente, um dos problemas mais sérios que afetam o meio ambiente é a poluição química de natureza orgânica ou inorgânica, decorrente dos despejos residenciais
e industriais (Aguiar et al., 2002). Vários são os poluentes descartados nos rios, incluindo
metais pesados, óleos, pesticidas, corantes, tensoativos, entre outros (Pereira, 2008).
2.2
O Problema dos corantes
A exata origem dos corantes não é conhecida, indícios apontam que, a mais de 40000 anos, pigmentos naturais foram usados pelas primeiras civilizações humanas para demarcação de territórios, inscrições em rochas, árvores e pintarem peles. Os corantes naturais, extraídos de vegetais, minerais, insetos e moluscos, foram os únicos utilizados até o século XIX.
Atualmente, os corantes sintéticos são usados extensivamente em muitos campos da tecnologia, por exemplo, em vários ramos da indústria têxtil, do curtimento de couro em produção de papel, em tecnologia de alimentos, em células fotoeletroquímicas, e em
colorações de cabelo (Forgacs et al., 2004).
5
escala e a aplicação extensiva, os corantes sintéticos podem causar poluição ambiental
considerável e é um grave fator de risco a saúde (Forgacs et al., 2004).
Devido à sua importância comercial, o impacto e a toxicidade de corantes que são liberados no ambiente têm sido amplamente estudados. Os riscos toxicológicos de corantes sintéticos à saúde humana estão relacionados ao modo de exposição, ingestão oral, sensibilização da pele e das vias respiratórias. O corante Azul de Metileno, por exemplo, é o mais comumente utilizado em algodão, madeira e seda. Ele pode causar queimaduras nos olhos e pode ser responsável por danos permanentes aos olhos dos humanos e animais. A inalação, que pode dar origem a curtos períodos de respiração rápida ou difícil, enquanto a ingestão pela boca produz uma sensação de ardor e pode causar náuseas, vômitos, sudorese
profunda, confusão mental e metemoglobinemia (Rafatullah et al., 2010). O corante
Violeta Cristal é também conhecido sob o nome de violeta genciana. Violeta Cristal é nocivo por inalação, ingestão, através de contacto com a pele e também pode causar câncer e irritação ocular grave em seres humanos (Ahmad, 2009).
A contaminação dos sistemas aquáticos por corantes provoca efeitos visuais e
organolépticos nos corpos d’água, não permitindo seu consumo ou utilização. A
contaminação por corantes promove alteração na coloração e uma diminuição da transparência da água, o que interfere na penetração da luz solar, dificultando a fotossíntese da vegetação aquática. Portanto, tratamento de efluentes, contendo corante, é de interesse devido a seus impactos nocivos sobre águas receptoras e aos seres humanos.
Mesmo pouco difundidas as informações sobre os riscos da contaminação por corantes e o impacto causado pelos seus rejeitos na qualidade da água e em ecossistemas aquáticos, sabe-se que esses compostos podem permanecer por cerca de 50 anos na biota terrestre e aquática, pondo em risco a estabilidade desses ecossistemas e a vida em seu entorno (Gupta e Suhas, 2009).
6
2.2.1
Classificação dos corantes
Os corantes são classificados de acordo com a sua estrutura química, em antraquinona, azo e indigóides. Os corantes azos representam a maioria dos corantes sintéticos e é a classe mais utilizada nas indústrias têxteis. Em suas estruturas químicas
apresentam o grupamento –N=N–, denominados azo. A Figura 2.1 representa um corante
azo.
Os corantes indigóides são produzidos através da extração de pigmento azul de plantas. O corante índigo sintético, usado para tingimento de jeans, é um corante indigóide produzido a partir do ácido cloro acético e da anilina no Século XIX. Sua estrutura pode ser observada na Figura 2.2.
Os corantes antraquinona representam a segunda classe mais utilizada depois dos azos. Eles são derivados da estrutura 9,10-antraquinona (Figura 2.3), e a variação das cores está relacionada pelo tipo, número e posição dos substituintes encontrados na estrutura.
Figura 2.1: Estrutura química característica de um azo corante.
Figura 2.2: Estrutura química do corante Índigo blue.
7
Os corantes podem ainda ser classificados de acordo com o modo de fixação da molécula na fibra, que pode ocorrer através de quatro tipos de interações: ligações de Van der Waals, de hidrogênio, iônicas e covalentes (Guaratini e Zanoni, 2000). As principais classes de corantes de acordo com o modo de fixação são apresentadas a seguir:
i)
Corantes ácidos
O termo corante ácido corresponde a um grande grupo de corantes solúveis em
água, portadores de um a três grupos sulfônicos (-SO3H). Estes grupos substituintes tornam
o corante solúvel em água, e têm vital importância no método de aplicação do corante em fibras protéicas (por exemplo, lã, seda) e em fibras de poliamida sintética. No processo de fixação, o corante previamente neutralizado (solução contendo cloreto, acetato, hidrogenossulfato, etc.) se liga à fibra através de uma troca iônica envolvendo o par de elétrons livres dos grupos amino e carboxilato das fibras protéicas, na forma não-protonada. Estes corantes caracterizam-se por substâncias com estrutura química baseada em compostos azo, antraquinona, triarilmetano, azina, xanteno, ketonimina, nitro e nitroso, que fornecem uma ampla faixa de coloração e grau de fixação.
ii)
Corantes Básicos
Também conhecidos como corantes catiônicos, são solúveis em água e capazes de colorir a lã, o acrílico, a seda, o algodão, entre outros. Estes corantes em água fornecem cátions coloridos, normalmente um sal de amina ou um grupo imino ionizado. Apenas o
corante barbeína (C. I. natural yellow 18) é conhecido como corante básico natural, porém
os primeiros corantes a serem sintetizados tais como a maloveína eram básicos. Esta classe
8
N
S N
N
+
Cl _
Azul de Metileno Violeta Cristal
N
N
N
+
Cl _
Figura 2.4: Estrutura dos corantes básicos Azul de Metileno e Violeta Cristal
iii)
Corantes Diretos
Este grupo de corantes caracteriza-se como compostos solúveis em água capazes de tingir algodão, papel, couro e nylon. São corantes aniônicos solúveis em água e quando são usados em solução com eletrólitos, apresentam uma alta afinidade por fibras celulósicas. A afinidade aumenta também pela planaridade na configuração da molécula do corante ou a dupla ligação conjugada que aumenta a adsorção do corante sobre a fibra. Esta classe de corantes é constituída principalmente por corantes contendo mais de um grupo azo (diazo, triazo e etc.) ou pré-transformados em complexos metálicos (Figura 2.5).
Figura 2.5 Exemplo de corante direto (I - corante Vermelho Congo) contendo grupos diazo como grupos cromóforo (Guaratini e Zanoni, 2000).
iv)
Corantes Dispersos
9 (a)
(b)
Figura 2.6: Exemplo de corante dispersivo Corante Vermelho de Lonamina KA (Guaratini e Zanoni, 2000).
v)
Corantes Reativos
São corantes contendo um grupo eletrofílico (reativo) capaz de formar ligação covalente. São geralmente usados em algodão ou em outras fibras celulósicas, porém também é usado em menor extensão na lã e no nylon. Existem numerosos tipos de corantes reativos, porém os principais contêm a função azo e antraquinona como grupos cromóforos e os grupos clorotriazinila e sulfatoetilsulfonila como grupos reativos. Neste tipo de corante, a reação química se processa diretamente através da substituição do grupo nucleofílico pelo grupo hidroxila da celulose (Figura 2.7). Este grupo de corantes apresenta como característica uma alta solubilidade em água e o estabelecimento de uma ligação covalente entre o corante e a fibra, cuja ligação confere maior estabilidade na cor do tecido tingido, quando comparado a outros tipos de corante em que o processo de coloração se opera através de ligações de maior intensidade.
Figura 2.7: Exemplo do processo de tintura de algodão com corante contendo o grupo sulfatoetilsufona como centro reativo da molécula (Guaratini e Zanoni, 2000)
vi)
Corantes Pré- Metalizados
Estes corantes são caracterizados pela presença de um grupo hidroxila ou carboxila
a posição orto em relação ao cromóforo azo, permitindo a formação de complexos com
10
corante (1:1) ou (1:2) (Figura 2.8). A desvantagem ecológica deste tipo de corante está associada ao alto conteúdo de metal (cromo) nas águas de rejeito.
Figura 2.8: Exemplo de tintura da lã com o corante pré-metalizado cromo/corante 1:1(Guaratini e Zanoni, 2000).
vii)
Corantes Sulfúricos
É uma classe de corantes que após a aplicação se caracterizam por compostos
macromoleculares com pontes de polissulfetos (-Sn-) (Figura 2.9), os quais são altamente
insolúveis em água. Estes compostos têm sido utilizados para o tingimento de algodão e de forma limitada de fibras de poliamida, seda, couro, papel e lã. Apresentam estruturas intermediárias e formam um grupo relativamente pequeno de corantes de baixo custo e boas características de resistência à lavagem, tornando-os uma importante classe de corantes. Entretanto, estes corantes usualmente apresentam resíduos altamente tóxicos.
Figura 2.9: Exemplo da reação de corantes contendo grupo tiossulfato com íon sulfeto e subsequente formação dos corantes com pontes de dissulfeto (Guaratini e Zanoni, 2000).
viii)
Corantes à Cuba
11
processo de tintura eles são reduzidos com ditionito, em solução alcalina, transformando-se em um composto solúvel (forma leuco). Posteriormente, a subsequente oxidação pelo ar, peróxido de hidrogênio, etc., regenera a forma original do corante sobre a fibra. Neste tipo de corante, o grupo carbonila pode estar situado no grupo etilênico ou em subunidades alicíclicas (Figura 2.10), onde:
n = 1 – índigo;
n = 2 – antraquinona;
n = 4 – pirantrona;
entre outros.
A maior aplicação deste tipo de corante tem sido a tintura de algodão, embora devido às suas excelentes propriedades de fixação, outros materiais também têm sido utilizados. No entanto, como a produção química de hidrossulfito de sódio pode causar problemas ecológicos, o custo desta classe de corantes tem sido bastante alto.
Figura 2.10: Estrutura geral de um corante à cuba (Guaratini e Zanoni, 2000)
2.2.2
Remoção de corantes
Devido às suas propriedades e estruturas químicas, os corantes são moléculas orgânicas recalcitrantes, resistente à digestão aeróbia, e são estáveis à luz, calor e agentes oxidantes e, portanto, de difícil remediação uma vez lançados no ambiente aquático. A disposição dessa água colorida em águas receptoras pode ser tóxica para a vida aquática, pois, pode ser mutagênica e cancerígena e pode causar graves danos ao seres humanos (Ozcan e Ozcan, 2004; Crini, 2006).
Efluentes contendo corantes da indústria têxtil são muito difíceis de tratar com tratamento de esgoto convencional, que são a coagulação, filtração, ozonização, oxidação, sedimentação, osmose reversa, flotação e precipitação devido a razões econômicas (Crini, 2006).
12
por foto-catálise ou processos de foto-oxidação, a decomposição microbiológica, oxidação química, ozonização e coagulação (Crini, 2006). Entre as numerosas técnicas de remoção de corante, a adsorção é o processo que dá os melhores resultados, pois ele pode ser usado
para remover diferentes tipos de corantes (Lata et al., 2008)
Os processos de tratamento ideais são fundamentados na operação de sistemas físico-químicos de precipitação-coagulação, seguidos de separação por sedimentação através de tratamento biológico via sistema de lodos ativados, apresentando uma elevada eficiência na remoção de partículas.
A coagulação se divide em três partes: adição do coagulante dissolvido ao efluente, agitação a uma velocidade baixa para formação de flocos ou corpos hidratados bem definidos, e por ultimo, a agitação é encerrada permitindo a decantação dos flocos formados. O curto tempo de residência e o baixo custo de operação tornam a coagulação química uma técnica largamente utilizada. Algumas das limitações deste método são os altos custos de produtos químicos para a precipitação e o ajuste de pH, problemas associados com a remoção de água, o tratamento do lodo gerado e a alta concentração de cátion residual que permanece no sobrenadante.
Existem muitas dificuldades na remoção biológica de cor e compostos orgânicos dissolvidos, além do grande inconveniente do sistema ser bastante susceptível à composição do efluente (cargas de choque), e de produzir um grande volume de lodo. A grande variação da composição do efluente, em razão da própria variação do processo
industrial que envolve a sequência de produção e acabamento têxtil, em cujo processo é
utilizado corantes, tensoativos, espessantes e produtos químicos diversos torna o efluente muito complexo, geralmente com altas concentrações de DBO e DQO, e com diferentes características de biodegradação (Hassemer e Sens, 2002).
Nesse sentido, cresce o interesse em desenvolver novos tratamentos para degradarem, de maneira satisfatória e eficaz, os compostos tidos como tóxicos e biorrefratários. Devido a esses inconvenientes é que surgem, os processos oxidativos avançados que são uma das alternativas mais eficazes na degradação de substratos (Oliveira, 2006). As vantagens mais significativas deste tipo de procedimentos estão representadas pela eficiência na degradação de compostos orgânicos tóxicos e persistentes (ex.: corantes, compostos organoclorados), produzindo para o meio ambiente produtos minerais inofensivos, sem a necessidade de recorrer à utilização de outros oxidantes
13
oxidação fotocatalítica heterogênea, tratamento com ozônio combinado com H2O2 , UVA e
ambos , sistemas H2O2/ UV, Fenton e reações foto-Fenton.
A ozonização é uma técnica que tem sido sugerida na literatura recente, como uma potencial alternativa para a descoloração. Oferece eficiência satisfatória, apresentando um efluente com pouca cor, baixa DQO, e adequado para ser lançado ao meio ambiente ou retornar ao processo. Num primeiro momento, a ozonização é empregada principalmente para quebrar as moléculas de corantes, e depois para a descoloração. O pré-tratamento com ozônio é um método promissor de oxidação dos corantes transformando-os em degradáveis. A ozonização, no final do tratamento, está sendo também cada vez mais utilizada para a eliminação da cor e de outras substâncias persistentes (Hassemer e Sens, 2002).
Adsorção é um método amplamente utilizado para o tratamento de águas residuais industriais contendo cor, metais pesados e outras impurezas orgânicas e inorgânicas. As vantagens do processo de adsorção são por sua simplicidade de operação, baixo custo (em comparação com outros processos de separação) e sem a formação de lodo (Chakraborty
et al., 2005). A pouca aplicação deste processo pelas indústrias está relacionada ao alto
custo de adsorventes atualmente disponíveis para fins comerciais (Lata et al., 2008). O
custo da aplicação da tecnologia de adsorção pode ser reduzido se o adsorvente é de baixo
custo (Lata et al., 2008).
O carvão ativado é geralmente o adsorvente mais utilizado para remoção de corantes devido a sua alta capacidade de adsorção. Esta eficiência está relacionada principalmente a sua característica estrutural, grande área superficial e estrutura microporosa, e ao alto grau de reatividade de superfície. Entretanto, há alguns problemas com seu uso, o alto custo e sua regeneração, que produz um pequeno efluente adicional e resulta em uma perda de 10-15% do adsorvente e da sua capacidade de captação e, portanto, isso aumenta as despesas operacionais.
14
2.2.3
Adsorventes alternativos na remoção de corantes
Muitos pesquisadores têm investigado a utilização de substitutos baratos e eficientes como alternativas para remover cor de águas residuais. Contudo, novos adsorventes econômicos, facilmente disponíveis e altamente eficazes ainda são necessários.
Uma grande variedade de suportes orgânicos e inorgânicos é relatada na literatura. Devido à sua boa estabilidade mecânica e química, área de superfície específica elevada e resistência à degradação microbiológica, suportes inorgânicos têm sido amplamente
aplicado em estudos de adsorção (Forgacs et al., 2004). Suportes orgânicos têm algumas
vantagens sobre inorgânicos, eles geralmente são originários de fontes renováveis ou são resíduos ou subprodutos de processos industriais, sem qualquer valor comercial.
Dentre os materiais naturais encontram-se as argilas, que devido ao seu baixo custo, abundância na maioria dos continentes do mundo, capacidade de sorção elevada e o potencial de troca iônica, são bons adsorventes. Elas possuem estrutura em camadas e são considerados como materiais de acolhimento para adsorbatos e contra-íons. O uso, como adsorventes para as águas residuais, de outros materiais naturais siliciosos como a sílica, fibras de vidro e perlita está a aumentar devido à sua alta abundância, fácil acesso e baixo custo. Sua textura porosa, área superficial elevada e estabilidade mecânica também os
tornam atraentes para aplicações como adsorventes de descontaminação (Rafatullah et al.,
2010).
A adsorção de corantes catiônicos em materiais naturais, como argilas foi testada por Eren e Afsin (2007), que investigaram a adsorção do corante violeta cristal em sepiolite in natura e após tratamentos. Demirbas e Nas (2009) avaliaram a adsorção de corante aniônico por sepiolite. Eren (2009) estudou a adsorção de corante catiônico em bentonita que também é uma argila.
A acumulação e concentração de corantes de soluções aquosas pela utilização de materiais biológicos são denominadas bioadsorção. Neste caso, a biomassa é utilizada como adsorventes para se concentrar e remover corantes de soluções. Bioadsorção é uma
abordagem inovadora, competitiva, eficaz e barata (Rafatullah et al., 2010).
15
a baixo custo, além de possuir um elevado potencial como adsorvente devido às suas
características físico-químicas (Rafatullah et al., 2010).
A adsorção em biomassa foi estudada por Marungrueng e Pavasant (2007) que utilizaram algas como suportes para remoção de corantes catiônicos. Basibuyuk e Forster (2003) utilizaram lodo ativado obtido de um sistema de tratamento de efluente municipal. Alguns resultados indicaram que o lodo ativado é altamente poroso com área superficial
entre 40 e 140 m2/g. Granulos aeróbios, agregados de bactérias imobilizadas com grande
estrutura microbiana, foram utilizados por Sun et al. (2008) na remoção do corante
catiônico Verde Malaquita.
Os resíduos e subprodutos da agricultura e outras indústrias podem ser assumidos como adsorventes de baixo custo devido à sua abundância na natureza e poucos requisitos de processamento. Resíduos agrícolas sólidos tais como folhas, fibras, cascas de frutas, sementes, materiais e resíduos das indústrias florestais como serragem e casca têm sido
utilizados como adsorventes (Rafatullah et al., 2010). Estes materiais estão disponíveis em
grandes quantidades e podem ser adsorventes potenciais devido às suas características físico-químicas e baixo custo. Geralmente estes produtos contêm vários compostos orgânicos (lignina, celulose e hemicelulose), com grupos polifenólicos que podem ser úteis
para adsorção de corantes, através de diferentes mecanismos (Rafatullah et al., 2010).
Resíduos industriais sólidos, como lodo, cinzas e lama vermelha são classificados como materiais de baixo custo e grande disponibilidade e podem ser usados como adsorventes para remoção de corantes. Muitos autores usaram a cinzas, originada em grande quantidade em estações de energia térmica, como adsorvente para remoção de contaminantes. Atualmente este resíduo é usado na produção de concreto e tijolo. Mas
ainda há problemas ambientais causados por sua disposição (Lin et al., 2008). A utilização
do lodo como adsorvente para remoção de poluentes industriais pode ser uma solução
ambiental e econômica. Lin et al.(2008), Ahmaruzzaman (2009) e Karagozoglu et al.
(2007) avaliaram a capacidade de adsorção do lodo na remoção de corantes catiônicos, compostos fenólicos e outros compostos orgânicos.
Os resíduos provenientes da agroindústria e de indústrias de madeira são amplamente estudados como materiais adsorventes alternativos para adsorção de corantes.
Os materiais utilizados podem estar na sua forma in natura, ou podem passar por
16
suporte. Contudo, o uso destes materiais após modificação química, na matriz do suporte, para remoção de poluentes ainda é pouco estudada, com poucos relatos presentes na literatura.
Resíduos sólidos agrícolas, baratos e prontamente disponíveis, tais como turfa
(Allen et al., 2004), serragem (Garg et al., 2004; Chakraborty et al., 2005) , serragem de
pinheiro brasileiro (Royer et al., 2009) , serragem de cedro (Hamdaoui, 2006), serragem
de cinerária Prosopis (Garg et al., 2004), madeira da seringueira (Kumar e Sivanesan,
2007), resíduos de chá (Uddin et al., 2009), folhas de chá (Hameed, 2009c), cascas de
sementes de girassol (Hameed, 2008), resíduo de coco (Hameed et al., 2008), pó de cana
(Ho et al., 2005), casca de semente de abóbora (Hameed e El-Khaiary, 2008c), casca de
arroz (Mohanty et al., 2006; Hameed e El-Khaiary, 2008b), folhas de abacaxi (Hameed et
al., 2009), casca de alho (Hameed e Ahmad, 2009), fibra do tronco de palmeira (Hameed e
El-Khaiary, 2008a), kudzu, nativa da Ásia Oriental, considerada uma praga devido a
dificuldade de controlar seu creescimento (Allen et al., 2003), cascas de sementes de
girasol (Hameed, 2008), sementes de mamão (Hameed, 2009a), grama e resíduos de jardim (Hameed, 2009b), têm sido empregados com sucesso na remoção de corantes catiônicos de soluções aquosas.
2.3
Aseteraminas
2.3.1
Processo de flotação e as eteraminas
A flotação é uma técnica de separação de misturas que consiste na introdução de bolhas de ar a uma suspensão de partículas. Com isso, verifica-se que as partículas se aderem às bolhas, formando uma espuma que pode ser removida da solução, separando seus componentes de maneira efetiva.
17
A flotação baseia-se na modificação de propriedades de interface, a partir da transformação de superfícies minerais em hidrofóbicas que podem ser capturadas pelas bolhas gasosas de ar que são introduzidas no reator. A modificação do caráter da superfície dos materiais é possível através de materiais que possuem caráter duplo, os surfactantes.
Com a redução das reservas de alto teor em minério de ferro, os processos de concentração tornaram-se indispensáveis para as empresas produtoras, necessitando de produtos finais com uma qualidade mais elevada. A técnica da flotação catiônica reversa consiste em flotar o quartzo e deprimir a hematita, em um processo de separação que utiliza as diferentes características de superfície dos minerais. No processo de flotação catiônica reversa do minério de ferro, o quartzo é removido pelo ar, pois a hematita é mais abundante, o que dificulta sua remoção na espuma. A sílica é considerada inútil no processo de beneficiamento do minério de ferro, sendo coletada através de bolhas de ar e posteriormente descartada para barragens de rejeito (Da Silva, 2009).
Uma série de reagentes é utilizada no processo de flotação: os coletores, que levam a partícula mineral para o leito da espuma; os espumantes, usados para gerar a espuma que transporta o mineral para a superfície; e os depressores que evitam que determinados minerais flutuem (Leal, 2010).
Na indústria mineral brasileira as aminas, são mais comumente utilizadas na flotação catiônica reversa de minério de ferro, e também na flotação de Willemita e Calamina (zinco), Pirocloro (nióbio), Calcita (carbonato de cálcio), Magnesita (carbonato de magnésio), Silvita (cloreto de potássio) e Apatita (fosfato) (Silva, 2008). As aminas são
compostos orgânicos derivados da amônia (NH3), são classificadas como primárias,
18
Figura 2.11: Classificação das aminas
Os reagentes empregados na flotação apresentam de seis a vinte carbonos na cadeia; homólogos com menos de seis carbonos não apresentam suficiente atividade superficial, enquanto aqueles com mais de 20 carbonos tornam-se insolúveis em água, apresentado um caráter pastoso. A presença do grupo funcional R-O-R (éter) nas eteraminas aumentam sua solubilidade em água.
Geralmente no processo de flotação do minério, utiliza-se uma mistura de coletores. Dois exemplos de aminas comerciais utilizadas na flotação são a eteramina e eterdiamina. Para os ensaios de adsorção, utilizou-se uma eterdiamina produzida pela Empresa Clariant®, eterdiamina Flotigam 2835 e sua estrutura pode ser visualizada na Figura 2.12(a). A Figura 2.12(b) apresenta ainda a estrutura geral de uma eteramina, também da Empresa Clariant®, eteramina Flotigan EDA 3B.
Figura 2.12: Estrutura geral de uma eterdiamina e uma eteramina
[R-O-(CH2)3-NH-(CH2)3-NH4]+ CH3COO-
R = radical alquil com 10 ou mais átomos de carbono
(a)
[R-O-(CH2)3-NH3] +
CH3COO
-R = radical alquil com 10 a 14 átomos de carbono
19
Assim, a flotação permite a separação seletiva entre as partículas de quartzo e os óxidos de ferro. As aminas graxas adicionadas ao sistema são adsorvidas na superfície do quartzo e ambos são removidos na forma de espuma do sistema. A flotação ocorre em pH próximo a 10, onde quartzo e hematita possuem superfície carregada negativamente, e podem adsorver a amina, embora a atração para o quartzo seja maior. Para evitar a flotação
do óxido de ferro, há a adição de um depressor, o amido (Araujo et al., 2008). Na presença
de amido, a eteramina adsorve o quartzo sobre sua superfície, tornando-o hidrofóbico e promovendo a flotação.
2.3.2
Custo e impacto ambiental
As aminas utilizadas, no processo de flotação como agente coletor do quartzo, têm custo elevado. O que torna o estudo da reciclagem desse reagente de fundamental importância, possibilitando redução nos custos do processo de flotação e também à redução do impacto ambiental das aminas.
Grande parte da amina utilizada na flotação fica retida no material flotado, o quartzo, e são dispostos na barragem de rejeito. Uma reutilização das aminas possibilitaria uma redução dos custos operacionais e a diminuição da quantidade de reagentes liberados para o meio ambiente. Estima-se que aproximadamente 5500 toneladas de derivados de amina sejam usadas anualmente no Brasil em processos de flotação (Neder, 2005). As aminas são reagentes essenciais no processo de concentração por flotação, contudo são relativamente caras, e chegam a representar cerca de 50% dos custos totais com reagentes no processo de
flotação (Araujo et al., 2008).
Nas barragens de rejeitos onde são descartadas, as eteraminas sofrem degradação microbiológica após algum período (Da Silva, 2009). Dos derivados de aminas, praticamente todos são classificados como perigosos, podendo ocasionar irritação nos olhos e na pele. Os vapores amoniacais, se inalados, podem ocasionar náuseas ou vômitos, e deve-se redobrar o cuidado no caso de ingestão acidental (Neder, 2005).
20
eteramina apresenta-se como um promissor estudo, podendo ser um passo importante para as empresas, na busca de alcançar a sustentabilidade em relação ao seu consumo de água e aos impactos gerados pelo descarte de efluentes.
Outros autores avaliaram a adsorção e reciclagem de eteraminas, Teodoro e Leão (2004) mostraram a possibilidade de remoção dessas aminas através da adsorção em
zeólitas seguida da dessorção dos produtos adsorvidos e seu reuso, Araujo et al. (2008)
investigaram a possibilidade de reutilização de aminas residuais provenientes do processo de flotação de minério de ferro.
Neste contexto, a descoberta de novos e eficientes materiais adsorventes é uma alternativa para minimização dos custos do processo de flotação e diminuição do impacto ambiental associado ao descarte dos efluentes.
2.4
Bagaço de cana
O Brasil apresenta um grande potencial agrícola, produzindo um volume muito grande de resíduos que, na maioria das vezes, são simplesmente descartados, fato que também pode gerar um desequilíbrio ambiental. Neste contexto a utilização de rejeitos agrícolas como suporte para adsorção de poluentes de efluentes, aliando-se a necessidade de reduzir custos dos adsorventes para remoção de poluentes dos efluentes industriais, constitui-se uma união bastante vantajosa, para o nosso país, tanto do ponto de vista
econômico quanto ambiental (Royer et al., 2009).
O bagaço de cana é o resíduo da cana após a moagem. É um material fibroso obtido após a extração nas moendas. É um material renovável e biodegradável que contém moléculas ricas em grupos hidroxilas que podem sofrer um grande número de modificações químicas para a produção de novos materiais, e sua reutilização pode minimizar problemas relacionados a seu acumulo.
2.4.1
Composição
21
volta de 50% de celulose, 27% de hemicelulose e 23% de lignina. Mas a composição pode variar de acordo com diversos fatores, dentre eles, o tipo de cana, o tipo de solo, as
técnicas de colheita e até o manuseio (Gurgel et al., 2009; Pereira et al., 2009).
A celulose, descoberta por Payen em 1938, é um polissacarídeo linear de alto peso molecular constituído de um único tipo de monossacarídeo e é o principal componente da parede celular da fibra. Em 1930 foi comprovado que a celulose era um polímero linear de
moléculas de D–glicose ligadas, onde a molécula seguinte foi girada aproximadamente
180°, resultando no monômero da celulose, a celobiose (Figura 2.13).
Figura 2.13: Formação da cadeia de celulose pela união de unidades β-D-glucose.
Algumas propriedades da celulose, tais como sua hidrofilicidade, quiralidade, degradabilidade estão relacionadas com sua estrutura molecular. Os grupos hidroxila (primária e secundária) são abundantes na cadeia polimérica da celulose, conferem alta variabilidade química devido a sua reatividade, formam ligações de hidrogênio intramolecular e intermolecular que promovem um arranjo cristalino altamente regular das cadeias. As microfibrilas são feixes de moléculas de celulose agregadas que em conjunto formam as fibras celulósicas, que conferem à estrutura uma alta resistência à tração e a torna insolúvel na maioria dos solventes (Pereira, 2008).
22
proporção destes monossacarídeos variam de acordo com a espécie e conferem diferentes características. A hemicelulose é o componente responsável pela biodegradação, absorção de umidade e degradação térmica da fibra vegetal (Karnitz, 2007).
Figura 2.14: Estrutura dos principais componentes da poliose.
A lignina é um polímero tridimensional, e é o segundo maior componente da matéria vegetal com a função de proporcionar rigidez e resistência. O peso molecular das ligninas naturais são supostamente muito alto, mas é impossível determinar com exatidão devido à inevitável degradação que ocorre quando a lignina é separada da celulose (Karnitz, 2007).
23
Figura 2.15: Precursores básicos da lignina
24
2.4.2
Utilização do bagaço de cana como adsorvente
O bagaço de cana se encaixa nas características dos adsorventes alternativos já estudados, pois, se trata de um subproduto da agroindústria, requer poucos requisitos de processamento, é um material de baixo custo e abundante. Estudos do uso do bagaço como
adsorvente de diversos poluentes podem ser encontrados na literatura (Ho et al., 2005;
Karnitz et al., 2007; Xing e Deng, 2009; Pereira et al., 2009).
Moléculas como a lignina (Xiao et al., 2001), a celulose (Navarro et al., 1996) ou
as polioses podem, através das suas funções hidroxilas, reagirem quimicamente e produzirem novos materiais com novas propriedades. A modificação química dessas macromoléculas é feita por esterificação ou eterificação introduzindo ou acrescentando, a partir de grupos funcionais já existentes, novos grupos funcionais reativos na cadeia molecular do suporte sólido e consequentemente, a fibra adquire várias novas propriedades (Pereira, 2008).
A utilização do bagaço de cana modificado quimicamente, através de várias rotas sintéticas, produzindo suportes com propriedades e capacidades distintas, foi avaliada pelo grupo de pesquisa LQOA, da UFOP. Nosso grupo estudou a adsorção em solução aquosa de metais pesados e oxiânions em bagaços modificados quimicamente com anidridos cíclicos.
Bagaço de cana modificado com anidrido succínico (BMS2) (Figura 2.17) foi
avaliado quanto a sua capacidade de adsorção de metais, tais como cobre (II), cádmio (II) e
chumbo (II) (Gurgel et al., 2008), e zinco (II) (Pereira et al., 2009) e mostrou uma
capacidade máxima de adsorção de 185,2, 212,8, 416,7 e 125,0mg/g para os cátions
metálicos Cu2+, Cd2+ , Pb2+ e Zn2+ respectivamente.
O número de funções ácido carboxílicos foi fator determinante na capacidade de
adsorção do material; segundo Gurgel et al. (2008) a eficiência de adsorção dos cátions
25 OH OH O O O piridina, O O OH OH O O O O O O O O O O O O
bagaço de cana BMS1
_ _ Na+ Na+ BMS2 NaHCO3
Figura 2.17: Rota de síntese do material adsorvente BMS2.
Após a modificação do bagaço de cana com dianidrido de EDTA, é possível observar as funções, ácido carboxílico e amina terciaria introduzidas no material de
origem, o que resulta em um material (BME) com uma maior capacidade de adsorção para
os cátions testados. Karnitz et al. (2009) e Pereira et al. (2009) estudaram a capacidade de
adsorção do material BME para os cátions metálicos Cu2+ e Zn2+ e a adsorção máxima
encontrada foi de 105,3 e 66,7mg/g para os cátions metálicos Cu2+ e Zn2+ respectivamente.
A Figura 2.18 apresenta a rota de síntese do material BME, a partir do bagaço de cana.
OH
DMF, 70°C
bagaço de cana
BME NaHCO3 N O N O O O O O 1) 2) O N O O N O O O O O Na+ Na+ Na+ _ _ _
Figura 2.18: Rota de síntese do material adsorvente BME.
Os materiais BMS2 e BME possuem cargas negativas devido à presença de grupos
carboxilatos. Essas cargas são capazes de interagir com a carga positiva de corantes catiônicos e assim remove-los a partir de soluções aquosas ou efluentes por processo de adsorção.
Devido à sua constituição, o bagaço de cana contém grupos hidroxila, podendo ser um barato, atraente e eficaz adsorvente para a remoção de corantes em águas residuais. Xing et al. (2010) e Xing e Deng (2009) utilizaram o bagaço modificado com o dianidrido
de EDTA, BME para a adsorção de corantes catiônicos, Azul de Metileno e Verde
26
corantes catiônicos em soluções aquosas, ou seja, a capacidade de adsorção para os
corantes catiônicos do bagaço modificado BME é maior que para o bagaço sem
modificação química.
A remoção de corantes pelo bagaço de cana foi estudada por Saad et al. (2010), que
comparou a capacidade de adsorção do bagaço de cana sem pré-tratamento e o bagaço tratado com ácido fosfórico. Este estudo demonstrou que os dois suportes usados apresentaram menor eficiência adsorção em relação ao carvão ativo comercial, em qualquer valor de pH, sendo que entre os adsorventes alternativos aquele que passou pelo tratamento com ácido fosfórico obteve melhores resultados.
Em alguns estudos, o bagaço e outros resíduos da agricultura são convertidos em carvões, por diversos métodos de ativação. Após a carbonização as características superficiais do material (área superficial, distribuição, volume e diâmetro dos poros) são
modificadas, aumentando a eficiência do adsorvente (Juang et al., 2002; Royer et al., 2009;
Tsai et al., 2001).
2.5
Adsorção
A adsorção em suportes sólidos pode ser definida como o acumulo de um determinado elemento ou substância na interface entre a superfície sólida e a solução adjacente. A substância que é adsorvida é denominada de adsorvato e o material sobre o qual ocorre a adsorção é o adsorvente (Atkins, 2004).
2.5.1
Modelos cinéticos
A adsorção de um soluto em um sólido é um fenômeno cuja cinética é frequentemente complexa (Hamdaoui, 2006). O mecanismo de adsorção depende das características físicas e/ou químicas do adsorvente, bem como do processo de transporte de
massa (Mohanty et al., 2006).
27
Para investigar o mecanismo de adsorção dos corantes, quatro modelos cinéticos foram considerados, os modelos de pseudo-primeira ordem, pseudo-segunda ordem, a equação de Elovich e o modelo de difusão intrapartucula. Estes modelos são os mais comumente usados para descrever a adsorção de corantes, e de outros poluentes (como
metais pesados) em adsorventes sólidos (Ozcan e Ozcan, 2004; Dogan et al., 2007; Gurgel
et al., 2009).
2.5.1.1
Modelo cinético de pseudo-primeira ordem
Quando a adsorção é precedida por difusão através de um filme, a cinética na maioria dos casos obedece à equação de taxa de pseudo-primeira ordem de Lagergren (Lagergren, 1898). A taxa de adsorção pode ser determinada pela equação de reação de primeira ordem, Equação 2.1:
Na equação qe (mg/g) é a concentração do adsorvato na superfície do adsorvente no
equilíbrio, qt (mg/g) é a concentração da fase sólida em um determinado tempo, t (min) é o
tempo e k1 (min-1) é a constante de velocidade de pseudo-primeira ordem. A integração da
Equação 2.1 com condições iniciais, qt = 0 para t = 0 e qt = qt para t = t, levam a:
Se os dados se ajustam a este modelo, um gráfico ln (qe – qt) versus t deve fornecer
uma reta com coeficiente angular -k1 e coeficiente linear ln qe.
Para relacionar a Equação 2.2 com os dados obtidos experimentalmente o termo qe
deve ser conhecido, mas em muitos casos não é, porque o processo de adsorção tende a ser lento e a quantidade adsorvida é ainda significativamente menor do que a quantidade do
equilíbrio. Por esta razão é necessário obter a real capacidade de adsorção qe, extrapolando
os dados experimentais para t tendendo ao infinito, ou utilizar o método de tentativa e erro.
28
2.5.1.2
Modelo cinético de pseudo-segunda ordem
A constante de velocidade de pseudo-segunda ordem (Ho e Mckay, 1998) é dependente a quantidade de soluto adsorvido na superfície do adsorvente e a quantidade adsorvida no equilíbrio. O modelo de pseudo-segunda ordem pode ser representado da seguinte forma (Equação 2.3):
Onde qe (mg/g) é a concentração do adsorbato na superfície do adsorvente no
equilíbrio, qt (mg/g) é a concentração da fase sólida em um determinado tempo, t (min) é o
tempo e k2 é a constante de velocidade de reação de pseudo-segunda ordem (g/mg min).
Integrando a Equação 2,3 nos limites de t = 0 até t = t e de qt = 0 até qt = qt, temos:
Que é a equação integrada da taxa para uma reação de segunda ordem, podendo ser linearizanda para obter a Equação 2.5:
Se a cinética de pseudo-segunda ordem é aplicável, um gráfico (t/q) versus t, deve
mostrar uma relação linear, com coeficiente linear (1/(k2qe2)) e coeficiente angular (1/qe).
O valor da constante (k2) é obtido através do coeficiente linear da reta.
2.5.1.3
Modelo cinético Elovich
A equação de Elovich é uma equação cinética envolvendo processo de quimiossorção (Juang e Chen, 1997). Essa equação é frequentemente validada para sistemas em que a superfície adsorvente é heterogênea, e é formulada com:
![Figura 2.12: Estrutura geral de uma eterdiamina e uma eteramina [R-O-(CH2)3-NH-(CH2)3-NH4]+ CH3COO-](https://thumb-eu.123doks.com/thumbv2/123dok_br/15745261.637035/35.892.146.760.112.368/figura-estrutura-geral-uma-eterdiamina-uma-eteramina-coo.webp)