i
Universidade Nova de Lisboa
Instituto de Higiene e Medicina Tropical
Estudo dos flebótomos (Diptera, Phlebotominae),
vectores de
Leishmania
sp.
no Concelho de Torres Novas, Portugal
Sofia Isabel Martins Branco
Dissertação apresentada para cumprimento dos requisitos necessários à obtenção do grau de Mestre em Parasitologia Médica realizada sob a orientação científica de:
iii AGRADECIMENTOS
Gostaria de agradecer a todos os que me auxiliaram na realização deste trabalho, e cujo contributo foi essencial, dentro e fora do âmbito académico:
À minha Orientadora, Professora Doutora Maria Odete Afonso, pela sua boa disposição e ―paixão flebotomínica‖, e pelo extraordinário empenho que dedicou à minha formação, ultrapassando em todos os aspectos o que se espera de um Orientador. Os seus ensinamentos, paciência e orientação contribuíram para o meu crescimento, não só a nível curricular, como pessoal e emocional. Um ―gigantesco‖ obrigada por tudo!
À minha Co-Orientadora, Professora Doutora Lenea Campino, pelos ensinamentos na área das Leishmanias e Biologia Molecular e pelo entusiasmo e pragmatismo transmitidos.
Ao Doutor Carlos Alves Pires, pelo seu bom humor, e disponibilidade em encontrar os ―artigos impossíveis‖, quando já não sabia mais onde os procurar.
À Doutora Carla Maia, Doutora Sofia Cortes e Dr. José Manuel Cristovão da Unidade de Leishmanioses do IHMT, pelo auxílio na realização das técnicas laboratoriais moleculares.
À Professora Doutora Luzia Gonçalves pelos esclarecimentos prestados na área da análise Estatística.
Ao meu Avô António, ao meu Irmão Pedro e ao meu Tio Carlos, por toda a companhia e ajuda prestada nas capturas flebotomínicas, e aos meus Pais António e Tina pelo seu apoio incondicional.
Ao Nuno Vieira pelo apoio gráfico e tratamento das imagens.
Ao Coordenador da Unidade de Entomologia Médica do IHMT, Professor Doutor Paulo Almeida, e a todos os Colaboradores desta Unidade.
iv RESUMO
Estudo dos flebótomos (Diptera, Phlebotominae), vectores de Leishmania sp. no
Concelho de Torres Novas, Portugal. Sofia Isabel Martins Branco
PALAVRAS-CHAVE: flebótomos, bioecologia, Leishmania, Torres Novas, Portugal.
Os flebótomos são insectos vectores de vários agentes patogénicos, dos quais se destacam os protozoários do Género Leishmania. Em Portugal, as leishmanioses, canina e humana, são causadas por L. infantum, sendo o cão o principal reservatório e Phlebotomus perniciosus e P. ariasi os vectores comprovados do parasita. São conhecidos três focos de doença, mas casos de leishmaniose canina têm sido reportados em outras regiões nas quais se desconhecem as espécies flebotomínicas presentes e respectivas taxas de infecção.
Neste trabalho, efectuou-se a primeira prospecção flebotomínica no Concelho de Torres Novas, Distrito de Santarém, localizado na região Centro de Portugal. Os principais objectivos foram determinar a fauna flebotomínica do Concelho, os aspectos bioecológicos, as taxas de infecção por Leishmania e os factores de risco para a transmissão vectorial.
De Junho a Novembro de 2010, 275 biótopos foram prospectados com armadilhas CDC. As capturas foram realizadas em 91 localidades, nas 17 freguesias do Concelho, e incluíram habitats domésticos, peridomésticos e silváticos. Os exemplares capturados foram identificados morfologicamente, as fêmeas utilizadas para detecção molecular de DNA de Leishmania e identificação das refeições sanguíneas. Análises de regressão simples e múltipla foram utilizadas para avaliação dos factores de risco para a presença das várias espécies flebotomínicas. Testes não paramétricos foram usados para comparar densidades.
Dos 1262 flebótomos capturados, quatro espécies foram assinaladas com as seguintes abundâncias relativas: P. perniciosus 73,69%, P. ariasi 8,16%, P. sergenti 6,58% e Sergentomyia minuta 11,57%. Em 82% das localidades prospectadas foi detectada pelo menos uma espécie flebotomínica e em 71,4% destas foi capturada pelo menos uma das espécies comprovadamente vectoras de L. infantum. P. perniciosus foi assinalado em todas as 17 freguesias do Concelho.
Os factores de risco identificados foram: temperaturas elevadas e humidades relativas baixas, locais abrigados e ausência de vento forte, presença de pinheiros como vegetação dominante, biótopos peridomésticos, particularmente currais de ovelhas e coelheiras, ou na proximidade de ovelhas, aves de capoeira e ninhos com andorinhas.
A taxa de infecção flebotomínica por L. infantum foi de 4% para P. ariasi e de 0,32% para o total de fêmeas capturadas.
v
A elevada abundância e distribuição das espécies vectoras, juntamente com a seroprevalência de Leishmania nos cães do Distrito (5-10%), e a captura de uma fêmea grávida de P. ariasi (infectante), sugerem que o Concelho de Torres Novas é um foco de leishmaniose no país.
A maior abundância relativa de P. sergenti, comparando com prospecções realizadas noutras áreas da região Centro de Portugal, sugere que este potencial vector esteja a expandir-se para latitudes mais elevadas, aumentando o risco de introdução de L. tropica no território, por contacto com imigrantes ou viajantes infectados de áreas endémicas.
vi ABSTRACT
Study of phlebotomine sand flies (Diptera, Phlebotominae), vectors of Leishmania
sp. in Torres Novas Municipality, Portugal. Sofia Isabel Martins Branco
KEYWORDS: phlebotomine sand flies, bioecology, Leishmania, Torres Novas,
Portugal.
Phlebotomine sand flies are hematophagous dipterans responsible for vectorial transmission of several pathogens, including protozoans of Genus Leishmania. In Portugal human and canine are caused by L. infantum, the dog the main reservoir, and Phlebotomus perniciosus and P. ariasi are the proven vectors of the parasite. Three foci are known but canine leishmaniasis has been reported from several other areas in the country, for which sand fly species and their infection rates are unknown.
This study is the first phlebotomine survey in Torres Novas Municipality, Santarém District, in Central Region, Portugal. The main objectives were to identify the phlebotomine species, their bioecological aspects, Leishmania infection rates, and vectorial transmission risk factors in the municipality.
From June to November, 2010, 275 biotopes were surveyed with CDC light traps. Captures were performed in 91 localities, covering the 17 parishes of the Municipality, and included domestic, peridomestic and silvatic biotopes. Captured specimens were identified morphologically and females were used for molecular detection of Leishmania DNA and blood meal identification. Simple and multiple regression analysis were used to determine risk factores for phlebotomine presence. Nonparametric tests were used to compare densities.
A total of 1262 sand flies were captured and identified. Four of the five species known for Portugal were detected, with the following relative abundances: P. perniciosus 73.69%, P. ariasi 8.16%, P. sergenti 6.58% and Sergentomyia minuta 11.57%. In 82% of localities at least on phlebotomine species was observed and in 71.4% at least one L. infantum comproved vector species was present. P. perniciosus was captured in all the Municipality 17 parishes.
Risk factores were identified as: high average temperatures and low relative humidities, sheltered locations and absence of strong wind, presence of pine trees as dominant vegetation, peridomestic biotopes, particularly sheep pens and rabbit warrens, or in proximity of sheep, poultry and swallow nests.
L. infantum infection rate was 4% for P. ariasi and 0.32% for the total of phlebotomine females.
P. perniciosus exhibited an opportunistic behavior, feeding in a wide variety of vertebrate hosts.
vii
gravid infecttive female, suggest that Torres Novas Municipality is a leishmaniasis focus in the country.
The higher abundance of P. sergenti, compared with surveys done in other areas of Central region of Portugal, suggests the vector may be expanding to higher latitudes, increasing the risk of introduction of L. tropica in the territory, by contact with infected immigrants or travelers from endemic areas.
ÍNDICE
Agradecimentos ... iii
Resumo ... iv
Abstract ... vi
Lista de abreviaturas e siglas... xii
1 - Introdução 1.1 - Flebótomos (Diptera, Psychodidae) ...1
1.1.1 - Morfologia geral ...2
1.1.1.1 - Morfologia dos imagos ...2
1.1.1.2 - Morfologia das formas imaturas ...6
1.1.2 - Taxonomia ...7
1.1.3 - Distribuição ...9
1.1.4 - Ciclo de vida e bioecologia geral ...9
1.1.4.1 – Bioecologia dos imagos ...11
1.1.4.2 - Bioecologia das formas imaturas ...13
1.1.5 - Importância em Medicina humana e veterinária ...14
1.2 - Leishmanioses ...15
1.2.1 - Epidemiologia ...16
1.2.2 - Manifestações clinícas da infecção por Leishmania sp. em humanos ...19
1.2.3 - Manifestações clínicas da infecção por L. infantum em cães, raposas e gatos ...20
1.2.4 - Ciclo de vida de Leishmania e tipos de transmissão ...21
1.2.4.1 - Desenvolvimento intravectorial de Leishmania sp. ...23
1.3 - Flebótomos em Portugal ...25
1.3.1 - Bioecologia das espécies flebotomínicas portuguesas ...27
1.4 - Leishmanioses em Portugal ...33
1.5 - Alterações climáticas, flebótomos e transmissão vectorial de Leishmania sp. ...34
1.6 - Controlo das leishmanioses ...36
1.6.1 - Controlo vectorial ...37
1.7 - Monitorização flebotomínica em áreas endémicas ...39
1.7.1- Métodos de captura de flebótomos ...40
1.7.1.1 - Amostragem de formas imaturas ...40
1.7.1.2 - Amostragem de imagos ...40
1.7.3 - Métodos de identificação das preferências hemáticas de flebótomos ...43
1.8 - Objectivos ...44
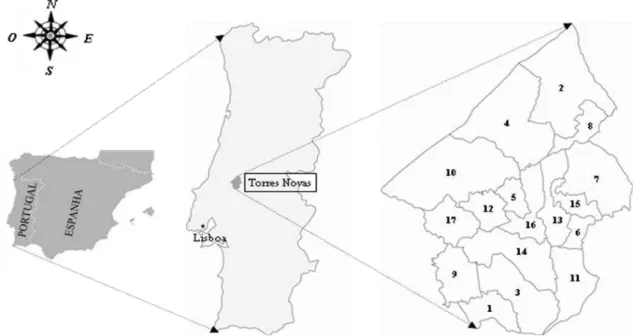
2 - Material e Métodos 2.1 - Caracterização da área de estudo ...46
2.1.1 - Demografia ...47
2.1.2 - Orografia e Hidrologia ...48
2.1.3 - Geologia ...48
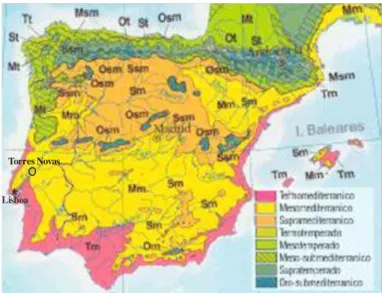
2.1.4 - Clima ...48
2.1.4.1 - Temperatura ...48
2.1.4.2 - Precipitação e Humidade relativa ...49
2.1.4.3 - Ventos dominantes ...49
2.1.4.4 - Classificação climática ...49
2.1.5 - Coberto vegetal ...51
2.1.6 - Fauna ...51
2.2 - Captura de flebótomos ...52
2.2.1 - Período de prospecção, método de captura e conservação do material ...52
2.2.2 - Método de amostragem ...53
2.2.3 - Biótopos prospectados ...54
2.2.3.1 - Divisão e caracterização dos vários tipos de biótopos ...54
2.2.3.2 - Registos dos biótopos ...57
2.3 - Identificação morfológica dos flebótomos capturados ...58
2.3.1 - Identificação dos flebótomos machos ...58
2.3.2 - Identificação dos flebótomos fêmeas ...59
2.3.3 - Chave dicotómica de identificação dos flebótomos ...61
2.3.3.1 - Chave de Identificação para espécies flebotomínicas (Diptera, Psychodidae) do Género Phlebotomus e de S. minuta de Portugal, Espanha e Marrocos - Machos ...63
2.3.3.2 - Chave de Identificação para espécies flebotomínicas (Diptera,Psychodidae) do Género Phlebotomus e de S. minuta de Portugal, Espanha e Marrocos - Fêmeas ...67
2.4 - Fotografias ...72
2.5 - Parâmetros determinados neste estudo ...72
2.6 - Análise estatística ...73
2.7 - Análise molecular ...74
2.7.1 - Extracção de DNA a partir de flébotomos ...74
2.7.2 - Detecção de DNA de Leishmania sp. ...76
2.7.2.2 - Amplificação do DNA ribossomal com sequências iniciadoras ITS1 ...78
2.7.2.3 - Polimorfismos de tamanho de fragmentos de restrição de DNA-RFLP ...79
2.7.3 - Análise das refeições sanguíneas ...80
2.7.3.1 - Purificação dos Produtos de PCR ...81
2.7.4 - Sequenciação e análise dos segmentos de DNA purificados ...82
3 - Resultados 3.1 - Aspectos bioecológicos das espécies flebotomínicas capturadas ...83
3.1.1 - Abundâncias relativas ...83
3.1.2 - Razão dos sexos ...84
3.1.3 - Fêmeas alimentadas e grávidas ...85
3.1.4 - Rotação da genitália dos machos ...87
3.1.5 - Ecto e endoparasitas (não Leishmania) em flebótomos capturados ...87
3.2 - Período de actividade, densidades flebotomínicas mensais e sua variação ...88
3.2.1 - Phlebotomus (Larroussius) perniciosus Newstead, 1911 ...89
3.2.2 - Phlebotomus (Larroussius) ariasi Tonnoir, 1921 ...90
3.2.3 - Phlebotomus (Paraphlebotomus) sergenti Parrot, 1917 ...91
3.2.4 - Sergentomyia (Sergentomyia) minuta (Rondani, 1843) ...92
3.3 - Temperaturas e humidades relativas mensais ...93
3.4 - Distribuição geográfica ...94
3.5 - Distribuição flebotomínica por tipo de biótopo ...101
3.5.1 - Biótopos domésticos ...102
3.5.2 - Biótopos peridomésticos ...103
3.5.2.1 - Densidades de P. perniciosus e P. ariasi nos vários tipos de biótopos que incluem canis ...104
3.5.3 - Biótopos silváticos ...105
3.6 - Factores de risco para a presença de flebótomos - Regressão logística ...106
3.6.1 - Phlebotomus (Larroussius) perniciosus Newstead, 1911 ...106
3.6.2 - Phlebotomus (Larroussius) ariasi Tonnoir, 1921 ...109
3.6.3 - Phlebotomus (Paraphlebotomus) sergenti Parrot, 1917 ...112
3.6.4 - Sergentomyia (Sergentomyia) minuta (Rondani, 1843) ...115
3.6.5 - Factores de variação nas densidades, em relação aos biótopos positivos para flebótomos ...118
3.7 - Associação de espécies ...119
3.7.1 - Associação entre as várias espécies flebotomínicas ...119
3.8 - Análise molecular ...120
3.8.1 - Taxa de infecção flebotomínica por Leishmania sp. ...120
3.8.2 - Identificação das refeições sanguíneas ...123
4 - Discussão e Conclusões ...128
Referências bibliográficas ...144
Lista de figuras e quadros ...172
xii LISTA DE ABREVIATURAS E SIGLAS
% - Percentagem
ºC - Grau Celsius
μm - Micrometro
CDC - ―Centers for Diseases Control and Prevention‖
Cit b - Citocromo b
cm - Centímetro
CMDFCI - Comissão Municipal de Defesa da Floresta Contra Incêndios
COI - Citocromo c Oxidase Subunidade I
Csa - Clima temperado mediterrânico, com verões quentes e chuvas no Inverno, segundo a classificação de Köppen
DDT - Dicloro-Difenil-Tricloroetano
DNA - Ácido desoxiribonucleico, do inglês ―Deoxyribonucleic acid‖
EDTA - Ácido etilenodiamino tetra-acético , do inglês ―Ethylenediamine tetraacetic acid‖
ELISA - do inglês ―Enzyme Linked Immunosorbent Assay”
Ex.- Exemplo
HAART - Terapêutica anti-retroviral de elevada eficácia, do inglês ―Highly active
antiretroviral therapy‖
IHMT - Instituto de Higiene e Medicina Tropical
Io - Índice ombrotérmico
IPCC - Painel intergovernamental em alterações climáticas, do inglês ―Intergovernmental Panel on Climate Change‖
Itc - Índice de termicidade compensado
ITS - Espaçadores internos transcritos, do inglês ―Internal transcribed spacers‖
kDNA - DNA cinetoplastideal
Km - Kilómetro
xiii
M - Mol
MLEE - Mobilidade electroforética de isoenzimas, do inglês “Multi-Locus Enzyme Electrophoresis‖
mA - Miliampere
mm - Milímetro
mM - Milimole
NNN - Novy-MacNeal-Nicolle
N - Norte
O - Oeste
OMS - Organização Mundial de Saúde
pb - pares de base
PCR - reacção em cadeia da polimerase, do inglês ―Polymerase chain reaction‖
pM - picomol
PNOC - Prepronociceptina
RFLP - Hidrólise do DNA amplificado por endonucleases de restrição, do inglês
―Restriction fragment lenght polymorphism‖
RNA - Ácido ribonucleico, do inglês ―Ribonucleic acid‖
rRNA - Ácido ribonucleico ribossómico, do inglês ―Ribosomal ribonucleic acid‖
SIA - Análise de isótopos estáveis, do inglês ―Stable isotopes analysis‖
SIDA - Síndrome de imunodeficiência adquirida
TAE - Tris-Acetato-EDTA
UNL - Universidade Nova de Lisboa
UPMM - Unidade de Parasitologia e Microbiologia Médicas
V- Volt
VIH - Vírus da imunodeficiência humana
Introdução
1
1- Introdução
1.1 - Flebótomos (Diptera, Psychodidae)
Os flebótomos (em inglês ―phlebotomine sand flies‖), em Portugal muitas vezes confundidos erradamente com mosquitos (Família Culicidae), são dípteros nematóceros de pequenas dimensões (2 a 5 mm de comprimento), de antenas longas, aspecto frágil, coloração que varia de castanha clara a negra, e de corpo alongado revestido de finas sedas (Fig. 1) (Killick-Kendrick, 1999).
Figura 1 - Flebótomos adultos, fêmea e macho, conservados em álcool (fotografias de Sofia Branco, exemplares capturados em Torres Novas, 2010).
Pertencem à Família Psychodidae e à Subfamília Phlebotominae. Esta
Subfamília distingue-se das restantes Subfamílias de psicodídeos (Trichomyiinae, Sycoracinae, Psycodinae, Bruchomyiinae e Horaiellinae) pela presença de (Lawyer et al., 2011):
1- Olhos separados, sem a presença de ponte interocular.
2- Palpos articulados com cinco segmentos.
3- Aparelho bucal picador-sugador e em que as peças bucais são pelo menos
tão longas como a cabeça.
Introdução
2
5- Nervura radial da asa com cinco ramos.
1.1.1 - Morfologia geral
A caracterização morfológica dos flebótomos, apresentada neste trabalho, foi efectuada com base nos trabalhos de Rioux et al. (1969), Abbonenc (1972) e Pires (2000).
1.1.1.1 - Morfologia dos imagos
Os flebótomos adultos apresentam o corpo dividido em cabeça, tórax e abdómen.
Cabeça
A cabeça (Fig. 2) apresenta um par de olhos compostos separados, na face dorsal, pela fronte, pela área de inserção das antenas, pela sutura interocular e pelo clípeo.
O aparelho bucal é do tipo picador-sugador, formado por seis peças: lábio, epifaringe, um par de mandíbulas e um par de maxilas. Estas, estão ausentes nos machos. Os palpos articulados, com cinco segmentos, inserem-se ao nível das maxilas.
O aparelho bucal prolonga-se, no interior da cavidade cefálica, num canal que se divide em duas regiões sucessivas: o cibário, ou cavidade bucal, e a faringe. Estas estruturas podem apresentar espículas, escamas, ou dentes, com importância taxonómica.
Introdução
3 Figura 2 - Vista dorsal da cabeça de um flebótomo e pormenor da faringe e cibário
(adaptado de El-Hossary, 2006 e Theodor, 1958).
Tórax
O tórax, com aspecto giboso, apresenta as asas (um par na região dorsal do mesotórax), os balanceiros (um par na região dorsal do metatórax) e as patas (três pares na região ventral, um par por cada segmento torácico):
- As asas são lanceoladas, pilosas e verificam-se nove nervuras bem individualizadas (Fig. 3): sete nervuras longitudinais e duas transversais. Nas nervuras longitudinais, a segunda, ou radial, bifurca-se originando um ramo anterior R1, ou primeira longitudinal, e um ramo posterior, ou segunda longitudinal. Esta última, bifurca-se duas vezes dando origem à nervura R4, na primeira ramificação, e às nervuras R2 e R3 na segunda. A quarta nervura longitudinal apresenta uma única ramificação, e as restantes nervuras são simples (sem ramificações). Os parâmetros α, β, δ e π, bem como o índice alar (α/β) apresentam importância taxonómica . As nervuras transversais encontram-se perto da base da asa.
Introdução
4 Figura 3 - Asa de flebótomo e respectiva nomenclatura das nervuras e parâmetros alares: C - nervura costal, SC - nervura subcostal, 1ª a 6ª long. - 1ª a 6ª nervuras longitudinais, r-m - nervura transversa que liga a 3ª e a 4ª longitudinais, m-cu - nervura transversa que liga a 4ª, 5ª e 6ª longitudinais. A radial bifurca-se na base originando um ramo anterior R1 e um ramo posterior ou 2ª longitudinal, que por sua vez se bifurca duas vezes, originando os ramos R2-R3 e o ramo R4. Os ramos M1 e M2 resultam da bifurcação da 4ª nervura longitudinal. A nervura cubital ou 7ª longitudinal é curta e geralmente pouco
visível (adaptado de Rioux et al., 1969).
- As patas são longas, com 5 a 6 mm de comprimento, cobertas por escamas e sedas, e são compostas, como em todos os dípteros, por coxa, trocanter, fémur, tíbia e tarso, este último com 5 segmentos.
Abdómen
O abdómen é aproximadamente cilíndrico e composto por dez segmentos subiguais cobertos de sedas. A disposição das sedas nos tergitos apresenta importância taxonómica para a identificação dos Géneros.
Os segmentos posteriores do abdómen encontram-se modificados, constituindo a genitália (os três últimos segmentos na fêmea e os quatro últimos segmentos no macho). A morfologia desta estrutura é essencial para a identificação taxonómica de ambos os sexos.
Introdução
5
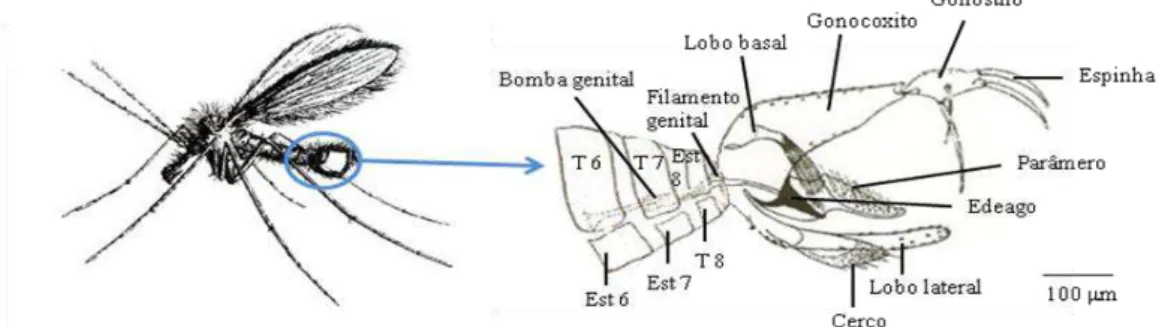
No macho, apenas os segmentos abdominais I a VIII são visíveis, os segmentos IX e X estão totalmente transformados em apêndices genitais. A genitália (ou terminália) é composta pelas seguintes estuturas:
- Um par de gonocoxitos ou artículos basais, volumosos, que dependendo das espécies podem apresentar, ou não, um lobo basal; um par de gonostilos ou artículos apicais, ligados aos gonocoxitos, onde se inserem espinhas fortemente quitizadas, em número variável.
- Um par de edeagos ou pénis, estruturas copuladoras externas que se prolongam para o interior do abdómen pelo filamento e bomba genital. As restantes estruturas internas do aparelho genital masculino consistem num par de testículos, um par de canais deferentes, uma vesícula seminal e um canal ejaculador, ligado à bomba genital.
- Um par de parâmeros.
- Um par de lobos laterais.
-Um par de cercos.
Figura 4 - Pormenor da extremidade posterior do abdómen de um flebótomo macho e
respectivas estruturas genitais externas e internas. T6 a T8 – tergitos 6 a 8; Est 6 a Est 8 – esternitos 6 a 8 (adaptado de Sabin et al., 1944 e de Lawyer etal., 2011).
Introdução
6
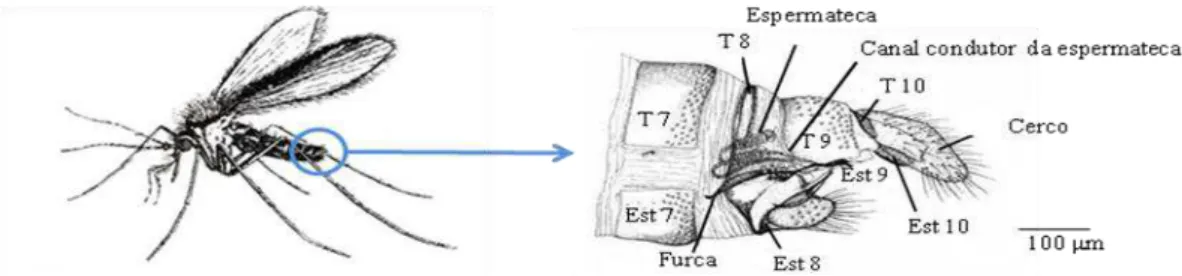
Nas fêmeas, todos os segmentos abdominais são visíveis e o último (X) apresenta um par de cercos ou gonapófises ventrais, entre os quais se situa o orifício anal. As estruturas genitais são internas e incluem:
- O átrio genital com espículas, rodeado pela furca quitinizada, e que se inicia a partir do orifício genital.
- Um par de espermatecas, onde se mantém o esperma do macho após a cópula. Cada espermateca é constituída por um reservatório, ou cápsula, que por sua vez é constituído por uma cabeça, um corpo e um pescoço ou colo, que se liga através de um canal condutor ao átrio genital. Os canais condutores podem ser individuais em toda a sua extensão ou fundir-se num canal comum, consoante as espécies.
- Um par de ovários, constituídos pelos ovaríolos cujo volume varia de acordo com o estado de desenvolvimento dos ovos. O oviducto é comum, formado pela junção dos canais condutores oriundos de cada um dos ovários.
- Um par de glândulas anexas, de forma alongada.
Figura 5 - Pormenor da extremidade posterior do abdómen de um flebótomo fêmea e respectivas estruturas genitais internas. T7 a T10 – tergitos 7 a 10; Est 7 a Est 9 – esternitos 7 a 9
(adaptado de Sabin et al., 1944 e Lane, 1993).
1.1.1.2 - Morfologia das formas imaturas
Introdução
7
As larvas são vermiformes e atingem cerca de 8 mm de comprimento. Apresentam o corpo dividido em cabeça, tórax e abdómen. A cabeça é bem desenvolvida e quitinizada. O abdómen é composto por nove segmentos, nos primeiros sete existem pseudópodes, ou falsas patas, e no último segmento (IX) insere-se um par de sedas caudais no primeiro estádio de desenvolvimento e dois pares nos restantes três estádios (na maioria das espécies flebotomínicas).
Na pupa, a cabeça e o tórax estão fundidos. Assim, o corpo está dividido em cefalotórax e abdómen, apresentando uma forma ligeiramente globosa. Os últimos segmentos abdominais encontram-se cobertos pela exúvia larvar do último estádio.
1.1.2 - Taxonomia
Em relação à Posição Taxonómica, os flebótomos pertencem ao Filo Arthropoda, Subfilo Hexapoda, Classe Insecta, Subclasse Pterygota, Superordem Endopterygota, Ordem Diptera, Subordem Nematocera, Infraordem Psychodomorpha, Família Psychodidae e Subfamília Phlebotominae (Leger & Depaquit, 2001).
Introdução
8 Quadro 1 - Géneros da Subfamília Phlebotominae e sua distribuição geográfica
(adaptado de Léger & Depaquit, 2001, Marcondes, 2007 e CIPA, 2011).
Géneros de Phlebotominae Distribuição geográfica
Australophlebotomus Theodor, 1948 Oceânia
Bichromomyia Artemiev, 1991 América do Norte, Central e do Sul
Brumptomyia França & Parrot, 1921 América Central e do Sul
Chinius Leng, 1987 China, Eurásia e África do Norte
Dampfomyia Addis, 1945 América do Norte, Central e do Sul
Deanemyia Galati,1995 América do Sul
Demeillonius Davidson, 1980 Indo-Malásia, África a Sul do Sahara
Evandromyia Mangabeira, 1941 América do Sul
Expapillata Galati, 1995 América do Sul
Grassomya Theodor & Mesghali, 1964 África, sul do Sahara
Hertigia Fairchild, 1949 América Central
Idiophlebotomus Quate & Fairchild, 1961 Oceânia, Indo-Malásia, Eurásia e África do Norte
Lutzomyia França, 1924 América do Norte, Central e do Sul
Martinsmyia Galati, 1995 América do Sul
Micropygomyia Barretto, 1962 América do Norte, Central e do Sul
Migonemyia Galati, 1995 América do Sul
Nyssomyia Barretto, 1962 América do Norte, Central edo Sul
Oligodontomyia Galati, 1995 América do Sul
Parvidens, Theodor & Mesghali 1964 África, Sul do Sahara +Phlebotomiella Meunier, 1905 + extinta +Phlebotomites Hennig, 1972 + extinta
Phlebotomus Rondani & Berté, 1840 Indo-Malásia, África (Norte e Sul do Sahara) e Eurásia
Pintomyia Costa Lima, 1932 América Central e do Sul
Pressatia Mangabeira, 1942 América Central e do Sul
Psathyromyia Barretto, 1962 América do Norte, Central e do Sul
Psychodopygus Mangabeira, 1941 América do Norte, Central e do Sul
Sciopemyia Barretto, 1962 América Central e do Sul
Sergentomyia França & Parrot, 1920 Oceânia, Indo- Malásia, África (Norte e Sul do Sahara) e Eurásia
Spelaeomyia Theodor, 1948 África, Sul do Sahara.
Spelaeophlebotomus Theodor, 1978 África, Sul do Sahara
Trichophoromyia Barretto, 1962 América Central e do Sul
Trichopygomyia Barretto, 1962 América Central e do Sul
Viannamyia Mangabeira, 1941 América Central e do Sul
Introdução
9
Com a continuação do desenvolvimento de métodos moleculares e biométricos, aplicados ao estudo das relações filogenéticas entre flebotomíneos, a posição taxonómica dos diferentes Géneros poderá sofrer alterações mesmo em relação às actuais classificações (Munstermann, 2004).
1.1.3 - Distribuição
Desde a primeira descrição de um flebótomo, em 1691, por Philippo Bonanni, que ilustrou um pequeno insecto a que chamou ―Culex minimus‖ (literalmente, pequeno mosquito) (Dedet, 2005), cerca de 850 espécies foram descritas (Brazil et al., 2010). Estas encontram-se distribuídas por regiões temperadas, tropicais e subtropicais, nomeadamente na Europa, Ásia, África, América Central e do Sul e Austrália. O limite Norte da distribuição na Europa é 50º 10’ N na Alemanha (Naucke et al., 2008). Este limite é semelhante ao observado no Canadá, na América do Norte. A Sul atingem os 40º de latitude, não tendo sido reportada, até á presente data, a sua presença na Nova Zelândia e Ilhas do Pacífico. Podem ser encontrados flebótomos desde abaixo do nível do mar, em redor do Mar Morto, até uma altitude de 3300 m no Afeganistão (Killick-Kendrick, 1999).
Apesar de ampla, a distribuição não é contínua, estando condicionada localmente ao tipo de vegetação, clima e outros factores bióticos e abióticos (Afonso & Alves-Pires, 2008).
1.1.4 - Ciclo de vida e bioecologia geral
Introdução
10
Figura 6 - Ciclo de vida dos flebótomos: fase aérea e terrestre (fotografias de Sofia Branco, 2011, exemplares da colónia de Phlebotomus perniciosus, UEI PM, IHMT, UNL).
O ciclo de vida desenvolve-se em dois meios distintos: os adultos vivem em meio aéreo e as formas imaturas em meio terrestre. A duração de cada uma das fases é variável, dependendo da espécie, disponibilidade de alimento, condições climáticas e fotoperíodo (Munstermann, 2004) (Quadro 2).
Quadro 2 - Duração aproximada das várias fases do ciclo de vida dos flebótomos (adaptado de Killick-Kendrick, 1999 e de Leger & Depaquit, 2001).
Fase do ciclo de vida Duração aproximada
Após postura, eclosão da larva 7 a 14 dias
De larva a pupa 21 dias
De pupa a imago 5-10 dias
Introdução
11 1.1.4.1 - Bioecologia dos imagos
Tanto os machos como as fêmeas alimentam-se de sucos e açúcares vegetais (Lewis & Domoney, 1966) e de secreções de outros insectos como afídeos e coccídeos (Lucientes et al., 2005), mas, no caso das fêmeas, estas são também hematófagas, tendo necessidade de efectuar uma refeição sanguínea num hospedeiro vertebrado para que se dê a maturação ovárica. Algumas espécies são autogénicas, ou seja tem a capacidade de efectuar a primeira postura antes de realizar uma refeição sanguínea (Johnson, 1961; El-Kammah, 1973; Kassem & Hassan, 2003), e a partenogénese, apesar de rara, foi já reportada para duas espécies do Novo Mundo (Brazil & Oliveira, 1999; Alves et al., 2008).
Período de actividade
Na sua maioria, os flebótomos apresentam actividade crepuscular e nocturna, quando a temperatura é mais baixa e a humidade relativa mais elevada. Existem algumas espécies que exibem actividade diurna quando o seu habitat é perturbado. O período de actividade, tanto o anual como o diário, é muito variado e fortemente condicionado por factores climáticos. Pensa-se que a velocidade do vento acima dos 1,5 metros por segundo iniba o vôo e que este seja totalmente suspenso se a velocidade atingir 4-5 m por segundo (Lane, 1993).
Nos países tropicais, observa-se actividade flebotomínica ao longo de todo o ano, podendo existir várias gerações anuais (até sete). Nas regiões temperadas, ocorre diapausa no quarto estádio larvar (Dolmatova & Demina, 1971) e verificam-se uma a duas gerações anuais (por vezes três). Em duas espécies neotropicais observa-se, excepcionalmente, diapausa no estádio de ovo (Lawyer & Young, 1991; Comer et al., 1994).
Locais de repouso
Introdução
12
solo, zonas de vegetação densa, tocas de roedores e outros mamíferos, ninhos de aves e termiteiras (Killick-Kendrick, 1999).
Dispersão
Os flebótomos são fracos voadores e afastam-se, no máximo, um ou dois Km dos seus criadouros (Killick-Kendrick et al., 1984). Contudo, estas distâncias são variáveis conforme as espécies (Afonso & Alves-Pires, 2008).
Comportamento alimentar das fêmeas
Embora as várias espécies flebotomínicas possam apresentar diferenças na preferência por um ou outro animal como fonte sanguínea, como por exemplo o ser humano ou o cão, a variação de potenciais hospedeiros é geralmente extensa, e dentro destes, na ausência de uma hospedeiro preferencial poderão apresentar um comportamento oportunista, alimentando-se no vertebrado disponível (Quinnel et al., 1992; Maroli et al., 2009).
Aproximam-se do ―alvo‖ em pequenos vôos silenciosos e, ao picarem, dilaceram a pele do hospedeiro com pequenos movimentos de vaivém, formando um microhematoma de onde sugam o sangue (telmofágicas, ―pool feeding‖), ao mesmo tempo que inoculam saliva com propriedades anticoagulantes e vasodilatadoras. A picada é geralmente dolorosa, a refeição sanguínea tem uma duração entre 30 segundos a cinco minutos e a maioria das espécies são exofágicas e exofílicas (Leger & Depaquit, 2001).
Reprodução
Introdução
13
em combinação com feromonas (Morton & Ward, 1989; Chelbi et al., 2011) e vibrações sonoras produzidas pelos machos (Ward et al., 1988). Durante a cópula, o macho mantém a fêmea fixa por meio dos apêndices genitais e com os seus edeagos ou pénis, inserem o esperma no átrio genital da fêmea, sendo este armazenado nas espermatecas.
O número de refeições sanguíneas por postura é variável consoante as espécies, podendo-se verificar ou não, concordância gonotrófica (Lucientes et al., 2005).
Oviposição
Para a oviposição (entre 30 a 70 ovos por postura), as fêmeas procuram locais abrigados, frescos e húmidos (entre 15,6ºC e 26,7ºC), como o solo de florestas, tocas de roedores, fissuras de paredes e muros, abrigos de animais peridomésticos, grutas e termiteiras, entre outros (Lane, 1993; Afonso & Alves-Pires, 2008).
Pensa-se que as fêmeas sejam inicialmente atraídas ao local de postura por características físico-químicas do substracto e posteriormente estimuladas a efectuarem a mesma pela presença de feromonas de ovos conspecíficos (Killick-Kendrick, 1999).
1.1.4.2 - Bioecologia das formas imaturas
Após a eclosão, as larvas alimentam-se de matéria orgânica, em decomposição, de diversas origens, animal e vegetal, e mesmo do revestimento externo dos ovos de onde provavelmente adquirirem simbiontes e parasitas das fêmeas adultas. Têm fraca mobilidade e permanecem no substrato a diferentes profundidades.
No final do quarto estádio, a larva deixa de se alimentar e procura um local mais seco para pupar, geralmente fixa-se a uma estrutura como uma folha seca ou uma pedra (Lawyer & Perkins, 2000).
Introdução
14 1.1.5 - Importância em Medicina humana e veterinária
A importância médica dos flebotomíneos deve-se ao facto de as fêmeas serem hematófagas e potenciais vectoras de diferentes agentes patogénicos para as pessoas e/ou animais (Adler & Theodor, 1957), dos quais há a realçar os seguintes:
- Protozoários do Género Leishmania (Kinetoplastida, Trypanosomatidae)
(ponto 1.2). Cerca de 70 espécies flebotomínicas são potencial ou comprovadamente vectoras deste parasita (Alexander & Maroli, 2003).
- Bartonella bacilliformis, uma proteobactéria responsável pela bartonelose humana ou doença de Carrion (febre de Oroya e verruga peruana), infecção limitada aos vales das montanhas Andinas na América latina (Bass et al., 1997).
- Vários arbovírus, dos Géneros Phlebovirus (Família Bunyaviridae), Orbivirus (Família Reoviridae) e Vesiculovirus (Família Rhabdoviridae (Comer & Tesh, 1991; Depaquit et al., 2010).
Os flebótomos podem também ser agentes de doença, nomeadamente a Harara que é uma forte reacção alérgica causada pela picada em seres humanos.
De acordo com a classificação taxonómica utilizada (ponto 1.1.2), também o número de Géneros flebotomínicos com importância médica difere. Assim, seguindo a classificação de Lewis e colaboradores apenas dois Géneros, Phlebotomus no Velho
Mundo e Lutzomyia no Novo Mundo, são comprovadamente vectores de agentes
patogénicos causadores de doenças humanas (OMS, 2010). Pela classificação apresentada no Quadro 1 (Rispail & Léger, 1998; Léger & Depaquit, 2001; Galati, 1995 e 2003), vários Subgéneros de Lutzomyia foram elevados a Géneros e, como tal, seis novos Géneros (Bichromomyia, Lutzomyia, Nyssomyia, Psychodopygus, Pintomyia e Migonemyia) estão agora implicados na transmissão vectorial de Leishmania sp.
Introdução
15
Na região mediterrânica verifica-se a presença de Leishmania e dos três Géneros de arbovírus, referidos anteriormente. Está presente a circulação do vírus Toscana (isolado de P. perniciosus, P. perfiliewi e detectado RNA em S. minuta)responsável por meningites e meningo-encefalites estivais, dos vírusSicília (isolado de P. papatasi e P. ariasi) e Nápoles (isolado de P. perniciosus, P. perfiliewi e P. papatasi) causadores da vulgarmente designada ‖febre por flebótomos‖ (febre papatacci ou febre dos 3 dias). Para além destes arbovirus, foram já isolados de flebótomos, nesta região, os flebovírus
Adria, Arbia, Corfou, Massilia e Punique, e os Vesiculovírus Radi e Yug Bogdanovac.
Contudo, à excepção do vírus Adria, suspeito de ser o agente causal de uma síndrome febril numa criança na Grécia (Anagnostou et al., 2011), desconhece-se a possibilidade de estes vírus poderem causar doenças em humanos ou animais (Comer & Tesh, 1991; Depaquit et al., 2010; Zhioua et al., 2010; Papa et al., 2011).
É ainda de realçar que o vírus Toscana foi isolado, pela primeira vez em humanos, a partir de um paciente que contraiu a infecção em Portugal, no Algarve (Ehrnst et al., 1985), e que a presença dos vírus Nápoles e Sicília no país, apesar de suspeita já desde 1912 devido a um surto de febre papatacci ocorrido nesse ano (França, 1913), só foi comprovada por estudos serológicos em 1974 (Filipe, 1974).
1.2 - Leishmanioses
As leishmanioses são parasitoses causadas por protozoários pertencentes ao Filo Sarcomastigophora, Ordem Kinetoplastida, Família Trypanosomatidae e Género Leishmania. As diferentes espécies de Leishmania são transmitidas por espécies flebotomínicas e afectam seres humanos e/ou animais, tanto domésticos como silváticos (Campillo etal., 1999).
Introdução
16 Quadro 3 - Espécies de Leishmania patogénicas para humanos (adaptado de OMS, 2010).
Subgénero L. (Leishmania) L. (Leishmania) L. (Viannia) L. (Viannia)
Velho Mundo L. donovani L. major L. infantum L.tropica
L. killickib
L.aethiopica L. infantum
Novo Mundo L. infantuma L. infantuma L. braziliensis L. braziliensis
L. mexicana L. guyanensis L. panamensis L. pifanoib L. panamensis
L.venezuelensis L. shawi L. garhamib L. naîffi
L. amazonensis L. lainsoni L. lindenbergi L. peruviana L. colombiensisc
Tropismo Viscerotrópica Dermotrópica Dermotrópica Mucotrópica
a = L. chagasi
b - o estatuto de espécie encontra-se em discussão. c - a posição taxonómica encontra-se em discussão.
1.2.1 - Epidemiologia
As leishmanioses são parasitoses, ainda negligenciadas, e endémicas em 98 países ou territórios (Fig. 7). Estima-se que a nível mundial existam 12 milhões de pessoas infectadas e mais de 350 milhões estão em risco de contrair estas zoonoses/antroponoses. Ocorrem, anualmente, cerca de meio milhão de novos casos de leishmaniose visceral e 1,5 milhões de leishmaniose cutânea (OMS, 2010).
Introdução
17 Figura 7 - Distribuição mundial das leishmanioses humanas: cutânea, mucocutânea e visceral
(adaptado de ParaSite, 2011).
A leishmaniose cutânea é causada por várias espécies dos Subgéneros Leishmania e Viannia (Quadro 3) e estima-se que 90% dos casos ocorrem no Afeganistão, Argélia, Brasil, Irão, Peru, Arábia Saudita e Síria. As manifestações mucocutâneas são causadas pela espécie L. braziliensis e, em casos menos frequentes, por L. panamensis (Subgénero Viannia), e encontram-se restritas na América Central e do Sul, ocorrendo 90% dos casos na Bolívia, Brasil e Peru (OMS, 2011).
A leishmaniose visceral é normalmente causada por espécies pertencentes ao complexo Leishmania donovani: L. donovani e L. infantum no Velho Mundo e Leishmania chagasi no Novo Mundo. Muitos autores consideram L. chagasi geneticamente indistinta de L. infantum, e pensa-se que o parasita tenha sido introduzido nas Américas durante o período dos descobrimentos. Estima-se que cerca de 90% dos casos de leishmaniose visceral ocorrem no Bangladesh, Índia, Nepal, Sudão e Brasil (OMS, 2011).
Introdução
18
A leishmaniose cutânea por L. tropica é uma antropozoonose presente no Médio Oriente, Norte de África e Grécia (Garifallou et al., 1984; Frank et al., 1993) e é transmitida por P. sergenti. L. major é responsável pela leishmaniose cutânea de carácter zoonótico no Norte de África e Médio Oriente, sendo P. papatasi o vector e os roedores gerbilíideos reservatórios. Em relação a L. killicki, também agente de leishmaniose cutânea na Argélia, Tunísia e Líbia, desconhecem-se, até à data, os respectivos vectores e reservatórios (OMS, 2011).
L. infantum é a única espécie de Leishmania presente na Europa (com excepção da Grécia onde se verifica também L. tropica) e é o agente responsável pela maioria dos casos de leishmaniose visceral e cutânea, nesta região, e de leishmaniose visceral na
restante Bacia do Mediterrâneo (OMS, 2010). Esta zoonose, em que o cão (Canis lupus
familiaris) é o principal hospedeiro reservatório, afecta, na região, sobretudo crianças e adultos imunocomprometidos.
Para além do cão, outros animais podem actuar como reservatórios de L. infantum ou hospedeiros acidentais: O gato é considerado um hospedeiro secundário (Gramiccia & Gradoni, 2005; Maroli et al., 2007) mas o número de casos de infecção destes animais, descritos em várias regiões do globo, sugere que este animal desempenhe um papel de reservatório habitual (Maia et al., 2008 e 2010a). A raposa e canídeos selvagens são considerados os reservatórios em meio silvático (Rioux, 1968; Abranches et al., 1983). Foram ainda detectados roedores (Bettini et al. 1980; Pozio et al., 1985; Morillaz- Marquez et al., 1985) e cavalos (Koehler et al., 2002; Rolão et al., 2005) infectados por L. infantum.
Introdução
19
Pensa-se que o aumento da incidência da leishmaniose, que se assistiu no Sul da Europa, ter sido devido, maioritariamente, a esta co-infecção, em conjunto com o turismo, alterações climáticas e outros factores (Desjeux & Alvar, 2003). No entanto, a incidência e o número de recidivas diminuíram na segunda metade da década de noventa com a introdução da terapêutica antri-retroviral forte ―HAART‖ (Fernandez Cotarelo et al., 2003; Campino & Maia, 2010).
1.2.2 - Manifestações clinícas da infecção por Leishmania sp. em humanos
Clinicamente, a doença em humanos apresenta três principais formas: cutânea,
mucocutânea e visceral, que variam dependendo da espécie de Leishmania em causa e
da resposta imunológica do indivíduo, entre outros factores:
- Leishmaniose cutânea: também conhecida como botão do Oriente, no Velho Mundo, é a forma mais comum da doença (Killick-Kendrick, 2010). Pode apresentar formas clínicas diversas desde lesões benignas, simples ou múltiplas, a lesões difusas, que dificilmente curam ou podem ser mesmo incuráveis (Campino & Abranches, 2002). Geralmente surgem nas zonas expostas do corpo, como a face, braços e pernas e, uma vez que deixam cicatrizes permanentes, podem ser causa de forte descriminação social (OMS, 2011).
- Leishmaniose mucocutânea ou espúndia: após um primeiro episódio de leishmaniose cutânea, ocorre a metastização com a destruição parcial ou total das membranas mucosas, nasal e oral, e tecidos adjacentes. A enorme desfiguração pode levar à exclusão social (OMS, 2011).
Introdução
20 1.2.3 - Manifestações clínicas da infecção por L. infantum em cães, raposas e gatos
Como foi referido, o cão é o principal reservatório doméstico de L. infantum. Neste, a infecção pode causar uma doença sistémica grave, que pode ser fatal na ausência de tratamento (OnLeish, 2011). A sintomatologia é variável, dependendo de múltiplos factores como o estado imunitário do animal, a estirpe de Leishmania em causa, a fase evolutiva da doença e os orgãos afectados. Apresenta geralmente envolvimento viscerocutâneo e a presença de elevado número de parasitas na pele favorece a transmissão pelo insecto vector (Pereira, 2008). Estima-se que cerca de 50% dos cães infectados sejam assintomáticos. Entre as manifestações clinícas, as mais comuns são linfadenopatias e lesões cutâneas. É também possível observar perda de peso, caquexia, polidipsia, hipertermia, anorexia, conjuntivite, esplenomegalia, epistaxe, onicogrifose, queratite, pneumonia, diarreia, melenas, rinite, icterícia, uveíte, sinais musculoesqueléticos e cardiovasculares e lesões nas membranas mucosas (Cardoso, 2004).
As raposas infectadas, contrariamente ao que se verifica nos cães, raramente apresentam manifestações (Abranches et al., 1984).
Introdução
21 1.2.4 - Ciclo de vida de Leishmania e tipos de transmissão
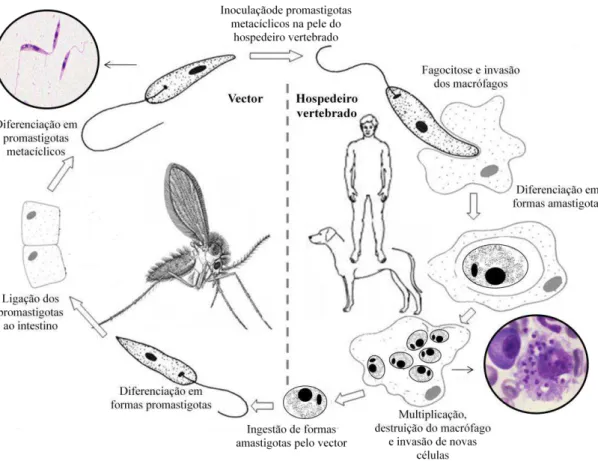
Figura 8 - Ciclo de vida de Leishmania sp. (adaptado de Beran, 2010, CDC, 2011a e de LeishRisk, 2011).
O ciclo (Fig. 8) é mantido entre o vector e o reservatório, e dependendo da espécie de Leishmania em causa, a transmissão é zoonótica ou antroponótica, consoante o reservatório é animal ou humano, respectivamente. É um parasita digenético que apresenta, fundamentalmente, duas formas morfológicas: a forma promastigota (flagelada e extracelular) no hospedeiro invertebrado ou vector, e a forma amastigota (sem flagelo e intracelular) no hospedeiro vertebrado (Bañuls et al., 2007).
Introdução
22
formas promastigotas metacílicas na pele do hospedeiro vertebrado. Neste, os parasitas são fagocitados e invadem monócitos e macrófagos, onde, no interior de fagolissossomas, se diferenciam em formas amastigotas, que se dividem por cissiparidade até que a célula eventualmente rebenta e o protozoário, agora livre, infecta novas células fagocítárias. A replicação e destruição das células repetem-se continuamente até que sejam controladas pela resposta imune do hospedeiro ou por tratamento. O ciclo reinicia-se quando uma outra fêmea flebotomínica efectua a sua refeição sanguínea no vertebrado infectado (CDC, 2011b).
Segundo Killick-Kendrick (1999) para que uma espécie flebotomínica possa ser incriminada como vectora é necessário que obedeça a cinco critérios:
1- A espécie tem de se alimentar no ser humano e no caso de uma zoonose tem
de se alimentar também no animal reservatório.
2- Tem de estar presente na mesma região geográfica onde ocorre a doença.
3- A fêmea tem de ser capaz de suportar o desenvolvimento do parasita após a refeição sanguínea digerida e excretada.
4- Os parasitas encontrados no flebótomo, na Natureza, têm de ser semelhantes aos isolados de pacientes.
5- A fêmea tem de ser capaz de transmitir o parasita por picada.
Introdução
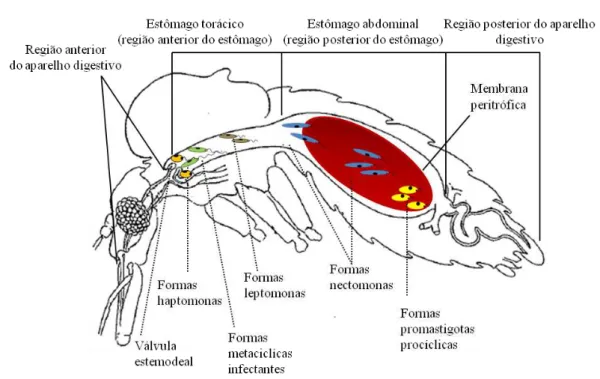
23 1.2.4.1 - Desenvolvimento intravectorial de Leishmania sp.
Figura 9 - Ilustração do aparelho digestivo de um flebótomo fêmea e desenvolvimento intravectorial de
Leishmania sp. (adaptado de Schlein, 1992 e de Afonso & Alves-Pires, 2008).
O ciclo intravectorial inicia-se quando uma fêmea flebotomínica efectua uma refeição sanguínea e ingere, por picada, as formas amastigotas do parasita, presentes no hospedeiro infectado (Fig. 9).
O sangue ingerido passa para a região abdominal do estômago onde rapidamente é rodeado pela membrana peritrófica (Sacks, 2001). Esta matriz quitinosa acelular é segregada pelo insecto e para além de facilitar a digestão, tem uma função protectora impedindo que o epitélio intestinal sofra danos mecânicos e químicos (resultantes da ingestão de sangue e processo digestivo) e actua como barreira a agentes infecciosos (Lehane, 1997).
Introdução
24
nectomonas, que migram após a ruptura da membrana peritrófica, e ligam-se pelos flagelos às microvilosidades da parede intestinal.
O local de fixação ao epitélio intestinal difere para os dois Subgéneros de Leishmania: nas espécies do Subgénero Leishmania o parasita liga-se ao nível do estômago (Suprapilária), enquanto para as espécies do Subgénero Viannia, apesar de alguns se ligarem a este nível, a maioria migra para a região peripilórica, onde se fixam (Peripilária) (Léger & Depaquit, 2001; Bates, 2007).
Após quatro a sete dias, com a maioria do sangue excretado (diurese), as nectomonas movem-se anteriormente para a válvula estemodeal onde se fixam à membrana quitinosa, através de hemidesmossomas produzidos na membrana do flagelo, e transformam-se em formas leptomonas, mais curtas, que retomam a multiplicação (segunda fase de multiplicação intravectorial).
A válvula tem como função impedir que o sangue ingerido retroceda no canal alimentar. A libertação de quitinases, por parte do parasita, vai danificá-la impedindo o
seu normal funcionamento (Volf et al., 2004) e a secreção de um gel dá origem a um
―rolhão‖que dificulta a passagem do sangue para o estômago (Rogers et al., 2002; Stierhof et al., 1999). Pensa-se que estas alterações favoreçam a transmissão de duas formas distintas: por um lado a válvula danificada permite a regurgitação de formas metacíclicas na pele do hospedeiro, de cada vez que a fêmea se tenta alimentar, considerando-se ser esta a forma mais usual de transmissão por picada (Killick-Kendrick, 2002); por outro, o flebótomo com a válvula danificada fica impossibilitado de se alimentar adequadamente, pelo que irá efectuar um maior número de picadas na tentativa de concretizar a refeição, e terá assim maior probabilidade de transmitir o parasita (Schlein et al., 1992).
A infecção da válvula estemodeal é por vezes acompanhada pela invasão da região anterior do tubo digestivo, incluindo faringe, cibário e probóscis, e em alguns casos observaram-se promastigotas metacíclicos nas glândulas salivares (Killick-Kendrick, 2002).
Introdução
25
imune do hospedeiro vertebrado. Nesta fase do ciclo, é também possível observar formas haptomonas ligadas à válvula estemodeal, cuja forma precursora é desconhecida (Ramalho-Ortigão et al., 2010).
Com a transformação em formas metaciclícas fica concluída a metaciclogénese (sete a nove dias). Os parasitas são inoculados num hospedeiro vertebrado quando a fêmea tenta realizar uma nova refeição sanguínea, mantendo-se, assim, o ciclo. A transmissão é cíclica evolutiva e multiplicativa.
Ao longo do desenvolvimento intravectorial, os parasitas são confrontados com diversas barreiras fisíco-químicas, das quais se destacam a acção das enzimas digestivas, a necessidade de escaparem da membrana peritrófica e de se ligarem ao epitélio intestinal para não serem excretados juntamente com os produtos da digestão do sangue. Pensa-se assim, que tenha ocorrido uma forte co-evolução vector/parasita suportada pelo facto de as espécies flebotomínicas vectoras apenas permitirem o desenvolvimento de uma (vector restrito), ou de um pequeno número de espécies de Leishmania (vector permissivo), e de que apesar da existência de um grande número de espécies de flebótomos apenas algumas são vectoras competentes do protozoário (Sacks & Kamhawi, 2001).
1.3 - Flebótomos em Portugal
O estudo dos flebótomos, em Portugal, teve início em 1912, ano em que o Doutor Carlos França, médico, parasitologista e bacteriologista português, e considerado o primeiro entomologista médico no país, assinalou pela primeira vez em Colares (Sintra) a presença de Phlebotomus (Phlebotomus) papatasi Scopoli, 1786 (França, 1913) na sequência de um surto de febre papatacci ocorrido no país. Em 1918, este Ilustre Cientista assinalou duas novas espécies também capturadas na mesma região, Phlebotomus (Larroussius) perniciosus Newstead, 1911 (a que chamou na altura P. lusitanicus), e Phlebotomus (Paraphlebotomus) sergenti Parrot, 1917 (França, 1918; Afonso et al., 2007).
Introdução
26
Lisboa (Azevedo, 1946) e onde foram assinaladas, pela primeira vez, a presença das
espécies Phlebotomus (Larroussius) ariasi Tonnoir, 1921 e Sergentomyia
(Sergentomyia) minuta (Rondani, 1843) (Meira & Ferreira, 1944). Os referidos autores estudaram alguns aspectos da distribuição (assinalaram a presença de flebótomos na Covilhã, Alcáçovas e Alcácer do Sal), da fenologia e da ecologia das espécies portuguesas. As preferências hemáticas, das fêmeas capturadas, foram analisadas pela técnica da reacção das precipitinas e morfologia dos glóbulos vermelhos, e a taxa de infecção, por Leishmania, por dissecção do aparelho digestivo (Ferreira & Ferreira, 1944; Ferreira, 1945; Azevedo & Teixeira, 1946). Apesar de terem sido detectadas formas metaciclícas no aparelho digestivo de fêmeas, a cultura dos parasitas não teve sucesso durante este período.
Em 1957, o Doutor Rés assinalou a presença de flebótomos na Bacia Hidrográfica do Douro e Guadiana (Rés, 1957).
A partir de 1979 (Pires, 1979), o conhecimento da distribuição e bioecologia das espécies, presentes no país, bem como a sua importância médica, sofreu um enorme impulso com os estudos realizados pelo Doutor Carlos Alves Pires, Investigador do IHMT, UNL. O referido Investigador, assinalou a presença de flebótomos num grande número de novas localidades e regiões, incluindo a Ilha da Madeira (Alves-Pires & Capela, 1996; Alves-Pires et al., 1997), e efectuou numerosos trabalhos particularmente no que se refere aos três principais focos de leishmanioseem Portugal: Trás-os-Montes e Alto Douro, Grande Lisboa / Arrábida e Sotavento Algarvio. Novos métodos de captura foram utilizados, como papéis impregnados com óleo de rícino e armadilhas luminosas do tipo CDC e Jersey. Até então, as capturas eram realizadas somente com tubos de vidro e aspiradores manuais, sendo necessário visualizar os insectos para directamente os capturar. Para análise das preferências hemáticas das fêmeas, utilizou, pela primeira vez no país, a técnica de ELISA (―Enzime-linked immunosorbent assay‖) (Alves-Pires et al., 1992; Pires, 2000).
Introdução
27
a partir de ambas as espécies, e o MON-24 foi isolado, pela primeira vez na Europa em flebótomos, a partir de fêmeas de P. ariasi capturadas no Alto Douro (Alves-Pires et al., 1991). Estes estudos foram efectuados com a colaboração dos Professores Doutores Pedro Abranches e Lenea Campino da Unidade de Leishmanioses do IHMT, UNL.
A partir dos anos 90, até á presente data, os estudos do Doutor Carlos Pires prosseguiram, em várias regiões, em colaboração com a Professora Doutora Maria Odete Afonso, UEI PM, UPMM, IHMT, UNL, Professora Doutora Lenea Campino e colaboradores, UEI PM, IHMT, UNL, Prof. Doutor Saúl Semião-Santos, Universidade de Évora, Professores Doutores Manuela Rodrigues e Luís Cardoso, UTAD (Alves-Pires et al., 2001; Afonso et al., 2005; Afonso et al., 2007, Alves-Pires et al., 2008).
Recentemente, as técnicas moleculares, como a reacção em cadeia da polimerase (―PCR‖), foram introduzidas no estudo da infecção flebotomínica por Leishmania (kDNA- PCR e ITS1-PCR) e na identificação das refeições sanguíneas (Cit b- PCR seguido de sequenciação) (Maia et al., 2009; Mendonça, 2011).
1.3.1 - Bioecologia das espécies flebotomínicas portuguesas
Até à presente data, dois Géneros e cinco espécies flebotomínicas foram assinaladas no país:
I- Género Phlebotomus Rondani & Berté, 1840
- Phlebotomus (Phlebotomus) papatasi (Scopoli, 1786)
- Phlebotomus (Larroussius) ariasi Tonnoir, 1921
- Phlebotomus (Larroussius) perniciosus Newstead, 1911
- Phlebotomus (Paraphlebotomus) sergenti Parrot, 1917 II- Género Sergentomyia França & Parrot, 1920
- Sergentomyia (Sergentomyia) minuta (Rondani, 1843)
Introdução
28 Figura 10 - Distribuição Europeia e Mediterrânica das várias espécies, do Género Phlebotomus,
assinaladas em Portugal: A - P. perniciousus, B - P. ariasi, C - P. sergenti e D - P. papatasi (adaptado de Depaquit et al., 1998a e de Depaquit et al., 2010).
As espécies apresentam marcada sazonalidade, verificando-se flebótomos adultos a partir de Abril/Maio até Outubro/Novembro (Alves-Pires & Ribeiro, 1991; Pires, 1985; Pires, 2000), cessando a sua actividade a temperaturas inferiores a 12ºC. Os ciclos variam de monofásicos a difásicos (um ou dois picos de eclosão dos imagos), consoante a espécie, região ou ano de estudo (Meira & Ferreira, 1944; Rés, 1957; Pires, 2000; Afonso et al., 2005).
Introdução
29 Quadro 4 - Abundância relativa das várias espécies flebotomínicas capturadas em Portugal.
Região Referências
Abundância relativa (%) Nº total
método de captura P.perni ciosus P. ariasi P. sergenti P.pap atasi S.
minuta flebótomos
Distrito Vila Real
Alto Douro Rés, 1957 53,6 46,2 1 macho 0 0,07 5717 aspirador manual
Alto Douro Alves-Pires & Ribeiro,
1991; Pires, 2000 31,8 62,3 0 0 5,9 5406 CDC/papéis adesivos
Alijó Afonso et al., 2007 19 73,1 0 0 7,9 4828 CDC
Distrito de Coimbra
Coimbra Pereira et al., 2009 69 23,4 0,3 0 7,3 992 CDC
Distrito Lisboa
Colares França, 1913 26,5 0 73,5 0 0 102
Colares Meira & Ferreira, 1944 75 12,5 12,5 0 0 8 tubo de ensaio
Lisboa Azevedo, 1946 89,4 1,1 1,7 0 7,8 3666 tubo de ensaio
Lisboa Ferreira & Ferreira, 1944 96,7 0,4 0,2 0 2,7 4070 tubo de ensaio
Lisboa Meira & Ferreira, 1944 89,1 0,4 4,9 0 5,6 1002 tubo de ensaio
Lisboa Rés, 1957 75 5,4 17,1 0 2,5 1282 aspirador manual
Lisboa Afonso et al., 2004 80,33 19,06 0,61 0 0 488 CDC
Distrito Setúbal
Arrábida Pires, 1985; Pires, 2000. 56 41,9 0 0 2,1 1662 Aspirador manual
Arrábida Afonso et al., 2005 58,65 13,83 0,45 0 27,07 665 CDC
Arrábida Amaro, 2010 94 2 4 0 0 4931 CDC
Alcácer do Sal Azevedo, 1946 95,2 0,7 0 0 0,7 148 tubo de ensaio
Distrito Évora
Évora Semião Santos et al.,
1995 36,5 9,4 42,1 0 12 159 CDC
Évora Alves-Pires et al., 2004 23,2 0 72,9 0 3,9 639 CDC
Mourão Rés, 1957 10 0 29,1 60,9 0 110 aspirador manual
Alcáçovas Azevedo, 1946 95,4 0 0 0 1 196 tubo de ensaio
Alqueva Maia et al., 2010b 86,73 4,59 4,59 1,53 2,56 196 CDC
Distrito Beja
Serpa e Moura Rés, 1957 97,74 0 1,13 1,13 0 177 aspirador manual
Distrito Faro
Algarve (Sotavento) Pires, 2000; Alves-Pireset al.
, 2001 51,5 0,8 8,7 0,03 39 3093
CDC/papel adesivo/aspirador
Algarve Schrey et al., 1989 79,5 0,1 1,5 0 18,9 1710 CDC/aspirador
Algarve Maia et al., 2009 90,51 0,84 2,11 0,21 6,33 474 CDC
Algarve Amaro, 2010 93 3 3 3 3 2647 CDC
Algarve Mendonça, 2011 86,3 2,5 0,7 0 10,5 1595 CDC
Algarve Maia et al., 2011 86,38 1,3 10,32 0,26 1,73 1153 CDC
Phlebotomus (Larroussius) perniciosus Newstead, 1911
Introdução
30
Em termos bioclimáticos, apresenta preferência por regiões sub-húmidas a semi-áridas, podendo, no entanto, tolerar outros tipos de clima (Rioux et al, 1984; Rioux, 2001).
Até à data, é a espécie mais abundante em Portugal (Quadro 4), sendo apenas suplantada por P. ariasi nas regiões de elevada humidade e temperaturas inferiores de Trás-os-Montes e Alto Douro, e por P. sergenti na região árida de Évora (Semião-Santos et al., 1995; Alves-Pires et al., 2004). No que diz respeito aos hospedeiros vertebrados preferenciais, já se detectaram fêmeas alimentadas em humanos, cães, gatos, aves, porcos, cavalos, roedores e bovinos (Ferreira & Ferreira, 1944; Ferreira, 1945; Azevedo & Teixeira, 1946; Alves-Pires et al., 1992; Mendonça, 2010).
Apresenta desenvolvimento larvar a uma temperatura óptima de 25ºC e a uma temperatura mínima de 0ºC. Em Portugal, encontra-se geralmente abaixo da cota dos 600 m (Afonso & Alves-Pires, 2008).
Phlebotomus (Larroussius) ariasi Tonnoir, 1921
Esta espécie é, juntamente com P. perniciousus, vectora de L. infantum em Portugal (Fig.11). Geralmente, é capturada em habitats peridomésticos rurais e em áreas silváticas podendo, mais raramente, surgir em habitações humanas ou próximo das mesmas (Pires, 1979 e 2000). É uma espécie com preferência por bioclimas húmidos e sub-húmidos (Rioux et al., 1984; Rioux, 2001), podendo tornar-se dominante, em relação a P. perniciosus, no primeiro, como se tem verificado na região de Trás-os-Montes e Alto Douro (Alves-Pires & Ribeiro, 1991; Afonso et al., 2007). É de realçar que, na região da Arrábida, os estudos anteriormente efectuados apontam para que seja predominantemente exofílica e associada ao ciclo silvático de transmissão de Leishmania, enquanto P. perniciosus (espécie endofílica nesta área) se encontra associada ao ciclo doméstico (Pires, 1988). Da análise das refeições sanguíneas realizadas no país, estima-se que P. ariasi se alimente em humanos, cães, aves e répteis, entre outros animais (Alves-Pires et al., 1992; Mendonça, 2010).
Introdução
31 Figura 11 - Pontos de amostragem para flebótomos em Portugal Continental e respectiva presença/ausência das espécies comprovadamente vectoras de L. infantum: A - P. perniciosus, B - P.
ariasi (adaptado de Afonso et al., 2006, Pires, 1979 e dos trabalhos citados no Quadro 4).
Phlebotomus (Paraphlebotomus) sergenti Parrot, 1917
É uma espécie vectora de L. tropica no Norte de África, Médio Oriente e subcontinente Indiano (Killick-Kendrick, 1990).
Geralmente, é capturada em biótopos onde se verifica a existência de seres humanos nomeadamente, em habitações humanas ou nas suas proximidades (Meira & Ferreira, 1944; Rés, 1957; Pires, 1979). Apesar de apresentar preferência por bioclimas semiáridos a áridos, pensa-se que possui alguma plasticidade climática (Rioux et al., 1984; Rioux, 2001).
Introdução
32
em Coimbra (Pereira et al., 2009 e 2010). Foi ainda assinalada, a sua presença, na Ilha da Madeira no Funchal (Alves-Pires & Capela, 1996).
Para o desenvolvimento larvar, esta espécie prefere temperaturas compreendidas entre os 31º-33ºC e os adultos preferem humidades relativas entre 0-45% (Singh, 1999). Tal como as espécies anteriormente referidas, em Portugal, encontra-se geralmente abaixo da cota dos 600 m.
Phlebotomus (Phlebotomus) papatasi (Scopoli, 1786)
Vector comprovado de L. major na Ásia Central e do Sul e no Norte de África, é considerada uma espécie rara em Portugal. Apesar de ter sido capturada em 1912 em Lisboa (França, 1913), desde essa data as capturas apenas tiveram sucesso no Sul do país (Algarve e Alentejo), apresentando baixas densidades e preferencialmente na proximidade de habitações humanas (Rés, 1957; Pires, 2000). Da análise das refeições sanguíneas, do pequeno número de fêmeas capturadas no país, verificou-se que a maioria se havia alimentado em humanos (Pires, 2000).
Apresenta preferência por bioclimas áridos e sobretudo hiper-áridos, sendo rara nos bioclimas húmido, sub-húmido e peri-árido (Rioux et al., 1984; Rioux, 2001).
O desenvolvimento larvar pode ocorrer entre os 4º-40ºC mas apresentando uma temperatura preferencial entre 28º-34ºC. Os adultos preferem humidades relativas entre os 36-45% e altitudes até aos 1000 m (Killick-Kendrick, 1999).
Sergentomyia (Sergentomyia) minuta (Rondani, 1843)
Apresenta grande plasticidade de habitats, sendo capturada em ambientes rurais e urbanos e tanto em meios domésticos e peridomésticos como silváticos. No Norte, onde não é muito frequente, e no Centro do país, aparenta ter preferência por casas de habitação, canis e pocilgas, e no Sul, por poços e capoeiras (Pires, 1979 e 2000).