1
Waldionê de Castro
MILTEFOSINA EXERCE SUA AÇÃO LEISHMANICIDA ATRAVÉS
DO RECEPTOR DE PAF
Ouro Preto
Universidade Federal de Ouro Preto Núcleo de Pesquisa em Ciências Biológicas
2
Waldionê de Castro
MILTEFOSINA EXERCE SUA AÇÃO LEISHMANICIDA ATRAVÉS
DO RECEPTOR DE PAF
Ouro Preto / 2011
Dissertação apresentada ao Núcleo de Pesquisa em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte das exigências para obtenção do grau de Mestre.
3 Catalogação: sisbin@sisbin.ufop.br
C355m Castro, Waldionê de.
Miltefosina exerce sua ação leishmanicida através do receptor de PAF [manuscrito] / Waldionê de Castro. – 2011.
65f.: il., color; graf., mapas.
Orientadora: Profa. Dra. Leda Quercia Vieira .
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências
Biológicas.
Área de concentração: Imunobiologia de protozoários.
1. Leishmaniose visceral - Teses. 2. Leishmania donovani - Teses. 3. Fator ativador de plaquetas - Teses. I. Universidade Federal de Ouro Preto. II. Título.
5 Esse trabalho foi desenvolvido no Laboratório de Gnotobiologia e Imunologia – ICB/UFMG e obteve auxílio dos seguintes órgãos financiadores:
7 AGRADECIMENTOS
Agradeço a minha orientadora, Professora Leda Q.Vieira, por me aceitar em seu laboratório, mesmo não tendo nenhuma experiência com pipetas, meios, células e tantas outras coisas importantes para realização deste trabalho. Obrigado por acreditar em mim, por apostar na minha capacidade, por me incentivar a estudar novamente. Sou muito grato por todos os conselhos e orientações e ainda mais por todo carinho comigo. Obrigado por me mostrar que existem pessoas reais e verdadeiras fazendo pesquisa.
Agradeço ao Professor Luis Carlos Crocco Afonso pelos conselhos, orientações e pelas discussões. Obrigado por abrir as portas de seu laboratório e me permitir conviver com todos do Lip.
Agradeço a Professora Maria Norma de Melo por me receber tão bem em seu laboratório e por sempre estar disposta a tirar minhas dúvidas com muita sabedoria e humildade. Também por ter sempre me salvado quando todas as culturas de Leishmania pareciam estar quase no fim.
Agradeço ao Professor Wagner Tafuri pela paciência, vontade de ajudar e pelos conselhos.
Agradeço ao Professor Ricardo Gonçalves pela disposição de ensinar e colaborar em meus experimentos.
Agradeço a Professora Maria de Fátima Martins Horta por compartilhar seus equipamentos.
Gostaria de agradecer a todos os professores das disciplinas que cursei no NUPEB pela vontade de ensinar e dividir conosco suas experiências.
Agradeço a todos os amigos que fiz em Ouro Preto, pela acolhida, pela colaboração e cumplicidade nestes dois anos..
Aos meus queridos amigos do LAGI, gostaria de agradecer a todos vocês por me receber tão bem, por me aceitar e me respeitar em todos os nossos dias de convivência. Mesmo naqueles dias em que tudo parece que vai desabar sobre nossas cabeças.
8
mostrou que na pesquisa nem tudo é transtorno obsessivo compulsivo e que repetição faz parte do protocolo.
Lili, Eric, Hassan, Juan, Magda, Paulinha, Caio, Leonardo, Everton, Clarinha e aos colegas da odonto obrigado a todos vocês por fazerem do laboratório um ambiente tão alegre, divertido, engraçado e leve. É bom saber que posso contar com vocês sempre que preciso.
Obrigado aos queridos Matheus e Louisa. Vocês são meu porto seguro no laboratório. Em todos os momentos vocês estiveram dispostos a me ajudar, aconselhar, explicar. Explicar outra vez e mais uma se necessário. E sempre foi! Sabe aquele ensinamento sobre determinada hora durante o experimento? Bem ainda estou tentando aprender a hora certa para fazer o certo.
Obrigado Yuri pelo seu esforço em manter sempre as coisas prontas e arrumadas, pela sua calma e disposição, além da parceria inestimável.
Aos meus amados e queridos pais, Waldir e Alva, por todo carinho e amor incondicionais. Vocês nunca mediram esforços para realizar vontades e desejos. Vocês sempre fizeram além das necessidades. Obrigado por tudo que me ensinaram através de seus exemplos e espero conseguir retribuir toda esta dedicação.
Ao meu irmão e toda a "tropinha de elite" pelas palavras de incentivo e por me dar tanta alegria e amor.
9 Resumo
A leishmaniose visceral, que pode ser causada pela Leishmania donovani, L. infantum e L. chagasi, é considerada pela Organização Mundial de Saúde (OMS) um dos seis principais problemas de saúde pública mundial, sendo fatal se não for tratada. A miltefosina (hexadecilfosfocolina), que primeiramente foi utilizada como tratamento em pacientes com câncer, vem sendo utilizada como uma droga oral efetiva na leishmaniose visceral. Existe uma semelhança estrutural entre a miltefosina e o fator de ativação de plaquetas (PAF). O PAF age ligando-se ao receptor de PAF (PAFR) presente nas células alvo. O mecanismo pelo qual a droga atua ainda não está bem estabelecido, nossa hipótese é que devido à semelhança estrutural entre PAF e a droga, a miltefosina utilize o receptor de PAF para se ligar à célula. Para testar esta hipótese utilizamos camundongos selvagens e deficientes no PAFR (PAFR-KO). Inicialmente verificamos que macrófagos de camundongos selvagens e de PAFR-KO apresentaram perfil de infecção semelhante quando infectados com L. donovani. Em seguida iniciamos os experimentos com infecções in vitro que revelaram que macrófagos de camundongos selvagens tratados com miltefosina eram mais eficientes no controle do crescimento dos parasitos que macrófagos de camundongos PAFR-KO. Entretanto, o tratamento com miltefosina não provocou a produção de quantidades significativas de óxido nítrico (NO), o que pode indicar um mecanismo citotóxico independente de NO. Ao avaliar a ação da droga sobre a atividade da enzima arginase percebemos que somente com a droga não há alteração da atividade da enzima, mas em associação com IFN-γ e LPS ocorre diminuição de sua atividade. Verificamos que a infecção in vivo com L. donovani não apresentou diferenças na suscetibilidade entre camundongos selvagens e KO. Em experimentos in vivo, tratamos camundongos selvagens e PAFR-KO oralmente a partir do 14º dia após a infecção com L. donovani, durante sete dias consecutivos, em doses de 10 e 20mg/kg/dia. Nossos dados mostram que o tratamento de camundongos selvagens levou a uma redução na carga parasitária no fígado e baço destes animais. Interessantemente, camundongos PAFR-KO apresentaram maior carga parasitária nestes órgãos. Nossos resultados indicam que parte da ação leishmanicida da miltefosina é mediada pelo PAFR.
10 Abstract
Visceral leishmaniasis,that can be caused by Leishmania donovani, L. infantum and L. chagasi, is considered by the World Health Organization (WHO) one of six major public health problems worldwide and is fatal if untreated. Miltefosine (hexadecylphosphocolina), which was first used as treatment in patients with cancer, has been used as an effective oral drug in visceral leishmaniasis. There is a structural similarity between miltefosine and platelet activating factor (PAF). PAF acts by binding to the PAF receptor (PAFR) present in target cells. The mechanism by which the drug works is not well established, our hypothesis is that due to structural similarities between PAF and the drug, miltefosine uses the PAF receptor to bind to the cell. To test this hypothesis, we used wild type mice and mice deficient in PAFR (PAFR-KO). Initially we found that macrophages from wild type mice and PAFR-KO showed a similar profile of infection when infected with L. donovani. The in vitro infection experiments revealed that macrophages from wild type mice treated with miltefosine were more effective in controlling the growth of the parasites than macrophages from PAFR-KO mice. However, treatment with miltefosine did not induce the production of significant amounts of nitric oxide (NO), which may indicate a cytotoxic mechanism independent of NO. When assessing the effect of miltefosine on the activity of the enzyme arginase, our data showed that the treatment with the drug only did not alter the enzyme activity, but in combination with IFN-γ and LPS was capable of downregulate its activity. We found that the in vivo infection with L. donovani showed no differences in susceptibility between wild-type mice and PAFR-KO. We treated wild type mice and PAFR-KO orally from day 14 after infection with L. donovani for seven consecutive days at doses of 10 and 20mg/kg/day. Our data revealed that treatment of wild type mice led to a reduction in parasite load in the liver and spleen of these animals. Interestingly, PAFR-KO mice showed a higher parasite load in these organs. Our results indicate that part of the antileishmanial activity of miltefosine is mediated by the PAFR.
11 LISTAS DE FIGURAS
Figura 1: Distribuição mundial da forma tegumentar de leishmaniose...16
Figura 2: Distribuição mundial da forma visceral de leishmaniose...16
Figura 3: Fórmula estrutural da miltefosina...22
Figura 4: Metabolismo da L-arginina...26
Figura 5: Miltefosina tem uma semelhança estrutural com o fator de ativação plaquetário (PAF) ...26
12 LISTA DE GRÁFICOS
4.1 – Macrófagos de camundongos BALB/c selvagens e PAFR-KO não apresentam diferenças na infecção por L. donovani. ...37
4.2 – A miltefosina apresentou menor efeito em macrófagos de camundongos PAFR-KO em relação a macrófagos de camundongos BALB/c selvagens infectados com L. donovani...39
4.3 – Verificação da atividade da arginase e produção de NO por macrófagos de camundongos BALB/c selvagens e PAFR-KO. ...45
4.4 – Curso de infecção com L. donovani em camundongos PAFR-KO e selvagens. ...48
13 LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
BSA: Soro albumina bovina
°C: Graus Celsius
CO2: Gás carbônico
g: Gravidade
g: Grama
H2SO4: Ácido sulfúrico
IFN: Interferon
Ig: Imunoglobulina
IL-#: Interleucina
iNOS: Óxido nítrico sintase indutível
L: Litro
LC: Leishmaniose cutânea
LDC: Leishmaniose cutânea difusa
LMC: Leishmaniose mucocutânea
LPS: Lipopolissacarídeo
LV: Leishmaniose visceral
m: Metro
µ: micro
M: Molar
RNAm: Ácido ribonucléico mensageiro
NaCl: Cloreto de sódio
NaHCO3: Bicarbonato de sódio
NO: Óxido nítrico
PAF: Fator de ativação plaquetário
PBS: Salinatamponada com fosfato 0,1 M, pH 7,3 (Phosphate Buffered Saline)
rpm: Rotações por minuto
SBF: Soro bovino fetal
STAT: Transdutores de sinal e ativadores de transcrição (Signal Transducers and Activators of the Transcription)
TNF: Fator de necrose tumoral
14 SUMÁRIO
Conteúdo
1 - INTRODUÇÃO...15
LEISHMANIOSES ...15
LEISHMANIOSE VISCERAL – MODELOS EXPERIMENTAIS ...19
TRATAMENTO DA LEISHMANIOSE VISCERAL HUMANA...20
MILTEFOSINA...22
O FATOR DE ATIVAÇÃO DE PLAQUETAS (PAF)...27
2 - OBJETIVOS...30
2.1 - OBJETIVO GERAL:...30
2.2 - OBJETIVOS ESPECÍFICOS: ...30
3 - MATERIAL E MÉTODOS...31
3.1 - ANIMAIS...31
3.2 – PARASITOS ...31
3.3 – INFECÇÃO DE CAMUNDONGOS POR LEISHMANIA...32
3.4 – QUANTIFICAÇÃO DE PARASITOS...33
3.5 – OBTENÇÃO E INFECÇÃO DE MACRÓFAGOS PERITONEAIS...33
3.6 – DOSAGEM DA ATIVIDADE DA ENZIMA ARGINASE...34
3.7 – DOSAGEM DE NITRITO ...35
3.8 - ANÁLISE ESTATÍSTICA ...36
4 – RESULTADOS...37
4.1 – Macrófagos de camundongos BALB/c selvagens e PAFR-KO não apresentam diferenças na infecção por L. donovani...37
4.2 – A miltefosina apresentou menor efeito em macrófagos de camundongos PAFR-KO em relação a macrófagos de camundongos BALB/c selvagens infectados com L. donovani...39
4.3 – Verificação da atividade da arginase e produção de NO por macrófagos de camundongos BALB/c selvagens e PAFR-KO. ...45
4.4 – Curso de infecção com L. donovani em camundongos PAFR-KO e selvagens. ...48
4.5 – Curso de infecção com L. donovani em camundongos PAFR-KO e selvagens tratados com miltefosina...50
5 - DISCUSSÃO...52
6 – CONCLUSÃO ...59
15
1 - INTRODUÇÃO
LEISHMANIOSES
As Leishmanioses, causadas por protozoários parasitos do gênero Leishmania (família Trypanosomatidae, ordem Kinetoplastida), são infecções encontradas em áreas tropicais e regiões subtropicais do mundo. Os parasitos são transmitidos por diferentes espécies de flebotomíneos (gêneros Phlebotomus e Lutzomyia), dependendo da localização no velho e no novo mundo.
Dois estágios distintos de desenvolvimento do parasito são reconhecidos. As formas promastigotas, extracelulares, são encontradas e se multiplicam no trato digestório da fêmea do flebotomíneo e tem uma forma alongada e flagelo longo. Promastigotas são as formas infectantes. Estas se diferenciam em amastigotas, forma intracelular de células do sistema fagocitário mononuclear do hospedeiro vertebrado (Olivier e cols., 2005; Olivier e cols., 2005).
Flebotomíneos fêmeas adquirem os parasitos quando se alimentam de sangue de hospedeiros mamíferos infectados. A queda de temperatura e aumento de pH levam à diferenciação da forma amastigota para a forma promastigota no trato digestivo do invertebrado. Assim, a infecção por Leishmania ocorre quando uma fêmea de flebotomíneo, ao realizar o repasto sanguíneo, inocula juntamente com sua saliva formas promastigotas metacíclicas de Leishmania sp (Bates, 2007).
16
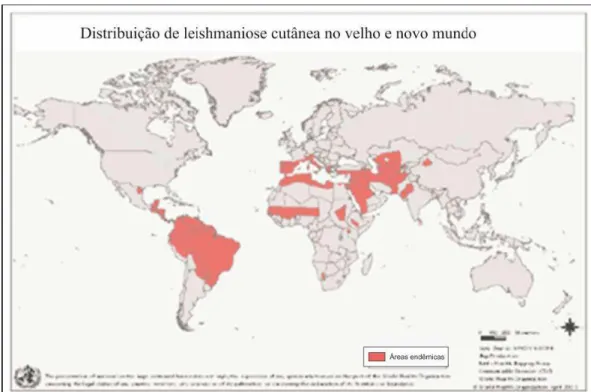
Figura 1: Distribuição mundial da forma tegumentar de leishmaniose. As áreas em vermelho
sinalizam zonas endêmicas. WHO/CSR/EDC-UNAIDS Mapa: “Public Health Mapping Group Communicable Diseases (CDS) World Health Organization, October 2003.”
Figura 2: Distribuição mundial da forma visceral de leishmaniose. As áreas em vermelho
sinalizam zonas endêmicas. WHO/CSR/EDC-UNAIDS Mapa: “Public Health Mapping Group Communicable Diseases (CDS) World Health Organization, October 2003.”
17
A forma cutânea da doença causa ulcerações na pele no local da picada do flebotomíneo, usualmente em partes expostas do corpo como a face, pescoço, braços e pernas. A forma cutânea é causada por diversas espécies de Leishmania: L. Brazilienses, L. guyanensis, L. major, L. tropica, L. aethiopica, L. mexicana, L. panamensis, L. peruviana e L. amazonensis. Os indivíduos doentes geralmente curam-se clinicamente, mas o tempo de cura varia entre as espécies infectantes e indivíduos. A doença pode se difundir pela pele do hospedeiro, sendo então conhecida como leishmaniose cutânea difusa. Essa doença pode ser causada pelas espécies L. aethiopica, L. mexicana e L. amazonensis, porém só ocorre quando os hospedeiros têm baixa imunidade (Silveirae cols., 2004; Kedzierskie cols., 2006).
Na leishmaniose mucocutânea, usualmente causada por L. brazilienses, a lesão inicial na pele pode se curar espontaneamente ou mais tarde podem desenvolver lesões com destruição parcial ou total de membranas mucosas. Indivíduos infectados e que apresentam desenvolvimento falho na resposta imunológica podem ter graves deformidades ou até mesmo morrer.
18
A LVH é uma doença sistêmica que pode ser fatal se não tratada, sendo a Leishmania donovani e Leishmania infantum as duas espécies mais frequentemente associadas à esta forma clínica. Leishmania chagasi é geralmente citada como sinônimo de L. infantum, sendo essas duas espécies praticamente indistinguíveis, mas o nome L. chagasi é frequentemente usado na literatura da América Latina (Maurício & Stothard, 2000)
As manifestações clínicas da LVH no Brasil são variadas sendo assim caracterizadas: (1) forma assintomática com cura espontânea e teste intradérmicos positivos para Leishmania sp; (2) forma subclínica ou oligossintomática, associada a manifestações inespecíficas (febrícula, tosse seca, adinamia, sudorese e hepatesplenomegalia discreta), mas sem desenvolvimento ou progressão da doença; (3) forma subclínica ou oligossintomática com evolução para a forma clássica ou manifesta; (4) forma aguda com duração inferior a dois meses, com febre alta, tosse, diarréia, hepatesplenomegalia e com elevação das globulinas do plasma IgM e IgG forma clássica (5) forma clássica ou manifesta da doença, sendo que o paciente apresenta febre diária, anorexia, emagrecimento, adinamia, sinais de desnutrição (pele seca, cabelos quebradiços, cílios longos), hepatesplenomegalia acentuada, distúrbios gastrintestinais (diarréia) e fenômenos hemorrágicos (epistaxe e gengivorragia).
Desta forma pode-se notar a importância sócio-econômica da doença considerando-se a perda da força de trabalho dos pacientes adultos (casos aumentando com a urbanização) adicionados os gastos governamentais com a profilaxia e tratamento dos doentes (Gama e cols., 2004; Badaro e cols., 1986).
19
mudanças no cabelo podem ocorrer. Tosse e hemoptise podem ser devidas à co-infecção com o bacilo da tuberculose pulmonar. Infecções bacterianas (pneumonia, septicemia, otite, infecções do trato urinário e da pele) também são complicações comuns (Bhattacharya e cols., 2006; Bhattacharya e cols., 2006).
LEISHMANIOSE VISCERAL – MODELOS EXPERIMENTAIS
Para estudos das leishmanioses a escolha do modelo animal deve ter como pré-requisito a correspondência deste modelo com a fisiologia humana, preocupar-se com a disponibilidade, manutenção e manuseio dos animais. (Awasthi e cols., 2004).
A espécie Mesocricetus auratus, hamster sírio, pode ser um modelo adequado para a caracterização da doença, uma vez que a infecção de hamsters com L. donovani reproduz as características clínicas e patológicas da LV humana, causando até a morte do animal. Porém, não há grande disponibilidade de reagentes para as análises imunológicas o que não torna estes animais bons como modelos de desenvolvimentos de vacinas (Carrion e cols., 2006).
O modelo murino de infecção por L. major definiu o paradigma Th1/Th2 de resistência/suscetibilidade à infecção por LC (Alexander & Bryson, 2005). Entretanto, os modelos de animais experimentais para estudo da LV utilizados não reproduzem com fidelidade as características observadas em seres humanos.
As espécies causadoras da LV (L. donovani e L. infantum/L. chagasi) têm a capacidade de infectar camundongos e podem reproduzir a doença humana, tornando-se mais fácil a utilização desses animais como modelos de estudo da genética do hospedeiro vertebrado, do controle da infecção, além de auxiliar na determinação do desenvolvimento e regulação de suas respostas imunes (Alexander & Bryson, 2005).
20
manuseio, além da suscetibilidade à LV os camundongos são os animais mais utilizados como modelos experimentais (Carrion e cols., 2006).
Apesar disso, a LV murina causada por L. donovani não reproduz as características da LVH. Em camundongos ocorre o aumento da carga parasitária no início da infecção e depois de quatro a oito semanas eles são capazes de desenvolver uma resposta imune celular anti-leishmania eficaz e controlam a infecção.
O controle é mediado pelo IFN-γ produzido por células T esplênicas e por um padrão característico de resposta Th1, com a participação da citocina IL-12. A ação do IFN-γ medeia o aumento da regulação da óxido nítrico sintase indutível (iNOS), levando à produção do NO. Este é um mecanismo crítico no controle da infecção, no qual macrófagos estão envolvidos no controle da replicação de parasitos em camundongos. Desse modo, o modelo murino de infecção por L. donovani é um bom modelo de replicação precoce de parasitos seguido do controle imunológico da infecção subclínica, mas não há modelo murino para a progressão da doença observada na LV humana (Melby e cols., 2001).
TRATAMENTO DA LEISHMANIOSE VISCERAL HUMANA
Em 1912, no Brasil, Gaspar de Oliveira Vianna observou que o tártaro emético (Sb (III)) era eficaz na terapêutica da LTA, porém devido aos seus efeitos tóxicos e graves efeitos colaterais, estes antimoniais trivalentes foram substituídos por compostos estibiados pentavalentes (Rath e cols., 2003). Até hoje o antimonial é usado, principalmente na sua forma pentavalente, a N-metil glucamina (Glucantime). No Brasil, é a droga de primeira escolha para o tratamento dessa doença e foi padronizada pela OMS na dose de 10 a 20 mg Sb(V)/kg/dia, onde SB(V) significa antimônio pentavalente (Anonymous2007; LIMA, 2007).
21
distúrbios gastrointestinais, alterações eletrocardiográficas, renais, hepáticas, pancreáticas, erupção cutânea, herpes-zóster e outros. Por isso, muitas vezes, esta droga é contra-indicada para cardiopatas, nefropatas, pessoas idosas e grávidas (Mayrink e cols., 2006)
O mecanismo de ação dos antimoniais baseia-se na interferência no metabolismo bioenergético das formas amastigotas de Leishmania, onde ocorre bloqueio e inibição seletiva de diferentes proteínas do parasito, principalmente enzimas envolvidas na glicólise e na oxidação de ácidos graxos, resultando numa diminuição da produção de ATP e GTP (Chan-Bacab & Pena-Rodriguez, 2001).
As drogas de segunda escolha para o tratamento da LVH são a anfotericina B e a pentamidina. Elas são utilizadas principalmente quando não ocorre resposta satisfatória com o uso do antimonial pentavalente.
Em infecções causadas por fungos, o mecanismo de ação da anfotericina B está relacionado com a sua ligação aos esteróides da membrana fúngica. Como a membrana da Leishmania apresenta ergosterol, esta droga reduz a permeabilidade celular do parasito, ocorrendo perda de cátions, principalmente K+, levando à morte da célula (Ordonez-Gutierrez e cols., 2007).
Existem vários relatos que usam alternativas quimioterápicas, por exemplo, as anfotericinas B associadas a moléculas de colesterol ou associadas a lipossomas capazes de alcançarem os órgãos infectados com grande eficácia.
A pentamidina interfere com o transporte de aminoácidos, compete com poliaminas pelos ácidos nucléicos e pode também preferencialmente ligar-se ao DNA do cinetoplasto (PAULA & SAMPAIO, 2003).
22
MILTEFOSINA
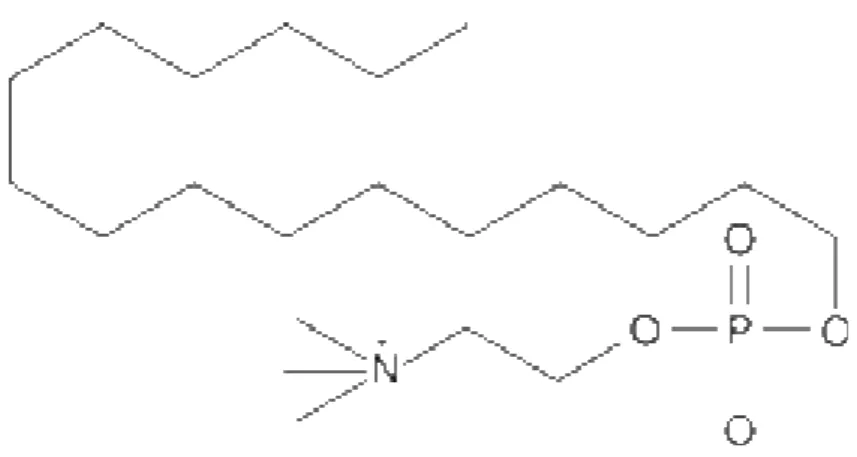
A miltefosina (1-0-hexadecilfosfocolina) (HPC) surgiu como nova promessa de tratamento da leishmaniose visceral humana, dada à ineficácia crescente dos tratamentos convencionais. Essa droga é uma alquilfosfocolina que foi originalmente desenvolvida para o tratamento de metástase cutânea em carcinomas mamários (Hilgard e cols., 1993) (Verma & Dey, 2004).
Figura 3: Fórmula estrutural da miltefosina
(Fonte:http://www.caymanchem.com/app/template/Product.vm/catalog/63280/a/z)
Posteriormente foi testada, com sucesso, no tratamento da LVH através de uma iniciativa da OMS reunindo um laboratório farmacêutico alemão e o Ministério da Saúde da Índia. Em estudo de fase III com adultos, realizado na Índia, a miltefosina, ministrada por via oral, curou 282 de 291 pacientes adultos (Sundar e cols., 2002). Subsequentemente, um estudo envolvendo crianças mostrou 94% de eficácia (Bhattacharya e cols., 2004). Efeitos colaterais foram observados em 3% dos pacientes incluindo distúrbios gastrintestinais e aumentos significativos dos níveis sorológicos de aminotransferase e creatinina. É interessante notar que este é um tratamento por via oral, que evita as injeções e grande parte dos efeitos colaterais do tratamento convencional.
23
assim como o metabolismo de fosfolipídios e a transdução do sinal proliferativo. Também induz morte celular por apoptose (More e cols., 2003) (Prasad e cols., 2004).
Em formas promastigotas de Leishmania (Leishmania) donovani a miltefosina foi capaz de induzir o processo de morte celular por apoptose atuando no citoplasma, núcleo e membrana das células, promovendo seu encolhimento, fragmentação do ácido desoxi-ribonucléico (DNA) e exposição da fosfatidilserina (Paris e cols., 2004).
Ainda, pode induzir a morte das formas amastigotas de L. donovani a partir de seu efeito imune-modulador sobre macrófagos e linfócitos T. São observadas ações como co-estimulação de eventos relacionados à liberação de citocinas, incluindo expressão de RNAm de interferon (IFN-γ) e fator estimulador de colônia granulócito-macrófago (GM-CSF); secreção de IFN-γ e fator de necrose tumoral α (TNF-α); expressão de receptores de citocinas na superfície de células e moléculas classe II do complexo principal de histocompatibilidade e induzindo ou incrementando a explosão respiratória e a liberação de óxido nítrico por macrófagos (Sundar e cols., 1998; Jha e cols., 1999; Murray & Delph-Etienne, 2000).
Na tentativa de se determinar a eficácia e o mecanismo de ação da miltefosina, vários experimentos foram realizados. Croft et al (1987) foram os primeiros pesquisadores a relatar a ação leishmanicida das alquilfosfocolinas e derivados. Neste trabalho, os pesquisadores testaram a ação da miltefosina contra formas amastigotas de L. donovani em camundongos BALB/c. Posteriormente, Kuhlencord et al (1992) demonstraram ótima ação da droga em camundongos BALB/c infectados com L. donovani e Leishmania (Leishmania) infantum tratados por via oral e os resultados obtidos através de quantificação de parasitos em macrófagos e em órgãos (fígado, baço e medula óssea), após quatro semanas de tratamento, foram superiores aos do antimonial.
24
semana após a infecção. Em doses menores da droga ocorreu uma inibição do crescimento dos parasitos de uma maneira dose dependente sem diferenças entre camundongos scid e BALB/c. Estes experimentos sugerem um efeito da miltefosina independente da imunidade adquirida, uma vez que camundongos scid são deficientes em células T e B.
Yardley et al pesquisaram a ação da miltefosina em macrófagos infectados com formas amastigotas de diferentes espécies de Leishmania causadoras da leishmaniose visceral (L. donovani) e leishmaniose cutânea (Leishmania (Viannia) braziliensis, Leishmania (Viannia) guyanensis, Leishmania (Leishmania) mexicana e Leishmania (Viannia) lainsoni). Foi observada uma grande variação nas concentrações de miltefosina necessárias para matar 50 % das formas amastigotas dessas diferentes espécies. As espécies de maior sensibilidade à ação da droga foram L. donovani e L. lainsoni. Isso demonstra uma notável diferença na sensibilidade in vitro das espécies de Leishmania à miltefosina (Yardley e cols., 2005).
A eficácia clínica da miltefosina para Leishmaniose cutânea do novo mundo foi investigada em estudos conduzidos na América Central e América do sul. A taxa de cura variou de uma espécie para outra, com a L. panamensis apresentando taxa de cura de 82%, L. mexicana apresentando 60 % e a L. braziliensis comtaxa de cura de 33 %. Soto et al relataram taxa de cura de 88% dos pacientes na Bolívia infectados por L. braziliensis. Estes dados mostram que a taxa de cura a Leishmaniose cutânea após tratamento com miltefosina varia entre as espécies de Leishmania e também dentro da mesma espécie proveniente de áreas endêmicas diferentes (Soto e cols., 2008; Soto e cols., 2004).
25
eficaz e seguro do que o padrão Sb (V) para o tratamento da LC (Machado e cols., 2010).
A eliminação da miltefosina é muito lenta, sendo ainda detectável no plasma humano de pacientes com Leishmaniose cutânea em amostras colhidas de cinco a seis meses após o final do tratamento e sua presença em concentrações sub-terapêuticas no sangue depois do tratamento podem aumentar sua eficácia, porém contribuem para seleção de parasitos resistentes (Dorlo e cols., 2008).
Apesar de sua eficácia comprovada por diferentes estudos, o mecanismo de ação da droga ainda não está totalmente esclarecido. Há relatos de que a miltefosina necessita de IFN-γ para sua ação leishmanicida. Esta ação foi significativamente comprometida em macrófagos de camundongos deficientes na produção de IFN-γ. A miltefosina mostrou-se capaz de restaurar a resposta de macrófagos ao IFN-γ por aumentar a expressão dos receptores de IFN-γ na superfície celular e de promover a fosforilação de STAT-1 e reduzir a ativação de SHP-1. Além disso, a droga induziu a fosforilação da quinase p38MAP necessária para a indução da proteína óxido nítrico sintase indutível (iNOS). Assim a miltefosina aumentou a expressão de iNOS e a produção de NO (Wadhone e cols., 2009).
26 L- Arginina
ARGINASE I
L- Ornitina
IL-4
URÉIA
Poliaminas
INOS
NO L- Citrulina
TNF-α
IFN-γ
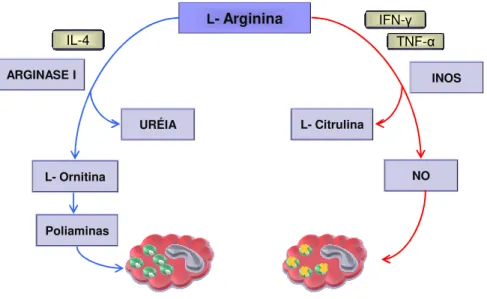
Figura 4: Metabolismo da L-arginina.
É interessante notar a semelhança estrutural entre a miltefosina e o fator de ativação de plaquetas (PAF, 1-O-alquil-2-acetil-sn-glicero-3-fosfocolina) (figura 4).
A. Estrutura da Miltefosina
B. Estrutura do PAF
Figura 5: Miltefosina [A] tem uma semelhança estrutural com o fator de ativação plaquetário
(PAF) [B], ambos tendo uma fosfocolina e uma cadeia hexadecil.
27
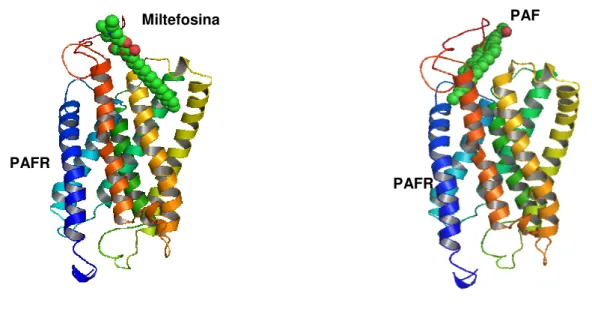
de 16 carbonos. No caso do PAF, trata-se do glicerol ligado a um grupo acetato e a uma cadeia alifática poli-carbonada, por uma ligação éter. Esta semelhança torna atraente a hipótese de que a miltefosina poderia ligar-se ao receptor de PAF. Realmente, já foram feitas modelagens demonstrando esta possível ligação (figura 5).
Figura 6: Modelagem de demonstração da ligação da miltefosina (esquerda) e PAF (direita) ao receptor de PAF.
Devido à semelhança estrutural entre a miltefosina e o PAF a hipótese deste trabalho é que a droga use o receptor de PAF (PAFR) para sua ação leishmanicida.
O FATOR DE ATIVAÇÃO DE PLAQUETAS (PAF)
O PAF é uma molécula pró-inflamatória que medeia anafilaxia, choque endotóxico e trombose Este mediador é produzido por várias células, incluindo-se os neutrófilos, eosinófilos, linfócitos, monócitos, macrófagos, células endoteliais e queratinócitos. O PAF age ligando-se ao receptor de PAF (PAFR) presente nas células alvo (Ishii & Shimizu, 2000).
O receptor de PAF (PAFR) apresenta uma típica estrutura de receptor acoplado à proteína G com sete cadeias α-hélice transmembranares. PAFR é expresso tanto na membrana celular quanto na nuclear e pode ativar várias vis de sinalização intracelular (Honda e cols., 1991; Nakamura e cols., 1991; Ishii e cols., 1996) (Marrache e cols., 2002).
Miltefosina
PAFR
PAF
28
No camundongo, o gene para o receptor de PAF está localizado do cromossoma quatro, e é expresso em vários tecidos como o cérebro, pulmão, fígado, baço, rim, músculo esquelético, intestino delgado, macrófagos e leucócitos (Ishii & Shimizu, 2000).
Recentemente, vários estudos foram feitos investigando o papel do PAF em modelos de infecção. Em um trabalho usando antígeno de Mycoplasma arthritidis a adição de PAF a culturas de células estimuladas com este antígeno ou células naïve não afetou a produção de NO. Entretanto estas células produziram TNF-α (Shio e cols., 2004). O PAF mostrou-se uma molécula chave envolvida na ativação inicial do NF-κB, que promove a resistência órgão-específicaà Candida albicans, pela indução de TNF-α (Choi e cols., 2001).
Em infecção pulmonária com Klebsiella pneumoniae camundongos deficientes para o receptor de PAF foram mais suscetíveis devido à relevância deste receptor em mediar a fagocitose desta bactéria (Soares et al., 2002).
Na infecção por Trypanossoma cruzi o PAF medeia a resistência favorecendo a fagocitose e produção de óxido nítrico (Aliberti e cols., 1999; Talvani e cols., 2003).
29
camundongos PAFR-KO, e a expressão de arginase maior. Assim, o PAFR seria importante na resistência parcial encontrada em camundongos C57BL/6 infectados com L. amazonensis, por um mecanismo que torna o macrófago menos apto a matar o parasito (Santiago e cols., 2006a).
A LVH é um grande problema de saúde pública mundial e estudos sobre novas drogas para o tratamento desta infecção são necessários. O Brasil e a Índia respondem por grande parte dos casos de leishmaniose do planeta. Ambos os países utilizam a miltefosina como um substituto de drogas antimoniais, devido à toxicidade destas e ao aparecimento de resistência ao tratamento. Estes países vêm buscando desenvolver pesquisas para melhor entender os mecanismos de ação da miltefosina. O grupo do professor Baskar Saha, do National Center for Cell Science, em Poona na Índia, tem vasta experiência no estudo de leishmaniose visceral e também desenvolve pesquisas com a miltefosina. Nossos grupos de pesquisa começaram uma colaboração a partir da sugestão do grupo indiano de que o mecanismo de ação da miltefosina poderia ser via receptor de PAF. Devido à sua semelhança estrutural com o fator de ativação plaquetário a droga pode utilizar o receptor deste fator para sua ação na eliminação das formas amastigotas de L. donovani. Os estudos propostos neste projeto são inéditos, onde o papel do PAF ou de seu receptor na infecção por L.
30
2 - OBJETIVOS
2.1 - OBJETIVO GERAL:
Verificar e avaliar se a atividade leishmanicida da hexadecilfosfocolina, ou miltefosina, é mediada pelo receptor de fator de ativação plaquetário (PAF).
2.2 - OBJETIVOS ESPECÍFICOS:
• Determinar o perfil de infecção com L. donovani in vitro de macrófagos de camundongos BALB/c selvagens e PAFR-KO.
• Comparar a função anti-leishmania da miltefosina em macrófagos de camundongos BALB/c selvagens e deficientes no receptor de PAF.
• Determinar atividade de arginase e a produção de NO em macrófagos de camundongos BALB/c selvagens e PAFR-KO.
• Determinar o curso de infecção com L. donovani em camundongos BALB/c selvagens e PAFR-KO, determinando a carga parasitária no fígado, baço e medula óssea.
31
3 - MATERIAL E MÉTODOS
3.1 - ANIMAIS
Camundongos BALB/c fêmeas foram fornecidos pelo Biotério Central da Universidade Federal de Minas Gerais (CEBIO/UFMG, Belo Horizonte,MG, Brasil) e mantidos no biotério experimental do Laboratório de Gnotobiologia e Imunologia da Universidade Federal de Minas Gerais. Camundongos BALB/c knockout para o gene do receptor de PAF foram gentilmente cedidos pelo Prof. Dr. Mauro Martins Teixeira (Departamento de Bioquímica e Imunologia, ICB, UFMG). As colônias de criação dos mesmos foram mantidas em microisoladores dotados de filtro EPA e sob ventilação forçada, no biotério de criação do Laboratório de Gnotobiologia e Imunologia, UFMG.
Os animais experimentais foram mantidos com barreiras ambientais sob condições de temperatura e fotoperíodo controladas, e foram oferecidas ração convencional para camundongos (Labina, Purina, Paulínea, SP, Brasil) e água filtrada ad libitum. Foram utilizados de cinco camundongos por grupo, com seis a dez semanas de idade ao início de cada experimento.
Todos os procedimentos realizados com os camundongos estão em acordo com os protocolos éticos. Este projeto foi submetido para avaliação e aprovado pelo Comitê de Ética em Experimentação Animal (CETEA/UFMG), sob o protocolo 150/09.
3.2 – PARASITOS
32
Technologies). As culturas foram mantidas em estufa BOD a 25°C, e repicadas a cada três dias, até no máximo 10 repiques. Após a décima passagem, os parasitos foram novamente isolados de baços e fígados de camundongos BALB/c, previamente infectados.
Para o isolamento de parasitos para cultura os animais foram sacrificados e seus órgãos macerados em salina tamponada com fosfato 10mM em pH 7,3 (PBS), este conteúdo foi centrifugado a 50 x g a 4º C por 4 minutos. O sobrenadante foi recolhido em outro tubo e nova centrifugação feita (2.000 x g a 4º C por 15 minutos). Após a segunda centrifugação o sobrenadante foi descartado e o pellet foi suspendido em 200µL de meio Grace completo (suplementado com 20% de soro fetal bovino inativado (SFB), 2 mM de L -glutamina, 100 U de penicilina por mL e 100 µg de estreptomicina por mL) e transferido para o primeiro poço de uma placa de 96 poços (TPP, Trasadingen, Schaffhausen, Suíça). Posteriormente, foram transferidos 50µL do conteúdo do primeiro poço para o segundo poço e deste para o terceiro, e assim sucessivamente. A placa foi, então, selada e mantida em estufa BOD a 25°C. Após sete dias, formas promastigotas de Leishmania foram recuperadas da placa e mantidas em garrafas de cultura de 25 cm3 (TPP).
3.3 – INFECÇÃO DE CAMUNDONGOS POR LEISHMANIA
33
3.4 – QUANTIFICAÇÃO DE PARASITOS
A quantificação de parasitos foi realizada pela técnica de diluição limitante, em que diluições sucessivas foram feitas a partir dos homogenatos dos baços, fígados e medulas ósseas dos camundongos experimentais infectados. Primeiramente os órgãos, inteiros, foram macerados em um homogeneizador de tecidos estéril. O homogenato foi centrifugado a 50 x g por 4 minutos e o sobrenadante foi transferido para outro tubo. Esse sobrenadante foi centrifugado a 2000 x g por 15 minutos. O sedimento foi suspenso em 400 L de meio Grace completo. Em uma placa estéril de poliestireno com 96 poços e fundo chato (TPP), foram colocados 150 µL/poço de meio de Grace completo, exceto na primeira coluna de poços, onde foi colocada 200 µL da suspensão do órgão macerado. Em seguida, foram feitas diluições sucessivas 1:4, tomando-se o cuidado de trocar o conjunto de ponteiras da pipeta multicanal a cada diluição para evitar o arraste de parasitos e um conseqüente resultado falso-positivo. As placas foram mantidas a 25°C em estufa BOD e a leit ura dos resultados foi feita de 10 dias após o início da cultura.
3.5 – OBTENÇÃO E INFECÇÃO DE MACRÓFAGOS PERITONEAIS
34
estimulados com IFN-γ e LPS. O tratamento com a droga foi feito em três diferentes doses (0,2 µM, 0,8 µM e 3,2 µM) e seu efeito foi avaliado em diferentes tempos de cultura (4 horas, 24 horas, 48 horas e 72 horas). Os parasitos foram contados sob microscópio ótico após coloração com Panótico rápido (Panótico Rápido (Laborclin,Pinhais, Paraná, Brasil)). O número de macrófagos infectados e o número médio de parasitos por macrófago foi determinado em 300 células. Os resultados foram expressos como índice de infecção, que é a porcentagem de macrófagos infectados multiplicada pelo número médio de amastigotas por macrófago.
3.6 – DOSAGEM DA ATIVIDADE DA ENZIMA ARGINASE
35
Spectrophotometer System, modelo SPECTRAmax 340, Molecular Devices, Sunnyvale, California). O resultado foi expresso como unidade de atividade de arginase por pata. Cada unidade é definida como a quantidade de enzima que catalisa a formação de 1 mol uréia/minuto.
3.7 – DOSAGEM DE NITRITO
A quantidade de óxido nítrico produzida em culturas de macrófagos foi estimada a partir da dosagem de nitrito nos de sobrenadantes de culturas de macrófagos infectados ou não com L. donovani, tratados ou não com miltefosina, in vitro pelo método de Griess (Green e cols., 1982). Para as dosagens em sobrenadante, as amostras foram colocadas em uma placa de 96 poços (TPP), 50 µL de amostra/poço. O padrão de nitrito de sódio (250 mM) foi adicionado em duplicata e diluído 1:2 nos poços posteriores em meio RPMI. O branco consiste apenas de RPMI completo. Logo após adicionaram-se 100 µL de solução de Griess sobre as amostras, o padrão e o branco. A placa foi mantida no escuro por 10 minutos e a densidade ótica foi determinada por leitura em espectofotômero (Microplate Spectrophotometer System, modelo SPECTRAmax 340, Molecular Devices, Sunnyvale, California).
3.8 – MILTEFOSINA
36
acordo com a média da massa corporal dos animais, dissovelndo-se o pó em PBS 1x estéril e mantidas refrigeradas a 4ºC.
3.9 - ANÁLISE ESTATÍSTICA
37
4 – RESULTADOS
4.1 – Macrófagos de camundongos BALB/c selvagens e PAFR-KO não apresentam diferenças na infecção por L. donovani.
38
A
B
Gráficos 1: macrófagos peritoneais inflamatórios de camundongos BALB/c selvagens (BALB/c) ou
PAFR-KO foram cultivados em uma concentração de 5 x 106/mL, as células não aderentes foram lavados com PBS e os macrófagos aderidos foram infectados com L. donovani em uma relação de dez parasitos por macrófago. Os parasitos não fagocitados foram lavados com PBS. Após 4, 24, 48 e 72 horas de infecção a porcentagem de macrófagos infectados [A] e o número de amastigotas por macrófago infectado [B] foram determinados. A análise estatística foi feita por análise de variância (ANOVA two-way) e seguidos de teste de Tukey. * indica P<0,05. Os resultados são representativos de três experimentos desenvolvidos independentemente.
4h 24h 48h 72h
0 50 100 150 BALB/c PAFR-KO % d e M ac ró fa g o s in fe ct ad o s
4h 24h 48h 72h
0 2 4 6
8
*
*
*
39
4.2 – A miltefosina apresentou menor efeito em macrófagos de camundongos PAFR-KO em relação a macrófagos de camundongos BALB/c selvagens infectados com L. donovani.
Para verificar o efeito da miltefosina sobre macrófagos infectados realizamos experimentos in vitro. Nestes experimentos infectamos macrófagos de camundongos BALB/c e PAFR-KO na proporção de 10 formas promastigotas de L. donovani para cada macrófago e determinamos a porcentagem de macrófagos que apresentavam parasitos em seu interior e o número de parasitos por macrófago após tratamento in vitro com miltefosina (Gráficos 2 e 3). Como controle positivo de ativação de macrófagos utilizou-se IFN-γ e LPS. O estímulo com IFN-γ e LPS provocou a diminuição na porcentagem de macrófagos infectados (Gráficos 2, p<0,05) e do número de parasitas por macrófago (Gráficos 3, p<0,05).
No gráfico 2A notamos que o tratamento com a miltefosina reduziu a porcentagem de macrófagos infectados de camundongos BALB/c selvagens em relação aos macrófagos controle quatro horas após a infecção e tratamento com 3,2 M. Em 24, 48 e 72 horas de infecção este efeito foi aumentado, deixando clara a diminuição da porcentagem de macrófagos infectados após o tratamento e ao longo do tempo. Como pode ser visto nos gráficos 2, o efeito da miltefosina sobre macrófagos de camundongos PAFR-KO foi menor que em camundongos selvagens. Assim, em 4 horas de tratamento com a miltefosina não vimos qualquer diminuição da porcentagem de macrófagos infectados (gráfico 2A), e com 24 horas só encontramos uma diminuição na porcentagem de macrófagos infectados nas maiores doses utilizada (0,8 e 3,2 M) (Gráficos 2B). Nos tempos subseqüentes encontramos um maior efeito da miltefosina (Gráficos 2C e 2D).
40
41 A
4h
Controle IFN + 0,2 µµµµM 0,8µµµµM 3,2mM 0 50 100 150 BALB/c PAFR-KO
*
*
*
LPS HPC # % d e M ac ró fa g o s in fe ct ad o s B24h
42 C
Controle IFN + 0,2 µµµµM 0,8µµµµM 3,2mM
0 50 100 150 BALB/c PAFR-KO
*
*
LPS HPC # # # #48h
% d e M ac ró fa g o s in fe ct ad o s DControle IFN + 0,2 µµµµM 0,8µµµµM 3,2mM
0 20 40 60 80 100 * * * LPS HPC 72h # # # # % d e M ac ró fa g o s in fe ct ad o s
Gráficos 2: macrófagos peritoneais inflamatórios de camundongos selvagens ou PAFR-KO foram
cultivados em uma concentração de 5 x 106/mL, os macrófagos não aderentes foram lavados com PBS e infectados com L. donovani em uma relação de dez parasitos por macrófago. Os parasitos não fagocitados foram lavados com PBS. Dois poços por placa foram estimulados com IFN-γ
(100U/mL) e LPS (100ng/mL) por 4 horas. Somente então algumas culturas foram tratadas com diferentes doses de miltefosina (HPC). Após 4, 24, 48 e 72 horas do tratamento com miltefosina a porcentagem de macrófagos infectados foi determinada. A análise estatística foi feita por análise de variância (ANOVA two-way) seguida de Teste de Tukey, * # indicam P<0,05. Os resultados
43 A
Controle IFN + 0,2µµµµM 0,8µµµµM 3,2µµµµM
0 2 4 6 8 10 BALB/c PAFR-KO 4h LPS HPC * * * N º d e a m a s ti g o ta s / M a c ró fa g o s i n fe c ta d o s B
44 C
Controle IFN + 0,2µµµµM 0,8µµµµM 3,2µµµµM
0 2 4 6 8 BALB/c PAFR-KO 48h LPS HPC # # # # N º d e a m a s ti g o ta s / M a c ró fa g o s i n fe c ta d o s D
Controle IFN + 0,2µµµµM 0,8µµµµM 3,2µµµµM 0 2 4 6 8
72 h
LPS HPC*
*
# # # # N º d e a m a s ti g o ta s / M a c ró fa g o s i n fe c ta d o sGráficos 3: macrófagos peritoneais inflamatórios de camundongos selvagens ou PAFR-KO foram
cultivados em uma concentração de 5 x 106/mL, os macrófagos não aderentes foram lavados com PBS e infectados com L. donovani em uma relação de dez parasitos por macrófago. Os parasitos não fagocitados foram lavados com PBS. Dois poços por placa foram estimulados com IFN-γ
(100U/mL) e LPS (100ng/mL) por 4 horas. Somente então algumas culturas foram tratadas com diferentes doses de miltefosina (HPC). Após 4, 24, 48 e 72 horas do tratamento com miltefosina o número de amastigotas por macrófago infectado foi determinado. A análise estatística foi feita por análise de variância (ANOVA two-way) seguida de Teste de Tukey, * # indicam P<0,05. Os
45
4.3 – Verificação da atividade da arginase e produção de NO por macrófagos de camundongos BALB/c selvagens e PAFR-KO.
46 A B
C
D
Gráficos 4: atividade de arginase de macrófagos peritoneais de camundongos selvagens [A] e
PAFR KO [B] tratados com diferentes doses de miltefosina (HPC). A atividade da enzima foi medida após 48 horas do tratamento com a droga. Os resultados de A e B estão combinados, para comparação, em [C]. [D] Macrófagos peritoniais inflamatórios foram infectados com L.
donovani em uma relação de 10 parasitos por macrófago. Análise estatística feita por análise de
variância (ANOVA two-way). * indica P<0,05. Experimento representativo de três realizados.
MO 0,2µµµµM 0,8µµµµM 3,2µµµµM
0 200 400 600 BALB/c HPC A ti vi da d e d e A rg in as e
MO 0,2µµµµM 0,8µµµµM 3,2µµµµM 0 50 100 150 200 250 PAFR-KO HPC A ti vi da d e de A rg in as e
MO 0,2µµµµM 0,8µµµµM 3,2µµµµM 0 200 400 600 BALB/c PAFR-KO HPC
*
*
*
*
A ti vi d ad e d e A rg in as e47
Gráfico 5:produção de NO por macrófagos de camundongos selvagens e PAFR KO. Macrófagos
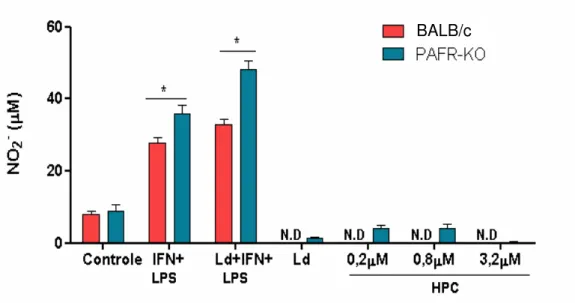
foram infectados com L. donovani em uma relação de 10 parasitos por macrófago. Algumas culturas foram estimuladas com IFN-γ (100U/mL) e LPS (100ng/mL) por 4 horas. Somente então
algumas culturas foram tratadas com diferentes doses de miltefosina (HPC). O sobrenadante das culturas foi coletado após 48 horas do início do tratamento com a droga. Análise estatística feita por análise de variância (ANOVA two-way). * indica P<0,05. N.D.Não detectado. Experimento representativo de três realizados.
BAL
48
4.4 – Curso de infecção com L. donovani em camundongos PAFR-KO
e selvagens.
49 A B C
Gráficos 6: quantificação de parasitos no fígado [A], baço [B] e medula óssea [C] de
camundongos BALB/c selvagens e PAFR-KO, infectados com 2 x 107 L. donovani( 1, 2, 4, 6 e 8 semanas após a infecção. Análise estatística feita por análise de variância (ANOVA two-way). * indica P<0,001. O resultado é representativo de dois experimentos desenvolvidos independentemente. (n= 5 camundongos /grupo)
Medula óssea
1ª 4ª 6ª 8ª
0 2 4 6 8
*
C ar g a p ar as it ár ia ( -l o g)Fígado
1ª 2ª 4ª 6ª 8ª
0 2 4 6 8 BALB/c PAFR-KO C ar g a p ar as it ár ia ( -l o g)
Baço
1ª 2ª 4ª 6ª 8ª
50
4.5 – Curso de infecção com L. donovani em camundongos PAFR-KO
e selvagens tratados com miltefosina
51 A B
C D
Gráficos 7: quantificação de parasitos no fígado [A e D], baço [B] e medula óssea [C], de
camundongos BALB/c selvagens e PAFR-KO infectados com 2 x 107 L. donovani e tratados com diversas doses de miltefosina. Os camundongos foram tratados a partir da segunda semana de infecção por sete dias, e eutanasiados quatro semanas após a infecção. Análise estatística feita por análise de variância (ANOVA two-way). * indica P<0,01. N.D. Não detectado.Mostramos os resultados de dois experimentos realizados independentemente. (n=5 camundongos/grupo).
52
5 - DISCUSSÃO
A leishmaniose visceral humana é fatal se não tratada. O tratamento de primeira escolha para esta doença é baseado em drogas antimoniais, porém, os pacientes encontram várias dificuldades para sua realização. O alto custo e o longo tempo de duração tratamento, a falta de disponibilidade dos medicamentos perto do domicílio, a necessidade de internações para a realização do tratamento com injeções diárias e os efeitos colaterais devido à alta toxicidade são os principais fatores envolvidos. Uma avaliação dos custos financeiros do tratamento da leishmaniose por paciente deve levar em conta o transporte, consultas, exames laboratoriais, internação, tratamento, taxas de suspensão do trabalho e médico. Além disto, há uma crescente preocupação com a resistência do parasito ao tratamento (Sundar & Rai, 2005).
O tratamento com drogas antimoniais necessita da participação do sistema imune do hospedeiro para ser mais eficiente. As células T têm sua ação de produzir de IFN-γ e IL-2 suprimida pela infecção por L. donovani. Entretanto, são necessárias para a eficácia da quimioterapia anti-leishmania convencional com antimônio pentavalente (SbV), uma vez que o tratamento é inativo em camundongos deficientes em céluls T (nude). Porém, quando é feita a transferência de células T de animais não infectados ou imunes, estes camundongos recuperaram a capacidade de responder ao tratamento com antimoniais (Murraye cols., 1989).
53
A miltefosina foi originalmente descrita como uma droga anti-câncer (Unger e cols., 1989). Apesar do desconhecimento do seu modo de ação, foi proposto que a droga pode interferir com a síntese de lipídios e, consequentemente, alterar a sobrevida celular (Berkovic e cols., 1995). Por apresentar uma longa cadeia de ácidos graxos, foi proposto que o medicamento pode interagir diretamente com as camadas lipídicas da membrana e interferir com a sinalização celular (Arthur & Bittman, 1998). Quando observou-se, pela primeira vez, que a droga era ativa contra Leishmania donovani in vitro, foi proposto que a ela poderia atuar diretamente sobre o parasito (Unger e cols., 1989) induzindo apoptose (Parise cols., 2004).
Devido ao fato de existir uma semelhança estrutural entre a miltefosina e o PAF e este atuar ligando-se especificamente ao receptor de PAF presente nas células alvo, propusemos que a miltefosina atue ligando-se também a este receptor.
Inicialmente comparamos o perfil de infecção por L. donovani em macrófagos de camundongos BALB/c selvagens e PAFR-KO e verificamos que não houve diferenças quanto à porcentagem de macrófagos infectados e nem quanto ao número de amastigotas nos macrófagos (Gráficos 1A e1B). Isso demonstra que na ausência do receptor de PAF não ocorreu uma alteração na suscetibilidade de macrófagos provenientes das duas linhagens de camundongos. Na sequência começamos os estudos in vitro abordando o papel do receptor de PAF no efeito da miltefosina após a verificação de que ambas as linhagens de macrófagos dos camundongos não apresentaram diferenças de infecção.
Quando acrescentamos miltefosina a macrófagos de camundongos selvagens, notamos que a infecção por L. donovani (medida pela porcentagem de macrófagos infectados e pelo número de parasitos por macrófago) não foi prejudicada pela presença da droga no após quatro horas de tratamento. Então, o efeito inicial de menor infecção devido à miltefosina não parece ser mediado pelo receptor de PAF.
54
amastigotas por macrófagos infectados diminuiu com o aumento da dosagem da droga e também com o tempo (Gráfico 3). Entretanto pode-se verificar que quando os macrófagos infectados com L. donovani são PAFR-KO, o efeito da miltefosina foi muito mais discreto em relação aos dos animais selvagens (Gráficos 2 e 3). Apesar de a droga apresentar algum efeito na eliminação dos parasitos, de maneira tempo dependente e dose dependente, este foi sempre menor neste tipo de macrófago em todos os tempos avaliados e houve um efeito menor que em camundongos selvagens. Estes resultados sugerem que realmente há um efeito da miltefosina via receptor de PAF.
Pelo menos dois estudos descrevem a atividade de PAF sobre a infecção de macrófagos por parasitos. Nestes trabalhos mostrou-se que a infecção de macrófagos por L. amazonensis foi inibida quando estes foram tratados com PAF e que o uso de antagonistas para o receptor de PAF anulou este efeito (Lonardoni e cols., 2000; Rosa e cols., 2001). Assim a miltefosina ao se ligar ao receptor de PAF poderia simular o efeito do PAF.
Visando avaliar possível efeito modulador da miltefosina sobre a ativação de macrófagos, avaliamos a atividade da enzima arginase e produção de óxido nítrico (NO).
O metabolismo da L-arginina, feito pelas enzimas arginase e iNOS,
é importante para o entendimento da suscetibilidade observada em camundongos BALB/c infectados L. major. Enquanto a expressão de arginase é induzida por IL-4 e IL-10 e favorece a replicação do parasito e, portanto, a suscetibilidade à infecção por L. major, a expressão de iNOS é disparada por IFN-γ e favorece a eliminação do parasito e assim a resistência à infecção (Corraliza e cols., 1995; Modolell e cols., 1995; Iniesta e cols., 2005). Em infecções por L. donovani esta relação parece não ter sido descrita ainda.
55
modulador do PAF e da miltefosina sobre a atividade da arginase e desta forma, abre-se campo para o estudo desta possível interação. Quando examinamos a atividade de arginase em macrófagos infectados (Gráfico 4D) notamos o mesmo padrão que em macrófagos não infectados (Gráfico 4C).
Ao relacionar os resultados de quantificação de parasitos in vitro (Gráficos 2 e 3) com os da atividade de arginase (Gráfico 4) percebe-se que macrófagos de camundongos PAFR-KO tratados com miltefosina apresentaram maior carga parasitária, porém menor atividade da enzima. Os motivos para este efeito não são ainda conhecidos, e merecem mais estudos.
Vários grupos relataram o aumento na produção de IFN-γ, GM-CSF, TNF-α e NO após tratamento com miltefosina em vários tipos celulares, incluindo células mononucleares humanas e macrófagos peritoniais de camundongos (Beckers e cols., 1994; Escobar e cols., 2001; Hochhuth e cols., 1992; Zeisig e cols., 1995). Estes trabalhos apóiam a ideia de que a miltefosina pode alcançar seu efeito modulando positivamente a resposta de macrófagos contra Leishmania.
Já havia sido relatado que a miltefosina estimulou macrófagos infectados ou não com T. cruzi a liberar NO de forma dose dependente (Saraiva e cols., 2002). Entretanto, estes macrófagos quando estimulados somente com
IFN-γ e LPS, apesar de produzirem grandes quantidades de NO, também apresentaram maior carga parasitária. Então o NO liberado na presença de miltefosina não foi importante para a eliminação do parasito. Estes resultados sugeriram que o efeito da miltefosina sobre T. cruzi em macrófagos infectados foi independente da ativação celular e da produção de NO.
56
No trabalho de Aliberti et al. (1999) com o mediador inflamatório PAF, verificou-se que este possui função na ativação de macrófagos, aumentando a atividade microbicida destas células. Como único estimulo, o PAF induziu a liberação de pequenas quantidades de NO por macrófagos infectados in vitro com
T. cruzi quando comparados àqueles estimulados com IFN-γ. Em infecção com
Mycoplasma arthritidis (Shio e cols., 2004), a adição de PAF ou de antagonistas
de seu receptor às culturas de macrófagos estimuladas ou não com antígeno de M. arthritidis, não produziu níveis detectáveis de NO. E ainda, na avaliação da atividade tumoricida de macrófagos (Howard & Erickson, 1995) somente a adição de PAF às culturas de macrófagos não foi suficiente para estimular a liberação de NO. Esta só foi alcançada quando as células foram estimuladas também com IFN-γ. Assim o PAF agiria sinergicamente com IFN-γ, dando o segundo estímulo para síntese de NO. Quando acrescentamos miltefosina a macrófagos, não conseguimos verificar a produção de NO. Entretanto, os macrófagos expostos à miltefosina eliminavam os parasitos ao longo dos tempos.
Uma vez que a infecção na ausência ou presença da miltefosina foi igual, atribuímos este efeito a uma ação leishmanicida da miltefosina. Pelo menos parte da atividade da miltefosina sobre macrófagos infectados seria independente do receptor de PAF, pois esta droga teve efeito leishmanicida também nos macrófagos de camundongos PAFR-KO. Mas ficou claro que parte do efeito da miltefosina foi mediado pelo receptor de PAF, pois houve diferença significativa entre as duas linhagens de camundongos. Portanto, não podemos excluir um efeito leishmanicida mediado pelo receptor de PAF, e outros experimentos serão realizados para esclarecer este ponto. O grupo de B. Saha (dados não publicados) mostrou que o bloqueio do receptor de PAF por anticorpos e por antagonistas reduziu a ação da miltefosina significativamente em macrófagos de camundongos selvagens infectados in vitro com L. donovani. Devido à semelhança estrutural do PAF com a miltefosina e por acreditarmos na ligação da droga com o receptor específico de PAF, a droga poderia apresentar este efeito.
57
camundongos BALB/c selvagens e PAFR-KO no mesmo fundo genético. Os camundongos selvagens e PAFR-KO infectados com 2 x107 parasitos pela veia da cauda não apresentaram diferença marcante no parasitismo, ao longo de 8 semanas (Gráfico 6). Uma diferença estatística foi encontrada quando comparamos o número de parasitos no baço na sexta semana de infecção: os camundongos PAFR-KO apresentaram maior número de parasitos que os camundongos selvagens (Gráfico 6B). Uma diferença maior foi encontrada no número de parasitos na medula óssea também na sexta semana de infecção. As diferenças encontradas no baço e na medula óssea na sexta semana podem não ser suficientes para caracterizar que camundongos PAFR-KO sejam mais suscetíveis que os camundongos selvagens à infecção por L. donovani, pois, representam apenas uma diferença discreta, temporária num ponto isolado durante todo o curso de infecção. Em um trabalho anterior de nosso grupo, a suscetibilidade de camundongos deficientes para o receptor de PAF foi muito maior em relação a camundongos selvagens (Santiagoe cols., 2006b). Entretanto neste trabalho as infecções eram feitas em camundongos C57BL/6 com L.
amazonensis.
Ainda em infecções in vivo com L. amazonensis, camundongos C57BL/6 demonstram um perfil de resistência e quando tratados com antagonistas do receptor de PAF apresentaram um aumento no tamanho das lesões na pata. Desta forma o receptor de PAF mediaria a resistência à infecção (Lonardonie cols., 2000).
Camundongos C57BL/6 infectados com T. cruzi e tratados com antagonistas do receptor de PAF tiveram a parasitemia aumentada. Quando animais deficientes para o receptor foram infectados, eles apresentaram o dobro de parasitemia em relação aos animais selvagens durante o pico da infecção, além de apresentarem menor tempo de sobrevivência. Resultados semelhantes podem ser vistos quando se utiliza outra linhagem de camundongos BALB/c.(Talvanie cols., 2003; Alibertie cols., 1999)