UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS
ENSAIOS TOXICOLÓGICOS, NÃO CLÍNICO E CLÍNICOS FASE I E
II, COM O ANTIVIRAL TÓPICO CELODENINA NO TRATAMENTO
DE HERPES LABIAL RECORRENTE.
MÔNICA LORENA DIAS MEIRELLES DA CUNHA
MÔNICA LORENA DIAS MEIRELLES DA CUNHA
Ensaios toxicológicos, não clínico e clínicos fase I e II, com o antiviral tópico celodenina no tratamento de herpes labial recorrente.
Tese apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da Universidade Federal da Paraíba, para a obtenção do título de DOUTOR EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS (área de concentração: FARMACOLOGIA).
Orientadora: Profa. Dra. Margareth de Fátima Formiga Melo Diniz
MÔNICA LORENA DIAS MEIRELLES DA CUNHA
Ensaios toxicológicos, não clínico e clínicos fase I e II, com o antiviral tópico celodenina no tratamento de herpes labial recorrente.
Tese apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da Universidade Federal da Paraíba, para a obtenção do título de DOUTOR EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS (área de concentração: FARMACOLOGIA).
BANCA EXAMINADORA
Profa. Dra. Margareth de Fátima Formiga Melo Diniz
Prof. Dr. Prof. Reinaldo Nóbrega de Almeida
Profa. Dra. Liana Clébia de Morais Pordeus
Profa. Dra. Edeltrudes de Oliveira Lima
DEDICO ESTE TRABALHO, COM AMOR:
Aos meus filhos Angélica e Antônio Lucas
Inspirações da minha vida, razões do meu viver.
Aos meus pais Josimar Meirelles da Cunha e Inês Dias Meirelles da Cunha. Eles me ensinaram todos os valores da minha vida além do incentivo
AGRADECIMENTOS
A Deus, pelo dom da vida e pela presença em todos os momentos da minha vida: por me fazer acreditar na realização dos meus sonhos.
À minha orientadora, Profa. Dra. Margareth de Fátima Formiga Melo Diniz, amiga presente nas horas mais difíceis da minha vida, agradeço o amor, o incentivo, a força e a coragem em todos os momentos no decorrer desta caminhada.
Aos pacientes participantes do estudo, pela confiança depositada no nosso projeto de pesquisa. Sem a ajuda de vocês, este sonho não seria possível.
À direção do Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos, aos professores, secretárias (em especial, Caroline Helena Meireles de Medeiros Mangueira) e colegas do doutorado, que, de modo direto ou indireto, contribuíram para a conclusão desta tese.
Ao funcionário do Laboratório de Tecnologia Farmacêutica da Universidade Federal da Paraíba, José Crispim Duarte, pela colaboração técnica na realização deste trabalho.
Às professoras doutoras Maria do Socorro de França Silva e Melissa Negrão de Dellacqua, pelas sugestões e apoio relevantes para a elaboração deste trabalho.
Ao Prof. Dr. Marçal de Queiroz Paula, pesquisador responsável pela síntese do fármaco utilizado neste estudo, pela competência, ética e ajuda em todos os momentos.
À Luciene Nunes Ferreira, que ofereceu um apoio excepcional para a conclusão deste trabalho.
Às direções do Hospital Universitário Lauro Wanderley e Centro de Ciências da Saúde da Universidade Federal da Paraíba, nas pessoas do Prof. Dr. Arnaldo Correia de Medeiros e Prof. Dr. Reinaldo Nóbrega de Almeida respectivamente, pelo apoio e pela oportunidade concedida para a realização desse trabalho.
RESUMO
CUNHA, M.L.D.M. Ensaios toxicológicos, não clínico e clínicos fase I e II, com o antiviral tópico celodenina no tratamento de herpes labial recorrente. 2014. 111f. Tese. Centro de Ciências da Saúde da Universidade Federal da Paraíba. Brasil.
O herpes simples labial, uma das infecções virais mais prevalentes no mundo, é doença crônica, recidivante e incurável, persistindo durante toda a vida do hospedeiro, geralmente sob a forma latente. Frente à dificuldade de se encontrar uma terapia eficaz com a medicina tradicional, busca-se na medicina complementar novas possibilidades de tratamento para esta patologia. O estudo objetivou realizar ensaios toxicológicos, não clínico e clínicos fase I e II, com o antiviral celodenina, neoflavonoide sintetizado, a partir do extrato etanólico das cascas do caule de Coutarea hexandra (Jacq) K. Shum, via tópica. Os estudos dermais não clínicos avaliaram a irritação primária da pele – efeito agudo (dose simples) e a irritação ocular aguda (dose simples) e em ambos os experimentos foram utilizados coelhos albinos neozelandeses, sadios, adultos, em número de 12, sendo 6 machos e 6 fêmeas (controle e tratado) para uma dose de 0,5 g doreferido creme. A avaliação da irritação primária da pele demonstrou que o creme não é irritante para a pele dos coelhos testados no Laboratório de Ensaios Toxicológicos da Universidade Federal da Paraíba, já que nenhum deles apresentou nenhum grau de eritema e edema durante todo o experimento. Em relação à irritação ocular simples, o creme demonstrou efeito de baixa irritabilidade, porque apenas 33,3% coelhos apresentaram rubor em conjuntiva nas primeiras 24 horas após a aplicação da substância em estudo. Não foi identificada nenhuma alteração na íris e na córnea, em qualquer dos animais em todo o experimento. Para investigar a toxicidade clínica fase I, em seres humanos, da celodenina, foram selecionados 30 voluntários, de ambos os sexos, clinicamente saudáveis, com faixa etária compreendida entre 18 e 65 anos. Os participantes do estudo foram tratados diariamente, no turno da noite, por via dermal, com o creme por um período de 4 semanas e avaliados antes do início do estudo e após o seu término com exames hematológicos (hemograma completo), bioquímicos (glicemia, uréia, creatinina, colesterol total, AST, ALT, fosfatase alcalina), com o objetivo de detectar possíveis alterações decorrentes da utilização do creme nos mesmos, bem como, comparar os resultados antes e após o término do estudo. Não foram evidenciados valores alterados, tanto para as variáveis hematológicas como para as bioquímicas entre os tempos e os grupos. Ao longo do tratamento com o creme, foram observadas algumas reações adversas nos participantes: ressecamento local (7%), ardor (13%), formigamento (7%) e eritema (7%), mas o número de voluntários acometidos foi pequeno, e os sintomas e sinais relatados ocorreram na primeira semana do estudo, não necessitando de tratamento específico, desaparecendo espontaneamente. Os estudos clínicos fase II foi randomizado, duplo-cego, comparando a celodenina 4% com placebo em 33 pacientes portadores de herpes labial recorrente entre 18 e 65 anos, que utilizaram as referidas substâncias 3 vezes ao dia durante 15 dias. Os pacientes também foram avaliados antes e após o término do estudo com exames hematológicos e bioquímicos, os quais não demonstraram valores significativos entre os tempos. Poucos efeitos adversos foram relatados, o ardor (21%) e o ressecamento local (5,3%), ambos, de forma branda, durante os primeiros 30 minutos após a aplicação nos primeiros 5 dias. As recidivas herpéticas foram avaliadas durante 30, 60 e 90 dias e os participantes tratados com celodenina 4% apresentaram menor percentual das mesmas em relação ao placebo em todos os tempos. Estes resultados sugerem a baixa toxicidade do produto, eficiência satisfatória no controle das recidivas e indicam que esta formulação pode ser utilizada para testes clínicos fase III, na dose e via de administração testada no tratamento do herpes labial recorrente.
ABSTRACT
CUNHA, M.L.D.M. Non-clinical and clinical phase I and II toxicological tests with topical antiviral celodenina in the treatment of recurrent herpes labialis. 2014. 111f. Thesis. Health Sciences Center of the Federal University of Paraíba. Brazil.
Herpes simplex labialis, one of the most prevalent viral infections worldwide, is a chronic, relapsing incurable disease, persist throughout the lifetime of the host, usually in a latent form. Facing the difficulty of finding an effective therapy to traditional medicine, we seek new possibilities in complementary medicine treatment for this condition. The study aimed to perform non-clinical and clinical phase I and II toxicological tests with topical antiviral celodenina, neoflavonide synthesized from the ethanol extract of the stem bark of Coutarea hexandra (Jacq) K. Shum, topically. Preclinical studies have evaluated the dermal primary skin irritation - acute effect (single dose) and acute eye irritation (single dose) and in both experiments albino rabbits Zealanders, healthy adults were used in number 12, being 6 males and 6 females (control and treated) at a dose of 0.5 g of the cream. The assessment of primary skin irritation demonstrated that the cream does not irritate the skin of rabbits tested in Drug Testing Laboratory of the Federal University of Paraíba, since none showed any degree of erythema and edema throughout the experiment. Regarding eye irritation simple, cream showed low irritant effect, as only 33.3% rabbits showed redness in conjunctiva during the first 24 hours after application of the test substance. Did not identify any changes in the iris and cornea, in any animal throughout the experiment. To investigate the clinical phase I toxicity in humans, the celodenina, 30 volunteers were selected, of both sexes, clinically healthy, aged between 18 and 65 years. Study participants were treated daily, the night shift, by dermal route, with the cream for a period of four weeks and evaluated before the start of the study and after its termination hematology (CBC), biochemical (glucose, urea, creatinine, total cholesterol, AST, ALT, alkaline phosphatase), in order to detect possible changes resulting from use of cream in them, as well as to compare the results before and after the study. No abnormal values for both hematological variables as for biochemical between times and groups were highlighted. During treatment with the cream, some adverse reactions were observed in participants: local dryness (7%), burning (13%), tingling (7%) and erythema (7%), but the number of affected subjects was small, and symptoms and signs reported occurred in the first week of the study, not requiring specific treatment, disappearing spontaneously. Clinical phase II trials were randomized, double-blind, comparing celodenina 4% with placebo in 33 patients with recurrent herpes labialis between 18 and 65 years, who used these substances three times daily for 15 days. Patients were also assessed before and after the study of hematological and biochemical tests, which showed no significant values between times. Few adverse effects were reported, burning (21%) and local dryness (5.3%), both mildly during the first 30 minutes after application in the first five days. Herpes recurrences were evaluated for 30, 60 and 90 days and the participants treated with celodenina 4% had lower percentage of same relative to placebo at all time. These results suggest a low toxicity of the product, satisfactorily efficient control of relapses and indicate that this formulation can be used in Phase III clinical trials, dose and route of administration tested in the treatment of recurrent herpes labialis.
LISTA DE ABREVIATURAS E SÍMBOLOS
ALT Alanina Aminotransferase
AST Aspartato Aminotransferase
CNS Conselho Nacional de Saúde
CCEN Centro de Ciências Exatas e da Natureza
DPPH 2,2-difenil-1-picrihidrazil
EECCH Extrato Etanólico das Cascas de Coutarea hexandra (Jacq.) K. Schum
Gs Glicoproteínas
HLR Herpes Labial Recorrente
HSV Herpes Simples Vírus
HSV-1 Herpes Simples Vírus Tipo 1
HSV-2 Herpes Simples Vírus Tipo 2
HULW Hospital Universitário Lauro Wanderley
IgG Imunoglobulina G
MC Medicina Complementar
MCNT Máxima Concentração Não Tóxica
MD Média Diária
M Média Máxima
PCR Reação em Cadeia da Polimerase
SUS Sistema Único de Saúde
TKs Timidinaquinase viral
UFPB Universidade Federal da Paraíba
LISTA DE FIGURAS
Figura 1 - Estrutura do HSV...20
Figura 2 - Estágios das infecções pelo HSV... ... ....21
Figura 3 - Gengivoestomatite herpética primária em criança ...23
Figura 4 - Herpes labial recorrente ... 24
Figura 5 - Herpes genital...25
Figura 6 - Panarício herpético...26
Figura 7 - Erupção variceliforme de Kaposi...27
Figura 8 - Eritema multiforme...27
Figura 9 -Teste de Tzanck...28
Figura 10 - Análogos nucleosídeos da guanosina...31
Figura 11 - Couterea hexandra (Jacq) K. Shum...36
Figura 12 - Estrutura química dos neoflavonoides...39
Figura 13 - Creme dermatológico celodenina ...43
Figura 14 - Sítios de aplicação tópica do creme celodenina ... 44
Figura 15 - Creme celodenina nos locais escolhidos, após a aplicação tópica ...45
Figura 16 - Olho do coelho após a administração do creme celodenina ... 48
Figura 17 - Celodenina 4%, em reservatórios de 15 gramas, utilizado pelos voluntários ... 54
Figura 18 - Fluxograma do estudo clínico fase I ... 55
Figura 19 - Fluxograma do estudo clínico fase II ... 61
Figura 20 - Efeito do creme celodenina 4%, uso tópico, antes e após o tratamento, sobre os parâmetros hematológicos, nos ensaios clínicos fase I...65
Figura 21 - Efeito do creme celodenina 4%, uso tópico, antes e após o tratamento, sobre a glicemia, nos ensaios clínicos fase I...67
Figura 23 - Efeito do creme celodenina 4%, uso tópico, antes e após o tratamento, sobre a função hepática, nos ensaios clínicos fase I...68
Figura 24 - Efeito do creme celodenina 4%, uso tópico, antes e após o tratamento, sobre a função renal, nos ensaios clínicos fase I...69
Figura 25 - Percentual de recidivas das lesões herpéticas após o tratamento com placebo e o celodenina 4% após 15 dias. ...73
Figura 26-Percentual de recidivas das lesões herpéticas após o tratamento com placebo e celodenina 4% após 30 dias. ...73
Figura 27 - Percentual de recidivas das lesões herpéticas após o tratamento com placebo e celodenina 4% após 60 dias. ...74
Figura 28 - Percentual de recidivas das lesões herpéticas após o tratamento com placebo e celodenina 4% após 90 dias...74
Figura 29 - Efeito da celodenina 4% (n=19) e placebo (n=14), uso tópico, antes e após o tratamento, sobre os parâmetros hematológicos, nos ensaios clínicos fase II... 76
Figura 30 - Efeito da celodenina 4% (n=19) e placebo (n=14), uso tópico, antes e após o tratamento, sobre a glicemia, nos ensaios clínicos fase II... 78
Figura 31 - Efeito da celodenina 4% (n=19) e placebo (n=14), uso tópico, antes e após o tratamento, sobre o colesterol total, nos ensaios clínicos fase II...78
Figura 32 - Efeito da celodenina 4% (n=19) e placebo (n=14), uso tópico, antes e após o tratamento, sobre a função hepática, nos ensaios clínicos fase II... 79
LISTA DE QUADROS
Quadro 1 - Classificação sistemática de Couterea hexandra (Jacq) K. Shum...37
Quadro 2 - Formulação do creme celodenina...43
Quadro 3 - Formação de eritema e escaras... 45
Quadro 4 - Formação de edema...46
Quadro 5 - Irritação primária da pele (A) ...46
Quadro 6 - Irritação primária da pele (B) ...47
Quadro 7 - Classificação das substâncias de acordo com poder irritante sobre a pele ...47
Quadro 8 - Cotação das lesões oculares – córnea...48
Quadro 9 - Cotação das lesões oculares – íris... 49
Quadro 10 - Cotação das lesões oculares - conjuntiva...49
Quadro 11 - Dados sobre a irritação ocular ... 50
Quadro 12 - Valores da classificação de primeira aproximação... 51
Quadro 13 - Métodos e valores de referência do hemograma ... 56
Quadro 14 - Métodos e valores de referência das dosagens bioquímicas...56
Quadro 15 - Métodos e valores de referência do -hCG......57
LISTA DE TABELAS
Tabela 1 - Número de coelhos que apresentaram eritema na pele após a administração tópica de celodenina 4%...62 Tabela 2 - Número de coelhos que apresentaram edema na pele após a administração tópica de celodenina 4%...62 Tabela 3 - Número de coelhos que apresentaram alterações oculares após a administração do creme celodenina 4%...63 Tabela 4 - Valores das variáveis hematológicas por gênero e no tempo total, segundo o tempo de avaliação. ...64
Tabela 5 - Valores das variáveis bioquímicas por gênero e no tempo total, segundo o tempo de avaliação. ... 66 Tabela 6 - Características e condições inerentes dos pacientes selecionados ... 71 Tabela 7 - Fatores desencadeantes relatados por pacientes antes do tratamento fase II...71 Tabela 8 - Tratamentos anteriores relatados pelos pacientes portadores de herpes recorrente labial antes do estudo ...72 Tabela 9 - Sintomas prodrômicos relatados pelos pacientes antes do estudo ... 72 Tabela 10 - Duração das recidivas anteriores relatada pelos pacientes ...73 Tabela 11 - Valores das variáveis hematológicas nos pacientes tratados com placebo e celodenina 4%, antes e após o tratamento. ...75
SUMÁRIO
1 INTRODUÇÃO ... 16
2 OBJETIVOS ... ..18
3 REFERENCIAL TEÓRICO ... 19
3.1 HERPES SIMPLES ... 19
3.1.1Conceito e epidemiologia ... ...19
3.1.2 Etiologia e patogênese ... .20
3.1.3. Achados clínicos ...22
3.1.4 Diagnóstico ... ...28
3.1.5 Abordagens terapêuticas...29
3.1.6 Vacinação anti-herpética ...29
3.2 MEDICINA COMPLEMENTAR ... 34
3.3 Coutarea hexandra (JACQ) K. SHUM ... 37
3.3.1 Considerações gerais ... 37
3.3.2Composição química dos extratos de Coutarea hexandra (Jacq.) K. Schum ...38
3.3.3 Propriedades farmacológicas dos extratos do caule e folhas de Coutarea hexandra (Jacq.) K. Schum ... 39
3.3.4 Estudos pré-clínicos ... 40
4 METODOLOGIA ... ...43
4.1 FORMULAÇÃO DO CREME CELODENINA...43
4.2 ENSAIOS TOXICOLÓGICOS NÃO CLÍNICOS COM O ANTIVIRAL TÓPICO CELODENINA ... 43
4.2.1 Local da pesquisa... ....43
4.2.2 Sujeitos e condições e experimentais ... ...43
4.2.3 Procedimentos experimentais...43
4.3 ENSAIOS FARMACOLÓGICOS CLÍNICOS FASE I COM O ANTIVIRAL TÓPICO CELODENINA ...51
4.3.1 Desenho do estudo ...51
4.3.2 Local da pesquisa ...52
4.3.3 Estudo clínico ...52
4.3.3.1 Probandos ...52
4.3.3.2 Critérios de inclusão ...53
4.3.3.3 Critérios de exclusão ...53
4.3.3.4 Período de administração ...53
4.3.5 Parâmetros hematológicos ...55
4.3.6 Parâmetros bioquímicos ...56
4.3.7 Parâmetro imunológico ...57
4.3.8 Reações adversas ...57
4.3.9 Tratamento estatístico...57
4.4 ENSAIOS FARMACOLÓGICOS CLÍNICOS FASE II COM O ANTIVIRAL TÓPICO CELODENINA...58
4.4.1 Desenho do estudo ...58
4.4.2 Local da pesquisa ...58
4.4.3 Estudo clínico...58
4.4.4 Protocolo experimental ...59
4.4.5 Avaliação da eficácia clínica e segurança ...60
4.4.6 Tratamento estatístico ...60
5 RESULTADOS ... ...62
5.1 ENSAIOS TOXICOLÓGICOS NÃO CLÍNICOS COM O ANTIVIRAL TÓPICO CELODENINA... 62
5.1.1 Irritação primária da pele – efeito agudo (dose simples) ...62
5.1.2 Irritação ocular aguda (dose simples) ...63
5.2 ENSAIOS FARMACOLÓGICOS CLÍNICOS FASE I COM O ANTIVIRAL TÓPICO CELODENINA...63
5.2.1 Parâmetros hematológicos ...63
5.2.2 Parâmetros bioquímicos ...66
5.2.3 Parâmetro imunológico ...69
5.2.4 Reações adversas ...69
5.3 ENSAIOS FARMACOLÓGICOS CLÍNICOS FASE II COM O ANTIVIRAL TÓPICO CELODENINA ...70
5.3.1 Características e condições inerentes dos pacientes selecionados ... 70
5.3.2 Avaliação clínica dos pacientes selecionados...71
5.3.3Recidivas...73
5.3.4 Reações adversas... ...74
5.3.5 Parâmetros hematológicos ...75
5.3.6 Parâmetros bioquímicos ...77
5.3.7 Parâmetro imunológico ...79
6 DISCUSSÃO ... ...80
7 CONCLUSÕES ... ....87
REFERÊNCIAS...89
ANEXO A - ... .101
ANEXO B - ... ..102
APÊNDICE A - ... ..104
APÊNDICE B - ... ..106
1 INTRODUÇÃO
O herpes simples labial é uma doença viral, crônica, recidivante e incurável, persistindo durante toda a vida do hospedeiro, geralmente sob a forma latente. Caracteriza-se pelo aparecimento de vesículas sobre base eritematosa que, em poucos dias, transformam-se em pequenas úlceras, precedidas de sintomas de ardência, prurido e dor. Uma das suas características únicas é a capacidade de promover infecção latente e recorrente, o que predispõe o hospedeiro a episódios de reativação viral e promove o potencial aumento da transmissão da patologia (BRADY; BERNSTEIN, 2004; FATAHZABEH; SCHWARTZ, 2007).
Essa entidade nosológica é uma das infecções mais prevalentes em todo o mundo, e estima-se que 40 a 75% dos adultos apresentam lesões herpéticas recorrentes com diagnóstico tardio e tratamento inadequado na maior parte dos casos. Quanto maior o número de recorrências sem tratamento, maior será a exposição a partículas virais e consequentemente maior o potencial de contaminação (CONSOLARO; CONSOLARO, 2009)
As opções terapêuticas para o herpes simples labial recorrente não visam à erradicação viral, mas sim a prevenção da transmissão, a supressão da recorrência, a atenuação da evolução clínica, excreção viral e complicações, assim como tratamento paliativo (BROWN et al., 2001; FILLET, 2002; HUBER, 2003; LEFLORE; ANDERSON; FLETCHER, 2000; NADELMAN; NEWCOMER, 2000). Ocorrendo um diagnóstico positivo, recomenda-se esclarecer dúvidas do paciente e avaliar seu estado emocional. Infelizmente, nenhuma das drogas atualmente oferecidas no mercado é capaz de curar infecções pelo herpes simples vírus (HSV), mas, sim podem modificar o clínico curso da doença, através da inibição de replicação viral e subsequente lesão do epitélio (KLEYMANN, 2003; LEFLORE; ANDERSON; FLETCHER, 2000).
O impacto das lesões herpéticas sobre a qualidade de vida dos pacientes tem sido amplamente investigado e demonstra afetar negativamente o desempenho funcional e social dos mesmos. Embora a infecção pelo HSV tenha um curso rápido, muitas vezes provoca dor, sinais e sintomas inflamatórios interferindo com o prazer da vida e contribuindo para agravar problemas de insegurança e ansiedade, oriundos do abalo à auto-estima ocasionado pelas mesmas (FATAHZABEH; SCHWARTZ, 2007; TRINDADE et al., 2007).
elevada transmissibilidade, devendo ser instituídos diagnóstico e tratamento precoces em todos os casos detectados (BRASIL, 2010).
Frente à dificuldade de se encontrar uma terapia eficaz com a medicina tradicional, busca-se na medicina complementar (MC) novas possibilidades de tratamento para o herpes simples labial recorrente. Estima-se que cerca de 82% da população brasileira utiliza produtos à base de plantas medicinais nos seus cuidados de saúde (RODRIGUES; DE SIMONI, 2010; BRASIL, 2012). Alguns fitoterápicos são utilizados para tratar infecções pelo vírus HSV e um grande número de moléculas pequenas, tal como fenois, polifenois, terpenos, flavonoides, compostos que contêm açúcar, foram isolados e reconhecidos como promissores agentes anti-herpéticos. Entretanto, a eficácia desses produtos precisa ser confirmada com estudos de maior casuística (KHAN et al., 2005).
A constatação dessas premissas motivou o desenvolvimento de ensaios toxicológicos dermais, não clínico e clínicos fase I e II, com a celodenina, na abordagem terapêutica de pacientes com herpes simples labial recorrente, com o objetivo de ampliar as alternativas de tratamento para esse grupo de enfermos. A celodenina é um neoflavonoide sintetizado por Paulo & Carvalho, no Laboratório de Química da Universidade Federal da Paraíba, em 1993, a partir do extrato etanólico das cascas do caule de Coutarea hexandra (Jacq) K. Shum, cujos
estudos in vitro demonstraram possuir potente atividade anti-inflamatória, antiviral e
2 OBJETIVOS
Geral: realizar ensaios toxicológicos dermais, não clínico e clínicos fase I e II, com o creme, uso tópico, à base de celodenina, na abordagem terapêutica do herpes simples labial recorrente, de modo a contribuir para o estudo dos efeitos farmacológicos do referido composto
Específicos:
avaliar os efeitos irritantes e/ou corrosivos da celodenina sobre a pele e olhos de mamíferos;
verificar os efeitos colaterais ou adversos e a segurança da celodenina em voluntários saudáveis com seguimento clínico e exames laboratoriais antes e após o estudo respectivamente;
analisar a eficácia terapêutica da celodenina no controle das recidivas em pacientes com herpes simples labial recorrente;
3 REFERENCIAL TEÓRICO
3.1 HERPES SIMPLES
3.1.1 Conceito e epidemiologia
As afecções provocadas pelo HSV são consideradas uma das infecções mais difundidas, afetando aproximadamente 60 a 95% de todos os adultos humanos, levando a surtos recorrentes e subsequentes quadros inflamatórios e álgicos, desconforto estético e transtornos psicológicos. São doenças crônicas, incuráveis e persistem durante toda a vida do hospedeiro, frequentemente de forma latente (BRADY; BERNSTEIN, 2004; OHANA et al., 2000).
As manifestações clínicas são variáveis e influenciadas pela porta de entrada do vírus, do grau de competência imunológica do hospedeiro, bem como pela natureza da doença, se primária ou secundária, quando o indivíduo teve contato prévio ou não com o vírus respectivamente (BRADY; BERNSTEIN, 2004; FATAHZABEH; SCHWARTZ, 2007). Estas variam desde a infecção assintomática, infecções mucocutâneas como a orolabial, ocular e genital, panarício herpético, herpes gladiatorum, eczema herpético e as complicações nervosas, como o herpes neonatal e a encefalite herpética, além da disseminação sistêmica, uma particular condição encontrada em pacientes imunossuprimidos (BRADY; BERNSTEIN, 2004; FATAHZABEH; SCHWARTZ, 2007; LEFLORE; ANDERSON; FLETCHER, 2000).
As infecções pelo HSV podem ser causadas por dois sorotipos de vírus, sendo o HSV tipo 1 (HSV-1) mais frequentemente associado com doença orofacial e o HSV tipo 2 (HSV-2) mais usualmente associado à infecção perigenital, sendo a causa mais comum de doença genital ulcerativa e importante fator de risco para aquisição e transmissão do vírus da imunodeficiência humana (WOLFF, et al., 2011).
diminua com o tempo (LAFFERTY et al., 1987).
A transmissão ocorre por contato íntimo com indivíduo transmissor do vírus, a partir de superfície mucosa ou soluções de continuidade na pele. O HSV é rapidamente inativado em temperatura ambiente e após secagem, o que faz com que a disseminação por aerossois ou fômites seja rara. A transmissão assintomática também é relatada. O herpes vírus não penetra com eficiência no epitélio queratinizado. Seu ciclo de replicação é curto, provocando efeito citopático em queratinócitos e fibroblastos em período que varia de 48 a 72 horas (BRASIL, 2010; LUPI, 2000).
3.1.2 Etiologia e patogênese
HSV-1 e HSV-2 são membros da família Herpesviridae, um grupo de DNA-vírus de grandes dimensões (150-250 nm) que apresenta quatro componentes básicos (figura 1); a estrutura helicoidal de DNA em dupla hélice, envolvida por capsídeo icosaédrico e circundada por substância amorfa (tegumento) e membrana lipídica mais externa, o envelope (LUPI, 2003). Ambos os sorotipos de HSV, juntamente com o vírus da varicela-zóster (VZV), fazem
parte da subfamília α-herpesviridae. Os vírus desta subfamília infectam múltiplos tipos celulares, crescem rapidamente e destroem eficientemente as células do hospedeiro. A infecção no hospedeiro natural é caracterizada por lesões na epiderme e superfícies mucosas, com disseminação para o sistema nervoso e estabelecimento de infecção latente nos neurônios, a partir do qual o vírus periodicamente exibe reativação (WOLFF, et al., 2011).
Figura 1 - Estrutura do HSV
A infecção pelo HSV pode ser dividida em três estágios (figura 2): (1) infecção aguda, (2) estabelecimento e manutenção da latência e (3) reativação. Durante a infecção aguda, o vírus replica-se no local de inoculação na superfície mucocutânea, resultando em lesões primárias a partir das quais ocorre disseminação rápida para terminais nervosos sensoriais, onde ocorre trânsito retrógrado axonal em direção ao núcleo neuronal no gânglio sensorial regional. Em um subgrupo de neurônios infectados, a infecção latente é estabelecida, sendo o DNA viral mantido como um epissomo de expressão gênica restrita (apenas um dos genes virais é abundantemente transcrito durante a latência). No último estágio, a replicação é reativada e ocorre transporte axonal anterógrado concomitantemente dos vírus recém-formados para locais periféricos, nas proximidades do local de entrada original (WOLFF, et al., 2011).
Figura 2 - Estágios da infecção pelo HSV
Fonte: Fitzpatrick- Tratado de Dermatologia/2011
O HSV-1 reativa-se mais eficientemente e usualmente a partir do gânglio trigêmeo, enquanto o HSV-2 se reativa primariamente a partir do gânglio sacral. A taxa de reativação parece ser influenciada pela quantidade de DNA viral latente no gânglio (LEKSTROM-HIMES; PESNICAK; STRAUS, 1998). Além disso, são observadas sequências dentro do genoma do HSV que parecem influenciar as taxas de recorrência em locais anatômicos específicos (YOSHIKAWA, et al., 1996). Além dos genes virais, fatores do hospedeiro influenciam bastante na reativação, que pode ser induzida em animais experimentais por exposição à radiação ultravioleta, hipertermia e trauma local, além de outros estressores fisiológicos (WOLFF, et al., 2011).
correlacionam-se com o nível de competência do sistema imune celular. Pacientes com defeitos de imunidade humoral não apresentam doença mais grave, mesmo que a resposta imune humoral seja importante na redução dos títulos virais no local de inoculação e nos tecidos neurais regionais durante a infecção primária (KHANNA et al., 2004; WOLFF, et al., 2011).
3.1.3 Achados clínicos
As manifestações clínicas dependem do local da infecção e do estado imune do hospedeiro. As infecções primárias ocorrem em pessoas sem imunidade preexistente para HSV-1 ou HSV-2, e são geralmente mais graves do que as recidivas (WOLFF, et al., 2011).
a) Gengivoestomatite herpética
A gengivoestomatite herpética tipicamente se desenvolve após a primeira exposição de indivíduos soronegativos ao HSV ou naqueles que não produzam resposta imunológica eficiente durante uma infecção prévia (LEFLORE; ANDERSON; FLETCHER, 2000; STOOPLER et al., 2003; WHITLEY; ROIZMAN, 2001) . Independentemente do tipo viral, afeta principalmente pele e membranas mucosas. É a manifestação orofacial mais comum de infecção HSV-1 e é caracterizada por lesões vesiculoulcerativas orais e periorais (BRADY; BERNSTEIN, 2004; HUBER, 2003).
É de observação mais comum em crianças entre 1 e 5 anos, mas ocasionalmente casos de infecção primária podem afetar adultos (ESMANN, 2001; LYNCH, 2000; NADELMAN; NEWCOMER, 2000; SAMPAIO; RIVITTI 2007; SIMMONS, 2002).
Figura 3 - Gengivoestomatite herpética primária em criança
Fonte: American Academy of Dermatology/2007
b) Herpes orofacial recorrente
O herpes orofacial recidivante é a forma mais comum da doença, que surge devido a uma receptividade especial que parece ser geneticamente determinada (AZULAY; AZULAY; AZULAY-ABULAFIA, 2008). Após a infecção primária, o HSV pode periodicamente reativar, migrando a partir dos gânglios sensoriais, causando o herpes oral ou genital recidivante (CHILIKURI; ROSEN, 2003; ESMANN, 2001; SACKS et al., 2004).
A reativação do vírus a partir da primoinfecção envolve a área perioral, sobretudo os lábios, sendo o terço lateral do lábio inferior mais frequentemente afetado. Outras localizações faciais incluem nariz, queixo e região zigomática que, somadas, contribuem com menos de 10% dos casos. Cerca de 2/3 das lesões labiais envolvem o vermelhão, enquanto o resto ocorre na junção entre a borda do vermelhão e a pele. Em pacientes com recorrências frequentes, as lesões podem ser levemente diferentes em localização a cada episódio (WOLFF, et al., 2011).
Comparados com a infecção primária, os episódios recorrentes são mais leves e mais curtos em duração com mínimo envolvimento sistêmico (GLICK, 2002; LYNCH, 2000; NALDEMAN; NEWCOMER, 2000). Contudo frequentes surtos estão associados com significante morbidade, inconveniência, dor, processo inflamatório, acometimento estético e estresse psicológico (KLEYMANN, 2003; LYNCH, 2000; NADELMAN; NEWCOMER, 2000).
(ESMANN, 2001; SAMPAIO; RIVITTI, 2007; WHITLEY; ROIZMAN, 2002). Estes sinais e sintomas prodrômicos representam a replicação viral nas terminações nervosas sensitivas que inervam o dermátomo mucocutâneo (ESMANN, 2001; WHITLEY; KIMBERLIN; ROIZMAN, 1998).
Mesmo em paciente imunocompetente, a severidade do herpes labial recorrente (HLR) é extremamente variável e pode oscilar desde sintomas prodrômicos isoladamente, sem subsequente desenvolvimento de lesões (episódio abortado), até doença extensa induzida por queimadura solar local grave (WOLFF, et al., 2011).
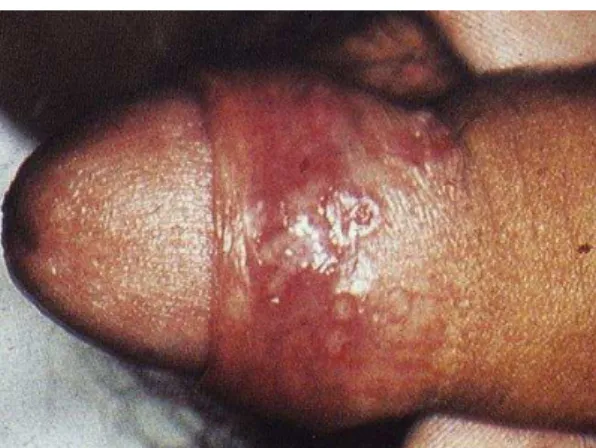
A progressão da lesão herpética clássica é dividida, clinicamente, nos seguintes estágios (figura 4): pródromo, eritema e pápula (estágio de desenvolvimento); vesícula, úlcera e crosta endurecida (estágio de doença); seguida resolução seca e edema residual (estágio de resolução). As lesões geralmente desaparecem dentro de 5 a 15 dias, sem deixar cicatriz (LYNCH, 2000; SAMPAIO; RIVITTI 2007; SCIUBBA, 2003; WOLFF, et al., 2011).
Figura 4 - Herpes labial recorrente
Fonte: Revista Dental Press de Ortodontia e Ortopedia Facial/2009
A frequência da recidiva é variável (semanas, meses ou anos). Fatores desencadeantes para a recorrência de herpes oral incluem estresse emocional, doença, exposição solar, trauma, fadiga, menstruação, rachaduras nos lábios e estação climática (AZULAY; AZULAY; AZULAY-ABULAFIA, 2008; SAMPAIO; RIVITTI, 2007; YOUNG; ROWE; BUCHANAN, 1976). Outros fatores de risco bem documentados incluem exposição à radiação ultravioleta, cirurgia do nervo trigêmeo, trauma oral, administração epidural de morfina e procedimentos cosméticos faciais, sejam eles abrasivos, químicos ou por laser. O
mecanismo exato pelos quais estes fatores induzem a reativação é desconhecido (WOLFF, et
c) Infecção genital
Herpes genital é a apresentação clínica da infecção por HSV-2, mas também pode resultar de HSV-1 em 10 a 40% dos casos, principalmente naqueles com contato orogenital. Infecção genital por ambos, HSV-1 e HSV-2 tem sido descrita (SUCATO et al., 1998;
WOLFF, et al., 2011).
Estudos revelam que a primoinfecção far-se-á, na maior parte dos casos, de forma subclínica e não detectada pelos infectados (WALD et al., 2004). Porém, a clássica infecção primária é precedida por dor, sensação de formigamento ou queimação no sítio da infecção, com posterior aparecimento de extensas lesões genitais em diferentes estágios de evolução, incluindo vesículas, pústulas e úlceras eritematosas, que podem requerer 2 a 3 semanas para desaparecer, sem deixar cicatriz, localizadas no corpo do pênis ou glande em homens, enquanto em mulheres as lesões acometem a vulva, períneo, nádegas, vagina ou cérvice uterina (figura 5). Sinais e sintomas sistêmicos como cefaléia, febre, mal estar, fraqueza, mialgia e linfoadenopatia inguinal são frequentemente observados (LAUTENSCHLAGER; ECHMANN, 2001; SAMPAIO; RIVITTI, 2007; WOLFF, et al., 2011).
Figura 5 - Herpes genital
Fonte: American Academy of Dermatology/2007
sendo a crise geralmente menos intensa que a infecção primária, cicatrizando em torno de 6 a 10 dias (WOLFF, et al., 2011).
d) Outras infecções cutâneas
O HSV pode infectar qualquer local cutâneo. Seja qual for a apresentação clínica, o vírus necessita penetrar em tecido normal e queratinizado. O panarício herpético é a infecção dos dedos pelo HSV adquirida por inoculação direta ou disseminação indireta a partir de locais cutâneos no momento da primoinfecção (figura 6). Portanto, a típica apresentação clínica é a criança que suga os dedos durante a crise de gengivoestomatite primária. O panarício também é uma expressão bem documentada de doença ocupacional em profissional de saúde (médicos, dentistas, enfermeiras e auxiliares de odontologia), geralmente causado por HSV-1 (KLEYMANN, 2003; NADELMAN; NEWCOMER, 2000; SAMPAIO; RIVITTI, 2007; WOLFF, et al., 2011).
Figura 6 – Panarício herpético
Fonte: American Academy of Dermatology/2007
O herpes cutâneo pode ser transmitido entre atletas envolvidos em esporte de contato como luta (herpes do gladiador). Nestes casos, as múltiplas lesões herpéticas podem apresentar-se no tórax, ouvidos, face, braços e mãos, causadas pela facilitação da infecção decorrente do trauma cutâneo durante a prática esportiva (WOLFF, et al., 2011).
Figura 7 – Erupção variceliforme de Kaposi
Fonte: Dermatologia na Prática Médica/2007
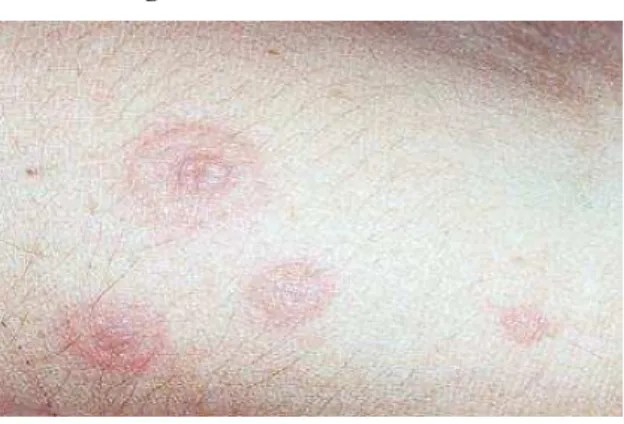
A infecção recorrente pelo HSV é o evento precipitador mais comum em casos de eritema multiforme (figura 8), que consiste em uma síndrome de hipersensibilidade, aguda, autolimitada, de curso benigno, frequentemente recorrente, caracterizada pelo aparecimento súbito de lesões eritemato-vesico-bolhosas na pele e/ou mucosas (WOLFF, et al., 2011).
Figura 8 – Eritema multiforme
Fonte: Oral Surgery Medicine Oral Pathology Oral Radiology and Endodontics/2007
3.1.4 Diagnóstico
O diagnóstico é eminentemente clínico, a partir de uma detalhada anamnese, dos sintomas e sinais detectados em um minucioso exame físico das lesões, porém em alguns casos, principalmente atípicos, estudos complementares são necessários para firmar o diagnóstico (AZULAY; AZULAY; AZULAY-ABULAFIA, 2008; CONSOLARO; CONSOLARO, 2009).
Os esfregaços de Tzanck podem ser úteis para o diagnóstico rápido, porém são pouco sensíveis (figura 9). Visam identificar células gigantes multinucleadas (diagnósticas de infecção por HSV) por meio de raspagem da base da vesícula recém-rompida e coloração do material obtido pelo Giemsa ou Wright (o método Papanicolau também pode ser utilizado) (BRASIL, 2010; WOLFF, et al., 2011).
Figura 9 – Teste de Tzanck
Fonte: http://www.oerafrica.org
3.1.5 Abordagens terapêuticas
O tratamento das infecções pelo HSV deveria começar com a prevenção. Exemplos de estratégias preventivas adequadas incluem a educação do público sobre a natureza contagiosa da doença, o seu potencial para auto-inoculação, a eficácia de técnicas de barreira, tais como preservativos na prevenção da transmissão viral e terapia antiviral profilática (FATAHZADEH; SCHWARTZ, 2007; FILLET, 2002; NADELMAN; NEWCOMER, 2000; SIEGEL, 2002; WALD et al., 2001).
A abordagem do tratamento atual para a infecção pelo HSV não visa à erradicação viral, mas sim a prevenção da transmissão, a supressão da recorrência, a atenuação da evolução clínica, diminuição da excreção viral e complicações, assim como tratamento paliativo (BROWN et al., 2001; FATAHZADEH; SCHWARTZ, 2007; FILLET, 2002 HUBER, 2003; LEFLORE; ANDERSON; FLETCHER, 2000; NADELMAN; NEWCOMER, 2000).
Agentes antivirais não curam infecções por HSV, mas sim modificam o curso clínico da doença, através da inibição da replicação viral e subsequente incapacidade de lesar o epitélio (LEFLORE; ANDERSON; FLETCHER, 2000; KLEYMANN, 2003). Tendo em vista a maior intensidade da replicação viral nas primeiras 48 horas de uma recorrência, o rápido acesso aos sítios de replicação do vírus é crítico para a eficácia terapêutica (ESMANN, 2001; KLEYMANN, 2003; SIMMONS, 2002; SPRUANCE et al., 1977).
Agentes antivirais de uso tópico, oral ou intravenoso podem ser utilizados no tratamento de infecções HSV. A eficácia dos agentes tópicos é determinada pela sua penetração através do epitélio e disponibilidade nas terminações nervosas sensoriais, onde a replicação viral ocorre e devem ser utilizados no herpes labial recorrente não complicado (ESMANN, 2001; WHITLEY; ROIZMAN, 2001). Já o tratamento com agentes antivirais sistêmicos é indicado em lesões que afetam o septo nasal, ouvido interno, couro cabeludo, ou genitália interna, eczema herpético, herpes neonatal, meningoencefalite, herpes ocular e infecções de HSV no paciente imunodeprimido (BRADY; BERNSTEIN, 2004; ESMANN, 2001; KIMBERLIN et al., 2001; RUDNICK; HOEKZEMA, 2002; SIMMONS, 2002).
éter, clorofórmio, anestésicos locais, várias preparações oclusivas e bálsamos para os lábios (HUBER, 2003; LYNCH, 2000; SIEGEL, 2002).
Decisões terapêuticas para uma gestão bem sucedida das recorrências devem envolver o paciente e a intensidade do quadro clínico. É essencial considerar a opinião do paciente, as circunstâncias específicas, o impacto pessoal e psicológico dos surtos, relacionamentos sexuais, e os custos com o tratamento (EMMERT, 2000; PATEL, 2002; STANBERRY et al., 1999).
No herpes orofacial recorrente, agentes antivirais são normalmente reservados para os pacientes que sofrem de episódios frequentes, lesões desfigurantes e exuberantes, surtos persistentes, ou ansiedade considerável. Estes incluem indivíduos com recorrências previsíveis devido às atividades de alto risco (exposição solar intensa) ou procedimentos faciais rejuvenescedores (GREENBERG, 2003; NADELMAN; NEWCOMER, 2000; SCIUBBA, 2003). Benefício clínico máximo com antivirais requer reconhecimento oportuno e precoce de sinais, sintomas e fatores precipitantes da doença com início da terapia no pródromo ou dentro do primeiro dia do surto (BROWN; MCCRARY; TYRING, 2002; ESMANN, 2001; STANBERRY et al., 1999).
Podem ser administrados os seguintes agentes antivirais para o tratamento das infecções pelo HSV (BRADY; BERNSTEIN, 2004; FATAHZADEH; SCHWARTZ, 2007):
a) Aciclovir:
O aciclovir possui real e potente ação antivirótica seletiva. É um análogo nucleosídeo da guanosina (figura 10) que sofre fosforilação 3 vezes para poder exercer seu efeito antiviral. A primeira fosforilação é realizada pela timidinaquinase viral (TKs), originando o monofosfato de aciclovir, que possui atividade apenas em células infectadas pelo vírus. As quinases das células hospedeiras transformam o novo composto em difosfato e trifosfato que se incorporando ao DNA viral, inibe a DNA-polimerase e evita o alongamento adicional da cadeia do DNA viral, interrompendo, assim a replicação do vírus (FATAHZADEH; SCHWARTZ, 2007; SAMPAIO; RIVITTI, 2007). Casos de resistência ao aciclovir ocorrem, predominantemente, como resultado de alterações nas TKs virais e, menos frequentemente de mutações na DNA polimerase viral (KIMBERLIN et al., 1995).
al., 2001). Outros fatores de relevância negativa em relação ao aciclovir são a inconveniência de administração e o custo financeiro imposto ao paciente, principalmente aqueles que sofrem de recidivas freqüentes (KHAN et al., 2005).
Figura 10 – Análogos nucleosídeos da guanosina
Fonte: www.slideplayer.com.br
As formulações possuem um bom perfil de segurança, e são bem toleradas pelos pacientes, contudo a sua baixa biodisponibilidade plasmática (10% -20%) e curta meia-vida requerem dosagens frequentes (BRADY; BERNSTEIN, 2004; BROWN; MCCRARY TYRING, 2002; NADELMAN; NEWCOMER, 2000). O aciclovir é disponível para administração intravenosa, oral e tópica (pomada 5%). Um efeito colateral raro associado com a administração intravenosa rápida do aciclovir em alta dose é a nefropatia de caráter reversível (CHAKRABARTY et al., 2004; WHITLEY; ROIZMAN, 2001).
b) Valaciclovir:
Possui biodisponibilidade até 5 vezes maior que o aciclovir, permitindo doses, via oral, mais esparsas e melhoria da adesão do paciente (NADELMAN; NEWCOMER, 2000; OMROD; SCOTT; PERRY, 2000; SOUL-LAWTON et al., 1995).
A reação adversa mais freqüente é a cefaleia, enquanto o risco de microangiopatia trombótica é citada como complicação potencialmente fatal a longo prazo (BELL; CHULAY; REINBERG, 1997; OMROD; SCOTT; PERRY, 2000) .
c) Fanciclovir:
É um diacetil éster, pró-droga de penciclovir, utilizado, sistemicamente por via oral (BROWN, 2001; HUBER, 2003). Rapidamente absorvido pelo trato gastrointestinal, com melhor absorção oral, maior biodisponibilidade, e mais intervalos entre as dosagens em comparação com penciclovir no tratamento de doenças provocadas HSV (BRADY; BERNSTEIN, 2004; BROWN; MCCRARY; TYRING, 2002; FILLET, 2002; NADELMAN; NEWCOMER, 2000; PEREIRA, 1996). Fanciclovir compartilha o mesmo mecanismo de ação do aciclovir por inibição da DNA polimerase, e está disponível, apenas, na forma de comprimidos (CIRELLI et al., 1996; EARNSHA et al., 1992; FILLET, 2002).
d) Foscarnet:
Foscarnet é uma medicação antiviral intravenosa aprovado para o tratamento de infecções HSV resistentes ao aciclovir em hospedeiros imunocomprometidos (BRADY; BERNSTEIN, 2004; BROWN; MCCRARY; TYRING, 2002; HUBER, 2003). Inibe diretamente a DNA polimerase viral e não requer fosforilação pela TKs virais (CHILUKURI; ROSEN, 2003; FIELD, 2001; MORFIN; THOUVENOT, 2003). Efeitos adversos graves limitam sua utilização, e incluem principalmente a toxicidade renal, obrigando acompanhamento desta função durante o tratamento (BROWN; MCCRARY; TYRING, 2002; GREENBERG, 1996). Resistência ao foscarnet é incomum e pode ser causada por mutações pontuais na DNA polimerase viral (KEDES; GANEM, 1997).
e) Cidofovir:
administração intravenosa e possui elevada nefrotoxicidade (CHILUKURI; ROSEN, 2003; FATAHZADEH; SCHWARTZ, 2007; MORFIN; THOUVENOT, 2003).
f) Formulações de uso tópico:
Docosanol é um álcool alifático saturado de 22 carbonos e parece inibir a fusão entre a membrana plasmática da célula hospedeira e o envelope do HSV, bloqueando a entrada do vírus (POPE et al., 1998). Disponível como creme tópico a 10% para o tratamento de HLR (MARQUIS; STRAUS, 2003; SCIUBBA, 2002; SCIUBBA, 2003). Penciclovir creme 1% e aciclovir creme 5% são tópicos antivirais aprovados para o tratamento de HLR em indivíduos imunocompetentes (BRADY; BERNSTEIN, 2004; BROWN; MCCRARY; TYRING, 2002; HUBER, 2003; SCIUBBA, 2003). Resiquimod é um modificador da resposta imune de uso tópico avaliado, quanto à segurança e eficácia, em estudos clínicos para tratamento de recorrências de herpes genital e labial (BERNSTEIN, 2001).
3.1.6 Vacinação anti-herpética
Existem duas concepções diferentes quanto ao real valor da vacinação anti-herpética. A primeira sugere que a vacinação teria que se concentrar nos indivíduos ainda não infectados, de preferência na população infantil. A outra perspectiva envolve a vacinação dos indivíduos infectados visando transformá-los em portadores sãos da infecção pelo HSV (LUPI, 2000). É possível que a primeira estratégia viabilize o controle da moléstia em algumas décadas, bloqueando o ciclo de transmissão a novos hospedeiros, mas é na segunda abordagem que se localiza quase todo o esforço atual no controle da infecção herpética (JOHNSTON; KOELLE; WALD, 2014; LUPI, 2003).
Os componentes da subfamília Alphaherpesviridae, em que se inclui o HSV-1 (herpes
As primeiras tentativas de vacinação anti-herpética utilizavam o vírus morto ou atenuado, após sucessivas passagens em cultura de células. Eram as chamadas "vacinas de primeira geração" e predominaram até o fim da década de 1970 (DUNDAROV et al., 1982; LUPI, 2003). Seguiram-se as "vacinas de segunda geração", valendo-se da observação de que as glicoproteínas de superfície apresentavam potencial imunogênico e grande especificidade biológica (LUPI, 2003; STANBERRY, 1991). Estas apresentam algumas restrições, como potência imunogênica reduzida e durabilidade curta. Seu custo e eficácia ainda não se comparam aos da terapêutica supressiva utilizando os análogos dos nucleosídeos (LUPI, 2003). Já as vacinas gênicas ou de DNA, desenvolvidas com partículas infectantes incapacitadas para mais de um ciclo replicativo, vêm-se tornando extremamente úteis no combate à infecção pelo HSV (AGUADO et al., 1996; STEPHENSON, 2001).
Apesar de resultados promissores com várias vacinas em modelos animais, vacinas profiláticas e terapêuticas não têm sido eficazes em ensaios clínicos. As vacinas anti-herpéticas ainda não são uma realidade disponível para o uso clínico rotineiro, mas o campo de vacinas HSV está evoluindo rapidamente e estudos são necessários de forma decisiva para o surgimento de novas tecnologias em imunoprofilaxia (JOHNSTON; KOELLE; WALD, 2014; LUPI, 2003).
3.2 MEDICINA COMPLEMENTAR
Desde os tempos remotos, a humanidade utiliza as plantas com finalidade terapêutica. De acordo com os estudos com fósseis humanos, a utilização de plantas medicinais data há cerca de 60.000 anos (FABRICANT; FARNSWORTH, 2001). Enquanto buscava alimentação para sua sobrevivência, o homem foi descobrindo as propriedades tóxicas ou curativas das plantas. Desta forma, a utilização da natureza para fins terapêuticos é tão antiga quanto à civilização humana e, por muito tempo, produtos naturais, de plantas e animais foram fundamentais para a área da saúde. Historicamente, as plantas medicinais são importantes como fitoterápicos e na descoberta de novos fármacos, estando no reino vegetal a maior contribuição de medicamentos (BRASIL, 2012; SANTOS; POZETI; VARANDA, 2006a).
uso de plantas como fonte de novos medicamentos é ainda pouco explorado. Em relação ao uso médico, estima-se que apenas 5 mil espécies foram estudadas (RATES, 2001). No Brasil, com cerca de 55 mil espécies de plantas, há relatos de investigação de apenas 0,4% da flora (GURIB-FAKIM, 2006).
Estima-se que pelo menos 25% de todos os medicamentos modernos são derivados diretamente ou indiretamente de plantas medicinais, principalmente por meio da aplicação de tecnologias modernas ao conhecimento tradicional (BRASIL, 2012). Paradoxalmente ao potencial e oportunidades que oferece – como o parque científico e tecnológico para o desenvolvimento de fármacos –, o país representa o décimo mercado farmacêutico mundial e importa cerca de 100% de matéria-prima utilizada na produção de fitoterápicos (ADAME; JACCOUD; COBRA, 2005).
Aproximadamente 82% da população brasileira utilizam produtos à base de plantas medicinais nos seus cuidados com a saúde, seja pelo conhecimento tradicional na medicina indígena, quilombola, entre outros povos e comunidades tradicionais, seja pelo uso popular na medicina popular, de transmissão oral entre gerações, ou nos sistemas oficiais de saúde, como prática de cunho científico, orientada pelos princípios e diretrizes do Sistema Único de Saúde (SUS). Assim, o uso de plantas com finalidade terapêutica é uma prática que incentiva o desenvolvimento comunitário, a solidariedade e a participação social (RODRIGUES; DE SIMONI, 2010).
Muitos foram os avanços nas últimas décadas com a formulação e implementação de políticas públicas, programas e legislações com vistas à valoração e valorização das plantas medicinais e derivados nos cuidados primários com a saúde e sua inserção na rede pública, assim como ao desenvolvimento da cadeia produtiva de plantas medicinais e fitoterápicos (BRASIL, 2012; RODRIGUES; DE SIMONI, 2010). Atualmente, os principais instrumentos norteadores para o desenvolvimento das ações/programas com plantas medicinais e fitoterapia são: a Política Nacional de Práticas Integrativas e Complementares no SUS, com diretrizes e
linhas de ação para “Plantas Medicinais e Fitoterapia no SUS”, e a “Política Nacional de Plantas Medicinais e Fitoterápicos”, com abrangência da cadeia produtiva de plantas
medicinais e fitoterápicos (BRASIL, 2012).
Desenvolvimento; da ampliação da oferta de serviços e produtos na rede pública; entre outros (BRASIL, 2012).
Em relação a este contexto, destaca-se a necessidade de pesquisa de novas opções terapêuticas para as infecções contra o HSV, já que as medicações utilizadas não provocam a erradicação do patógeno, bem como já é relatada na literatura, casos de resistência ao aciclovir e análogos nucleosídeos quando surgem mutações nas DNA-polimerases ou timidinaquinases virais (SON et al., 2013).
3.3
Coutarea hexandra (JACQ) K. SHUM3.3.1 Considerações gerais
Dentre as diversas plantas medicinais utilizadas no Brasil encontra-se a rubiácea
Coutarea hexandra (Jacq) K. Shum (Figura 11), também conhecida como murta-do-mato,
quina, quina-branca, quina-de-dom-diego, quina-de-pernambuco, pará, quina-do-piauí, quina-quina e quineira (LORENZI, 1998). A família Rubiaceae Juss, foi descrita
primeiramente por Antoine Laurent de Jussieu, em 1789, e tem seu nome derivado, do gênero
Rubia L., do latim rubium, relativo à tinta vermelha produzida pelas raízes das plantas deste
gênero, utilizadas para tingir tecidos (CRONQUIST, 1981).
Figura 11 – Coutarea hexandra (Jacq) K. Shum: A. Ramo com flores; B. Inflorescência
Fonte: Pereira, 1980
Coutarea hexandra (Jacq)K. Shum pertence à família Rubiaceae que é a maior da ordem
Gentianales, com cerca de 650 gêneros e 13.000 espécies que corresponde a 66% do total das Gentianales (COELHO, AGRA, BARBOSA, 2006; ROVA et al., 2002). No Brasil, segundo Barroso et al., (1999), compreende 18 tribos, 101 gêneros e 1010 espécies, amplamente distribuídas em quase todas as formações vegetais. É nativa do Brasil, e de maior ocorrência em partes úmidas da Amazônia e Mata Atlântica, especialmente no estrato arbustivo (GOMES, 1996). Apresenta-se como uma árvore ou arvoreta, 3-5 metros de altura, de tronco curto e tortuoso, ramos achatados, folhas simples, frutos com sementes membranosas, copa globosa, com inflorescência rósea, sendo usada bastante como planta ornamental em paisagismo. Na medicina popular, a casca de sabor fortemente amargo, é usada contra febre intermitente, malária, feridas e inflamações (BARROSO et al., 1999; PEREIRA; BARBOSA, 2004; SOUZA; MENDONÇA; SILVA, 2013).
Quadro 1 - Classificação sistemática de Coutarea hexandra (Jacq) K. Shum
Reino Divisão Classe Ordem Família Tribo SubTribo Gênero Espécie
Plantae
Magnoliophyta Magnoliopsida Gentianales Rubiaceae Cinchoneae Hillieae Coutarea
Coutarea hexandra K. Shum
Fonte: florabrasiliensis.cria.org.br
A espécie tem distribuição neotropical, podendo ser encontrada no México, América Central e do Sul (ANDERSON, 1992; LORENCE 1999; SHUMANN, 1889). No Brasil é amplamente distribuída, havendo registros para os Estados do Rio de Janeiro, Amazonas, Minas Gerais, Paraná, São Paulo, Mato Grosso, entre outros (LORENCE 1999). Na região Nordeste foi registrada por Barbosa (1996), habitando diversos ecossistemas, desde áreas litorâneas até ambientes mais secos do semi-árido; na Paraíba também foi registrada por Barbosa (1996) em uma área remanescente de Mata Atlântica.
(AQUINO et al., 1988; D`AGOSTINO et al., 1989a; D`AGOSTINO et al., 1989;
D`AGOSTINO et al., 1990; DELLEMONACHE; BOTTA; LIMA, 1984;
DELLEMONACHE et al., 1990) em extratos de Coutarea hexandra (Jacq)K. Shum. Alguns
flavonoides e neoflavonoides também têm sido sintetizados (DELLEMONACHE et al., 1985; IINUMA et al., 1987; LUCENA et al., 2006; PAULO; CARVALHO, 1993).
Atividade antitérmica (LORENZI, 1998), anti-inflamatória (FALÇÃO et al., 2005; LUCENA et al., 2006), analgésica, antiviral (LUCENA et al., 2006) têm sido detectadas para
Coutarea hexandra (Jacq) K. Shum. A indicação popular do efeito abortivo para a casca da
referida planta foi avaliada em ratas tendo se observado efeito antifertilizante após tratamento com a fração acetato de etila desta casca enquanto a fração hexânica, embora não tenha apresentado efeito antifertilizante, alterou o crescimento fetal e aumentou a mortalidade intra-uterina (ALMEIDA et al., 1990). Reabsorção fetal foi observada na presença do extrato etanólico da casca de Coutarea hexandra (Jacq) K. Shum (RAO et al., 1990).
Entre as espécies popularmente conhecidas como quinas, sendo empregadas com atividade antimalárica na medicina popular está a Coutarea hexandra (Jacq)K. Shum, sendo
empregadas as cascas do caule, sugerindo possível atividade contra o protozoário Plasmodium falciparum (BOTSARIS, 2007; CAMARGO, 1995). A casca inferior age contra cálculos
biliares e as cólicas deles decorrentes (LIMA et al., 2011).
Estudos utilizando os extratos brutos de Coutarea hexandra e Cnidoscolus phyllacanthus demonstraram que as concentrações administradas não eram tóxicas para as
larvas do Aedes aegypti, mas foram letais para as pupas deste vetor, com potencial de
desenvolvimento de ferramentas úteis no controle da doença nos diferentes períodos de desenvolvimento no ciclo de vida deste inseto (CANDIDO; CAVALCANTI; BESERRA, 2013).
3.3.2 Composição química dos extratos de Coutarea hexandra (Jacq.) K. Schum
Os principais constituintes químicos de Coutarea hexandra (Jacq.) K. Shum são as
vitaminas, flavonoides e cumarinas, presentes nas folhas e cascas do caule. Existem na literatura estudos que isolaram e identificaram neoflavonoides da referida espécie.
A partir do extrato etanólico das cascas do caule de C. hexandra (Jacq.) K. Shum os
Figura12 - Estrutura química dos neoflavonoides: (a) γ’,4’,5,7-tetrahidroxi-4-fenilcumarina (celotenina) e (b) 5,7-tetrahidroxi-4-fenilcumarina (celodenina) isoladas das cascas do caule de Coutarea
hexandra (Jacq.) K. Schum, família Rubiaceae
Fonte: Paulo; Carvalho, 1994
A partir do extrato benzênico das cascas de Coutarea hexandra (Jacq.) K. Schum
foram isolados e identificados dois neoflavonoides: 3'-hidroxi-5,7,8,4'-tetrametoxi-4-fenilcumarina e 8,3'-di-hidroxi-5,7,4-trimetoxi-4-3'-hidroxi-5,7,8,4'-tetrametoxi-4-fenilcumarina. O padrão de substituição 3',4',8-trihidroxi-5,7-dimetoxi-4-fenilcumarina, também foi isolado e suas estruturas foram confirmadas por métodos espectroscópicos e por meio de reações químicas. Os neoflavonoides 5,7-dimetoxi-γ’,4’-metilenodioxy-4-fenilcumarina; 5,7-dimethoxi-γ’,4’ -dihidroxi-4-fenilcumarina, γ’,5,7-trimetoxi-4-fenilcumarina e 5,7-dimetoxi-4’ -hidroxi-4-fenilcumarina também foram isoladas a partir de extratos C6H6: AcOEt (9:1) das cascas do
caule de Coutarea hexandra (Jacq.) K. Schum (DELLEMONACHE et al., 1990,
DELLEMONACHE; BOTTA; LIMA, 1984). Já Aquino e colaboradores (1988) isolaram
quatro novos neoflavonoides, cujas estruturas foram determinadas por meio de métodos químicos e espectroscópicos.
3.3.3 Propriedades farmacológicas dos extratos do caule e folhas de Coutarea hexandra
(Jacq.) K. Schum
O extrato etanólico das cascas de Coutarea hexandra (Jacq.) K. Schum (EECCH) foi
submetido a testes qualitativos de difusão em discos para nove microrganismos de diferentes classes: Gram-positivos, Gram-negativos, bacilos álcool ácido-resistentes e leveduras, com o objetivo de avaliar sua atividade antimicrobiana. O extrato EECCH apresentou resultados positivos para os seguintes micro-organismos: Staphylococcus aureus, Mycrococcus luteus e
Bacillus subtilis todos Gram-positivos e a levedura Candida albicans. Os microrganismos
Gram-negativos e bacilos álcool ácido-resistentes não foram inibidos pelo respectivo extrato (SANTOS et al., 2010). Já Araújo e colaboradores (1988) avaliaram a atividade antibacteriana e antifúngica do composto 5, 7, 2`,5`tetraacetoxi-4-fenilcumarina obtido a partir do extrato etanólico de Coutarea hexandra (Jacq)K. Shum(Rubiaceae).
Os extratos etanólicos da casca do caule e da folhas de Coutarea hexandra (Jacq) K.
Shum também foram analisados em relação aos efeitos mutagênicos e atividade antioxidante. Os resultados mostraram mutagenicidade para a linhagem celular TA100 após a ativação metabólica e importante atividade antioxidante. Este estudo sugere que é aconselhável ter precaução no uso desta planta, pois a mesma é utilizada popularmente em preparações medicinais, no entanto, estudos in vivo devem ser realizados para confirmar estes dados
(NUNES et., 2012).
Estudo fitoquímico desta planta levou ao isolamento de metabólitos 4-aril-cumarinas (DELLEMONACHE; BOTTA; LIMA, 1984), e fenilcumarinas que apresentam comprovada ação relaxante muscular, sem apresentar efeitos tóxicos, quando administrada por via oral em camundongos (ARAÚJO et al., 1988).
O extrato aquoso da entrecasca de Coutarea hexandra (Jacq) K. Shum possui efeitos
anti-inflamatório e antinociceptivo e não apresenta toxicidade aguda em camundongos (LUCENA et al., 2006). Já o efeito anti-hepatotóxico foi avaliado por Carvalho (2009), que concluiu fraco efeito em toxicidade induzida por paracetamol em ratos.
3.3.4 Estudos pré-clínicos
Estudos foram realizados para avaliar os efeitos antinociceptivo e anti-edematogênico do extrato aquoso da entrecasca de Coutarea hexandra (Jacq) K. Shum, tendo sido também
avaliada a toxicidade aguda. Doses orais do extrato aquoso (1, 3 e 5 g/kg; p.o.) significativamente reduziram as contorções abdominais induzidas por ácido acético, aumentaram o tempo de latência ao calor no teste da placa quente, reduziram o edema de pata induzido por carragenina e, na segunda fase do teste da formalina, também reduziram a resposta dos animais à formalina. O efeito detectado no teste da formalina não foi revertido por naloxona ou cafeína. Nos ensaios de toxicidade aguda, não foi observada a morte de nenhum animal até a dose de 5 g/kg. Em conclusão, o extrato aquoso da entrecasca de
apresenta toxicidade aguda em camundongos. O efeito antinociceptivo não está relacionado à ativação dos sistemas opioide e adenosina e, ao menos parcialmente, é decorrente da atuação do extrato aquoso em nível do sistema nervoso central (LUCENA et al., 2006).
Foi realizada também uma avaliação toxicológica do extrato hidroalcoólico (EtOH:H2O 8:2) das cascas de Coutarea hexandra em ratos; quanto toxicidade aguda os
resultados mostraram que, por via oral, o extrato não apresentou efeito tóxico significativo em dose de 5,0g/kg. Já na avaliação toxicológica crônica de doses repetidas, administradas por via oral em ratos, o referido extrato hidroalcoólico também não apresentou toxicidade significativa, quando avaliado em doses de 50 mg/kg durante 35 dias (BRITO, 1997).
Já o efeito anti-hepatotóxico dos extratos etanólicos das cascas e folhas de Coutarea hexandra (Jacq) K. Shum foi investigado em ratos com diferentes doses (100, 200, 300
mg/kg, peso corporal, oralmente) com hepatotoxidade induzida por paracetamol. Diferentes parâmetros bioquímicos como aspartato aminotransferase (AST), alanina aminotransferase (ALT), fosfatase alcalina (FA) e gama-glutamil transferase ( -GT) foram avaliados. As
4 METODOLOGIA
4.1 FORMULAÇÃO DO CREME
O creme dermatológico utilizado no estudo foi denominado celodenina e contem na sua formulação o 5,7-diacetoxi-4-arilcromano, produto final de reações sintéticas cujo reagente de partida, originou-se do extrato etanólico das cascas do caule de Coutarea hexandra (Jacq) K. Shum (figura 13). A formulação encontra-se especificada no quadro 2, e
foi especialmente preparada no Laboratório de Química de Produtos Naturais, do Centro de Ciências Exatas e da Natureza (CCEN) da Universidade Federal da Paraíba para este estudo, pelo Professor Dr. Marçal Paula de Queiroz.
Quadro 2 – Formulação do creme celodenina FORMULAÇÃO DO CREME CELODENINA
Celodenina-3’,4’-diacetilada ... 0,40 g Conservantes ( parabenos) ... 0,02 g Base creme (O/A) ... 10 g
Figura 13 – Creme dermatológico celodenina
4.2 ENSAIOS TOXICOLÓGICOS NÃO CLÍNICOS COM O ANTIVIRAL TÓPICO CELODENINA
4.2.1 Local da pesquisa
As atividades da pesquisa pré-clínica foram realizadas no Laboratório de Ensaios Toxicológicos (LABETOX) e no Biotério Thomas George, do Instituto de Pesquisa em Fármacos e Medicamentos da Universidade Federal da Paraíba (UFPB), onde funciona o Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde. O projeto foi aprovado pela Comissão de Ética no Uso de Animais do Centro de Biotecnologia da UFPB conforme parecer 0107/12 (anexo A).
4.2.2 Sujeitos e condições experimentais
Foram utilizados coelhos albinos neozelandeses, sadios, adultos, em número de 12, peso de ± 3 kg, sendo 6 machos e 6 fêmeas (controle e tratado), para cada dose do creme dermatológico celodenina 4%. Os sujeitos experimentais foram mantidos em gaiolas individuais. A temperatura local foi aproximadamente de 21 ± 2 0C; a taxa de umidade relativa do ar situou-se entre 30 e 70%. Períodos de claro e escuro obedeceram a ciclos de 12 horas. O regime alimentar conveniente para os animais foi o regime clássico de laboratório, com água potável e alimentação ad libitum.
4.2.3 Procedimentos experimentais
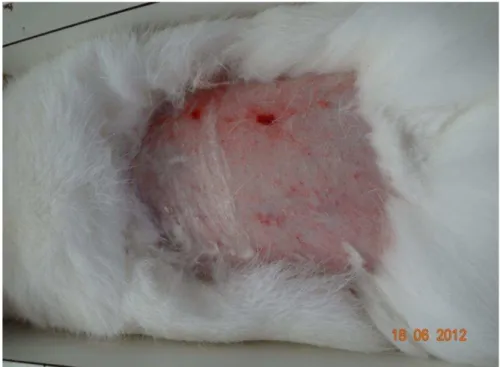
a) Irritação primária da pele – efeito agudo (dose simples)
Permite determinar as propriedades irritantes e/ou efeitos corrosivos de uma substância sobre a pele de mamíferos, indicando os prováveis resultados da pele humana em exposição a esta substância. A irritação dérmica é a produção, sobre a pele, de alterações inflamatórias, reversíveis, frente à aplicação de uma substância-teste (BRITO, 1994).
Figura 14 - Sítios de aplicação tópica do creme celodenina, dois dos quais foram submetidos abrasão (lado direito)
Fonte: Cunha, 2012
Figura 15 – Creme celodenina nos locais escolhidos, após a aplicação tópica
Fonte: Cunha, 2012
A observação dos sinais de edema e eritema nos sujeitos e a anotação das respostas foram efetuadas após sessenta minutos, 24 e 72 horas após a retirada das compressas. As irritações cutâneas foram observadas e registradas em todos os tempos, sendo feitas sempre para as áreas submetidas ou não à abrasão. As lesões foram classificadas de acordo com o sistema empregado pelo Federal Hazardous Substances Act of the USA, conforme esquema a
seguir quadros 3 e 4.
Quadro 3: Formação de eritema e escaras
FORMAÇÃO DE ERITEMA E ESCARAS
LESÃO VALOR
Sem eritema 0
Eritema leve (apenas perceptível) 1
Eritema bem definido 2
Eritema moderado a grave 3