Universidade de Trás-os-Montes e Alto Douro
Resposta biológica do selador endodôntico à base de silicato
de cálcio num modelo ex vivo de remodelação óssea
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
Bruna Isabel de Sousa Pinheiro
Orientadores: Professor Doutor Bruno Jorge Antunes Colaço e Professora Doutora Maria Helena Raposo Fernandes
Resposta biológica do selador endodôntico à base de silicato de cálcio num
modelo ex vivo de remodelação óssea
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
Bruna Isabel de Sousa Pinheiro
Orientadores: Professor Doutor Bruno Jorge Antunes Colaço e Professora Doutora Maria Helena Raposo Fernandes
COMPOSIÇÃO DO JÚRI:
CLASSIFICAÇÃO:
DATA: ___/___/___
III
“Nunca saberemos o quão forte somos
até que ser forte seja a única escolha.”
IV
AGRADECIMENTOS
Quero agradecer à Universidade de Trás-os-Montes e Alto Douro e aos professores pela excelente formação dada ao longo do mestrado.
Agradeço também aos elementos do Laboratório de Farmacologia e Biocompatibilidade Celular da Faculdade de Medicina Dentária da Universidade do Porto, nomeadamente à Doutora Maria Helena, ao Doutor Pedro e à Doutora Liliana, pela oportunidade de estágio e por toda a disponibilidade e ajuda durante o mesmo.
Por último, um grande agradecimento aos meus orientadores, Professora Doutora Maria Helena Raposo Fernandes e Professor Doutor Bruno Jorge Antunes Colaço, pelo ensinamento e esclarecimento de todo o trabalho realizado.
Agradeço também a quem não me deixou desistir e me apoiou em fases menos boas.
V
RESUMO
Em Medicina Dentária o tratamento endodôntico tem como objetivo a eliminação da infeção dos canais radiculares, bem como a completa obturação do espaço canalar, de forma a prevenir a penetração apical ou coronal de líquidos ou microrganismos. Neste processo, os seladores endodônticos desempenham um papel relevante preenchendo o espaço entre a parede do canal radicular e o material do núcleo do canal radicular, canais laterais e acessórios.
O objetivo deste trabalho assenta na caracterização da resposta biológica de cimentos endodônticos à base de silicato de cálcio, recorrendo a modelos in vivo e ex vivo, caracterizando a toxicidade e o potencial de modelação osteogénica destes cimentos.
De forma a alcançar estes objetivos foi avaliado o comportamento biológico de cimentos endodônticos usados em medicina dentária (MTA Plus, MTA+, MTA Fillapex e TopSeal). Com este intuito, realizou-se um ensaio de irritabilidade na membrana corioalantóide (CAM) do embrião de galinha, onde foi avaliada a toxicidade dos cimentos endodônticos. De seguida, foi realizado um estudo ex vivo recorrendo a fémures provenientes de embrião de galinha na presença de cimentos onde se pretendeu avaliar o efeito dos cimentos na modulação osteogénica. As amostras recolhidas do ensaio ex vivo foram avaliadas através de colorações histológicas (Alcian Blue/ Sirius Red) e da análise da expressão génica (RT-PCR) para os genes.
Analisando os resultados dos ensaios de irritabilidade constatamos que a implantação do cimento MTA Plus não provocou alterações significativas na organização e estrutura vascular da CAM, ao contrário do observado para os cimentos TopSeal e MTA+, nos quais se observaram fenómenos de lise vascular, principalmente aos 360 segundos.
Observamos nos ensaios ex vivo, que o MTA Plus promoveu, comparativamente ao controlo e aos fémures cultivados na presença de MTA Fillapex, um avanço do processo osteogénico. Isto pode ser confirmado através de um aumento do tecido da região central rico em colagénio, com uma avançada organização trabecular e interconectada na diáfise do fémur cultivado com MTA Plus. Podemos também constatar que a presença de MTA Plus induziu o aumento da expressão dos genes SOX9, ACAN, RUNX2 e SOST.
Desta forma os nossos resultados demonstraram que os cimentos endodônticos testados possuem, de forma geral, baixa irritabilidade, sendo o MTA Plus o que provoca menor irritação. Este, à base de silicato de cálcio, revelou também possuir elevado potencial osteogénico, no modelo ex vivo, onde conduziu ao aumento dos marcadores de diferenciação osteogénica e condrogénica.
VI Assim, devem ser realizados mais estudos de forma a melhor avaliar o potencial osteogénico do MTA Plus, para poder vir a ser utilizado, no futuro, como biomaterial de reparação e/ou regeneração óssea.
Palavras-chave: seladores endodônticos, silicato de cálcio, membrana
corioalantóide, in vivo, ex vivo, fémur de embrião de galinha, RT-PCR, genes condrogénicos, genes osteogénicos, MTA Plus, SOX9, ACAN, RUNX2 e SOST.
VII
ABSTRACT
In dentistry, endodontic treatment goal is remove canal infection and prevent apical or coronal penetration of microorganisms with the root canal obturation. In this process endodontic sealers play a relevant role, filling the space between the root canal wall and the root core material, channels and fittings.
The objective of this work is to characterize the biological response of calcium silicate endodontic sealers using in vivo and ex vivo models to reporte the toxicity and osteogenic modeling potential of the sealers.
To achieve these objectives, the biological behavior of endodontic sealers used in dentistry (MTA Plus, MTA +, MTA Fillapex and TopSeal) was evaluated. An irritability test was performed on the chorioallantoic membrane (CAM) of the chicken embryo, to evaluate the endodontic sealers toxicity. An ex vivo study was made using chicken embryo femurs in the presence of sealers to evaluate the effect of sealers on osteogenic modulation. Samples from the ex vivo assay were evaluated by histological staining (Alcian Blue/Sirius Red) and gene expression analysis (RT-PCR) for SOX9, ACAN, RUNX2 and SOST genes.
The results shown that the implantation of MTA Plus didn´t cause significant changes in the organization and vascular structure of the CAM, unlike the TopSeal and MTA+, where we observed vascular lysis at 360 seconds.
We also observed in ex vivo tests that MTA Plus promoted an advancement of the osteogenic process, compared to control and MTA Fillapex grown femurs. This can be confirmed by an increase of tissue in collagen rich central region, with advanced trabecular and interconnected organization, in the MTA Plus cultured femur. We can also see that the presence of MTA Plus increased the expression of SOX9, ACAN, RUNX2 and SOST genes.
Our results showed that the tested endodontic sealers have low irritability, being MTA Plus the one that causes least irritation. This, calcium silicate sealer, also revealed to have a high osteogenic potential in the ex vivo model, which led to the increase of osteoblastic and chondrogenic differentiation markers.
Therefore, further studies should be performed to better assess the osteogenic potential of MTA Plus, so it can be used in the future as a bone repair and/or regeneration biomaterial.
VIII
Keywords: endodontic sealers, calcium silicate, chorioallantoic membrane, in vivo, ex vivo, chicken embryo femur, RT-PCR, chondrogenic genes, osteogenic genes, MTA
IX
ÍNDICE
AGRADECIMENTOS ... IV RESUMO ... V ABSTRACT ... VII ÍNDICE DE FIGURAS ... XIÍNDICE DE TABELAS ... XIII
ÍNDICE DE GRÁFICOS ... XIV
1. INTRODUÇÃO ... 1
1.1. DESENVOLVIMENTO EMBRIONÁRIO DENTÁRIO... 1
1.2. ANATOMIA DO DENTE ... 3
1.3. FUNÇÕES DOS DENTES ... 5
1.4. PATOLOGIAS DENTÁRIAS ... 6
1.4.1. CÁRIE DENTÁRIA ... 6
1.4.2. PATOLOGIAS PERIAPICAIS ... 8
1.5. TRATAMENTO ENDODÔNTICO ... 10
1.5.1. CIMENTOS ENDODÓNTICOS ... 11
1.5.1.1. TIPOS DE CIMENTOS ENDODÔNTICOS ... 12
1.5.1.3. VANTAGENS E DESVANTAGENS DOS CIMENTOS ENDODÔNTICOS ... 16
1.6. ENSAIOS DE AVALIAÇÃO DO COMPORTAMENTO BIOLÓGICO DE CIMENTOS ENDODÓNTICOS ... 18 1.6.1. ESTUDOS IN VITRO ... 18 1.6.2. ESTUDOS EX VIVO... 19 1.6.3. ESTUDOS IN VIVO ... 20 2. OBJETIVO E ESTRUTURA ... 22 3. METODOLOGIA EXPERIMENTAL ... 23 3.2. PROTOCOLO EXPERIMENTAL ... 24 3.3. ENSAIO DE IRRITAÇÃO/TOXICIDADE ... 25
X
3.5. HISTOLOGIA ... 28
3.6. EXTRAÇÃO DE RNA COM TRIZOL ... 30
3.6.1. QUANTIFICAÇÃO DO RNA ... 31
3.6.2. ANÁLISE DA EXPRESSÃO GÉNICA (RT-PCR) ... 32
4. RESULTADOS E DISCUSSÃO ... 34
4.1. ENSAIO DE IRRITABILIDADE... 34
4.2. AVALIAÇÃO DO POTENCIAL DE MODULAÇÃO DA OSTEOGÉNESE ... 36
4.3. ANÁLISE DA EXPRESSÃO GÉNICA ... 39
5. CONCLUSÃO ... 42
XI
ÍNDICE DE FIGURAS
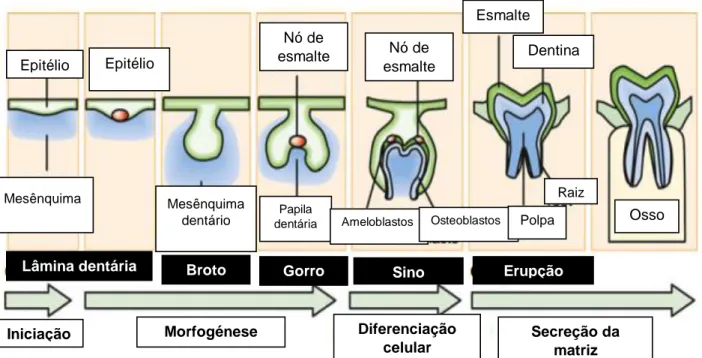
Figura 1 – Representação esquemática da formação do dente. As células do mesênquima
proliferam formando o broto que, por sua vez, vai formar uma concavidade e dar origem à fase de gorro. Por último, na fase de sino, forma-se também uma concavidade no órgão de esmalte promovendo a diferenciação das células em ameloblastos e osteoblastos. Os primeiros são os responsáveis pela formação da dentina e, posteriormente, da polpa dentária.
Adaptado de Thesleff, 2014. ... 3
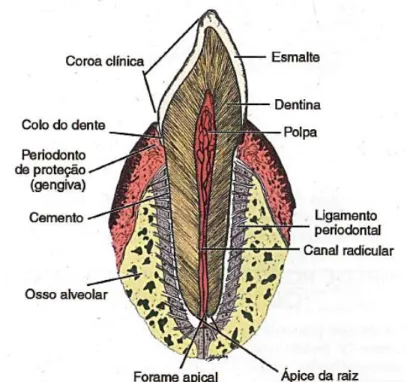
Figura 2 – O dente é constituído por esmalte, dentina, polpa e cemento, estando fixado no osso alveolar pelo ligamento periodontal. Adaptado de Teixeira et al., 2008. ... 4
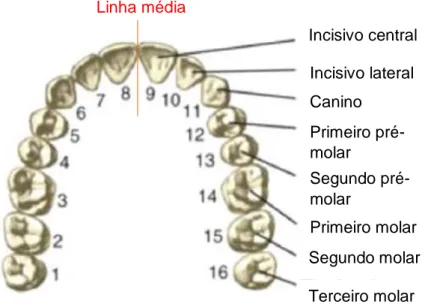
Figura 3 – Organização e nomenclatura dos dentes na cavidade oral, a partir da linha média. Adaptado de Zohrabian et al., 2015a. ... 5
Figura 4 – Dentes com cáries de coloração escura. Adaptado de Laudenbach et al., 2014. . 7
Figura 5 – Interação dinâmica do processo de desenvolvimento da cárie dentária. Adaptado de Mitchell et al., 2014. ... 8
Figura 6 – As lesões de cárie extensas permitem a entrada de bactérias na camara pulpar, contaminando a polpa e movimentando-se pelos canais radiculares, alojando-se nos tecidos periapicais. Adaptado de Zohrabian et al., 2015b. ... 9
Figura 7 – Reações adversas da polpa à infeção bacteriana/trauma: pulpite, dor, necrose da polpa e lesão periapical. Adaptado de Bergenholtz et al., 2010. ... 9
Figura 8 – Representação esquemática da CAM no interior de um ovo de galinha fecundado.. Adaptado de Valdes et al., 2001. ... 20
Figura 9 - Esquema geral da metodologia experimental – Parte superior - colocação dos cimentos em contato com a membrana corioalantóide, para a realização dos testes de irritabilidade. Parte inferior – recolha dos fémures do embrião de galinha e colocação dos cimentos endodônticos – avaliação por histologia e expressão génica. ... 25
Figura 10 – A: abertura do ovo e exposição da CAM, B: substância a testar colocada na superfície da CAM, C: avaliação de sinais de hemorragia, coagulação ou rebentamento de vasos sanguíneos. Adaptado de Wilson et al., 2015. ... 26
Figura 11 – Representação da toxicidade por hemorragia (A), lise (B) ou coagulação (C), adaptado de Eichenbaum et al., 2013. ... 27
Figura 12 - Fémur recolhido do embrião de galinha. ... 27
Figura 13 - A: insert e B: placa de 6 poços ... 28
Figura 14 - Processador de tecidos automático. ... 29
XII
Figura 16 - Corte histológico de fémures de embrião de galinha com a coloração Alcian
Blue/Sirius Red. ... 29
Figura 17 – Esquema da extração de RNA com trizol: inicia-se com a extração do fémur de
embrião de galinha, seguido pela adição de trizol, clorofórmio, agitação da amostra, centrifugação da mesma, visualização da fase aquosa e transferência da mesma para um eppendorf para ser novamente centrifugada; é descartado o sobrenadante e adiciona-se álcool a 75% gelado, é centrifugada a amostra e descarta-se o álcool deixando secar. Finalmente é adicionada a água DEPC (água ultra pura livre de endonucleases), obtendo-se uma solução de RNA. ... 30
Figura 18 - Esquema da quantificação e avaliação da qualidade do RNA: na placa de leitura
coloca-se água DEPC (branco) e as diferentes amostras; a placa é depois colocada no Nanodrop® para ser determinada a absorvância a 260 e 280 nm. ... 31
Figura 19 - Imagens do teste de irritabilidade em CAM. MTA + e TopSeal provocam lise
vascular - zonas identificadas com o círculo preto. Ausência de alterações significativas com o MTA Plus. ... 35
Figura 20 – Secções histológicas dos fémures cultivados na ausência (controlo negativo) e
presença dos cimentos endodônticos de silicato de cálcio. Podemos ver, comparando com o controlo, que o MTA Plus promove a osteogénese, com um aumento da densidade e organização trabecular na região da diáfise e que o MTA Fillapex parece atrasar este processo mesma. Coloração diferencial Alcian Blue (peptidoglicanos – cartilagem) e Sirius Red (colagénio – tecido ósseo). ... 37
XIII
ÍNDICE DE TABELAS
Tabela 1 - Vantagens e desvantagens de alguns cimentos endodônticos ... 17 Tabela 2 - Ensaios de avaliação do comportamento biológico de cimentos endodônticos in vitro. ... 18 Tabela 3 - Ensaios de avaliação do comportamento biológico de cimentos endodônticos –
modelos ex vivo. ... 19
Tabela 4 - Ensaios de avaliação do comportamento biológico de cimentos endodônticos in vivo ... 21 Tabela 5 - Tipos, fabricantes e ingredientes dos cimentos em estudo. ... 23 Tabela 6 - Genes condrogénicos e osteogénicos utilizados: ... 33
XIV
ÍNDICE DE GRÁFICOS
Gráfico 1 - Gráfico com o ΔΔCT do SOX9, MTA Plus muito expresso em relação ao controlo
... 39
Gráfico 2 - Gráfico com o ΔΔCT do ACAN, MTA Plus mais expresso em relação ao controlo
... 39
Gráfico 3 - Gráfico com o ΔΔCT do RUNX2, MTA Plus mais expresso em relação ao
controlo ... 40
Gráfico 4 - Gráfico com o ΔΔCT do SOST, MTA Plus muito expresso em relação ao controlo
1
1. INTRODUÇÃO
Em Medicina Dentária o tratamento endodôntico tem como objetivo a eliminação da infeção dos canais radiculares, bem como a completa obturação do espaço canalar de forma a prevenir a penetração apical ou coronal de líquidos ou microrganismos (Donnermeyer et al., 2018). Clinicamente, na generalidade, os canais são preenchidos com guta-percha em combinação com um selador endodôntico, um componente essencial para a correta obturação canalar. Os seladores endodônticos visam o preenchimento integral dos espaços entre o principal material de preenchimento – normalmente a gua-percha - e as paredes do canal radicular, bem como por entre os espaços existentes por entre este material, de forma a criar uma massa coerente de material de obturação (Bansode et al., 2018).
Na revisão bibliográfica desta dissertação iremos fazer uma breve introdução às estruturas dentárias: desenvolvimento embrionário, anatomia e funções. Abordaremos também as principais patologias dentárias e sua abordagem terapêutica, tendo por base o tratamento endodôntico.
Neste contexto, iremos dar enfâse aos seladores endodônticos/ cimentos endodônticos, nomeadamente às diversas classes e suas propriedades, detalhando as suas vantagens e desvantagens. No contexto da caracterização biológica destes materiais iremos abordar também os vários tipos de ensaios de avaliação do comportamento biológico de cimentos endodônticos, em particular os ensaios in vitro, ex vivo e in vivo.
1.1.
DESENVOLVIMENTO EMBRIONÁRIO DENTÁRIO
Os mamíferos começam o seu desenvolvimento inicial com a formação de tecidos embrionários e extraembrionários, sendo os primeiros os responsáveis pela estruturação do futuro organismo (Harrison et al., 2017).
Na quarta semana de vida intrauterina começa o desenvolvimento da face do embrião. Após a formação do tubo neural, a porção cefálica é constituída por 5 pares de arcos branquiais, em que cada arco possui 3 camadas: a ectoderme, o mesoderme e a endoderme. A formação maxilar e mandibular deriva do primeiro arco branquial, ocorrendo a formação do estomodeu ou boca primitiva, que é uma depressão ventral que precede a formação das estruturas dentárias (Zohrabian et al., 2015). O epitélio oral e as células mesenquimais
2 subjacentes irão dar origem aos dentes, iniciando-se com o espessamento do epitélio, ao qual se segue a condensação das células mesenquimais. Ocorre também a formação da coroa dentária, que engloba estágios definidos pela forma do seu epitélio (forma de broto, gorro e sino), seguido do desenvolvimento da raiz (figura 1) (Thesleff, 2014).
A cavidade oral primitiva, formada pelo estomodeu, é revestida pela ectoderme que, à sexta semana de desenvolvimento fetal, se organiza numa faixa de epitélio mais espessa, com o nome de banda epitelial primária. Esta banda, em forma de ferradura, desenvolve-se em lâmina vestibular e em lâmina dentária. A lâmina dentária é a base do desenvolvimento das estruturas dentárias. Neste local, as células proliferam e originam o broto dentário que, por sua vez, vai proliferar e formar uma concavidade por invaginação do mesênquima, alcançando a fase de gorro. Este é composto pelos epitélios de esmalte, externo e interno, e pelo retículo estrelado. No epitélio de esmalte interno vão-se aglomerando células ectomesenquimais originando a formação da papila dentária e estruturando o folículo dentário que servirá de suporte às estruturas dentárias. A fase de sino desenvolve-se através da formação de uma concavidade na parte interna do órgão do esmalte (Zohrabian et al., 2015). É nesta fase que as cúspides imergem, quando se trata de um dente isolado vão originar a ponta da coroa, quando se tratam de dentes multicúspides, os nós secundários do esmalte vão formar-se nos locais das futuras cúspides (Jernvall et al., 2012). É ainda nesta fase que as células do epitélio interno do esmalte se diferenciam em ameloblastos, os responsáveis pela produção do esmalte, e em odontoblastos, estes vão formar a dentina e, posteriormente, a polpa dentária (nervos, vasos sanguíneos e tecido conjuntivo de suporte) (Jernvall et al., 2012; Zohrabian et al., 2015). A formação da dentina induz a formação do esmalte, tendo início no topo do dente, seguindo em direção à sua raiz. Em simultâneo, vai-se formando o canal radicular com o estreitamento da polpa dentária (Zohrabian et al., 2015).
3 Um adulto humano possui 32 dentes, encontrando-se 16 no maxilar e outros 16 na mandíbula. A partir da linha média, os dentes são nomeados de incisivo central, incisivo lateral, canino, primeiro pré-molar, segundo pré-molar, primeiro molar, segundo molar e terceiro molar (figura 2) (Zohrabian et al., 2015).
1.2.
ANATOMIA DO DENTE
Os dentes são órgãos maioritariamente constituídos por tecidos duros mineralizados, tornando-se duros e resistentes (Teixeira et al., 2008). São constituídos pela coroa (parte do dente exposta na cavidade oral) e pela raiz (parte contida nos alvéolos da maxila e da mandíbula) (Madeira & Rizzolo, 2007; Teixeira et al., 2008). Por ter uma constituição heterogénea (tecidos diferentes) o dente é considerado, histologicamente, como um órgão (Teixeira et al., 2008).
Existem, nos dentes, três tecidos duros e um tecido mole. Os tecidos duros são a dentina, o esmalte e o cemento, sendo o tecido mole a polpa dentária (Teixeira et al., 2008). Na coroa, a dentina é coberta por esmalte e, na raiz, pelo cemento (Madeira & Rizzolo, 2007). No seu interior existe a cavidade pulpar, onde está alojada a polpa dentária (tecido mole, rico em nervos e vasos sanguíneos), que se distribui pelas regiões da coroa e da raiz (figura 2) (Teixeira et al., 2008).
Os dentes estão inseridos no rebordo ósseo sinusal, chamado alvéolo, e estão fixados pelo ligamento periodontal (figura 2), que lhes permitem um suporte estruturado, com
Epitélio Mesênquima Mesênquima dentário Nó de esmalte Nó de esmalte Papila
dentária Ameloblastos Osteoblastos Esmalte Dentina Polpa Raiz Osso Epitélio Lâmina dentária Iniciação
Broto Gorro Sino Erupção
Morfogénese Diferenciação celular
Secreção da matriz
Figura 1 – Representação esquemática da formação do dente. As células do mesênquima proliferam
formando o broto que, por sua vez, vai formar uma concavidade e dar origem à fase de gorro. Por último, na fase de sino, forma-se também uma concavidade no órgão de esmalte promovendo a diferenciação das células em ameloblastos e osteoblastos. Os primeiros são os responsáveis pela formação da dentina e, posteriormente, da polpa dentária. Adaptado de Thesleff, 2014.
4 ligeiros micromovimentos. O processo alveolar divide a cavidade oral em central e periférica, sendo que a primeira contém a língua e a segunda engloba lábios e bochechas (Zohrabian et al., 2015).
Nos primeiros anos de vida, desde os 6 meses de idade e até aos 2/3 anos, aproximadamente, ocorre a erupção da dentição decídua. Esta é caracterizada pela presença de 20 dentes no total (8 incisivos, 4 caninos e 8 molares), que vão sendo progressivamente substituídos por dentes permanentes. A dentição permanente, iniciada aos 6 anos e terminada na idade adulta, caracteriza-se pela presença de 32 dentes, onde 8 são incisivos, 4 são caninos, 8 são pré-molares e 12 são molares (Teixeira et al., 2008). A partir da linha média, os dentes são nomeados de incisivo central, incisivo lateral, canino, primeiro pré-molar, segundo pré-molar, primeiro molar, segundo molar e terceiro molar (figura 3) (Zohrabian et al., 2015).
Figura 2 – O dente é constituído por esmalte, dentina, polpa e
cemento, estando fixado no osso alveolar pelo ligamento periodontal. Adaptado de Teixeira et al., 2008.
5
1.3.
FUNÇÕES DOS DENTES
Os dentes possuem dois tipos de funções, a função ativa e as funções passivas. A função ativa principal é a mastigação, onde os alimentos são mecanicamente reduzidos a pedaços com dimensões mínimas para serem subsequentemente deglutidos. A mastigação engloba etapas como:
Apreensão – realizada pelos lábios e incisivos, acontece antes da mastigação e tem como objetivo de segurar os alimentos e enviá-los para a zona mais posterior da cavidade oral;
Incisão – realizada pelos incisivos, consiste em fragmentar os alimentos; Dilaceração - realizada pelos caninos, com o intuito de rasgar os
alimentos, tornando-os mais pequenos;
Trituração - realizada pelos pré-molares e molares, vão moer os alimentos e, juntamente com a saliva que os humedece, contribuir para a formação do bolo alimentar.
Figura 3 – Organização e nomenclatura dos dentes na cavidade
oral, a partir da linha média. Adaptado de Zohrabian et al., 2015.
Incisivo central Incisivo lateral Canino Primeiro pré-molar Segundo pré-molar Primeiro molar Segundo molar Terceiro molar Linha média
6 As funções passivas não estão relacionadas com a mastigação, e englobam:
Estética – os dentes podem estar dispostos de variadas formas, apresentar diferentes formatos e colorações e são importantes a moldar a face, principalmente os tecidos de suporte como os lábios;
Proteção e sustentação de tecidos moles relacionados – assegura a posição da língua, bochechas e lábios e a proteção da gengiva contra a mastigação;
Fonação – modulação dos sons emitidos;
Oclusão – alterações na posição e movimentação da mandíbula (Teixeira et al., 2008).
1.4.
PATOLOGIAS DENTÁRIAS
Podemos encontrar vários tipos de patologias dentárias, que podem afetar os tecidos mineralizados dos dentes, de forma mais superficial ou mais profunda. Ao nível do esmalte e dentina estão descritas patologias como a erosão dentária (Laudenbach & Simon, 2014) e a cárie dentária, que pode progredir e atingir a estrutura pulpar. Ao nível dos tecidos moles de suporte, doenças como a pericoronarite (Zohrabian et al., 2015), doença periapical e a doença periodontal, são as mais frequentes.
1.4.1. CÁRIE DENTÁRIA
A cárie dentária (figura 4) é uma doença infeciosa dependente da presença de açúcares refinados na dieta, provocando danos irreversíveis na estrutura dentária, é frequentemente associada à dor e, em casos mais graves, à perda do próprio dente (Laudenbach & Simon, 2014; Mitchell et al., 2014). As cáries decorrem da desmineralização do esmalte e da dentina, causadas pela diminuição do pH, que é provocada pelo ácido láctico produzido pelas bactérias que metabolizam os hidratos de carbono oriundos da dieta (Mitchell et al., 2014). As bactérias mais comumente implicadas são o Streptococcus mutans,
Streptococcus sobrinus, Lactobacillus e espécies de Actinomyces. Resumindo, para que haja
o desenvolvimento de cáries, os doentes têm que possuir colónias destas estirpes de bactérias, e fornecer-lhes substratos alimentares e um ambiente propicio para que sobrevivam e se multipliquem (Laudenbach & Simon, 2014).
7 Os dentes com lesões de cárie ativas apresentam descolorações sob a forma de pontos brancos, que representam a desmineralização do esmalte, ou cores escuras; sendo que as cáries apresentam uma coloração que vai da cor esbranquiçada à cor preta (figura 4) (Laudenbach & Simon, 2014). A existência de cavitação dentária, fraturas nos dentes, dor e/ou edema intraoral e facial são características que levam ao reconhecimento das cáries (Laudenbach & Simon, 2014). Estas podem ser classificadas como singulares ou múltiplas, e quando severas, podem estender-se à câmara pulpar, podendo proceder uma doença periapical ou periodontal (Scheinfeld et al., 2012).
Uma criança até aos 5 anos de idade pode desenvolver cáries por diversas razões, por exemplo, se a progenitora também as tiver, se for socioeconomicamente carenciada, se possuir uma alimentação rica açúcares (figura 5) ou se tiver registo clínico de defeitos no esmalte (muitas vezes com aspeto de pontos brancos) (Laudenbach & Simon, 2014).
A partir dos 6 anos de idade, as cáries podem ser causadas pelos motivos anteriormente descritos mas também por dieta cariogénica, quimioterapia, consumo abusivo de álcool ou drogas, distúrbios alimentares, incapacidade de implementar uma higiene oral adequada ou xerostomia (diminuição do fluxo salivar) (Laudenbach & Simon, 2014). A saliva, como tem pH alcalino e diversos sistemas tampão, neutraliza a descida do pH necessária para o desenvolvimento da lesão de cárie; quando há diminuição da produção salivar, aumenta a probabilidade do desenvolvimento de lesões de cárie (Mitchell et al., 2014).
Figura 4 – Dentes com cáries de coloração escura.
8
1.4.2. PATOLOGIAS PERIAPICAIS
As lesões de cárie, severas ou prolongadas, podem causar infeções dentárias quando se estendem ao longo da dentina até à camara pulpar, permitindo a introdução de microrganismos nos tecidos pulpares (figura 6) ((Laudenbach & Simon, 2014; Zohrabian & Abrahams, 2015). Como os dentes são constituídos por um sistema complexo de canais radiculares, com eventuais deltas apicais, canais acessórios e secundários, quando estas estruturas se encontram colonizadas, ocorre proliferação bacteriana (Laudenbach & Simon, 2014; Hargreaves & Berman, 2016). Dadas as características anatómicas de elevada complexidade dos canais pulpares, é muitas vezes difícil a sua desinfeção completa, permitindo muitas vezes que os microrganismos sobrevivam, quando alojados em locais inacessíveis à desinfeção (Hargreaves & Berman, 2016).
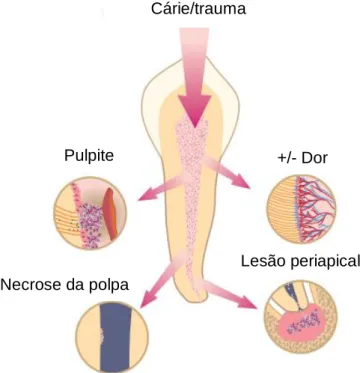
A invasão da camara pulpar pelos microrganismos conduz a uma inflamação da polpa, pulpite (figura 7), tornando-se irreversível se não for tratada. Quando não é tratada, a resposta inflamatória aumenta a pressão dentro do dente, conduzindo à necrose da polpa (figura 7) (Zohrabian & Abrahams, 2015).
Quando as bactérias, especialmente Gram-negativas, invadem os canais radiculares e libertam produtos tóxicos do seu metabolismo, induzem uma periodontite apical, caracterizada pela inflamação persistente dos tecidos periapicais, que pode culminar com a
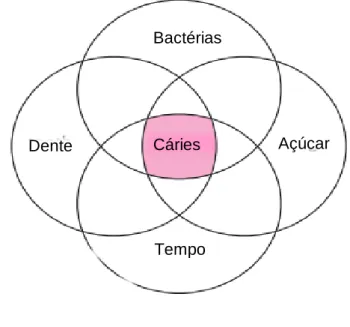
Bactérias
Açúcar
Tempo
Dente Cáries
Figura 5 – Interação dinâmica do processo de
desenvolvimento da cárie dentária. Adaptado de Mitchell et al., 2014.
9 destruição do osso alveolar (Page et al., 1997; Xiong et al., 2019; Zohrabian & Abrahams, 2015).
Figura 6 – As lesões de cárie extensas permitem a entrada de
bactérias na camara pulpar, contaminando a polpa e movimentando-se pelos canais radiculares, alojando-se nos tecidos periapicais. Adaptado de Zohrabian & Abrahams, 2015.
Cárie/trauma
+/- Dor
Lesão periapical Necrose da polpa
Pulpite
Figura 7 – Reações adversas da polpa à infeção
bacteriana/trauma: pulpite, dor, necrose da polpa e lesão periapical. Adaptado de Bergenholtz et al., 2010.
10
1.5.
TRATAMENTO ENDODÔNTICO
O termo endodontologia tem origem grega e significa “o conhecimento do que está dentro do dente”, ou seja, aborda o estudo das estruturas e processos que ocorrem dentro da câmara, dos canais pulpares e da polpa dentária (Bergenholtz et al., 2010).
Durante muitos anos, as pessoas tiveram que suportar as consequências das lesões inflamatórias da polpa e dos tecidos periapicais, até que em 1836, foi realizada a primeira desvitalização, utilizando arsênico - método que se manteve em prática durante uma centena de anos. No século XIX, iniciou-se a prática de remoção da polpa dentária sem a utilização de produtos químicos, e no século XX, a utilização generalizada da anestesia local, tornou a pulpectomia um processo indolor (Bergenholtz et al., 2010). Desenvolveram-se assim técnicas centradas na eliminação dos microrganismos e dos seus produtos da estrutura dentária, visando também prevenir a periodontite apical (Zaki et al., 2018). O seu sucesso depende de um diagnóstico correto acompanhado por um plano de tratamento e pela desinfeção adequada do sistema de canais radiculares e seu selamento (Khoshbin et al., 2018). A eliminação dos tecidos necróticos da polpa, dos microrganismos residuais e da
smear layer - termo que descreve os microfragmentos ou microdetritos produzidos durante a
instrumentação endodôntica - são os pré-requisitos para o sucesso do tratamento endodôntico. Esta camada favorece o aparecimento de microrganismos e limita o acesso das soluções de irrigação e de medicação intracanalar, aos túbulos dentinários. A sua eliminação aumenta o isolamento e a resistência contra a penetração bacteriana (Khoshbin et al., 2018).
O tratamento endodôntico pode então ser descrito em 3 fases, a fase de preparação do acesso ao interior do dente, a fase de preparação biomecânica do canal radicular e, por último, a fase do preenchimento da estrutura canalar (Jungnickel et al., 2018). É muito importante que a estrutura dentária lesada seja removida adequadamente para que seja alcançado com eficácia o canal radicular e para melhorar a qualidade e prognóstico do tratamento (Missau et al., 2017).
Podemos aferir que existem duas abordagens para o tratamento da polpa vital exposta. O capeamento pulpar (pulpotomia parcial) que é menos invasivo e tem como objetivo manter a vitalidade do dente. E o tratamento do canal radicular (pulpectomia) que é mais agressivo e implica a remoção da estrutura pulpar remanescente e a obturação do canal radicular (Broden et al., 2019).
A pulpotomia é um procedimento utilizado para amputar o tecido da polpa coronária dentária inflamada e infetada, sendo que normalmente este tratamento é realizado quando os tecidos da polpa coronária são expostos por cáries, durante a remoção de cáries
11 ou em caso de trauma. O seu objetivo é remover os tecidos inflamados – de localização superficial – assim como os microrganismos, para permitir a viabilidade do tecido pulpar remanescente, no canal radicular (Lin et al., 2014). Depois da amputação da polpa coronária, o tecido da polpa remanescente é coberto com um biomaterial adequado, visando a manutenção da vitalidade da polpa radicular (Olatosi et al., 2015).
Já a pulpectomia tem como objetivo a remoção dos tecidos da polpa infetados e dos microrganismos existentes, no sistema de canais (Newman et al., 2018). Para ser bem sucedida, devem ser atingidos os seguintes critérios: resolução dos sintomas clínicos pré-tratamento num prazo de duas semanas, o processo infecioso deve ser resolvido radiograficamente num prazo de seis semanas e, por último, não deve haver reabsorção patológica ou radiolucência apical (Tannure et al., 2011).
Se os grandes desafios da endodontia assentam na habilidade de induzir a deposição de material mineralizado, a existência de biocompatibilidade e a presença de propriedades antimicrobianas são características essenciais para os biomateriais utilizados nestas abordagens terapêuticas (Zaki at al., 2018). Assim, o encerramento do sistema de canais radiculares após a desinfeção e a modelagem é um dos elementos essenciais do tratamento endodôntico. Para isso existem diversos tipos de materiais usados para obturação em medicina dentária, são eles os materiais plásticos (guta-percha), sólidos ou com núcleos de metal (pontos de prata, cones revestidos, ouro, aço inoxidável, titânio e platina de irrídio – cada vez menos utilizados) e ainda as pastas e os cimentos (MTA, fosfato de cálcio, etc) que visam preencher os espaços residuais por entre os materiais plásticos ou sólidos (Bansode et al., 2018).
1.5.1. CIMENTOS
ENDODÓNTICOS
No âmbito desta dissertação iremos focar-nos nos cimentos endodônticos.
Estes cimentos têm como função preencher o espaço entre a parede do canal radicular e o material do núcleo do canal radicular, espaços por entre o material do núcleo, preenchendo também os vazios e irregularidades no canal radicular, canais laterais e acessórios, entre outros; podem ainda servir como lubrificantes durante o processo de obturação (Hargreaves & Berman, 2016; Donnermeyer et al., 2018). A eliminação destes espaços é um aspeto determinante na prevenção da reinfeção do canal radicular, cuja causa é o crescimento de microrganismos por infiltração. O selamento do sistema de canais radiculares estabelecido pelo cimento endodôntico é um aspeto fundamental na avaliação das propriedades clínicas dos diferentes cimentos (Donnermeyer et al., 2018).
12 Os cimentos ou seladores do canal radicular devem ser biologicamente compatíveis, devem prevenir a infeção e permitir a cicatrização periapical. Devem suportar e acelerar a reparação dos tecidos periradiculares remanescentes. As suas propriedades devem permitir a reparação histológica dos tecidos periapicais, depois do tratamento, sem o desenvolvimento de quaisquer reações adversas. Estas reações incluem alterações inflamatórias, carcinogénicas, de toxicidade ou alergia (Zaki at al., 2018).
Para serem considerados um “cimento ideal”, estes materiais deverão apresentar as seguintes propriedades:
ser viscoso quando misturado, de maneira a estabelecer uma boa adesão com a parede do canal;
estabelecer um selamento hermético;
ser radiopaco, para ser identificado radiograficamente; permitir uma fácil mistura e preparação;
ter um tempo de trabalho adequado ao procedimento clínico; não contrair durante o endurecimento;
não pigmentar;
ser bacteriostático ou bactericida; ser insolúvel nos fluídos biológicos;
não provocar respostas adversas nos tecidos periradiculares; promover uma cicatrização adequada dos tecidos biológicos;
ser solúvel num solvente comum (no caso de ser necessário removê-lo) (Hargreaves & Berman, 2016).
No entanto, nenhum material apresenta todas as características desejáveis, por isso vão sendo feitas melhorias ao nível das propriedades físicas, químicas e biológicas, para o desenvolvimento de novos cimentos endodônticos (Almeida et al., 2018).
1.5.1.1.
TIPOS DE CIMENTOS ENDODÔNTICOS
Muitos cimentos com diferentes propriedades estão disponíveis no mercado (Khoshbin et al., 2018). Ao longo da história e até aos dias de hoje, muitos são os materiais utilizados como cimentos endodônticos, sendo eles essencialmente à base de:
a) óxido de zinco-eugenol (ZOE); b) hidróxido de cálcio;
13
c) ionómero de vidro; d) resina;
e) silicone;
f) biocerâmica (Savadkouhi & Fazlyab, 2016).
Mais detalhadamente, são eles:
a) Óxido de zinco-eugenol
Os cimentos de óxido de zinco- eugenol existem há muitos anos e são caracterizados por possuírem um histórico de sucesso clínico elevado devido, por exemplo, à sua atividade antimicrobiana face a Enterococcus faecalis e a bactérias anaeróbias (Bergenholtz et al., 2010; Hargreaves & Berman, 2016; Savadkouhi & Fazlyab, 2016). Estes são também cimentos facilmente absorvidos pelos tecidos periradiculares, o que limita a sua utilização a longo prazo (Hargreaves & Berman, 2016). Adicionalmente, comparados com outros cimentos endodônticos mais recentes, apresentam uma menor capacidade de selamento e propriedades biológicas inferiores. Este tipo de cimentos possui ainda uma toxicidade local moderada (Bergenholtz et al., 2010).
São exemplos de cimentos à base de óxido de zinco-eugenol o Pulp Canal Sealer® e o TubliSeal® (Savadkouhi & Fazlyab, 2016).
b) Hidróxido de cálcio
Relativamente aos seladores à base de hidróxido de cálcio, foram desenvolvidos para atividade terapêutica devido às suas propriedades antibacterianas e à capacidade de formarem uma barreira calcificada (Mitchell et al., 2014; Hargreaves & Berman, 2016) . São dos poucos materiais que suportam a cicatrização apical e a formação dos tecidos duros. Não há muitos relatos sobre efeitos tóxicos, alergénios ou mutagénicos, mas sabe-se que possuem uma baixa citotoxicidade (Bergenholtz et al., 2010).
São exemplos destes materiais à base de hidróxido de cálcio o Sealapex® e o Apexit®, definidos pela sua atividade antimicrobiana (Savadkouhi & Fazlyab, 2016).
14
c) Ionómero de vidro
Os materiais à base de ionómero de vidro são utilizados pelas suas propriedades de ligação à dentina, por exemplo, o Ketac-Endo® é recomendado devido à sua adesão à parede do canal radicular, por que causa uma obturação em monobloco (Hargreaves & Berman, 2016; Savadkouhi & Fazlyab, 2016). São materiais de difícil remoção, em caso de necessidade.
d) Resinas
Caracterizam-se pelas suas propriedades mecânicas e de adesão à dentina e apresentam um perfil adequado de reações adversas. Possuem boas propriedades antimicrobianas e baixa citotoxicidade (Bergenholtz et al., 2010).
O AH-Plus®, MetaSeal® e RealSeal® são alguns dos cimentos à base de resinas, e não possuem eugenol na sua composição, possuindo uma boa adesão ao canal radicular (Savadkouhi & Fazlyab, 2016).
e) Silicone
Introduzido como base para cimentos endodônticos em 1984, quando comparado com outros, originam cimentos menos fluídos, logo com pouco risco de extravasamento e baixa risco de toxicidade. Contudo, não apresenta atividade antimicrobiana (Bergenholtz et al., 2010).
Temos como exemplo o RoekoSeal®, que é polidimetilsiloxano e apresenta a característica única de ligeira expansão durante a polimerização, ao contrário da generalidade dos cimentos que apresentam características de expansão (Savadkouhi & Fazlyab, 2016).
f) Biocerâmicos
Os cimentos à base de silicato de cálcio, como o agregado de trióxido mineral (MTA) são utilizados na tentativa de combinar propriedades biológicas e de isolamento em várias aplicações clínicas, como o recobrimento pulpar, pulpotomia, reparo de perfuração radicular ou da reabsorção interna/externa (Rathinam et al., 2016; Almeida et al., 2018).
A hidratação dos cimentos de silicato de cálcio (MTA) e o seu contato com o fosfato (proveniente dos fluídos dos tecidos) conduz à precipitação de fosfato de cálcio ou
15 carbonato de cálcio, na superfície do material. A interação entre o fosfato e o cimento de silicato de cálcio forma hidroxiapatite na sua superfície, tornando-se a razão para o potencial bioativo dos materiais e cimentos de silicato dicálcico e tricálcico. Forma-se, pelo silicato de cálcio, uma camada interfacial na parede dentária. Os efeitos cáusticos alcalinos dos produtos de hidratação do cimento de silicato de cálcio degradam o colagénio da dentina interfacial, conduzindo à formação de uma estrutura porosa que facilita a permeabilização de elevadas concentrações de iões de Ca2+, OH- e de CO
32-, levando ao aumento da mineralização nesta região (Donnermeyer et al., 2018).
São exemplos destes cimentos o MTA Fillapex®, iRoot SP® e o MTA Plus®, (Savadkouhi & Fazlyab, 2016).
1.5.1.2. PROPRIEDADES ANTIMICROBIANAS E OSTEOGÉNESE DOS
CIMENTOS ENDODÔNTICOS
Como já referido, o sucesso do tratamento endodôntico depende da eliminação de microrganismos patogénicos, localizados na região pulpar infetada. Por isso, os cimentos endodônticos que proporcionam um bom selamento e uma boa atividade antimicrobiana são os mais desejados (Kayaoglu et al., 2005). Sabemos que alguns cimentos endodônticos possuem propriedades antimicrobianas, por exemplo, uma mistura de óxido de zinco com óleo de tomilho demostrou ter uma forte atividade antibacteriana contra todos os microrganismos presentes no canal radicular do dente (Thosar et al., 2018). É também o caso do AH Plus, que se mostrou eficaz na redução de microrganismos, nomeadamente de E. faecalis – um agente patogénico comum na patologia pulpar (Kayaoglu et al., 2005).
Geralmente estas propriedades antimicrobianas são de curta duração, não ultrapassando os sete dias, tornando-se clinicamente insuficientes para uma proteção eficaz contra infeções bacterianas persistentes, sendo necessário melhorar estas propriedades incorporando, por exemplo, agentes antimicrobianos como a clorexidina, cloreto de cetilpiridínio ou cloreto benzalcónio (Gjorgievska et al., 2017).
Relativamente à osteogénese, há também alguns cimentos que a induzem, como os cimentos de hidróxido de cálcio que podem induzir a formação de uma barreira calcificada, pois o seu grupo hidroxilo fornece um ambiente alcalino que vai estimular a calcificação. Este pH neutraliza o ácido lático dos osteoclastos e ativa a fosfatase alcalina, sendo esta muito importante na formação dos tecidos duros (Mohammadi & Dummer, 2011). Cimentos à base
16 de silicato de cálcio também são capazes de desencadear uma resposta celular favorável na diferenciação osteoblástica, odontoclástica e na regeneração periodontal (Rathinam et al., 2016). Também os cimentos à base de fosfato de cálcio, quando implantados, apresentam propriedades adequados para a reação celular e colonização de osteoblastos, conduzindo à osteocondução, conduzindo o crescimento ósseo e promovendo a ligação ao biomaterial implantado (Chow, 2000). Este tipo de cimento foi aprovado pela Food and Drug
Administration (FDA), em 1996, para uso clínico na reparação de defeitos craniofaciais em
humanos (Moreau & Hockin, 2019). Nos cimentos à base de biocerâmicos temos o MTA, que liberta Ca2+ que vai aumentar a viabilidade osteoblástica, a proliferação e diferenciação celular, e liberta também, grupos OH- que inibem o crescimento bacteriano, modulando o pH do microambiente (Maeno et al., 2005; Dawood et al., 2017).
1.5.1.3. VANTAGENS E DESVANTAGENS DOS CIMENTOS ENDODÔNTICOS
São seguidamente descritas, na tabela 1, algumas das vantagens e desvantagens específicas de cada tipo de biomateriais utilizados como cimentos endodônticos. Podemos observar na tabela 1 que os cimentos à base de resina epóxi caracterizam-se pela ausência de eugenol, sendo que o cimento AH 26 tem como desvantagem a descoloração do esmalte. No caso dos materiais à base de hidróxido de cálcio, estes apresentam como vantagens a capacidade de esterilização e a estimulação da formação de tecido mineralizado. Aferimos também que os cimentos à base de silicato de cálcio apresentam uma elevada osteo-condutividade, biocompatibilidade e bioatividade. E que outros cimentos biocerâmicos, como o iROOT SP, possuem boa adesão à dentina, sendo por outro lado, de difícil remoção. O óxido de zinco/eugenol (ZOE), um dos cimentos endodônticos mais antigos e mais utilizados, possui uma excelente atividade antimicrobiana como vantagem, mas apresenta inúmeras desvantagens como a descoloração dentária e o risco de citotoxicidade. Os cimentos com base de ionómero de vidro são tecnicamente menos exigentes e de difícil remoção.
As vantagens descritas pelos fabricantes de cada categoria de cimentos não são baseadas em evidências com ensaios clínicos, verificando-se ainda uma reduzida evidência científica na avaliação e caracterização do desempenho biológico destes materiais. Todos os cimentos endodônticos apresentam toxicidade, independentemente do tipo de material escolhido, deve por isso ser evitada a sua colocação nos tecidos periradiculares (Hargreaves & Berman, 2016).
17
Tabela 1 - Vantagens e desvantagens de alguns cimentos endodônticos
Tipo de
Cimento Cimento Vantagens Desvantagens
Resina epóxi
AH Plus
Elevadas forças de adesão à dentina (Chen et al., 2018),
x Fácil remoção (Chen et al., 2018),
Facilmente penetra em canais colaterais e túbulos dentinários (Chen et al., 2018)
AH 26 X
Severa descoloração das estruturas dentárias (Zarei et
al., 2017) Geral Livre de eugenol (Savadkouhi & Fazlyab, 2016) x
Hidróxido de
cálcio Geral
Capacidade de alcalinidade e esterilização (Chen et al., 2018),
x Estimula a formação de tecido mineralizado (Chen et al.,
2018),
Forte adesão à dentina (Chen et al., 2018)
Biocerâmica
iROOT SP
Propriedades fisio-biológicas favoráveis (Chen et al., 2018),
Remoção difícil (Chen et al., 2018)
Excelente biocompatibilidade e bioatividade (Chen et al., 2018),
Adere fortemente à dentina intracanal (Chen et al., 2018) Silicato de
cálcio (MTA)
Elevada osteo-condutividade (Jafari et al., 2017),
x Biocompatibilidade e bioatividade (Jafari et al., 2017)
Óxido de zinco e eugenol
(ZOE)
Geral Atividade antimicrobiana profunda (Zarei et al., 2017)
Descoloração dentária (Zarei et al., 2017),
Efeitos citotóxico (Markowitz et al., 1992),
Reabsorção nos tecidos periradiculares após a extrusão (Savadkouhi &
Fazlyab, 2016), Contração durante o
endurecimento, Secagem lenta (Savadkouhi
& Fazlyab, 2016), Descoloração dentária (Savadkouhi & Fazlyab, 2016) Nano-sized
ZOE powder particles
(NZOE)
Citocompatibilidade (Zarei et al., 2017), Atividade antibacteriana
com capacidade de obturação satisfatória (Zarei et al., 2017)
x
Ionómero de vidro
Ketac-endo
Ligação química à dentina (Lee et al., 1997),
x Altamente resistente à
reabsorção por fluidos tecidulares (Lee et al., 1997)
Geral
Fornece suporte físico para resistir a fraturas radiculares
(Lee et al., 1997), Difícil de remover (Savadkouhi & Fazlyab, 2016) Tecnicamente menos exigente (Lee et al., 1997)
18
1.6.
ENSAIOS DE AVALIAÇÃO DO COMPORTAMENTO BIOLÓGICO DE
CIMENTOS ENDODÓNTICOS
1.6.1. ESTUDOS IN VITRO
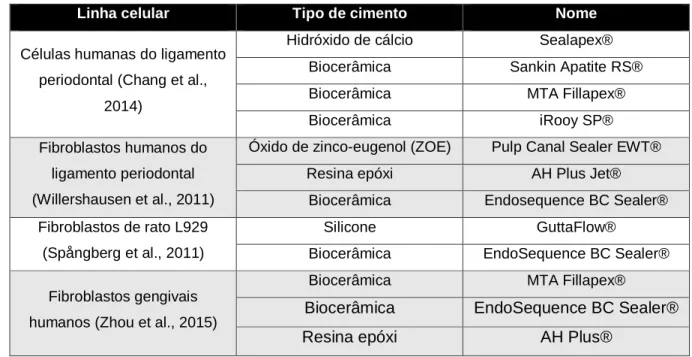
Na literatura, encontramos diversos estudos de caracterização biológica in vitro de cimentos endodônticos destacando-se, na tabela 2, alguns destes trabalhos com distintos cimentos. Em alguns destes ensaios são estabelecidos sistemas de culturas de células, como fibroblastos da gengiva humana, aos quais são posteriormente adicionados os cimentos endodônticos em avaliação, para caracterização da sua citotoxicidade (Zhou et al., 2015). Outro exemplo, assenta na comparação de 4 cimentos distintos, relativamente à viabilidade celular, ativação inflamatória e potencial osteogénico de células do ligamento periodontal humano (Chang et al., 2014).
Tabela 2 - Ensaios de avaliação do comportamento biológico de cimentos endodônticos in vitro.
Linha celular Tipo de cimento Nome
Células humanas do ligamento periodontal (Chang et al.,
2014)
Hidróxido de cálcio Sealapex® Biocerâmica Sankin Apatite RS® Biocerâmica MTA Fillapex®
Biocerâmica iRooy SP®
Fibroblastos humanos do ligamento periodontal (Willershausen et al., 2011)
Óxido de zinco-eugenol (ZOE) Pulp Canal Sealer EWT® Resina epóxi AH Plus Jet®
Biocerâmica Endosequence BC Sealer® Fibroblastos de rato L929
(Spångberg et al., 2011)
Silicone GuttaFlow®
Biocerâmica EndoSequence BC Sealer® Fibroblastos gengivais
humanos (Zhou et al., 2015)
Biocerâmica MTA Fillapex®
Biocerâmica EndoSequence BC Sealer®
Resina epóxi AH Plus®
Podemos verificar que os cimentos à base de biocerâmicos são os mais testados, seguidos pelos cimentos de resina epóxi. Tal facto dever-se-á à sua mais recente introdução no mercado, e a um menor conhecimento da sua resposta biológica em utilização clínica.
Apesar da sua conhecida eficiência seria importante, quando possível, validar os ensaios in vitro com ensaios in vivo, da mesma natureza (Anderson, 2016).
19
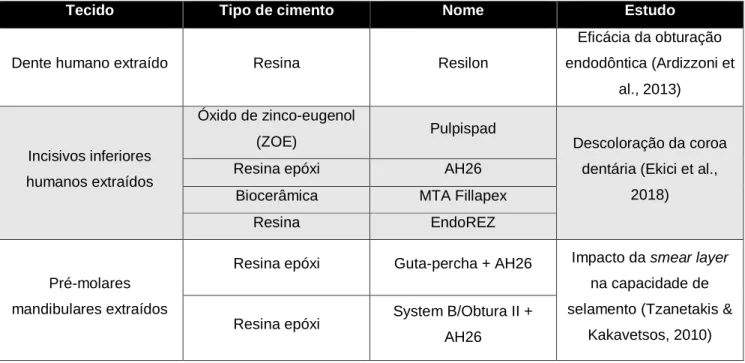
1.6.2. ESTUDOS EX VIVO
Os ensaios ex vivo podem ser utilizados para complementar os dados recolhidos dos ensaios in vitro, relativos à atividade biológica dos cimentos endodônticos, recorrendo à utilização de sistemas mais complexos que melhor mimetizam a aplicação clínica (tabela 3). Por exemplo, estuda-se a eficácia destes materiais, em dentes extraídos de pacientes com problemas periodontais, realizando-se uma coronectomia e introduzindo os cimentos endodônticos (Ardizzoni et al., 2013). Estes estudos são também utilizados para avaliação da descoloração da coroa dentária, onde são selecionados diversos tipos de dentes que são preenchidos com os cimentos (Ekici et al., 2018).
Tabela 3 - Ensaios de avaliação do comportamento biológico de cimentos endodônticos – modelos ex
vivo.
Tecido Tipo de cimento Nome Estudo
Dente humano extraído Resina Resilon
Eficácia da obturação endodôntica (Ardizzoni et al., 2013) Incisivos inferiores humanos extraídos Óxido de zinco-eugenol
(ZOE) Pulpispad Descoloração da coroa dentária (Ekici et al.,
2018)
Resina epóxi AH26
Biocerâmica MTA Fillapex
Resina EndoREZ
Pré-molares mandibulares extraídos
Resina epóxi Guta-percha + AH26 Impacto da smear layer na capacidade de selamento (Tzanetakis &
Kakavetsos, 2010) Resina epóxi System B/Obtura II +
AH26
Verifica-se pela análise da literatura, que neste tipo de ensaios, os tipos de cimentos mais caracterizados são os cimentos de resina epóxi.
20
1.6.3. ESTUDOS IN VIVO
Nos ensaios de caracterização biológica in vivo, os modelos animais mais utilizados são ratos, ratazanas e cães, e têm desempenhado um papel crucial em muitos aspetos da pesquisa científica (Valdes et al., 2002; Smith et al., 2013). O progresso na medicina regenerativa tem beneficiado dos modelos animais, por exemplo, no desenvolvimento de novas terapias clínicas (Smith et al., 2013).
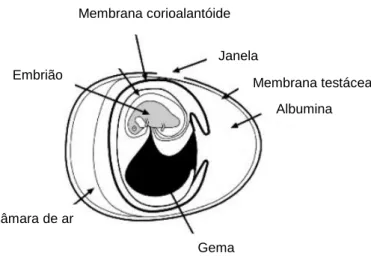
Um dos modelos mais utilizados é o ensaio de avaliação de irritação na membrana corioalantóide (CAM) do embrião de galinha (figura 8), onde são colocados os objetos em estudo diretamente em contato com os vasos sanguíneos desta membrana (Ribatti et al., 1987). Este teste permite uma avaliação rápida, simples e económica das reações do tecido a materiais implantados, sendo caracterizadas, de forma semi-quantitativa, as alterações vasculares verificadas na CAM (Valdes et al., 2002).
Há também outros tipos de ensaios (tabela 4), por exemplo, estudos dos cimentos endodônticos para perceber quais as suas influências na cicatrização de lesões periapicais crónicas (Borlina & Souza, 2010).
Membrana corioalantóide Membrana da casca Janela Albumina Gema Embrião
Figura 8 – Representação esquemática da CAM no interior de um ovo de galinha
fecundado.. Adaptado de Valdes et al., 2001.
Câmara de ar
21
Tabela 4 - Ensaios de avaliação do comportamento biológico de cimentos endodônticos in vivo
Tecido Tipo de cimento Nome Nome Estudo
Canais radiculares dos pré-molares superiores de
cães
Hidróxido de cálcio Guta-percha + Apexit
Avaliação comparativa da cura periapical (Zaki et al., 2018) Silicato de cálcio Gutta-percha +
I-Root SP Canais radiculares dos
incisivos superiores, molares superiores e
pré-molares inferiores de cães adultos
Hidróxido de cálcio Sealer 26
Influência do cimento endodôntico na cicatrização de
lesões periapicais crônicas (Borlina & Souza, 2010) Óxido de
zinco-eugenol (ZOE) Endomethasone
Neste caso, os cimentos mais estudados são os cimentos de hidróxido de cálcio.
Os modelos in vivo apresentam algumas desvantagens, são dispendiosos, altamente complexos e acarretam problemas éticos, valorizando assim o desenvolvimento de sistemas alternativos, como os modelos ex vivo (Smith et al., 2013).
22
2. OBJETIVO E ESTRUTURA
O objetivo geral desta dissertação assenta na caracterização da resposta biológica de cimentos endodônticos à base de silicato de cálcio, recorrendo a modelos in vivo e ex vivo, caracterizando a toxicidade e o potencial de modelação osteogénica destes cimentos.
O trabalho encontra-se dividido em duas partes. Na primeira, é realizado um ensaio de toxicidade aos diferentes cimentos endodônticos, com testes de irritabilidade num modelo in vivo, após a implantação de cimentos na membrana corioalantóide (CAM) do embrião de galinha. Na segunda parte é avaliada a resposta biológica de fémures de embrião de galinha, desenvolvidos num modelo ex vivo, em contacto com os cimentos endodônticos MTA + e MTA Fillapex. É detalhada a estrutura histológica destes fémures, bem como caracterizada a expressão de alguns genes específicos.
Pretende-se assim uma abordagem alargada à caracterização biológica dos cimentos endodônticos, recorrendo a ensaios in vivo e ex vivo, procurando identificar os biomateriais com melhor desempenho para aumentar o sucesso dos tratamentos em clínica humana.
23
3.
METODOLOGIA EXPERIMENTAL
3.1.
PREPARAÇÃO DOS CIMENTOS ENDODÔNTICOS
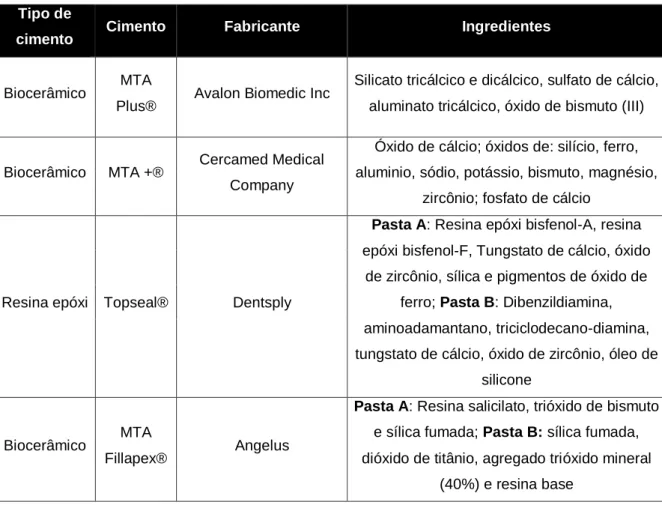
Neste estudo foram avaliados quatro cimentos endodônticos, cujos ingredientes estão descritos na tabela 5, habitualmente utilizados na prática clínica endodôntica, em intervenções médico-dentárias:
I. MTA Plus (Prevest DenPro), II. MTA + (Cerkamed),
III. TopSeal (Dentsply), IV. MTA Fillapex (Angelus).
Tabela 5 - Tipos, fabricantes e ingredientes dos cimentos em estudo.
Tipo de
cimento Cimento Fabricante Ingredientes
Biocerâmico MTA
Plus® Avalon Biomedic Inc
Silicato tricálcico e dicálcico, sulfato de cálcio, aluminato tricálcico, óxido de bismuto (III)
Biocerâmico MTA +® Cercamed Medical Company
Óxido de cálcio; óxidos de: silício, ferro, aluminio, sódio, potássio, bismuto, magnésio,
zircônio; fosfato de cálcio
Resina epóxi Topseal® Dentsply
Pasta A: Resina epóxi bisfenol-A, resina
epóxi bisfenol-F, Tungstato de cálcio, óxido de zircônio, sílica e pigmentos de óxido de
ferro; Pasta B: Dibenzildiamina, aminoadamantano, triciclodecano-diamina, tungstato de cálcio, óxido de zircônio, óleo de
silicone
Biocerâmico MTA
Fillapex® Angelus
Pasta A: Resina salicilato, trióxido de bismuto
e sílica fumada; Pasta B: sílica fumada, dióxido de titânio, agregado trióxido mineral
(40%) e resina base
Os cimentos foram preparados de acordo com as respetivas instruções dos fabricantes.
24 Resumidamente, os cimentos MTA + e MTA Plus, compostos principalmente por silicato dicálcico e tricálcico, originam um preparado através da mistura do pó com a água, originando um gel coloidal pegajoso que, posteriormente, solidifica (Dawood et al., 2017). No caso do TopSeal e do MTA Fillapex foram misturadas as 2 pastas até à obtenção de uma pasta uniforme.
Para cada ensaio experimental, os cimentos foram preparados a fresco. Para o ensaio de toxicidade foi utilizada uma quantidade correspondente a 250 µL de cimento, colocado em contacto direto com a CAM, imediatamente após a sua manipulação. No ensaio de avaliação da modulação osteogénica foram utilizados 750 µL de cimento, distribuídos uniformemente no fundo do poço da placa de cultura (placa de 6 poços), deixando-se endurecer à temperatura ambiente (Mestieri et al., 2015). Procedeu-se depois à sua esterilização, com radiação ultravioleta (UV), durante 25 minutos. Depois de esterilizados, foram colocados os inserts juntamente com os fémures, adicionando-se também 750µL de meio de cultura suplementado, como descrito pormenorizadamente nas secções seguintes.
3.2.
PROTOCOLO EXPERIMENTAL
Nesta dissertação, o trabalho experimental foi dividido em duas partes, recorrendo à utilização do embrião de galinha como modelo. Na primeira parte, foi realizado um ensaio de toxicidade/irritabilidade na membrana corioalantóide do próprio embrião, onde foi avaliada a potencial toxicidade dos cimentos endodônticos (Figura 9 – parte superior). Na segunda, utilizaram-se os fémures recolhidos dos embriões, para avaliação do potencial efeito dos cimentos na modulação osteogénica, recorrendo à cultura dos fémures, em inserts, por metodologias ex vivo (Figura 9 – parte inferior).
25
3.3.
ENSAIO DE IRRITAÇÃO/TOXICIDADE
Os testes de irritação foram realizados através de um ensaio in vivo na membrana corioalantóide (CAM), de acordo com as diretrizes do Comité de Coordenação Interinstitucional sobre a Validação de Métodos Alternativos (Costa et al., 2016).
Os ovos de galinha fertilizados foram incubados a 37ºC, com 60% de humidade e rotação periódica (Costa et al., 2016). Após 8 dias de incubação, a casca do ovo foi desinfetada com etanol a 70º e realizou-se uma abertura circular na região da câmara de ar
Figura 9 - Esquema geral da metodologia experimental – Parte superior - colocação dos
cimentos em contato com a membrana corioalantóide, para a realização dos testes de irritabilidade. Parte inferior – recolha dos fémures do embrião de galinha e colocação dos cimentos endodônticos – avaliação por histologia e expressão génica.
Colocação dos
cimentos Testes de irritabilidade
Fixados em formaldeído tamponado 10% durante 4 dias
26 associada à CAM. De seguida, irrigou-se com soro fisiológico a membrana interna e procedeu-se à sua remoção, com o auxílio de uma pinça, expondo a CAM (figura 10A). Na CAM de cada ovo os cimentos em estudo foram colocados diretamente (um tipo de cimento em cada ovo) (figura 10B). Ao fim de 0,5 ,2 e 5 minutos foram recolhidas imagens, com o auxílio de uma lupa binocular (Lan Optics), para avaliar visualmente alterações vasculares da CAM, sugestivas de alterações de irritação/toxicidade (figura 10C).
(Wilson et al., 2015)
No final, a toxicidade pode ser exibida de diferentes maneiras, são elas:
Hemorragia – sangramento dos vasos sanguíneos da CAM. Pode ser localizada, existindo vários pontos de sangramento, ou difusa, sangramento de toda a CAM (figura 11A);
Lise – dano na estrutura do vaso, podendo levar ao seu desaparecimento (se houver desintegração da parede do vaso) ou ao ganho de uma tonalidade branca (impossibilidade de visualização da circulação sanguínea) (figura 11B);
Coagulação – diminuição do fluxo sanguíneo nos vasos ou ausência do mesmo, originando uma trombose (figura 11C)(Eichenbaum et al., 2013).
Figura 10 – A: abertura do ovo e exposição da CAM, B: substância a
testar colocada na superfície da CAM, C: avaliação de sinais de hemorragia, coagulação ou rebentamento de vasos sanguíneos. Adaptado de Wilson et al., 2015.
27
Figura 11 – Representação da toxicidade por hemorragia (A), lise (B) ou coagulação (C), adaptado de
Eichenbaum et al., 2013.
3.4.
ENSAIO DE MODULAÇÃO OSTEOGÉNICA
Este ensaio foi realizado ex vivo, em fémures recolhidos de embriões de galinha após 11 dias de desenvolvimento embrionário. Até este período os ovos fecundados foram mantidos numa incubadora com rotação periódica, a 37ºC e com 50 % de humidade (Moreno-Jimenez et al., 2017).
Depois da incubação, procedeu-se à recolha dos fémures, após eutanásia dos embriões, em condições de assepsia. Com o auxílio de uma gaze estéril retirou-se todo o tecido mole (músculos e ligamentos) que envolve a cartilagem, até se conseguirem identificar as partes constituintes do membro posterior do embrião de galinha, a tíbia e o fémur. Procedeu-se, por fim, ao isolamento e recolha do fémur (figura 12) (Kim et al., 2014).
Os fémures foram dispostos, paralelamente, em inserts (NetwellTM Insert, malha de poliéster com 440 µm, Corning®) – 2 fémures por insert (figura 13A) e colocados na placa de cultura com o fundo dos poços revestido pelos cimentos, como anteriormente descrito (figura 13B). Para permitir o crescimento dos fémures na interface ar/líquido, a cada poço de cultura foram adicionados 750 µL de meio de cultura α-MEM (Minimum Essential Medium
Figura 12 - Fémur recolhido do embrião de galinha.
A
B
C
28
Eagle - alpha modification) suplementado com estreptomicina (100 µg/mL), penicilina (100
µg/mL), ácido ascórbico (50 µg/mL) e anfotericina B (2.5 µg /mL) (todos, reagentes da Gibco®). As placas com os fémures foram depois colocadas na estufa a 37ºC com uma atmosfera húmida com 5% de CO2 em ar, durante 11 dias. O meio de cultura foi trocado diariamente (Kanczler et al., 2012).
3.5.
HISTOLOGIA
Após os 10 dias de cultura, na presença dos cimentos endodônticos, os fémures foram lavados com PBS Aldrich) e fixados em formaldeído tamponado 10% (Sigma-Aldrich) durante 4 dias. Posteriormente, procedeu-se à inclusão dos fémures, em parafina, num processo otimizado que engloba desidratar, clarificar e impregnar as amostras com parafina, realizado por um processador de tecidos automático (Thermo scientific micron STP120) (figura 14). Após inclusão realizaram-se cortes histológicos de 4 µm de espessura com o auxílio de um micrótomo (Thermo scientific micron HM 335E) (figura 15) (Nganvongpanit et al., 2015).
Figura 13 - A: insert e B: placa de 6 poços
B
A
29 Depois da fixação, os cortes histológicos foram submetidos à coloração diferencial
Alcian Blue/Sirius Red para corar, respetivamente, de azul os tecidos ricos em proteoglicanos
(cartilagem) e de vermelho os tecidos ricos em colagénio (tecido ósseo) (figura 16)(Aldahmash & Vishnubalaji, 2017).
Figura 14 - Processador de tecidos automático.
Figura 15 - Micrótomo automático.
Figura 16 - Corte histológico de fémures de embrião de galinha com a coloração
30
3.6.
EXTRAÇÃO DE RNA COM TRIZOL
Alguns fémures foram reservados para a caracterização da expressão génica, após extração de RNA e realização de PCR em tempo real. O processo de extração do RNA iniciou-se com a maceração do fémur e com a adição do trizol, terminando com a obtenção do RNA do fémur (figura 17).
Figura 17 – Esquema da extração de RNA com trizol: inicia-se com a extração do fémur de embrião
de galinha, seguido pela adição de trizol, clorofórmio, agitação da amostra, centrifugação da mesma, visualização da fase aquosa e transferência da mesma para um eppendorf para ser novamente centrifugada; é descartado o sobrenadante e adiciona-se álcool a 75% gelado, é centrifugada a amostra e descarta-se o álcool deixando secar. Finalmente é adicionada a água DEPC (água ultra pura livre de endonucleases), obtendo-se uma solução de RNA.
31 No primeiro passo, fezse a maceração dos fémures que estavam congelados a -80ºC, verteu-se azoto líquido num almofariz onde foi depois colocado o fémur para ser macerado até à obtenção de um pó; já na hotte foi adicionado 1mL de trizol (Invitrogen).
No segundo passo, a extração de RNA desenvolveu-se com a homogeneização das amostras com movimentos de pipetagem. Acrescentaram-se às amostras 300µL de clorofórmio (Merck®) gelado, e agitou-se a amostra vigorosamente por 15 segundos. Foram depois centrifugadas (Sigma 2-16 PK) durante 15 minutos a 12000 rpm e a 4ºC. No final visualizaram-se três fases no eppendorf: a fase aquosa (RNA total), a fase intermediária (DNA) e a fase orgânica (proteínas). A parte aquosa foi transferida para um novo eppendorf e após 10 minutos à temperatura ambiente, as amostras foram centrifugadas novamente durante 15 minutos a 12000 rpm e a 4ºC, onde foi possível obter um precipitado no fundo do eppendorf. Descartou-se o sobrenadante e acrescentou-se 1mL de álcool a 75º, gelado. As amostras foram centrifugadas a 8400 rpm e a 4ºC, posteriormente o álcool foi descartado, mantendo-se o precipitado. Durante 25 minutos o eppendorf esteve aberto para que o álcool evaporasse e o precipitado ficasse seco. Por último, adicionaram-se 20µL de água DEPC (Invitrogen) (livre de RNAses), para ressuspender o pellet com movimentos de pipetagem (Le Bleu et al., 2017).
3.6.1. QUANTIFICAÇÃO DO RNA
Procedeu-se, seguidamente, à quantificação e avaliação da qualidade do RNA, (figura 17).
Figura 18 - Esquema da quantificação e avaliação da qualidade do RNA: na placa de leitura coloca-se
água DEPC (branco) e as diferentes amostras; a placa é depois colocada no Nanodrop® para ser determinada a absorvância a 260 e 280 nm.