“Efeitos Biológicos de produtos usados em Talassoterapia:
Estudos in vitro e in vivo”
– Versão Definitiva –
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
João Manuel Felisberto Borges
Orientadora: Professora Doutora Isabel O' Neill de Mascarenhas Gaivão
Coorientador: Dr. António Lúcio Baptista
“Efeitos Biológicos de produtos usados em Talassoterapia:
Estudos in vitro e in vivo”
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
João Manuel Felisberto Borges
Orientadora: Professora Doutora Isabel O' Neill de Mascarenhas Gaivão
Coorientador: Dr. António Lúcio Baptista
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde, submetida à Universidade de Trás-os-Montes e Alto Douro, para cumprimento dos requisitos necessários à atribuição do grau de Mestre, elaborada sob a orientação da Professora Doutora Isabel O’Neill De Mascarenhas Gaivão e Dr. António Lúcio Baptista.
“A terra é toda vida E o mar é todo o Amor. No mar está escondida Uma força maior que a vida:
A terra é criatura, e o mar é criador.” (Eduardo Marquina)
A concretização desta dissertação de mestrado só foi possível com a colaboração inestimável de muitas pessoas, sem as quais não seria possível desenvolver todo o meu trabalho realizado, passando a agradecer:
À Universidade de Trás-os-Montes e Alto Douro em nome do Professor Doutor António Augusto Fontaínhas Fernandes, Reitor da UTAD, pelas facilidades concedidas na realização deste trabalho;
Ao Departamento de Genética e Biotecnologia, da UTAD, pela cedência dos espaços para a realização e execução da dissertação;
À Coordenadora do Mestrado em Biotecnologia para as Ciências da Saúde, Professora Doutora Paula Filomena Martins Lopes;
À Professora Doutora Isabel Gaivão, minha orientadora, não só pela oportunidade que me deu, mas também por todo o apoio, disponibilidade, orientação e amizade que me deu para elaboração da minha tese de mestrado, bem como a cuidada correção da mesma. Um muito Obrigado;
Ao Doutor António Lúcio Baptista, meu Coorientador, expresso também os meus agradecimentos pela oportunidade concedida e pela clarificação dos novos rumos da ciência médica;
À Doutora Maria do Rosário Pinto Leite e a toda à equipa, do Laboratório de Citogenética do Serviço de Genética do Centro Hospitalar de Trás-os-Montes e Alto-Douro, pela disponibilidade e ensinamentos em cultura de células;
Ao Professor Doutor José Eduardo Brito, pela disponibilidade e cedência do Laboratório de Genética;
À Técnica Isabel Santos, por todo o apoio e cuidado prestado no laboratório;
Com grande afeto e em especial ao meu amigo e companheiro Nuno Valente, sem o qual não seria possível a realização deste trabalho, pela dedicação e paciência que teve comigo na realização deste projeto, pois passamos bons momentos com as nossa drosófilas os quais nunca mais esquecerei. Um profundo obrigado;
Aos meus colegas de Mestrado, em especial a minha grande amiga já de Licenciatura Simone pelas ideias trocadas e ajuda na elaboração desta dissertação;
por todo o carinho, força e encorajamento que me deram ao longo deste trabalho; Em especial à minha namorada Vera Damião, por todo o apoio, paciência e dedicação
que me tens dado ao longo de todos estes anos, e em especial neste últimos dois anos de mestrado.
Palavras-chave: Talassoterapia; Genotoxicidade; Antigenotoxicidade, SMART; SCGE.
Desde a era dos descobrimentos até aos dias de hoje que Portugal possui uma forte ligação com o mar, explorando-o nas mais diversas vertentes, entre as quais a económica e a de lazer. No entanto, relativamente à composição química, estas águas têm também características de elevada importância que as tornam ricas para fins terapêuticos e preventivos para o organismo, como é o caso da talassoterapia.
A Talassoterapia consiste no uso medicinal da água do mar e do seu ambiente marinho como fonte de terapia. Deste modo, recorre à utilização da água do mar e dos seus produtos, sob supervisão médica, a uma temperatura aproximada de 38 °C. Comumente é usada como uma estratégia terapêutica em diversos países, inclusive Portugal, para a prevenção e tratamento de múltiplas patologias.
Assim, o objetivo é estudar quais os efeitos tóxicos, genotóxicos, anti genotóxicos e de longevidade que os produtos thalion (TH), lamas marinhas (LM) e água do mar (AM) possam promover. Os efeitos tóxicos são determinados a partir do número de adultos eclodidos, pela sua longevidade e pela prolificidade celular das células da linha MG 63. A genotoxicidade dos produtos é determinada pelos danos no DNA nas células neuroblásticas de Drosophila
melanogaster, nas células da linha celular MG 63 e pelas lesões nos omatídios de D. melanogaster, recorrendo ao teste do ensaio do “cometa” e ao teste de recombinação e mutação
somática (SMART).
Neste contexto foram testados produtos utilizados atualmente em diversos SPA’s para fins estéticos (regeneradores, tonificantes e hidratantes). Através da análise dos resultados dos diferentes ensaios realizados, verificou-se que os produtos TH, LM e AM testados não têm qualquer efeito genotóxico, averiguando-se também que o produto TH possui um efeito anti mutagénico. Nestes mesmos ensaios constatou-se também o aumento da prolificidade em D.
melanogaster quando comparado com o grupo controlo.
Estes dados sugerem que estes produtos possuem características peculiares, quando usados isolados ou combinados, que poderão ter grande importância na saúde para o tratamento de diversas patologias, na área da dermatologia e oncologia.
Keywords: Thalassotherapy; Genotypic effects; genotoxicity; Antimutagenic, SMART;
SCGE.
Since the age of discovery to the present day that Portugal has a strong connection to the sea, exploring it in several aspects, including the economic and leisure. However, regarding the chemical composition, these waters have also highly important characteristics that make them rich for therapeutic and preventive purposes to the body, as is the case of thalassotherapy. The SPA is the medical use of seawater and its marine environment as a source of therapy. Thus, makes use of seawater and their products under medical supervision at a temperature of about 38 ° C. Commonly is used as a therapeutic strategy in many countries, including Portugal, for the prevention and treatment of many pathologies.
The objective is to study what a toxic, genotoxic, anti-genotoxic and longevity that Thalion products (TH), marine mud (LM) and seawater (AM) can promote. Toxic effects are determined from the number of adults hatched, the longevity and cellular prolificacy MG cell line 63. The genotoxicity of products is determined by DNA damage in Drosophila melanogaster neuroblastic cells, cells in the cell line MG 63 and causes for the omatídios D. melanogaster, using the test rehearsal "comet" and recombination and somatic mutation test (SMART).
In this context were tested products currently used in many spas for aesthetic purposes (regenerative, toning and moisturizing). By analyzing the results of the various tests conducted, it was found that the product TH, LM and MA tested have no genotoxic effect, it is also ascertaining that the HT product has an anti-mutagenic effect. In these same studies have also observed increased prolificacy in D. melanogaster compared with the control group.
These data suggest that these products have peculiar characteristics, when used alone or in combination, that may be of great importance in health for the treatment of various diseases in the field of dermatology and oncology.
Agradecimentos ... IV Resumo ... VI Abstract ... VII INDICE DE FIGURAS ... X INDICE DE TABELAS ... XII ABREVIATURAS/SIGLAS ... XIII
1.INTRODUÇÃO TEÓRICA ... 1
1.1 CONCEITO DE TURISMO DE SAÚDE E BEM-ESTAR ... 1
1.1.1 Conceito de Talassoterapia ... 3
1.1.2Principais produtos marinhos utilizados na Talassoterapia ... 4
1.2 UTILIZAÇÃO DA DROSÓFILA COMO SISTEMA DE TESTAGEM ... 9
1.2.1 Aspetos gerais D. melanogaster ... 9
1.2.2 Ciclo de vida da D. melanogaster ... 11
1.2.3 Discos imaginais e formação do olho da D. melanogaster ... 12
1.2.4 Genoma da D. melanogaster e similaridade com humanos ... 13
1.3 ENSAIOS DE GENOTOXICIDADE ... 14
1.3.1 Eletroforese em Gel de Células individuais – Ensaio do Cometa ... 15
1.3.1.1 Metodologia geral ... 16
1.3.1.2 Vantagens e aplicações ... 18
1.3.2 Teste de Mutação e Recombinação Somática ... 19
1.4. OSTEOSSARCOMA, LINHAS CELULARES USADAS EM ESTUDOS IN VITRO 21 2. OBJETIVOS ... 23
3. MATERIAIS E MÉTODOS ... 24
3.1 DROSÓFILA COMO MODELO EXPERIMENTAL ... 24
3.1.1 Técnicas gerais de manuseamento da Drosófila ... 25
3.1.1.1 Meio de cultura ... 25
3.1.1.2 Isolamento de fêmeas virgens ... 26
3.1.1.3 Distinção sexual ... 26
3.1.1.4 Método Anestésico ... 27
3.1.1.5 Pré-Cruzamento ... 28
3.4.1 Ensaio do Cometa ... 31
3.4.2 Ensaio SMART w/w+ ... 36
3.5 ENSAIOS EM LINHAS CELULARES... 39
3.5.1 Ensaio MTT ... 39
3.5.2Ensaio do Cometa em culturas Celulares ... 42
4. RESULTADOS E DISCUSSÃO ... 44
4.1RESULTADOS DO NÚMERO DE DESCENDENTES ... 44
4.1.1Número de descendentes nos produtos isolados ... 44
4.1.2 Resultados do Número de descendentes nos produtos conjugados... 48
4.2 ENSAIOS DE LONGEVIDADE ... 50
4.2.1Longevidade dos progenitores nos produtos isolados ... 50
4.2.2 Longevidade dos descendentes nos produtos isolados ... 54
4.2.3 Longevidade dos progenitores nos produtos conjugados ... 56
4.2.4 Longevidade dos descendentes nos produtos conjugados... 57
4.3 ENSAIOS DE GENOTÓXICIDADE EM D. MELANOGASTER ... 59
4.3.1Ensaio do cometa ... 59
4.3.2 Ensaio SMART w/w+ ... 61
4.4 CULTURAS CELULARES ... 62
4.4.1 Ensaio do MTT ... 62
4.4.1.1MTT dos produtos isolados ... 63
4.4.1.2 MTT dos produtos conjugados ... 66
4.4.2 Ensaio do cometa em linhas celulares: ... 67
4.4.2.1Ensaio do cometa em linha celular com produtos isolados ... 68
4.4.2.2Ensaio do cometa em linha celular com produtos conjugados ... 70
CONCLUSÃO ... 72
REFERÊNCIAS BIBLIOGRÁFICAS ... 74
Figura 1: Mecanismos de ação e interesse terapêutico dos “Pelóides”. ... 8
Figura 2: Ciclo de vida da D. melanogaster. ... 12
Figura 3: Representação da heterocromatina num cromossoma mitótico de D. melanogaster ... 13
Figura 4: Representação do complexo Drosophila Hom-C e a similaridade com os genes Hox encontrados nos mamíferos. ... 14
Figura 5: Representação esquemática das fases criticas do ensaio do cometa em meio alcalino. ... 17
Figura 6: Classificação de danos no ensaio cometa ... 18
Figura 7: Esquema genético ilustrando os diferentes acontecimentos genéticos que podem ocorrer no teste SMART white/white+ ... 21
Figura 8: Osteossarcoma desenvolvido nos ossos da perna ... 22
Figura 9: Representação da Drosophila melanogaster macho e fémea. ... 27
Figura 10: Cérebro de uma Drosophila melanogaster no 3º estádio larvar ... 33
Figura 11: Fotografia à lupa de um olho de D. melanogaster, em que está afetado um grande número de omatídeos ... 38
Figura 12: Quantidades dos produtos utilizados e respetivas diluições a serem testadas em cultura celular. ... 40
Figura 13: Número de descendentes com o produto TH. ... 45
Figura 14: Número de descendentes com o produto LM ... 46
Figura 15: Número de descendentes com o produto AM ... 47
Figura 16: Número de descendentes com os produtos conjugados. ... 49
Figura 17: Ensaio de longevidade relativo aos progenitores testados como produto TH. ... 51
Figura 18: Ensaio de longevidade relativo aos progenitores testados como produto LM. ... 52
Figura 19: Ensaio de longevidade relativo aos progenitores testados como produto AM. ... 53
Figura 20: Ensaio de longevidade relativo aos descendentes testados como produto TH. ... 54
Figura 21: Ensaio de longevidade relativo aos descendentes testados como produto LM. .... 55
Figura 22: Ensaio de longevidade relativo aos descendentes testados como produto AM. ... 55
Figura 23: Ensaio de longevidade relativo aos progenitores dos produtos conjugados com o produto TH e LM ... 56
Figura 25: Ensaio de longevidade relativo aos descendentes dos produtos conjugados com o
produto LM ... 58
Figura 26: Média em unidades arbitrárias dos danos totais ocorridos no DNA dos neuroblastos,
nos produtos TH e LM ... 60
Figura 27: Efeitos dos produtos TH e LM na percentagem de olhos com mosaicos nos
omatídios das Drosophila melanogaster. ... 61
Figura 28: Ensaio do MTT com tratamento nas diferentes concentrações do produto TH .... 63 Figura 29: Ensaio do MTT com tratamento nas diferentes concentrações do produto LM ... 64 Figura 30: Ensaio do MTT com tratamento nas diferentes concentrações do produto AM. .. 65 Figura 31: Ensaio do MTT nos tratamentos com concentrações intermédias dos produtos
conjugados ... 66
Figura 32: Ensaio do MTT nos tratamentos com concentrações mais elevadas dos produtos
conjugados. ... 67
Figura 33: Média em unidades arbitrárias dos danos totais ocorridos no DNA das células da
Linha Celular MG 63, nos diferentes produtos sem incubação com FPG ... 68
Figura 34: Média em unidades arbitrárias dos danos totais ocorridos no DNA das células da
Linha Celular MG 63, nos diferentes produtos incubados com FPG.. ... 69
Figura 35: Média em unidades arbitrárias dos danos totais ocorridos no DNA das células da
Linha Celular MG 63, na conjugação dos diferentes produtos, sem incubação com FPG ... 70
Figura 36: Média em unidades arbitrárias dos danos totais ocorridos no DNA das células da
Tabela 1: Quantidades dos produtos utilizados para a elaboração do meio de cultura de D. melanogaster ... 26 Tabela 2: Produtos e quantidades testados de forma isolada nos ensaios de longevidade. .... 29 Tabela 3: Produtos e quantidades testados de forma conjugada nos ensaios de longevidade. 30 Tabela 4: Produtos e quantidades testados no ensaio do cometa ... 31 Tabela 5: Produtos e quantidades testadas no ensaio SMART ... 36 Tabela 6: Tabela referente aos produtos e as quantidades testadas neste ensaio (volume final 5
3A- 3 Algas AM- Água do mar BA- Banho Aromático
CHTAD- Centro Hospitalar de Trás-os-Montes e Alto Douro DAPI - 4,6- Diamino-2-Fenilindol
dH2O – Água Destilada
DMSO - Dimetilsulfóxido DNA – deoxyribonucleic acid DP - Disc Proper
EDTA - Etileno Diamino Tetra-Acético
EFSA - Autoridade de Segurança Alimentar Europeia ELISA - Enzyme-Linked Immunosorbent Assay
EMEPC - Estrutura de Missão para a Extensão da Plataforma Continental ENU - N-etil-N-nitrosureia
FPG - Formamidopirimidina-DNA-Glicosilase GST - Glutationa-S-transferase
H0- Hipótese Nula
HA- Hipótese Alternativa
HOX - Genes Homeóticos
ISMH- Sociedade Internacional de Hidrologia Médica LM- Lamas Marinhas
MG 63 - Linha Celular Humana de Osteossarcoma
MTT - 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide
Na2EDTA – Etileno Diamino Tetra-Acético Disódico
NAD - Dinucleótido de Adenina e Nicotinamida (Forma oxidada) NADH – Dinucleótido de Adenina e Nicotinamida (Forma reduzida)
NADP+ - Fosfato de Dinucleótido de Adenina e Nicotinamida (Forma oxidada)
NADPH - Fosfato de Dinucleótido de Adenina e Nicotinamida (Forma reduzida) OK-y - Oregon K-y
PBS - Tampão Fosfato-Salin pH – Potencial Hidrogeniónico
ROS - Espécies Reativas de Oxigénio
SCGE- Eletroforese em Gel de Células Individuais SLRT- Teste dos Letais Recessivos Ligados ao Sexo SMART- Teste de Mutação e Recombinação Somática SN – Streptonigrina
SNC - Sistema Nervoso Central SVF - Soro Vitelo-Fetal
TH- Thalion
Tris - Tris(hidroximetil)aminometano
UTAD- Universidade de Trás-os-Montes e Alto Douro UV - Radiação Ultravioleta
w- Locus White WT - Wild type
X2- Qui-quadrado
1.INTRODUÇÃO TEÓRICA
1.1 CONCEITO DE TURISMO DE SAÚDE E BEM-ESTAR
O conceito de turismo em Portugal e no mundo é cada vez mais diferenciado, não se limitando apenas aos conceitos de sol e praia. A crescente exigência da sociedade, o estilo de vida atual, caraterizado de forma stressante e altamente exigente em termos profissionais, leva cada vez mais as pessoas a procurarem, na época de descanso, locais onde possam desfazer-se desse tipo de stresse da rotina diária (Garcia-Altês, 2005).
Neste contexto, é onde se enquadra o tipo de turismo de saúde e bem-estar, referindo-se este a ofertas que são dedicadas a todas as pessoas que procuram atividades relacionadas com a promoção da saúde e bem-estar físico e emocional. O sector de bem-estar, normalmente, encontra-se associado à qualidade e ao luxo dos empreendimentos com ambientes que apelam à pureza e à tranquilidade (Garcia-Altês, 2005).
No que diz respeito ao conceito de turismo de saúde, existem ainda algumas divergências. De acordo com Vieira (1997) o turismo de saúde é: “um conjunto de produtos, que tendo a saúde como motivação principal e os recursos naturais como suporte, tem por fim proporcionar a melhoria de um estado psicológico ou físico fora da residência habitual”.
Mais recentemente, Ernâni Lopes, (2005) definiu este tipo de turismo de acordo com
British SPA’s Federation como: “ um conjunto de deslocações a todo o tipo de
locais/infraestruturas orientadas para o bem-estar físico e emocional e que fornecem serviços de relaxamento e reabilitação, através de um espectro de cuidados que integram a medicina com tratamentos complementares, anti stresse, relaxamento e beleza, num enquadramento de grande conforto e de um excelente acolhimento; muitas vezes esses serviços/produtos baseiam-se na utilização da água com fins terapêuticos (águas com qualidades minero-naturais) ou com objetivos de relaxamento anti stresse e da melhoria da estética somática”.
A evolução que o turismo tem vindo a ultrapassar nas últimas décadas, tem comprovado uma elevada tendência para a expansão em termos da inovação de novos produtos ou na reformulação de produtos já existentes, mais propriamente na área do turismo de saúde e bem-estar, com a conceção de locais característicos de revitalização do equilíbrio físico e psíquico, decorrentes do stresse da vida moderna (Barbosa, 2002, Mueller et al, 2001).
Assim sendo, para Fernandes e Fernandes (2008) o turismo de saúde apresenta três grandes objetivos:
Satisfação de cuidados profiláticos de saúde (medicina preventiva); Prestação de serviços terapêuticos (medicina curativa);
Realização de tratamentos de recuperação (medicina de reabilitação).
Para os mesmos autores, o turismo de saúde é dividido em cinco modalidades principais: o termalismo, a talassoterapia, o climatismo, a recuperação da forma e o turismo médico, as quais são definidas da seguinte forma:
Termalismo: utilização das propriedades terapêutica das águas mineromedicinais; Talassoterapia: aproveitamento dos recursos marinhos com fins profiláticos e terapêuticos;
Climatismo: utilização das propriedades curativas de alguns microclimas, no litoral ou na montanha, devido à qualidade do ar ambiental;
Recuperação da forma (remise en forme, ou fitness): através da dietética, bons hábitos de vida, prática de exercícios físicos, massagens, hidroterapia e outras terapias complementares. O fitness visa reabilitar, recuperar e melhorar a forma física, bem como contribuir para o relaxamento físico e mental;
Turismo médico: constituído por medicinas curativas especializadas (oftalmológica, neurológica, fisiátrica, dermatológica, estética, odontológica, etc.), em destinos turísticos privilegiados (Fernandes e Fernandes, 2008).
O turismo de saúde e bem-estar em Portugal encontra-se ainda insuficientemente aproveitado. No campo de ação deste tipo de turismo, as termas têm sido nos últimos anos os locais por excelência mais procurados por portugueses e estrangeiros (Fernandes e Fernandes, 2008).
Neste contexto os tratamentos de talassoterapia assumem ainda uma importância muito reduzida no turismo de saúde, atendendo às enormes potencialidades existentes no país. Portugal apresenta uma costa marítima com 1792 quilómetros (continente mais arquipélagos dos Açores e da Madeira), abundante em areias finas e águas, que em regra apresentam pouca poluição, e elevado grau de insolação anual, apresentando assim uma enorme potencialidade para a criação de mais centros de talassoterapia (Fernandes e Fernandes, 2008).
Tendo em conta as enormes potencialidades de Portugal, este apresenta as seguintes características propícias ao desenvolvimento da área da Talassoterapia:
Qualidade da água que banha o nosso litoral oceânico; Clima ameno;
Património natural, histórico e gastronómico (Fernandes e Fernandes, 2008).
Dados estes factos, irá ser dada principal ênfase neste trabalho à modalidade de talassoterapia, visto ser um produto de saúde e bem-estar com relevo no turismo da atualidade.
1.1.1 Conceito de Talassoterapia
A água é um bem indispensável conhecida pelos homens quase há tanto tempo quanto a sua existência, sendo ela água doce ou salgada. Deste modo, os centros hidrológicos que recorrem à água do mar salgada estão no primórdio do surgimento da talassoterapia (Fernandes e Fernandes, 2008).
De acordo com Fernandes e Fernandes (2008): “designa-se Talassoterapia a utilização, sob orientação médica, com fins profiláticos e terapêuticos, dos recursos existentes nas zonas costeiras: clima marinho, água do mar (pura e fresca), algas, esponjas, anémonas, conchas, corais, areia e lodos de origem marinha natural. (…) Pressupõe o uso da água do mar viva, para que mantenha todas as suas propriedades físicas e químicas.”
De acordo com a perspetiva do médico Bernard-François Bardelon, este define a Talassoterapia do seguinte modo: “Num local privilegiado, a Talassoterapia é a utilização simultânea, sob supervisão médica e com fim curativo ou preventivo, das virtudes terapêuticas do meio marinho, que compreende: a água do mar, o clima marinho, os lodos marinhos, as algas, a areia e todos os produtos que podem concentrar os elementos deste meio” (Tinghérian, 2005).
Observando a origem da Talassoterapia, os Egípcios foram o primeiro povo a compreender as propriedades terapêuticas da água do mar, sendo que foram os Gregos e os Romanos que comprovaram os seus poderes curativos e terapêuticos e a utilizaram recorrentemente (Tinghérian, 2005).
Ao conhecimento dos efeitos curativos e terapêuticos da água do mar, juntou-se a sua utilização para fins meramente lúdicos, levando à sua proliferação por todo mundo (France Talasso, 2014).
Atualmente, a Talassoterapia assume uma maior importância na Europa e na bacia do Mediterrâneo, porém tem vindo a alastrar-se cada vez mais por todo o mundo. Sendo a França
o país que continua a ocupar o primeiro lugar a nível mundial, com cerca de cinquenta centros de talassoterapia, seguida da Tunísia, com cerca de quarenta centros, e a nossa vizinha Espanha com cerca de trinta centros. Existem ainda outros centros de Talassoterapia noutros países da Europa e do Mediterrâneo, como é o caso da Alemanha, Bélgica, Bulgária, Chipre, Creta, Croácia, Israel, Malta, Portugal, Roménia, Rússia e a Ucrânia. (Fernandes e Fernandes, 2008).
Apesar das enormes potencialidades e características de Portugal, este dispõem de alguns centros de talassoterapia, entre eles: Grande Real Santa Eulália Resort e Real Bellavista Hotel & Spa (Albufeira), Sofitel Thalassa Vilalara Resort (Lagoa), Vila Sol World-Class Spa e Real Marina Hotel & Spa (Olhão), Centro Thalasso da Costa da Caparica (Costa da Caparica), Grande Real Villa Itália Hotel & Spa (Cascais), Hotel Praia Golfe, em Espinho; Hotel CS Madeira e Hotel Tivoli Madeira, Vidamar Resort Madeira (Funchal), Hotel Vila Baleira Thalassa (Porto Santo) (Fernandes e Fernandes, 2008; Turismo de Portugal, 2014).
1.1.2Principais produtos marinhos utilizados na Talassoterapia
O mar é povoado por milhares de espécies diferentes das quais ainda se sabe muito pouco. Das que foram descobertas apenas uma quantidade insignificante são usadas pela indústria para criação de produtos com fins terapêuticos, alimentares, entre outros (Fernandes e Fernandes, 2008).
Até à atualidade estima-se que habitem no mar 800 mil espécies diferentes, entre as quais foram identificadas cerca de 25 mil espécies de algas. Utilizando-se por todo o mundo à volta de 6500 produtos naturais marinhos provenientes das espécies mais conhecidas (Fernandes e Fernandes, 2008).
Destes produtos são usados os seguintes em talassoterapia: Água do mar;
Clima e ar marinho (climoterapia e aeroterapia); Algas (algoterapia);
Banhos de areia (psammaterapia);
Banhos de Lama/Lodos (vasoterapia ou fagoterapia); Tratamentos com fitoplâncton;
Esponjas naturais; Krill;
Dieta marinha (Fernandes e Fernandes, 2008; Lampa e Rossi, 2010).
Os mares e os oceanos cobrem cerca de 70 % do planeta terra. Neles encontram-se dissolvidos a maior parte das substâncias existentes no planeta. A composição química da água do mar é praticamente idêntica à do plasma humano, embora com uma concentração 3,5 vezes superior, aproximadamente 35 g/L (Fernandes e Fernandes, 2008; Millero, 2013).
A água do mar possui 92 substâncias diferentes, entre as quais se destacam: o oxigénio, hidrogénio, cloro, sódio, magnésio, enxofre, cálcio, potássio, bromo, carbono, estrôncio, boro, fluor, azoto, iodo, entre muitas outras substâncias e oligoelementos como: o iodo, ferro, prata, ouro, zinco, cobre molibdeno, magnésio, selénio, essências para a saúde humana e fauna marítima (Millero, 2013; Pilson 2013).
Os oligoelementos e os sais minerais diluídos na água do mar são indispensáveis ao ser
humano, atravessando a pele por difusão, para tal é necessário um contacto da água do mar com a pele superior a dez minutos. As trocas são assim facilitadas quando a temperatura da água do mar se aproxima da temperatura do corpo humano (34 a 37 ºC) (Andrade et al, 2008; Crescente
et al, 2012).
A água do mar entre muitas outras características possui propriedades anti-inflamatórias e antibióticas. Devido ao facto das grandes quantidades de ozono e de iões negativos também possui uma grande capacidade antibacteriana (Pros, 1980; Tréguer, 2003).
O clima marinho engloba as características climáticas específicas à beira mar: o sol, o ar, o vento e a ionização, sendo mais rico junto à orla costeira, mais propriamente junto ao mar, é onde se encontra uma maior ionização negativa (Pros, 1980).
O meio marinho possui por si só um efeito diurético natural, estimula o metabolismo celular e o sistema hormonal, favorecendo a produção de serotonina (neurotransmissor com ação tranquilizante e sedativa), tem um efeito anti stresse e a atmosfera marinha, devido à sua elevada ionização negativa, facilita a oxigenação das células (regenerador dos alvéolos pulmonares). O ar e o clima marinho caracterizam-se pela fraca presença de micróbios e germes e, devido ao facto de serem ricos em oligoelementos, são fortes fortalecedores do sistema imunitário (Lamas e Rossi, 2010; Pros, 1980; Tinghérian, 2005).
As algas marinhas, no seu ecossistema natural, são uma fonte primária de alimento para os peixes, moluscos, entre muitos outros seres aquáticos, e são responsáveis por cerca de 70 % do oxigénio do planeta terra (Fernandes e Fernandes, 2008).
Atualmente, as algas são utilizadas desde a indústria alimentar até à indústria farmacêutica, existindo cerca de 25 mil espécies de algas diferentes, em que só uma pequena minoria é usada para fins indústrias (Chaussade, 2002).
Portugal possui uma flora algal muito vasta, tendo sido estudada exaustivamente por Ardré (1970, 1971), que identificou e escreveu 246 espécies de Rhodophyceae, 98
Phaeophyceae e 60 Chorophyceae, números que não se alteraram significativamente até aos
nossos dias (Pereira, 2007).
As algas são ricas em muitos oligoelementos, vitaminas, sais minerais, fito-hormonas, enzimas e proteínas essenciais para o fortalecimento e rejuvenescimento do corpo humano. Assim, as principais propriedades das algas no geral são:
Antioxidantes; Anti-inflamatórias; Analgésicas; Antidepressivas; Tonificantes; Bactericidas e fungicidas; Hipoalergénicas; Esfoliantes e branqueadoras; Lipo-redutoras e anti-celulíticas;
Tornam os tecidos mais firmes e atenuam as rugas; Previnem as estrias;
Suavizam e tonificam a pele;
Restauram e tonificam o cabelo (Houreau, 2002; Pereira, 2007; Spolaore et al, 2006; Tréguer, 2003).
Em França há muitos centros de talassoterapia que utilizam maioritariamente as
Phaeophyceae, nomeadamente a Fucus Vesiculosus e a Laminareas Digitata.
A Fucus vesiculosus é uma alga que sintetiza as vitaminas C e D, tendo uma ação anti envelhecimento, uma atividade anti tumoral, anticoagulante e antiviral, anti-inflamatórias e anti-celulíticas, sendo mais utilizada em cosméticos sobretudo aplicado ao anti envelhecimento (Holtkamp et al, 2009; Fujimura et al, 2002; Pereira, 2007).
A Laminaria digitata também muito utilizada em talassoterapia apresenta funções que afetam o sistema nervoso e músculo-esquelético, devido ao facto de ser muito rica em cálcio e
magnésio, possuindo assim características antirreumáticas, anti-inflamatórias, reguladoras do peso corporal e da tensão arterial (devido à presenças de laminarina e laminina). Estas ainda previnem a arteriosclerose e outros problemas vasculares, pelos seus efeitos fluidificantes da corrente sanguínea (Pereira, 2007).
A areia marinha utilizada na psammaterapia é uma areia rica em sais minerais e macro elementos como o cálcio, o fósforo, potássio, magnésio, enxofre, entre muitos outros que possuem propriedades benéficas para o corpo humano. Normalmente os tratamentos são efetuados com areia quente, entre os 45-50 ºC, por um período de vinte minutos, estando indicados para diversas patologias como: raquitismo, reumatismo, artrite e dor ciática. Estes tratamentos estimulam também a indução da secreção adrenocortical, eosinofilopenia e aumentam os níveis de açúcar no sangue, (Lampa e Rossi, 2010).
Os banhos de lamas/lodos são utilizados desde a antiguidade até aos dias de hoje de uma forma empírica. Em 1931 a Sociedade Internacional de Hidrologia Médica (ISMH) resolve dar a designação de “Pelóide” para os produtos utilizados em terapêutica termal onde eram incluídas as lamas, os lodos, argilas, turfas entre outros materiais semelhantes. Sendo só em 1949 que o ISMH define os “pelóides” como: “Produtos naturais consistindo na mistura de água mineral (compreendendo nesta designação a água mineral natural, a água do mar ou a água salgada de um lago) com materiais orgânicos e inorgânicos, resultantes de processos geológicos ou biológicos, ou conjuntamente de uns e outros, utilizados para fins terapêuticos sob a forma de cataplasmas ou de banhos” (Teixeira, 2011). Os “pelóides” possuem assim dois tipos de efeitos, o efeito específico e o efeito inespecífico. De acordo com o efeito, assim possuem mecanismos de ação e interesse terapêuticos distintos (Figura 1).
Figura 1: Mecanismos de ação e interesse terapêutico dos “Pelóides”. (Adaptado de Teixeira, 2011)
Os efeitos inespecíficos possuem um efeito térmico local estando indicados para reumatismo, síndromes dolorosas musculo-tendinosas, síndromes dolorosas abdominais e em geral contribuem para o bem-estar; e os efeitos específicos possuem propriedades anti-inflamatórias e antioxidantes, estando indicados para reumatismo, síndromes dolorosas musculo-tendinosas e dermatoses.
Ambos são aplicados a temperaturas de 37-38 °C nos banhos gerais, e até 45 °C em cataplasmas (Teixeira, 2011).
Os restantes produtos usados em talassoterapia como: o tratamento com fitoplâncton, esponjas naturais, krill, conchas, corais e anémonas são usados basicamente em produtos de estética e cosmética (Fernandes e Fernandes, 2008).
Os tratamentos de talassoterapia devem ser sempre acompanhados de uma dieta alimentar à base de peixes, em particular ricos em ómega-3, em mariscos, algas e krill, para se obter uma maior eficácia de tratamento (Fernandes e Fernandes, 2008).
1.2 UTILIZAÇÃO DA DROSÓFILA COMO SISTEMA DE TESTAGEM
Os testes de mutagenicidade são uma parte fundamental do perfil toxicológico moderno de um produto químico (Graf et al,1983). Os sistemas de testagem têm como objetivo serem preditivos não só em relação à capacidade de um composto produzir uma alteração hereditária como também em relação às suas propriedades carcinogénicas (Kramers, 1988). A toxicidade genética de compostos químicos pode ser detetada em diferentes sistemas de testagem biológicos, como é o caso dos vírus, bactérias, leveduras, fungos, plantas e insetos, células de mamíferos in vitro, ratos, entre outros (Sierra e Gaivão, 2014).
Deste modo, os mamíferos desempenham um papel crucial nos estudos de toxicidade, sendo os mais usados os Rattus norvegicus e Mus musculus. Contudo, uma das principais preocupações para a Ciência e Ética tem sido minimizar o número de organismos superiores usados na investigação toxicológica e testagem. É neste contexto que se tem dado particular destaque à utilização de animais-modelo alternativos. A Drosophila melanogaster, devido à sua genética e biologia do desenvolvimento bem caracterizadas, é utilizada como modelo para doenças humanas e em investigação toxicológica. O Centro Europeu para a Validação de Métodos Alternativos tem apoiado vigorosamente o uso da D. melanogaster para investigação e testagem (Siddique, 2005).
1.2.1 Aspetos gerais D. melanogaster
A D. melanogaster, comummente denominada mosca da fruta, é um inseto de pequeno porte (cerca de 2 e 3 mm, macho e fêmea, respetivamente). É um organismo eucarionte, da ordem díptera, com 2n = 8 cromossomas, apresentando 3 pares de autossomas e 1 par sexual (Pierce, 2005). Apresenta uma ampla difusão por todo o mundo, abundantemente em frutas, razão pela qual vulgarmente é conhecida (Sanchez, 1990).
Thomas Hunt Morgan (1866-1945) em 1909 foi o primeiro e o responsável por desenvolver como sistema de testagem a D. melanogaster como organismo na investigação
genética. Através do seu trabalho, foram feitas descobertas cruciais como a explicação genética da hereditariedade ligada ao sexo e o princípio do mapeamento genético (Robinson, 2003).
São inúmeras as vantagens que tornam a D. melanogaster atrativas para o estudo de genotoxicidade e antigenotoxicidade, nomeadamente:
Curto ciclo de vida. Este organismo é um inseto holometabólico, que em laboratório num ambiente estandardizado (a uma temperatura média de 25 ºC e uma humidade relativa de 60 %) demonstra a duração de um ciclo de vida de aproximadamente 9-10 dias. (Wurgler et al, 1984; Gaivão, 1999);
Boa caraterização genética. É um dos organismos superiores com uma caracterização genética extensa (Gaivão, 1999). O seu genoma encontra-se sequenciado e anotado (Adams et
al, 2000);
Possui sistemas enzimáticos de destoxificação de agentes xenobióticos semelhantes aos mamíferos. Ou seja, dispõem de um sistema microssomal cujo grau de versatilidade metabólica é similar ao do fígado dos mamíferos (Gaivão, 1999). Através da análise bioquímica foi possível comprovar a existência de enzimas (Kramers,1988);
Uma grande variedade de compostos que requerem ativação metabólica para sua atividade mutagénica foi considerado positivo em testes de mutagénese (Aguirrezabalaga, 1994);
A existência de um grande número de mutantes e linhas bem caracterizadas geneticamente (Rincón et al, 1990);
Apresentam testes de mutagénese bem definidos que permitem que se estude todo o espectro de endpoints genéticos, tanto em células somáticas com nas células de linha germinativa (Graf e Singer, 1992);
Meios de cultura de preparação rápidos e pouco dispendiosos, relativamente a outros sistemas desenvolvidos em mamíferos (Gaivão, 1999);
Espaço para armazenamento reduzido face a outros sistemas. Restringe-se a uma câmara climatizada com ciclo de luz (Gaivão, 1999);
Descendência abundante, facilitando a comprovação estatística dos resultados. Um único casal pode dar origem a mais de 200 descendentes (Sanchez, 1990);
Facilidade de manuseamento, dada a sua facilidade de trabalhar com um grande número de descendência (Sanchez, 1990).
1.2.2 Ciclo de vida da D. melanogaster
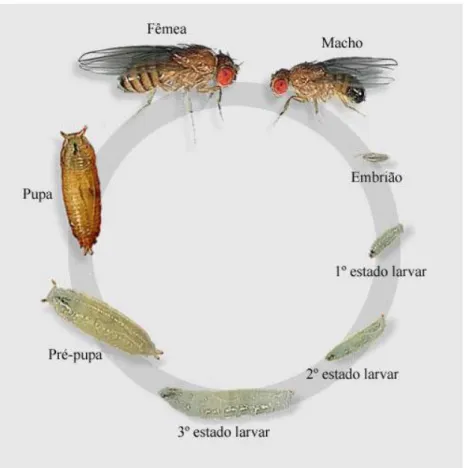
Como já foi referido anteriormente, a D. melanogaster é um organismo holometabólico em que a sua evolução passa pelas fases de ovo, larva, pupa e adulto ou imago. O seu ciclo de vida depende das condições ambientais sendo que, a 25 ºC e a uma humidade relativa de 60 %, o ciclo é de aproximadamente entre 9 a 10 dias (Wurgler et al, 1984). Neste sentido e a temperaturas elevadas produzem-se fenómenos de esterilidade, enquanto que a temperaturas mais baixas o ciclo estende-se (Raymond, 1988).
Após a fecundação da fêmea, esta vai proceder à postura dos ovos, estes vão eclodir dando origem às larvas brancas, com mandíbulas negras e, em cada extremo, possuem um par de espiráculos com função traqueal. Estas por sua vez apresentam-se muito ativas e vorazes, crescendo muito rapidamente. Existem 3 estádios larvares com duração aproximada de 24 horas, 24 horas, 48 horas, respetivamente (Figura 2) (Raymond,1988; Gilbert,2008).
No primeiro estádio, as larvas alimentam-se à superfície do meio, enquanto nos estádios seguintes estas se encontram no interior do meio; durante este período ocorrem alterações no pH e na microflora do meio de cultura. Os estádios larvares são distinguidos através de espiráculos posteriores na medida em que se conseguem observar a partir do segundo estádio, por diferenças estruturais na mandíbula. No final do terceiro estádio as larvas alcançam um comprimento de 4,5 mm, abandonam o meio de cultura e iniciam o estádio de pupa. Por sua vez os espiráculos transformam-se em antenas pupais, o comprimento do seu corpo diminui tornando-se mais escuro para formar o puparium. Durante esta fase a cutícula vai escurecendo, tornando-se mais escura e rígida, sendo no seu interior que vai ocorrer a transformação para se originar o organismo adulto. É de salientar que a maioria do corpo da larva é sistematicamente destruído por morte celular programada, enquanto se desenvolve o organismo adulto a partir de
células imaginais. Esta fase dá-se aproximadamente em 5 dias dando origem ao adulto ou imago (Raymond,1988; Gilbert,2008).
Figura 2: Ciclo de vida da D. melanogaster. (Drosopphila melanogaster, 1998, acedido em 20 de junho de 2014 em: http://html.rincondelvago.com/drosophila-melanogaster_5.html).
1.2.3 Discos imaginais e formação do olho da D. melanogaster
A D. melanogaster apresenta três tipos de células imaginais, os discos imaginais, o grupo de histoblastos e os agregados de células imaginais. Os discos imaginais são as células que irão formar as estruturas cuticulares dos adultos como olhos, asas, antenas, patas, cabeça e o tórax; o grupo de histoblastos são as células imaginais que vão dar origem ao abdómen no adulto e os agregados de células imaginais que se encontram no interior de cada órgão, originam o órgão adulto à medida que a larva se vai diferenciando (Wulger e Vogel, 1986; Gilbert, 2008). No decorrer do desenvolvimento dos estádios larvares os discos imaginais são observados como espessamentos locais da epiderme, as células multiplicam-se até entrarem em diferenciação no estádio de pupa. É neste estádio que os diferentes órgãos ficam formados e dos quais se destacam os olhos (Gaivão, 1999).
O olho da D. melanogaster é composto por várias partes, onde se destaca a retina. A retina consiste em cerca de 800 unidades denominadas de omatídeos, cada um destes é composto por 20 células organizadas num padrão preciso, sendo 8 destas células fotorrecetores e as restantes fazem parte das células que constituem a lente. O olho vai desenvolver-se na camada epitelial plana do disco imaginal do olho da larva. Durante o terceiro estádio larvar, ocorre a diferenciação destas células epiteliais, organizadas aleatoriamente nos fotorrecetores da retina e no tecido da lente que os rodeia. Desta forma, vai formar-se uma reentrância na margem posterior do disco imaginal, onde este sulco morfogenético vai começar a deslocar-se para a frente em direção à parte anterior do epitélio (Gilbert, 2008).
1.2.4 Genoma da D. melanogaster e similaridade com humanos
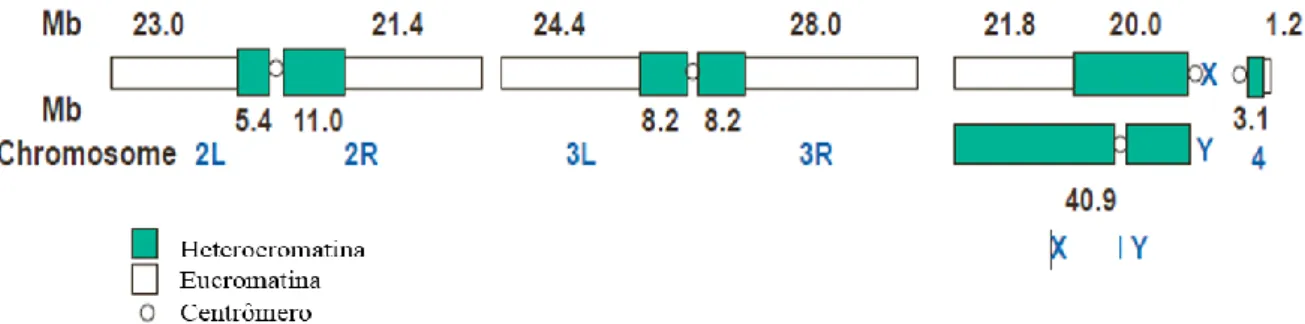
A publicação da sequenciação do genoma deste organismo modelo ocorreu no ano 2000. Este genoma é constituído por 180 milhões de pares de bases, sendo dois terços de eucromatina e um terço de heterocromatina (Adams et al, 2000).
A eucromatina contém sensivelmente 98 % dos genes codificantes de proteínas e a heterocromatina é maioritariamente constituída por sequências de repetição simples. Contém aproximadamente 13676 genes que constituem cerca de 20% do genoma (Figura 3) (Celniker e Rubin, 2003).
Figura 3: Representação da heterocromatina num cromossoma mitótico de D. melanogaster (Adaptado de Adams et al, 2000)
Pondera-se que mais de 60 % do genoma corresponde ao DNA não-codificante, que vai estar envolvido no controle da expressão genética (Mackay et al, 2006).
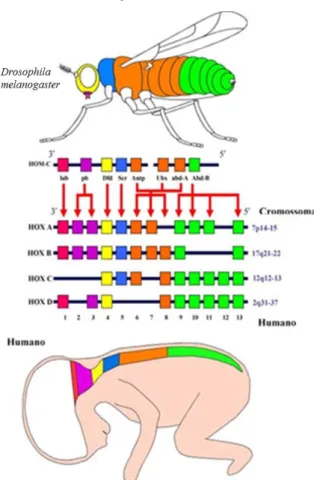
Há uma homologia direta entre genes deste modelo e os genes que estão relacionados com algumas doenças humanas. De todos os genes que se encontram envolvidos em doenças nos humanos, mais de 60 % têm ortólogos na D. melanogaster e mais de metade das sequências proteicas destes organismos são semelhantes às dos mamíferos (Figura 4). Deste modo, a D.
melanogaster é um modelo genético para estudar doenças como Alzheimer, Huntington e
Parkinson. Além disso, é também usada para estudar os mecanismos que estão subjacentes ao envelhecimento e stresse oxidativo, diabetes, imunologia e cancro (Crowther et al, 2004; Chen, 2005; Mackay et al, 2006).
A relevância da D. melanogaster levou à criação de uma base de dados das quais se destaca a Flybase. Os dados que esta inclui são: fenótipos mutantes, caracterização molecular dos alelos mutados, classificação molecular dos produtos génicos, imagens anatómicas, inserções e construções transgénicas. Possui ainda mapas genéticos, citogenéticos e genómicos anotados (Drysdale et al, 2005; Grumbling et al, 2006).
Figura 4: Representação do complexo Drosophila Hom-C e a similaridade com os genes Hox encontrados nos
mamíferos (Adaptado e traduzido de Lappin et al 2006).
1.3 ENSAIOS DE GENOTOXICIDADE
Historicamente, a D. melanogaster é um organismo modelo de eleição para a mutagénese na medida em que, já em 1929, Muller estudou a capacidade mutagénica das radiações raios X neste organismo (Green et al, 1986).
Dado o estilo de vida e o ambiente em que habitamos, somos frequentemente expostos a compostos genotóxicos ou potencialmente genotóxicos. Estes compostos podem causar danos no DNA das células, levando a um aumento de mutações e, por vezes, dando origem a cancro em células somáticas. No entanto, quando são afetadas as células germinativas, o dano pode provocar efeito nas gerações seguintes (Baumgartner et al, 2009).
A resposta de um indivíduo a um medicamento, toxina ou carcinogéneo depende assim de vários fatores (como atividade de diferentes enzimas, polimorfismos dos genes envolvidos, historial de exposição ao composto, entre outros) que alteram a respetiva suscetibilidade ao mesmo. Neste sentido, para que seja possível estudar a complexidade subjacente a este mecanismo, é necessário um modelo in vivo versátil (Jowett et al, 1991).
Os testes in vivo com a D. melanogaster podem assim ser vistos como uma ligação entre os sistemas de testagem in vitro com microrganismos e os testes de genotoxicidade in vivo com mamíferos (Frei e Wurgler, 1996).
Com a finalidade de verificar a ocorrência destes danos, foram desenvolvidos alguns testes e ensaios, na sua maioria baseados na formação de pequenos fragmentos de DNA e no relaxamento que a molécula sofre após a ocorrência destas ruturas (Fairbairn et al, 1995).
Os diferentes testes de genotoxicidade têm como objetivo principal a avaliação do potencial de indução de mutações nas células quando estas são expostas a compostos potencialmente genotóxicos. Para avaliar estes efeitos são utilizados diversos sistemas de testagem, como a Eletroforese em Gel de Células individuais (SCGE), o Teste dos Letais Recessivos Ligados ao Sexo (SLRT), o Teste de Mutação e Recombinação Somática (SMART), entre outros, que são utilizados para detetar os efeitos dos produtos genotóxicos na célula aquando a sua exposição (Lee et al, 1983; Ostting e Johanson, 1984, Singh et al 1988).
Estes métodos são simples e podem ser realizados com amostras de tecidos ou órgãos de organismos a serem avaliados, podendo ser realizados in vitro, recorrendo-se a culturas de células expondo-as aos produtos que se pretendem avaliar.
1.3.1 Eletroforese em Gel de Células individuais – Ensaio do Cometa
O ensaio do cometa foi descrito pela primeira vez em 1984 por Ostiing e Johanson e permitia apenas a avaliação de quebras nas cadeias duplas no núcleo das células. Mais tarde em 1988 o método foi revisto por Singh e seus colaboradores, que procederam à modificação da
técnica proporcionando não só a avaliação das quebras de cadeias duplas, mas também à avaliação das cadeias simples (Ostting e Johanson, 1984; Singh et al, 1988).
O que Singh e seus colaboradores fizeram foi aumentar o pH da solução usada na eletroforese para condições alcalinas, o que levou a um aumento da imigração do DNA associado a um aumento dos níveis de quebras do DNA de cadeia simples, permitindo a identificação de compostos com atividade genotóxica, aumentando significativamente a sensibilidade do método (Singh et al, 1988; Tice et al, 2000).
Este método tomou esta designação, devido à aparência que as células tomam após serem sujeitas a uma eletroforese pois, quando ocorrem quebras no DNA, devido à ação dos compostos genotóxicos, existe um relaxamento na estrutura da cromatina que se apresenta menos enrolada e compacta. Quando as células são submetidas ao campo elétrico existe uma migração dos fragmentos em direção ao ânodo, ou seja, as células que possuem DNA intacto, apresentam um núcleo redondo, contrariamente às células com quebras no DNA. Estes fragmentos vão migrar para fora do núcleo, dando origem a uma cauda, que dá à célula um aspeto de cometa, podendo ser maior ou menor consoante o número de quebras sucedidas (European Standards Committee on Oxidative DNA Damage, 2003).
Cada vez mais este teste é utilizado e aceite em testes de genotoxicidade e biomonitorização humana, por ser um método com aplicabilidade a vários tecidos e/ou tipos de células, sendo eficaz mesmo com uma pequena quantidade de células e pela facilidade e velocidade geral de desempenho do teste (Speit et al, 2008).
1.3.1.1 Metodologia geral
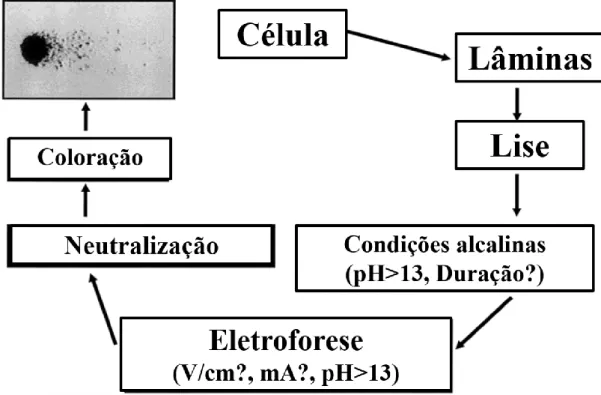
De um modo geral, o ensaio do cometa pode dividir-se nas seguintes fases: obtenção das células, preparação das lâminas, lise celular, tratamento alcalino, eletroforese, neutralização, coloração e por último a visualização das lâminas ao microscópio (Figura 5) (Tice et al, 2000).
Figura 5: Representação esquemática das fases criticas do ensaio do cometa em meio alcalino (pH>13) (Adaptado e traduzido de Tice et al, 2000).
O presente método consiste em colocar as células num gel de agarose com baixo ponto de fusão disposto sobre uma lâmina de microscópio previamente revestida com agarose de ponto de fusão normal. Posteriormente, as células são lisadas numa solução com detergente de elevada concentração salina, a qual vai promover a dissolução das membranas e consequentemente a remoção das histonas e de outras proteínas solúveis, para produzir nucleoides de DNA superenrolado ligado à matriz nuclear que, posteriormente, são desnaturados e submetidos a eletroforese (Collins et al, 2005; Wong et al, 2005).
Devido à coloração do DNA com um fluorocromo vai obter-se uma imagem semelhante a um cometa, onde se pode visualizar e distinguir uma cabeça e uma cauda de DNA, quando visualizado num microscópio de fluorescência. Por sua vez, as células com maior número de quebras no DNA apresentam uma cauda maior (Collins et al, 2008).
Existem inúmeros fatores que podem influenciar as deteção da migração do DNA fragmentado, como a concentração do gel de agarose, o pH, a temperatura, o tempo, a voltagem e a amperagem, na qual se devem ter em conta para garantir a viabilidade do procedimento (Azaqueta et al, 2011).
Os dados obtidos pela visualização das lâminas ao microscópio de fluorescência, ou seja, a análise dos cometas pode ser feita através da utilização de um programa automatizado
com sistema de captura de imagem ou através da avaliação visual (Collins et al, 2008; Wong et
al, 2005).
Na análise visual são avaliadas até 100 células às quais é atribuída uma classificação de 0 a 4, em que 0 significa células sem dano (cometas sem cauda ou com cauda pouco percetível) e 1 a 4 revelam intensidades crescentes de danos (Figura 6) (Collins et al, 2008).
Figura 6: Classificação de danos no ensaio cometa. 0) Classe 0, sem dano; (1) Classe 1; (2) Classe 2; (3) Classe
3 e (4) Classe 4, dano máximo (adaptado de Mota et al, 2010).
1.3.1.2 Vantagens e aplicações
O ensaio do cometa é um método rápido, sensível e fiável para detetar danos no DNA e avaliar a integridade do genoma nas células individuais. Este método é uma técnica flexível, de fácil aplicabilidade, os custos são reduzidos e o tempo necessário para a sua realização é curto. Sendo uma das suas grandes vantagens poder ser possível executá-lo com um número reduzido de células em cada amostra (Baumgartner et al, 2009; Tice et al, 2000).
Este método possui uma grande diversidade de aplicações em toxicologia genética, das quais se podem destacar: potencial teste de monitorização altamente potente, estudos
mecanísticos para distinguir danos cromossomais induzidos por compostos
genotóxicos/citotóxicos e estudos mecanísticos in vivo para distinguir entre carcinogénicos genotóxicos e não genotóxicos (Tice et al, 2000).
O ensaio do cometa, para além das aplicações acima referidas, ainda pode ser aplicado ao nível da monitorização humana, estudos nutricionais, diagnóstico de patologias, sendo uma importante ferramenta na avaliação dos danos do DNA em populações expostas. Este é também
o método escolhido em estudos populacionais de exposição ocupacional e ambiental a poluentes aéreos, pesticidas, metais pesados, radiação entre outros xenobióticos (Collins, 2004; Valverde e Rojas., 2009).
1.3.2 Teste de Mutação e Recombinação Somática
A perda de heterozigosidade é devida a mecanismos relevantes como a mutação e recombinação. Estudos sobre os acontecimentos genéticos relacionados com o desenvolvimento de doenças, demostram a importância de estudar a perda de heterozigosidade relacionadas com os desenvolvimentos dessas mesmas doenças (Graf et al, 1992).
O teste de mutação e recombinação somática (SMART) fundamenta-se nas células dos
discos imaginais que proliferam logaritmicamente durante o estágio larvar. Assim, este teste possibilita expor uma grande população de células que crescem por mitose. Para este tipo de ensaios são usadas larvas que são heterozigóticas para os marcadores que vão alterar caracteres externos da D. melanogaster adulta (Ricón et al, 1990; Graf et al, 1998).
Quando uma alteração genética ocorre numa destas células dos discos imaginais, estas alterações vão estar presentes nas células descendentes e constituirá um clone das células mutadas. Como a alteração vai causar uma alteração visível no fenótipo, o clone de células mutadas podem ser detetadas como um aglomerado de células mutadas na superfície do corpo da D. melanogaster adulta (Ricón et al, 1990; Graf et al, 1998).
Este teste permite assim, detetar vários tipos de mutações (mutações pontuais, deleções e alguns tipos de aberrações cromossómicas), recombinações mitóticas e conversão génica (Graf et al, 1998).
Atualmente existem quatro tipos de testes SMART: o teste white-zeste instável, o teste
white-ivori (wi), o teste de mosaicos em asas (mwh/flr3) e o teste white/white+ (w/w+) (Graf et al, 1998; Grenn et al, 1986; Rasmucon e Grenn, 1974; Rasmucon et al, 1984; Wurgler et al,1986; Zijlstra,1987).
Dos quatro testes só dois são os mais usados como ensaio geral de deteção de efeitos genotóxicos. O teste white-zeste instável entrou praticamente em desuso, sendo o teste dos
mosaicos em asas (mwh/flr3) e o teste white/white+ (w/w+) os testes geralmente mais usados
(Gaivão, 1999). O teste white-ivori (wi), segundo Ferreiro et al, (1997) não apresenta vantagens
em relação aos testes mwh/flr3 e w/w+, assim sendo estes autores não recomendam o seu uso
Para o desenvolvimento da presente tese de mestrado o teste utilizado foi o teste
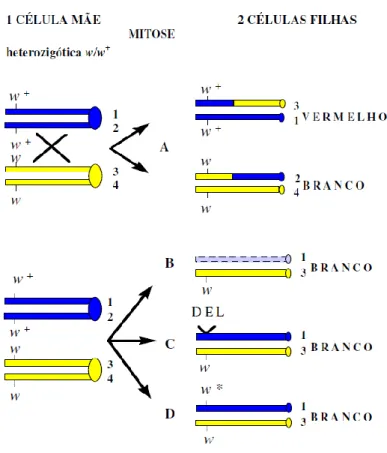
white/white+ (w/w+). Este teste apresenta-se esquematizado na Figura 7, em que o alelo w+
resulta na cor vermelho escuro das células pigmentadas no omatídeo do olho diferenciado. O alelo mutado w não permite a formação de pigmentos nas células do olho resultando na cor branca (Rincón et al, 1990).
Assim sendo, o princípio genético deste sistema é a perda da heterozigosidade para o
gene repórter selvagem w+, um evento que se deve predominantemente à recombinação
mitótica entre os cromossomas X homólogos dos genótipos femininos. Como consequência obtêm-se clones de células w/w que são detetadas num fundo do olho vermelho (Vogel e Nivard, 1993; Ramel et al, 1996).
O teste w/w+ é um teste in vivo rápido e de baixo custo, que revelou excelentes resultados
na avaliação dos efeitos químicos de uma diversidade de compostos químicos Vogel e Nivard, 1993 e Gaivão e Comendador, 1996). Este teste torna-se mais vantajoso pelo facto de ser rápido, quando comparado ao teste das asas, na medida em que se torna mais indicado quando se pretende avaliar um grande número de variáveis (Gaivão, 1999).
O teste SMART oferece uma grande variedade e flexibilidade de protocolos para estudos de anti-mutageneicidade, onde são viáveis co-tratamentos simultâneos e pré- ou pró- tratamentos de várias durações com dois ou mais compostos (Graf et al, 1998).
Figura 7: Esquema genético ilustrando os diferentes acontecimentos genéticos que podem ocorrer no teste
SMART white/white+. Os cromossomas das células mãe estão representados com dois cromatídeos e os das células
filhas apenas com um. Os símbolos a preto representam os cromossomas portadores do alelo w+ e os símbolos a cinzento representam os cromossomas portadores do alelo w. A: Formação de clones w/w (fenotipicamente brancos) por recombinação mitótica entre cromatídeos dos dois cromossomas X homólogos. Estes clones sem pigmento são facilmente identificáveis num fundo vermelho (só se indicam os casos em que se originam mosaicos).B, C e D: Formação de clones w/w respetivamente por perda cromossómica (B), deleção incluindo o locus white (C) ou mutação pontual no locus white (w+,w*) sendo w* uma mutação white (D) ( Gaivão, 1999).
1.4. OSTEOSSARCOMA, LINHAS CELULARES USADAS EM ESTUDOS IN VITRO
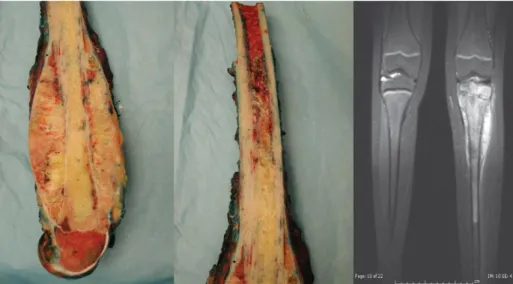
O tecido ósseo é um tecido vivo constantemente renovado, pode ser afetado por várias perturbações, das quais se destacam as neoplasias. O osteossarcoma é uma neoplasia maligna primária mais comum do osso, sendo um conjunto complexo e heterogêneo de neoplasias, verificando-se a sua maior incidência na população jovem (Figura 8) (Niederhuber et al, 2014).
Figura 8: Osteossarcoma desenvolvido nos ossos da perna (Adaptado de Niederhuber, 2014).
Nos Estados Unidos da América em 2012 foram diagnosticados 2890 novos casos de neoplasias ósseas, o osteossarcoma não é uma neoplasia com uma frequência muito relevante, mas em contrapartida, apresenta uma elevada incidência em jovens e uma elevada taxa de mortalidade (aproximadamente 30-40 % em doentes não metastizados, e de 80 % em doentes metastizados) (Niederhuber et al, 2014; Ta et al, 2009).
Este tipo de neoplasia tem uma propagação rápida, ocorrendo preferencialmente em ossos longos (tíbias e fémures), mas também noutros ossos (vértebras, bacia, mandibula) (Clarke et al, 2008).
Os osteossarcomas são usados em estudos in vitro, usando-se várias linhas celulares, particularmente a MG 63 e a Saos-2 (Mohseny et al, 2011).
Na realização do presente trabalho, a linha utilizada foi a linha celular MG 63 que é caracterizada por ser uma linha celular derivada de osteossarcoma. As suas células possuem uma morfologia típica de fibroblastos, crescendo em monocamada aderente.
Esta linha celular apresenta as seguintes vantagens: Relativa facilidade de cultura;
Fornecimento elevado de material celular;
Elevado número de estudos bioquímicos e moleculares em fatores capazes de regular o metabolismo dos osteoblastos (Bilbe et al, 1996).
2. OBJETIVOS
Portugal possui uma forte ligação ao mar (histórica, cultural, económica e social) que tem evoluído ao longo dos anos com o desenvolvimento de novas modalidades de turismo e de saúde. Dentro dessas modalidades surge a talassoterapia que, nos últimos anos, tem recebido um aumento de adesão por parte da população que procura o seu bem-estar interior e exterior.
Esta por sua vez usa produtos que estão disponibilizados nos mercados e que são usados de uma forma empírica sem qualquer fundamento científico. Deste modo, torna-se fundamental avaliar os potenciais efeitos biológicos destes produtos.
O objetivo deste trabalho foi verificar se o Thalion (TH), as Lamas Marinhas (LM) e a Água do Mar (AM) possuem efeitos biológicos ou nefastos em termos de efeito genotóxico/antigenotóxico e outros efeitos biológicos, in vivo em D. melanogaster e in vitro numa linha celular humana. Para que este objetivo fosse alcançado foi necessário:
Em D. melanogaster:
Avaliar o efeito dos produtos ao nível da toxicidade, da fecundidade, da influência na prolificidade e na longevidade;
Testar através do Ensaio do Cometa e do SMART se as concentrações utilizadas têm efeitos genotóxicos;
Avaliar antigenotoxicidade com o Ensaio SMART, se os produtos têm capacidade de reverter os danos genéticos induzidos pela Streptonigrina (SN);
NA Linha celular Humana MG 63:
Avaliar a viabilidade celular, através do ensaio do MTT.
3. MATERIAIS E MÉTODOS
Todos os procedimentos abaixo descritos foram realizados no laboratório da D.
melanogaster do Departamento de Genética, na Universidade de Trás-os-Montes e Alto Douro
(UTAD) e no laboratório do serviço de Genética do Centro Hospitalar de Trás-os-Montes e Alto Douro (CHTAD). Os produtos usados para a realização dos procedimentos experimentais descritos foram fornecidos pela Vilalara Thalassa Resort.
3.1 DROSÓFILA COMO MODELO EXPERIMENTAL
Para a realização do presente trabalho foi utilizado o organismo modelo D.
melanogaster. As razões da utilização da sua utilização já foram referenciadas na primeira parte
do trabalho.
Através do trabalho desenvolvido por Vogel et al, (1991), foram desenvolvidas seis linhagens de D. melanogaster, designadamente Hikone-R, Berlin-K, Oregon-k-y (OK-y), 91-C, 91-R e Haag-79. Estas linhagens variam tanto no conteúdo como na inducibilidade de enzimas oxidativas microssomias (possuem atividades metabólicas diferentes) (Vogel et al, 1991). De acordo com as características das seis linhagens de D. melanogaster, a linhagem que mais se adequa ao trabalho realizado é a linha OK-y, na medida em que apresenta uma frequência de olhos com mosaico relativamente baixo (baixa taxa de mutações espontâneas nos omatídeos) (Gaivão et al, 1999).
Esta linhagem apresenta também ao nível bioquímico e genético uma grande sensibilidade, a valores baixos da atividade da catalase e superóxido dismutase e uma elevada capacidade de sintetizar o anião superóxido. Assim sendo, a linhagem OK-y é útil na avaliação genotóxica de agentes indutores de espécies reativas de oxigénio (ROS), estas induzem danos no DNA que condicionam nos resultados do ensaio do cometa e teste SMART (Gaivão et al, 1996).
Esta interferência deve-se ao facto do antibiótico antitumoral, SN, utilizado promover a um aumento de produção de ROS. Esta linhagem tem como marcadores os genes white (w) e yellow (y), os quais foram introduzidos através da N-etil-N-nitrosureia, deixando a maior parte do genoma intacto. A N-etil-N-nitrosureia é um potente mutagénico o qual pode induzir ganho ou perda de função de um determinado gene, daí a sua utilização nesta linhagem (Vogel et al, 1991).
3.1.1 Técnicas gerais de manuseamento da Drosófila
3.1.1.1 Meio de cultura
Para a criação de D. melanogaster, existem numerosos meios de cultura. Na realização da presente tese de mestrado foram utilizados dois meios de cultura, o meio de cultura instantâneo com a fórmula 4-24 da Carolina Biological Supply Co., Burlington, N.C., EUA e o meio de cultura convencional.
O meio de cultura instantâneo com a fórmula 4-24 da Carolina Biological Supply Co.,
Burlington, N.C., EUA, é desidratado o qual se hidrata adicionando a mesma quantidade de
água destilada (dH2O) e meio de cultura instantâneo. Após a reconstituição em dH2O, o meio
presenta uma cor azul o que facilita a visualização das larvas.
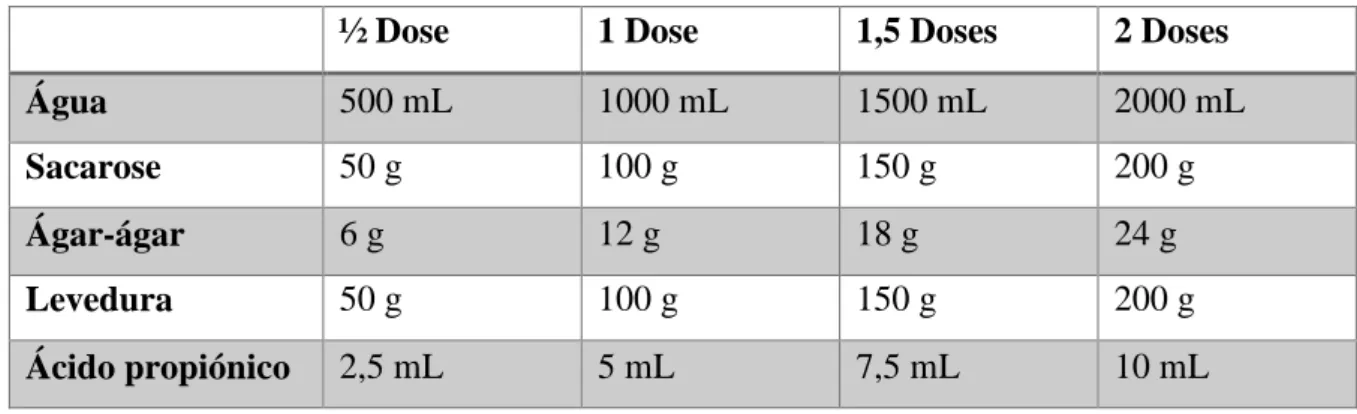
O meio de cultura convencional possui a seguinte composição: fermento de padeiro; sacarose; ágar-ágar; ácido propiónico e cloreto de sódio.
As quantidades dos constituintes do meio de cultura estão descritos na Tabela 1.
Procedimento:
Proceder à dissolução da sacarose e, em separado, dissolver a levedura e o ágar-ágar; Após a dissolução total da sacarose, colocar o preparado sobre a placa de aquecimento e juntar a levedura e o ágar-ágar, mexer sempre o meio para facilitar a homogeneização;
Decorridos aproximadamente 30 minutos, retirar o meio da placa de aquecimento e deixar arrefecer até atingir uma temperatura de mais ou menos 50 ºC;
Posteriormente, adicionar o ácido propiónico, que vai atuar como um antifúngico, para uma melhor conservação do meio;
Colocar aproximadamente 50 mL de meio em frascos de vidro com a capacidade de 250 mL.
Nos ensaios de longevidade e genotoxicidade, até ao nascimento dos descendentes, utilizou-se o meio instantâneo, sendo a manutenção dos descendentes feita posteriormente com o meio de cultura convencional.
Tabela 1: Quantidades dos produtos utilizados para a elaboração do meio de cultura de D. melanogaster
½ Dose 1 Dose 1,5 Doses 2 Doses
Água 500 mL 1000 mL 1500 mL 2000 mL
Sacarose 50 g 100 g 150 g 200 g
Ágar-ágar 6 g 12 g 18 g 24 g
Levedura 50 g 100 g 150 g 200 g
Ácido propiónico 2,5 mL 5 mL 7,5 mL 10 mL
3.1.1.2 Isolamento de fêmeas virgens
As fêmeas possuem a capacidade de armazenar e usar o esperma de uma única inseminação durante grande parte da sua vida. Deste modo, é necessário selecionar as fêmeas virgens para cruzamentos genéticos controlados. Este passo torna-se essencial para o desenvolvimento do trabalho pois as fêmeas vão ser colocadas no frasco de vidro em contacto com o meio de cultura e a substância a testar, permitindo que a fecundação e postura dos ovos e posterior desenvolvimento larvar ocorra (Raymond, 1988).
Existem essencialmente duas formas de isolamento de fêmeas virgens. A primeira consiste na identificação do sexo e isolamento das fêmeas adultas com seis horas de idade, no máximo. Seis horas é o tempo que as fêmeas necessitam para atingir a maturação sexual. O segundo método consiste na seleção de drosófilas recém-emergidas que se apresentam com uma cor branca e pálida, corpo alongado e como as asas por sobressair. Neste tipo de método é necessário um cuidado acrescido no manuseamento das drosófilas de forma a não danificar as asas, sendo um método que necessita de uma maior experiência pois existe uma maior dificuldade na identificação sexual (Raymond, 1988; Sanches, 1990).
3.1.1.3 Distinção sexual
Nas drosófilas adultas a distinção entre sexos é simples podendo ser feita a olho nu e mais pormenorizada com o auxílio de uma lupa (Figura 9).
As fêmeas apresentam um abdómen maior e mais pontiagudo do que o macho, especialmente quando esta está mais distendida com os ovos. Possuem também várias listas escuras no seu abdómen, enquanto o macho possui menos listas e apresenta uma zona terminal mais arredondada e escura. O macho é ainda caraterizado pela presença de um pente sexual que consiste em cerca de 10 cerdas escuras na articulação do tarso superior da perna anterior, esta característica é fulcral na distinção dos sexos nas 2 primeiras horas após a eclosão, quando a forma e a pigmentação do corpo ainda não estão completamente desenvolvidas (Griffiths et al, 2006; Pierce, 2005).
Figura 9: Representação da Drosophila melanogaster macho e fémea.(Adapatado de Drosophila melanogaster adultes, acedido em 20 de junho de 2014 em:
http://www.savoirs.essonne.fr/sections/ressources/photos/photo/drosophila-melanogaster-adultes).
3.1.1.4 Método Anestésico
Quando se pretende trabalhar com drosófilas de modo seguro e eficaz, é necessário proceder à sua anestesia. Existem diversos métodos para o poder fazer, sendo o mais utilizado o recurso ao éter. Apesar de ser um método simples, este requer alguns cuidados no seu manuseamento. Deve-se ter em conta o tempo de exposição em que as drosófilas estão em contacto com o mesmo, pois períodos de tempo prolongados podem conduzir a esterilidade e até mesmo levá-las à morte. Geralmente uma drosófila anestesiada permanece imóvel por um período compreendido entre os 5 e os 10 minutos
Fêmea