Estudo da expressão molecular de Vimentina,
Colagénio e Citoqueratina 14 em
adenocarcinomas do endométrio felino
Dissertação de Mestrado em Bioquímica
Marina Cláudia Gonçalves Abreu
Orientador: Professora Doutora Maria dos Anjos Clemente Pires
Co-Orientador: Professora Doutora Rita Payan-Carreira
ii
Universidade de Trás-os-Montes e Alto Douro
Estudo da expressão molecular de Vimentina,
Colagénio e Citoqueratina 14 em
adenocarcinomas do endométrio felino
Dissertação de Mestrado em Bioquímica
Marina Cláudia Gonçalves Abreu
Orientador: Professora Doutora Maria dos Anjos Clemente Pires Coorientador: Professora Doutora Rita Payan-Carreira
Composição do Júri:
iii
Agradecimentos
- À minha orientadora Professora Doutora Maria dos Anjos Pires pelos conhecimentos transmitidos, pelo apoio incondicional e palavras amigas que esteve sempre disposta a dar. Por fim mas não menos importante um obrigado pela boa orientação ao longo de todo o trabalho, sem ela não teria sido possível a sua realização.
- À minha co-orientadora Professora Doutora Rita Payan-Carreira, pela disponibilidade apresentada e principalmente pela forma clara com que me ajudou a perceber o ciclo éstrico da gata.
- À técnica Lígia Bento pela disponibilidade e colaboração ao longo do trabalho, de forma imprescindível na realização da técnica de Van Gieson.
- À D.ª Glória Milagres pela boa disposição e prestabilidade.
- Aos meus pais, por todo o esforço feito para que conseguisse finalizar mais esta etapa. Pelo carinho e atenção dados incondicionalmente.
- Às minhas irmãs e cunhados, pelo apoio e encorajamento nos momentos menos bons.
- Às minhas sobrinhas pelo carinho e por tornarem fácil tudo aquilo que para mim se tornava complicado.
- Ao meu namorado pela paciência que teve durante este período da minha vida. Pelo carinho e amor demonstrado sempre e incondicionalmente.
- À Luísa pelos ensinamentos transmitidos.
- Aos colegas de laboratório, Andreia, Fernando e Marcelo pela companhia e palavras amigas.
- Às estagiárias Helena, Raquel e Liliana que contribuíram para que o meu trabalho fizesse mais sentido.
iv
Resumo
Os adenocarcinomas do endométrio são considerados uma patologia rara em animais domésticos, apesar de a sua prevalência ser maior em coelhas e vacas. Contudo, na última década parece observar-se uma ocorrência mais elevada deste tipo de lesões em gata do que o anteriormente descrito na bibliografia.
Assim, neste trabalho pretende-se caraterizar o endométrio normal e as suas lesões através do estudo da expressão da Vimentina e da Citoqueratina 14 recorrendo à técnica de imunohistoquímica, e da caraterização histoquímica do colagénio pela técnica de Van Gieson.
Para melhor fazer esta caraterização, e dada a escassez de estudos nesta área, o trabalho teve o seu início pela obtenção de dados relativos a úteros controlo (normais), para o que se utilizaram amostras representativas das, duas fases do ciclo éstrico [fase folicular (n=9) e fase lútea (n=9)] e no caso da vimentina e da Citoqueratina 14 [na fase folicular (n=5) e fase lútea (n=7)]. Foram usados para estes estudos 34 adenocarcinomas do endométrio e 5 hiperplasias quísticas.
Os resultados mostraram que ao contrário do que seria de esperar, houve marcação positiva à vimentina nas células epiteliais do útero normal, apesar da marcação nos adenocarcinomas do endométrio ser significativamente superior. No estroma, as hiperplasias quísticas e os adenocarcinomas apresentaram a marcação mais intensa.
Na marcação do colagénio verificou-se que as hiperplasias quísticas apresentam uma intensidade de marcação significativamente superior aos úteros normais e aos adenocarcinomas do endométrio.
No que respeita à CK 14, não houve qualquer marcação nos úteros controlo e os adenocarcinomas do endométrio apresentaram um número de células marcadas superior ao exibido pelas hiperplasias quísticas.
Palavras-chave:
Gata, Adenocarcinoma, Endométrio, Vimentina, Citoqueratina 14, Imunohistoquímica, histoquimica, Van Gieson
v
Abstract
Endometrial adenocarcinomas are considered a rare disease in domestic animals, although is greater in rabbits and cows. However, in the last decade appears to be observed a higher occurrence of this type of cat in injury than previously described in the literature.
Thus, this study aims to characterize the normal endometrium and their injuries by studying the expression of vimentin and cytokeratin 14 using the immunohistochemical technique, and histochemical characterization of collagen by Van Gieson technique.
To better make this characterization, and given the lack of studies in this area, the work had its beginning by obtaining data from uterus control, for wich we used representative samples of the two phases of the estrous cycle [follicular phase (n=9) and luteal phase (n=9)] in the case of vimentin, and cytokeratin 14 [follicular phase (n=5) and luteal phase (n=7)]. Used for these studies were 34 adenocarcinomas of the endometrium and 5 cystic hyperplasia.
The results show that contrary to what one would except, was positive staining of vimentin in the epithelial cells of normal uterus, although the marking in adenocarcinomas of the endometrium de significantly higher. In the stroma, the cystic hyperplasia and adenocarcinomas showed the most intense staining.
In the marking collagen it was found that cystic hyperplasia exhibit a significantly higher intensity marking to normal uterus and adenocarcinomas of the endometrium.
As regards CK 14, there was no tag control into the uterus and adenocarcinomas of the endometrium showed a higher number of marked cells to display the cystic hyperplasia.
Keywords:
Cat, endometrial adenocarcinoma, endometrium, Vimentin, Cytokeratin 14, immunohistochemistry, histochemistry, Van Gieson
vi
Índice geral:
Agradecimentos ... iii Resumo ... iv Palavras-chave: ... iv Abstract ... v Keywords: ... v Índice geral: ... viÍndice de figuras: ... viii
Índice de Tabelas: ... x
Abreviaturas: ... xi
Capítulo I – Revisão Bibliográfica ... 1
1 – Introdução ... 1
1.1 - Ciclo éstrico ... 1
1.2 - Útero ... 3
1.2.1 - Alterações Histológicas cíclicas do endométrio... 5
2 - Adenocarcinoma do endométrio da gata (AEG) ... 5
2.1- Adenocarcinoma papilar seroso ... 6
2.2 - Adenocarcinoma “in situ” ... 7
2.3 - Adenocarcinoma de células claras ... 8
2.4 – Sinais Clínicos e Diagnóstico ... 8
3 - Hiperplasia Quística do Endométrio ... 9
3.1- Sinais clínicos e diagnóstico ... 10
4- Citoesqueleto ... 11 4.1-Vimentina ... 14 4.1.1 - Função ... 16 4.2 - Citoqueratinas ... 17 5- Transição epitelio-mesenquima ... 19 6 – Métodos de estudo ... 20 6.1- Imunohistoquímica ... 21 6.2 – Histoquímica ... 23 Capítulo II – Objetivos ... 25
Capítulo III – Materiais e Métodos ... 26
vii
2 - Métodos ... 27
2.1 - Imunohistoquímica ... 27
2.2 - Histoquímica - técnica de Van Gieson ... 29
2.3 - Avaliação da marcação ... 29 2.4 - Tratamento Estatístico ... 30 Capítulo IV – Resultados ... 31 1 - Vimentina ... 31 2 - Citoqueratina 14 ... 37 Capítulo V – Discussão ... 42 Capítulo VI – Conclusões ... 47
Capítulo VII – Referências Bibliográficas ... 48
viii Índice de figuras:
Figura 1 - Ciclo éstrico da gata ... 1
Figura 2 - Aspeto macroscópico do útero normal da gata………3
Figura 3 - Aspeto microscópico do útero de gata. ... 4
Figura 4 - Adenocarcinoma do endométrio da gata, papilar seroso.. ... 7
Figura 5 - Adenocarcinoma do endométrio da gata, in situ. ... 7
Figura 6 - Adenocarcinoma do endométrio de gata, células claras. ... 8
Figura 7 - Hiperplasia Quística do Endométrio (HQE). ... 9
Figura 8 – Representação esquemática da estrutura dos filamentos intermédios ... 13
Figura 9 - Estrutura da vimentina ... 15
Figura 10 - Representação esquemática das moléculas das citoqueratinas .... 18
Figura 11 - Marcação pela vimentina do epitélio de superfície nas fases normais do ciclo éstrico (progestagénica e estrogénica) e nas Hiperplasias quísticas do endométrio nas zonas mais afastadas dos quistos, consideradas normais neste estudo. ... 31
Figura 12 - Comparação da marcação do epitélio glandular de superfície das fases normais do ciclo éstrico (progestagénica e estrpgénica) com o epitélio das hiperplasias quísticas normal e em volta dos quístos... 32
Figura 13 - Comparação da marcação do epitélio glandular profundo das fases normais do ciclo éstrico (estrogénica e progestagénica) com o epitélio das hiperplasias quísticas normal e em volta dos quistos... 32
Figura 14 - Comparação da marcação dos diferentes epitélios das hiperplasias quísticas, o considerado normal e o que se encontra em volta dos quistos. ... 33
Figura 15 - Comparação da marcação do epitélio de superfície das fases normais do ciclo éstrico (progestagénica e estrogénica) com o epitélio que se encontra em volta dos quistos nas hiperplasias quísticas do endométrio. ... 34
Figura 16 - Comparação da marcação do epitélio de superfície das fases normais do ciclo éstrico (progestagénica e estrogénica) com o epitélio tumoral e o normal das hiperplasias quísticas. ... 34
Figura 17 - Comparação da marcação do epitélio tumoral com o dos quistos das hiperplasias quísticas. ... 35
Figura 18 - Comparação da marcação do estroma das fases normais do ciclo éstrico com o dos tumores e das hiperplasias quísticas. ... 36
Figura 19 - Imagens do útero normal na fase estrogénica (A) e de AEG com marcador imunohistoquímico para a vimentina, onde se observa a marcação intensa do estroma. Contraste com hematoxilina de Gill. ... 36
Figura 20 - Comparação da marcação do miométrio das fases normais do ciclo éstrico com o das hiperplasias quísticas com o dos tumores. ... 37
Figura 21 - Imagens de uma hiperplasia quística com marcação nas células basais de um local com diferenciação escamosa (A); AEG com marcação esporádica (B). ... 37
Figura 22 - Número de células marcadas pela citoqueratina 14 nos diferentes grupos estudados. ... 38
Figura 23 - Intensidade da marcação do miométrio nos diferentes grupos estudados. ... 39
ix
Figura 24 - Imagens de útero normal (A) e de AEG (B) com histoquímica para o colagénio (vermelho). Coloração de Van Gieson. ... 40 Figura 25 - Intensidade da marcação do estroma do miométrio nos diferentes grupos estudados. ... 40
x
Índice de Tabelas:
Tabela I - Classificação dos diferentes filamentos intermédios ………...12
Tabela II - Número de casos utilizados ... 26
Tabela III - Diluição dos diferentes anticorpos ... 28
Tabela IV - Classes dos scores usados ... 30
Tabela V - Análise estatística da marcação da citoqueratina 14. ... 38
Tabela VI - Análise estatística da marcação pela técnica de Van Gieson. ... 41
xi
Abreviaturas:
Ac – Anticorpo
AEC – 3-Amino-9-Etilcarbazole
AEG – Adenocarcinoma do endométrio da gata Ag – Antigénio
CK – Citoqueratina
DAB – 3,3’-Tetracloreto de Diaminanobenzidina FI – Filamento intermédio
GFAP – Proteína acídica fibrilhar glial HQ - Histoquímica
HRP – Peroxidase de rábano IHQ – Imunohistoquímica
LDL – Lipoproteína de baixa densidade LH – Hormona luteínizante
OVH – Ovariohisterectomia
PDGF – Fator de crescimento derivado de plaquetas TEM – Transição epitelio-mesenquima
1
Capítulo I – Revisão Bibliográfica
1 – Introdução
A gata tem sido utilizada como modelo animal em estudos destinados não só à conservação de diferentes espécies de felídeos, mas também para estudar algumas doenças em humanos (Goodrowe et al., 1989).
As lesões uterinas são raras nas espécies domésticas. Os tumores uterinos têm uma incidência estimada de apenas 0,29% de todos os tumores diagnosticados em gatos (Miller et al., 2003), incluindo os de origem mesenquimatosa e epitelial (Papparella & Roperto, 1984). Nos últimos tempos, os adenocarcinomas do endométrio da gata (AEG) têm vindo a ser descritos como sendo mais comuns que os anteriormente descritos (Saraiva et al, 2015), atingindo mesmo animais muito jovens (Payan-Carreira et al. 2013).
Além do mais, a sua sintomatologia é muito discreta e pouco específica, dificultando o seu diagnóstico (Saraiva et al, 2012)
1.1 - Ciclo éstrico
Figura 1 - Ciclo éstrico da gata (A- ciclo sem ovulação; B- Ciclo com ocorrência de cópula seguida de gestação; C- Ciclo com ovulação induzida por medicamentos, presença de outros animais ou de forma mecânica).
A fisiologia reprodutiva da gata difere bastante dos outros animais domésticos. A gata é uma fêmea que apresenta um ciclo poliéstrico sazonal em que a ovulação é maioritariamente induzida pelo coito (Johnson et al., 2001) (Figura
2 1). Desta forma, há que distinguir nos gatos os ciclos anovulatórios (em que por não ocorrer ovulação não existe fase lútea) dos ovulatórios (nos quais ocorre ovulação).
Na ausência de ovulação (Figura 1, A), a gata faz episódios de proestro e estro (fase de crescimento folicular designada de fase estrogénica ou proliferativa) recorrentes, separados entre si por uma fase curta designada por interestro. O período de interestro entre um estro e o seguinte é uma fase de repouso em que os níveis de estradiol regressam a valores basais em consequência da atrésia folicular que se observa nos ovários. Neste período não há qualquer comportamento sexual ou receptividade (Banks, 1986; Stabenfeldt & Pedersen, 1991; Johnston et al, 2001).
Os ciclos ovulatórios, pela ocorrência de ovulação, alternam entre si fases foliculares (estrogénicas ou proliferativas) e luteínicas (progestagénicas ou secretoras). Neste tipo de ciclos, a duração da fase lútea pode diferir consoante se obtém uma gestação ou não (Figura 1, B e C respetivamente), sendo mais longa no primeiro caso, pela produção de progesterona pela placenta (Johnston
et al, 2001).
Sendo os gatos animais sazonais, apresentam no seu ciclo éstrico um período sazonal de ausência de atividade – o anestro é um período não reprodutivo que corresponde normalmente à estação do ano com o fotoperíodo mais reduzido, no outono e inverno (Little, 2001); este período de anestro pode variar, nos gatos, em função da localização geográfica e das condições ambientais fornecidas aos animais. Em Portugal corresponde a um curto período entre novembro e dezembro, podendo ser quase inexistente em animais de casa, em que a temperatura se mantenha constante e a luminosidade fornecida seja superior a 12h de luz. A lactação e amamentação das crias podem, no pós-parto, também acompanhar-se de anestro, que acompanha a involução uterina mas que geralmente é mais curto que a duração da lactação, persistindo até 2 ou 3 semanas após o parto se as condições de nutrição e ambientais forem adequadas (Johnston, et al., 2001).
3
1.2 Útero
Como noutros mamíferos, o aparelho reprodutor da gata é constituído por dois ovários, dois ovidutos (ou trompas), um útero e uma vagina e vulva. O útero comporta dois cornos uterinos bem desenvolvidos (pelo que é morfologicamente classificado como bicórneo), um corpo pouco desenvolvido e uma cérvix, que encerra a cavidade uterina (Ellenport, 1986; Zambelli & Cunto, 2005) (Figura 2). Os cornos uterinos unem-se na base (parte posterior), em ângulo agudo, continuando-se pelo corpo uterino, de estrutura cilíndrica e de calibre uniforme. O canal cervical apresenta-se fortemente oblíquo em direção ventro-caudal, de tal forma que a sua abertura vaginal se encontra junto à parte ventral da vagina (Barone, 1990; Ferreira e Colaço, 2002).
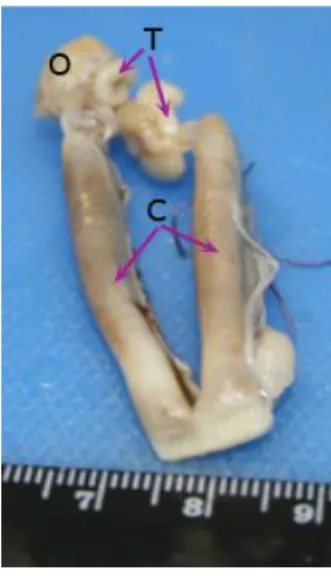
Figura 2 - Aspeto macroscópico do útero normal da gata. Constituído por 2 ovários (O), trompas (T) e 2 cornos uterinos (C). (cortesia da Profª Drª Maria dos Anjos Pires).
Do ponto de vista histológico, o útero apresenta três camadas (Figura 3), o endométrio (mucosa) é a camada mais interna e delimita o lúmen, o miométrio (constituído por duas camadas de músculo liso de disposição distinta) e o perimétrio ou serosa (Banks, 1993).
O endométrio é constituído por células epiteliais (que integram os epitélios de superfície e glandular), que variam de cúbicas a colunares dependendo da fase do ciclo, e pelo estroma, que suporta as glândulas uterinas e os vasos do endométrio, e onde se localizam as células do sistema imunitário residentes no
4 endométrio. As glândulas uterinas podem apresentar-se simples ou em ramificação tubular, estendendo-se até à lâmina própria (Banks,1993), segundo a hormona esteróide predominante. Estas glândulas encontram-se mais desenvolvidas (ramificadas) na fase progestagénica (Banks,1993).
O miométrio é constituído por duas camadas de músculo liso. A camada interna é circular e mais densa e a camada externa longitudinal é mais fina, continuando-se esta última para a serosa de tecido conjuntivo. Encontra-se presente um grande número de vasos sanguíneos e linfáticos no estrato vascular, que se localiza entre as duas camadas musculares (Banks, 1993). Os ovários, considerados por Bearden & Fuquay (1997) como os órgãos reprodutores femininos principais, são pequenos, alongados, de formato oval e com cerca de 1 cm (Ellenport, 1986); dividem-se em duas regiões: a medular e a cortical. A região medular contém nervos, vasos sanguíneos, vasos linfáticos e tecido conjuntivo laxo (Karlson et al., 1982). Na região cortical encontram-se as células germinativas (os ovócitos) e esses, por sua vez, estão contidos nos folículos ováricos (Bearden e Fuquay, 1997). O ovário contém os folículos em vários estadios que se desenvolvem na zona periférica do mesmo e que se dispõem em pequenos aglomerados, nesta espécie (McGeady, Quinn, FitzPatrick & Ryan, 2006). Os ovidutos permitem a ligação entre os ovários ao útero pelo que à ovulação os óvulos são transportados através destas estruturas até ao útero. Durante a travessia dos ovidutos, os óvulos encontram-se dependentes do fluido produzido nesta estrutura, e que permite a sua sobrevivência e maturação (Bearden e Fuquay, 1997).
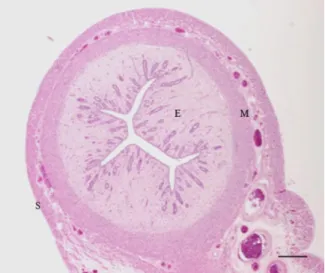
Figura 3 - Aspeto microscópico do útero de gata. E-endométrio; M-miométrio; Entre as duas camadas de músculo encontra-se o estrato vascular com variados vasos sanguíneos. S- serosa ou perimétrio. Hematoxilina e Eosina. Estalão 300µm (cortesia da Profª Drª Maria dos Anjos Pires).
5
1.2.1 - Alterações Histológicas cíclicas do endométrio
A morfologia do útero é variável ao longo do ciclo éstrico, respondendo às variações das hormonas produzidas pelo ovário. Estas alterações cíclicas são fisiológicas e tomam o nome de ciclo do endométrio. Na fase estrogénica, folicular ou proliferativa, o epitélio de superfície sofre hipertrofia e as glândulas uterinas permanecem alinhadas entre si. À medida que se aproxima o estro, a proliferação glandular torna-se mais evidente na área superficial do endométrio (Banks, 1993).
Na fase progestagénica, lútea ou secretora, o desenvolvimento glandular atinge a máxima expressão, encontrando-se as glândulas muito enroladas. Nesta fase, se ocorrer gestação mantém-se esta atividade máxima. Caso não ocorra gestação, a vascularização do estroma diminui e as células e glândulas epiteliais entram em apoptose (Banks, 1993).
Quando os animais se encontram em anestro, o endométrio apresenta escassos elementos glandulares pois as glândulas encontram-se pouco desenvolvidas, rodeadas por um estroma laxo, e a superfície do endométrio encontra-se revestida por epitélio cúbico simples (Banks, 1993).
2 - Adenocarcinoma do endométrio da gata (AEG)
O útero é o local mais comum de ocorrência de tumores no sistema reprodutivo dos felinos (Miller, et al., 2003). Os adenocarcinomas uterinos são neoplasias malignas que se desenvolvem a partir das células epiteliais do endométrio, mais comummente em vacas e coelhas, e descrito como uma patologia rara em gatas (Kennedy et al., 1998). No entanto, estudos recentes referem um aumento no número de casos descritos destas lesões nesta espécie (Saraiva et al., 2015, Payan-Carreira et al., 2013).
É uma neoplasia que se desenvolve com maior frequência em fêmeas de idade adulta (Klein, 2007), oque tem sido associado a uma frequência maior de castrações praticadas em gatas jovens (Miller et al., 2003; Taylor, 2010). No entanto, foram descritos recentemente casos destas lesões em gatas
6 extremamente jovens (Payan-Carreira et al., 2013), com idades inferiores aos 2 anos.
Esta doença pode evoluir de forma “silenciosa” e não é detetada clinicamente até ao desenvolvimento de lesões mais graves ou metástases, ou apresentar sintomatologia semelhante à da patologia inflamatória do útero, como a piómetra (Preiser, 1964; O' Rourke e Geib, 1970; Klein, 2007; Saraiva, et al., 2012).
O adenocarcinoma do endométrio da gata pode metastisar regionalmente ou à distância, nos pulmões, cérebro ou globo ocular (McEntee, 1990; Klein, 2007; Taylor, 2010; Saraiva, et al., 2012). Quando se verifica a presença de metástases, há manifestação frequente de sintomas dos órgãos afetados, nomeadamente ascite, anorexia e perda de peso, que podem coexistir com anemia, hipertermia e caquexia (Meier, 1956; McEntee, 1990; Johnston, et al., 2001; Morris e Dobson, 2008; Taylor, 2010; Saraiva, et al., 2012).
O aspeto morfológico destes tumores está pouco descrito, devido à raridade destas lesões (Kennedy et al., 1998). Estudos mais recentes, propõem uma classificação morfológica baseada nos padrões predominantes em adenocarcinoma papilar seroso, adenocarcinoma in situ e adenocarcinoma de células claras (Saraiva, et al., 2012).
2.1- Adenocarcinoma papilar seroso
O adenocarcinoma papilar seroso (Figura 4) é responsável por 3-10% dos carcinomas do endométrio na mulher (Mathews, et al., 1997). Na gata foi proposta esta classificação pelas semelhanças morfológicas observadas, sendo o tipo morfológico predominante (Saraiva, et al., 2012).
Este tumor apresenta-se na forma de papilas suportadas por um estroma fibrovascular fino; as papilas são revestidas por várias camadas de células epiteliais neoplásicas. Nestas células os núcleos são circulares ou ovais, vesiculares ou hipercromáticos, perdendo as células a polaridade normal (Saraiva, et al., 2012).
7 É possível encontrar-se numerosas células multinucleadas, de núcleos muito basófilos distribuídos de forma aleatória no tumor; é muito frequente observar- -se necrose e apoptose das células epiteliais (Saraiva, et al., 2012).
A invasão do miométrio, dos vasos sanguíneos e linfáticos não é uma ocorrência constante, mas foi observada de forma esporádica. Algumas neoplasias apresentam um notório infiltrado inflamatório de macrófagos, plasmócitos, linfócitos, neutrófilos e raramente eosinófilos (Saraiva, et al., 2012). Figura 4 - Adenocarcinoma do endométrio da gata, papilar seroso. Estalão 500µm. (Cortesia da Profa Dra Maria dos Anjos Pires).
2.2 - Adenocarcinoma “in situ”
A morfologia destes tumores (Figura 5) é muito semelhante à dos adenocarcinomas papilares serosos, com a diferença na localização no endométrio, uma vez que neste caso a neoplasia é muito superficial e este tipo de tumor é não invasivo para as camadas profundas do endométrio; não foram encontrados nunca sinais de invasão para o miométrio (Saraiva, et al., 2012).
Figura 5 - Adenocarcinoma do endométrio da gata, in situ. Estalão 50 µm. (Cortesia da Profa Dra
8
2.3 - Adenocarcinoma de células claras
Este é o tipo de tumor menos comum nos AEG, sendo maioritariamente constituído por células de grandes dimensões, de distribuição papilar ou sólido, com escasso estroma fibrovascular, podendo por vezes exibir estruturas extensas que proliferam em direção ao lúmen do útero, como nódulos na superfície do endométrio (Saraiva et al., 2012).
O carcinoma de células claras (Figura 6) representa apenas 0,8-5,5% dos casos observados na mulher (Mathews, et al., 1997). Na gata foram descritos raros casos deste tipo morfológico, com escassas mitoses e invasão do miométrio inconstante (Saraiva, et al., 2012).
Figura 6 - Adenocarcinoma do endométrio de gata, células claras. Estalão 500 µm. (Cortesia da Profa Dra Maria dos Anjos Pires).
2.4 – Sinais Clínicos e Diagnóstico
Em estado inicial, os AEG evoluem de forma silenciosa e só são detetados clinicamente quando apresentam lesões graves, metástases ou piómetra, variando a sintomatologia de acordo com a localização das metástases ou envolvimento mais geral do animal (Saraiva et al., 2012).
Os principais sinais apresentados pelos animais são semelhantes aos de piómetra, nomeadamente corrimento vaginal, vómitos, apetite irregular, perda de condição corporal e pelo baço. Estes sintomas podem aparecer acompanhados de um aumento do útero e distensão abdominal (Johnston et al., 2001; Taylor, 2010). Quando o tumor adquire grandes dimensões pode comprimir vísceras
9 adjacentes e causar outros sintomas como obstipação (Klein, 2007; Saraiva et
al., 2012).
Apenas a histologia fornece um diagnóstico definitivo relativamente a este tipo de tumor (Klein, 2007). O tratamento final passa pela cirurgia, a ovariohisteretomia (OVH), e é sempre recomendada a análise histopatológica do útero e ovários (Saraiva et al., 2012).
3 - Hiperplasia Quística do Endométrio
Uma hiperplasia é o aumento de um tecido devido ao aumento do número de células que o constituem, provocado por algum estímulo (Fernandez, 2004; Pires
et al., 2004). Este processo ocorre apenas em células passíveis de sofrer mitose.
A hiperplasia pode estar associada a processos fisiológicos, como por exemplo no útero quando o animal se encontra gestante, ou a estímulos patológicos, como em caso de inflamação ou neoplasia (Jones, Hunk, King, 1997; Bacha & Bacha, 2000; Pires et al., 2004).
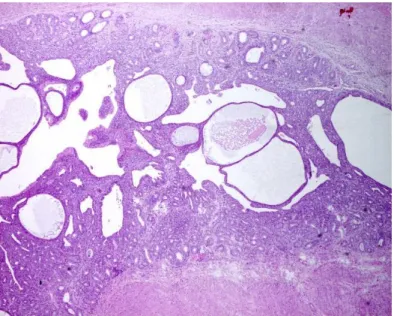
Figura 7 - Hiperplasia Quística do Endométrio (HQE). Obj 4x. (Cortesia da Profa Dra Maria dos Anjos Pires).
A hiperplasia quística do endométrio (HQE) (Figura 7) é uma resposta por parte do útero a uma exposição prolongada e crónica à progesterona, sendo que esta influência progestagénica leva a um crescimento anómalo das glândulas e do endométrio uma vez que períodos repetidos de influência progestagénica
10 predispõem ao crescimento patológico desta estrutura (Lawler et al., 1991; Perez
et al, 1999; Feldnam & Nelson, 2004; Chatdarong et al., 2005; Rungsipipatb et al., 2005). A progesterona atua num endométrio sensibilizado pelos estrogénios,
funcionando estas hormonas como uma sensibilização (priming) deste tecido, preparando-o para a ação da progesterona que é assim potencializada (Jones
et al., 1997; Evans, Chen, Hendry III & Leavit, 1980; Von Reitzeinstein et al.,
2000; Graves, 2006; Schlafer & Miller, 2007).
A progesterona atua no útero provocando hiperplasia do epitélio e das glândulas do endométrio, aumentando a sua atividade secretora, e suprimindo a contractibilidade do miométrio, com consequente diminuição da motilidade uterina, o que agrava a acumulação das secreções que vão sendo produzidas. Outra das suas ações é a inibição da resposta leucocitária local, que predispõe o útero para possíveis infeções (Davidson, 1995; Johnson, 2009; Feldman & Nelson, 2004).
A HQE aparece frequentemente associada a piómetra resultante da colonização bacteriana no útero e seu conteúdo (Agudelo, 2005; Schlafer e Gifford 2008; Kempisty et al., 2013). A ocorrência de HQE acompanhada de piómetra tem sido descrita como um processo dependente da progesterona, embora possa não ser este o único fator hormonal envolvido, como atrás referido. Apesar de este fenómeno ocorrer com muita frequência, são pouco conhecidos os fatores que lhe estão subjacentes na gata (Agudelo, 2005; Schlafer e Gifford, 2008; Kempisty et al., 2013). Existe um aumento da expressão dos recetores de progesterona no endométrio com piómetra, assim como nos casos de hiperplasia do endométrio (ligeira ou grave), em comparação com a sua concentração num útero sem alterações (Misirlioglu et al., 2006).
3.1- Sinais clínicos e diagnóstico
A HQE não apresenta por si só, nas suas fases iniciais, sintomas passíveis de serem detetados, apresentando-se o animal normal ao exame físico, mas o útero poderá estar palpável (Little, 2001; Feldman & Nelson, 2004). Esta doença poderá manifestar-se no animal através da ocorrência de anestro prolongado, e
11 é uma causa frequente de infertilidade ou morte fetal tanto em gatos como em cães (Little, 2003; Feldman & Nelson, 2004; Axnér, et al., 2010).
Na eventualidade das lesões de HQE evoluírem para hidrómetra ou mucómetra (i.e., acumulação de fluido de viscosidade variável na cavidade uterina na ausência de contaminação bacteriana), estas alterações não provocam, de uma forma geral, sintomatologia muito expressiva. Pode ocorrer, distensão abdominal e corrimento seroso ou mucoso (Haaften & Taverne, 1989; Potter et al., 1991; Little, 2001; Johnson, 2009). A distensão abdominal, se for grave, causa aumento de pressão nesta zona, o que se poderá refletir na respiração do animal, que apresentará um aumento na taxa respiratória (Haaften & Taverne, 1989).
4- Citoesqueleto
O citoesqueleto é uma estrutura dinâmica de origem proteica intracitoplasmática que tem como principal caraterística a organização e sustentação mecânica das células (Karantza, 2011). É responsável pela interação das células com o meio extra celular, pela divisão celular, suporte da membrana plasmática e pelo fornecimento de ligações mecânicas, as quais protegem as células em situações de stresse (Alberts, et al., 2002).
O citoesqueleto é constituído por três tipos de filamentos: microfilamentos, os microtúbulos e os filamentos intermédios (FI). Os microfilamentos são compostos por cadeias de actina e têm como função a resistência à tensão e a manutenção da forma celular. Os microtúbulos têm especial importância no transporte intracelular e na formação do eixo mitótico (Karantza, 2011). Os filamentos intermédios constituem fibras interlaçadas com 10 nm de diâmetro, formados por proteínas pertencentes a uma ampla e heterogénea família (Alberts, et al., 2009) que possui propriedades únicas que os distinguem dos restantes componentes do citoesqueleto, nomeadamente, a inexistência de polaridade intrínseca, a impossibilidade de ligação das subunidades constituintes a nucleótidos e uma relevante estabilidade (Lodish, et al., 2008). Estes filamentos intermédios podem ser divididos em cinco tipos diferentes dos quais se destacam o tipo I e II onde se enquadram as citoqueratinas que são as
12 formas mais complexas (Ramaekers e Bosman, 2004), e o tipo III onde se integra a Vimentina (Ramaekers e Bosman, 2004).
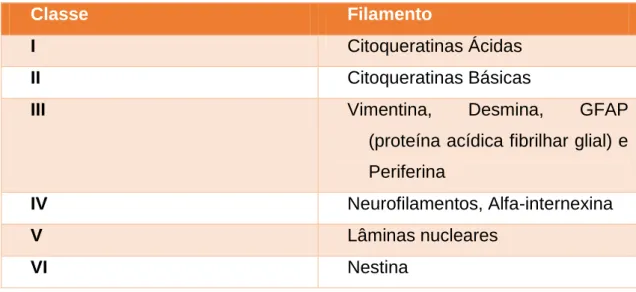
Atualmente, os FI encontram-se agrupados em 6 subclasses distintas (Tabela I) e, segundo Gard e colaboradores (1979), podem ser encontradas várias classes destas proteínas na mesma célula e o mesmo filamento pode conter mais de um tipo de subunidade proteica. Estas variações tornam-se evidentes quando a composição de um determinado filamento intermédio é observada em diferentes tipos celulares ou em diferentes estados de diferenciação de um mesmo tipo, podendo acrescentar à caracterização dos FI o facto da sua expressão e função ser regulada pelo estado de desenvolvimento da célula (Gard et al., 1979).
Tabela I - Classificação dos diferentes filamentos intermédios (adaptado de Machado & Figueiredo, 1996).
Os FI possuem regiões com sequências que definem o domínio alfa-helicoidal em forma de mola que é responsável por uma semelhança na morfologia entre todos os filamentos (Steinert et al., 1980). Os mesmos autores propuseram uma estrutura comum para as proteínas dos FI que consiste em dois domínios homólogos em alfa-hélice que são separados e se estendem por cinco domínios variáveis globulares, o que explicaria a semelhança estrutural e a diversidade química e imunológica entre os FI (Steinert, et al., 1980).
Classe Filamento
I Citoqueratinas Ácidas
II Citoqueratinas Básicas
III Vimentina, Desmina, GFAP
(proteína acídica fibrilhar glial) e Periferina
IV Neurofilamentos, Alfa-internexina
V Lâminas nucleares
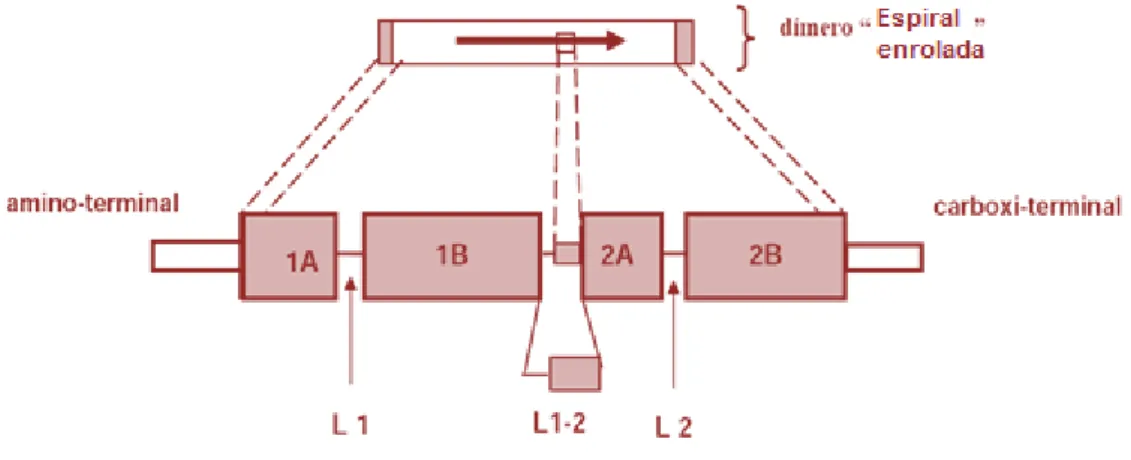
13 O domínio central é subdividido em quatro partes denominadas 1A, 1B, 2A e 2B, unidas entre si por três segmentos curtos não-helicoidais (“linkers”), identificados pelas siglas: L1, L1-2, e L2. Em cada uma de suas extremidades, o domínio central se encontra ligado a domínios terminais: uma estrutura carboxi-terminal por um lado, e uma estrutura amino-carboxi-terminal por outro. (Fuchs, 1995) (Figura 8).
Apesar da possibilidade de se produzir anticorpos específicos para cada filamento intermediário, a proteína de 66 Kd é comum a todos os FI de vertebrados e invertebrados (Pruss, et al., 1981).
Figura 8 – Representação esquemática da estrutura dos filamentos intermédios (adaptado de: Haake, 1998).
Segundo a definição de Lazarides (1982), os FI compreendem uma complexa classe de proteínas que possuem regiões de homologia na sequência de aminoácidos, bem como extensas áreas de divergências entre os mesmos. A existência de áreas, estruturalmente homólogas poderiam também permitir a copolimerização de duas ou mais subunidades, como é o caso da vimentina e desmina, vimentina e GFAP e vimentina e várias citoqueratina (Lazarides, 1982). A sequenciação de proteínas e de cDNA tem mostrado que os FI são membros de uma grande família de multigenes que codificam um número variável de sequências de aminoácidos (Fliegner, 1990).
14 Têm vindo a ser identificadas inúmeras proteínas associadas aos FI, formando um grupo heterogéneo e associadas aos FI que regulam a organização molecular do citoesqueleto (Steinert, et al.,1988).
4.1-Vimentina
A vimentina é o principal filamento intermédio das células do tecido conjuntivo, nomeadamente dos fibroblastos. A extração, deste filamento em presença de detergente iónico, permitiu a obtenção de um polipeptídeo de 52-58 KDa. A maior parte das células de origem mesenquimatosa possui filamentos de vimentina, que podem ser diferenciados por via de diferentes técnicas, nomeadamente histoquímica, imunohistoquímica e bioquímicamente das outras classes de FI (Franke, 1978). As subunidades de vimentina polimerizam-se formando um complexo sistema de redes com uma organização radial estendendo-se de maneira centrífuga ao núcleo. A localização das redes de vimentina é coincidente com a localização das redes de microtúbulos, sugerindo que estes dois sistemas de filamentos interajam entre si (Yoon et al.,1998; Clarke & Allan, 2002). Os anticorpos anti-vimentina apresentam reação cruzada com células de mamíferos, aves e anfíbios, indicando que esta proteína foi bem conservada na evolução (Franke, 1978). No entanto, Chou, 1989 refere que a vimentina de alguns mamíferos e aves mostra algumas diferenças entre si e podem ser produzidos anticorpos específicos para cada espécie desde que não apresentem reações cruzadas.
Alguns trabalhos mostraram que a vimentina e a desmina coexistem juntas, durante toda a miogénese, e enquanto a vimentina predomina em estados iniciais a desmina passa a predominar em estados mais tardios (Chou, 1989).
Em algumas fases, a distribuição de vimentina e desmina é indistinta, o que sugere que as suas subunidades são capazes de formar co-polímeros para originar um filamento. A variação dos níveis de vimentina e desmina no músculo adulto é uma importante caraterística que se relaciona com a capacidade funcional do mesmo. Desta forma, os músculos esqueléticos dos mamíferos mostram, principalmente, a desmina como filamento intermédio, enquanto a
15 vimentina é encontrada em pequenas quantidades ou está ausente (Lazarides, 1982).
O alto grau de insolubilidade da vimentina sugere que a sua função estrutural é no citoplasma. Algumas evidências bioquímicas e morfológicas indicam que os filamentos de vimentina estão associados à membrana nuclear e plasmática, mantendo a posição do núcleo e do fuso mitótico. Durante a mitose, a vimentina sofre fosforilação do seu domínio amino terminal e dispersa-se em agregados, contendo formas filamentosas (Chou, 1989). O controlo dos processos de polimerização e despolimerização de vimentina é realizado por um complexo sistema de cinases e fosfatases (Steiner et al., 1993). Tem sido demonstrado que a vimentina pode ser fosforilada em resíduos de serina e treonina. Além disso, o fator de crescimento derivado de plaquetas (PDGF) é capaz de induzir a fosforilação de vimentina em resíduos de tirosina, promovendo despolimerização em determinados segmentos (Valgeirsdótir et al., 1998).
A detecção de proteínas de filamentos intermédios como a vimentina ou outras ajuda a determinar a origem das células tumorais quando existem situações de muita indiferenciação morfológica, uma vez que na maior parte dos casos as células transformadas mantêm a expressão dos seus FI originais (Ramos-Vara, et al., 2010).
Figura 9 - Estrutura da vimentina: molécula composta por dois monómeros enrolados entre si formando um dímero que possui nas extremidades domínios amino e carboxil. Estes dímeros formam tetrâmeros que interagem entre si formando a folha-beta. (acesso: http://pt.wikipedia.org/wiki/Vimentina) em: 10-07-2014
16 A vimentina (Figura 9) é o filamento intermédio mais amplamente distribuído nas células mesenquimatosas, sendo expressa em quase todas as células com esta origem, e nas células epiteliais pode ser co-expressa com citoqueratinas. Esta proteína apresenta-se expressa também nas fases exponenciais de crescimento de células em cultura, independentemente do tipo de FI que estas expressavam “in vivo” (Eckes et al., 1998; Valgeirsdótir et al., 1998). Apesar de a maioria dos adenocarcinomas do endométrio serem negativos para a vimentina, há evidências que certos tumores epiteliais de elevado grau de atipia adquirem a capacidade de expressar esta molécula (Leong, et al., 1999).
4.1.1 - Função
O alto grau de insolubilidade da vimentina sugere que a sua função estrutural decorre no citoplasma, como forma de suporte e ancoragem da posição dos organelos. A vimentina está ligada ao núcleo, retículo endoplasmático e mitocôndria, podendo esta ligação ser lateral ou terminal relativamente a estes organelos (Katsumoto et al., 1990).
A natureza dinâmica da vimentina é importante para oferecer flexibilidade à célula. Em geral, a vimentina é um componente do citoesqueleto responsável por manter a integridade celular (Goldman, et al., 1996). Descobriu-se ainda que vimentina controla o transporte de colesterol derivado da lipoproteína de baixa densidade (LDL), do lisossoma para o local de esterificação (Sarria, et al., 1992). Com o bloqueio do transporte de colesterol derivado do LDL dentro da célula, as células passam a armazenar uma percentagem muito menor de lipoproteína do que células normais com vimentina. Essa dependência parece ser o primeiro processo da uma função biológica em qualquer célula que depende de uma rede celular de filamentos intermédios. Esse tipo de dependência tem ramificações em células das glândulas adrenais do córtex, as quais dependem de ésteres de colesterol derivados do LDL (Sarria, et al., 1992).
Observações da expressão da vimentina, em tipos celulares particulares e em determinados estadios do desenvolvimento, demonstram a sua interação em funções como a migração e a sinalização celular, para além das tradicionalmente descritas de manutenção da arquitetura celular (Eckes, et al., 1998). Durante o
17 desenvolvimento, em ratos, a expressão de vimentina está associada com a mobilidade de células da crista neural (Cochard & Paulin, 1984), da endoderme parietal (Lehtonen, et al., 1983) e das células mesenquimatosas (Franke et al., 1982).
A expressão de vimentina em células pré-diferenciadas durante o desenvolvimento do sistema nervoso e dos músculos sugere que esta proteína possa servir com um sistema precoce de estruturação celular que mais tarde vem a ser substituído por um sistema mais especializado como, por exemplo, a GFAP em astrócitos (Cochard & Paulin, 1984) ou a desmina em células musculares (Furst et al., 1989). Ingber et al. (1994) e Maniotis et al. (1997) têm sugerido que a distribuição intracelular da vimentina está relacionada com um sistema de transmissão de sinais mecânicos e bioquímicos. A sobre-expressão de vimentina em ratos leva a uma diferenciação aberrante do cristalino (Capetanaki et al., 1989), porém este mesmo efeito é observado com a sobre-expressão de outros sistemas de FI (Monteiro et al., 1990). Colucci-Guyon e colaboradores (1994), utilizando um sistema de inativação do gene para a vimentina em ratos, não observaram nenhuma alteração significativa no que diz respeito ao desenvolvimento e a funções distintas nos tecidos e órgãos. Em adição a estes dados, Holwell e colegas (1997) relatam que a vimentina não apresenta função no crescimento, mobilidade celular e na resistência a lesões mecânicas.
4.2 - Citoqueratinas
As citoqueratinas (CK) são um grupo de proteínas de filamentos intermédios composto por mais de 50 polipéptidos diferentes (Schweizer et al., 2006). O termo “citoqueratina” (CK) é utilizado pelos biólogos celulares e patologistas para descrever as queratinas encontradas no citoplasma das células epiteliais, com o intuito de distingui-las das queratinas especializadas, como as que compõem as unhas e cabelos na raça humana. No citoplasma das células eucarióticas, as citoqueratinas constituem um importante componente do citoesqueleto, sendo responsáveis pela função de manutenção estrutural da célula e do tecido e a proteção contra traumas mecânicos, além de apresentarem também um papel
18 provável na intercomunicação de células epiteliais adjacentes (Ishida-Yamamoto, 2002; Oshima, 2002).
Este tipo de filamentos intermédios estão presentes nas células epiteliais de forma diferenciada, distribuindo-se especialmente por cada subtipo celular epitelial, bem como nos tumores quer malignos quer benignos com origem nestas células. Mais raramente, podem surgir também em células não epiteliais (Moll et al., 1982).
As CK abrangem um total de 20 subunidades diferentes com peso molecular compreendido entre os 40-70 KDa e podem ser divididas de acordo com o peso molecular e ponto isoelétrico. As citoqueratinas do tipo I (CK 9 a CK 20) são de natureza ácida e possuem um baixo peso molecular, enquanto as do tipo II (CK1 a CK8) constituem uma forma básica e com maior peso molecular. Todas as CK têm uma molécula semelhante, constituída por quatro segmentos helicoidais - 1A, 1B, 2A e 2B - intercalados por segmentos curtos não helicoidais, designados por segmentos ligantes L1, L12 e L2. Na extremidade encontram-se os segmentos variáveis, V1 e V2, sendo que as CK básicas apresentam segmentos H1 e H2 (head_segments) responsáveis pela interação entre os FI das proteínas, entre os helicoidais e os variáveis. Apesar dessa grande semelhança, foram desenvolvidos anticorpos monoclonais capazes de marcar apenas cada uma das CK (Fuchs, 1995) (Figura 10).
Figura 10 - Representação esquemática das moléculas das citoqueratinas, com os segmentos helicoidais (1A, 1B, 2A, 2B), segmentos de ligação (L1, L12, L2), segmentos homólogos (H1, H2) - presentes somente nas citoqueratinas básicas - e os segmentos variáveis (V1 e V2).
Diferentes tipos de CK são expressas durante a diferenciação das células epiteliais, em diferentes estadios de desenvolvimento e em diferentes tecidos epiteliais, bem como em estadios patológicos ou sob alterações de ambiente celular (Nagle,1989).
19 Neste trabalho propomos o estudo da citoqueratina 14, um filamento intermédio que distingue as células epiteliais simples das escamosas, estando geralmente associada a estas últimas (O´Connell et al., 2000). A maioria dos epitélios estratificados, como esôfago, córnea, epiderme e folículo piloso, expressa as CK 5 e 14 nas células da camada basal e nas células precocemente diferenciadas (Chu, 2002). Esta CK também está presente nas células basais com caraterísticas mioepiteliais da glândula mamária da gata (Travassos, 2006). A camada externa de células do folículo piloso e os dutos sebáceos também expressam as CKs 5 e 14 (Freedberg, 2001).
5- Transição epitelio-mesenquima
A transição de células epiteliais para mesenquimatosas (TEM -
epithelial-mesenchymal transition) é caraterizada pela diminuição das caraterísticas
epiteliais (tais como reorganização das junções intercelulares epiteliais, perda de polaridade ou adesão intercelular) e reforço das caraterísticas mesenquimatosas (tais como o aumento da expressão de vimentina, fibronectina e enzimas proteolíticas, aumento das características invasoras e migratórias). O termo TEM encontra-se descrito na morfogénese embrionária, na regeneração e reparação dos tecidos assim como no início da invasão tumoral e formação de metástases (Kalluri, et al., 2009; Tomaskovic, et al., 2009).
A vimentina é uma molécula considerada como indicadora de conversão de células epiteliais em mesenquimatosas e parece ser um dos melhores sinalizadores da TEM em carcinomas (Zeisberg, 2009). A expressão aumentada da vimentina e a redução dos marcadores epiteliais estão associados ao aumento da migração e invasão das células tumorais, como é esperado para a TEM (Birembaut & Foidart, 2003; Korsching, et al., 2005).
A vimentina é um filamento intermédio do tipo III normalmente expresso em células de origem mesenquimatosa. No entanto, vários estudos demonstraram que a vimentina é expressa também em células epiteliais quando estão envolvidas em processos patológicos ou fisiológicos que requerem migração celular epitelial; a vimentina demonstrou ter um papel funcional na migração celular das células epiteliais (Hendrix, et al., 1997; Eckes, et al., 1998; Gilles, et
20
al., 1999; Singh et al., 2003) e poderá desempenhar um papel na invasão
tumoral. Além disso, células de tumores primários positivas à vimentina poderiam ter maior potencial metastático, como foi demonstrado em linhas celulares de pulmão, num modelo “in vivo” desenvolvido por Bonnomet e colaboradores (2012), mimetizando a TEM associada à progressão metastática (Bonnomet, et
al., 2012).
A expressão da vimentina em células tumorais epiteliais tem sido descrito em neoplasias da mama, da próstata e em carcinomas cervicais (Gilles, et al., 1996; Lang, et al., 2002; Kokkinos, et al., 2007; Logullo, et al., 2010).
Montserrat e colaboradores (2012) sugerem que a transição de epitélio para mesenquima poderá contribuir para a progressão do adenocarcinoma do endométrio da mulher em particular na invasão do miométrio. Um mecanismo sugerido para a propagação dos adenocarcinomas está relacionado com esta transição, em que há perda da expressão das citoqueratinas pelas células epiteliais passando a expressar a vimentina e a α-actina, caraterísticas das células mesenquimatosas (Thiery, 2002; Montserrat et al, 2012).
6 – Métodos de estudo
A coloração de rotina de hematoxilina e eosina (H&E) é universalmente utilizada no diagnóstico morfológico dos tecidos animais. Estes dois corantes conferem coloração diferencial a estruturas celulares ácidas (como o núcleo, que cora de azul pela hematoxilina) ou básicas (os compostos do citoplasma que coram de rosa pela eosina). Esta diferença permitiu a leitura diferencial das estruturas celulares constituindo a base da descrição morfológica em histologia e histopatologia, sendo nesta coloração que se baseia o diagnóstico das lesões encontradas (Bancroft, 2007).
Posteriormente ao diagnóstico morfológico, e procurando uma maior precisão ou fundamentos para emissão de um prognóstico, pode haver a necessidade de o complementar pela realização de técnicas de histoquímica (HQ) e de imunohistoquímica (IHQ) (Bancroft, 2007). A técnica de IHQ é bastante
21 vantajosa no diagnóstico diferencial de tumores, sendo possível avaliar a origem tecidular da neoplasia em estudo (Moll, et al., 2008).
6.1- Imunohistoquímica
As técnicas de Imunohistoquímica (IHQ) baseiam-se na formação de complexos imunes sobre estruturas tecidulares, permitindo assim a deteção das mesmas ou de produtos “in situ”, revelados por fluorescência, cor ou eletrodensidade dos alvos. É também possível a sua observação microscópica em simultâneo com o aspeto morfológico que é preservado nesta técnica (Polak, 2003).
A técnica de IHQ pode ser efetuada pelos métodos direto ou indireto. O método direto é o mais simples, com apenas um passo (one-step) e engloba apenas um anticorpo marcado com o conjugado enzimático que reage diretamente com o antigénio que está no tecido. Este é um procedimento simples e rápido, mas com muitos falsos positivos (Bancroft, 2007).
O método indireto é uma técnica em mais do que um passo, em que se utiliza um anticorpo primário não-marcado com conjugado que reage com o antigénio presente no tecido, e um anticorpo secundário marcado com a enzima, capaz de reagir com o anticorpo primário. O método indireto, além de apresentar alta sensibilidade, apresenta a vantagem de que apenas necessita de uma pequena quantidade de anticorpos secundários conjugados (Bancroft, 2007).
Atualmente as técnicas de IHQ mais utilizadas são enzimáticas, indiretas que utilizam enzimas como marcadores, e que permitem a obtenção de resultados mais sensíveis, assim como a determinação da intensidade relacionada com a quantidade de antigénio (Ag) detetado. Estas técnicas são reveladas pelas reações entre a enzima e o seu substrato para obter produtos coloridos a partir de cromogénios incolores e visualizados em microscopia de luz ou de fluorescência (Bancroft, 2007).
A enzima mais utilizada, por rotina, é a derivada da peroxidase de rábano (horseradish peroxidase- HRP), que tem como substrato o peróxido de hidrogénio e como cromogénio mais frequente o 3,3’-Tetrahidrocloreto
22 Diaminobenzidina (DAB), que forma um precipitado castanho, ou o 3-Amino-9-Etilcarbazole (AEC), que toma uma coloração laranja-avermelhada, no local da ligação do antigénio com o anticorpo (Ac) (Ramos-Vara, 2005).
A técnica de IHQ utiliza anticorpos poli- ou monoclonais para detetar os múltiplos Ag que se pesquizam nos tecidos, seja congelados ou fixados em formol ou outro fixador, e processados em parafina (Saliki & Dubovi, 2004; Radostits, et al., 2007).
Geralmente os anticorpos monoclonais são mais específicos, uma vez que detetam apenas um epítopo do Ag em estudo. São produzidos “in vitro” depois de uma primeira fase de imunização dos animais vivos. Os anticorpos policlonais são obtidos pela inoculação do antigénio em animais que, após re-inoculação em tempos predeterminados, desenvolvem uma resposta imune eficaz com produção de anticorpos que são isolados do soro numa mistura heterogénea de anticorpos que reconhecem diversos epítopos do mesmo Ag (Saliki & Dubovi, 2004).
A técnica de IHQ tem como principais vantagens a sua elevada sensibilidade e especificidade, permitindo detetar um antigénio específico em diferentes tecidos numa só lâmina, e que também pode ser utilizado em células individuais. É de realização simples e necessita de quantidades pequenas de anticorpos (Saliki & Dubovi, 2004).
Também apresenta algumas desvantagens, nomeadamente o demorado processamento da amostra, a necessidade de um observador treinado para a sua interpretação, e a subjetividade dos resultados inerentes aos avaliadores (Meira, 2010).
Como todas as técnicas, a de imunohistoquímica tem algumas limitações e estas prendem-se com vários pontos críticos: a fixação inadequada ou excessiva dos tecidos, variações no pH do fixador; a inativação inadequada das enzimas endógenas como peroxidases e biotina, a insuficiente ou exagerada recuperação dos antigénios, deficiente ou excessiva revelação, ou autólise dos tecidos (Meira, 2010). Segundo este autor, podem ainda haver pigmentos (por exemplo os hemáticos) nas células que podem mascarar a interpretação da IHQ por ser
23 semelhante à marcação do cromogénio, induzindo em erro o avaliador (Meira, 2010).
6.2 – Histoquímica
Os tecidos e seus constituintes são incolores, sendo necessário recorrer a técnicas de coloração, que permitam evidenciar e discriminar as diferentes estruturas celulares (Drury, et al., 1980) ou componentes tecidulares. Estas técnicas assumem extrema importância na caracterização de determinadas lesões, e evidenciamos a técnica de Van Gieson para o colagénio ou o Tricrómio de Masson para diferenciar músculo, colagénio e eritrócitos (Gouveia, 1999).
A técnica de Van Gieson é usada para diferenciar o colagénio em diferentes tecidos e demonstrar o aumento deste composto em situações patológicas. Este método combina dois ou mais corantes aniónicos e dependem de ligação por componentes do tecido diferencial (Bancroft, 2007). Segundo este autor, a diferenciação é determinada por uma combinação de diferenças no tamanho relativo das moléculas de corante, as diferenças na estrutura física do tecido, e as diferenças na composição em aminoácidos dos elementos de tecido. Sendo as fibras de colagénio fortemente interligadas por pontes dissulfito, após um tratamento oxidativo pela iodina, estas são convertidas em derivados aniónicos de ácido sulfónico, extremamente basofílicos e capazes de reagir com corantes básicos como a hematoxilina. Concentrações elevadas de eletrólitos na solução corante potenciam a reação e inibem a ligação do corante à cromatina e ao RNA ribossomal (Bancroft, 2008).
A coloração de Van Gieson é uma mistura de ácido pícrico e fucsina ácida. É o método mais simples de coloração diferencial de colagénio e outro tecido conjuntivo. Ao usar soluções combinadas de ácido pícrico e fucsina ácida, as pequenas moléculas de ácido pícrico penetram todos os tecidos rapidamente, mas são firmemente retidas nos eritrócitos e músculo (Bancroft, 2008), conferindo-lhes uma cor amarela. O colagénio cora de vermelho/magenta.
A técnica de Van Gieson tem como principais limitações o facto de a solução enfraquecer depois de algum tempo de preparação, que pode ser reforçada pela adição de algumas gotas de fucsina ácida fresca; a espessura do corte de tecido
24 (por microtomia) pode afetar a intensidade da coloração assim como a necrose pode apresentar coloração não específica. Tem que ser usado tecido com controlo interno
25
Capítulo II – Objetivos
O objetivo geral deste trabalho foi a contribuição para caraterização do endométrio normal e dos adenocarcinomas do endométrio da gata, utilizando anticorpos anti-vimentina e a histoquímica de Van Gieson para a caraterização do estroma, e anticorpos anti-CK 14 para a determinação ou não da sua existência nos elementos epiteliais do endométrio normal e nos adenocarcinomas do endométrio de gata. Assim, os objetivos mais específicos foram:
- Adaptação do método indireto de imunohistoquímica com anticorpo anti-vimentina e anti-CK 14 aos tecidos de gato
- Caraterização da imunolocalização da vimentina no endométrio da gata durante o ciclo éstrico;
- Avaliação de eventuais alterações no padrão normal de vimentina em hiperplasias quísticas e adenocarcinomas do endométrio da gata;
- Caraterização histoquímica do colagénio pela coloração de Van Gieson no útero normal de gata nas diferentes fases do ciclo éstrico, nas hiperplasias quísticas e nos adenocarcinomas do endométrio.
- Caraterização da imunoexpressão da CK 14 no endométrio cíclico da gata e avaliação de possíveis alterações nas HQE e nos AEG;
26
Capítulo III – Materiais e Métodos
1 - Materiais
Para este trabalho foram usadas amostras do arquivo do Laboratório de Histologia e Anatomia Patológica da Universidade de Trás-os-Montes e Alto Douro (LHAP-UTAD), que consistem em tecidos incluídos em parafina, após fixação em formol tamponado a 10% e sujeitos ao processamento de rotina.
Este trabalho foi devidamente autorizado pela Comissão de Ética da UTAD com o número DOC22/CE/2014.
Os casos foram previamente diagnosticados pela técnica de rotina de hematoxilina e eosina que determinou os grupos de animais controlo em fase proliferativa, em fase secretora, assim como os casos com hiperplasia quística e casos de adenocarcinoma do endométrio em gata. Foram utilizadas amostras de útero de gata com diagnóstico de adenocarcinoma do endométrio e como controlos usaram-se úteros nas fases estrogénica e progestagénica, e hiperplasias quísticas do endométrio (Tabela II). Destes casos foram efetuados cortes seriados de 3 micra em lâminas adesivadas em Silane® que foram usados para todas as técnicas em estudo.
Tabela II - Número de casos utilizados
Estadios Van Gieson Vimentina Citoqueratina 4
Fase Estrogénica 5 9 5
Fase Progestagénica 6 9 7
AEG 34 34 34
27 Neste trabalho usámos o método indireto de imunohistoquímica com aplicação do anticorpo primário monoclonal anti vimentina e anti citoqueratina 14.
Para complementar a análise da marcação do anticorpo anti vimentina será utilizada a técnica de histoquímica pela coloração de Van-Gieson que é específica para o tecido conjuntivo, mais especificamente, para as fibras de colagénio, como já descrito.
2 - Métodos
2.1 - Imunohistoquímica
2.1.1 - Preparação das amostras
A técnica de IHQ foi executada sobre uma lâmina de vidro adesivada com Silane®, um composto que permite ao tecido (previamente fixado e processado para parafina) manter-se colada durante todo o processamento.
2.1.2 - Hidratação das lâminas
Todo o processamento de IHQ foi feito em meio líquido, pelo que os tecidos colados nas lâminas deverão ser primeiro hidratadas. Assim, as lâminas contendo os cortes dos tecidos foram colocadas em xilol durante 10 a 15 minutos, e hidratadas em álcoois sucessivos de concentração decrescente (cerca de 10 minutos em cada passo) e por fim passadas por água destilada.
2.1.3 - Tratamento térmico
As lâminas foram colocadas em tinas de material passível de ir ao micro-ondas (MO) e cobertas com tampão citrato a pH 6 sendo então sujeitas a ciclos de 5 minutos no MO a 750W (1 ciclo de 5 minutos no caso da vimentina e 2 ciclos de 5 minutos para a citoqueratina 14).
28 Terminado este passo, as lâminas são arrefecidas lentamente no tampão citrato durante cerca de 30 minutos.
De seguida as lâminas foram inativadas com peróxido de hidrogénio (H2O2) a 3% durante 30 minutos. Findo este período, as lâminas foram lavadas com PBS.
Depois das lâminas colocadas em câmara húmida horizontal, incubaram-se com soro normal (5 minutos) cuja função é ocupar, de forma inespecífica, todos os locais de possível ligação no tecido. Usámos o soro universal Ultra V Block.
Foi retirado o excesso de soro normal e fez-se a incubação com o anticorpo primário (Tabela 3).
As lâminas voltaram a ser lavadas com PBS, com o soro biotinilado durante 10 minutos. Lavaram-se novamente as lâminas seguindo o procedimento descrito anteriormente.
Tabela III - Diluição dos diferentes anticorpos
Anticorpo Diluíção Incubação Clone Laboratório
Vimentina 1:100 overnight NCL-L-Vim-V9 Novocastra Laboratories Ltd Citoqueratina 14 1:20 overnight NCL-LL002 Novocastra Laboratories Ltd
Por fim fez-se a incubação com o complexo enzimático (peroxidase) durante 10 minutos, e fizeram-se novamente as lavagens com PBS. Seguidamente adicionou-se DAB ao qual se juntou previamente H2O2 a 30% e deixou-se atuar durante 10 minutos. Lavaram-se as lâminas com água corrente durante 10 minutos e fez-se o contraste com Hematoxilina de Gill durante 2 minutos. Em seguida lavaram-se as lâminas com água corrente tépida durante 10 minutos.
29
2.1.4 - Desidratação das lâminas
As lâminas foram desidratadas por imersão em álcoois de concentrações crescentes (70º 80º 90º 100º), por períodos individuais de cinco minutos, sendo depois colocadas em xilol. Por fim foram montadas com Entellan ®.
2.2 - Histoquímica - técnica de Van Gieson
2.2.1 - Hidratação das lâminas
Todo o processamento de HQ foi feito em meio líquido pelo que as lâminas foram sujeitas ao mesmo processo de desidratação anteriormente descrito para a IHQ
2.2.2 - Coloração
As lâminas foram lavadas em água corrente durante 2 min, seguidamente foram coradas durante 15 minutos com hematoxilina férrica. Findo este tempo foram lavadas em água corrente tépida durante 10 minutos e por fim foram coradas pelo Van Gieson 1 a 3 minutos. Passaram-se diretamente para o álcool a 95% e fez-se a desidratação, diafanização e montagem tal como na IHQ.
2.3 - Avaliação da marcação
A expressão da marcação da vimentina e da citoqueratina 14 foi avaliada ao microscópio ótico por dois observadores independentes, através da estimativa da intensidade das células positivas, da sua percentagem e localização da marcação das diferentes estruturas do endométrio no caso dos controlos (epitélio de superfície – ES; glândulas superficiais – GS; glândulas profundas – GP), também o epitélio dos quistos nas HQE e nos tumores nas células neoplásicas (epitélio tumoral – ET). Em todos os casos foi também quantificada a intensidade de marcação no estroma e miométrio.
A intensidade da marcação para todos as células (normais e tumorais) foi expressa em: 0 – sem marcação ou negativa; 1 (+) = fraca; 2 (++) = moderada e 3 (+++) = intensa.
30 Nos casos em que houve positividade, a percentagem de marcação foi avaliada em: 1 = <25%; 2 = 25%-75% e 3 >75%, estes parâmetros foram usados para a vimentina e para o Van Gieson.
Para a vimentina foi usado um score resultante do produto da percentagem pela intensidade de marcação (Tabela IV).
Tabela IV - Classes dos scores usados
Percentagem*Intensidade Score Classificação
0 0 Sem marcação
1 a 3 1 Fraca
4 a 6 2 Moderada
>8 3 Forte
Foram comparadas a intensidade e a percentagem de marcação em cada uma das estruturas dos úteros cíclicos (controlos; fase estrogénica vs. fase progestagénica), bem como das amostras normais de cada fase com os casos de AEG e HQE.
Para CK 14 dado a escassez e caraterísticas observadas, foram contabilizadas além da localização, o número de células positivas em 10 campos em grande ampliação (objectiva de 40x), em 0 = 0; <10 = 1; >10 =2.
2.4 - Tratamento Estatístico
A análise estatística dos dados obtidos foi efetuada com recurso aos programas Microsoft Excel™ 2010 e IBM SPSS Statistics® 22 para Microsoft Windows® 7.
Realizou-se o teste de Qui-Quadrado de Pearson (χ2). O nível de probabilidade utilizado na decisão dos testes estatísticos foi (p) <0,05.
31
Capítulo IV – Resultados
1 - Vimentina
Ao contrário do que seria previsto, observámos células epiteliais positivas à vimentina no endométrio normal de gata.
O epitélio de superfície (Figura 11) das fases normais apresentou 3/9 casos negativos para ambas as fases, e embora ambos apresentassem casos com marcação fraca e moderada, não se observaram diferenças significativas (p=0,572) entre elas neste tipo de epitélio (Tabela 1, anexo).
Figura 11 - Marcação pela vimentina do epitélio de superfície nas fases normais do ciclo éstrico (progestagénica e estrogénica) e nas Hiperplasias quísticas do endométrio nas zonas mais afastadas dos quistos, consideradas normais neste estudo.
Também nos epitélios glandulares se observou marcação pela vimentina, mas menor que no epitélio de superfície, sendo que esta marcação vai diminuindo com a profundidade das camadas epiteliais. Na marcação das glândulas superficiais (Figura 12), ambas as fases apresentaram 4/9 casos negativos, enquanto nas glândulas profundas (Figura 13) a fase estrogénica apresentou 7/9 e a progestagénica 6/9 casos negativos. Mesmo assim, não houve diferenças significativas entre as duas fases dos controlos, e apenas nas glândulas profundas se verificou marcação diferenciada mais intensa na fase
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
Estrogénica Progestagénica HQE (normal)
% c as os m arc ad os Estadios
Marcação do epitélio de superfície normal
4,6 1,2,3 0 scores
32 progestagénica (p=1 para as glândulas superficiais e p=0,576 para as glândulas profundas).
Figura 12 - Comparação da marcação do epitélio glandular de superfície das fases normais do ciclo éstrico (progestagénica e estrpgénica) com o epitélio das hiperplasias quísticas normal e em volta dos quístos.
As HQE apresentaram marcação intensa no epitélio normal e nos quistos (Figura 14). Nestes 20% (n=1) dos casos não apresentou qualquer marcação. Em ambas as estruturas, em 40% dos casos apresentaram marcação moderada. Não foram encontradas diferenças significativas entre eles (p=1,000).
Figura 13 - Comparação da marcação do epitélio glandular profundo das fases normais do ciclo éstrico (estrogénica e progestagénica) com o epitélio das hiperplasias quísticas normal e em volta dos quistos. 0% 20% 40% 60% 80% 100% % c as os m arc ad os Estadios
Marcação das glândulas de superfície vs
HQE (normais e quistos)
4,6 1,2,3 0 scores 0% 20% 40% 60% 80% 100% % c as os m arc ad os Estadios
Marcação das glândulas profundas vs HQE
(normais e quistos)
4,6 1,2,3 0 scores