UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Dissertação de Mestrado
"Caracterização de Superfícies Antiincrustantes para
o
Limnoperna fortunei
- Mexilhão Dourado"
Autora: Estael Araújo de Faria
Orientador: Prof. Dr. José Roberto Tavares Branco
UFOP - CETEC - UEMG
REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Estael Araújo de Faria
"Caracterização de Superfícies Antiincrustantes para o
Limnoperna
fortunei
-
Mexilhão Dourado"
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para a obtenção do título de Mestre em Engenharia de Materiais.
Área de Concentração: Engenharia de Superfície
Orientador: Prof. Dr. José Roberto Tavares Branco
“A ti Senhor meu Deus dedico
o que tu mesmo me destes,
hoje sei que tudo podes
e que nada para ti é impossível”
AGRADECIMENTOS
- A Deus pelo dom da minha vida.
- Aos meus pais por todo amor e também aos meus familiares.
- A Comunidade Renovada Santo Antônio de Pádua, pela força dada nos momentos mais difíceis, em especial a Sônia Dantas, Joyce Maria e Maria Íris.
- Ao meu orientador José Roberto Tavares Branco, por tudo que me ensinou, dia a dia
principalmente o que não estava nos livros e à equipe do Laboratório de Engenharia e Modificações de Superfícies do CETEC.
- A CEMIG e a ANEEL pelo apoio no projeto, na pessoa de Maria Edith Rolla.
- A EMBRAPA – PANTANAL pelo apoio nos ensaios de campo, em especial a Márcia
Divina e sua equipe.
- Ao CETEC, em especial ao setor de Hidrobiologia na pessoa de Mônica Campos, e a
sua equipe pelos testes efetuados em laboratório e a orientação necessária.
- A FAPEMIG pelo apoio através de bolsas de iniciação científica, o que permitiu outros estudantes colaborarem com este trabalho, em especial o Bruno Versianni e a Elisa Dias.
- A Boutique do Vidro, em especial a Maria Lúcia Fernandes.
- Ao Everton Neiva Galvão e a Márcia Cristina Souza pelo apoio moral e logístico.
- Ao Rogério Antônio Xavier Nunes pela cooperação técnica que viabilizou um novo material para testes neste trabalho.
SUMÁRIO:
LISTA DE FIGURAS...II LISTA DE TABELAS...IV RESUMO...V ABSTRACT...VI
CAPÍLULO 1: INTRODUÇÃO ... 1
CAPÍTULO 2: OBJETIVOS... 4
CAPÍTULO 3: REVISÃO BIBLIOGRÁFICA ... 5
CAPÍTULO 4: PARTE EXPERIMENTAL ... 19
4.1 – Parte Experimental em Laboratório ... 19
4.1.1 – Placas utilizadas para teste ... 19
4.1.2 – Cultivo dos organismos ... 19
4.1.3 – Cálculo da força de desligamento ... 20
4.1.4 – Cálculo do ângulo de contato para o cálculo da energia livre de superfície e suas componentes ... 20
4.1.5 – Seleção dos organismos para teste ... 23
4.1.6 – Preparo dos corpos de prova ... 24
4.1.7 – Medida da força de desligamento ... 24
4.1.8 – Medida da rugosidade média, Ra, e rugosidade total, Rt ... 25
4.2 – Parte Experimental em Campo ... 27
4.2.1 – Placas utilizadas para teste ... 27
4.2.2 – Preparo dos corpos de prova ... 27
4.2.3 – Preparo do experimento em campo ... 27
4.2.4 – Contagem da abundância do Mexilhão Dourado por placa ... 28
4.2.5 – Ensaio da força de desligamento ... 28
CAPÍTULO 5: RESULTADOS E DISCUSSÃO ... 29
5.1 – Testes efetuados em laboratório para as placas sem recobrimento. ... 29
5.2 – Testes efetuados em laboratório para os recobrimentos comerciais ... 35
5.3 – Teste em laboratório para recobrimento desenvolvido no CETEC ... 37
5.4 – Influencia da rugosidade nos testes efetuados em laboratório ... 39
5.5 – Testes efetuados em campo para as placas sem recobrimentos ... 42
5.6 – Testes efetuados em campo para os recobrimentos comerciais sem biocidas ... 44
5.7 – Testes efetuados em campo para recobrimentos comerciais com biocidas ... 45
5.8 – Teste em campo para recobrimentos desenvolvidos no CETEC ... 48
5.9 – Ensaio de Força de desligamento no Campo ... 49
CAPÍTULO 6: CONCLUSÕES ... 51
CAPÍTULO 7: RELEVÂNCIA DOS RESULTADOS ... 52
CAPÍTULO 8: SUGESTÕES PARA TRABALHOS FUTUROS ... 53
LISTA DE FIGURAS:
Figura 1.1 - Água de lastro sendo descarregada por um navio... 1
Figura 1.2 - Saída de água da Usina Hidroelétrica de Itaipu... 2
Figura 1.3 - Mexilhões retirados da tubulação de uma usina hidroelétrica... 3
Figura 1.4 - Filtro alto limpante de uma usina hidroelétrica... 3
Figura 3.1 -Seção transversal de um molusco apresentando a estrutura de um bisso. 8 Figura 3.2 - Regiões distintas de uma fibra de um bisso... 8
Figura 3.3 - Bisso da Pinctada fucata aderido ao granito... 9
Figura 3.4 - Fibras de bisso do Molusco Perna viridis... 9
Figura 3.5 - Mapa da expansão do Limnoperna fortunei na América do Sul... 10
Figura 3.6 - Definição do ângulo de contato θ entre uma gota líquida e uma superfície plana e horizontal... 11
Figura 3.7 - Forças atuando em átomos ou moléculas no interior e na superfície de um material... 12
Figura 3.8 - Esquema da superfície de um sólido ... 13
Figura 3.9- Esquema de ângulos de contato de um líquido sobre uma superfície 14 Figura 3.10 - Força de desligamento versus Energia livre de superfície... 16
Figura 3.11 - Força de desligamento versus Componente de polar... 16
Figura 3.12 - Força de desligamento versus Componente Dispersiva... 17
Figura 3.13 - Força de desligamento versus materiais... 17
Figura 4.1 - Aquário do Laboratório de hidrobiologia, onde se cultivou o Limnoperna fortunei no CETEC... 19
Figura 4.2 - Goniômetro montado para realização de experimentos... 21
Figura 4.3 - Esquema da gota de líquido sobre sólidos com ângulos maiores e menores que 90°... 22
Figura 4.4 - Aquários do laboratório de hidrobiologia do CETEC onde os organismos foram retirados para experimento... 23
Figura 4.5 - Seleção do Limnoperna fortunei em laboratório... 23
Figura 4.6 - Placa com mexilhões... 25
Figura 4.7 - Teste de tração... 25
Figura 4.8 - Rugosidade média Ra... 25
Figura 4.9 - Rugosidade total Rt... 26
Figura 5.1.1 - Porcentagem de organismos mortos e organismos aderidos versus
materiais... 30
Figura 5.1.2 - Força Média de desligamento versus materiais... 30
Figura 5.1.3 - Energia livre de superfície versus Força média de desligamento... 32
Figura 5.1.4 - Componente dispersiva versus Força média de desligamento... 33
Figura 5.1.5: Componente polar versus Força média de desligamento... 33
Figura 5.1.6 - Componente de ligação de hidrogênio versus Força média de desligamento... 34
Figura 5.2.1 - Porcentagem de mortos e aderidos versus materiais com recobrimentos comerciais... 35
Figura 5.2.2 - Força média de desligamento versus materiais, para recobrimentos comerciais... 36
Figura 5.3.1 - Porcentagem de mortos e aderidos versus recobrimentos desenvolvidos... 37
Figura 5.3.2 - Força média de desligamento versus recobrimento desenvolvidos... 38
Figura 5.4.1 - Raversus Força de média de desligamento... 39
Figura 5.4.2 - Rtversus Força de média de desligamento... 40
Figura 5.4.3 - Porcentagem de mortos e aderidos versus rugosidades do aço inoxidável... 41
Figura 5.4.4 - Força média de desligamento versus rugosidades diferentes do aço inoxidável... 41
Figura 5.5.1 - Número médio de organismos aderidos/mês versus materiais sem recobrimentos... 43
Figura 5.6.1 - Número médio de organismos aderidos por mês versus recobrimentos sem biocidas... 44
Figura 5.7.1 - Placa retirada do campo com recobrimento com biocida... 45
Figura 5.7.2 - Recobrimento com biocida ampliada... 45
Figura 5.7.3 - Número médio de organismos aderidos versus recobrimentos que continham biocidas... 46
Figura 5.8.1 - Número médio de organismos por mês versus recobrimentos desenvolvidos no CETEC... 48
LISTA DE TABELAS:
Tabela IV.1.1 - Energia livre de superfície dos líquidos que foram utilizados... 20
Tabela V.1.1 - Resultados obtidos para cada material sem recobrimento... 29
Tabela V.1.2 - Componentes da energia livre de superfície... 32
Tabela V.2.1 - Força média de desligamento, porcentagem de mortos e aderidos para recobrimentos comerciais... 35 Tabela V.3.1 - Força média de desligamento e porcentagem de mortos e aderidos para recobrimentos desenvolvidos no CETEC... 37 Tabela V.4.1 - Valores de rugosidade e força média de aderência por material testado... 39 Tabela V.4.2 - Efeito das rugosidades na força média de desligamento, porcentagem de mortos e aderidos no aço inoxidável 304... 40 Tabela V.5.1 - Média de organismos incrustados por mês por material sem recobrimento... 42 Tabela V.6.1 - Média de organismos incrustados por mês por recobrimentos comerciais sem biocidas... 44 Tabela V.7.1 - Número médio de organismos incrustados por mês para recobrimentos com biocidas... 46 Tabela V.8.1 - Número médio de organismos incrustados por mês por
RESUMO
O Mexilhão Dourado ou Limnoperna fortunei é um organismo invasor que tem causado grandes prejuízos a sistemas de captação de água e usinas hidroelétricas, sendo que mais recentemente vem causando danos ao deslocamento de embarcações fluviais em águas do Pantanal Mato-grossense. No presente trabalho foi feito um estudo, em laboratório e em campo, de materiais antiincrustantes. A relação entre a força de desligamento do Mexilhão Dourado e a energia livre de superfície foi avaliada. Vários materiais foram selecionados para se cobrir uma faixa ampla de energia livre de superfície, incluindo-se materiais com baixa energia de superfície como polímeros, materiais utilizados em usinas hidroelétricas e um novo grupo de materiais com potencial antiincrustante, produzido à base de PET aspergido termicamente com inclusão de pó de cobre como biocida, além de alguns materiais comercializados como antiincrustantes. A relação entre rugosidade e força de desligamento também foi estudada. O trabalho permitiu avaliar técnicas de laboratório para o cultivo e fixação de mexilhões. Verificou-se que em laboratório os valores da força de desligamento dos organismos são significativamente menores que os valores verificados em campo. Qualitativamente, o desempenho do aço inoxidável, o alumínio e o poliuretano, testados em laboratório e em campo, apresentaram-se relativamente consistentes entre si e com dados de literatura. No entanto, o desempenho de alguns dos materiais classificados como
“antifouling” foi aquém do esperado, tendo se comportado nos ensaio realizados no campo
até de forma inferior ao poliuretano, ao alumínio e ao aço inoxidável. Tal anomalia pode estar relacionada a fatores relativos aos procedimentos dos ensaios e o mecanismo de atuação do material antiincrustante. Dentre os materiais testados em campo, aqueles a base de PET pós-consumo apresentaram o maior potencial antiincrustante. A correlação linear entre força de desligamento e a energia livre de superfície foi verificada, mas com baixo coeficiente de correlação, sendo maior o efeito da componente de ligação de hidrogênio.
Abstract
The Golden Mussel or Limnoperna fortunei is an invading organism that has caused much damage to water supply systems and hydroelectric power plants. More recently, this mussel is affaecting the transportation by boats in the “Pantanal” waters of Mato Grosso. In the present work a laboratory and field study of the detachment force of Golden Mussel was carried on aiming the understanding of its relationship with the free surface energy and its components. The materials were chosen to cover an ample range of surface free energy, including materials with low surface energy as polymers, metallic materials and paints used in a local hydroelectric power company and a new group of materials under development at CETEC, based on post-consumer PET, produced by thermal spraying, with the possibility to add copper as a biocide. The relationship between roughness and detachment force was studied. The results indicate that in the laboratory experiments the detachment force of mussels are significantly lower than the corresponding results after the experiments in the field. Qualitatively, the performance of stainless steel, aluminum and polyurethane, tested in laboratory and in the field, are consistent among themselves and with respect to results in the literature. However, the performance of some antifouling materials, available in the market, was lower than expected, showing lower performance than polyurethane, stainless steel and aluminum. This behavior may be related with the conditions in the experiments and those considered for their designe. Among the materials tested in the field, those based on post-consumer PET showed the best anti-fouling potencial. A linear correlation between surface free energy and mussel detachement force was verified but with a poor correlation coefficient, the most strong effect being due to hydrogen bonds.
CAPÍLULO 1: INTRODUÇÃO
A incrustação de organismos em cascos de navios, tubulações e outras estruturas de indústrias que utilizam águas de rios em seus sistemas tem provocado grandes prejuízos econômicos, sociais e ecológicos.
Um caso interessante é o de organismos contidos em água de lastro de navios que podem sobreviver durante viagens transoceânicas. Para manter-se em boas condições de estabilidade para manobra e flutuação, um navio precisa de lastro. É chamado de lastro o volume de água que estes navios levam em tanques específicos para este fim. Quando o navio chega vazio a um porto onde será carregado deve-se esvaziar parte deste lastro para mantê-lo nivelado, da mesma forma que quando o navio for descarregado voltar-se-á a recolher água em seus tanques, compensando-se onde necessário o peso na embarcação, colocando-a em condições de retomar a viagem. Um descarregamento de água de lastro pode ser visualizado na Figura 1.1.
Figura 1.1 - Água de lastro sendo descarregada por um navio[1].
a organismos introduzidos por diferentes meios em um ecossistema onde elas, até então, não existiam.
Uma combinação do aumento das freqüências de viagens de navios de carga com o aumento do volume da água de lastro transportada e da velocidade dos navios fazem com que o risco seja aumentado, o que se tem verificado ao longo das últimas décadas. Uma vez que a população de uma espécie exótica sobreviva a mudanças nas condições ambientais, ela poderá se multiplicar e quando isso acontece torna-se difícil e algumas vezes impossível a sua erradicação. Este é, por exemplo, o caso do Mexilhão Dourado que é uma espécie invasora no Brasil.
O Mexilhão Dourado ou Limnoperna fortunei é originário da China e sudeste da Ásia, que foi detectado pela primeira vez em 1991 na desembocadura do Rio da Prata, especificamente no balneário de Bagliardi, próximo de Buenos Aires, Argentina[2] e no final da década de 90 ao sul do Lago Guaíba no Rio Grande do Sul[3]. O Mexilhão Dourado é de pequeno porte, tendo no máximo 4cm, e rápida reprodução, sendo responsável por incrustações em estruturas portuárias e embarcações, assim como pela obstrução de tubulações de captação de água e conseqüentemente paradas forçadas das usinas para fins de limpeza; problemas de corrosão, perda de fluxo devido à fricção, aumento no gasto de energia para o bombeamento da mesma vazão de água, etc. Alguns exemplos de incrustações são mostrados nas Figuras 1.2, 1.3 e 1.4.
Figura 1.3 – Mexilhões retirados da tubulação Figura 1.4 – Filtro alto limpante de uma usina hidroelétrica[1] de uma usina hidroelétrica[4]
Com a capacidade de se incrustar em várias superfícies submersas, como madeira, rocha, plástico e até vidro, essa espécie exótica está causando graves problemas, levando o Ministério do Meio Ambiente (MMA) a ações de alta prioridade. Em 22 de dezembro de 2003, editou-se a Portaria n.º 494, que criou uma força-tarefa nacional (FTN), composta por representantes de 7 ministérios e 13 entidades ligadas aos setores de geração de energia, abastecimento e meio ambiente, para pesquisá-lo e tentar controlar a expansão do Mexilhão Dourado.
Antigamente, para o controle de espécies incrustantes eram utilizadas tintas a base de Tributilestanho (TBT) como antiincrustantes. Hoje, no entanto, o seu uso está proibido devido aos problemas ecológicos causados pela sua toxicidade. Atualmente várias tintas comerciais têm sua composição baseada em materiais metálicos pesados que também possuem toxicidade significativa, não só aos organismos incrustantes, como também a outros membros da biota aquática. Devido a estes problemas as mais recentes pesquisas a respeito de recobrimentos antiincrustantes estão focadas em materiais não tóxicos, onde suas características físico-químicas atuem de forma que não haja uma aderência desses organismos.
CAPÍTULO 2: OBJETIVOS
- verificar quais as propriedades dos materiais afetam a fixação do Liminoperna fortunei sobre suas superfícies;
- avaliar a força de desligamento e preferência do Limnoperna fortunei aos materiais comumente usados em usinas hidroelétricas, e aos recobrimentos antiincrustantes comercializados contando com outros materiais citados na literatura internacional;
- analisar a relação entre a força de desligamento do Limnoperna fortunei e a energia livre de superfície de materiais;
- avaliar o efeito da rugosidade na força de desligamento do Limnoperna fortunei;
CAPÍTULO 3: REVISÃO BIBLIOGRÁFICA
Biofouling é um processo que envolve adsorção de substancias e espécies, colonização e
desenvolvimento de seres vivos, em ecossistemas diverso. Esse processo pode ter efeito danoso em estruturas artificiais, sendo um dos problemas mais importantes que a tecnologia marinha enfrenta atualmente [5].
Os efeitos prejudiciais do biofouling (ou fouling através de organismos como bactérias, algas e invertebrados) incluem, entre outros, aumento da resistência ao deslocamento de embarcações e de fluidos em oleodutos e aquedutos, causando redução de velocidade, aumento custo da produção de energia, redução em transferência de calor condutiva por trocadores de calor, corrosão biologicamente induzida de superfícies metálicas, entre outros[5].
Há efeitos nocivos da formação dos biofoulings que tem sido combatidos a mais que 2000 anos. Antigamente os fenícios e cartagíanos usavam piche, e possivelmente, cobre em suas embarcações, outras culturas antigas usavam graxa, alcatrão e asfalto. Outras fontes relatam a descoberta de chumbo em cascos de galeões fenícios 700 anos a.C.. No século V a.C, estudos recentes de historiadores relatam o uso de recobrimentos de arsênio e enxofre misturados com óleos em navios de combate. No século III a.C os gregos usaram graxa, alcatrão e ainda chumbo em suas embarcações. Séculos depois no século XIII até o século XV d.C. os vikings usavam alcatrão, piche era usado extensivamente para proteger os cascos de navios, muitas vezes misturados com óleo e resina[6].
Hoje em dia predominam tecnologias de camadas antifouling baseadas em mecanismos nos
quais biocidas, íons de metais normalmente tóxicos, notadamente de arsênio, cobre, chumbo, mercúrio e estanho, matam organismos formadores de incrustações. No entanto, o uso desses materiais vem sendo inibido em muitos países[5].
Biocidas de organoestanho como TBT (tributilestanho) são atualmente o antifoulant mais efetivo disponível no mercado. Embora efetivos, organoestanhos se tornaram impactantes ao ambiente, causando preocupação para o futuro da saúde humana, o que conduz a recente proposta para uma proibição global no seu uso, em 1° de janeiro de 2003 na Marine
Environmental Protection Committee of the International Maritime Organization (MEPC-IMO)[5].
Os recobrimentos que utilizam biocidas podem ser divididos em dois grupos: os que possuem matriz solúvel em água e os que possuem matriz insolúvel[6].
Para os recobrimentos não tóxicos nenhum desenvolvimento alternativo parece ser capaz de alcançar a efetividade dos recobrimentos à base de biocidas num curto espaço de tempo. Entretanto, já há muitas linhas de investigação que merecem especial atenção devido às suas características promissoras de produzir um sistema efetivo e porque elas envolvem um modo de ação mais amigável com o meio ambiente[6].
Quando submersas na água, a maioria das superfícies e’ colonizada rapidamente por microorganismos, que se fixam a elas, produzindo combinações orgânicas, as incrustações,
biofouling ou biofilme[7]. Tal processo consiste usualmente em quatro estágios. Primeiramente
moléculas orgânicas, como polissacarídeos, proteínas e possivelmente compostos inorgânicos acumulam-se sobre uma superfície, na forma de um filme. Este processo é essencialmente governado por forcas intermoleculares como ligações de Van Der Waals. Em seguida há o desenvolvimento de bactérias, protozoários e outros microorganismos. O desenvolvimento de colônias destes microorganismos é o terceiro estágio. O quarto estágio envolve o desenvolvimento de macro-invertebrados ou crescimento de macro-algas, resultando no que é chamado de macrofouling[6].
elas. Estudos nessa área são tratados na ecologia fisiológica ou o estudo de como os organismos interagem com o ambiente físico, e assim demonstrando como tais interações influenciam sua distribuição e abundância. Tais estudos tratam as relações entre características dos organismos e a taxa de transferência de momentum, de calor e de massa entre os mesmos e o ambiente[8].
Alguns relatos demonstram que a natureza não confia em apenas um único mecanismo para a fixação dos mexilhões, mas usa vários deles. Sendo assim, um antiincrustante eficaz deve inutilizar ao mesmo tempo todos esses mecanismos[9]. Conchas incrustantes tais como cracas, mexilhões e incrustações leves, como bactérias, usam adesivos e processos de fixação variados[9]. Mexilhões se fixam a substratos secretando sobre suas superfícies fibras, produzidas a partir de glândulas localizadas no pé do organismo. Essas fibras constituem-se principalmente de colágeno, mas contém polifenólicos hidrófilos, que são proteínas adesivas entre as quais ocorre ligação cruzada por reação de oxidação-redução envolvendo um catalisador de polifenol-oxidase[9]. De um modo geral, proteínas adesivas secretadas por invertebrados, como mexilhões e cracas, são insolúveis em água e aderem a superfícies de vários substratos no ambiente aquático[10].
Cada fibra do bisso é conectada a uma haste comum que está enraizada dentro da glândula do pé do Mexilhão, que está finalmente conectado aos músculos retratores dos bissos, Figura 3.1[8].
Figura 3.1 - Seção transversal de um molusco apresentando a estrutura de um bisso[8].
As fibras dos bissos diferem de outras fibras protéicas animais, pois suas fibras são produzidas dentro de um encaixe do pé por um processo que é semelhante a uma moldagem por injeção. Isso permite que o mexilhão dê forma a duas regiões morfologicamente distintas em cada fibra de bisso: uma região proximal, que é relativamente grossa e ondulada, e uma outra região distal que é fina e lisa, que contacta um substrato por intermédio de uma placa adesiva[8], Figura 3.2.
Figura 3.2 - Regiões distintas de uma fibra de um bisso[8].
A região proximal estende tipicamente junto à casca do mexilhão enquanto a região distal é inteiramente externa. A região proximal pode ser considerada um material compósito, com fibras de colágeno reforçando uma matriz protéica macia, enquanto a região distal consiste basicamente de fibras de colágeno densamente empacotadas[8].
Devido a diferentes morfologias e composições moleculares das regiões proximal e distal suas propriedades mecânicas também são diferentes. Testes de tração dos bissos de uma variedade de espécies mostraram que a região distal não é somente mais dura, mais forte e menos extensa do que a região proximal, mas também tem um comportamento distinto antes que se rompa. Quanto ao comportamento sob tensão a falha mecânica ocorre tipicamente na placa adesiva ou na região proximal e somente depois na região distal. Os fios de bissos podem ser considerados elásticos e se estendem consideravelmente antes de se romperem[8].
Músculo retrator
Pé
Haste
Fibra de bisso
Placa adesiva
Região proximal Região distal
Uma investigação mais profunda é necessária para esclarecer o relacionamento entre a estrutura molecular e a função mecânica das fibras de bissos[8].
Com a recente invasão de moluscos no Brasil e considerando-se todas as prováveis variáveis do novo ambiente faz-se necessário um estudo de suas propriedades ecomecânicas, o
Limnoperna fortunei, possui no máximo 4 centímetros de comprimento e na fase adulta vive
fixo a qualquer substrato duro formando agregados e cobrindo extensas superfícies[12]. A principal forma de disseminação é através do tráfego de embarcações, tanto comerciais quanto de esporte e lazer[11].
Estes organismos possuem fertilização externa onde é formada a larva ou veliger que pode nadar. O último estado larval conta com um pé bem desenvolvido e capaz de fazer contato com o substrato e desenvolver seu bisso[13], Figura 3.3 e 3.4.
Figura 3.3 – Placa adesiva da Pinctada fucata aderido a granito (1.00 mm/div.) [10].
Figura 3.4 – Fibras de bisso do Molusco Perna viridis[14].
reprodutivo e a falta de inimigos naturais propiciam ao Mexilhão Dourado a formação de grandes aglomerados na Argentina e Brasil, causando macrofouling[16], que além dos problemas citados também causa a contaminação de água pela presença de organismos mortos[16], que também contribuirão para a oclusão de bombas, filtros e sistemas de refrigeração de indústrias[16].
Os Mexilhões Dourados foram observados pela primeira vez no Sul do Brasil, no final do ano de 1998, junto ao Delta do Jacuí, em frente ao porto de Porto Alegre. Um mês depois foram encontrados vários exemplares pequenos a 70 km ao sul do Delta, nas praias a jusante do Guaíba, em Itapuã, quase na saída para a Lagoa dos Patos[12].
Os rios Paraguai e Paraná formam a Bacia do Prata, a segunda maior bacia fluvial da América do Sul e a quarta do mundo[11]. A navegação é um sistema importante de transporte capaz de integrar as economias dos cinco países desta Bacia (Brasil, Bolívia, Argentina, Paraguai e Uruguai)[12]. Através da navegação, o Mexilhão Dourado-Limnoperna fortunei chegou, em 1998, no Pantanal Mato-grossense seguindo a rota da navegação[12]. Inicialmente foi observado no material do fundo de uma lagoa ligada ao rio Paraguai, a Baia do Tuiuiú, próxima a Corumbá [12]. Há também registros no Canal do Tamengo, um canal de ligação entre a Bolívia e o Brasil[12]. A colonização ocorre nos mais diversos ambientes: rios, canais, baías, sobre diferentes substratos (rochas, madeira, metais, plásticos)[12]. Podemos observar a expansão do Limnoperna fortunei pela Figura 3.5.
A partir do trabalho de revisão e Yebral et all[6], as propriedades que tem sido discutidas e que podem afetar a força de ligação do Limnoperna fortunei incluem:
1. energia livre de superfície do substrato[6, 18- 32]; 2. composição química da superfície do substrato[6, 31]; 3. textura da superfície do substrato[6, 31];
Dentre estas, a energia livre de superfície se destaca[18-34].
Energia livre de superfície é uma manifestação direta das forças intermoleculares dos elementos e moléculas dispostos em superfícies ou próximo delas. A atividade dos átomos ou das moléculas na superfície de um líquido ou sólido é influenciada pelas forças não balanceadas que neles atuam e portanto difere da atividade dos mesmos átomos ou moléculas correspondentes no interior dos líquidos ou sólidos[35].
A interação entre uma superfície e um determinado líquido pode ser estudada por intermédio da medida do chamado ângulo de contato θ[35]. Este é definido como o ângulo entre um plano tangente a superfície de uma gota do líquido, a partir da interseção do líquido com o substrato, e o plano do substrato onde o líquido se encontra depositado, conforme esquematizado na Figura 3.6[35].
Figura 3.6 - Definição do ângulo de contato θ entre uma gota líquida e uma superfície plana e horizontal[35].
O conceito de energia livre de superfície pode ser mais facilmente compreendido usando-se um líquido como exemplo. Átomos e moléculas do líquido podem se mover livremente procurando ocupar uma posição de menor energia potencial. Em se tratando de átomos no interior do líquido há forças sobre eles agindo em várias direções, visto que eles estão cercados de outros átomos. Por outro lado, os átomos da superfície de um material experimentam apenas forças dirigidas para dentro do líquido, conforme mostrado na Figura 3.7. Devido a este fato, as superfícies são sempre regiões de maior energia. E é justamente a diferença entre a energia das espécies na superfície e no interior do material que dá origem à energia de superfície, que no caso de líquidos pode ser diretamente relacionada a uma tensão superficial[35].
De acordo com a segunda lei da termodinâmica, a natureza tende sempre a um estado de mínima energia livre. É por esta razão, por exemplo, que uma gota de água quando em contato com uma superfície tende à forma esférica, pois esta é a forma geométrica que mantém o volume com a menor área superficial. Da mesma forma, a adesão de um material sobre outro será tanto melhor quando maiores forem as energias de superfícies dos materiais envolvidos e menor a energia da interface entre eles[35].
Figura 3.7 – Representação esquemática de forças atuando em átomos ou moléculas no interior e na superfície de um material[35].
Rigorosamente falando, γS como apresentado na Figura 3.5, é a energia de superfície do
sólido apenas quando este se encontra no vácuo. A diferença entre γS e γSV é denominada
pressão de espalhamento πe (πe =, onde γSV seria a energia de superfície do sólido em equilíbrio com um vapor). Todavia, é assumido que a adsorção de vapor em sólidos de baixa
Por definição, a energia livre de superfície de um material é o excesso de energia livre por unidade de área devido à existência da superfície livre, como está esquematizado na Figura 3.9. Equivalentemente,a energia livre de superfícies é o trabalho termodinâmico por unidade de área que tem que ser feito para se estender infinitesimalmente a área de uma superfície [35].
Figura 3.9 - Esquema da superfície de um sólido. Os círculos representam os átomos e as linhas retas as ligações químicas entre eles, as linhas curvas representam a energia livre de superfície.
Considerando-se que a gota da Figura 3.6 esteja em equilíbrio sobre uma superfície sólida, tem-se[35]:
θ γ
γ
γS = SL + LV *cos Eq 3.1
ou,
SL S
LV θ γ γ
γ *cos = − Eq
3.2
que é conhecida como a equação de Young[35].
O trabalho de adesão, Wa, entre o sólido e o líquido pode ser expresso pela equação de Dupré[35]:
SL S LV a
W =γ +γ −γ Eq. 3.3
Assim sendo, combinando-se a Eq. 3.2 e a Eq. 3.3 obtém-se a equação de Young-Dupré[35]:
(
cos 1)
* +
=γLV θ a
W Eq. 3.4
Esta última equação é mais útil que a equação de Dupré pois relaciona duas grandezas mensuráveis com relativa facilidade e precisão, θ e a tensão superficial do líquido γLV[35].
Quando θ = 0, cos θ = 1, então:
LV a
W =2γ Eq 3.5
A quantidade 2γLV é denominada trabalho de coesão do líquido. Portanto, o ângulo de contato igual a zero se observa quando o trabalho de adesão líquido - sólido se iguala, ou supera, o trabalho de coesão do líquido, ou seja, o líquido se espalha pela a superfície sólida quando as forças de atração líquido - sólido se igualam ou superam as forças de atração líquido - líquido. Por outro lado, quando θ = 180°, tem-se cos θ = -1 e o trabalho de adesão líquido - sólido é zero[35]. Este é o caso limite quando não há adesão entre as duas fases, como representado na Figura 3.8.
Figura 3.9 – Esquema de assentamento de gotículas sobre um substrato e indicação de ângulos de contato do líquido e a superfície sólida.
A energia livre de superfície se manifesta promovendo a minimização de área de líquidos e de superfícies e interfaces em sólidos. As superfícies sólidas, como as líquidas, possuem energia
Θ 0° 90° 180°
cos Θ 1 0 - 1
Θ 0° 90° 180°
livre de superfícies, mas devido à baixa mobilidade de átomos nelas, o efeito da energia livre de superfícies não é igualmente notável[35].
Fowkes[33] propôs que a energia de superfície pode ser descrita como a soma de contribuições de interações dispersivas (γd), e não – dispersivas(γp), também chamadas de polares, e das
ligações de hidrogênio(γh):
h p
d γ γ
γ
γ = + + Eq.3.6
Owens et all[34] estenderam a equação de Fowkes para uma forma mais geral:
(
)
*(
1 cos)
(
*) (
12 *) (
12 *)
12* 2 1 h L h S p L p S d L d S h L p L d
L γ γ θ γ γ γ γ γ γ
γ + + + = + + Eq.3.7
Onde:
γSd = Componente dispersiva do sólido (mJ/m2);
γSp = Componente polar do sólido (mJ/m2);
γSh = Componente ligação de hidrogênio do sólido (mJ/m2);
γLd = Componente dispersiva do líquido (mJ/m2);
γLp = Componente polar do líquido (mJ/m2);
γLh = Componente ligação de hidrogênio do líquido (mJ/m2).
Figura 3.10 - Força de desligamento versus Energia livre de superfície [31-36].
Figura 3.11 – Força de desligamento versus Componente de polar [31-36].
y = 0,0354x - 0,581 R2 = 0,8087
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6
0 10 20 30 40 50 60
Energia livre de superfície/(mJ/m2)
F o rç a d e d es lig am en to /( N )
y = 0,0533x + 0,2221 R2 = 0,8127
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6
0 5 10 15 20 25
Componente polar/(mJ/m2)
Figura 3.12 - Força de desligamento versus Componente dispersiva [31-36]. 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Vidr o Pire x Cob re PVC PM MA Silic one Poliu reta no Teflo n Borra cha natu ral Poliis opre no 6-ny lon Polie tilen o Polip ropi leno Polic arbo nato Materiais F o rç a (N )
Figura 3.13 - Força de desligamento versus materiais[31].
y = 0,0643x - 1,0979 R2 = 0,4911
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6
0 5 10 15 20 25 30 35 40
Componente de dispersão/(mJ/m2)
A força de desligamento (força de tração necessária para desligar um organismo de um substrato), por bisso, é baixa quando o molusco desliga-se na interface entre substrato e as placas das fibras do bisso (falha adesiva). Por outro lado, foi observado que a força de desligamento é maior quando o molusco se desliga devido à quebra das fibras dos bissos[31].
A ligação dos bissos aos materiais tende a ser menor em substratos com baixa densidade de pontes de hidrogênio e energia livre superficial, quando então se favorece as falhas adesivas. Por outro lado, bissos tendem a se aderir fortemente em superfícies com alta densidade de pontes de hidrogênio e energia livre de superfície. Neste tipo de superfície, verifica-se a tendência de que o molusco seja desligado preponderantemente com a quebra das fibras de bissos [31].
CAPÍTULO 4: PARTE EXPERIMENTAL
4.1 – Parte Experimental em Laboratório 4.1.1 – Placas utilizadas para teste
Os experimentos foram conduzidos com materiais com alta energia de superfície como o vidro e alumínio, aço inoxidável AISI 304; materiais tóxicos ao Mexilhão Dourado como zinco, cobre e latão, bem como materiais poliméricos com baixa energia livre de superfície (Polietileno, PET, PVC, Teflon, Polipropileno, Poliuretano) e aço carbono SAE 1020, por ser esse um material muito usado em usinas hidroelétricas. Usou-se ainda recobrimentos comerciais utilizados em usinas hidroelétricas, denominado A, B, C, D e E, bem como recobrimentos comercializados como antifouling, que foram denominados F, G, H e I. Recobrimentos desenvolvidos no CETEC, à base de PET aspergido e pó de cobre como biocida, também foram testados.
4.1.2 – Cultivo dos organismos
O Limnoperma fortunei, depois de coletado no reservatório da Usina Binacional de Itaipu, foi
mantido em aquário com aeração e em água declorada na temperatura do ar próximo dos vinte e cinco graus Celcius, como mostra a Figura 4.1, sendo ela trocada três vezes por semana para se evitar o acúmulo de excretas. Usou-se alimentação `a base da alga Selenastrum
capricornutum e alimento composto (ração de peixe fermentada e levedura dissolvida em
água destilada).
Figura 4.1 – Aquário do Laboratório de hidrobiologia, onde se cultivou o
4.1.3 – Cálculo da força de desligamento
O cálculo da força de desligamento foi feito a partir de medidas de força de desligamento realizadas com auxílio de uma balança. Durante a medida, uma garra é fixada a mexilhão já bissado e deslocada verticalmente em direção oposta ao organismo, enquanto observa-se no display da balança o valor da carga aplicada durante o processo de tracionamento, anotando-se o valor imediatamente antes do desligamento, a que anotando-se denomina massa mínima de tração. Subtraindo-se a massa do conjunto (placa + mexilhão) da massa mínima, e multiplicando-se o valor pela aceleração da gravidade, pode-se calcular a tração necessária para desprender-se o mexilhão do substrato onde ele se fixou, ao que se denomina a força de desligamento do mexilhão, Eq. 4.1:
(
Mconj Mmex M)
gFd = − − min * Eq.4.1
Onde:
Fd = Força de desligamento (N)
Mconj = Massa da placa + massa do mexilhão (Kg)
Mmex = massa do mexilhão (Kg)
min
M = massa mínima registrada na balança durante o processo de tração (Kg)
g= Aceleração da gravidade (m2/s)
4.1.4 – Cálculo do ângulo de contato para o cálculo da energia livre de superfície e suas componentes
Mediu-se o ângulo de contato das placas testadas utilizando-se um goniômetro (Contact Anglometer – modelo 1501 - Micromeritics Corporation S.A.), Figura 4.2. Para a determinação de diferentes componentes da energia de superfícies, usou-se três líquidos com componentes da tensão superficial conhecidos, Tabela IV.1.1. Para os cálculos, utilizou-se a equação de Owens et all, Eq. 3.7[34]:
Tabela IV.1.1 - Energia livre de superfície dos líquidos que foram utilizados[31].
Líquidos puros γγγγLd(mJm-2) γγγγLp(mJm-2) γγγγLh(mJm-2)
n-Hexacecano 27.6 0 0
Água 29.1 1.3 42.4
Figura 4.2 - Goniômetro montado para realização dos experimentos, tripé regulável de aço inoxidável cuja parte superior possui um encaixe para o porta-amostra, porta-amostra de aço-inoxidável com rosca, suporte de acrílico que é acoplado ao porta-amostra, micrômetro para medir a altura máxima da gota sobre a amostra.
Para cada amostra polimérica e para a amostra de vidro, foi registrada, com a utilização do goniômetro, a altura máxima que uma gota de cada um desses líquidos atingia após a altura não variar significamente, quando depositada sobre os materiais. O procedimento foi feito em triplicata para cada material. Utilizou-se os valores médios para o cálculo dos ângulos de contato da interface sólido-líquido para cada substrato, de acordo com os modelos apresentados, Eq.4.2 e Eq.4.3.
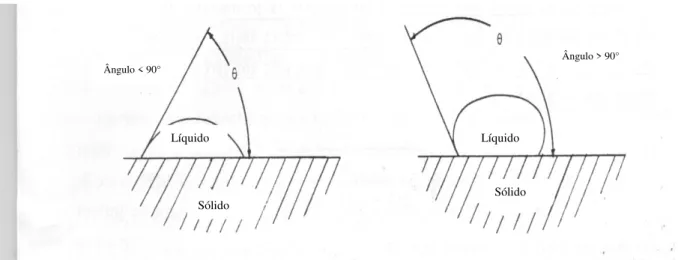
Figura 4.3 - Esquema da gota de líquido sobre sólidos com ângulos maiores e menores que 90°.
Se o operador visualizar um ângulo θ entre 0 e 90° ele utilizará a Eq. 4.2 e se a visualização do ângulo indicar valor maior do que 90°, ele utilizará a Eq.4.3, para se obter o resultado do ângulo de contato.
(
1)
*(
1(
* 2)
)
* 3 * 1 cos 2 2 h B h B − − − = ε
θ Eq.4.2
(
)
22 * * 1 * 3 * * 2 4 1 cos h B B h ε θ − − + −
= Eq.4.3
Sendo B=ρ*gγ Eq.4.4
onde:
ρ= densidade do líquido (g/cm3) g= aceleração da gravidade (cm/s2)
γ= energia livre de superfície do líquido (ergs/cm2) h = altura máxima do líquido (cm);
ε = porosidade da superfície.
Na prática, a porosidade de um sólido pode ser considerada como zero.
A partir do ângulo de contato pode-se calcular as componentes de energia livre para as placas testadas, utilizando a Eq. 3.7.
Líquido Líquido
Sólido Sólido
Ângulo < 90°
4.1.5 – Seleção dos organismos para teste
Foram selecionados os mexilhões dourados para teste de acordo com método usado por Matsui et all[31] .Os organismos usados possuíam tamanho da concha intacta entre 1,5cm e 2,0cm, que estavam bissados no aquário ou entre eles e que respondiam a estímulos externos, como mostra a Figura 4.4 e 4.5.
Figura 4.4 – Aquários do laboratório de hidrobiologia do CETEC onde os organismos foram retirados para experimento.
4.1.6 – Preparo dos corpos de prova
Os corpos de prova para a fixação de mexilhões foram cortados no tamanho de 13,5cm por 8cm, para em seguida serem limpos, com procedimento adequado para cada tipo de corpo de prova (jateamento para o aço carbono, desengraxamento para os materiais metálicos e vidro, limpeza ultra-sônica, para materiais metálicos, vidros e polímeros). Um barbante foi amarrado nas placas, que foram usados para se forçar os organismos a se manterem sobre elas, conforme procedimento de Matsui et all[31].
4.1.7 – Medida da força de desligamento
Foram utilizadas 8 placas de cada material com 13,5 x 8cm cada. Os mexilhões utilizados nos experimentos estavam sendo cultivados em laboratório, tendo-se utilizado 60 organismos para cada tipo de material. Esses organismos foram usados em duas etapas. Na primeira foram dispostos 5 organismos por placa, totalizando-se 40 deles. Em uma segunda etapa esse experimento foi repetido, utilizando-se 4 placas com 5 organismos cada somando-se mais 20 organismos testados por material, excetuando-se o experimento com os recobrimentos comerciais utilizados por usinas hidroelétricas e recobrimentos comerciais que foram testados utilizando apenas 2 placas com 5 organismos em cada totalizando 10 organismos. Os recobrimentos desenvolvidos no CETEC foram testados em grupos de 5 placas por composição, sobre os quais foram colocados 4 organismos por placa totalizando 20 organismos por composição de recobrimento, esta variação no número de organismos testados se deve a disponibilidade de organismos na data do teste.
As placas foram retiradas da água e secas com papel toalha. As amostras foram colocadas sobre a balança e os testes realizados, como mostram as Figuras 4.6 e 4.7.
Figura 4.6 - Placa com mexilhões. Figura 4.7 - Teste de tração.
4.1.8 – Medidas de rugosidade
Medidas da rugosidade média, Ra, e rugosidade total, Rt, das placas poliméricas e de vidro foram feitas utilizando-se um perfilômetro (fabricante Taylor-Hobson, marca Form Talysurf Series 2), Figura 4.8 e 4.9. Placas de aço inoxidável foram jateadas de modo a se obter três níveis diferentes de rugosidade para um mesmo material, foram preparadas e ensaiadas para medir-se força de desligamento e porcentagem de mortos e aderidos.
4.2 – Parte Experimental em Campo 4.2.1 – Placas utilizadas para teste
Foram escolhidos materiais com altas energia de superfície, vidro e metais, alguns desses materiais tóxicos ao Mexilhão Dourado, como zinco, cobre e latão, sendo os outros não tóxicos (aço carbono SAE 1020, aço inoxidável AISI 304, alumínio); materiais poliméricos com baixa energia de superfície (Polietileno, PET, PVC, Teflon, Polipropileno, Poliuretano); bem como recobrimentos comerciais, inclusive recobrimentos comercializados como
antifouling. Recobrimentos comerciais sem biocidas foram denominados de A, B, C, D, F, G
e H e os recobrimentos que continham biocidas foram denominados de I, J, L, M, N, O, P, Q, R, S e T. Novos recobrimentos desenvolvidos no CETEC, à base de PET aspergido e pó de cobre como biocida, também foram testados.
4.2.2 – Preparo dos corpos de prova
Os corpos de prova foram cortados no tamanho de 13,5cm por 8cm a partir de placas que e nelas realizados furos com 0,5mm de diâmetro para fixação em garrafas PET. Essas garrafas foram submersas para o teste no campo. A limpeza adequada de cada placa foi feita antes de se enviar o material para o campo, o que consistiu em jateamento para o aço carbono, desengraxamento para os materiais metálicos e limpeza ultra-sônica para materiais metálicos e polímeros.
4.2.3 – Preparo do experimento em campo
O local escolhido para efetuar o experimento em campo foi o rio Paraguai,próximo à região de Corumbá, Estado de Mato Grosso do Sul, onde já há registro da infestação do Mexilhão Dourado.
aderidos.Uma placa de cada material foi mantida no ambiente até março para que os organismos fixados a ela pudessem crescer para se realizar o teste da força de desligamento.
4.2.4 – Contagem da abundância do Mexilhão Dourado por placa
De novembro a dezembro foi contado o número de mexilhões aderidos em cada material. A Figura 4.10 mostra uma das garrafas com placas submetidas ao ensaio para fixação dos organismos.
Figura 4.10 - Placas ensaiadas, dispostas dentro de uma garrafa PET, antes da contagem de organismos aderidos.
4.2.5 – Ensaio da força de desligamento
CAPÍTULO 5: RESULTADOS E DISCUSSÃO
5.1 – Testes efetuados em laboratório para as placas sem recobrimento.
Os valores médios de força de desligamento, a porcentagem de organismos mortos e numero de organismos aderidos, bem como o valor da energia livre de superfície por materiais, estão apresentados na Tabela V.1.1 e nas Figuras 5.1.1 e 5.1.2.
Tabela V.1.1 - Resultados de força média de desligamento, energia livre de superfície, porcentagem de organismos mortos e porcentagem de organismos aderidos obtidos para cada material sem recobrimento.
Material Força média de
desligamento/(N)
Desvio
Padrão /(N) de superfície/ Energia livre (mJ/m2)
Organismos mortos/(%)
Organismos aderidos/(%)
Vidro 0,490 0,157 160,3 28 23
Aço Inoxidável 0,243 0,207 * 3 28
Alumínio 0,114 0,195 * 22 27
Aço Carbono 0,070 0,086 * 3 8
Zinco 0
0 * 55 0
Cobre 0
0 * 82 0
Latão 0
0 * 52 0
PVC 0,232
0,244 75,9 24 25
Polielietileno 0,059 0,017 60,1 30 4
Polipropileno 0,027
0,029 33,9 29 11
PET 0,056 0,044 49,2 5 12
Poliuretano 0,211 0,140 31 23 31
Teflon 0,198 0,343 19,5 31 18
0 10 20 30 40 50 60 70 80 90 Vidr o Zinc o Cob re PVC Polie lietil
eno PET
Polip ropi leno Poliu reta no Teflo n Materiais P o rc en ta g em d e M o rt o s e A d er id o s
Porcentagem de mortos Porcentagem de aderidos
Figura 5.1.1 - Porcentagem de organismos mortos e organismos aderidos versus materiais.
-0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 Vidr o Zinc o Cob re PVC Polie tilen o Polip ropi
leno PET
Poliu reta no Teflo n Materiais F o rç a M éd ia d e d es lig am en to /( N )
Figura 5.1.2 - Força média de desligamento versus materiais.
obteve-se valores mais elevados de força média de desligamento e maior porcentagem de organismos aderidos em relação aos outros materiais testados. A baixa força de desligamento para o aço carbono e a baixa porcentagem de organismos que se fixaram a ele podem ser devido à oxidação que esse material sofre quando em contato com a água, sendo que os produtos dessa reação são fracamente ligados ao substrato de aço. Materiais que formam óxidos que são biocidas para o Mexilhão Dourado como o zinco, cobre e latão, não tiveram qualquer aderência a esses materiais, tendo-se constatado também ser alta a mortalidade dos organismos frente a esses óxidos, principalmente para as placas de cobre. Materiais como o polietileno e o PET obtiveram uma baixa aderência e também uma baixa força de desligamento, destacando-se aqui por serem materiais não tóxicos.
As forças médias de desligamento obtidas estão abaixo dos valores obtidos por Matsui[31]. Os organismos utilizados por Matsui tinham entre 2,5 e 3cm de comprimento da concha e portanto para eles seria de se esperar maiores valores de força de desligamento, compatível com a diferença notável entre as medidas desse trabalho e aquelas anteriores[31] . Para o teflon, em relação aos outros materiais testados nesse trabalho, observou-se valor relativamente maior da força média de desligamento, em relação aos resultados anteriores, Figura 3.13.
Tabela V.1.2 - Componentes da energia livre de superfície:
Material Componente dispersiva /(mJ/m2)
Componente polar/ (mJ/m2)
Componente ligação de hidrogênio/(mJ/m2)
Vidro 21,8 0 138,4
PVC 27,6 40 8,4
Polietileno 27,6 32,4 0,2
Polipropileno 25,8 7,3 0,8
PET 21,6 24,3 3,2
Poliuretano 22,6 5,9 2,4
Teflon 18,4 0,4 0,7
y = 0,0026x + 0,0208 R2 = 0,6078
0 0,1 0,2 0,3 0,4 0,5 0,6
0 20 40 60 80 100 120 140 160 180
Energia livre de superfície /(mJ/m2)
F o rç a m é d ia d e d e s lig a m e n to / (N )
y = -0,0145x + 0,5243 R2 = 0,0989
0 0,1 0,2 0,3 0,4 0,5 0,6
0 5 10 15 20 25 30
Componente dispersiva/ (mJ/m2)
F o rç a m é d ia d e d e s lig a m e n to / (N )
Figura 5.1.4 - Componente dispersiva versus Força média de desligamento.
y = -0,0038x + 0,2415 R2 = 0,1469
0 0,1 0,2 0,3 0,4 0,5 0,6
0 5 10 15 20 25 30 35 40 45
Componente polar/ (mJ/m2)
F o rç a m é d ia d e d e s lig a m e n to /( N )
y = 0,0027x + 0,1228 R2 = 0,746
0 0,1 0,2 0,3 0,4 0,5 0,6
0 20 40 60 80 100 120 140 160
Componente ligação de hidrogênio /(mJ/m2)
F
o
rç
a
m
é
d
ia
d
e
d
e
s
lig
a
m
e
n
to
/(
N
)
5.2 – Testes efetuados em laboratório para os recobrimentos comerciais
Os valores médios de força média de desligamento, a porcentagem de organismos mortos e aderidos estão apresentados na Tabela V.2.1 e Figuras 5.2.1 e 5.2.2.
Tabela V.2.1 - Força média de desligamento, porcentagem de mortos e aderidos para recobrimentos comerciais.
Material Força média de desligamento/(N)
Desvio Padrão
/(N) Mortos % Aderidos %
A 0,023 0,020 30 40
B 0,013 0 40 10
C 0 0 80 0
D 0,066 0,004 30 20
E 0,073 0,018 40 20
F 0 0 100 0
G 0 0 20 0
H 0 0 100 0
I 0 0 30 0
0 10 20 30 40 50 60 70 80 90 100
A B C D E F G H I
Materiais P o rc e n ta g e m d e M o rt o s e A d e ri d o s % Mortos % Aderidos
0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,1
A B C D E F G H I
Materiais comerciais F o rç a m é d ia d e d e s lig a m e n to /( N )
Figura 5.2.2 - Força média de desligamento versus Materiais, para recobrimentos comerciais. .
5.3 – Teste em laboratório para recobrimento desenvolvido no CETEC
Os valores médios da força de desligamento e a porcentagem de mortos e aderidos para os recobrimentos desenvolvidos podem ser visualizados na Tabela V.3.1 e Figuras 5.3.1 e 5.3.2.
Tabela V.3.1 - Força Média de desligamento e porcentagem de mortos e aderidos para recobrimentos desenvolvidos no CETEC.
Material Força média de
deligamento/(N) padrão/(N) Desvio Mortos, % Aderidos,%
Pet aspergido 0,076 0 30 10
Pet com 10% de cobre
aspergido 0,002 0,089 15 15
Pet com 20% de cobre
aspergido 0,066 0,043 20 30
0 5 10 15 20 25 30 35
Pet Aspergido Pet com 10% de cobre aspergido Pet com 20% de cobre aspergido
Recobrimentos Desenvolvidos
M
o
rt
o
s
e
A
d
e
ri
d
o
s
,%
Porcentagem de mortos Porcentagem de aderidos
-0,1 -0,05 0 0,05 0,1 0,15
PET aspergido PET com 10% de cobre aspergido PET com 20% de cobre aspergido
Recobrimentos
F
o
rç
a
m
éd
ia
d
e
d
es
lig
am
en
to
(
N
)
Figura 5.3.2 - Força Média de desligamento versus Recobrimento desenvolvidos no CETEC.
Nota-se que a incidência de organismos aderidos aumentou com o aumento do teor de cobre e conseqüentemente com o aumento da energia livre de superfície do material e com o acréscimo de um metal, no caso o cobre. A baixa mortalidade verificada, apesar do cobre ser um biocida, pode ser devida à pequena duração do ensaio em laboratório, 7 dias, o que pode ter sido insuficiente para que o óxido de cobre formado se diluísse na água. Portanto, os organismos podem não ter absorvido o biocida, evitando esse efeito sobre sua mortalidade, tendo então predominado em laboratório não a toxicidade do recobrimento, mas sim sua maior molhabilidade com o acréscimo de cobre.
5.4 – Influencia da rugosidade nos testes efetuados em laboratório
Os resultados dos parâmetros de rugosidade Ra e Rt medidos, bem como a força média de desligamento para os materiais poliméricos e do vidro podem ser visualizados na Tabela V.4.1 e Figuras 5.4.1 e 5.4.2..
Tabela V.4.1 - Valores de rugosidade e força média de aderência por material testado.
Material Ra Médio /(µµµµm) Rt Médio/(µµµµm) Força média de desligamento/(N)
vidro 0,02 0,54 0,490
PVC 0,21 5,57 0,232
polietileno 0,25 3,89 0,059
polipropileno 0,31 5,74 0,027
poliuretano 0,96 1,62 0,211
teflon 1,1 12,56 0,198
y = -0,5628x + 0,5893 R2 = 0,0437
0 0,2 0,4 0,6 0,8 1 1,2
0 0,1 0,2 0,3 0,4 0,5 0,6
Força média de desligamento/(N)
R
a
(
M
ic
ro
m
e
tr
o
s
)
y = -9,6231x + 6,9405 R2 = 0,1384
0 2 4 6 8 10 12 14
0 0,1 0,2 0,3 0,4 0,5 0,6
Força média de desligamento /(N) RT
(
M
ic
ro
m
e
tr
o
s
)
Figura 5.4.2 - Rtversus Força de média de desligamento.
Observou-se uma baixa correlação entre a rugosidade e a força média de desligamento, Tabela V.4.1 e Figuras 5.4.1 e 5.4.2. O teflon apresentou uma alta rugosidade e também um valor mais alto de força média de desligamento em comparação com os outros materiais, o que segundo Matsui[31] não seria de se esperar. Porém, como afirma Brady et all[9] os bissos podem se prender até mesmo na ausência de compatibilidade química, quando as superfícies são rugosas, penetrando em suas cavidades e prendendo-se a elas.
O efeito da rugosidade sobre a porcentagem de mortos e aderidos, bem como a força média de desligamento, foi avaliado para o aço inoxidável 304, Tabela V.4.2 e Figuras 5.4.3 a 5.4.6.
Tabela V.4.2 - Efeito das rugosidades na força média de desligamento, porcentagem de mortos e aderidos no aço inoxidável 304.
Condição Ra /(µµµµm) Rt /(µµµµm)
Força média de desligamento
/(N)
Desvio padrão
/(N) Mortos,% Aderidos,%
Ra1 4,24 40,01 0,087 0,074 13 40
Ra2 4,22 42,20 0,010 0,0047 20 33
0 5 10 15 20 25 30 35 40 45
4.24 4.22 3.77
R ug o sid ad e méd ia, micro - met ro
%mort os %aderidos
Figura 5.4.3 - Porcentagem de mortos e aderidos versus rugosidades do aço inoxidável.
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.18
4.24 4.22 3.77
Rugosidade média, micro-metro
F o rç a m éd ia d e d es lig am en to /( N )
Figura 5.4.4 - Força média de desligamento versus rugosidades diferentes do aço inoxidável.
5.5 – Testes efetuados em campo para as placas sem recobrimentos
A cada mês foi contado em laboratório o número de organismos aderidos às placas, tendo-se trabalho com o valor médio por mês no período de quatro meses (outubro a dezembro de 2004). O mesmo procedimento foi realizado para as placas com recobrimentos comerciais que não continham biocidas, para os recobrimentos comerciais que continham biocidas e os recobrimentos desenvolvidos no CETEC, Tabela V.5.1 e Figura 5.5.1.
Tabela V.5.1 - Média de organismos incrustados por mês sem recobrimento.
Material Média de organismos
incrustados/Mês Desvio Padrão
Aço Inoxidável 7 5
Alumínio 7 5
Aço Carbono 2 2
Zinco 1 0
Cobre 6 8
Latão 19 27
PVC 107 201
Polietilento 191 209
Polipropileno 26 34
PET 252 208
Poliuretano 8 10
-200,00 -100,00 0,00 100,00 200,00 300,00 400,00 500,00 Zinc o Cob re PV C Polie tilen to Polip ropi
leno PET
Poliu reta no Teflo n Materiais N ú m er o m éd io d e o rg an is m o s/ m ês
Figura 5.5.1 - Número médio de organismos aderidos/mês versus materiais sem recobrimentos.
Nota-se que as placas poliméricas de PVC, polietileno, PET e o teflon propiciaram um valor mais elevado de incrustação do que os materiais metálicos. O polipropileno e o poliuretano também propiciaram um alto desvio padrão. Isso pode estar relacionado à presença de biofilme nessas placas, o que poderia auxiliar os organismos a se aderirem a esses materiais propriamente.
5.6 – Testes efetuados em campo para os recobrimentos comerciais sem biocidas
O número médio de organismos incrustados por mês para os recobrimentos comerciais sem biocidas podem ser visualizados na Tabela V.6.1 e na Figura 5.6.1.
Tabela V.6.1 - Média de organismos incrustados por mês por recobrimentos comerciais sem biocidas.
Materiais sem biocidas Número médio de organismos incrustados/Mês
Desvio Padrão
A 3 4
B 2 4
C 13 18
D 19 35
F 4 4
G 2 213
H 43 53
-250 -200 -150 -100 -50 0 50 100 150 200 250
A B C D F G H
Recobrimentos comerciais sem biocidas
N ú m er o m éd io d e o rg an is m o s ad er id o s/ m ês
Figura 5.6.1 - Número médio de organismos aderidos por mês versus recobrimentos sem biocidas.
5.7 – Testes efetuados em campo para recobrimentos comerciais com biocidas
Algumas placas retidas do campo podem ser visualizadas nas Figuras 5.7.1 e 5.7.2.
Figura 5.7.1 - Placa retirada do campo com recobrimento com biocida.
O número médio de organismos incrustados por mês nos recobrimentos comerciais contendo biocidas pode ser visualizado na Tabela V.7.1 e na Figura 5.7.3.
Tabela V.7.1 - Número médio de organismos incrustados por mês para recobrimentos com biocidas.
Materiais com biocidas Número médio de organismos incrustados/Mês
Desvio Padrão
I 2 3
J 8 8
L 13 12
M 6 6
N 52 56
O 19 13
P 3 2
Q 7 3
R 45 22
S 22 31
T 247 340
-200 -100 0 100 200 300 400 500 600 700
I J L M N O P Q R S T
Recobrimentos com biocidas
n ú m er o m éd io d e o rg an is m o s in cr u st ad o s/ M ês
Figura 5.7.3 - Número médio de organismos aderidos versus recobrimentos que continham biocidas.
V.7.1 e Figura na 5.7.3. O desvio padrão destes materiais com alta taxa de incrustação também foi alto, o que sugere um comportamento irregular durante os testes. Os melhores materiais testados acima foram o I, J, M, P, Q.
5.8 – Teste em campo para recobrimentos desenvolvidos no CETEC
O número médio de organismos incrustados por mês para os recobrimentos desenvolvidos no CETEC pode ser visualizado na Tabela V.8.1 e na Figura 5.8.1.
Tabela V.8.1 - Número médio de organismos incrustados por mês por recobrimento desenvolvido.
Recobrimentos desenvolvidos Número médio de organismos incrustados/mês
Desvio Padrão
PET aspergido 2 2
PET com 10% de cobre aspergido 3 2
PET com 20% de cobre aspergido 0 0
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50 5,00
PET aspergido PET com 10% de cobre aspergido PET com 20% de cobre aspergido
Recobrimentos desenvolvidos N ú m e ro m é d io d e o rg a n is m o /m ê s
Figura 5.8.1 - Número médio de organismos por mês versus recobrimentos desenvolvidos no CETEC.
5.9 – Ensaio de Força de desligamento no Campo
Muitas placas que foram colocadas em campo se perderam depois de seis meses de ensaio, porque elas foram presas à garrafa PET com fios de aço carbono que, com o tempo, foram corroídas e rompidas ou não tiveram organismos aderidos com tamanho suficiente para os ensaios de desligamento. Os resultados das placas que tinham essas condições podem ser visualizados na Tabela V.9.1 e na Figura 5.9.1
Tabela V.9.1 - Força média de desligamento por material testado em campo.
Material Força Média de
desligamento /(N) Desvio Padrão
Poliuretano 0,410 0,231
Alumínio 1,580 0,469
Aço Inoxidável 2,205 1,202
B 3,342 0,160
M 5,011 0,390
R 3,499 0,426
0,00 1,00 2,00 3,00 4,00 5,00 6,00
Poliuretano Alumínio Aço Inoxidável B M R
Materiais
F
o
rç
a
m
éd
ia
d
e
d
es
lig
am
en
to
/(
N
)
Verificou-se que em campo se obteve maiores valores da força de desligamento. Possivelmente esse aumento se deve ao maior tempo de exposição dos corpos de prova ao meio com mexilhões (seis meses), o que proporcionaria o desenvolvimento pleno de bissos, bem como pelas condições do ambiente em que havia fluxo de água sobre os organismos eventualmente fixados.
![Figura 1.3 – Mexilhões retirados da tubulação Figura 1.4 – Filtro alto limpante de uma usina hidroelétrica [1] de uma usina hidroelétrica [4]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15906559.672622/15.892.469.790.116.416/figura-mexilhões-retirados-tubulação-figura-limpante-hidroelétrica-hidroelétrica.webp)
![Figura 3.1 - Seção transversal de um molusco apresentando a estrutura de um bisso [8]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15906559.672622/20.892.342.633.119.290/figura-seção-transversal-de-molusco-apresentando-estrutura-bisso.webp)
![Figura 3.3 – Placa adesiva da Pinctada fucata aderido a granito (1.00 mm/div.) [10]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15906559.672622/21.892.292.620.540.749/figura-placa-adesiva-pinctada-fucata-aderido-granito-div.webp)


![Figura 3.10 - Força de desligamento versus Energia livre de superfície [31-36] .](https://thumb-eu.123doks.com/thumbv2/123dok_br/15906559.672622/28.892.113.824.137.554/figura-força-desligamento-versus-energia-livre-superfície.webp)
![Tabela IV.1.1 - Energia livre de superfície dos líquidos que foram utilizados [31] .](https://thumb-eu.123doks.com/thumbv2/123dok_br/15906559.672622/32.892.102.798.1039.1145/tabela-iv-energia-livre-superfície-líquidos-foram-utilizados.webp)