38 REnCiMa, v. 9, n.4, p. 38-57, 2018
A IMPORTÂNCIA DA SIMBOLOGIA NO ENSINO DE QUÍMICA E SUAS
CORRELAÇÕES COM OS ASPECTOS MACROSCÓPICOS E
MOLECULARES
THE IMPORTANCE OF SYMBOLOGY IN CHEMISTRY TEACHING AND ITS CORRELATIONS WITH MACROSCOPIC AND MOLECULAR ASPECTS
Débora Piai Cedran
Universidade Estadual de Maringá, depiai@yahoo.com.br
Neide Maria Michellan Kiouranis
Universidade Estadual de Maringá - UEM/Programa de Pós-Graduação em Educação para a Ciência e a Matemática – PCM, nmmkiouranis@gmail.com
Jaime da Costa Cedran
Universidade Tecnológica Federal do Paraná – UTFPR Câmpus Medianeira, jaimecedran@utfpr.edu.br
Resumo
A simbologia química é um dos temas mais importantes no estudo desta ciência, pois é por meio dela que se traduzem os fenômenos subatômicos e, assim, podemos considerá-la mediadora no entendimento de diversos conceitos macroscópicos e molecuconsiderá-lares. Apesar da relevância, pesquisas revelam que estudantes apresentam dificuldades centradas neste tema, o que pode dificultar a compreensão de conceitos químicos. Nesse sentido, esta pesquisa possui o intuito de identificar se 72 estudantes ingressantes de uma universidade pública do estado do Paraná, que cursavam a disciplina de química geral, compreendiam alguns símbolos amplamente usados em química e os significavam em suas diversas circunstâncias, através de suas representações/modelos. A partir dos dados coletados, pretendeu-se apresentar reflexões sobre os modelos dos estudantes para tais entidades, em especial, se os acadêmicos compreendiam os símbolos por ele próprio e se eram capazes de relacioná-los com os seus aspectos teóricos e empíricos. A análise da questão aplicada indicou que os alunos identificaram alguns símbolos, porém, tiveram dificuldades para representá-los, demonstrando a necessidade em ampliar as reflexões sobre a importância da simbologia e das discussões que se referem à integração dos três aspectos do conhecimento químico: macroscópicos; simbólicos e moleculares.
39 REnCiMa, v. 9, n.4, p. 38-57, 2018 Abstract
Symbology in chemistry is one of the most important themes in the study of this science, as subatomic phenomena are translated through it, enabling it to be considered a mediator in the understanding of diverse macroscopic and molecular concepts. Despite its relevance, research reveals that students have difficulties with this theme, which can hinder the understanding of chemistry concepts. This study aims to identify if 72 Paraná state public university general chemistry students understood a number of symbols that are widely used in chemistry, and their meanings in diverse circumstances, by means of representations/models. Based on the collected data, the intention was to reflect on the models of the students for such entities, verifying especially if the students understood the symbols by themselves, and if they were able to relate them to their theoretical and empirical aspects. Analysis indicated that the students managed to identify some symbols, but had difficulties representing them, which demonstrates the necessity of greater reflection on the importance of symbology and discussions that refer to the integration of three aspects of chemistry knowledge: macroscopic, symbolic and molecular.
Keywords: Johnstone’s triangle. Symbols. Learning.
Introdução
A química é uma ciência que se caracteriza por explicar fenômenos derivados das transformações da matéria, baseando suas explicações nas existências de partículas, sendo que as alterações no arranjo ou interações entre estas partículas causam mudanças que podem ser observadas macroscopicamente. Porém, essa relação entre os fenômenos observáveis macroscópicos e o “mundo” corpuscular só pode ser elucidada por meio de modelos que procuram representar da melhor forma possível estas entidades não observáveis (POZO e GOMES CRESPO, 2009). É por meio da proposição e refutação de modelos que a ciência química se desenvolve.
Assim, as teorias em química, de maneira geral, materializam-se em representações, especialmente quando pensamos nas entidades corpusculares não observáveis (GRESCZYSCZYN, 2017) que podem ser denominadas, como exemplo, átomos, moléculas, partículas, compostos. Com isso, o objetivo deste estudo é provocar uma reflexão a respeito dos modelos que se tem para tais entidades e sua simbologia, principalmente no que se refere às implicações teóricas de construção intrínsecas a cada modelo ou símbolo, bem como sua abordagem nas situações de ensino e aprendizagem. A simbologia química: implicações teóricas e seus pressupostos históricos
No final do século XVIII, o sueco Jons Jacob Berzelius (1779 - 1848), estudante de medicina na Universidade de Upsala, teve contato com a primeira obra alemã a contemplar o novo sistema de Lavoisier “Anfangsgrunde der antiphlogistischen Chemie” (Elementos da Química Antiflogística) publicada em 1792 por Christoph Gitanner (1760– 1800). Berzelius passou a se dedicar à química e, em 1814, apresentou sua proposta de símbolos para representar os “corpos simples” (hoje elementos químicos).
40 REnCiMa, v. 9, n.4, p. 38-57, 2018 Os símbolos químicos deveriam ser letras, para maior facilidade de escrever, e não desfigurar um livro impresso. Embora esta última circunstância possa não parecer de grande importância, deve ser evitada sempre que possível. Tomarei, portanto, o sinal químico, a letra inicial do nome latino de cada substância elementar (BERZELIUS, 1814, p. 51, tradução nossa).
Para elaboração da proposta, Berzelius levou em conta os conceitos e teorias em discussão naquele momento, como o modelo atômico recém proposto por Dalton; o trabalho de Richter sobre as proporções de ácidos e bases, na formação de sais neutros; a Lei das Proporções Definidas de Proust; a Lei das Proporções Múltiplas; a Lei das Proporções Recíprocas; a Lei das Proporções Volumétricas de Gay-Lussac; a Teoria Eletroquímica Dualística e o Isomorfismo, propostos pelo próprio Berzelius; a Hipótese de Avogadro (parcialmente aceita); a lei de Dulong e Petit e a Analogia Química (GONZALEZ e SILVA, 2013).
Isso significa que, para propor a representação por símbolos indicados pela primeira letra do nome latino dos corpos simples, Berzelius fez uso das teorias citadas. Isso reflete a complexidade conceitual do sistema desenvolvido pelo químico sueco, pois, mais do que imaginar uma representação simplificada para os elementos químicos, Berzelius foi capaz de estruturar, nessa representação, as teorias consideradas satisfatórias à época. Como exemplo disso, tem-se o uso das proporções múltiplas, pois, em seu sistema de símbolos, Berzelius contemplou a formação de substâncias (do qual denominava corpos compostos) com proporções definidas entre os seus elementos constituintes, como é evidenciado no texto do autor:
O símbolo químico expressa sempre um volume da substância. Quando é necessário indicar vários volumes, é feito adicionando o número de volumes: por exemplo, o óxido cuproso é composto por um volume de oxigênio e um volume de metal; portanto seu símbolo é Cu + O. O óxido cúprico é composto de 1 volume de metal e 2 volumes de oxigênio; então seu símbolo é Cu + 2O. Da mesma maneira, o símbolo do ácido sulfúrico é S + 3O; ácido carbônico C + 2O; para água 2H + O, e etc. Quando expressamos o volume de um composto de primeira ordem, jogamos fora O +, e colocamos o número de volumes acima da letra: por exemplo, CuO + SO3 = sulfato de cobre, CuO2 + 2SO3 = persulfato de cobre. [...] Quanto aos volumes (de compostos) de segunda ordem, [...] faremos isso usando o parêntese, como é feito em fórmulas algébricas: por exemplo, o alumem é composto de 3 volumes de sulfato de alumina e 1 volume de sulfato de potássio. O seu símbolo é 3 (AlO2 + 2SO3) + (Po2 + 2SO3) (BERZELIUS, 1814, p. 52, tradução nossa).
Ao apresentar seu sistema de representação para os elementos químicos, dedicou-se a considerar e integrar todas as teorias para propor a existência da proporcionalidade entre os elementos em um composto. Com esse sistema, publicado em 1814, a química, por meio da notação, pôde ser sistematizada e ensinada de maneira universal, representando, assim, as teorias e explicações fenomenológicas. A própria explanação de Berzelius, para formação de óxidos (BERZELIUS, 1819), retrata o novo sistema de notações que traria facilidades para a compreensão da química, mesmo esse sistema representacional carregando todas as relações existentes nas combinações, proporções, ou seja, o que se pode compreender e refletir por meio de um símbolo. Isso, de certa
41 REnCiMa, v. 9, n.4, p. 38-57, 2018 forma, contribuiu para que outras teorias surgissem e novas perspectivas sobre a química fossem pensadas.
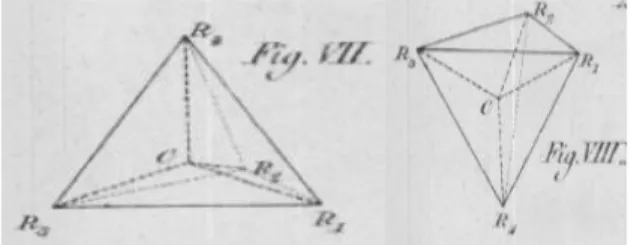
Outro relevante momento histórico em que a representação fez-se presente no desenvolvimento de um novo olhar sobre a química, foi a proposição da geometria tetraédrica para os compostos de carbono, modelo esse, apresentado pelo químico holandês Jacobus Henricus van't Hoff (1852 – 1911) e pelo francês Joseph le Bell (1847 – 1930), de forma independente, no fim do mesmo século XIX. Eles se utilizaram também de um vasto arcabouço teórico que subsidiaria tal representação. No trabalho em que explica sua representação tetraédrica para os compostos de carbono, van´t Hoff afirma:
Quando as quatro afinidades do carbono são satisfeitas por quatro grupos univalentes diferentes, dois, e não mais que dois diferentes tetraedros são obtidos, sendo um deles, a imagem especular não sobreponível do outro (VAN´T HOFF 1874, p. 446, tradução nossa).
Assim como no trabalho de Berzelius, a proposta de representação de van´t Hoff foi construída por meio do uso de vastas teorias e dados experimentais, conhecidos por ele, e que necessariamente tiveram que ser levados em conta no modelo proposto. Assim, destacam-se dois pontos na asserção deste modelo: o primeiro seria a tetravalência do carbono proposto por Kekulé (1861), e o trabalho apresentado por Louis Pasteur, em 1860 (RICHARDSON, 1901), sobre as substâncias que apresentam o que hoje se designa isomeria óptica. Desta forma, van´t Hoff (figura 1), adequou o seu modelo aos dados e teorias vigentes, elevando-o a mais que uma representação tridimensional dos compostos químicos, mas a um conceito que contém implicitamente ideias fundamentais para que a proposta pictórica apresentada pelo químico holandês fosse possível.
Figura 1 – Estruturas tetraédricas propostas por van´t Hoff Fonte: van´t Hoff (1874, p. VII)
Assim, utilizando os exemplos de Berzelius e van’t Hoff, nota-se que os símbolos são primordiais no entendimento da química e, sobre a perspectiva de torná-la mais acessível, historicamente, foram modificados, dando significados a teorias e fenômenos.
Para tornar isso possível, o primeiro passo foi estabelecer símbolos que fossem consensuais entre os químicos para, em seguida, propor nomenclaturas que também fossem aceitas pela comunidade científica. Neste ínterim, na segunda metade do século XIX ocorreu o primeiro encontro da comunidade química europeia, o Congresso de Karsluhe, em 1860, que embora não tenha sido conclusivo na definição de termos e nomenclatura, foi fundamental para que outros encontros pudessem ocorrer.
Em 1892, na conferência de Genebra, foram lançadas as bases para um sistema de nomenclatura orgânica, aceito internacionalmente. Já para os compostos inorgânicos as primeiras normativas sobre a nomenclatura foram publicadas em 1940 (CONNELLY et
42 REnCiMa, v. 9, n.4, p. 38-57, 2018
al., 2005), pela IUPAC (sigla em inglês para a União Internacional de Química Pura e
Aplicada, fundada em 1919). Desde então, periodicamente, a IUPAC atualiza as normas para simbologia e nomenclatura das substâncias químicas por meio da publicação dos intitulados “color books” no qual cada cor remete a uma área específica da Química (IUPAC, 2018). Hoje, os nomes e símbolos são utilizados como parte da linguagem química, atrelados aos fenômenos e teorias que fundamentam essa ciência.
A simbologia e a educação química
No contexto escolar, a leitura simbólica dos elementos, moléculas, átomos, íons, entre outros, também se faz presente. O estudo da química sem o uso dessas representações quase que se impossibilita, assim, espera-se que os estudantes tenham certa familiaridade com os aspectos relacionados à simbologia. A expectativa quanto ao uso desta vertente do conhecimento químico faz-se tão presente nas aulas que, por vezes, o ensino se baliza fortemente sob seu uso.
O entendimento da simbologia química se torna primordial na compreensão desta ciência, já que, ao nos referimos a qualquer conceito químico, é necessária certa familiaridade com esta linguagem. Assim, Jacob (2001) assume que:
O nível inicial de linguagem química contém símbolos químicos para substâncias e, à primeira vista, dificilmente se assemelha a uma linguagem moderna. O simbolismo químico tem suas próprias regras quanto ao uso operacional dos símbolos. O tratamento do simbolismo como linguagem implica, por exemplo, que é possível definir regras formais e semânticas para o uso de símbolos químicos. Esta escolha inicial - embora não inteiramente não problemática - permite a aplicação de conceitos linguísticos básicos a todos os níveis da linguagem química (JACOB, 2001, p.32, tradução nossa).
Apesar da relevância, algumas pesquisas têm apresentado as dificuldades por parte dos alunos no domínio da temática, no que diz respeito às regras formais e compreensão conceitual dos símbolos. Como exemplo, Herron (1975) relata os entraves percebidos em seus estudantes. O autor indica que seus alunos não conseguiam diferenciar as representações do H+, H e H2 quando questionados, mencionando poucas vezes as palavras íon, átomo ou moléculas às três espécies, não exprimindo diferenciação alguma nos símbolos. Nesse sentido, Herron (1975) justifica a dificuldade de seus alunos pelos níveis de formação cognitiva necessários para compreensão da química. Como as representações não são entendidas em termos moleculares, os estudantes se utilizam desta simbologia de maneira mecânica, não conseguindo então diferenciar a simbologia de uma molécula ou de um íon, por exemplo.
Yarroch (1985) entrevistou quatorze estudantes de química de duas escolas secundárias americanas, com o objetivo de compreender como alunos já iniciados no conteúdo de balanceamento de equações químicas realizavam o processo, o conhecimento empregado ao equilibrar as equações e suas representações para as equações balanceadas. Como resposta ao estudo, doze alunos foram capazes de equilibrar com êxito as quatro equações apresentadas, no entanto, sete dos doze alunos não foram eficazes em construir representações que fossem razoavelmente consistentes
43 REnCiMa, v. 9, n.4, p. 38-57, 2018 com a notação da equação. Segundo o autor, os estudantes que apresentaram dificuldades em construir as representações não compreendiam claramente os símbolos apresentados nas equações, pois confundiam, por exemplo, o significado dos números subscritos, mostrando incerteza se eles poderiam ser modificados ou não no processo de balanceamento. Para os pesquisadores, ficou claro que o processo de balanceamento, para alguns deles, tratava-se de igualar os símbolos, em vez de indicar os pressupostos de conservação das partículas. Assim, “possuíam o conhecimento mínimo necessário para manipular com sucesso os símbolos, mas não foram capazes de demonstrar que tinham conhecimento adicional sobre eles” (YARROCH, 1985, p. 457).
Já no ano de 1993, Keig e Rubba pesquisaram a temática dos símbolos, com o objetivo de caracterizar a habilidade de estudantes de química em traduzi-los no que diz respeito à estrutura da matéria. Os estudos preliminares, que consistiram na aplicação de atividades, avaliações, entrevistas, contaram com a participação de 82 estudantes de nível médio de uma escola dos Estados Unidos. Em meio às atividades, algumas substâncias consideradas de simples compreensão foram apresentadas, por exemplo, H2O, CH2O, N2, CO2, assim, os estudantes necessitavam, dentre outros afazeres, explicar as fórmulas químicas. Os resultados deste estudo mostraram que os estudantes possuíam uma variedade de dificuldades integradas ao uso das fórmulas, como a associação de símbolos a elementos indistintos, a equivalência dos índices numéricos em diferentes compostos de mesma fórmula mínima, a aplicação dos subscritos ao elemento seguinte, ao invés do que o precede, além de atribuir ao numeral subscrito o papel de ligação dupla ou tripla, por exemplo. Neste sentido, Glazar e Devetak (2002) observaram que alguns estudantes eslovenos construíram fórmulas incorretas devido ao mal-entendido do papel dos números de oxidação e do significado dos prefixos (di-, tri-,...) em nome de compostos. Eles também citam que alguns alunos utilizavam ânions e cátions errados na fórmula de um sal ou cometiam equívocos ao definir a carga de íons em um sal.
No Brasil, a temática também foi discutida em algumas investigações. Brito, et al. (2008) realizaram uma pesquisa com um grupo de 46 estudantes de licenciatura em química, os quais necessitavam fazer o balanceamento e a representação de uma reação química. Das respostas apresentadas, houve o indicativo de que todos os alunos conseguiram balancear corretamente a equação, no entanto a representação foi feita de maneira insatisfatória. Os resultados desta pesquisa indicam que, apesar de os alunos expressarem corretamente os coeficientes da reação, eles não compreendiam o que isso de fato representava o que expressou a tendência de que realizavam a operação de maneira algébrica, sem estabelecer relações com os modelos moleculares envolvidos na reação.
Outros estudos também indicam dificuldades com a simbologia no ensino e aprendizagem da química (KIOURANIS et al., 2012) realizaram uma pesquisa com 81 alunos do terceiro ano do ensino médio a fim de investigar se esses alunos compreendiam alguns símbolos utilizados na química. Os resultados desta pesquisa mostraram que apenas 6 alunos conseguiram explicar corretamente o que a seta de reação retratava. No que diz respeito à representação de alguns compostos, 39 alunos conseguiram indicar corretamente o que a simbologia da água líquida representava,
44 REnCiMa, v. 9, n.4, p. 38-57, 2018 enquanto que para água sólida este número caiu para 28.
Com a expressão da necessidade corrente em compreender como a linguagem química e os símbolos se relacionam com os materiais envolvidos nos problemas teóricos de química, Gonzalez (2016) explorou a temática da simbologia com 8 alunos do curso de licenciatura de química da Universidade Federal da Bahia. A pesquisadora indicou que, apesar dos licenciandos conseguirem representar alguns símbolos pedidos, a maioria se baseou em regras para a formulação, o que posteriormente os impediu de explicar os fundamentos usados nos procedimentos de construção dos símbolos.
Assim, as pesquisas aqui destacadas indicam as dificuldades dos estudantes na compreensão da simbologia química, bem como sua representação. Desse modo, se os alunos têm, por muitas vezes problemas em entender tal simbologia ou operar sobre elas, em outras situações, pode ser ainda mais complicado e sem significados. É preciso, sobretudo, compreender que a simbologia representa um conjunto de situações complexas e que possui embasamentos teóricos em sua elaboração, o que de certa forma é atenuado no ensino da química.
Os aspectos macroscópico, molecular e simbólico no ensino de química
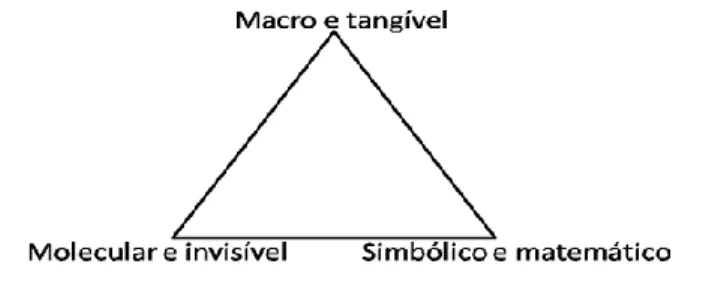
Johnstone (1982, 2000, 2010) considera, então, que a química se constrói sob três aspectos que agregam todas as formas de representação e interpretação da química: macroscópico; molecular e simbólico A dimensão simbólica envolve a atribuição de símbolos para a expressão das entidades, como átomos, moléculas, sinais para exibição de carga elétrica, índices utilizados para indicar a atomicidade de certa molécula, letras que apresentam o estado físico de certa substância, além das representações estruturais das moléculas. Também se insere, nessa dimensão, as convenções adotadas para as representações de equações químicas e os coeficientes usados para tornar as equações balanceadas. Assim, o aspecto simbólico representa os modelos e teorias propostos na dimensão molecular para explicar os fenômenos observáveis.
Nesta perspectiva, a dimensão macroscópica (também denominada de tangível, fenomenológica) pode ser compreendida como o que é facilmente perceptível na vida cotidiana, assim, pode ser medido e/ou observado, como a massa, temperatura, volume, a liberação de um gás em uma reação ou a mudança de coloração em um fenômeno químico (JOHNSTONE, 1982, 2000, 2010). Este nível é exprimível por meio das propriedades empíricas e caracteriza não somente o observável imediato, como um experimento feito em sala de aula, mas também pode agregar as vivências dos sujeitos em suas atividades anteriores (GILBERT e TREAGUST, 2009).
Já os aspectos moleculares (indicados na literatura como submicroscópicos, invisíveis, teóricos) relacionam as informações de natureza atômico-molecular, envolvendo, portanto, explicações baseadas em modelos abstratos e que incluem entidades não diretamente observáveis, como átomos, moléculas, íons, elétrons etc. (GILBERT e TREAGUST, 2009). Assim, neste aspecto, preconizam-se as perspectivas teóricas explicativas, como a cinética dos gases, a transferência de elétrons numa reação redox, ou ainda a teoria de colisões.
45 REnCiMa, v. 9, n.4, p. 38-57, 2018 tríade, pois o entendimento se dá considerando os aspectos macroscópicos, que se explicam sobre a vertente molecular, que é apresentada por meio dos símbolos. Assim, esta relação pode ser representada pela figura 2, interpretada pela fusão dos três aspectos, de modo que a acepção da química tenha a particularidade de cada vertente, mas de maneira indissociada.
Apesar da importância conferida a cada um dos aspectos do conhecimento químico, a proposta do triângulo apresentada por Johnstone é alvo de discordância entre alguns pesquisadores. Dentre eles, destacamos o trabalho de Labarca (2010), que afirma que a proposta do tripleto químico apresenta erro filosófico e indefinições entre os planos de argumentação. Segundo o autor, a proposta do triângulo confunde o plano ontológico, linguístico-conceitual e matemático, pois os níveis macro e moleculares pertenceriam ao plano ontológico enquanto o nível simbólico seria um híbrido dos planos conceitual e matemático. Assim, seria incoerente comparar os níveis propostos por Johnstone, pois pertencem a planos diferentes. Araujo Neto (2009) também critica a dificuldade, ou falta de clareza, na compreensão do tripleto de Johnstone:
Tais níveis parecem confundir referentes e referência, o representante e a própria representação. Isso pode ocorrer por uma confusão entre os tais níveis de representação e as coisas do mundo. Se as coisas ao nosso redor, todos os tipos de materiais, os entes que classificam como submicroscópicos (moléculas, átomos, etc) ou quaisquer tentativas que puderem ser feitas criadas de entendê-los (desenhos, artefatos materiais, equações, etc) são tomados como representação, tem-se uma proposta não realista de constituição do mundo (ARAUJO NETO, 2009, p. 49). Outra proposta de tripleto químico foi apresentada por Mortimer et al. (2000), na qual os autores utilizam os termos teórico, fenomenológico e representacional para os vértices do triângulo. Para os autores, o aspecto fenomenológico diz respeito aos fenômenos de interesse da química, sejam aqueles concretos e visíveis, sejam aqueles que temos acesso apenas indiretamente. Já o aspecto teórico relaciona-se com explicações baseadas em modelos abstratos. Os conteúdos químicos de natureza simbólica estão agrupados no aspecto representacional, que compreende informações inerentes à linguagem química (MORTIMER, et al., 2000). Embora similares, a proposta de Mortimer, et al. (2000) distingue-se em alguns aspectos, incluindo experiências cotidianas e dados experimentais no aspecto fenomenológico, além de atenuar as críticas feitas por Araújo Neto (2009) no que diz respeito à representação (SOUZA, 2012).
Apesar da necessidade de readequação em alguns aspectos, optou-se, por utilizar os pressupostos de Johnstone, pois entendemos que o referencial, no que tange às
Figura 2 – Três aspectos do conhecimento químico Fonte: Adaptado de Johnstone (2010, p. 24)
46 REnCiMa, v. 9, n.4, p. 38-57, 2018 questões simbólicas, mostra-se satisfatório e, apesar das críticas, o trabalho do autor revelou a problemática, inaugurando um novo olhar sobre a compreensão dos conhecimentos químicos. Neste sentido, entendemos que a proposta de Johnstone se concentra na tese de que os três aspectos do conhecimento químico, necessariamente, integram-se. Além disso, esse referencial continua sendo utilizado na literatura, como nos trabalhos de Vilardo, Mackenzie e Yezierski (2017), Santos e Arroio (2016); Melo (2015); Pauletti, Rosa e Catelli (2014); Taskin e Bernholt (2014); Philipp, Johnson e Yezierski (2014); Contreras e González (2014).
Mesmo que estes três aspectos se façam presentes nas aulas de química, e refletindo de maneira aprofundada, a construção de um conceito dificilmente não perpassaria por tais perspectivas. Frequentemente estas dimensões são abordadas de maneira intuitiva e isoladas pelos professores. O aspecto molecular, por exemplo, é estabelecido por memorização de leis e os experimentos que podem agregar os enfoques macroscópicos ficam restritos à certificação dos princípios. Assim, as relações traçadas entre estes aspectos não são permeadas, dificultando a elaboração de modelos explicativos por parte dos estudantes. Desta forma, utilizando algumas extremidades do triângulo de Johnstone (1982, 1991, 2010), é comum também que, ao fazer interpretações de algumas representações, os alunos as concentrem em uma vertente, ou ainda apresentem dificuldades ao elaborar suas explicações.
Dentro dessa perspectiva, este artigo apresenta a análise qualitativa de uma questão, aplicada a 72 estudantes ingressantes em cursos de graduação de uma universidade pública do estado do Paraná, que tinham como disciplina básica a química geral, com o intuito de identificar se estes estudantes compreendiam alguns símbolos amplamente usados em química e os significavam em suas diversas circunstâncias, através de suas representações/modelos. A partir dos dados coletados, pretendeu-se apresentar reflexões sobre as representações elaboradas pelos estudantes, para tais entidades, em especial, se os acadêmicos compreendiam os símbolos por ele próprio e se eram capazes de relacioná-los com os seus aspectos teóricos e empíricos.
Percurso metodológico
Para o desenvolvimento dessa pesquisa, foi aplicada e analisada uma atividade diagnóstica composta de três questões abertas relacionadas à simbologia e outros conteúdos essenciais empregados na química, com a finalidade de investigar a familiaridade que os estudantes possuíam com as mesmas, elaborando, posteriormente, modelos acerca dos símbolos e fenômenos apresentados. A preocupação em elaborar modelos está diretamente ligada à concepção de que, através das construções do pensamento, é possível formular hipóteses, operando sobre a capacidade de abstração que pode ser, ou já foi desenvolvida, usando características interpretativas e justificativas para realidade conhecida (EICHLER, 2001). Assim, com as representações apresentadas pelos estudantes, é possível inferir suas concepções e compreender se eles conseguiram atribuir significado aos símbolos, entre outros conteúdos, integrando-os aos outros aspectos da química.
47 REnCiMa, v. 9, n.4, p. 38-57, 2018 do Paraná que cursavam a disciplina de química geral responderam a atividade diagnóstica que foi aplicada no primeiro dia de aula da disciplina. A atividade foi respondida individualmente de forma que, em sua análise, fosse possível perceber suas interpretações no que se refere aos temas. Para esse estudo, nos direcionamos aos aspectos simbólicos contidos na primeira questão da atividade. Desta forma, segue parte da primeira questão apresentada no quadro 1:
Quadro 1 – Questão aplicada aos estudantes participantes da pesquisa
Considere os seguintes símbolos: H2O(s); H2O(g); Na; Na+(aq); HCl(g); HCl(aq)
a) Explique o que cada símbolo representa.
b) Represente cada situação acima, supondo que cada átomo é uma esfera.
Fonte: Autoria própria
A escolha dos símbolos apresentados se deve ao fato de que cada um representa condições que julgamos importantes na compreensão da química, como no caso da água sólida e gasosa, ou elemento sódio e íons sódio em meio aquoso se justapondo um ao outro nos exemplos dados em termos de conceitos e explicações. A partir das respostas obtidas, tabulamos os resultados e analisamos as informações apresentadas ao item a da questão, identificando, por meio do item b, se os símbolos explicados pelos alunos podiam ser representados adequadamente por eles, por meio da utilização de modelos.
Reflexões sobre os resultados da análise
Apesar de a química ter caráter fortemente empírico, seu objeto específico de estudo não é observável. Seu empirismo vai além da simples observação, passando então para reflexões mais profundas nas relações existentes entre o indutivo e o dedutivo, o concreto e o abstrato. Em uma reação, por exemplo, a observação da efervescência, ou a mudança de coloração com a adição de um reagente em outro, não são elementos suficientes para descrever e interpretar o fenômeno. Para tanto, é necessário que o fenômeno empírico seja compreendido com base numa hipótese, modelo e\ou teoria, seja aquela aceita pela comunidade científica, ou mesmo uma ideia criada pelo observador do fenômeno. E, para representar hipótese, modelo e\ou teoria, surge a necessidade da utilização de símbolos, para que, através deles se façam compreensíveis entidades que não são diretamente manipuláveis. Assim os três aspectos do conhecimento químico devem ser integrados e significados na compreensão da química (JOHNSTONE, 2000).
Assim, ressaltar a importância conferida à apropriação da simbologia da química é compreender que se dificulta o entendimento desta ciência, em seus aspectos amplos e particulares, se os símbolos mais usados não são incorporados pelos estudantes. Dessa forma, é importante que os professores reflitam sobre a relevância dos símbolos nesse processo, bem como, sobre a dificuldade de compreender as relações entre tais símbolos e as teorias e fenômenos, pois, segundo Brito et al.(2008), fórmulas e equações químicas são:
Mediadoras do conhecimento químico, e o sucesso do ensino e consequentemente de sua aprendizagem dependem da maneira como os professores trabalham e relacionam esta simbologia com outros aspectos do conhecimento químico, principalmente os aspectos macroscópicos e microscópicos (BRITO, et al., 2008, p. 1).
48 REnCiMa, v. 9, n.4, p. 38-57, 2018 Além disso, o desenvolvimento da química como ciência necessariamente se pautou no desenvolvimento da simbologia, pois, por meio dela, também foi possível compreender aspectos conceituais, assim como discutido por Andrade Neto et al. (2009), que apresentam a alteração na forma de representação ocorrida nas primeiras décadas do século XIX, quando os símbolos propostos por Berzelius passam a ser usados para representar processos químicos, complementando a nomenclatura descritiva de Lavoisier. Sobre esse momento histórico, os autores argumentam que:
A mudança na notação ocorre para resolver pragmaticamente o problema central da conservação de massa e de identificação do elemento químico. Além disto, as representações começam a ser operáveis, tal qual ocorre na matemática, onde se podem fazer cálculos estequiométricos diretamente nas representações externas (ANDRADE NETO, et al., 2009, p.6).
Considerando a importância da simbologia para o desenvolvimento e compreensão da ciência e seu papel na educação química, foi pedido aos alunos que explicassem a simbologia das espécies químicas citadas na questão apresentada. Encontramos diversas explicações que foram enquadradas nas categorias: definições aceitas cientificamente e definições não aceitas cientificamente. Tal designação foi feita de acordo com as teorias estabelecidas pela ciência atual. Segundo Jacob (2001), os símbolos elementares são combinados na formação das fórmulas químicas e esta combinação de símbolos segue um conjunto de regras formais, as quais abrangem fundamentos empíricos, como os estados de oxidação, a eletronegatividade, os mecanismos de reação, e se consolidam por meio de teorias. Dessa forma, os dados gerais encontram-se no quadro 2:
Quadro 2 – Número de alunos que explicaram com definições aceitas cientificamente e com definições não aceitas cientificamente os símbolos
Símbolos Categorias H2O(s) H2O(g) Na Na+ (aq) HCl(g) HCl(aq)
Definições aceitas cientificamente 47 46 46 28 4 32
Definições não aceitas cientificamente 24 24 19 33 55 25 Não explicaram 1 2 7 11 13 15
Fonte: Autoria própria
Sobre as explicações obtidas, pode-se perceber que apesar de os símbolos usados nesta pesquisa serem amplamente empregados na química e em outras ciências, nem sempre os estudantes conseguem explicar apropriadamente o que cada um representa. Dentre todas as substâncias habituais na química, provavelmente a água é a mais utilizada, então, seria razoável que, no estudo de sua simbologia, estivessem presentes as menores dificuldades de acepção, o que pôde ser evidenciado nesta pesquisa. No entanto, quando combinada à simbologia desta substância ao símbolo de seu estado físico, 24 alunos explicaram de maneira inapropriada a simbologia.
As dificuldades são notadas nos excertos apresentados nas figuras 3, 4, 5 e 6, retirados das atividades. Nota-se que mesmo atribuindo o nome “água” à fórmula H2O, algumas dificuldades foram encontradas, exemplificadas pelas figuras 3, 4, 5 e 6, em que
49 REnCiMa, v. 9, n.4, p. 38-57, 2018 o índice (s) foi interpretado como solução, ou ainda a expressão “formato gasoso”, também ser encontrada em outras respostas, dando a impressão de que a água assume uma forma diferente dependendo do seu estado físico. Ainda consideramos inapropriada a indicação algorítmica das moléculas, como no caso abaixo apresentado, “1 molécula de
água no estado gasoso”, já que se compreende que o estado físico não pode ser
representado por uma única molécula.
O fato, então, de os estudantes reconhecerem a simbologia das espécies químicas, mas não sugerirem explicações adequadas sobre os fenômenos, dá indícios de que os outros aspectos (macro e molecular), não são considerados nem entendidos. Compreendemos que o símbolo relacionado à molécula de água foi reconhecido, no entanto, as explicações que se vinculam a outras questões simbólicas não são familiares. Segundo Taber (2009), a linguagem química pode ser entendida como uma segunda língua para os iniciados, ou seja, tão difícil como aprender e compreender, por exemplo, inglês, chinês, ou qualquer outra. Assim, é compreensível que nem sempre os alunos entendam outros símbolos que não os mais usados, especialmente, quando não se dá muita importância para a relação entre o símbolo e seu significado. Nesse sentido, Flôr e Cassiani (2016) afirmam que professores tendem a tratar fenômenos como equações:
Como se a relação entre os dois fosse óbvia. Isto ocorre em parte porque, para ele, que tem formação em química e fala a partir da posição do cientista, a ligação entre o descrito e o equacionado realmente é direta. Eles não percebem que para o estudante, que está sendo iniciado nos conhecimentos químicos, essa relação não é transparente, direta (FLÔR e CASSIANI, 2016, p. 372).
Gilbert e Cheng (2009) interpretam a dificuldade dos estudantes na compreensão simbólica vinculando a temática a outros aspectos da química, visto que o conhecimento simbólico não se encontra de maneira isolada, assim como os conhecimentos científicos, e as ciências também não o são. Para os autores, os significados são atribuídos aos símbolos e também às representações se os estudantes forem capazes de integrar os conhecimentos simbólicos aos outros aspectos do conhecimento químico (macro e molecular), que também são representados pela simbologia, como a representação dos estados físicos na questão em análise da presente pesquisa.
Apesar das explicações não darem subsídios para afirmar que a concepção dos estudantes seja de que o estado físico é permitido com a participação de uma única molécula, ou que esta assume uma “forma”, dependendo do estado em que se encontra, a representação dos alunos a partir das respostas do item b indica que essa pode ser a concepção assumida por alguns deles (figuras 7 e 8):
Figura 6 – Exemplo de explicação da H2O(s)
Figura 4 – Exemplo de explicação da H2O(g)
Figura 3 – Exemplo de explicação da H2O(s)
50 REnCiMa, v. 9, n.4, p. 38-57, 2018 Dessa forma, pode-se perceber que nas figuras 7 e 8 o estado físico influência no arranjo da molécula, e nas figuras 9 e 10 o estado físico foi representado por uma única molécula, não havendo diferenciação. Estas representações, no que se refere ao esperado para estes estudantes, refletem a convergência encontrada entre os ensinamentos escolares e o que de fato se compreende sobre determinado conceito, aqui caracterizados pelos símbolos discutidos. Assim, é possível que os estudantes encontrem dificuldades em transpor para outros modos de representação, usando as esferas, por exemplo, a simbologia e suas concepções sobre as situações apresentadas.
Gilbert e Cheng (2009) defendem que a incompreensão dos conceitos químicos pode ser atribuída à dificuldade em transitar em diferentes modos de representação, que dependem da demonstração da compreensão da “convenção” para diferentes níveis e dimensionalidade; da capacidade de transitar entres diferentes níveis e modos de representação e da capacidade de construir uma representação dentro de qualquer nível e dimensionalidade para um determinado propósito (GILBERT e CHENG, 2009, p. 59).
Esse tipo de representação consiste em uma importante ferramenta para entender o que os alunos compreendem sobre a simbologia, além do fenômeno em questão, pois indicam seus modelos explicativos e conceituais, ou seja, os aspectos moleculares. Assim, outra representação bem presente nesta pesquisa, para a molécula de água, em seus estados físicos distintos, indica o distanciamento dos átomos nesta molécula (figuras 11, 12, 13 e 14).
Nesse sentido, os estudantes possivelmente assumem a ideia de uma menor Figura 8 – Exemplo de representação
da H2O(s) e H2O(g)
Figura 7- Exemplo de representação da H2O(s) e H2O(g)
Figura 9 – Exemplo de representação da H2O(s) e H2O(g)
Figura 10 – Exemplo de representação da H2O(s) e H2O(g)
Figura 11 – Exemplo de representação da H2O(s) e H2O(g)
Figura 14 – Exemplo de representação da H2O(s) e H2O(g)
Figura 13 – Exemplo de representação da H2O(s) e H2O(g)
Figura 12 – Exemplo de representação da H2O(s) e H2O(g)
51 REnCiMa, v. 9, n.4, p. 38-57, 2018 interação no estado gasoso e maior no estado sólido, no entanto, admite-se a aproximação ou não dos átomos que compõem a molécula de água e não das moléculas em si. Apreciando, então, todas as representações, poucas puderam ser avaliadas em aceitas cientificamente, já que existia a necessidade de retratar a situação presente nos símbolos. As consideradas mais adequadas são exemplificadas pelas figuras 15 e 16.
Considerando a importância da representação, Barke e Engida (2001) investigaram a “habilidade espacial” de cerca de 1500 estudantes alemães e etíopes, de 13 a 20 anos, sobre o nível de compreensão desses estudantes no que diz respeito ao arranjo espacial de objetos e também de átomos e moléculas. Os pesquisadores concluíram que, embora questões culturais possam ter alguma influência no entendimento do arranjo espacial de compostos químicos, as dificuldades apresentadas pelos alunos etíopes e por parte dos alunos alemães, aqueles matriculados em colégio públicos, são basicamente as mesmas. Já a outra parte dos alunos alemães, matriculados em colégios particulares, apresentaram menos dificuldade que os demais. Segundo os autores, a causa mais provável da diferença na habilidade espacial dos estudantes é o currículo da escola.
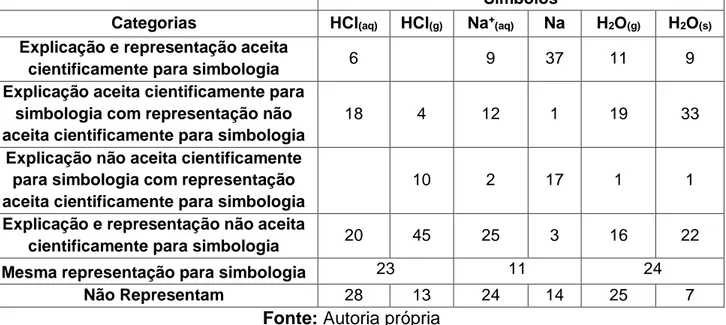
Nesse sentido, é fundamental que a escola e os professores fomentem atividades que propiciem o desenvolvimento da visão espacial dos alunos de forma que eles sejam capazes de transitar entre os aspectos do conhecimento químico. Com base nos resultados obtidos, é preciso refletir sobre diferentes formas em que se pode auxiliar o aluno a compreender o significado dos símbolos que lhes são apresentados, pois, muitas vezes, para o professor, a relação é trivial, por exemplo, quando se explica o distanciamento das partículas nos diferentes estados físicos. Dessa forma, resumimos as informações sobre as representações e explicações dos símbolos no quadro 3.
Por meio da análise das respostas apresentadas pelos estudantes, é possível notar que a maioria dos alunos reconhece a simbologia da água em seus estados físicos, sendo 47 para H2O(s) e 46 para H2O(g) como já indicado no quadro 2. No entanto, a representação correta para estes símbolos fica em 9 para H2O(s) e 11 para H2O(g), tornando-se perceptível a dificuldade dos estudantes em simular, ou ainda, demonstrar suas concepções diversas sobre os símbolos apresentados. Esta informação torna-se evidente quando analisamos o número de estudantes que apresentam explicações aceitas cientificamente, e representações não aceitas cientificamente (33 estudantes).
Ainda que parte dos estudantes tenha conseguido fazer a “leitura” dos símbolos, pode-se concluir que eles pouco puderam interiorizar, durante seus processos de escolarização, o significado atribuído aos símbolos químicos e, provavelmente, pouco puderam refletir sobre seus modelos “interiores”. Assim, para água, a maioria dos alunos consegue relacionar o símbolo com seu aspecto macro, pela própria abundância e relevância dessa substância em nosso cotidiano, porém, o aspecto molecular, que julgamos ser indicados por meio das representações, não é compreendido pela maioria
Figura 15 – Exemplo de representação da H2O(s) e H2O(g)
Figura 16 – Exemplo de representação da H2O(s) e H2O(g)
52 REnCiMa, v. 9, n.4, p. 38-57, 2018 dos alunos pesquisados.
Quadro 3 – Número de alunos que apresentaram explicação e representação aceita e não aceita cientificamente para os símbolos
Símbolos H2O(s) H2O(g) Na Na+ (aq) HCl(g) HCl(aq) Categorias 9 11 37 9 6 Explicação e representação aceita
cientificamente para simbologia
33 19 1 12 4 18
Explicação aceita cientificamente para simbologia com representação não aceita cientificamente para simbologia
1 1
17 2
10 Explicação não aceita cientificamente
para simbologia com representação aceita cientificamente para simbologia
22 16 3 25 45 20
Explicação e representação não aceita cientificamente para simbologia
24 11
23 Mesma representação para simbologia
7 25 14 24 13 28 Não Representam
Fonte: Autoria própria
Taber (2009) discute a questão da vasta simbologia usada em química, e que ela pode ser um grande facilitador para os mais habituados a ela, pois se integra aos conhecimentos conceituais. No entanto, segundo o autor, “tais representações podem trazer demandas adicionais consideráveis para os alunos já desafiados tanto pela natureza abstrata dos conceitos como pela variedade de substâncias a que esses conceitos são aplicados no currículo” (TABER, 2009, p. 75, tradução nossa).
Assim, no que se referem às outras substâncias questionadas, os estudantes tiveram dificuldades ainda maiores para explicar a simbologia. Para o Na+(aq), 33 alunos apresentaram respostas com elementos não aceitos cientificamente para leitura e representação do símbolo, assim como exemplificado nas figuras 17, 18 ,19, 20, 21 e 22:
As explicações apontadas representam as grandes dificuldades que os estudantes apresentaram para a explicação da simbologia do Na+(aq), utilizando-se de informações e termos que não se enquadram nas situações, como a perda de um átomo. Estas mesmas informações gerais foram apresentadas para a água. Já as representações também demonstram os problemas no entendimento da simbologia. Para o Na e Na+(aq), tivemos 11 estudantes que representaram a simbologia igualmente, o que expressa a pouca significação do símbolo que representa a carga elétrica.
Figura 17 – Exemplo de explicação do Na+
(aq) Figura 18 – Exemplo de explicação do Na+(aq)
Figura 22 – Exemplo de representação do Na Figura 19 – Exemplo de representação do Na+ (aq) Figura 21 – Exemplo de representação do Na Figura 20 – Exemplo de representação do Na e Na+ (aq)
53 REnCiMa, v. 9, n.4, p. 38-57, 2018 Para o sódio, as representações não aceitas cientificamente foram poucas, já que as ponderamos com uma esfera o modelo correto. Mesmo assim, consideramos relevante demonstrar algumas representações, e nelas é possível compreender que alguns estudantes não sabem diferenciar quando uma substância é constituída de um único elemento ou mais (figuras 19, 21 e 22).
Já para o HCl(g) e HCl(aq) o número de explicações aceitas cientificamente ficou em 4 e 32 respectivamente. Por muitas vezes, durante a aplicação da questão e na análise das respostas, foi possível perceber que os alunos não conseguiam compreender por que era pedido para explicar ou representar os símbolos, por exemplo, do HCl(g) e HCl(aq), já que os dois pareciam representar a mesma substância, ou seja, os dois foram considerados em sua maioria como “ácido clorídrico”, gasoso ou aquoso. Encontramos, então, para estes símbolos, as maiores dificuldades nas explicações dos estudantes, sendo isto representado pelas figuras 23 e 24:
Já para as representações destes símbolos encontramos dificuldades bem similares às encontradas para a água:
Pela figura 25, é possível perceber que o aluno tenta esboçar seu entendimento sobre os estados físicos da matéria. Mesmo assim, compreende que a maior ou menor proximidade presente nos diversos estados (interpretando, aquoso como estado) se dá pela aproximação dos átomos. Também verificamos 23 respostas com as mesmas representações para os dois símbolos. Em alguns casos, o átomo de cloro foi “dividido” (figura 27), assim como o sódio.
Com base nas pesquisas realizadas sobre simbologia e também por intermédio das questões aqui levantadas, faz-se necessária a reflexão sobre as dificuldades encontradas no que diz respeito à integração dos símbolos com seus aspectos visuais (macro) e conceituais. Nesse sentido, Taber (2009, p.77) indica algumas das justificativas que ocasionam estas dificuldades, pois os estudantes não possuem: familiaridade com o simbolismo; compreensão teórica sólida dos princípios conceituais quando fazem uso das representações simbólicas e também um amplo repertório químico em que pudessem recorrer a exemplos e referenciais para representações simbólicas.
Pronuncia-se o fato dos alunos, como na percepção de Taber (2009), perderem-se quanto a “familiaridade com os símbolos”, mesmo que já tenham sido apresentados à tal, pois, para eles, as aulas de química podem ainda se resumir a apresentação de uma
Figura 25 – Exemplo de representação do HCl(g) e HCl(aq)
Figura 23 – Exemplo de explicação do HCl(g) e HCl(aq)
Figura 24 – Exemplo de explicação do HCl(g) e HCl(aq) Figura 27 – Exemplo de representação do HCl(g) e HCl(aq) Figura 26 – Exemplo de representação do HCl(g) e HCl(aq)
54 REnCiMa, v. 9, n.4, p. 38-57, 2018 série de “fórmulas”, nomenclaturas que possuem tempo certo para cair no esquecimento, o que se vincula aos outros dois pontos levantados pelo autor: como compreender química, ou seja, os aspectos conceituais, sem a compreensão e familiaridade com os símbolos? Ainda, como explicar os aspectos da experiência sensorial dos fenômenos químicos sem os modelos e representações? Não se trata de conferir à simbologia maior importância que os outros dois aspectos, mas de sugerir que os três possuam a mesma relevância (JOHNSTONE, 2000) para que a eles sejam atribuídos significados.
Nesse sentido, não há dúvida que os três aspectos dos conhecimentos químicos sejam discutidos durante o processo de escolarização, pois, ao se abordar conceitos químicos, seja no nível básico como também no superior, são tratados fenômenos, teorias e símbolos. Entendemos que não só a abordagem dos aspectos seja relevante, mas que a sua integração seja de maior valia para a aprendizagem de conceitos químicos, assim como foi para a história da construção deles. Assim, a integração dos três aspectos discutida ainda é muito incipiente na educação em química, no que diz respeito à sua concepção, pois não se tem muito conhecimento sobre discussões desta natureza na educação básica, portanto, poucas são as percepções sobre a importância que deve ser conferida na relação desses três aspectos, que embora possam ser discutidos separadamente, são indissociáveis (JOHNSTONE, 2000).
Considerações finais
As explicações e representações dos estudantes podem ser reveladoras, já que podem indicar o tipo de ensino que eles vêm recebendo. Também são importantes porque exprimem suas concepções, seus modelos, mostrando, para nós educadores, as fragilidades e a complexidade do pensamento. No decorrer deste estudo, por muitas vezes os estudantes apresentaram explicações condizentes à simbologia, no entanto, tiveram grandes dificuldades em exprimir representações, modelos, o que indica que os símbolos foram significados de maneira intuitiva, mas não foram compreendidos.
Por se tratar de símbolos que representam espécies químicas que comumente aparecem em sala de aula, os alunos ingressantes na Universidade obviamente já haviam tido contato com os mesmos. O que chamou atenção é a dificuldade dos alunos em compreender o significado dos símbolos apresentados. Retomando os três aspectos do conhecimento químico, os alunos, de maneira geral, compreendem que os símbolos representam elementos químicos e que estes grafados lado a lado podem representar um composto químico. Porém, o arcabouço teórico que embasa o significado da representação apresentada está diretamente relacionado com os outros dois aspectos já citados, o macroscópico e o molecular, e, não apenas no símbolo por ele próprio, como muitas vezes acaba transparecendo. Assim, neste processo de ensino e aprendizagem, é importante o acesso a atividades que promovam a apropriação progressiva das ações, logo os alunos poderão transformar seus objetos, experimentos e símbolos em representação. Desta forma, com as operações interiorizadas, os alunos poderão mobilizar seus pensamentos, aplicar conhecimentos em situações cotidianas, de acordo com as particularidades de cada situação, sem prender-se a uma única forma de pensar.
55 REnCiMa, v. 9, n.4, p. 38-57, 2018 Referências
ANDRADE NETO, A, S, A,. RAUPP, D., MOREIRA, M. A.; A evolução histórica da linguagem representacional: uma interpretação baseada na teoria dos campos conceituais. Em:VIII Encontro Nacional de Pesquisa em Educação em Ciências, 2009. Anais do VIII Encontro Nacional de Pesquisa em Educação em Ciências. Florianópolis: Universidade Federal de Santa Catarina, 2009.
ARAÚJO NETO, W. N. Formas de uso da representação estrutural no ensino superior de química. 2009. Tese de Doutorado - Universidade de São Paulo, Faculdade de Educação, São Paulo, 2009.
BARKE, H. D.; ENGIDA, T. Structural Chemistry and Spatial Ability in Different Cultures. Chemistry Education: Research and Practice in Europe, v.2 ,n. 3, p. 227-239, 2001. BERZELIUS, J. J. Essay on the cause of chemical porportion, and on some circuntaces related to them: together with a short and easy Method of expressin them. Annals of Philosophy. v. 3, p. 51 - 62, 1814.
BERZELIUS, J. J. Essai sur la Théorie des Proportions Chimiques et sur l´Influence chimique de l´Életrecité. Paris, Mequignon-Mervis, p. 120, 1819.
BRITO, M. S.; DAMASCENO, H. C.; WARTHA, E. J. As representações mentais e a simbologia química. Em: XIV Encontro Nacional de Ensino de Química, 2008, Curitiba. Anais do Encontro Nacional de Ensino de Química. Curitiba: Universidade Federal do Paraná, 2008.
CHENG, M.; GILBERT, J. K. Towards a Better Utilization of Diagrams in Research into the Use of Representative Levels in Chemical Education. Em: GILBERT, J. K.; TREAGUST, D. (Org.). Models and Modeling in Science Educations: Multiple Representations in Chemical Education. New York: Ed. Springer, p, 379, 2009.
CONNELY, N. G.; DAMHUS, T.; HARTSHORN, R. M.; HUTTON, A. T. Nomenclature of inorganic chemistry – IUPAC recommendations 2005. Cambridge, Royal Society of Chemistry, p. 377, 2005.
CONTRERAS, S.; GONZÁLEZ, A. La selección de contenidos conceptuales en los programas de estudio de Química y Ciencias Naturales chilenos: análisis de los niveles macroscópico, microscópico y simbólico. Educación Química, v.25, n. 2, p.97-103, 2014. EICHLER, M. Os modelos abstratos na apreensão da realidade química. Educación Química, v.12, n.3, p. 61 – 71, 2001.
FLÔR, C. C.; CASSIANI, S. Qual Química ensinar? Reflexões a respeito da educação Química e formação de leitores em aulas de Química no Ensino Médio. Revista Reflexão e Ação, v. 24, n. 1, p. 366-381, 2016.
GILBERT, J. K.; TREAGUST, D. Macro, Submicro and Symbolic Representations and the Relationship Between Them: Key Models in Chemical Education. Em: GILBERT, J. K.; TREAGUST, D. (Org.). Models and Modeling in Science Educations: Multiple Representations in Chemical Education.New York: Ed. Springer, p. 379, 2009.
56 REnCiMa, v. 9, n.4, p. 38-57, 2018 Acta Chimica Slovenica, v.49, p. 43-53. 2002.
GONZALEZ, I. M.; SILVA, J. L. P. B. As fórmulas químicas literais de Berzelius e a composição dos materiais: uma função sígnica nas aulas de química. Em: IX Encontro Nacional de Pesquisa em Educação em Ciências, 2013, Águas de Lindóia. Anais do Encontro Nacional de Pesquisa em Educação em Ciências. Águas de Lindóia: ABRAPEC, 2013.
GONZALEZ, I. M. Composição Química: estudos semióticos e psicológicos.2016. . Tese de Doutorado - Universidade Federal da Bahia, Instituto de Física, Salvador, 2016. GRESCZYSCZYN, M. C. O. Múltiplas representações para o Ensino de Química Orgânica: Uso do Infográfico como meio de busca de aplicativos. 2017. Dissertação de Mestrado - Universidade Tecnológica Federal do Paraná de Brasília, Programa de Pós-Graduação em Ensino de Ciências Humanas, Sociais e da Natureza, Londrina, 2017 HERRON, J. D. Piaget for Chemists: Explaining what good students cannot understand. Journal of Chemical Education, v. 52, n. 3, p. 146 – 150, 1975.
IUPAC, Color Books. Disponível em <https://iupac.org/what-we-do/books/color-books/> Acesso em: 20 Ago. 2018.
JACOB, C. Analysis and Synthesis: Interdependent Operations in Chemical Language and Practice. International Journal for Philosophy of Chemistry, v. 7 , n. 1, p. 31-50, 2001. JOHNSTONE, A. H. Macro and micro-chemistry. The School Science Review, v. 64, 377–379, 1982.
JOHNSTONE, A. H. Why is science difficult to learn? Things are seldom what they seem. Journal of Computer Assisted Learning, v. 7, n. 2, p. 75-83, 1991.
JOHNSTONE, A. H. Theaching of Chemistry - Logical or Psychological? Chemistry Education: Research and Practice in Europe, v. 1, n 1, p. 9-15, 2000.
JOHNSTONE, A. H. You can't get there from here. Journal of Chemical Education, v. 87 n. 1, p. 22-29, 2010.
KEIG, P. F.; RUBBA, P. A. Translation of representations of the structure of matter and its relationship to reasoning, gender, spatial reasoning, and specific prior knowledge. Journal of Research in Science Teaching, v. 30, n, 8, p. 883-903, 1993.
KEKULÉ, A. Lehrbuch der Organischen Chemie. Erlangen, verlag von Ferdinad Enke, p. 766, 1861.
KIOURANIS, N. M. M.; BATISTON, W. P.; SILVA, C. F. N. Compreensão da linguagem química simbólica por alunos de ensino médio. Em: XVI Encontro Nacional de Ensino de Química, 2012. Anais do XVI Encontro Nacional de Ensino de Química. Salvador: Universidade Federal da Bahia, 2012.
LABARCA, M. Acerca del triangulo de Johnstone: algunos comentarios filosóficos. Em: 1ª Conferência Latino-americana do International History, Philosophy and Science Teaching Group, 2010. Anais da 1ª Conferência Latino-americana do International History, Philosophy and Science Teaching Group, São Sebastião, Universidade Federal de São Carlos, 2010.
57 REnCiMa, v. 9, n.4, p. 38-57, 2018 MELO, M. S. A Transição entre os níveis – macroscópico, submicroscópico e representacional – uma proposta metodológica. 2015. Dissertação de Mestrado - Universidade de Brasília, Programa de Pós-Graduação em Ensino de Ciências da Universidade de Brasília, Brasília, 2015.
MORTIMER, E. F.; MACHADO, A. H.; ROMANELLI, L, I. A proposta curricular de química do estado de Minas Gerais: fundamentos e pressupostos. Química Nova, v. 23, n. 2, p. 273-283, 2000.
PAULETTI, F.;ROSA, M. P. A.; CATELLI, F. A importância da utilização de estratégias de ensino envolvendo os três níveis de representação da química. Revista Brasileira de Ensino de Ciência e Tecnologia, v.7, n. 3, p.121-134, 2014.
PHILIPP, S. B.; JOHNSON, D.K.; YEZIERSKI, E. J.Development of a protocol to evaluate the use of representations in secondary chemistry instruction. Chemistry Education Research and Practice, v. 15, p. 777 - 786, 2014.
POZO, J. I.; GÓMEZ CRESPO, M. A. A aprendizagem e o ensino de Ciências: do conhecimento cotidiano ao conhecimento científico. 5. ed. Porto Alegre: Artmed, 2009 RICHARDSON, G. M. Foundations of Stereo Chemistry. New York, American Book Company, p. 135, 1901.
SANTOS, V. C.; ARROIO. A. The representational levels: Influences and contributions to research in chemical education. Journal of Turkish Science Education, v. 3, n. 1, p. 3-18, 2016
SOUZA, K. A. F. D. Estratégias de comunicação em química como índices epistemológicos: análise semiótica das ilustrações presentes em livros didáticos ao longo do século XX. 2012. Tese de Doutorado - Universidade de São Paulo, Instituto de Química, São Paulo, 2012.
TABER, K. S. Learning at the Symbolic Level. In: GILBERT, J. K.; TREAGUST, D. (Org.). Models and Modeling in Science Educations: Multiple Representations in Chemical Education. New York: Ed. Springer, p. 379, 2009.
TASKIN, V; BERNHOLT, S. Students’ understanding of chemical formulae:a review of empirical research. International Journal of Science Education,v.36,n.1, p.157–185, 2014.
VAN’T HOFF, J. H. Sur Les Formules de Structure dans L’espace. Archives néerlandaises des sciences exactes et naturelles, v 9, p. 445 - 454, 1874.
VILARDO, D. A.; MACKENZIE A. H.; YEZIERSKI, E. J. Using Students’ Conceptions of Air To Evaluate a Guided-Inquiry Activity Classifying Matter Using Particulate Models. Journal of Chemical Education. v. 94, n.2 p. 206 - 210, 2017.
YARROCH, W. L. Student understanding of chemical equation balancing. Journal of Research in Science Teaching, v. 22, n. 5, p. 449-459, 1985.
Submissão: 03/07/2017