UNIVERSIDADE FEDERAL DE UBERLÂNDIA
INSTITUTO DE CIÊNCIAS EXATAS E NATURAIS DO PONTAL CURSO DE CIÊNCIAS BIOLÓGICAS
Revisão bibliográfica sobre os aspectos funcionais, estruturais e aplicações terapêuticas de diferentes fosfolipases A2 isoladas da peçonha de Bothrops pauloensis
Lívia Maria Gomes Araújo
Trabalho de Conclusão de Curso apresentado à
Coordenação do Curso de Ciências Biológicas
da Universidade Federal de Uberlândia, para
obtenção do grau de Bacharel em Ciências
Biológicas.
UNIVERSIDADE FEDERAL DE UBERLÂNDIA
INSTITUTO DE CIÊNCIAS EXATAS E NATURAIS DO PONTAL CURSO DE CIÊNCIAS BIOLÓGICAS
Revisão bibliográfica sobre os aspectos funcionais, estruturais e aplicações terapêuticas de diferentes fosfolipases A2 isoladas da peçonha de Bothrops pauloensis
Lívia Maria Gomes Araújo
Drª. Veridiana de Melo Rodrigues Ávila
Trabalho de Conclusão de Curso apresentado à
Coordenação do Curso de Ciências Biológicas
da Universidade Federal de Uberlândia, para
obtenção do grau de Bacharel em Ciências
Biológicas.
AGRADECIMENTOS
Aos meus pais, madrinha e avós por estarem ao meu lado e sempre acreditarem em mim.
À minha amiga/irmã Bruna por nunca ter desistido de mim e estar do meu lado nos bons e maus momentos desde a nossa infância.
Sou grata também aos amigos que fiz ao longo da minha trajetória durante a graduação e que fizeram da universidade um lugar melhor.
Às pessoas que direta ou indiretamente me ajudaram e apoiaram, e aos demais amigos e familiares não citados, que se fizeram presentes e me incentivaram mesmo estando distantes.
À minha orientadora, Drª. Veridiana de Melo Rodrigues Ávila, pelos conhecimentos transmitidos, acolhimento e paciência.
RESUMO
As fosfolipases A2 (PLA2s E.C. 3.1.1.4) são objeto de pesquisas devido à sua relação com doenças inflamatórias em humanos e acidentes por animais peçonhentos. Estas são enzimas que exibem uma relevante função no metabolismo da conformação lipídica da membrana celular e estão implicadas em variados processos como a homeostase de membranas, a aquisição de nutrientes e a geração de moléculas bioativas. As toxinas de serpentes estão sendo exploradas como modelos promissores a serem utilizados na criação de novos medicamentos. Diversos estudos já abordaram sobre suas ações farmacológicas e aplicabilidade no tratamento de patologias, demonstrando êxito. Neste trabalho foi realizada uma revisão de literatura tendo como fontes de pesquisa artigos internacionais na base de dados PubMed tendo como critério de inclusão, artigos publicados relacionados principalmente às diferentes PLA2s isoladas da peçonha de Bothrops pauloensis (uma espécie de serpente da família Viperidae, abundante na Bolívia, no Paraguai e na região central do Brasil, conhecida popularmente como jararaca-pintada) até o presente momento, enfatizando suas caracterizações estruturais e funcionais, além de seu potencial terapêutico em atividades antitumorais, antiplaquetárias, antiangiogênicas, hipotensivas, antiparasitárias e microbicidas.
SUMÁRIO
1. INTRODUÇÃO...6
1.1 Fosfolipases: classes e atividades catalíticas...6
1.2 Fosfolipases de peçonhas de serpentes...13
2. OBJETIVOS...16
2.1 Objetivos específicos...16
3. MATERIAL E MÉTODOS...16
4. RESULTADOS E DISCUSSÃO...17
4.1. Obtenção das PLA2s da peçonha de Bothrops pauloensis...17
4.2. Características bioquímicas e estruturais das PLA2s isoladas de Bothrops pauloensis...20
4.3. Características funcionais e potencial terapêutico das PLA2s da peçonha de Bothrops pauloensis...23
5. CONCLUSÃO...29
6. REFERÊNCIAS...30
6 1. INTRODUÇÃO
1.1 Fosfolipases: classes e atividades catalíticas
As fosfolipases (PLs) são enzimas que participam no metabolismo de fosfolipídeos, os quais são componentes essenciais das membranas celulares e participam de sua estrutura e funcionamento. Estas enzimas estão presentes em quase todos os animais, plantas e bactérias (NIEWERTH e KORTING, 2001) e estão envolvidas em processos diversificados como: a homeostase de membranas, a aquisição de nutrientes e a geração de moléculas bioativas (KÖHLER et al, 2006). Elas hidrolisam predominantemente glicerofosfolipídeos, entretanto também podem realizar a degradação de lipídios neutros (KÖHLER et al, 2006); entre os fosfolipídios naturais, a fosfatidilcolina ou lecitina é o substrato mais comum de PLs cataliticamente ativas. Um fosfolipídio contém quatro porções ésteres, e todas elas são propensas à hidrólise enzimática de fosfolipases (DENNIS, 1983).
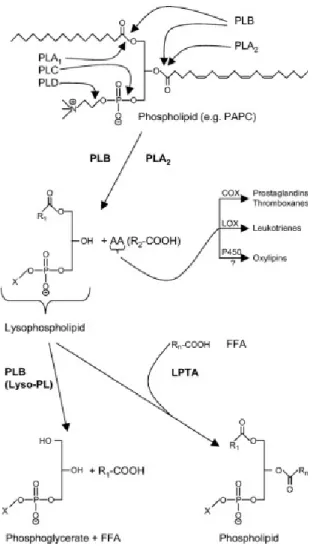
A classificação das mesmas é realizada de acordo com a posição em que hidrolisam o substrato, sendo distribuídas em fosfolipases A, B, C ou D (Figura 1) (KÖHLER et al, 2006; NIEWERTH e KORTING, 2001).
7 A PLA1 é uma enzima que hidrolisa a posição sn-1 as ligações ésteres dos fosfolipídeos, tendo como produto lisofosfolipídeos e ácidos graxos (INOUE; ARAI; AOKI, 2005). Em mamíferos foram descritos dois tipos de PLA1s com sequências distintas de aminoácidos, classificadas em intra e extracelular. O tipo I extracelular é composto por PLA1
Figura 1. Sítios de hidrólise das PLs (A, B, C, D) e posições das atividades hidrolíticas de
cada tipo de fosfolipase em um fosfolipídio (PAPC). As enzimas PLA2 ou PLB
formam lisofosfolipídeos cujo ácido graxo esterificado restante pode ser removido
por PLBs ou outras lisofosfolipases. A atividade de lisofosfolipase/transacilase (LPTA)
encontrada em PLBs pode esterificar um ácido graxo livre (FFA) a
um lisofosfolipídeo gerando um fosfolipídeo. O ácido araquidônico (AA) na posição sn-2 da
PAPC pode ser mobilizado pelas enzimas PLA2 ou PLB e funcionar como um precursor para
os eicosanóides que são gerados pelas atividades enzimáticas indicadas (KÖHLER et al.,
8 específica de fosfatidilserina (PS-PLA1), forma curta de fosfolipase A1 específica de fosfatidilserina (PS-PLA1∆C), fosfolipase seletiva de ácido fosfatídico associada à membrana A1α (mPA-PLA1α), e fosfolipase A1β seletiva de ácido fosfatídico associada à membrana (mPA-PLA1β), enquanto o tipo II intracelular é constituída por ácido fosfatídico que prefere a fosfolipase A1 (PA-PLA1), proteína KIAA0725 e p125 (INOUE; ARAI; AOKI, 2005).
Nas plantas, as PLAs são classificadas por analogia da sequência e funções biológicas, nas classes: PLA1 hidrolisante de PC (PC-PLA1), PLA1 específica de PA (PA-PLA1), PLA2 secretada de baixo peso molecular (sPLA2) e PLA como patatina (pPLA) (WANG et al., 2012).
A PLA2 foi a primeira fosfolipase a ser identificada; sua descoberta fundamentou-se na análise da hidrólise de fosfatidilcolina pelo suco pancreático e pela peçonha de serpente (WITTCOFF, 1951). As PLA2s compõem uma família de enzimas que clivam glicerofosfolipídeos, rompendo a membrana através da hidrólise dependente de Ca2+ na ligação éster sn-2, criando lisofosfolipídeos e liberando ácidos graxos; fundamentais em numerosos processos biológicos, incluindo a geração de mediadores lipídicos pró-inflamatórios, tais como prostaglandinas e leucotrienos, e a regulação do metabolismo lipídico (GLASER, 1995; SANTOS et al., 2010; KUDO; MURAKAMI, 2002;).
9 As cPLA2 hidrolisam principalmente glicerofosfolipídeos com ácido araquidônico na posição sn-2, seu sítio catalítico apresenta resíduos de serina e aspartato, possuem ação catalítica dependente de Ca2+ e sua massa molecular pode variar entre 61 a 114 kDa (BURKE; DENNIS, 2008b). O grupo teve seu isolamento, determinação sequencial e clonagem executados com base na linhagem de células U973, e pode ser encontrado em diversas células como eritrócitos, macrófagos e células do rim (CLARK; MILONA; KNOPF, 1990; CLARK et al., 1991; KRAMER et al., 1996; SHARP et al., 1991).
As LPLA2s foram isoladas a partir de cérebro bovino e esterificam um grupo acil com um grupo hidroxil na posição C-1 de ceramidas, onde os fosfolipídeos atuam funcionalmente como doadores de radicais acil (ABE e SHAYAMAN, 1998). São assim chamadas por estarem localizadas próximo à β-hexosaminidase (HIRAOKA; ABE; SHAYMAN, 2002). Estas enzimas apresentam uma tríade conservada dos resíduos de serina, histidina e aspartato e quatro resíduos de cisteína, que são fundamentais para a catálise (BURKE; DENNIS, 2008b).
10 As Acetil-hidrolases de fatores ativadores de plaquetas (PAF-AH) realizam a hidrólise de grupos acetil da posição sn-2 de fatores ativadores de plaquetas (SCHALOSKE; DENIS, 2006), e podem ser encontradas com abundância em mamíferos, em locais como sistema nervoso central e em eritrócitos (BURKE; DENNIS, 2008b). As PLA2 tecido adiposo específicas (AdPLA2) são expressas no tecido adiposo e catalisam a amplificação de ácidos graxos livres e lisofosfolipídeos a partir da fosfatidilcolina, realizando a hidrólise preferencialmente na posição sn-2 de fosfolipídeos, cuja atividade no metabolismo adipogênico é relevante para o mesmo (DUNCAN et al., 2008).
As PLA2s secretadas (sPLA2) são as mais bem caracterizadas do grupo e estão envolvidas em uma variedade de atividades biológicas como digestão, inflamação, geração de mediadores de lipídeos, multiplicação celular, exocitose, ação microbicida, entre outras. Em conformidade com a quantidade de resíduos de aminoácidos e posição das ligações dissulfeto, elas são distribuídas em diferentes grupos como: IA, IB, IIA, IIB, IIC, IID, IIE, IIF, III, V, IX, X, XIA, XIB, XIIA, XIIB, XIII e XIV (BURKE; DENNIS, 2008a; DENNIS et al., 2011). A maioria desses grupos de enzimas apresentam ativação interfacial (BURKE; DENNIS, 2008a).
As fosfolipases A2 secretadas são definidas pela sua baixa massa molecular variando de 13 a 18 kDa, presença de histidina no sítio ativo, requerem Ca2+ para catálise, a presença de seis ligações dissulfeto conservadas, e manifestação de uma ou duas pontes dissulfeto adicionais variáveis (SCHALOSKE; DENNIS, 2006; SIX; DENNIS, 2000). Essas enzimas são estocadas em grânulos citoplasmáticos, e são secretadas para o meio extracelular quando ocorre a estimulação (AKIBA; SATO, 2004).
11
Elapidae e Hydrophiidae, enquanto as do grupo IIA, famílias Crotalidae e Viperidae (WARD et al., 2001).
Dentre as subdivisões do grupo IIA, as principais são PLA2s Asp49, que são enzimas cataliticamente ativas, apresentando um resíduo de aspartato na posição 49, e PLA2s Lys49, cataliticamente inativas ou com pouca atividade, cujo resíduo da posição 49 é substituído por uma lisina (GUTIÉRREZ e LOMONTE, 1997; OWNBY et al., 1999; SOARES; FONTES; GIGLIO, 2004). As PLA2s Asp 49 ainda podem ter caráter básico ou ácido, com pontos isoelétricos entre 7,0 e 10,0 (DAMICO et al., 2005; CALGAROTTO et al., 2008; VINDAS et al., 2018), ou 4,0 a 6,0 (FULY et al., 2002; MODESTO et al., 2006; SOBRINHO et al., 2018), respectivamente. As distinções das propriedades enzimáticas proteicas das sPLA2s pertencentes ao grupo II são definidas principalmente pelo resíduo localizado na posição 49 (RODRIGUES, 2006). O arranjo das cadeias laterais de ácido graxo propõe uma via de acesso comum do substrato, desde sua posição no agregado lipídico até sua interação com o sítio ativo no mecanismo de ação. A ligação ótima e a catálise na interface lipídio-água ocorrem devido à difusão facilitada do substrato da superfície de ligação interfacial ao sítio catalítico que possui em sua forma ativa um íon cálcio, que é coordenado pela carboxila da cadeia lateral de um resíduo de Asp na posição 49, mais duas moléculas de água estrutural, além dos átomos de oxigênio do carboxilato dos resíduos de aminoácidos presentes nas posições 28 e 30 e 32 (SCOTT et al., 1990). A substituição do aspartato de aminoácido por uma lisina provoca a perda da atividade enzimática destas PLA2s por não interagirem com o cálcio do sítio ativo, (LOMONTE; ANGULO; SANTAMARÍA, 2003), porém, as Lys49-PLA2s podem perturbar a integridade das membranas e induzir efeitos farmacológicos (DÍAZ et al., 1991; RUFINI et al., 1992; LOMONTE; ANGULO; SANTAMARÍA, 2003; LOMONTE; RANGEL, 2012).
12 facilitar a lise celular e liberação de lipídeos como segundos mensageiros através de uma hidrólise dos fosfolipídeos, onde quando fagocitada, essa enzima leva a ruptura do fagolisossomo (KRONSTAD et al., 2011; ALMEIDA et al., 2015). É descrita para essas enzimas atividade tipo fosfolipase transacilase em fungos (CHEN et al., 2000), sendo consideradas fatores de virulência para organismos patogênicos (SHEN et al., 2004). Logo, estas enzimas apresentam três tipos de atividades enzimáticas, mas ainda não se sabe qual a mais importante para sua ação patogênica (GANENDREN et al., 2006). Além de ser encontrada nos fungos, as fosfolipases B também já foram descritas em uma variedade de peçonhas de serpentes e peçonha de abelha (DOERY e PEARSON, 1964), e em tecidos de mamíferos (NOGUCHI, 1944; SHAPIRO, 1953; DAWSON, 1956; MARPLES e THOMPSON, 1960). E através de estudos realizados por Contardi e Ercoli (1933) com o farelo de arroz, esses pesquisadores reconheceram a PLB como uma enzima específica que não agia sobre a lecitina até que um ácido graxo fosse removido pela fosfolipase A.
13 Finalmente, as fosfolipases D (PLDs) são enzimas capazes de liberarem a colina da fosfatidilcolina para catalisar a formação do ácido fosfatídico, aumentando a composição lipídica ácida da membrana celular (NIEWERTH e KORTING, 2001; SELVY et al., 2011). Essas enzimas pertencem ao grupo das fosfolipases ubíquas na natureza e são encontradas em uma ampla diversidade de organismos, desde vírus, bactérias, leveduras, plantas e animais (JENKINS e FROHMAN, 2005). Em mamíferos, duas isoformas de PLD, PLD1 e PLD2, estão localizadas na membrana plasmática e em membranas intracelulares, incluindo a do retículo endoplasmático (FREYBERG et al., 2001; FREYBERG; BOURGOIN; SHIELDS, 2002), na maioria dos tipos celulares desses animais a atividade enzimática é relatada, com exceção de leucócitos e algumas linhagens de linfócitos (JENKINS e FROHMAN, 2005). Ambas as isoformas de PLD desempenham funções cruciais na regulação de processos celulares como autofagia e apoptose, apresentando potencial para utilização na terapia do câncer (NAKAGAWA et al., 2017).
1.2. Fosfolipases de peçonhas de serpentes
14 neuromusculares, doenças sanguíneas e cardiovasculares, infecções e doenças inflamatórias (VONK et al.,2011; CALDERON et al., 2014; PAL et al., 2002).
As PLA2s são proteínas bastante abundantes na peçonha das serpentes da família
Viperidae (ZOUARI-KESSENTINI et al., 2013), e já demonstraram uma variedade de atividades, incluindo neurotoxicidade, miotoxicidade, atividade hemolítica, antibacteriana, anticoagulante e antiplaquetária; algumas PLA2s de peçonhas já foram descritas com atividades antitumorais e antiangiogênicas por mecanismos independentes de sua atividade enzimática (ZOUARI-KESSENTINI et al., 2013; LOMONTE et al., 2010; AZEVEDO, et al., 2016). Em uma única peçonha pode haver várias classes de PLA2, e estas isoenzimas podem diferir amplamente nas características físicas, químicas, enzimáticas e farmacológicas.
Desde a descoberta da espécie B. pauloensis houveram alterações em sua nomenclatura, que primariamente foi descrita por Amaral (1925) como Bothrops neuwiedi pauloensis, entretanto, revisões sistemáticas de SILVA (2004) consideraram B. n. Pauloensis
uma espécie distinta. Futuramente, Fenwick e colaboradores 2009 categorizaram o gênero Bothrops como Bothropoides, mas a taxonomia tradicional (Bothrops) permaneceu com base em dados morfológicos, ecológicos e moleculares (MACHADO; SILVA; SILVA, 2014; CARRASCO et al., 2012). De acordo com pesquisas realizadas por Rodrigues e colaboradores (2012), utilizando o transcriptoma da glândula e o proteoma da peçonha de B. pauloensis, há uma enorme variedade de compostos bioativos em sua composição, onde as metaloproteinases, PLA2s e potenciadores de bradicinina representam as principais classes de toxinas.
15 hemorragia, inflamação, necrose epidérmica, necrose muscular no local da picada, hemólise sistêmica, perturbações da coagulação e choque hipotensivo (NISHIOKA; SILVEIRA, 1992; GUTIÉRREZ; LOMONTE, 1995).
A implicação desses compostos em diversos processos fisiopatológicos levou a um avanço na busca por inibidores de origem natural ou artificial, para a neutralização das PLA2s, além de maior compreensão sobre seu mecanismo de ação. As toxinas encontradas em peçonhas podem ser identificadas e inibidas por anticorpos poli ou monoclonais, e outros agentes como produtos químicos e compostos animais e vegetais (BORGES et al., 2000; BORGES et al., 2001; STÁBELI et al., 2005). As serpentes e alguns mamíferos apresentam resistência a envenenamentos por peçonha de serpentes (OMORI-SATOH et al., 1972; OVADIA; KOCHVA, 1977), possuindo proteínas inibitórias da PLA2, no plasma sanguíneo para a proteção contra as toxinas e seus efeitos prejudiciais (FAURE, 2000; FORTES-DIAS, 2002). Esses inibidores isolados do plasma ou soro de serpentes são proteínas oligoméricas ácidas com massa molecular de 18 a 75 kDa, compostas por 3-6 subunidades de 20-50 kDa, unidas por ligações não covalentes (LIZANO; DOMONT; PERALES, 2003), e são classificados em tipos α, β e γ, devido a características estruturais (THWIN et al., 2002).
16 novas pesquisas nesta área que visam o entendimento do mecanismo de ação de tais proteínas presentes nas peçonhas animais, bem como estudos que buscam novos modelos farmacológicos de origem natural em benefício do tratamento e diagnóstico de diferentes patologias.
2. OBJETIVOS
O presente trabalho teve como objetivo a elaboração de uma revisão de literatura sobre os aspectos funcionais, estruturais e aplicações terapêuticas de diferentes PLA2s isoladas da peçonha de B. pauloensis.
2.1.1 Objetivos específicos
Realizar uma descrição dos principais aspectos relacionadas ao isolamento, a estrutura, função e potencial terapêutico das PLA2s BnSP6, BnSP7, BnpTX1, BnpTXII, BpPLA2 e BpPLA2TX1 isoladas da peçonha de B. pauloensis.
3. MATERIAL E MÉTODOS
A metodologia escolhida foi a de revisão de literatura, e os artigos científicos foram coletados em buscas em bases de dados como PubMed, além de teses de doutorado e dissertações de mestrado encontradas no acervo da biblioteca da Universidade Federal de Uberlândia. A elaboração deste estudo implicou em leitura da bibliografia e análise das informações obtidas que passaram a fazer parte da composição do trabalho.
17
4. RESULTADOS E DISCUSSÃO
4.1 Obtenção das PLA2s da peçonha de Bothrops pauloensis
Da peçonha de B. pauloensis foram isoladas até o momento quatro PLA2s básicas denominadas de BnSP-6 e BnSP-7 (RODRIGUES et al., 1998); BnpTX-I e BnpTX-II (RODRIGUES et al., 2004); e duas PLA2s ácidas denominadas de BpPLA2 (RODRIGUES et al., 2007) e BpPLA2TX1 (FERREIRA et al., 2011). Usualmente, todas as isoformas isoladas de B. pauloensis de caráter básico e ácido até o presente momento foram obtidas com a utilização de diferentes processos cromatográficos (Figura 2), e a homogeneidade das enzimas foi confirmada por eletroforese em géis de poliacrilamida e cromatografias de alta performance em fase reversa (HPLC-RP).
As PLA2s básicas apresentam um conteúdo maior de resíduos de aminoácidos básicos, possuindo pIs mais elevados facilitando assim a utilização de colunas cromatográficas trocadoras catiônicas como a CM-Sepharose para os processos iniciais de purificação. Estas enzimas ligam-se fortemente aos grupos aniônicos (carboxi-metil) dessas resinas cromatográficas, sendo posteriormente eluídas pelo aumento da força iônica do tampão eluente (SOARES et al., 1998; ANDRIÃO-ESCARSO et al., 2000; SOARES et al., 2001; SOARES; FONTES; GIGLIO, 2004).
18 gradiente convexo de concentração molar utilizando o tampão bicarbonato de amônio 0,05 M a 0,5 M pH 8,0. Estas PLA2s foram purificadas da peçonha bruta utilizando apenas uma etapa cromatográfica. As PLA2s básicas BnpTX-I e II foram também obtidas pelo mesmo processo descrito anteriormente utilizando a cromatografia em CM-Sepharose (RODRIGUES et al., 2004), porém necessitaram de mais duas etapas sequenciais de purificação em cromatografias de gel filtração (Sephadex G-50) e fase reversa (HPLC-RP).
Os procedimentos utilizados para o isolamento de PLA2s básicas frequentemente contêm uma etapa cromatográfica de troca catiônica, para separá-las dos componentes ácidos da peçonha, pois geralmente essas enzimas miotóxicas são os últimos componentes a serem eluídos a partir de colunas de permuta catiônica, utilizando gradientes de sal e pH neutro (GUTIÉRREZ; LOMONTE, 1995). Moura da Silva e colaboradores (1991) isolaram PLA2s de peçonhas de diferentes espécies de Bothrops utilizando um sistema FPLC por cromatografia de permuta catiônica. As amostras foram aplicadas à coluna mono S-HR S/5 equilibrada com tampão fosfato de sódio 50 mM, pH 6,0 e as proteínas ligadas à coluna foram eluídas com um gradiente linear de cloreto de sódio (0 a 1 M) no mesmo tampão. Wu e Tinker (1969) purificaram a PLA2 da peçonha de Crotalus atrox usando fracionamento com sulfato de amônio seguido por cromatografia em coluna Sephadex G-75.
Calgarotto e colaboradores (2008) isolaram a BmTX-I da peçonha de Bothrops moojeni com apenas um passo cromatográfico utilizando HPLC de fase reversa na coluna μ-Bondapak C-18. Kasturi e Gowda (1989) purificaram VRV PL-VIIIa, uma PLA2
19 As duas PLA2s ácidas isoladas da peçonha de B. pauloensis foram denominadas de BpPLA2 (RODRIGUES et al., 2006) e BpPLA2-TXI (FERREIRA, 2011).A BpPLA2 foi obtida após três passos cromatográficos em troca-iônica (CM-Sepharose), interação hidrofóbica (Phenyl-Sepharose) e fase reversa em coluna C18 (HPLC-RP). Já a BpPLA2-TXI foi isolada após o fracionamento da peçonha bruta de B. pauloensis em CM-Sepharose, sendo que o pico que apresentou atividade fosfolipásica A2 foi posteriormente aplicado a uma coluna de gel filtração em Sephacryl-S300 HR HiPrep 26/60, a qual resultou em sete novas frações proteicas, denominadas S1-S7. A fração S4, que exibiu alta atividade de PLA2, foi aplicada em uma coluna de troca aniônica Hi-Trap Q FF, resultando em dois picos, Q1 e Q2. A fração Q2 ativa foi aplicada em cromatografia líquida de alta eficiência de fase reversa (HPLC) C2-C18 μRPC, resultando na purificação da BpPLA2-TXI.
20 Posteriormente passou-se por DEAE-Sepharose, onde a maior atividade de PLA2 eluiu na fração D1. A subsequente separação por RP-HPLC desta fração eliminou a maioria dos contaminantes, e o restante foi removido por um passo final de fracionamento em CM-Sephadex a pH 5,0 (FERNÁNDEZ et al., 2010). Araújo, Radvanyi e Bon (1994) purificaram uma PLA2 ácida da peçonha de Bothrops lanceolatus utilizando a filtração em gel de Sephadex G-50 e cromatografia de troca iônica em CM-celulose. Saikia, Thakur e Mukherjee (2011) isolaram a RVVA-PLA2-I a partir da peçonha de Daboia russelli. Inicialmente foi utilizada a resina CM Sephadex C-50, depois as frações ativas foram fracionadas através de um trocador aniônico DEAE Sephadex A-50. Um dos picos resultantes (V) foi eluído e em seguida fracionado através de coluna de filtração em gel e separado em três frações. A fração GFI foi ainda purificada utilizando RP-HPLC.
4.2. Características bioquímicas e estruturais das PLA2s isoladas de Bothrops pauloensis
21 conteúdo de resíduos de aminoácidos básicos e hidrofóbicos. O N-terminal destas proteínas contém um resíduo de serina e resíduos de Gly30, Gly33, His48, Asp 99 conservados em sua estrutura (MAGRO et al., 2003).
As demais PLA2s básicas isoladas de B. pauloensis (BnpTXI e II) apresentaram um
Mr em torno de 14.000 para o monômero e 28.000 para o dímero, pI 7.8, cerca de 121 resíduos de aminoácidos e sete ligações dissulfeto. As sequências N-terminais de ambas revelaram analogia com miotoxinas Asp49 básicas de outras peçonhas de serpentes, possuindo em média 70% de similaridade (RODRIGUES et al., 2004). A análise da estrutura primária da BnpTX-I por Rodrigues e colaboradores (2004) mostrou que esta enzima contém todos os resíduos conservados da PLA2 implicados na ligação ao Ca2 + (Tyr28, Gly30, Gly32 e Asp49) e na rede
22 catalítica (His48). Foram observadas substituições no canal hidrofóbico onde o Trp19, relatado como membro da superfície de ligação interfacial (SCOTT et al., 1990), é substituído por um resíduo Phe19. A BnpTX-II não foi sequenciada até seu 49º resíduo de aminoácido, mas sua atividade catalítica, homologia de sequência e antigenicidade sugerem que é uma Asp49 PLA2 (RODRIGUES et al., 2004).
As PLA2s Asp-49 ou Lys 49 básicas apresentam um grande conteúdo de resíduos de lisina (FULY et al., 2000). Muitas pesquisas têm mostrado que a região C-terminal dessas proteínas, inclui um segmento contendo os resíduos 115-129, este é responsável pela miotoxicidade das Lys49-PLA2s, devido à combinação de resíduos carregados positivamente e resíduos hidrofóbicos (NÚÑEZ, ANGULO e LOMONTE, 2001; CHIOATO et al., 2007), e que esta ação está diretamente ligada com a forma dimérica das PLA2-Lys49 em solução (FRANCIS et al., 1991; DA SILVA GIOTTO et al., 1998; OLIVEIRA et al., 2001). A MjTX-I, isolada por Soares e colaboradores (2000a) a partir da peçonha de Bothrops moojeni apresentou peso molecular estimado de 13.400, pI 8,2 e 121 aminoácidos, com alta proporção de resíduos básicos e hidrofóbicos. Outra proteína isolada da mesma espécie por Calgarotto e colaboradores (2008), a BmTX-I, apresenta uma massa molecular de 14238,71 Da, pI 7,84, e também apresentou sequência de 121 resíduos de aminoácidos, 14 resíduos de semi-cisteína, e alto grau de homologia com miotoxinas Asp49 PLA2 básicas de outras peçonhas de Bothrops.
23 aminoácidos conservados envolvidos no domínio de ligação do cálcio e no sítio catalítico (Tyr28, Gly30, Gly32, His48 e Asp49). A outra PLA2 ácida da peçonha de BpPLA2-TXI também teve sua estrutura primária elucidada a partir do sequenciamento de seu cDNA, o qual é formado por 417 pares de bases que codificam uma proteína de 122 resíduos de aminoácidos com o resíduo de aspartato na posição 49 (FERREIRA, 2011).
Os principais aspectos estruturais das PLA2s ácidas como massa molecular, pI e aminoácidos presentes em suas sequências são similares. A enzima Ba SpII RP4 de Bothrops alternatus contém massa molecular de 14185,48 Da, pI de 4,88, conformação homodimérica, é composta por 121 resíduos de aminoácidos, e o alinhamento dos mesmos com aminoácidos de outras PLA2s de Bothrops revelaram um alto grau de homologia na sequência (DENEGRI et al., 2010). A sequência amino terminal de LM-PLA2, isolada de Lachesis muta possui um resíduo de ácido aspártico localizado na posição 49, com aminoácidos conservados presentes nas fosfolipases Asp-49, tais como Tyr-28, Gly-30, Gly-32, His-48 (FULY et al., 2000). Chen e Chen (1989) isolaram uma PLA2 da peçonha de Agkistrodon acutus, cujo peso molecular aproximado era de 16.400, ponto isoelétrico de 4.9 e apresenta os dez resíduos de aminoácidos N-terminal homólogos aos das fosfolipases A2 ácidas de outras peçonhas crotálicas. A BaspPLA2-II, purificada de Bothrops asper é monomérica, apresentando uma massa de 14.212 Da, pI de 4.9, e sequência de 124 aminoácidos, indicando que pertence às enzimas cataliticamente ativas Asp49, e suas características toxicológicas sugerem que sua finalidade pode estar restrita às funções digestivas (FERNÁNDEZ et al., 2010).
24 Há mais de cinquenta anos estudos envolvendo o isolamento e a caracterização estrutural e funcional de PLA2s de serpentes vêm sendo realizados (SAITO; HANAHAN, 1962; RUSSELL, 1967; BHAT; GOWDA, 1989; CHEN; CHEN, 1989; OWNBY; ANGULO et al., 1997; COLBERG; WHITE, 1997; SERRANO et al., 1999; FULY et al., 2002; KETELHUT et al., 2003; NÚÑEZ et al., 2004; PONCE-SOTO et al., 2007; CALGAROTTO et al., 2008; DIZ FILHO et al., 2009; NUNES et al., 2011). Vários autores ainda dedicam seus esforços no sentido de elucidar o mecanismo de ação das fosfolipases A2 isoladas de peçonhas ofídicas e a verificação de seus potenciais terapêuticos.
Estas enzimas são responsáveis por uma variedade de efeitos tóxicos e farmacológicos. Dentre seus efeitos mais comuns destacam-se a miotoxicidade, edema, indução ou inibição da agregação plaquetária, neurotoxicidade, efeito hipotensor, bactericida e citotoxicidade (FRANCISCHETTI et al., 1998; KINI, 2003; MASUDA et al., 2005; STÁBELI et al., 2006; RODRIGUES et al., 2007; SANTOS-FILHO et al., 2008; FERNÁNDEZ et al., 2010).
25 regeneradas (HARRIS, 2003). Estes são dados que possibilitam futuramente tratamentos para processos de regeneração que se encontram defasados em algumas condições clínicas.
A PLA2 BnSP-7 também apresentou atividade antimicrobiana por suprimir o crescimento de Escherichia coli (SOARES et al., 2000b), induziu efeito antiparasitário induzindo citotoxicidade contra formas promastigotas de Leishmania amazonensis, e apresentou efeitos sobre as formas amastigotas, diminuindo a viabilidade do parasita e retardando o processo de diferenciação de amastigota em promastigota (NUNES et al., 2013). Esta proteína ambém foi capaz de diminuir a adesão e proliferação de formas infectantes de
Toxoplasma gondii, por meio da modulação de citocinas pro-inflamatórias MIF e IL-6 pelas células hospedeiras (BORGES et al., 2016). Os autores sugeriram que a BnSP-7 pode ser uma ferramenta importante para a descoberta de novos alvos parasitas que podem ser explorados para o desenvolvimento de novos fármacos para o tratamento da leishmaniose e toxoplasmose.
26 Gram-negativas Xanthomonas axonopodis. pv. passiflorae, e ambas as PLA2s compreenderam atividade antibacteriana (BARBOSA et al., 2005).
Azevedo e colaboradores (2016) investigaram a atividade antitumoral da BnSP-6 sobre células de câncer de mama MDA-MB-231, uma linhagem de células triplo negativa e altamente metastática. Os autores demonstraram que a PLA2 BnSP-6 foi citotóxica para células MDA-MB-231 e apresentou baixa citotoxicidade para células de mama não tumorigênica MCF10A, relevando uma especificidade celular por alvos na célula tumoral. Além disso, a PLA2 BnSP-6 foi capaz de estimular a autofagia promovendo a formação de vacúolos autofágicos e induzir apoptose, confirmada pelo aumento da expressão de genes relacionados a via apoptótica. Também foi demonstrado por esses autores que a BnSP-6 foi capaz de inibir a adesão e migração de células MDA-MB-231, eventos importantes para metástase tumoral. Por fim, a PLA2 BnSP-6 foi capaz de provocar um aumento da expressão de genes BRCA2 e TP53, que codificam proteínas caracterizadas como supressoras de tumor (AZEVEDO, et. al., 2016). O efeito citotóxico causado por BnSP-6 foi consideravelmente menor contra a linhagem celular de mama não tumoral (MCF10A), sugerindo que a enzima apresentou uma possível preferência por alvos em células cancerígenas, somando aos efeitos antitumorais, propõe-se aplicações farmacêuticas desta PLA2 como um agente antiangiogênico e anti-metastático (AZEVEDO et al., 2016).
27 capacidade de interferir na viabilidade induzindo a morte celular por autofagia ou apoptose como em linhagem celular leucêmica mielóide K562 (YAN et al., 2006). Há dois possíveis mecanismos que podem expor o potencial terapêutico das PLA2s contra as linhagens de células tumorais: a ação citotóxica diretamente nas células e/ou mudanças nos processos fundamentais para o crescimento do tumor, como o efeito inibitório de algumas PLA2s na angiogênese (RODRIGUES et al., 2015).
As PLA2s BnpTX-I e BnpTXI-II também foram exploradas quanto aos seus aspectos bioquímicos e funcionais. Ambas as proteínas foram capazes de induzir citotoxicidade sobre células C2C12 mioblastos e miotubos, bem como induzir miotoxicidade, edema e letalidade em camundongos. Além disso, BnpTX-I possui elevada atividade anticoagulante, bactericida contra bactérias Gram negativas (E. coli) e Gram positivas (S. aureus), e induz um bloqueio neuromuscular em nervo frênico extraídos de camundongos (RODRIGUES et al, 2004).
28 muscular com o aumento dos níveis de creatina quinase (CLEMENT et al., 2012) e induzir lesões em tecidos do fígado, pulmão e coração (NISENBOM; SEKI e VIDAL, 1986).
Outras atividades têm sido demonstradas para as PLA2s Aps-49 ácidas isoladas de peçonhas de serpentes. Teixeira (2011) mostraram efeito citotóxico sobre células tumorais, bactérias, fungos e leishmanias, inibição da agregação plaquetária e coagulação do plasma e efeito hipotensor in vivo utilizando a enzima BpirPLA2-I, isolada da peçonha de B. pirajai. Rudrammaji e Gowda (1998) avaliaram a capacidade inibitória do crescimento da massa tumoral do tumor ascítico de Ehrlich por PLA2s ácidas da peçonha de Naja naja naja, e pesquisadores como Bazaa e colaboradores (2009) demonstraram queMVL-PLA2 isolada de Macrovipera lebetina transmediterranea induziu aadesão e migração celular.
As PLA2s ácidas da peçonha de serpentes do gênero Bothrops ainda são pouco exploradas e o entendimento de suas características tanto estruturais quanto funcionais poderá colaborar para um melhor discernimento de seu mecanismo de ação frente às suas atividades biológicas
BpPLA2 e BpPLA2-TXI de B. pauloensis foram capazes de inibir a agregação plaquetária induzida por colágeno e ADP (RODRIGUES et al., 2007), mostrando uma potencialidade ao tratamento de disfunções plaquetárias relacionadas a agregação, como a trombose. Porém, Huang e colaboradores. (1984) demonstraram que essa inibição pode ser independente de atividade catalítica. Wang et al. (1996) demonstraram que uma PLA2 ácida de A. halys pallas continha um domínio aromático associado com resíduos ácidos que poderiam estar envolvidos na inibição da agregação plaquetária.
Santos-filho e colaboradores (2008) testaram a capacidade de inibição da agregação
29 plaquetária foram purificadas, tais como LM-PLA2-I e LM-PLA2-II
de Lachesis muta (FULY et al., 2000; FULY et al., 2002) e BE-IPLA2
de B. erythromelas (MODESTO et al., 2006). Quando testada em plasma rico em plaquetas, a enzima BE-I-PLA2 demonstrou efeito inibitório eficaz na agregação induzida por ácido araquidônico e colágeno, exceto por ADP, e não modificou a agregação em plaquetas lavadas (MODESTO et al., 2006). Sobrinho (2014) por meio de ensaio de agregação plaquetária detectou que ambas as PLA2s purificadas de Bothrops brazili (Braziliase-I e (Braziliase-I(Braziliase-I) indicaram apresentar atividade antiplaquetária sobre a agregação induzida por ADP e a Braziliase-II sobre a agregação induzida por colágeno também.
Estes estudos de inibição da agregação plaquetária utilizando PLA2s de peçonha ofídica podem indicar um possível direcionamento para novas pesquisas visando o entendimento dos processos moleculares envolvidos na agregação de plaquetas, bem como tais estudos permitem a geração de novos modelos moleculares para o desenho racional de futuros fármacos para o tratamento de desordens trombóticas.
5. CONCLUSÃO
30 linhagens de células tumorais. O desenvolvimento de pesquisas nessa área representa grande importância, possibilitando um futuro desenvolvimento de fármacos obtidos a partir de fontes naturais, e com maior especificidade e eficácia, podendo apresentar também tratamentos com menores custos.
6. REFERÊNCIAS
ABE, Akira; SHAYMAN, James A.. Purification and Characterization of 1-O-Acylceramide Synthase, a Novel Phospholipase A2 with Transacylase Activity. Journal Of Biological Chemistry, [s.l.], v. 273, n. 14, p.8467-8474, 3 abr. 1998. American Society for Biochemistry & Molecular Biology (ASBMB). http://dx.doi.org/10.1074/jbc.273.14.8467.
ACKERMANN, Elizabeth J.; KEMPNER, E. S.; DENNIS, E. A. Ca (2+) -independent cytosolic phospholipase A2 from macrophage-like P388D1 cells. Isolation and characterization. Journal of Biological Chemistry, v. 269, n. 12, p. 9227-9233, 1994. AKIBA, Satoshi; SATO, Takashi. Cellular Function of Calcium-Independent Phospholipase A2. Biological & Pharmaceutical Bulletin, [s.l.], v. 27, n. 8, p.1174-1178, 2004. Pharmaceutical Society of Japan. http://dx.doi.org/10.1248/bpb.27.1174. ALMEIDA, F.; WOLF, J. M.; CASADEVALL, A. Virulence-Associated Enzymes of
Cryptococcus neoformans. Eukaryot Cell, v. 14, n. 12, p. 1173-1185, 2015.
AMARAL, A. N. D. A general consideration of snake poisoning and observations on neotropical pit-vipers, 1st ed.; Harvard University press: Cambridge, 1925.
ANDRIÃO-ESCARSO, Sı́lvia H et
al. Structural and functional characterization of an acidic platelet aggregation inhibitor a nd hypotensive phospholipase A
2 from Bothrops jararacussu snake venom. Biochemical Pharmacology, [s.l.], v. 64, n. 4, p.723-732, ago. 2002. Elsevier BV. http://dx.doi.org/10.1016/s0006-2952(02)01210-8.
ANDRIÃO-ESCARSO, Silvia H. et al. Myotoxic phospholipases A2 in Bothrops snake venoms: Effect of chemical modifications on the enzymatic and pharmacological properties of bothropstoxins from Bothrops jararacussu. Biochimie, [s.l.], v. 82, n. 8, p.755-763, ago. 2000. Elsevier BV. http://dx.doi.org/10.1016/s0300-9084(00)01150-0. ANGULO, Yamileth et
31 Rica. Archives Of Biochemistry And Biophysics, [s.l.], v. 339, n. 2, p.260-266, mar. 1997. Elsevier BV. http://dx.doi.org/10.1006/abbi.1996.9865.
ARAÚJO, Albetiza Lôbo de; RADVANYI, François;
BON, Cassian. Purification of an acidic phospholipase A2 from Bothrops lanceolatus (f er de lance) venom: Molecular and enzymatic properties. Toxicon, [s.l.], v. 32, n. 9, p.1069-1081, set. 1994. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(94)90391-3. AZEVEDO, Fernanda van Petten Vasconcelos et al. Human breast cancer cell death induced by BnSP-6, a Lys-49 PLA2 homologue from Bothrops pauloensis venom. International Journal Of Biological Macromolecules, [s.l.], v. 82, p.671-677, jan. 2016. Elsevier BV. http://dx.doi.org/10.1016/j.ijbiomac.2015.10.080.
BALSINDE, Jesús; DENNIS, Edward A.. Distinct Roles in Signal Transduction for Each of the Phospholipase A Enzymes Present in P388D Macrophages. Journal Of Biological Chemistry, [s.l.], v. 271, n. 12, p.6758-6765, 22 mar. 1996. American Society for
Biochemistry & Molecular Biology (ASBMB).
http://dx.doi.org/10.1074/jbc.271.12.6758.
BALSINDE, J. et al. Arachidonic acid mobilization in P388D1 macrophages is controlled by two distinct Ca (2+)-dependent phospholipase A2 enzymes. Proceedings Of The National Academy Of Sciences, [s.l.], v. 91, n. 23, p.11060-11064, 8 nov. 1994. Proceedings of the National Academy of Sciences. http://dx.doi.org/10.1073/pnas.91.23.11060.
BARBOSA, P.s.f. et al.
Renal and antibacterial effects induced by myotoxin I and II isolated from Bothrops jar aracussu venom. Toxicon, [s.l.], v. 46, n. 4, p.376-386, set. 2005. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2005.04.024.
BAZAA, Amine et al. MVL-PLA2,
a phospholipase A2 from Macrovipera lebetina transmediterranea venom, inhibits tum or cells adhesion and migration. Matrix Biology, [s.l.], v. 28, n. 4, p.188-193, maio 2009. Elsevier BV. http://dx.doi.org/10.1016/j.matbio.2009.03.007.
BHAT, Manoj Kumar;
GOWDA, T.veerabasappa. Purification and characterization of a myotoxic phospholipa se A2 from Indian cobra (Naja naja naja) venom. Toxicon, [s.l.], v. 27, n. 8, p.861-873, jan. 1989. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(89)90098-6.
BORGES, Isabela Pacheco et al. Anti-parasitic effect on Toxoplasma gondii induced by BnSP-7, a Lys49-phospholipase A2 homologue from Bothrops pauloensis venom. Toxicon, [s.l.], v. 119, p.84-91, set. 2016. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2016.05.010.
32 BURKE, John E.; DENNIS, Edward A.. Phospholipase A2 Biochemistry. Cardiovascular Drugs And Therapy, [s.l.], v. 23, n. 1, p.49-59, 18 out. 2008a. Springer Nature. http://dx.doi.org/10.1007/s10557-008-6132-9.
BURKE, John E.; DENNIS, Edward A.. Phospholipase A2 structure/function, mechanism, and signaling. Journal Of Lipid Research, [s.l.], v. 50, n. , p.237-242, 14 nov. 2008b. American Society for Biochemistry & Molecular Biology (ASBMB). http://dx.doi.org/10.1194/jlr.r800033-jlr200.
CALDERON, Leonardo A. et al. Antitumoral Activity of Snake Venom Proteins: New Trends in Cancer Therapy. Biomed Research International, [s.l.], v. 2014, p.1-19, 2014. Hindawi Limited. http://dx.doi.org/10.1155/2014/203639.
CALGAROTTO, Andrana K. et
al. Biological and biochemical characterization of new basic phospholipase A2 BmTX-I isolated from Bothrops moojeni snake venom. Toxicon, [s.l.], v. 51, n. 8, p.1509-1519, jun. 2008. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2008.03.030.
CALVETE, Juan J.; JUÁREZ, Paula;
SANZ, Libia. Snake venomics. Strategy and applications. Journal Of Mass Spectrome try, [s.l.], v. 42, n. 11, p.1405-1414, 2007. Wiley. http://dx.doi.org/10.1002/jms.1242. CARRASCO, Paola A. et al. Morphology, phylogeny and taxonomy of South American Bothropoid pitvipers (Serpentes, Viperidae). Zoologica Scripta, [s.l.], v. 41, n. 2, p.109-124, 7 fev. 2012. Wiley. http://dx.doi.org/10.1111/j.1463-6409.2011.00511.x.
CASTILLO, Juan et al. In
Vitro Antiplasmodial Activity of Phospholipases A2 and a Phospholipase Homologue Is olated from the Venom of the Snake Bothrops asper. Toxins, [s.l.], v. 4, n. 12, p.1500-1516, 14 dez. 2012. MDPI AG. http://dx.doi.org/10.3390/toxins4121500.
CHEN, S. C. A.; WIRGHT, L. C.; GOLDING, J. C.; SORREL, T. C. Purification and characterization of secretory phospholipase B, Isysophospholipase and Iysophopholipase/transacylase from a virulent strain of the pathogenic fungus
Cryptococcus neoformans. The Biochemical journal, v. 347, p. 431-439, 2000.
CHEN, Rui-hong; CHEN,
Yuan-chung. Isolation of an acidic phospholipase A2 from the venom of Agkistrodon acutus ( five pace snake) and its effect on platelet aggregation. Toxicon, [s.l.], v. 27, n. 6, p.675-682, jan. 1989. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(89)90018-4.
CHIOATO, L.; ARAGAO, E. A.; FERREIRA, T. L.; DE MEDEIROS, A. I.; FACCIOLI,
L. H.; WARD, R.
J. Mapping of the structural determinants of artificial and biological membrane damagin g activities of a
33 CLARK, James D. et al. A novel arachidonic acid-selective cytosolic PLA2 contains a Ca2+-dependent translocation domain with homology to PKC and GAP. Cell, [s.l.], v. 65, n. 6, p.1043-1051, jun. 1991. Elsevier BV. http://dx.doi.org/10.1016/0092-8674(91)90556-e.
CLARK, J. D.; MILONA, N.; KNOPF, J. L.. Purification of a 110-kilodalton cytosolic phospholipase A2 from the human monocytic cell line U937. Proceedings Of The National Academy Of Sciences, [s.l.], v. 87, n. 19, p.7708-7712, 1 out. 1990. Proceedings of the National Academy of Sciences. http://dx.doi.org/10.1073/pnas.87.19.7708.
CLEMENT, Herlinda et al. Isolation,
amino acid sequence and biological characterization of an “aspartic
-49” phospholipase A2 from Bothrops (Rhinocerophis) ammodytoides venom. Toxicon, [s.l.], v. 60, n. 7, p.1314-1323, dez. 2012. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2012.08.019.
CONTARDI, A.; ERCOLI, A. Über die enzymatische Spaltung der Lecithine und Lysocithine. Biochem. Z, v. 261, p. 275-302, 1933.
COSTA, Tassia R. et
al. Myotoxic phospholipases A2 isolated from Bothrops brazili snake venom and synthe tic peptides derived from their
C-terminal region: Cytotoxic effect on microorganism and tumor cells. Peptides, [s.l.], v. 29, n. 10, p.1645-1656, out. 2008. Elsevier BV. http://dx.doi.org/10.1016/j.peptides.2008.05.021.
DAMICO, Daniela C.s. et al. Biochemical and enzymatic characterization of two basic Asp49 phospholipase A2 isoforms from Lachesis muta muta (Surucucu) venom. Biochimica Et Biophysica Acta (bba) - General Subjects, [s.l.], v. 1726, n. 1, p.75-86, out. 2005. Elsevier BV. http://dx.doi.org/10.1016/j.bbagen.2005.05.022.
DA SILVA-GIOTTO, M. T. et
al. Crystallographic and spectroscopic characterization of a
molecular hinge: conformational changes I bothropstoxin I, a dimeric Lys49-phospholipase A2 homologue. Prot. Struct. Funct. Genet. v. 30, p. 442 – 454, 1998. DAWSON, R. M. C. The phospholipase B of liver. Biochemical Journal, v. 64, n. 1, p. 192, 1956.
DENEGRI, María E. Garcia et al. Isolation and functional characterization of a new acidic PLA2
Ba SpII RP4 of the Bothrops alternatus snake venom from Argentina. Toxicon, [s.l.], v.
56, n. 1, p.64-74, ago. 2010. Elsevier
BV. http://dx.doi.org/10.1016/j.toxicon.2010.02.031.
34 DENNIS, Edward A.. 9 Phospholipases. Lipid Enzymology, [s.l.], p.307-353, 1983. Elsevier. http://dx.doi.org/10.1016/s1874-6047(08)60307-8.
DÍAZ, Cecilia et al. The effect of myotoxins isolated from Bothrops snake venoms on multilamellar liposomes: relationship to phospholipase A2, anticoagulant and myotoxic activities. Biochimica Et Biophysica Acta (bba) - Biomembranes, [s.l.], v. 1070, n. 2, p.455-460, dez. 1991. Elsevier BV. http://dx.doi.org/10.1016/0005-2736(91)90086-n. DIZ FILHO, E.b.s. et al. Enzymatic and structural characterization of new PLA2 isoform isolated from white venom of Crotalus durissus ruruima. Toxicon, [s.l.],
v. 53, n. 1, p.104-114, jan. 2009. Elsevier
BV. http://dx.doi.org/10.1016/j.toxicon.2008.10.021.
DOERY, Hazel M.; PEARSON, Joan E. Phospholipase B in snake venoms and bee venom. Biochemical Journal, v. 92, n. 3, p. 599, 1964.
DUNCAN, Robin E. et al. Identification and Functional Characterization of Adipose-specific Phospholipase A2(AdPLA). Journal Of Biological Chemistry, [s.l.], v. 283, n. 37, p.25428-25436, 9 jul. 2008. American Society for Biochemistry & Molecular Biology (ASBMB). http://dx.doi.org/10.1074/jbc.m804146200.
FAURE, G. Natural inhibitors of toxic phospholipases A2. Biochimie, [s.l.], v. 82, n.
9-10, p.833-840, 10 set. 2000. Elsevier BV. http://dx.doi.org/10.1016/s0300-9084(00)01175-5.
FENWICK, Allyson M. et al. Morphological and molecular evidence for phylogeny and classification of South American pitvipers, genera Bothrops, Bothriopsis, and Bothrocophias (Serpentes: Viperidae). Zoological Journal Of The Linnean Society, [s.l.], v. 156, n. 3, p.617-640, jul. 2009. Oxford University Press (OUP). http://dx.doi.org/10.1111/j.1096-3642.2008.00495.x.
FERNÁNDEZ, Julián et al. Isolation of an acidic phospholipase A2 from the venom of the snake Bothrops asper of Costa Rica: Biochemical and toxicological characterization☆. Biochimie, [s.l.], v. 92, n. 3, p.273-283, mar. 2010. Elsevier BV. http://dx.doi.org/10.1016/j.biochi.2009.12.006.
FERREIRA, Francis Barbosa. Caracterização bioquímico-farmacológica de uma PLA2 ácida isolada da peçonha de Bothropoides pauloensis (Bothrops pauloensis). 2011. 71 f. Dissertação (Mestrado) - Curso de Ciências Biológicas, Universidade Federal de Uberlândia, Uberlândia, 2011.
FORTES-DIAS, Consuelo L.. Endogenous inhibitors of snake venom phospholipases A2 in the blood plasma of snakes. Toxicon, [s.l.], v. 40, n. 5, p.481-484, maio 2002. Elsevier BV. http://dx.doi.org/10.1016/s0041-0101(01)00274-4.
35 FREYBERG, Zachary; BOURGOIN, Sylvain; SHIELDS, Dennis. Phospholipase D2 Is Localized to the Rims of the Golgi Apparatus in Mammalian Cells. Molecular Biology Of The Cell, [s.l.], v. 13, n. 11, p.3930-3942, nov. 2002. American Society for Cell Biology (ASCB). http://dx.doi.org/10.1091/mbc.02-04-0059.
FREYBERG, Zachary et al. Intracellular Localization of Phospholipase D1 in Mammalian Cells. Molecular Biology Of The Cell, [s.l.], v. 12, n. 4, p.943-955, abr. 2001. American Society for Cell Biology (ASCB). http://dx.doi.org/10.1091/mbc.12.4.943.
FULY, André L. et al. Purification and characterization of a phospholipase A 2 isoenzyme isolated from Lachesis muta snake venom. Biochemical Pharmacology, [s.l.], v. 63, n. 9, p.1589-1597, maio 2002. Elsevier BV. http://dx.doi.org/10.1016/s0006-2952(02)00873-0.
FULY, André L et
al. Myotoxic activity of an acidic phospholipase A2 isolated from Lachesis muta (Bush master) snake venom. Toxicon, [s.l.], v. 38, n. 7, p.961-972, jul. 2000. Elsevier BV. http://dx.doi.org/10.1016/s0041-0101(99)00208-1.
GANENDREN, R.; CARTER, E.; SORREL, T.; WILMER, F. & WRIGHT, L. Phospholipase B activity enhances adhesion of Cryptococcus neoformans to a human lung epithelial cell line. Microbes and Infection, v. 8, p. 1006-1015, 2006.
GEBRIM, Luiz Carlos et
al. Antitumor effects of snake venom chemically modified Lys49 phospholipase A2
-like BthTX-I and a synthetic peptide derived from its C-terminal region. Biologicals,
[s.l.], v. 37, n. 4, p.222-229, ago. 2009. Elsevier
BV. http://dx.doi.org/10.1016/j.biologicals.2009.01.010.
GLASER, Keith B.. Regulation of Phospholipase A2 Enzymes: Selective Inhibitors and their Pharmacological Potential. Advances In Pharmacology, [s.l.], p.31-66, 1995. Elsevier. http://dx.doi.org/10.1016/s1054-3589(08)61011-x.
GONZALEZ, F. H., CERONI da SILVA, S. Bioquímica hormonal. In: Introdução à bioquímica hormonal. 2.ed. Porto Alegre (RS): Editora da UFRGS, Cap.7, p. 251-312, 2006.
GUTIÉRREZ, José Marı́a; OWNBY, Charlotte L. Skeletal muscle degeneration induced by venom phospholipases A2: insights into the mechanisms of local and systemic myotoxicity. Toxicon, [s.l.], v. 42, n. 8, p.915-931, dez. 2003. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2003.11.005.
36 GUTIÉRREZ, Josémaría; LOMONTE, Bruno. Phospholipase A2 myotoxins from
Bothrops snake venoms. Toxicon, [s.l.], v. 33, n. 11, p.1405-1424, nov. 1995. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(95)00085-z.
HARRIS, J.b.. Myotoxic phospholipases A2 and the regeneration of skeletal muscles. Toxicon, [s.l.], v. 42, n. 8, p.933-945, dez. 2003. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2003.11.011.
HIRAOKA, Miki; ABE, Akira; SHAYMAN, James A.. Cloning and Characterization of a Lysosomal Phospholipase A2, 1-O-Acylceramide Synthase. Journal Of Biological Chemistry, [s.l.], v. 277, n. 12, p.10090-10099, 14 jan. 2002. American Society for
Biochemistry & Molecular Biology (ASBMB).
http://dx.doi.org/10.1074/jbc.m111977200
HUANG, Huei-chen. Release of slow reacting substance from the guinea-pig lung by phospholipases A2 of Vipera russelli snake venom. Toxicon, [s.l.], v. 22, n. 3, p.359-372, jan. 1984. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(84)90080-1.
INOUE, Keizo; ARAI, Hiroyuki; AOKI, Junken. Phospholipase A1 Structures, Physiological and Patho-physiological Roles in Mammals. Lipases And Phospholipases In Drug Development, [s.l.], p.23-39, 7 jan. 2005. Wiley-VCH Verlag GmbH & Co. KGaA. http://dx.doi.org/10.1002/3527601910.ch2.
JAIN, Deepika; KUMAR, Sudhir. Snake Venom: A Potent Anticancer Agent. Asian Pacific Journal Of Cancer Prevention, [s.l.], v. 13, n. 10, p.4855-4860, 31 out. 2012. Asian Pacific Organization for Cancer Prevention. http://dx.doi.org/10.7314/apjcp.2012.13.10.4855.
JENKINS, G. M.; FROHMAN, M. A.. Phospholipase D: a lipid centric review. Cellular And Molecular Life Sciences, [s.l.], v. 62, n. 19-20, p.2305-2316, 7 set. 2005. Springer Nature. http://dx.doi.org/10.1007/s00018-005-5195-z.
KASTURI, S.; GOWDA, T.veerabasappa. Purification and characterization of a major phospholipase A2 from Russell's viper (Vipera russelli) venom. Toxicon, [s.l.], v. 27, n. 2, p.229-237, jan. 1989. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(89)90136-0. KETELHUT, D.f.j et
al. Isolation, characterization and biological activity of acidic phospholipase A2 isoform s from Bothrops jararacussu snake venom. Biochimie, [s.l.], v. 85, n. 10, p.983-991, out. 2003. Elsevier BV. http://dx.doi.org/10.1016/j.biochi.2003.09.011.
KINI, R Manjunatha. Excitement ahead: structure, function and mechanism of snake venom phospholipase A2 enzymes. Toxicon, [s.l.], v. 42, n. 8, p.827-840, dez. 2003. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2003.11.002.
37 KRAMER, Ruth M. et al. Cytosolic phospholipase A2 (cPLA2) and lipid mediator release in the brain. Journal of lipid mediators and cell signalling, v. 14, n. 1-3, p. 3-7, 1996. KRONSTAD, J. W. et al. Expanding fungal pathogenesis: Cryptococcus breaks out of the opportunistic box. Nat Rev Micro, v. 9, n. 3, p. 193-203, 2011.
KUDO, Ichiro; MURAKAMI, Makoto. Phospholipase A2 enzymes. Prostaglandins & Other Lipid Mediators, [s.l.], v. 68-69, p.3-58, ago. 2002. Elsevier BV. http://dx.doi.org/10.1016/s0090-6980(02)00020-5.
LIZANO, Sergio; DOMONT, Gilberto; PERALES, Jonas. Natural phospholipase A2 myotoxin inhibitor proteins from snakes, mammals and plants. Toxicon, [s.l.], v. 42, n. 8, p.963-977, dez. 2003. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2003.11.007. LOMONTE, Bruno; RANGEL, José. Snake venom Lys49 myotoxins: From phospholipases A2 to non-enzymatic membrane disruptors. Toxicon, [s.l.], v. 60, n. 4, p.520-530, set. 2012. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2012.02.007. LOMONTE, Bruno; ANGULO, Yamileth; MORENO, Edgardo. Synthetic Peptides Derived from the C-Terminal Region of Lys49 Phospholipase A2 Homologues from
Viperidae Snake Venoms: Biomimetic Activities and Potential Applications. Current Pharmaceutical Design, [s, I], v. 16, n. 28, p.3224-3230, jul. 2010.
LOMONTE, Bruno; ANGULO, Yamileth; SANTAMARÍA, Carlos. Comparative study of synthetic peptides corresponding to region 115–129 in Lys49 myotoxic phospholipases A2 from snake venoms. Toxicon, [s.l.], v. 42, n. 3, p.307-312, set. 2003. Elsevier BV. http://dx.doi.org/10.1016/s0041-0101(03)00149-1.
MACHADO, Taís; SILVA, Vinícius X.; SILVA, Maria José de J.. Phylogenetic relationships within Bothrops neuwiedi group (Serpentes, Squamata): Geographically highly-structured lineages, evidence of introgressive hybridization and Neogene/Quaternary diversification. Molecular Phylogenetics And Evolution, [s.l.], v. 71, p.1-14, fev. 2014. Elsevier BV. http://dx.doi.org/10.1016/j.ympev.2013.10.003. MAGRO, Angelo J. et al. Crystal structures of BnSP-7 and BnSP-6, two Lys49-phospholipases A2: quaternary structure and inhibition mechanism insights. Biochemical And Biophysical Research Communications, [s.l.], v. 311, n. 3, p.713-720, nov. 2003. Elsevier BV. http://dx.doi.org/10.1016/j.bbrc.2003.10.047.
MARPLES, Elizabeth A.; THOMPSON, R. H. S. The distribution of phospholipase B in mammalian tissues. Biochemical Journal, v. 74, n. 1, p. 123, 1960.
MODESTO, Jeanne Claine de Albuquerque et al. BE-I-PLA2, a novel acidic phospholipase A2 from Bothrops erythromelas venom: Isolation, cloning a nd characterization as potent anti-platelet and inductor of prostaglandin I2
release by endothelial cells. Biochemical Pharmacology, [s.l.], v. 72, n. 3, p.377-384, jul. 2006. Elsevier BV. http://dx.doi.org/10.1016/j.bcp.2006.04.032.
MOURA, Andréa A. de et
38
Bothrops mattogrossensis Snake Venom with Toxicity against Leishmania
and Tumor Cells. Biomed Research International, [s.l.], v. 2014, p.1-13, 2014. Hindawi Limited. http://dx.doi.org/10.1155/2014/195356.
MOURA-DA-SILVA, A.m. et al. Isolation and comparison of myotoxins isolated from venoms of different species of bothrops snakes. Toxicon, [s.l.], v. 29, n. 6, p.713-723, jan. 1991. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(91)90063-w.
NAKAGAWA, Hiroshi et al. Inhibition of PLD1 activity causes ER stress via regulation of COPII vesicle formation. Biochemical And Biophysical Research Communications, [s.l.], v. 490, n. 3, p.895-900, ago. 2017. Elsevier BV. http://dx.doi.org/10.1016/j.bbrc.2017.06.137.
NIEWERTH, M.; KORTING, H. C.. Phospholipases of Candida albicans. Mycoses, [s.l.], v. 44, n. 9-10, p.361-367, nov. 2001. Wiley-Blackwell. http://dx.doi.org/10.1046/j.1439-0507.2001.00685.x.
NISENBOM, H.e.; SEKI, C.;
VIDAL, J.c.. Phospholipase A2 from Bothrops alternatus (víbora
de la cruz) venom. Purification and some characteristic properties. Toxicon, [s.l.], v. 24, n. 3, p.259-272, jan. 1986. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(86)90151-0.
NISHIOKA, Sergio de Andrade; SILVEIRA, Paulo Vitor Portella. A Clinical and Epidemiologic Study of 292 Cases of Lance-Headed Viper Bite in a Brazilian Teaching Hospital. The American Journal Of Tropical Medicine And Hygiene, [s.l.], v. 47, n. 6, p.805-810, 1 dez. 1992. American Society of Tropical Medicine and Hygiene. http://dx.doi.org/10.4269/ajtmh.1992.47.805.
NOGUCHI, Shunji. Über die lezithinspaltenden fermente. The Journal of Biochemistry, v. 36, p. 113-129, 1944.
NUNES, Débora C. O. et al. BnSP-7 toxin, a basic phospholipase A2 from Bothrops
pauloensis snake venom, interferes with proliferation, ultrastructure and infectivity of
Leishmania (Leishmania) amazonensis. Parasitology, [s.l.], v. 140, n. 07, p.844-854, 27
fev. 2013. Cambridge University Press (CUP).
http://dx.doi.org/10.1017/s0031182013000012.
NUNES, Débora C.o. et
al. Isolation and functional characterization of proinflammatory acidic phospholipase A2 from Bothrops leucurus snake venom. Comparative Biochemistry And Physiology P art C: Toxicology & Pharmacology, [s.l.], v. 154, n. 3, p.226-233, set. 2011. Elsevier BV. http://dx.doi.org/10.1016/j.cbpc.2011.06.003.
NÚÑEZ, Vitelbina et al. Structural and functional characterization of myotoxin I, a Lys49 phospholipase A2
39
NÚÑEZ, C. E.; ANGULO, Y.; LOMONTE,
B. Identification of the myotoxic site of the Lys49 phospholipase A2 from Agkistrodon
piscivorus piscivorus snake venom: synthetic
C-terminal peptides from Lys49, but not from Asp49 myotoxins, exert membrane-damaging activities. Toxicon. v. 39 (10), p. 1587-1594, 2001.
OLIVEIRA, Carolina de Freitas et al. Insights of local tissue damage and regeneration induced by BnSP-7, a myotoxin isolated from Bothrops (neuwiedi) pauloensis snake venom. Toxicon, [s.l.], v. 53, n. 5, p.560-569, abr. 2009. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2008.12.025.
OLIVEIRA, Carolina de Freitas et al. Estudo da lesão tecidual local induzida por miotoxinas isoladas da peçonha de Bothrops neuwiedi pauloensis (jararaca pintada). Horizonte Científico, v. 1, n. 1, 2007.
OLIVEIRA, A. H. C. de et al. A
pH-Induced Dissociation of the Dimeric Form of a Lysine 49-Phospholipase A2Abolishes Ca2+-Independent Membrane Damaging Activity†. Biochemistry, [s.l.], v. 40, n. 23, p.6912-6920, jun. 2001. American Chemical Society (ACS). http://dx.doi.org/10.1021/bi0026728.
OMORI-SATOH, Tamotsu et al. Purification and characterization of an antihemorrhagic factor in the serum of Trimeresurus flavoviridis, a crotalid. Biochimica Et Biophysica Acta (bba) - Protein Structure, [s.l.], v. 285, n. 2, p.414-426, dez. 1972. Elsevier BV. http://dx.doi.org/10.1016/0005-2795(72)90328-5.
OVADIA, M.; KOCHVA, E.. Neutralization of Viperidae and Elapidae snake venoms by sera of different animals. Toxicon, [s.l.], v. 15, n. 6, p.541-547, jan. 1977. Elsevier BV. http://dx.doi.org/10.1016/0041-0101(77)90105-2.
OWNBY, Charlotte L et al. Lysine 49 phospholipase A2 proteins. Toxicon, [s.l.], v. 37, n. 3, p.411-445, mar. 1999. Elsevier BV. http://dx.doi.org/10.1016/s0041-0101(98)00188-3.
OWNBY, Charlotte L; COLBERG, Terry R; WHITE, Steven P. Isolation, characterization and crystallization of a phospholipase A2 myotoxin from th e venom of the prairie rattlesnake (Crotalus viridis viridis). Toxicon, [s.l.], v. 35, n. 1, p.111-124, jan. 1997. Elsevier BV. http://dx.doi.org/10.1016/s0041-0101(96)00054-2. PAL, Sanjoy Kumar et al. Snake venom as therapeutic agents: From toxin to drug development. Indian Journal Of Experimental Biology. [s, I], p. 1153-1358. dez. 2002. PONCE-SOTO, Luis Alberto et al. Structural and functional properties of BaTX, a new Lys49 phospholipase A2
homologue isolated from the venom of the snake Bothrops alternatus. Biochimica Et B iophysica Acta (bba) - General Subjects, [s.l.], v. 1770, n. 4, p.585-593, abr. 2007. Elsevier BV. http://dx.doi.org/10.1016/j.bbagen.2006.11.015.
PEICHOTO, María E. et al.
rear-40 fanged snake species on the growth of Leishmania major: Identification of a protein wit h inhibitory activity against the parasite. Toxicon, [s.l.], v. 58, n. 1, p.28-34, jul. 2011. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2011.04.018.
RODRIGUES, Renata S. et al. Combined snake venomics and venom gland transcriptomic analysis of Bothropoides pauloensis. Journal Of Proteomics, [s.l.], v. 75,
n. 9, p.2707-2720, maio 2012. Elsevier BV.
http://dx.doi.org/10.1016/j.jprot.2012.03.028.
RODRIGUES, Renata S. et al. Isolation and functional characterization of a new myotoxic acidic phospholipase A2 from Bothrops pauloensis snake venom. Toxicon, [s.l.], v. 50, n. 1, p.153-165, jul. 2007. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2007.03.005.
RODRIGUES, Renata Santos. Purificação e caracterização de uma nova fosfolipase A2 ácida da peçonha de Bothrops pauloensis. 2006. 82 f. Dissertação (Mestrado) - Curso de Ciências Biológicas, Universidade Federal de Uberlândia, Uberlândia, 2006. RODRIGUES, Veridiana et al. Bothrops pauloensis Snake Venom Toxins: The Search for New Therapeutic Models. Current Topics In Medicinal Chemistry, [s.l.], v. 15, n. 7, p.670-684, 10 mar. 2015. Bentham Science Publishers Ltd.. http://dx.doi.org/10.2174/1568026615666150217120347.
RODRIGUES, Veridiana M et al. Bactericidal and neurotoxic activities of two myotoxic phospholipases A2 from Bothrops neuwiedi pauloensis snake venom. Toxicon, [s.l.], v. 44, n. 3, p.305-314, set. 2004. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2004.06.008.
RODRIGUES, Veridiana M et al. Geographic variations in the composition of myotoxins from Bothrops neuwiedi snake venoms: biochemical characterization and biological activity. Comparative Biochemistry And Physiology Part A: Molecular & Integrative Physiology, [s.l.], v. 121, n. 3, p.215-222, nov. 1998. Elsevier BV. http://dx.doi.org/10.1016/s1095-6433(98)10136-8.
RUDRAMMAJI, L.m.s.;
GOWDA, T.v.. Purification and characterization of three acidic, cytotoxic phospholipas es A2 from Indian cobra (Naja naja naja) venom. Toxicon, [s.l.], v. 36, n. 6, p.921-932,
jun. 1998. Elsevier BV. http://dx.doi.org/10.1016/s0041-0101(97)00097-4.
RUFINI, S. et al. Calcium ion independent membrane leakage induced by phospholipase-like myotoxins. Biochemistry, [s.l.], v. 31, n. 49, p.12424-12430, 15 dez. 1992. American Chemical Society (ACS). http://dx.doi.org/10.1021/bi00164a018.
RUSSELL, Findlay E.. Pharmacology of animal venoms. Clinical Pharmacology & T herapeutics, [s.l.], v. 8, n. 6, p.849-873, nov. 1967. Wiley. http://dx.doi.org/10.1002/cpt196786849.
SAIKIA, Debashree; THAKUR, Rupamoni;
41 drolysis of plasma phospholipids and by non-enzymatic inhibition of factor Xa in
a phospholipids/Ca2+ independent manner. Toxicon, [s.l.], v. 57, n. 6, p.841-850, maio 2011. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2011.02.018.
SAITO, Kunihiko; HANAHAN,
Donald J.. A Study of the Purification and Properties of the Phospholipase A of Crotalu s adamanteus Venom*. Biochemistry, [s.l.], v. 1, n. 3, p.521-532, 25 maio 1962. American Chemical Society (ACS). http://dx.doi.org/10.1021/bi00909a025.
SANTOS-FILHO, Norival A. et al. A new acidic myotoxic, anti-platelet and prostaglandin I2 inductor phospholipase A2 isolated from Bothrops moojeni snake venom. Toxicon, [s.l.], v. 52, n. 8, p.908-917, dez. 2008. Elsevier BV. http://dx.doi.org/10.1016/j.toxicon.2008.08.020.
SCHALOSKE, Ralph H.; DENNIS, Edward A.. The phospholipase A2 superfamily and its group numbering system. Biochimica Et Biophysica Acta (bba) - Molecular And Cell Biology Of Lipids, [s.l.], v. 1761, n. 11, p.1246-1259, nov. 2006. Elsevier BV. http://dx.doi.org/10.1016/j.bbalip.2006.07.011.
SCOTT, D. et al. Interfacial catalysis: the mechanism of phospholipase A2. Science, [s.l.], v. 250, n. 4987, p.1541-1546, 14 dez. 1990. American Association for the Advancement of Science (AAAS). http://dx.doi.org/10.1126/science.2274785.
SELVY, Paige E. et al. Phospholipase D: Enzymology, Functionality, and Chemical Modulation. Chemical Reviews, [s.l.], v. 111, n. 10, p.6064-6119, 12 out. 2011. American Chemical Society (ACS). http://dx.doi.org/10.1021/cr200296t.
SERRANO, Solange M.t. et al. A Novel Phospholipase A2, BJ-PLA2, from the Venom of the Snake Bothrops jararaca: Purification, Primary Structure Analysis, and Its Characterization as a Platelet-Aggregation-Inhibiting Factor. Archives Of Biochemistry And Biophysics, [s.l.], v. 367, n. 1, p.26-32, jul. 1999. Elsevier BV. http://dx.doi.org/10.1006/abbi.1999.1230.
SHAPIRO, B. Purification and properties of a lysolecithinase from pancreas. Biochemical Journal, v. 53, n. 4, p. 663, 1953.
SHARP, John D. et al. Molecular cloning and expression of human Ca (2+)-sensitive cytosolic phospholipase A2. Journal of Biological Chemistry, v. 266, n. 23, p. 14850-14853, 1991.
SHEN, D.; NOODEH, A. D.; KAZEMI, A.; GRILLOT, R.; ROBSON, G & BRUHERE, J. Characterisation and expression of phospholipases B from opportunistic fungus
Aspergillus fumigatus. FEMS Microbiology Letters, v. 229, p. 87-93, 2004.
SILVA, V. X. In: The Venomous Reptiles of the Western Hemisphere; Campbell, Ed.: London, 2004; pp. 410-422.