Pós-Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza | Universidade Federal da Paraíba Cidade Universitária - João Pessoa - PB - Brasil - CEP 58059-900 Telefone: (83) 3216 7407 - Fax: (83) 3216 7787 - e-mail: pgbcm@dbm.ufpb.br
VANESSA DE LIMA SERAFIM
SÍNTESE E AVALIAÇÃO ANTI-Leishmania DE NOVOS DERIVADOS HÍBRIDOS TIOFÊNICOS-ACRIDÍNICOS
UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
Pós-Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza | Universidade Federal da Paraíba Cidade Universitária - João Pessoa - PB - Brasil - CEP 58059-900 Telefone: (83) 3216 7407 - Fax: (83) 3216 7787 - e-mail: pgbcm@dbm.ufpb.br
VANESSA DE LIMA SERAFIM
SÍNTESE E AVALIAÇÃO ANTI-Leishmania DE NOVOS DERIVADOS HÍBRIDOS TIOFÊNICOS-ACRIDÍNICOS
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Celular e Molecular do Centro de Ciências Exatas e da Natureza, da Universidade Federal da Paraíba, como parte dos requisitos para obtenção do título de MESTRE EM BIOLOGIA CELULAR E MOLECULAR
Orientador: Profa. Dra. Márcia Rosa de Oliveira Co-orientador: Prof. Dr. Ricardo Olímpio de Moura
Pós-Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza | Universidade Federal da Paraíba Cidade Universitária - João Pessoa - PB - Brasil - CEP 58059-900 Telefone: (83) 3216 7407 - Fax: (83) 3216 7787 - e-mail: pgbcm@dbm.ufpb.br
VANESSA DE LIMA SERAFIM
IV
Dedico
V
AGRADECIMENTOS
A Deus por ter me ajudado a chegar até aqui, por ter me dado esta oportunidade e me dar forças para concluí-la, sem Ele nada seria, nada sou;
Aos meus pais, Aucilene e Valmir e meu irmão Valmir Junior, por nunca desistirem de mim, por lutarem comigo nesta árdua jornada, e por sempre terem acreditado que eu poderia vencer, mesmo com todas as dificuldades que a vida nos impôs;
A toda minha família, pelo apoio e pela torcida, em especial a um anjo, minha tia Lucicleide, que me ajudou a ver a vida com outros olhos, devido a toda sua superação. Obrigada por ser esse exemplo de vida, de garra e perseverança.
Às minhas amigas do laboratório, Mayara, Daiana, Patrícia e Laísa, pela convivência, pelos momentos agradáveis, de apoio, de conversas, brincadeiras, paciência e pela força. Em especial a Patricia que sempre me socorreu ao surgirem às infinitas dúvidas. Obrigada Paty pelas conversas, pela paciência e incentivo (principalmente nos momentos de desespero). E a Klinger pelo auxílio e conhecimento prestados.
Aos colegas do LSVM/UEPB por todos os momentos em que estive de volta ao laboratório para concluir este trabalho, e me sentia como se nunca estivesse saído dele.
Aos colegas da turma do mestrado, pelas discussões e contribuições para o aprendizado durante as aulas e seminários.
Ao meu grande amor, o meu esposo Flávio, pela cumplicidade, compreensão e paciência. Por cada ida ao laboratório, nos fins de semana ou à noite, por sempre torcer a cada experimento finalizado, por nunca me abandonar nos momentos de desespero e por sempre me acalentar. Obrigada por confiar em mim, amo você.
À minha orientadora, profa. Dra. Márcia Rosa de Oliveira, por ter aberto as portas de seu laboratório e ter me ensinado a arte do cuidado de células. Por tudo que aprendi ao longo do mestrado, pelo auxílio, dedicação e compreensão aos imprevistos ocorridos.
Ao meu querido co-orientador e amigo, o prof. Dr. Ricardo Olimpio de Moura, por ter me encaminhado na vida acadêmica, pela paciência e compreensão nos momentos mais difíceis da execução deste trabalho e principalmente pelo conhecimento que me foi passado e pela amizade ao longo destes anos de orientação.
À profa Dra. Sinara Mônica Vitalino de Almeida do LIKA/UFPE, por toda ajuda e colaboração nos experimentos de espectroscopia e fluorescência, e toda a sua receptividade e estadia nos dias em que estive em Recife.
À profa Dra. Maria do Carmo Alves de Lima, por toda colaboração e receptividade no LQIT/UFPE, e por todos os ensinamentos e conselhos.
À Anne Ludmilla pelo auxílio prestado em cada solicitação, informação e dúvidas retiradas. E a Regina Emy, que está auxiliando a pós-graduação. Obrigada por todo profissionalismo. À técnica de laboratório Rosângela pelo auxílio prestado em cada dia de trabalho no laboratório, por cada conversa e ao técnico Bosco, por me socorrer sempre.
Aos professores do mestrado, pela indiscutível contribuição para minha formação. E aos que compõe a banca de avaliação deste trabalho, por toda contribuição para consolidação do mesmo.
VI
“Antes de julgar a minha vida ou o meu caráter... calce os meus sapatos e percorra o caminho que eu percorri, viva as minhas tristezas, as minhas dúvidas e as minhas alegrias. Percorra os anos que eu percorri, tropece onde eu tropecei e levante-se assim como eu fiz. E então, só aí poderás julgar. Cada um tem a sua própria história. Não compare a sua vida com a dos outros. Você não sabe como foi o caminho que eles tiveram que trilhar na vida.”
VII
RESUMO
SERAFIM, V. L. SÍNTESE E AVALIAÇÃO ANTI-Leishmania DE NOVOS DERIVADOS
HÍBRIDOS TIOFÊNICOS-ACRIDÍNICOS. 2016. Dissertação (Mestrado em Biologia Celular e Molecular). Centro de Ciências Exatas e da Natureza, Universidade Federal da Paraíba, João Pessoa –
PB, 2016.
As leishmanioses são um conjunto de doenças causadas por protozoários do gênero Leishmania,
transmitidas por insetos flebotomíneos. Como os tratamentos recomendados são tóxicos e pouco satisfatórios, faz-se necessário encontrar novas drogas, mais eficazes contra o parasito e que tenham
baixa toxicidade para o hospedeiro. Neste contexto, este trabalho buscou sintetizar, elucidar estruturalmente, e avaliar o potencial anti-Leishmania de novos derivados híbridos
tiofênicos-acridínicos frente às formas promastigotas de Leishmania (L.) amazonensis. Neste estudo, foram
avaliados 23 compostos, dos quais 14 derivados são híbridos. A síntese dos compostos apresentou rendimento de 47,7% (ACT06) a 88% (ACT05) para série ACT, e na ACS de 44,8% (ACS05) a 94,9%
(ACS02). Todos os compostos da série ACS apresentaram atividade antipromastigota (IC50 de 3,9 a
30,9 μg/mδ). De modo diferente, os derivados da série ACT não apresentaram atividade antiparasitária. Nenhum dos derivados apresentou citotoxicidade para hemácias de origem humana, comparados às drogas de referência. Os compostos com melhor atividade, ACS01 e ACS02 (IC50 = 3,9 e 4,6 μg/mδ; IS = 205,1 e 173,9 respectivamente) foram selecionados para prosseguir com a investigação. ACS01 e ACS02 foram eficazes contra cepas resistentes ao antimonial trivalente da
mesma forma que nas culturas sensíveis. Além do mais, a atividade do ACS01 não está associada à
fragmentação do DNA do parasito, porém ACS01 e ACS02 apresentaram uma constante de ligação de
104 M-1, demonstrando sua capacidade de intercalação ao DNA. Assim, estes resultados sugerem que os derivados da série ACS são possíveis candidatos a fármacos para a terapêutica das leishmanioses.
Palavras-Chave: Leishmaniose, Leishmania (L.) amazonensis, 2-amino-tiofênicos, acridina, atividade
VIII
ABSTRACT
SERAFIM, V. L. SYNTHESIS AND EVALUATION ANTI-Leishmania OF NEW
DERIVATIVES HYBRIDS ACRIDINES-THIOPHENICS. 2016. Dissertação (Mestrado em Biologia Celular e Molecular). Centro de Ciências Exatas e da Natureza, Universidade Federal da Paraíba, João Pessoa – PB, 2016.
Leishmaniasis is a group of diseases caused by protozoa of the genus Leishmania, transmitted by sand
flies insects. As recommended treatments are toxic and not very satisfactory, it is necessary to find new drugs more effective against the parasite and that have low toxicity to the host. In this context, this study aimed to synthesize, structurally elucidate and evaluate the anti-Leishmania potential novel
hybrids thiophenics-acridines front of promastigotes of Leishmania (L.) amazonensis. In this study, we
evaluated 23 compounds, of which 14 were derived hybrids. The synthesis of compounds had a yield from 47.7% (ACT06) to 88% (ACT05) to ACT series, and ACS series from 44.8% (ACS05) to 94.9%
(ACS02). All compounds of ACS series showed antipromastigote activity (IC50 values from 3.9 to 30.9
µg/mL). Differently, hybrids of ACT series no showed antiparasitic activity. None of the derivatives showed cytotoxicity to erythrocytes of human origin, as compared to reference drug. The compounds with improved activity, ACS01 and ACS02 (IC50 3.9 and 4.6 µg/mL; SI 205.1 and 173.9 respectively)
were selected to proceed with the investigation. ACS01 and ACS02 were effective against strains
resistant trivalent antimony in the same way as in sensitive strains. Furthermore, the activity of ACS01is not associated with parasite DNA fragmentation, but ACS01 and ACS02 showed a binding
constant of 104 M-1, demonstrating their DNA intercalation capacity. Thus, these results suggest that the derivatives of the ACS series are possible drug candidates for the therapy of leishmaniasis.
Keywords: Leishmaniasis, Leishmania (L.) amazonensis, 2-amino-thiophenics, acridine, activity
IX
LISTA DE FIGURAS
Figura 1. Taxonomia de Leishmania sp... 18
Figura 2 Manifestações clínicas da leishmaniose tegumentar e visceral ... 20
Figura 3. Fotomicrografia de diferentes estágios de desenvolvimento de Leishmania sp... 21
Figura 4. Hospedeiro invertebrado de Leishmania sp. ... 22
Figura 5. Reservatórios doméstico e silvestres e de Leishmania sp... 23
Figura 6. Ciclo de vida de Leishmania sp... 24
Figura 7. Estrutura proposta do antimoniato de meglumina e estibogluconato de sódio, respectivamente... 25
Figura 8. Estrutura da Anfotericina B (AmB)... 27
Figura 9. Estrutura da Pentamidina... 27
Figura 10. Estrutura da Miltefosina... 28
Figura 11. Estrutura da Paronomicina... 29
Figura 12. Estruturas do Cetoconazol, Fluconazol e Itraconazol... 30
Figura 13. Estrutura do núcleo acridínico... 33
Figura 14. Estrutura da Amsacrina (m-AMSA)... 34
Figura 15. Estrutura da 4,5-bis(hidroximetil)acridina (B’52)... 35
Figura 16. Estrutura da quinacrina... 36
Figura 17. Estrutura do anel tiofênico... 36
Figura 18. Experimento de atividade antipromastigota com Leishmania (L.) amazonensis... 44
Figura 19. Ilustração da avaliação da atividade antipromastigota, por dois diferentes métodos colorimétricos na presença de drogas de referência: o antimonial trivalente e a anfotericina B... 63
Figura 20. Ilustração da redução enzimática do MTT em formazan por enzimas celulares.... 65
Figura 21. Diferença estrutural entre os dois núcleos acridínicos utilizados para hibridação molecular... 78
Figura 22. Diferença entre os núcleos tiofênicos-acridínicos da série ACS... 79
Figura 23. Formas promastigotas de L. (L.) amazonensis tratados com diferentes concentrações de derivados híbridos tiofênicos-acridínicos da série ACS... 80
Figura 24. Formas promastigotas de L. (L.) amazonensis tratados com diferentes concentrações de derivados híbridos tiofênicos-acridínicos da série ACT... 81
Figura 25. Ilustração do ensaio de avaliação da atividade hemolítica dos derivados híbridos tiofênicos-acridínicos da série ACT... 85
Figura 26. DNA genômico de L. (L.) amazonensis tratados com diferentes concentrações do derivado híbridos tiofênico-acridínico ACS01 em gel de agarose (1%)... 95
Figura 27. Espectro de absorção dos derivados híbridos tiofênicos-acridínicos ACS01 e ACS02... 97
X
LISTA DE TABELAS
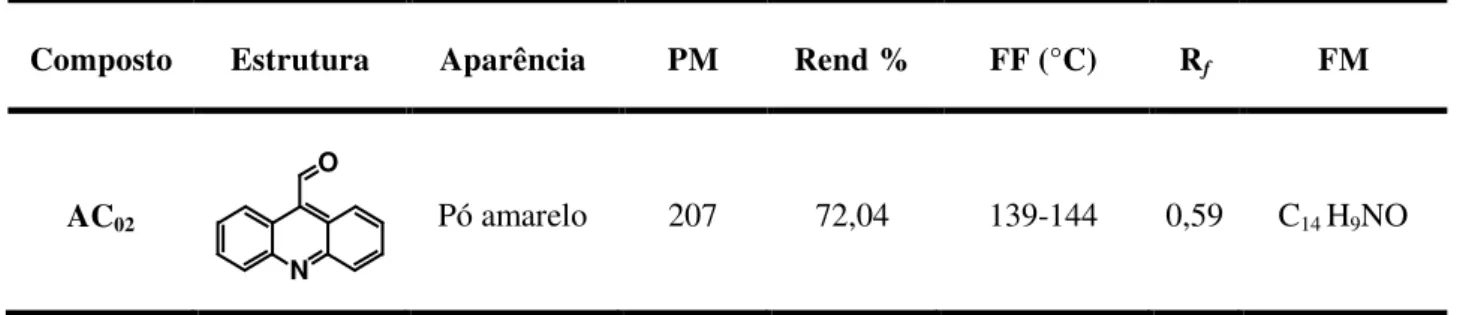
Tabela 1. Acridina-9-carboxaldeído e suas respectivas características físico-químicas... 53
Tabela 2. Compostos da série ACT sintetizados e suas respectivas características físico-químicas... 54
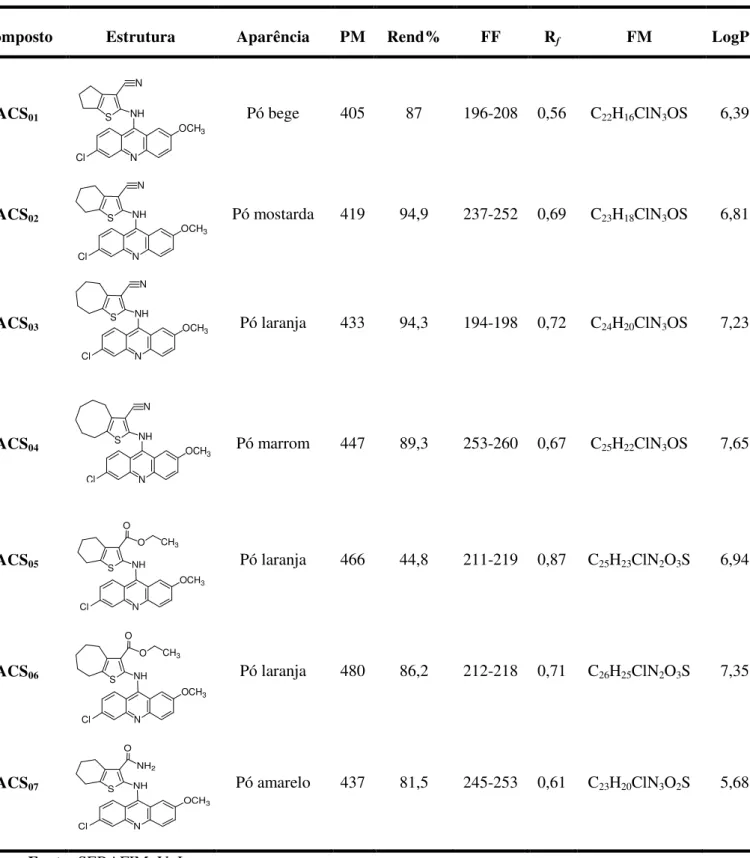
Tabela 3. Compostos da série ACS sintetizados e suas respectivas características físico-químicas... 56
Tabela 4. Dados dos espectros de RMN 1H ( em ppm)...... 57
Tabela 5. Dados dos espectros de RMN 1H( em ppm) da série ACS... 58
Tabela 6. Dados dos espectros de RMN 13C( em ppm) da série ACS... 59
Tabela 7. Dados de IV da série ACT... 60
Tabela 8. Dados de IV da série ACS... 60
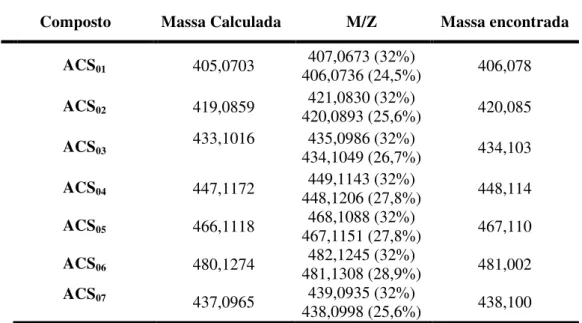
Tabela 9. Dados das massas exatas dos íons moleculares. Valores obtidos e calculados... 61
Tabela 10. Valores da atividade antipromastigota mensurados pelos ensaios com MTT, Resazurina e quantificação direta em câmara de Neubauer... 67
Tabela 11. Concentração inibitória de 50% do crescimento (IC50) de promastigotas de L. (L.) amazonensis de dois derivados acridínicos... 69
Tabela 12. Concentração inibitória de 50% do crescimento (IC50) de promastigotas de L. (L.) amazonensis de derivados 2-amino-tiofênicos... 71
Tabela 13. Concentração inibitória de 50% do crescimento (IC50) de promastigotas de L. (L.) amazonensis de derivados híbridos tiofênicos acridínicos da série ACT... 74
Tabela 14. Concentração inibitória de 50% do crescimento (IC50) de promastigotas de L. (L.) amazonensis de derivados híbridos tiofênicos acridínicos da série ACS... 77
Tabela 15. Concentração inibitória de 50% do crescimento (IC50) de promastigotas de L. (L.) amazonensis na presença de diferentes concentrações das drogas de referência: antimonial trivalente, anfotericina B e glucantime... 83
Tabela 16. Concentração capaz de promover 50% de hemólise (HC50), das drogas de referencia: Antimonial trivalente, Anfotericina B e Glucantime... 90
Tabela 17. Concentração inibitória de 50% do crescimento (IC50) de promastigotas de L. (L.) amazonensis, concentração capaz de promover 50% de hemólise (HC50) e índice de seletividade (IS = HC50/IC50) de derivados acridínicos e drogas de referência... 91
Tabela 18. Concentração inibitória de 50% do crescimento (IC50) de derivados híbridos tiofênicos-acridínicos sobre promastigotas de L. (L.) amazonensis resistente e sensível ao Antimonial trivalente... 94
XI
LISTA DE ESQUEMAS
XII
LISTA DE GRÁFICOS
Gráfico 1. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações das drogas de referência: antimonial trivalente e anfotericina B por quantificação direta em câmara de Neubauer... 62 Gráfico 2. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações de Antimonial trivalente e Anfotericina B, avaliada pelos ensaios colorimétricos com MTT e Resazurina... 64 Gráfico 3. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações dos derivados acridínicos AC02 e ACS... 68
Gráfico 4. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações dos derivados 2-amino-tiofênicos... 70
Gráfico 5. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações dos derivados híbridos tiofênicos-acridínicos da série ACT... 73 Gráfico 6. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações dos derivados híbridos tiofênicos-acridínicos da série ACS... 76 Gráfico 7. Inibição do crescimento das formas promastigotas de L. (L.) amazonensis na
presença de diferentes concentrações das drogas de referência: Antimonial trivalente, Anfotericina B e Glucantime... 82 Gráfico 8. Viabilidade celular de hemácias na presença de diferentes concentrações dos dois
derivados acridínicos... 84 Gráfico 9. Viabilidade celular de hemácias na presença de diferentes concentrações dos
derivados 2-amino-tiofênicos... 86 Gráfico 10. Viabilidade celular de hemácias na presença de diferentes concentrações dos
derivados híbridos tiofênicos-acridínicos da série ACT... 86 Gráfico 11. Viabilidade celular de hemácias na presença de diferentes concentrações dos
derivados híbridos tiofênicos-acridínicos da série ACS... 87 Gráfico 12. Viabilidade celular de hemácias na presença de diferentes concentrações das
drogas de referencia: Antimonial trivalente, Anfotericina B e Glucantime... 89 Gráfico 13. Atividade anti-Leishmania do derivado híbrido tiofênico-acridínico ACS01 sobre
formas promastigotas de L. (L.) amazonensis sensíveis e resistentes ao Antimonial
trivalente... 92 Gráfico 14. Atividade anti-Leishmania do derivado híbrido tiofênico-acridínico ACS02 sobre
formas promastigotas de L. (L.) amazonensis sensíveis e resistentes ao Antimonial
XIII
LISTA DE SIGLAS, ABREVIATURAS E FÓRMULAS MOLECULARES
AC02 Acridina-9-carboxaldeído
AcOEt Acetato de Etila AcOH Ácido Acético
ACS 6,9-dicloro-2-metóxi-acridina AmB Anfotericina B
ANOVA Análise de Variância
BOD Estufa de demanda biológica de oxigênio CCD Cromatografia Analítica em Camada Delgada DMSO Dimetilsulfóxido
DMSO-d6 Dimetilsulfóxido deuterado
DNA Ácido desoxirribonucléico (desoxiribonucleic acid) DPA N-N-difenilamina
DSS Dodecil Sulfato de Sódio
EC50 Concentração efetiva capaz de diminuir em 50% a viabilidade celular
EtOH Etanol
F.F Faixa de fusão
HC50 Concentração capaz de causar de 50% de hemólise
IC50 Concentração capaz de inibir de 50% de crescimento
IS Índice de Seletividade LC Leishmaniose Cutânea LCD Leishmaniose Cutânea Difusa LCDS Leishmaniose Cutânea Disseminada LM Leishmaniose Mucocutânea
LTA Leishmaniose Tegumentar Americana LV Leishmaniose Visceral
MHz Megahertz
MTT 3-(4,5-dimetil-2-tiazol)-2,5-difenil-2H-brometo de tetrazólio
OMS Organização Mundial da Saúde
PBS Tampão Fosfato Salino (phosphate buffered saline) PCC Clorocromato de Piridínio
Rf Fator de Retenção
RMN 13C Ressonância Magnética Nuclear de Carbono
RMN ¹H Ressonância Magnética Nuclear de Hidrogênio SBF Soro Bovino Fetal
SbIII Antimonial Trivalente SbV Antimonial Pentavalente
UEPB Universidade Estadual da Paraíba UFPB Universidade Federal da Paraíba UFPE Universidade Federal de Pernambuco
WHO Organização Mundial da Saúde (World Health Organization) ZnCl2 Dicloreto de zinco
XIV
SUMÁRIO RESUMO
ABSTRACT
LISTA DE FIGURAS LISTA DE ESQUEMAS LISTA DE TABELAS LISTA DE GRÁFICOS LISTA DE SIGLAS
1. INTRODUÇÃO... 16
1.1 Doenças tropicais negligenciadas: Leishmanioses... 16
1.2 Ciclo de vida de Leishmania sp... 21
1.3 O tratamento das Leishmanioses... 25
1.4 Resistência aos antimoniais... 30
1.5 A importância do planejamento de fármacos na descoberta de novos agentes.... 31
1.6 Derivados acridínicos e sua importância farmacológica... 33
1.7 Derivados tiofênicos e sua importância farmacológica... 36
1.8 Hibridação molecular como ferramenta utilizada na Química Medicinal na busca de novos fármacos... 38
2. OBJETIVOS... 39
2.1 Objetivo geral... 39
2.2 Objetivos específicos... 39
3. MATERIAL E MÉTODOS... 40
3.1 Síntese e caracterização dos compostos... 40
3.2 Preparo das soluções dos derivados avaliados... 43
3.3 Parasitos e sua manutenção in vitro... 43
3.4 Avaliação da atividade antipromastigota e determinação da concentração que inibe 50% do crescimento dos parasitos (IC50)... 44
3.5 Avaliação da atividade antipromastigota por diferentes métodos colorimétricos: MTT e Resazurina... 45
3.5.1 Ensaio com MTT... 45
3.5.2 Ensaio com Resazurina... 46
3.6 Avaliação da atividade hemolítica com suspensão de células mononucleares (CMN) de sangue periférico humano... 47
3.6.1 Obtenção de eritrócitos e células mononucleares (CMN) de sangue periférico humano... 47
3.6.2 Avaliação da atividade hemolítica... 47
XV
3.8 Avaliação da atividade antipromastigota e determinação da concentração que inibe 50% do crescimento dos parasitos (IC50) de cepas resistentes de L. (L.)
amazonensis frente ao antimonial trivalente... 48
3.9 Análise de fragmentação de DNA por eletroforese em gel de agarose... 49
3.10 Estudos da interação ao DNA... 50
3.10.1 Espectroscopia Eletrônica de Absorção de UV/v... 50
3.10.2 Espectroscopia de emissão de Fluorescência... 51
3.11 Análise estatística... 52
4. RESULTADOS E DISCUSSÃO... 53
4.1 Síntese e caracterização dos novos derivados híbridos tiofênicos-acridínicos.... 53
4.2 Avaliação da atividade antipromastigota de drogas de referência sobre Leishmania (L.) amazonensis por diferentes métodos... 62
4.3 Avaliação da atividade antipromastigota de novos derivados híbridos tiofênicos-acridínicos... 67
4.3.1 Avaliação da atividade antipromastigota de derivados 2-amino-tiofênicos e núcleos acridínicos sobre Leishmania (L.) amazonensis... 67
4.3.2 Avaliação da atividade antipromastigota de derivados híbridos tiofênicos-acridínicos da série ACT sobre Leishmania (L.) amazonensis... 72
4.3.3 Avaliação da atividade antipromastigota de derivados híbridos tiofênicos-acridínicos da série ACS sobre Leishmania (L.) amazonensis... 75
4.4 Atividade anti-Leishmania das drogas de referência Anfotericina B®; Glucantime® e Antimonial trivalente... 81
4.5 Avaliação da citotoxidade dos derivados híbridos tiofênicos-acridínicos para células de mamíferos: investigação da atividade hemolítica sobre hemácias de origem humana... 83
4.5.1 Atividade hemolítica dos derivados 2-amino-tiofênicos, núcleos acridínicos e derivados híbridos tiofênicos-acridínicos... 84
4.5.2 Atividade hemolítica das drogas de referência Anfotericina B®; Glucantime® e Antimonial trivalente... 89
4.6 Índice de seletividade... 90
4.7 Avalição da atividade anti-Leishmania de derivados híbridos tiofênicos-acridínicos sobre cepas resistentes de L. (L.) amazonensis resistentes ao antimonial trivalente... 92
4.8 Avaliação da fragmentação de DNA de Leishmania (L.) amazonensis na presença de derivados tiofênicos-acridínicos... 94
4.9 Análise da interação ao DNA de novos derivados tiofênicos-acridínicos... 95
5. CONCLUSÕES... 100 REFERÊNCIAS...
SERAFIM, V. L. Introdução 16
1. INTRODUÇÃO
1.1 Doenças tropicais negligenciadas: Leishmanioses
O termo "doença negligenciada" data da década de 70 e refere-se a um grupo de doenças causadas por agentes infecciosos e parasitários. A adoção deste adjetivo tomou como base o fato de que tais enfermidades não despertam o interesse das grandes empresas farmacêuticas para a produção de medicamentos e vacinas, pelo motivo de acometerem principalmente populações pobres e de países subdesenvolvidos. Neste sentido, a pesquisa neste setor não conta com recursos suficientes, o que gera a escassez dos métodos de profilaxia disponíveis em todo o mundo (SOUZA, 2010; SANTOS et al., 2012; WHO/TDR, 2015; MARTINS-MELO et al., 2016).
As doenças tropicais negligenciadas (DTNs) são um grupo de diversas doenças transmissíveis que prevalecem em condições tropicais e subtropicais em 149 países.Dentre as DTNs, as mais comuns são: dengue, doença de Chagas, esquistossomose, hanseníase, leishmanioses, malária e tuberculose (SOUZA, 2010; BRASIL, 2010; WHO/TDR, 2015).
Segundo dados da Organização Mundial da Saúde (OMS), mais de um bilhão de pessoas apresentam uma ou mais doenças negligenciadas, o que representa um sexto da população mundial. Elas afetam principalmente as populações que vivem em condições de pobreza, sem saneamento adequado e em estreito contato com vetores infecciosos, animais domésticos e gado (WHO, 2015).
O Brasil é responsável por uma grande proporção das DTNs que ocorrem na América Latina, incluindo a hanseníase (86%), dengue (40%), a esquistossomose (96%), doença de Chagas (25%), leishmaniose cutânea (39%) e leishmaniose visceral (93%), ocorrendo em populações com baixo status socioeconômico e principalmente no norte e nordeste do país
(MARTINS-MELO et al., 2016).
Dentre o grupo das DTNs, as leishmanioses têm se destacado em todo o mundo, pois se revelam como a segunda maior incidência mundial parasitária, logo após a malária, ao qual possui um alto índice de mortalidade e morbidade.
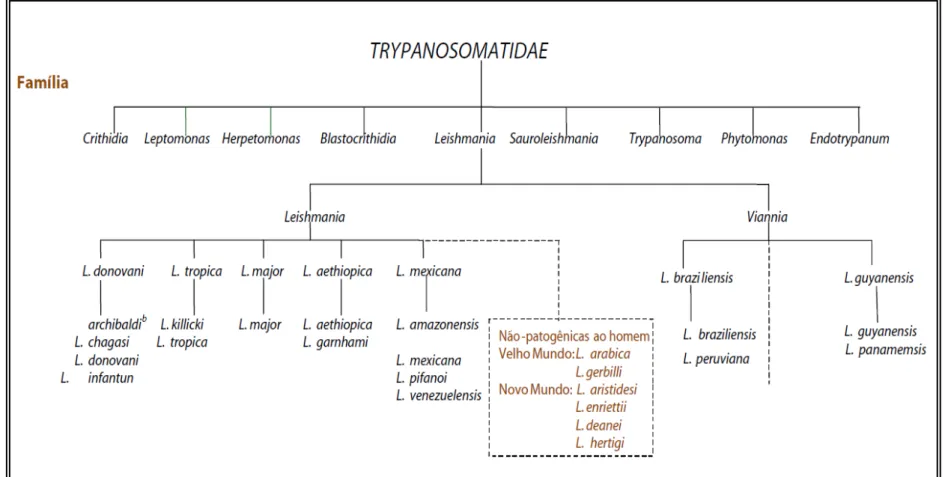
As leishmanioses são um complexo de doenças infecto-parasitárias, causadas por mais de vinte espécies de protozoários pertencentes ao sub-Reino Protozoa, ao Filo Sarcomastigophora à ordem Kinetoplastida, à família Trypanosomatidae e ao gênero
SERAFIM, V. L. Introdução 17
subgêneros: Leishmania e Viannia (figura 1), ao qual essa divisão é definida de acordo com o local de desenvolvimento das formas promastigotas no inseto vetor: no subgênero Leishmania o desenvolvimento ocorre no intestino médio; já no subgênero Viannia o desenvolvimento ocorre no intestino posterior (LAISON; SHAW, 1987).
As leishmanioses tem ampla distribuição, são endêmicas em 88 países ou territórios, ocorrendo principalmente na Ásia, na Europa, no Oriente Médio, na África e nas Américas afetando aproximadamente 12 milhões de pessoas. Porém o alcance geográfico destas patologias se eleva continuamente, pois existe o risco de aproximadamente 350 milhões de pessoas de contraí-las nas áreas endêmicas (HUSSAIN et al., 2014; WHO, 2015; WHO/TDR, 2015).
Dados da OMS mostram que a incidência anual de pessoas infectadas com o parasito seja de aproximadamente 1,3 milhões, sendo que 500 mil destes são da forma visceral. Destes 500 mil casos, entre 20 e 30 mil casos evoluem até a morte (HUSSAIN et al., 2014; WHO/TDR, 2015).
No Brasil, dados do Ministério da Saúde indicam que no período de 2000 a 2013, foram notificados 24.694 casos anuais de leishmaniose tegumentar e, atualmente, as leishmanioses estão registradas todos os estados, apresentando transmissão autóctone em cerca de 1.684 municípios em 2013 (BRASIL, 2015).
Para o desenvolvimento das diferentes formas clínicas das leishmanioses, diversos fatores podem influenciá-los. Dentre eles podemos destacar a espécie de Leishmania presente na infecção (infectividade, patogenicidade e virulência), os fatores ambientais, além da capacidade de resposta imunológica e constituição genética do hospedeiro vertebrado (BOGDAN et al., 1996; ALEXANDER et al., 1999; MURRAY et al., 2005; GOTO; LINDOSO, 2012; WHO, 2015).
SERAFIM, V. L. Introdução 18
Figura 1. Taxonomia de Leishmania sp.
SERAFIM, V. L. Introdução 19
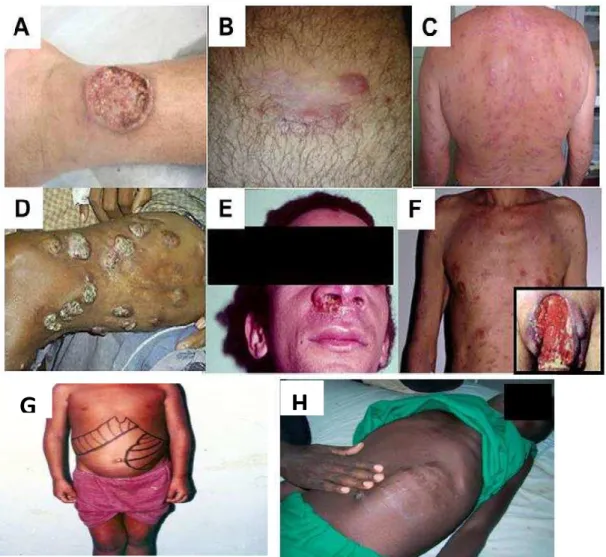
A LT é caracterizada por infecção limitada à derme, apresentando cinco tipos básicos de forma clínica: leishmaniose cutânea localizada (LCL), cutânea recidiva (LR), cutânea difusa (LCD), cutânea disseminada (LD), mucocutânea (LMC). No continente americano, as formas de LT são também genericamente designadas como Leishmaniose Tegumnetar Americana (LTA). (GOTO; LINDOSO, 2012).
A LCL apresenta como característica principal lesão típica, úlcera indolor, de borda elevada e fundo granuloso, podendo ser única ou múltipla (até 10 lesões) (figura 2A). Causada principalmente pela espécie Leishmania (Viannia) braziliensis e, em menor escala, pela espécie Leishmania (Leishmania) amazonensis, apresentando tendência à cura espontânea em aproximadamente 2 a 15 meses. Alguns pacientes imunodeprimidos ficam mais susceptíveis a apresentar a LC, com múltiplas lesões atípicas (figura 2 F).
A LR é mais prevalente no Velho Mundo (associada com infecção por L. (L.) tropica), mas também foi observada no Novo Mundo, associada a L. (V.) braziliensis e L. (L.) amazonensis. Caracterizada por uma lesão ativa (ou próxima) a borda da lesão curada ou uma cicatriz (figura 2B) que se desenvolve com ou sem tratamento após um período de tempo variável.
A LD apresenta-se como úlceras múltiplas e pequenas (10-300 lesões) em diversas áreas do corpo, resultantes da disseminação hematogênica ou linfática, geralmente encontrada em pacientes imunosuprimidos (figura 2C). Essas formas são causadas principalmente pelas espécies L. (V.) braziliensis, L. (V.) guyanensis, L. (V.) lainsoni e L. (L.) amazonensis.
A LCD (figura 2D) caracteriza-se por lesões nodulares não-ulceradas, precedidas por úlcera única que evolui com disseminação linfática do parasito. Esta é uma manifestação rara e grave da LTA que ocorre geralmente em pacientes considerados anérgicos, com deficiência específica na resposta imune celular a antígenos de Leishmania.
SERAFIM, V. L. Introdução 20
Figura 2. Manifestações clínicas da leishmaniose tegumentar e visceral.
Fonte: BRASIL, 2006; GOTO; LINDOSO, 2012. (A) LCL, caracterizada por lesão única de borda elevada e fundo granulomatoso na região maleolar externa; (B) LR, apresenta pápulas e vesículas ao redor da lesão curada da leishmaniose cutânea na perna;. (C) LD, apresenta múltiplas lesões pequenas e ulceradas nas costas; (D) LCD apresenta lesões tumorais e nódulos associados com crostas e várias cicatrizes de lesões anteriores na coxa esquerda. (E) LMC, apresenta destruição parcial da região nasolabial; (F) leishmaniose cutânea atípica em paciente infectado com o vírus da imunodeficiência humana apresentando múltiplas máculas no tórax e abdômen. (Inserção em F) úlcera no pênis de um paciente com síndrome da imunodeficiência adquirida. (G) LV na fase inicial; (H) LV no período final, caracterizada pela intensa desnutrição e hepatoesplenomegalia.
A LV, também conhecida como calazar (do indu kala-azar: kala = negra, azar = febre; termo empregado em virtude do discreto aumento da pigmentação da pele durante a doença em alguns pacientes), caracteriza-se por febre alta, substancial perda de peso, pancitopenia, acometimento das vísceras do hospedeiro pelo parasito, apresentando organomegalia especialmente no fígado e baço (CHAPPUIS et al., 2007). No Brasil, ela é causada principalmente pela espécie L. (L.) chagasi, sinonímia de L. (L.) infantum (MCGWIRE; SATOSKAR, 2014).
SERAFIM, V. L. Introdução 21
No estado inicial da doença, chamada de “aguda” por alguns autores, caracteriza o início da sintomatologia que pode variar de paciente para paciente, mas na maioria dos casos inclui febre com duração inferior a 4 semanas, palidez cutâneo-mucosa e hepatoesplenomegalia. O estado geral do paciente está preservado, o baço geralmente não ultrapassa a 5 cm do rebordo costal esquerdo (figura 2G). Já o período de estado caracteriza-se por febre irregular, associada a emagrecimento progressivo, palidez cutâneo-mucosa e aumento da hepatoesplenomegalia. Apresenta um quadro clínico arrastado geralmente com mais de 2 meses de evolução, na maioria das vezes associado a comprometimento do estado geral (figura 2H). Caso não seja feito o diagnóstico e tratamento, a doença evolui progressivamente para o período final, com febre contínua e comprometimento mais intenso do estado geral. Instala-se a desnutrição, edema dos membros inferiores, e diferentes tipos de hemorragias, icterícia e ascite (BRASIL, 2006).
1.2 Ciclo de vida de Leishmania sp
O protozoário Leishmania é um parasito que apresenta um ciclo de vida heteroxênico, onde há alternância entre dois estágios morfológicos, a forma extracelular promastigota, que é fusiforme, apresenta núcleo central e possui flagelo, organela relacionada à locomoção do parasito no tubo digestivo do inseto (envolve um hospedeiro invertebrado), e a forma amastigota, que é ovalada, não apresenta flagelo visível e é encontrada no interior dos fagolisossomos dos macrófagos (envolve um hospedeiro vertebrado) (FRAGA et al., 2010). Estes dois estágios estão representados na figura 3.
Figura 3. Fotomicrografia de diferentes estágios de desenvolvimento de Leishmania sp.
Fonte: Laboratório de Leishmanioses-DBM-UFPB. (A) cultura de promastigotas de Leishmania (L.) chagasi. Coloração hematológica panótico rápido. Aumento: 1000x. (B) Fotomicrografia do aspirado de medula óssea humana. Macrófago (MØ) infectado com formas amastigotas de Leishmania. Coloração hematológica panótico rápido. AF: 1000x.
A
B
SERAFIM, V. L. Introdução 22
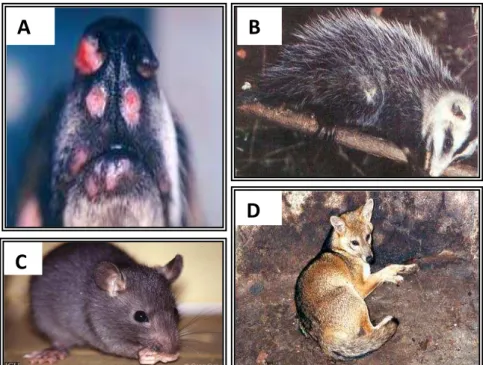
Os hospedeiros invertebrados são flebotomíneos hematófagos do gênero Lutzomyia, no Novo Mundo, ou Phlebotomus, no Velho Mundo (figura 4), com vasta distribuição nos climas quentes e temperados (ROBERTS; JANOVY, 2000; DE ALMEIDA et al., 2003). Esses pequenos dípteros têm preferência por lugares úmidos e quentes. Estima-se que existam cerca de 400 espécies de flebotomíneos nas Américas, sendo que 50 dessas parecem estar envolvidas na transmissão da Leishmania (KILLICK-KENDRICK, 1999). São apenas as fêmeas dos flebotomíneos infectados que transmitem todas as espécies de Leishmania (GOMES; OLIVEIRA, 2012). Estes são popularmente conhecidos, como mosquito-palha, tatuquira, birigui, asa dura, asa branca, cangalha, cangalhinha, ligeirinho, péla-égua, entre outros.
Figura 4. Hospedeiro invertebrado de Leishmania sp.
Fonte: BRASIL, 2006. (A) Phlebotomuspapatasi; (B) Lutzomyia longipalpis;
Além de um vetor invertebrado, o parasito necessita de um hospedeiro vertebrado que atua como reservatório. Dentre esses, temos uma ampla variedade de roedores, canídeos, marsupiais e humanos (figura 5). Geralmente o homem participa do ciclo de transmissão como um hospedeiro acidental, quando entra em ambientes de alta transmissão, onde a doença se mantém em função dos reservatórios naturais (MOLYNEUX; KILLICK-KENDRICK, 1987; BRASIL, 2007).
No hospedeiro invertebrado, o ciclo se inicia quando o vetor (flebotomíneo fêmea) se infecta ao ingerir sangue de um hospedeiro vertebrado contendo macrófagos que possuem amastigotas (pequenas com aproximadamente 3-5 mm) no seu interior. Após a lise do macrófago infectado as amastigotas transformam-se em promastigotas, as quais aderem às microvilosidades do intestino médio do inseto. As alterações das condições, a partir da mudança do hospedeiro mamífero para o intestino médio do flebotomíneo (tais como
F
SERAFIM, V. L. Introdução 23
diminuição da temperatura e aumento do pH) desencadeiam esta transformação morfológica e seu desenvolvimento no vetor. Nesta fase, os parasitos são denominados procíclicos, e caracterizam-se por se multiplicarem rapidamente por divisão binária, transformando-se, após alguns dias em promastigotas metacíclicos, que são muito móveis e não têm a capacidade de se dividir (DOSTÁLOVÁ; VOLF, 2012).
Os promastigotas metacíclicos, infectantes, migram para a probóscide do inseto e são injetados com a saliva durante o próximo repasto sanguíneo. No momento da picada, o flebotomíneo fêmea regurgita os parasitos na derme do hospedeiro vertebrado, juntamente com a sua saliva, facilitando o processo de infecção do parasito (SACKS; KAMHAWI, 2001; GOMES; OLIVEIRA, 2012; DOSTÁLOVÁ; VOLF, 2012).
Figura 5. Reservatórios doméstico e silvestres e de Leishmania sp.
Fonte: BRASIL. 2007. (A) cão doméstico - Canis familiaris; (B) Marsupial - Didelphis albiventri; (C)
Roedor - Rattus rattus; (D) Raposa - Dusicyon vetulus;
Os promastigotas inoculados sobrevivem aos mecanismos de defesa inatos do hospedeiro e então infectam os macrófagos. Dentro dos macrófagos forma-se o fagolisossomo, onde as formas promastigotas metacíclicas sobrevivem e estabelecem as condições favoráveis para a diferenciação em amastigotas, que se dividem, lisam o macrófago e infectam novas células, repetindo o ciclo (SACKS; KAMHAWI, 2001; PEREIRA; SACRAMENTO; MARQUES, 2011), conforme mostrado na figura 6.
A
B
C
SERAFIM, V. L. Introdução 24
A sobrevivência intracelular do parasito pode estar relacionada à rapidez de sua transformação em amastigota (LEWIS, 1974), uma vez que estas formas encontram-se melhor dotadas bioquimicamente e enzimaticamente para resistirem aos mecanismos leishmanicidas dos macrófagos (PEARSON et al., 1983; CASTELLANO, 2005; PEREIRA; SACRAMENTO; MARQUES, 2011).
Figura 6. Ciclo de vida de Leishmania sp.
Fonte: Centers for Disease Control and Prevention (CDC), 2015. Parasitos do gênero Leishmania são
SERAFIM, V. L. Introdução 25
1.3 O tratamento das Leishmanioses
Atualmente, não há vacinas contra as leishmanioses que acometem seres humanos. As medidas mais utilizadas para o combate da enfermidade se baseiam no controle dos vetores e dos reservatórios, proteção individual, diagnóstico precoce e tratamento dos doentes, manejo ambiental e educação em saúde. Apesar de toda profilaxia, ainda existe uma expansão geográfica da doença (BRASIL, 2006).
O tratamento das leishmanioses é baseado principalmente na quimioterapia, ao qual se iniciou com o uso dos antimoniais trivalentes (SbIII). No Brasil, foi apenas em 1913 que o médico Gaspar Viana, utilizou pela primeira vez o SbIII, o chamado tártaro emético (tartarato de potássio e antimônio), obtendo resultados promissores, pois naquela época 90% dos casos de LV evoluíam para o óbito por não haver tratamento adequado (DAVIDSON, 1998). No entanto, esta formulação apresentava grande toxicidade para o hospedeiro, além de sua difícil administração. Assim, em 1937, o estibogluconato de sódio [Pentostan®, um derivado do ácido estibônico, em que o antimônio está na sua forma pentavalente (SbV)] foi utilizado, também por via intramuscular, reduzindo os efeitos colaterais e a toxicidade (SUNDAR; OLLIARO, 2007). Observando-se que uma pequena modificação molecular, favorece a redução de efeitos colaterais e melhora a atividade farmacológica, como observado na figura 7, a mudança estrutural de SbIII para SbV (FRÉZARD; DEMICHELI; RIBEIRO, 2009).
Figura 7. Estrutura proposta do antimoniato de meglumina e estibogluconato de sódio, respectivamente.
Fonte: FRÉZARD; DEMICHELI; RIBEIRO, 2009. Estrutura proposta do antimoniato de meglumina e estibogluconato de sódio, respectivamente.
SERAFIM, V. L. Introdução 26
antimoniato de meglumina (Glucantime ®) e o estibogluconato de sódio ou gluconato de antimônio (V) sódico (Pentostan®), aos quais são as drogas de referência tanto no tratamento da LV quanto da LT. Uma ressalva é que, no Brasil, o Pentostan® não é utilizado (RATH et al., 2003; BRASIL, 2007).
No Brasil o Glucantime® é a droga de escolha e sua dose recomendada para LC varia entre 10 e 20 mg/SbV/kg/dia durante 20 dias; para tratamento das lesões mucosas recomenda-se 20 mg/SbV/Kg/dia durante 30 dias recomenda-seguidos (BRASIL, 2007). Para o tratamento da LV recomenda-se o uso de 20 mg/SbV/Kg/dia com aplicação endovenosa ou intramuscular no período de 20 a 40 dias (BRASIL, 2006).
Mesmo sendo utilizados até hoje, o mecanismo de ação dos antimoniais ainda não foi claramente elucidado. Alguns estudos sugerem que, in vitro, os macrófagos promovam o acúmulos dos SbVs, e possivelmente inibam as enzimas da via glicolítica e da oxidação de ácidos graxos do parasito. Outra possibilidade seria a de ligação com sítios sulfidrílicos, resultando na morte dos parasitos. Estudos recentes sugerem que os SbVs atuem como pró-fármacos, sendo convertidos em SbIIIs. Os SbIIIs inibem a enzima tripanotiona redutase in vitro e, desta forma induzem a perda de tióis intracelulares, promovendo desequilíbrio fatal na homeostase desses grupos, levando ao acúmulo de espécies reativas de oxigênio. Alguns autores mencionam que os antimoniais matam os parasitos por mecanismos de apoptose (FRÉZARD; DEMICHELI; RIBEIRO, 2009; TEMPONE et al., 2010; SOUZA et al., 2010; SANTOS, 2012).
Uma das principais desvantagens do uso dos antimoniais são os diversos efeitos colaterais, devido a sua ação sobre o sistema cardiovascular, havendo outros efeitos também como: insuficiência renal, icterícia, elevação das enzimas hepáticas, hepatotoxicidade e pancreatite, dentre outras complicações (OLIVEIRA et al., 2011).
Em consequências aos efeitos colaterais em alguns pacientes, bem como a falta de resposta satisfatória ao tratamento utilizando os SbVs, e resistência do parasito, existem os chamados fármacos de segunda escolha: a Anfotericina B®, a Pentamidina e a Miltefosina e Paromomicina (TIUMAN et al., 2011).
SERAFIM, V. L. Introdução 27
Figura 8. Estrutura da Anfotericina B (AmB).
Fonte: FALCI; PASQUALOTTO, 2015. Estrutura da Anfotericina B (AmB).
O mecanismo de ação envolve a interação com alguns esteróis de membrana (o ergosterol), assim a AmB age alterando a permeabilidade celular dos parasitos, levando a morte celular. Porém, a toxicidade dessa droga provavelmente está relacionada com a semelhança entre o ergosterol de membrana da Leishmania e colesterol de células de mamíferos, limitando seu uso na prática clínica (NAGLE et al., 2014; HUSSAIN et al., 2014; KOTB ELMAHALLAWY; AGIL, 2015). Com o intuito de se reduzir a toxicidade apresentada pela AmB, a incorporação em formulações lipossomais reduzem significativamente sua toxicidade e efeitos colaterais porém, o alto custo de sua formulação é um fator limitante para o uso desses medicamentos, especialmente nos países em desenvolvimento (KOTB ELMAHALLAWY; AGIL, 2015).
A Pentamidina (figura 9) é uma diamina aromática, utilizada no tratamento da LV (KOTB ELMAHALLAWY; AGIL, 2015).
Figura 9. Estrutura da Pentamidina.
Fonte: (NAGLE et al., 2014). Estrutura da Pentamidina.
SERAFIM, V. L. Introdução 28
transportadores de diamina de alta afinidade e tem como principal alvo a mitocôndria, causando modificação da ubiquitina. A alta toxicidade dessa droga é um fator limitante para seu uso. Alguns efeitos como hipoglicemia, hipotensão, alterações cardiológicas, nefrotoxicidade, náuseas, vômitos, dor de cabeça, fadiga e até mesmo morte repentina foram descritas (NAGLE et al., 2014; HUSSAIN et al., 2014; KOTB ELMAHALLAWY; AGIL, 2015.).
A Miltefosina (figura 10), registrada como Impavido®, uma hexadecilfosfocolina, utilizada como no tratamento do câncer, tem sido utilizada no tratamento da LV (SUNDAR; OLIARO, 2007; KOTB ELMAHALLAWY; AGIL, 2015).
Figura 10. Estrutura da Miltefosina.
Fonte: (NAGLE et al., 2014). Estrutura da Miltefosina.
Diferentemente dos demais tratamentos, a Miltefosina é oralmente administrada. O seu mecanismo de ação não é precisamente conhecido, porém está associada com o envolvimento de um transportador putativo de miltefosina (LdMT), e a translocação de fosfolipídios em Leishmania. Ela também estimula a resposta imune leishmanicida por produção IFN-gamma pela óxido nítrico-sintetase indutível 2 (iNOS2) da célula hospedeira, e, por conseguinte, catalisa a geração de óxido nítrico (NO), que mata o parasito no interior do macrófago. E também pode causar morte celular programada, pela via mitocondrial dependente da sua interação com componentes de membrana, que afeta as vias de sinalização de células que causam a modulação de receptores de superfície celular, metabolismo do inositol, inibição da proteína cinase C e outras vias mitogênicas e, consequentemente desencadeia o circuito apoptótico (KOTB ELMAHALLAWY; AGIL, 2015).
SERAFIM, V. L. Introdução 29
A Paromomicina (figura 11) é um aminoglicosídeo utilizado por via oral no tratamento de criptosporidíase, amebíase, giardíase e topicamente para tricomoníase. Sua atividade anti-Leishmania foi identificado em 1960 (KOTB ELMAHALLAWY; AGIL, 2015).
Figura 11. Estrutura da Paronomicina.
Fonte: (NAGLE et al., 2014). Estrutura da Paronomicina.
Formulações tópicas com paromomicina são eficazes para casos de LTA. Seu mecanismo de ação consiste na inibição de síntese proteica, através de ligação às proteínas ribossômicas induzindo a leitura equivocada do RNAm. Desta forma, interfere no complexo de formação de peptídeos causando ruptura dos polissomos em monossomos não funcionais. Efeitos tóxicos, como nefrotoxicidade e ototoxicidade são associados com excessos de doses recomendadas e uso concomitante de outros agentes com toxicidades similares (NAGLE et al., 2014; HUSSAIN et al., 2014; KOTB ELMAHALLAWY; AGIL, 2015.)
Outros fármacos também têm sido utilizados, como cetoconazol, fluconazol e itraconazol (figura 12), como forma alternativa aos problemas enfrentados na terapêutica das leishmanioses (NAGLE et al., 2014).
SERAFIM, V. L. Introdução 30
Figura 12. Estruturas do Cetoconazol, Fluconazol e Itraconazol.
Fonte: (NAGLE et al., 2014). Estruturas do Cetoconazol (1), Fluconazol (2) e Itraconazol (3).
Diante dessas limitações e visto que não há vacina disponível no mercado para uso em humanos, há dificuldades na execução do tratamento, como a via de administração da droga e há presença de fortes efeitos colaterais, é de extrema importância salientar a necessidade de estudos com fármacos candidatos a novas drogas, na busca de tratamentos alternativos que proporcionem mais conforto aos pacientes e contribuam para novas estratégias de combate as leishmanioses (RIDLEY, 2003; WHO, 2015; RODRIGUES et al., 2015; FÉLIX et al., 2016).
1.4 Resistência aos antimoniais
SERAFIM, V. L. Introdução 31
O surgimento de parasitos resistentes é um problema que vem se agravando, e, por exemplo, na Índia, a maior parte da população não responde mais ao tratamento com os antimoniais (MOHAPATRA, 2014). Embora o projeto do genoma de Leishmania, isto é de Leishmania (L.) major, não tenha sido completado, vários transportadores ABC de espécies de Leishmania têm sido identificados e verificou-se que estes estão envolvidos em resistência a drogas, dentre estes foi relatado que o gene pgpA que codifica o transportador ABC-PGPA é frequentemente amplificado na resistência em L. (L.) tarentolae (LAGE, 2003).
Devido o vasto surgimento de cepas resistentes às drogas das mais diversas espécies de Leishmania, faz-se urgente a necessidade de novas pesquisas a fim de compreender melhor a respeito das mudanças ocorridas no parasito que promovem os mecanismos de resistência (PONTE-SUCRE, 2003). Bem como novos investimentos em pesquisas na busca de medicamentos que possam superar tais mecanismos.
1.5 A importância do planejamento de fármacos na descoberta de novos agentes.
A Química Medicinal é uma disciplina baseada na química, envolvendo aspectos das ciências biológicas, médica e farmacêutica, cuja missão é o planejamento, descoberta, invenção, identificação e preparação de compostos biologicamente ativos (protótipos), o estudo do metabolismo, interpretação do mecanismo de ação a nível molecular e a construção das relações entre a estrutura química e a atividade farmacológica (SAR) (LIMA, 2007, BARREIRO, 2009; DA SILVA, 2013). É pelas ferramentas da química medicinal que o planejamento de novos fármacos acontece.
Assim, a busca por novos fármacos mais eficazes e potentes é um desafio dos químicos medicinais, que através de estruturas já conhecidas ou do conhecimento de alvos biológicos, buscam a obtenção de novas entidades químicas para superar as dificuldades enfrentadas pelas existentes, que a cada dia tornam-se mais amplas devido às mudanças ocorridas no perfil da humanidade, bem como às resistências desenvolvidas ao longo dos tratamentos (DA SILVA, 2013).
SERAFIM, V. L. Introdução 32
ao aparecimento e desenvolvimento de doenças, tornaram possível a descoberta de formulações terapêuticas notáveis. As etapas envolvidas no processo de P&D baseia-se, simplificadamente, no estudo de compostos para o tratamento de doenças. A primeira etapa consiste na descoberta de um composto com atividade terapêutica. Na segunda etapa são feitos testes in vitro para avaliação das propriedades biológicas das moléculas obtidas, e, por meio de bioensaios in vivo avalia-se o metabolismo, a farmacocinética e a farmacodinâmica nos animais. Na terceira e última etapa do processo são realizados estudos clínicos em humanos, em várias fases, parte denominada estudo clínico (GUIDO; ANDRICOPULO; OLIVA, 2010).
Dentre o contexto do P & D de novos fármacos, sabe-se que o planejamento e a síntese de novas drogas com base em estruturas privilegiadas, também chamadas de scaffolds, ou composto lead, baseia-se no objetivo principal de obtenção de derivados com maior interesse terapêutico, maior atividade, biodisponibilidade e metabolismo, tornando-se mais adequado para uso terapêutico. Estes compostos devem apresentar menor toxicidade, podendo assim adquirir melhores características farmacocinéticas e farmacodinâmicas (WERMUTH, 2008;BARREIRO; FRAGA 2015; BROWN, 2007). Demonstrando a importância do estudo de compostos lead aos quais já possuem suas atividades farmacológicas descritas com o intuito de ampliar o arsenal terapêutico com menos custos.
Outra ferramenta bastante utilizada é o bioisosterismo, que é utilizado como uma estratégia de planejamento, desenho, modificação molecular e otimização de ligantes e compostos-protótipos. Baseada na troca de determinados fragmentos moleculares, por exemplo, um grupamento funcional por outro que apresente propriedades físico-químicas semelhantes, como a acidez. Esta técnica pode ser aplicada visando melhorias na fase farmacocinética (modulando as propriedades de absorção, distribuição, metabolismo e eliminação), ou farmacodinâmica de ação de um composto bioativo. A motivação de seu emprego pode estar ainda, relacionada à melhoria do perfil farmacodinâmico de uma substância identificada a partir de um rastreamento de coleções de milhares de outras, visando transformá-lo em um candidato a composto-protótipo mais promissor e atraente em termos terapêuticos (BARREIRO; FRAGA, 2015).
SERAFIM, V. L. Introdução 33
privilegiada", no qual uma estrutura molecular simples é capaz de proporcionar ligantes para alvos diferentes. Alguns estudos confirmam que as pequenas substituições na estrutura do tiofeno causam grandes diferenças nos seus perfis biológicos e farmacológicos (RODRIGUES et al., 2015; FÉLIX et al., 2016).
Os derivados acridínicos também demonstram ser um núcleo versátil, sendo considerado um scaffold, visto que diferentes modificações moleculares têm sido feitas e originado diferentes atividades como anti-Leishmania, antitumoral, antimalárica, antiinflamatória (KUMAR et al., 2013). Assim, é de grande importância o estudo destas duas potencialidades farmacológicas com o intuito de desenvolver novos farmacos mais seguros e eficazes no tratamento das leishmanioses.
Uma das ferramentas da química medicinal que auxilia no descobrimento de scaffolds é o estudo de QSAR (Relações Quantitativas de Atividade-Estrutura), capaz de distinguir, por exemplo, a interação sistema-químico sistema-biológico em esquema grupo-aditivo de séries homólogas onde, para uma série pequena, as potências relativas são semelhantes. Outra ferramente que é freqüentemente utilizado, é o Diagrama de Craig, que fundamenta muitas das mais avançadas técnicas de planejamento de séries para o estudo de QSAR para o estudo de novos compostos (TAVARES, 2004).
1.6 Derivados acridínicos e sua importância farmacológica
Derivados acridínicos apresentam uma estrutura planar como núcleo principal da molécula, estes compostos são caracterizados pela presença de três anéis e um ou dois grupos substituintes que são flexíveis (figura 13), e também podem ser chamados de dibenzo[b,e]piridina, benzo[b] quinolina, 2,3,5,6-dibenzo-piridina ou 10-azaantraceno (SÁNCHEZ, 2006; ZHANG et al., 2014; SCHMIDT; LIU, 2015).
Figura 13. Estrutura do núcleo acridínico.
Fonte: SCHMIDT; LIU, 2015. Núcleo acridínico, que pode ser chamado de dibenzo[b,e]piridina,
SERAFIM, V. L. Introdução 34
Os derivados acridínicos são fortes candidatos a novos fármacos, pois possuem diversas atividades já descritas na literatura, como: antitumoral (BARROS et al., 2012), antimicrobiana (PATEL, et al., 2006), anti-inflamatória (SONDHI et al., 2010), antimalárica (TOMAR et al., 2010), antipríon (MAY et al., 2006), anti-alzheimer (FANG et al., 2008) e antitripanossomal (GAMAGE et al., 1997).
Um dos principais mecanismos que tem caracterizado a atividade biológica destes compostos tem sido atribuído à planaridade de suas estruturas aromáticas, o qual pode intercalar na cadeia dupla de DNA, e assim interferir nas funções celulares e enzimáticas (GAO et al., 2010; LIU et al., 2010; JANOVEC et al., 2011; LAFAYETTE et al., 2013; DE ALMEIDA et al., 2015).
Um bom exemplo destes compostos é a m-Amsacrina (m-AMSA, figura 14) que é um derivado 9-anilinoacridínico utilizado para o tratamento de vários tipos de câncer, e foi uma das pioneiras no tratamento contra leucemia promielocítica, sendo o primeiro fármaco no qual o seu modo de ação foi previsto como uma interação com o complexo DNA-Topoisomerase II (DENNY, 2002; CHILIN et al., 2009; BARROS et al., 2012).
Figura 14. Estrutura da Amsacrina (m-AMSA)
Fonte: ZHANG et al., 2014. Estrutura da Amsacrina (m-AMSA).
Os diversos derivados acridínicos, analógos à m-AMSA, tem demonstrado diversas atividades, como antitumoral, antiprolifertivas e de ligação ao DNA, ao qual em alguns estudos, este potencial também tem sido correlacionado com atividades antiparasitárias (FIGITTI et al., 1992; PEREZ et al., 2008).
SERAFIM, V. L. Introdução 35
MAUEL et al., 1993; DI GIORGIO et al., 2003; 2005; 2007; GAMAGE et al.,1996; 1997; MESA-VALLE et al., 1996).
Di Giorgio e colaboradores (2005) sintetizaram uma série de 4,5 di-acridinas substituídas. Nestes compostos, a B’52 (figura 15) mostrou atividade contra formas amastigotas de L.(L.) infantum com IC50 de 0,6µM e índice de seletividade maior que 200, porém verificaram que essa atividade não está relacionada com o aumento da produção de oxido nítrico em macrófagos infectados e tratados com o composto, bem como não é por mecanismo de intercalação com o DNA.
Figura 15. Estrutura da 4,5-bis(hidroximetil)acridina (B’52)
Fonte: DI GIORGIO et al., 2005. Estrutura da 4,5-bis(hidroximetil)acridina (B’52)
Dando continuidade aos estudos desta série com atividade anti-Leishmania e aprofundando a atividade antiproliferativa e de ligação ao DNA, Di Giorgio e colaboradores (2007), obtiveram uma nova série de derivados acridínicos, derivados monofuncionais 6-substituidos e bifuncionais 3,6-di-substituídos, ao qual verificaram que estas modificações os tornaram mais específicos para o parasito.
Caffrey e colaboradores (2007) sintetizaram derivados bis-acridínicos e verificaram que estes possuíam um potencial anti-Leishmania contra forma promastigotas de Leishmania (L.) donovani onde se verificou que os derivados bis-acridínicos substituídos com poliamidas e com poliamidas alquiladas se mostraram mais promissores.
Wong e colaboradores (2009) sintetizaram uma série de compostos a partir de um análogo da acridina, a quinacrina (figura 16), ao qual é utilizado na terapêutica da malária, chamado também de mepacrina e também utilizaram um dímero de apigegina. Os autores avaliaram atividade anti-Leishmania destes compostos, em cepas sensíveis de L. (L.) enriettii e de L. (L.) donovani e resistentes a pentamidina, e verificaram que estes compostos podem restaurar a susceptibilidade dos parasitos para pentamidine, bem como pode atuar sinergicamente para sensibilizar Leishmania sp a pentamidina, concluindo que está sensibilidade pode ser mediada por múltiplos alvos.
N
SERAFIM, V. L. Introdução 36
Figura 16. Estrutura da quinacrina
Fonte: ZHANG et al., 2014. Estrutura da quinacrina. (RS) -N '- (6-Cloro-2-meóoxi-acridin-9-il) -N, N-dietil-1,4-pentano-diamina
Assim, observamos a importância das modificações e substituições nos núcleos acridínicos e seus análogos, ampliando a sua atividade farmacológica, possibilitando o surgimento de novos fármacos para a terapêutica das leishmanioses.
1.7 Derivados tiofênicos e sua importância farmacológica
O anel tiofênico (figura 17) é um importante heterociclo existente em diversas moléculas com atividades biológicas presentes em diversas drogas de origem natural e sintética (PUTEROVÁ; KRUTOŠÍKOVÁ; VÉGH, 2010).
Figura 17. Estrutura do anel tiofênico
Fonte: PUTEROVÁ; KRUTOŠÍKOVÁ; VÉGH, 2010. Estrutura do anel tiofênico.
SERAFIM, V. L. Introdução 37
analgésica e anti-inflamatória (HARRINGTON, MOORE, GERSTER, 1972; FAKHR et al., 2009).
Mohareb e Fahmy (2013) sintetizaram novos derivados 4,5,6,7-tetrahidrobenzo[b]tiofeno e avaliaram sua citotoxicidade e seu uso como potenciais agentes anti-Leishmania. Todos os compostos testados apresentaram elevada atividade de inibição leishmanicida moderada contra formas amastigotas axênicas de L. donovani com nenhum padrão consistente no que diz respeito à substituição do éster ou ciano. Os compostos (E)-etil 3-(3-ciano-4,5,6,7-tetrahidrobenzo[b]tiofen-2-ilimino)-2-cianopropanoato e etil 2-(2-(etoxicarbonil)- 2-cianoetilidenoamino)-4,5,6,7-tetrahidrobenzo[b]tiofeno-3-carboxilato apresentaram atividade de inibição máxima de 98%, se comparado com o controle positivo de anfotericina.
Rodrigues e colaboradores (2015) avaliaram os efeitos de dez derivados 2-amino-tiofênicos sobre formas promastigotas e amastigotas axênicas de L. (L.) amazonensis. Todos os derivados testados apresentaram atividade leishmanicida contra formas promastigotas e amastigotas axênicas, e menor toxicidade para os macrófagos murinos e eritrócitos. Os melhores valores foram obtidos para compostos contendo um anel de indol lateral, o que nos indica a importância na atividade biológica da substituição nos anéis tiofênicos.
Félix e colaboradores (2016) estudando a importância da hibridação molecular de derivados 2-amino-tiofênicos, sintetizaram 32 novos compostos e avaliando o potencial
anti-Leishmania destes compostos, verificaram que a maioria dos compostos exibiram
significativa atividade leishmanicida (IC50 <10,0 µg/mL), mostrando um melhor desempenho do que os fármacos de referência (antimoniais tri e pentavalentes). Todos os compostos foram menos tóxicos do que os fármacos de referência, até mesmo na maior concentração avaliada (400 µg/mL), não apresentando citotoxicidade para os eritrócitos humanos. TN8-7 composto que foi mais eficaz (IC50 2,1 µg/mL) também mostrou-se eficaz contra uma cultura resistente ao SbIII, e também observou-se que a sua atividade de leishmanicida está associada a fragmentação do DNA do parasito.
SERAFIM, V. L. Introdução 38
1.8 Hibridação Molecular como Ferramenta utilizada na Química Medicinal na busca de novos fármacos
Dentre as ferramentas da química medicinal que proporcionam à busca de novos fármacos, bem como o melhoramento dos já existentes, a estratégia de hibridação molecular de um composto-protótipo, tem se mostrado muito útil no planejamento e desenvolvimento de novos fármacos, que superem os problemas atualmente enfrentados.
Esta técnica é baseada na combinação de determinadas características estruturais de diferentes substâncias bioativas para produzir um novo composto híbrido que possua melhor afinidade e eficácia, quando comparado com seus precursores, podendo resultar ainda, em um composto que apresente perfil de seletividade modificado, diferentes e/ou duais modos de ação e diminuição de efeitos colaterais indesejados (VIEGAS-JÚNIOR et al., 2007).
Assim destaca-se a potencialidade da hibridação molecular de compostos acridínicos e tiofênicos para favorecer a síntese de novos fármacos anti-Leishmania, com o intuito de aumentar a sua eficácia e seletividade.
A ideia de hibridação do núcleo acridínico com grupamentos 2-amino-tiofênicos substituídos surgiu devido à potencialidade biológica também documentada na literatura como foi mencionado anteriormente.
Diante desse quadro realizaram-se etapas de síntese, purificação e elucidação estrutural de novos compostos tiofênicos-acridínicos híbridos, acompanhados por ensaios in
vitro visando à avaliação de seu potencial anti-Leishmania. Assim, possibilita-se o
SERAFIM, V. L. Objetivos 39
2. OBJETIVOS 2.1 Objetivo Geral
Desenvolver novos derivados híbridos tiofênicos-acridínicos através da síntese e elucidação estrutural, e avaliar sua atividade anti-Leishmania in vitro visando obter potenciais agentes terapêuticos mais seguros, eficazes e potentes.
2.2 Objetivos Específicos
2.2.1 Promover a síntese química de novos derivados híbridos tiofênicos-acridínicos, determinar suas características físico-químicas e elucidá-los estruturalmente;
2.2.2 Avaliar a atividade anti-Leishmania dos derivados tiofênicos-acridínicos sobre formas promastigotas de Leishmania (L.) amazonensis;
2.2.3 Investigar a atividade hemolítica dos novos derivados tiofênicos-acridínicos sobre hemácias humanas;
2.2.4 Avaliar a atividade antipromastigota de L. (L.) amazonensis em cepas resistentes ao antimonial trivalente;
2.2.5 Investigar se a atividade anti-Leishmania dos derivados tiofênicos-acridínicos sobre L. (L.) amazonensis está associada à fragmentação do DNA dos parasitos, sendo um possível mecanismo de ação.
SERAFIM, V. L. Material e métodos 40
3. MATERIAL E MÉTODOS
3.1 Síntese e caracterização dos compostos
A síntese dos novos derivados híbridos tiofênicos-acridínicos foi realizada previamente no Laboratório de Síntese e Vetorização de Moléculas (LSVM) na Universidade Estadual da Paraíba (UEPB), no Campus V, de João Pessoa, sob coordenação do prof. Dr. Ricardo Olimpio de Moura.
A síntese destes novos derivados ocorreu de acordo com uma via plena convergente, onde primeiramente foi obtido o núcleo acridínico, a acridina-9-carboxaldeído (AC02), e paralelamente foram obtidos os derivados 2-amino-tiofênicos, estes posteriormente foram acoplados ao núcleo acridínico, obtendo-se assim os compostos finais, denominados de série ACT. Deste mesmo modo, obteve-se outra série de novos compostos, a série ACS, utilizando-se outro núcleo acridínico, o núcleo polisubstítuido com os grupos cloro (Cl) e metóxi (OCH3), que é a 6,9-dicloro-2-metóxi-acridina (ACS) (Alfaesar®), um composto obtido comercialmente (CAS 8638-4).
A obtenção da AC02 realizou-se através da síntese descrita por Barros e colaboradores (2012), resumidamente: o composto 9-metilacridínico foi preparado a partir de N-N-difenilamina (DPA) com dicloreto de zinco (ZnCl2) em ácido acético (AcOH) (TSUGE et al., 1963). Subsequentemente a esta etapa, ocorre à oxidação com clorocromato de piridínio (PCC), obtendo-se assim a AC02, como descrito por Mosher e Natale (1995).
Os derivados 2-amino-tiofênicos foram sintetizados através da clássica reação de Gewald, que consiste na condensação multicomponente de uma cetona ou aldeído, uma nitrila ativada, enxofre elementar na presença de uma base e um catalizador orgânico, tais como morfolina e dietilamina (HUANG; DOMLING, 2011). Todos os derivados 2-amino-tiofênicos utilizados neste trabalho, 5CN, 6CN, 7CN, 8CN, 6EST, 7EST e 6AMD foram anteriormente sintetizados e devidamente caracterizados pelo LSVM e confirmados com os dados da literatura (MENDONÇA-JUNIOR et al., 2011; SOUZA et al., 2012).
SERAFIM, V. L. Material e métodos 41
foram acoplados com a ACS também em meio etanólico a 70ºC, conforme demonstrado no esquema 1.
Todas as reações foram acompanhadas por cromatografia analítica em camada delgada (CCD)utilizando como eluente uma solução de n-Hexano:Acetato(AcOEt) 7:3, ou 6:4, bem como Clorofórmio:Metanol 9:1, para verificar o fim da reações e obtenção dos compostos.
Constatado o término da reação, o precipitado formado foi filtrado e lavado com etanol (EtOH), obtendo-se os cristais puros, estes foram colocados na estufa e posteriormente determinadas suas características físico-químicas, que se fazem saber: cálculo do fator de retenção (Rf), cálculo do rendimento, faixa de fusão (F.F), aparência e solubilidade.
N Cl Cl OCH3 n O R CN
S8, EtOH Base
n = 1, 2, 3, 4
EtOH AcOH T.A. (n) S R NH N OCH3 Cl (n) S R NH2 +
0ºC - T.A
N O EtOH 70ºC SÉRIE ACT SÉRIE ACS (n) S R N N
R= COOEt
CONH2 CN
Esquema 1. Esquema reacional de síntese dos derivados híbridos tiofênicos-acridínicos