i Pós-Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza | Universidade Federal da Paraíba Cidade Universitária - João Pessoa - PB - Brasil - CEP 58059-900 Telefone: (83) 3216 7407 - Fax: (83) 3216 7787 - e-mail: pgbcm@dbm.ufpb.br
MAYARA BARBALHO FÉLIX
DESENVOLVIMENTO E AVALIAÇÃO BIOLÓGICA DE NOVOS DERIVADOS 2-AMINO TIOFÊNICOS INDÓLICOS COMO POSSÍVEIS AGENTES
ANTI-Leishmania
UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
JOÃO PESSOA
ii Pós-Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza | Universidade Federal da Paraíba Cidade Universitária - João Pessoa - PB - Brasil - CEP 58059-900 Telefone: (83) 3216 7407 - Fax: (83) 3216 7787 - e-mail: pgbcm@dbm.ufpb.br
MAYARA BARBALHO FÉLIX
DESENVOLVIMENTO E AVALIAÇÃO BIOLÓGICA DE NOVOS DERIVADOS 2-AMINO TIOFÊNICOS INDÓLICOS COMO POSSÍVEIS AGENTES
ANTI-Leishmania
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Celular e Molecular do Centro de Ciências Exatas e da Natureza, da Universidade Federal da Paraíba, como parte dos requisitos para obtenção do título de MESTRE EM BIOLOGIA CELULAR E MOLECULAR
Orientadora: Profª. Dr. Márcia Rosa de Oliveira
Co-Orientador: Prof. Dr. Francisco Jaime Bezerra Mendonça Junior
Pós-Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza | Universidade Federal da Paraíba Cidade Universitária - João Pessoa - PB - Brasil - CEP 58059-900 Telefone: (83) 3216 7407 - Fax: (83) 3216 7787 - e-mail: pgbcm@dbm.ufpb.br
MAYARA BARBALHO FÉLIX
Dedico aos meus pais, marido, irmão e demais familiares,
AGRADECIMENTOS
A Deus por todas as conquistas que ele me proporciona, por me conceder passar em um doutorado quando ainda estava em conclusão deste mestrado. A fé fez milagres em mim! A minha orientadora, Profª. Drª. Márcia Rosa pelo conhecimento e contribuição para a concretização deste trabalho. E ao meu Co-orientador, Prof. Dr. Francisco Jaime por todo o incentivo, apoio e dedicação.
A equipe de alunos pesquisadores do Laboratório de Leishmaniose por toda cumplicidade, em especial Klinger Rodrigues, por sempre ser tão prestativo e por compartilhar todo o seu conhecimento conosco.
A todos os professores que proporcionaram todo conhecimento e aprendizado necessário para minha formação acadêmica, profissional e pessoal.
Aos meus pais, Joziane Barbalho e Severino Monteiro, irmão, Caio Barbalho e tios, Beatriz Barbalho e Gerônimo Neves, pelo apoio emocional no decorrer desta pós-graduação. Por todas as palavras de conforto e incentivo que sempre foram muito edificantes para minha vida. Por acreditarem no meu potencial, por todo amor e dedicação. Devo muito a eles, sou muito grata.
“Confia no Senhor e faze o bem...
Agrada-te do Senhor e ele satisfará os desejos do teu coração. Entrega o teu caminho ao Senhor, confia nele, e o mais ele fará.
Descansa no Senhor e espera nele...”
RESUMO
DESENVOLVIMENTO E AVALIAÇÃO BIOLÓGICA DE NOVOS DERIVADOS 2-AMINO TIOFÊNICOS INDÓLICOS COMO POSSÍVEIS AGENTES
ANTI-Leishmania
As leishmanioses são um conjunto de doenças causadas por protozoários do gênero Leishmania,
transmitida por insetos flebotomíneos. Os tratamentos recomendados para as leishmanioses são muito tóxicos e pouco satisfatórios, portanto se faz urgente a necessidade de encontrar novas drogas
anti-Leishmania que sejam mais eficazes contra o parasito e que apresentem baixa toxicidade para o
hospedeiro. Logo, este trabalho buscou sintetizar e caracterizar e avaliar o potencial anti-Leishmania
de novos derivados 2-amino-tiofenos. Foram estudados 32 derivados 2-amino tiofenos indólicos por nosso grupo de pesquisa. A síntese dos compostos apresentou um rendimento variando de 31,7% (TN7-6) a 96,4% (TN6-4). Além disso, a faixa de fusão variou entre 150ºC (TN5) e 295ºC (TN6-4). Todos os compostos apresentaram atividade antipromastigota, sendo obtido diferentes valores de IC50, variando de 2,07 a 1067 µg/ml. Nenhum dos derivados tiofênicos indólicos apresentou citotoxicidade para hemácias de origem humana, comparados as drogas de referência. Dentre os compostos com atividade anti-Leishmania, a substância TN8-7 foi selecionada para prosseguir com os estudos, devido
ao seu alto índice de seletividade (IS > 193,2). Foi observado que cepas de L. amazonensis resistentes
ao antimônio trivalente continuaram com os mesmos níveis de sensibilidade ao TN8-7 apresentado pelas culturas sensíveis ao antimônio. Adicionalmente foi observado que atividade anti-Leishmania do
TN8-7 está associada à fragmentação do DNA das formas promastigotas do parasito. Portanto, os resultados do presente estudo sugerem que os derivados 2-amino tiofenos indólicos são moléculas promissoras e possíveis candidatos a fármacos para a terapêutica das leishmanioses.
Palavras-Chave: Leishmanioses, 2-amino tiofeno, tratamento, Leishmania amazonensis, atividade
ABSTRACT
DEVELOPMENT AND EVALUATION OF NEW BIOLOGICAL PRODUCTS 2-
AMINO THIOPHENES INDOLE AS POSSIBLE ANTI-Leishmania AGENTS
Leishmaniasis is a group of diseases caused by protozoa of the genus Leishmania, transmitted by
insects phlebotomines. The recommended treatments for leishmaniasis are very toxic and unsatisfactory. Therefore, it is urgent to find new anti-Leishmania drugs that are more effective against
the parasite and exhibit low toxicity to the host. Thus, this study sought to synthesize, characterize and evaluate the anti-Leishmania potential novel 2- amino-thiophenes. Thirty-two 2-amino thiophenes
indole derivatives were studied by our research group. The synthesis of compounds showed a yield ranging from 31.7% (TN7-6) to 96.4% (TN6-4). In addition, the fusion ranged between of 150 ° C (TN5) and 295ºC (TN6-4). All compounds showed antipromastigota activity obtained with different IC50 values, ranging from the 2.07 - 1067 µg/ml. None of tiofenicos indole derivatives showed cytotoxicity to erythrocytes of human origin, compared to the referenced drugs. Among compounds with anti-Leishmania activity, TN8-7 substance was selected to proceed with the studies due to its
high selectivity index (SI> 193.2). It was observed that L. amazonensis strains resistant to trivalent
antimony continued with the same levels of sensitivity to TN8-7 presented by crops sensitive to antimony. Additionally, it was observed that the anti-Leishmania TN8-7 activity is associated with
DNA fragmentation of promastigotes of the parasite. Therefore, the results of this study suggest that indole 2-amino thiophenes derivatives are promising molecules and possible drug candidates for the therapy of leishmaniasis.
Keywords: Leishmaniasis, 2-amino thiophene, treatment, Leishmania amazonensis, anti-Leishmania
LISTA DE SIGLAS LT – Leishmaniose Tegumentar
LV – Leishmaniose Visceral
LTA – Leishmaniose Tegumentar Americana
LCDS – Leishmaniose Cutânea Disseminada LC – Leishmaniose Cutânea
LCD – Leishmaniose Cutânea Difusa
LM – Leishmaniose Mucocutânea
DMSO– Dimetilsulfóxido
DNA – Ácido desoxirribonucléico (desoxiribonucleic acid)
PBS – Tampão Fosfato Salino (phosphate buffered saline)
SbIII–Antimonial Trivalente
SbV– Antimonial Pentavalente
Anf B – Anfotericina B
WHO–Organização Mundial da Saúde (World Health Organization)
IC50 – Concentração Inibitória de 50% do crescimento da população
HC50 – Concentração capaz de lisar 50% das células
IS – Índice de Seletividade
Rf – Fator de Retenção
PF – Ponto de Fusão
SBF– Soro Bovino Fetal
MTT– Brometo de 3-[4,5-dimetiltiazol-zil]-2,5-difeniltetrazolio
IS– Índice de Seletividade
LISTA DE FIGURAS
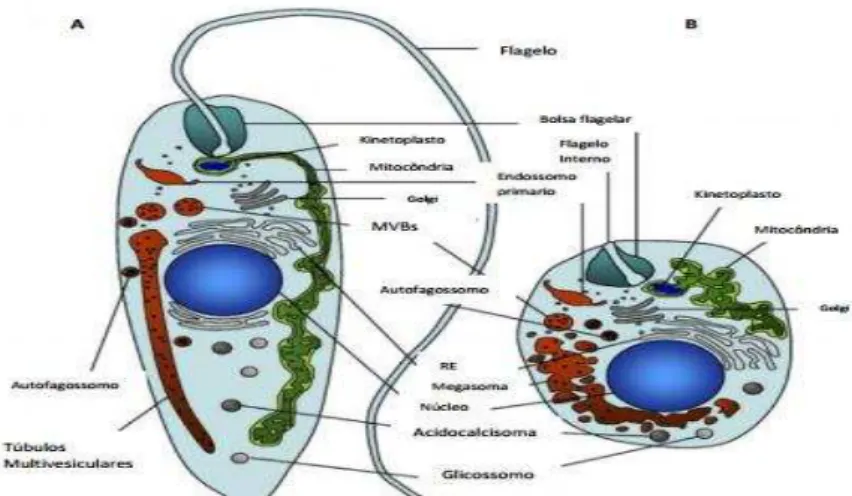
Figura 1. Principais tipos morfológicos encontrados no ciclo evolutivo da Leishmania: a) Forma promastigota; b) Forma Amastigota. Figura adaptada de “Besteiro et al., 2007”.
Corpos multivesiculares (MVBs) e Retículo endoplasmático (RE)...18
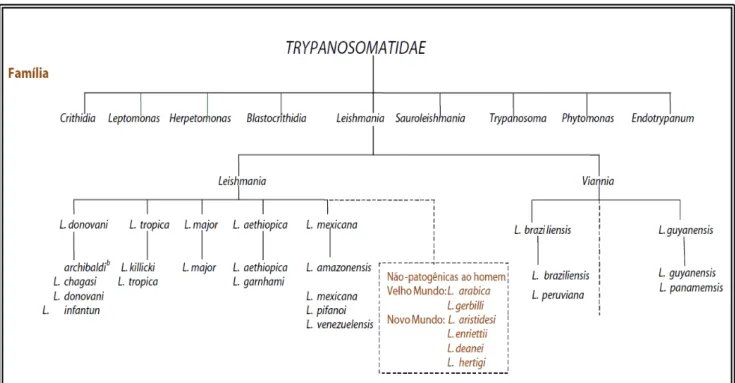
Figura 2. Taxonomia de Leishmania sp...19
Figura 3. Estrutura do tiofeno...23
Figura 4. Metil-3-diacetilamino-4,7-dioxo-4,7-d-hidrobenzo[b]tiofeno-2-2carboxilato...24
Figura 5. Grupamento Indol...24
Figura 6. Representação do experimento de análise hemolítica realizado em placa de 96 poços...55
LISTA DE TABELAS
Tabela 1. Características fisico-químicas e rendimentos dos ciclopenta[b]tiofenos indólicos
(Série TN5)...35
Tabela 2. Características fisico-químicas e rendimentos dos ciclohexa[b]tiofenos indólicos (Série TN6)...37
Tabela 3. Características fisico-químicas e rendimentos dos ciclohepta[b]tiofenos indólicos (Série TN7)...38
Tabela 4. Características fisico-químicas e rendimentos dos cicloocta[b]tiofenos indólicos (Série TN8)...39
Tabela 5. Atividade antipromastigota por meio do método de contagem direta utilizando câmara de Neubauer...41
Tabela 6. Atividade antipromastigota determinada por métodos colorimétricos...41
Tabela 7. Dados de IC50 dos compostos da série nomeada TN5...44
Tabela 8. Dados de IC50 dos compostos da série nomeada TN6...47
Tabela 9. Dados de IC50 dos compostos da série nomeada TN7...49
Tabela 10. Dados de IC50 dos compostos da série nomeada TN8...52
Tabela 11. Concentração capaz de lisar 50% das hemácias (HC50). Utilizando três drogas de referência...64
LISTA DE GRÁFICOS
Gráfico 1. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na
presença de diferentes concentrações das substâncias testes (série TN5)...43
Gráfico 2. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na presença de diferentes concentrações das substâncias testes (série TN6)...45
Gráfico 3. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na presença de diferentes concentrações das substâncias testes (série TN7)...48
Gráfico 4. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na presença de diferentes concentrações das substâncias testes (série TN8)...51
Gráfico 5. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na presença de diferentes concentrações dos fármacos de referência (Glucantime®, SbIII e Anfotericina B®)...53
Gráfico 6. Viabilidade celular de hemácias expostas as substância-teste da série TN5...57
Gráfico 7. Viabilidade celular de hemácias expostas as substância-teste da série TN6...59
Gráfico 8. Viabilidade celular de hemácias expostas as substância-teste da série TN7...60
Gráfico 9. Viabilidade celular de hemácias expostas as substância-teste da série TN8...61
Gráfico 10. Viabilidade celular de hemácias expostas às três drogas de referência: A – Glucantime®; B – SbIII; C – Anfotericina B®...63
LISTA DE ESQUEMAS
Sumário
1. INTRODUÇÃO...16
2. REFERENCIAL TEÓRICO...18
2.1 Ciclo de vida dos parasitas Leishmania sp...18
2.2 Formas Clínicas das Leishmanioses...19
2.3 Tratamento das Leishmanioses...21
2.4 Derivados tiofênicos indólicos e seu potencial farmacológico...22
3. OBJETIVOS...26
3.1 Objetivo Geral...26
3.2 Objetivos Específicos...26
4. MATERIAIS E MÉTODOS...27
4.1 Obtenção das substâncias avaliadas...27
4.2 Cromatografia, Purificação e Caracterização dos compostos...28
4.3 Avaliação da atividade anti-Leishmania...29
4.3.1 Preparo das soluções das substâncias avaliadas...29
4.3.2 Parasitas e sua manutenção in vitro...30
4.3.3 Avaliação da atividade antipromastigota dos derivados tiofênicos indólicos por meio do teste de MTT...30
4.3.4 Avaliação da atividade antipromastigota utilizando a Resazurina...30
4.3.5 Avaliação da atividade antipromastigota por observação microscópica em câmera de Neubauer...30
4.3.6 Obtenção de eritrócitos de sangue periférico humano...31
4.3.7 Avaliação da atividade hemolítica...32
4.3.8 Determinação do índice de seletividade...32
4.3.9 Análise de fragmentação de DNA por eletroforese em gel de agarose...33
4.3.10 Avaliação da atividade antipromastigota frente a cepas resistentes ao SbIII...34
5. RESULTADOS E DISCUSSÃO...35
5.1 Derivados tiofênicos indólicos sintetizados e suas características físico-químicas...35
5.2 Análise da atividade antipromastigota por diferentes metodologias...41
5.3 Atividade antipromastigota dos 2-amino-tiofenos indólicos sobre Leishmania amazonensis...42
5.3.1 Atividade antipromastigota dos derivados ciclopenta[b]tiofenos indólicos (Série TN5)...42
5.3.2 Atividade antipromastigota dos derivados ciclohexa[b]tiofenos indólicos (Série TN6)...45
5.3.3 Atividade antipromastigota dos derivados ciclohepta[b]tiofenos indólicos (Série TN7)...48
5.3.4 Atividade antipromastigota dos derivados cicloocta[b]tiofenos indólicos (Série TN8)...50
5.3.5 Análise comparativa da atividade antipromastigota dos derivados 2-amino-tiofenos indólicos das 4 séries estudadas...53
5.4 Atividade anti-Leishmania das drogas de referência Glucantime®, SbIII e Anfotericina B...55
5.5 Atividade hemolítica e índice de seletividade...56
5.5.1 Atividade hemolítica dos derivados ciclopenta[b]tiofenos indólicos (Série TN5)...56
5.5.2 Atividade hemolítica dos derivados ciclohexa[b]tiofenos indólicos (Série TN6)...58
5.5.3 Atividade hemolítica dos derivados ciclohepta[b]tiofenos indólicos (Série TN7)...60
5.5.4 Atividade hemolítica dos derivados cicloocta[b]tiofenos indólicos (Série TN8)...61
5.6 Atividade hemolítica das drogas de referência...62
5.7 Análise comparativa do índice de seletividade dos novos derivados 2-amino-tiofenos indólicos...64
5.9 Verificação da morte de Leishmania amazonensis por fragmentação do DNA causada pelo
1.
INTRODUÇÃO
Uma das primeiras descrições clínicas da leishmaniose, foi realizada por Alexandre Russel, no ano de 1756. Em 1901, Leishman identificou alguns organismos através de esfregaços provenientes do baço de pacientes mortos pela febre, na época, conhecida como
“Dum - dum”. Em 1903, estabeleceu-se a relação entre tais organismos e a doença kala azar, descrevendo assim, pela primeira vez, o gênero Leishmania (ROSS, 1903).
Atualmente esta doença é considerada um problema de saúde pública, pois atinge cerca de 2 milhões de pessoas por ano. Aproximadamente 350 milhões de pessoas vivem em áreas endêmicas, com risco de contrair a doença (WHO, 2015).
No período de 2000 a 2013, foram registrados uma média anual de 24.694 casos de leishmaniose tegumentar (LT) no Brasil. No entanto, observou-se uma tendência de redução da endemia, passando de um coeficiente de detecção de 20,3 casos por 100 mil habitantes em 2000, para 9,1, em 2013. No momento a leishmaniose visceral (LV) está distribuída em 21 unidades federadas, atingindo as cinco regiões brasileiras. Nos últimos anos, a doença vem se expandindo para as regiões Centro-Oeste, Norte e Sudeste, sendo que, até o final da década de 1990, a Região Nordeste (considerada de acordo com as estatísticas do Ministério da Saúde, a região com maior número de casos, especialmente na forma visceral) concentrava 90% dos casos e em 2013, registrou 53,6% do total de casos do País (BRASIL. Ministério da Saúde, 2015).
Devido à variedade de espécies do parasito, de insetos vetores e de animais hospedeiros em diferentes ambientes, há uma maior existência de modalidades epidemiológicas da infecção (MARZOCHI & MARZOCHI, 1994). Apesar de existirem relatos indicando que os principais reservatórios mamíferos de Leishmania, descritos nas Américas são os roedores, gambás, edentados, equinos, caninos e os primatas, atualmente discute-se a possibilidade do gato apresentar algum papel como hospedeiro da Leishmania, devido à alta proporção de felinos encontrados infectados nos últimos anos (DUARTE et al, 2010).
social e econômico sendo, no Brasil, caracterizada como uma doença de caráter ocupacional (NEGRÃO & FERREIRA, 2014).
No Brasil há uma diversidade de hospedeiros e reservatórios, assim ocorre complexos e distintos padrões de transmissão que dificultam seu controle (CURTI, 2009). Portanto, constitui-se problema de saúde pública em território brasileiro pela alta incidência, ampla distribuição geográfica, dificuldades no diagnóstico e tratamento (GONTIJO & CARVALHO, 2003).
Porém, apesar da importância epidemiológica dessas doenças, os tratamentos disponíveis para as leishmanioses estão longe de serem satisfatórios. A principal terapia para as leishmanioses é realizada por meio da aplicação de antimoniais pentavalentes por via parenteral (CALDEIRA, 2011). Embora as taxas de cura sejam altas, o tratamento é acompanhado por diversos efeitos colaterais e possibilidade de falha terapêutica devido a parasitos resistentes ao medicamento. Logo, se faz urgente a necessidade de encontrar novas drogas anti-Leishmania que sejam mais eficazes contra o parasito e que apresentem baixa toxicidade para o hospedeiro (MICHELETTI & BEATRIZ, 2012).
2.
REFERENCIAL TEÓRICO
2.1 Ciclo de vida dos parasitos Leishmania sp
É sabido que a leishmaniose define-se como um conjunto de doenças causadas pelo protozoário do gênero Leishmania (ordem: Kinetoplastida/ família: Trypanosomatidae) (BALAÑA-FOURCE et al., 1998) (ALEXANDER & RUSSEL, 1985). Estes parasitas podem ser encontrados em dois tipos de hospedeiros: nas fêmeas dos insetos transmissor, denominados flebotomíneos (Phlebotomus sp. e Lutzomyia sp.), onde se encontram na forma flagelada, denominada promastigotas (fase extracelular) e sob a forma amastigota (forma intracelular) (Figura 1). Logo o ciclo de vida da Leishmania sp. é dito dimórfico (BATES, 1994).
Sua transmissão para o mamífero ocorre pela inoculação, de uma forma infectante do parasita denominada promastigota metacíclica realizada pelo flebotomíneo, que quando fagocitadas pelos macrófagos, transformam-se em formas amastigotas (BRASIL. Ministério da Saúde, 2013; WHO, 2015). Logo, esta última passa por um processo de multiplicação no interior do fagolisossomo e, ocorrendo a lise da célula hospedeira, as amastigotas acabam por ser liberadas e infectam novos macrófagos. Quando macrófagos infectados são ingeridos pelo flebotomíneo, as formas amastigotas são imediatamente liberadas e transformadas nas formas promastigotas procíclicas e depois metacíclicas (BATES, 1994).
Figura 1. Principais tipos morfológicos encontrados no ciclo evolutivo da Leishmania:
2.2 Formas Clínicas das Leishmanioses
As leishmanioses são classificadas em duas formas gerais: tegumentar e visceral, esta última sendo considerada a mais grave de todas, podendo ser fatal quando não tratada. Dentro da forma tegumentar, podemos encontrar quatro formas básicas, de acordo com alguns quadros clínicos: leishmaniose cutânea simples, cutânea difusa, disseminada, mucocutânea, estas no continente americano são genericamente designadas Leishmaniose Tegumentar Americana (LTA) (ALVAR et al., 2012). Diferentes espécies de Leishmania e condições imunológicas do hospedeiro mamífero, bem como as diversas condições ambientais, resultam nestas distintas manifestações clínicas (WHO, 2015).
No Brasil, 7 espécies de Leishmania dermotrópicas causadoras da LTA foram identificadas, sendo 6 delas do subgênero Viannia e 1 do subgênero Leishmania (Figura 2). As 3 espécies mais comuns no Brasil são: Leishmania (Viannia) braziliensis, Leishmania (Leishmania) amazonensis, e Leishmania (Viannia) guyanensis (GONTIJO & CARVALHO, 2003).
Figura 2. Taxonomia de Leishmania sp
A leishmaniose cutânea localizada (LC) é caracterizada por uma ou mais úlceras com bordas elevadas, mais frequentemente localizadas nos membros superiores e inferiores, mas também encontrada na cabeça, face e tronco (BARRAL-NETO et al., 1997; JONES et al., 1987). Esta forma clínica, no Brasil, é causada principalmente por L. (Viannia) braziliensis e L. (Leishmania) amazonensis. Pode ser curada espontaneamente em alguns meses, ou dependendo da espécie de Leishmania e outros fatores ainda pouco conhecidos, desenvolver-se para a forma cutânea difusa, disdesenvolver-seminada ou mucocutânea (TELES et al, 2011).
A leishmaniose cutânea difusa (LCD) tem L.(L.) amazonensis como agente etiológico, é uma complicação rara comumente relacionada à deficiência do sistema imunológico do paciente. Tem início de forma sutil, com o paciente apresentando uma única lesão. A partir de então, vai evoluindo de forma lenta, por meio da formação de placas e nodulações múltiplas não ulceradas. Esta forma clínica comumente não responde aos medicamentos existentes (BRASIL. Ministério da Saúde, 2006).
A leishmaniose cutânea disseminada (LCDS), apresenta inúmeras lesões acneiformes, papulosas e ulceradas, às vezes associadas a sinais e sintomas como febre, perda de peso, calafrios e astenia, sustentando a ideia de uma possível disseminação hematogênica do parasita. As espécies causadoras desta forma clínica são L. braziliensis e L. amazonensis (BARRAL & COSTA, 2011). Esta manifestação é rara podendo ser observada em até 2% dos casos de LTA. A resposta aos medicamentos existentes é comumente satisfatória em relação à cura das lesões (BRASIL. Ministério da Saúde, 2007).
A leishmaniose mucocutânea (LM) inicia-se de forma comum à leishmaniose cutânea simples. Tais lesões surgem de forma devagar e progressiva, no entanto, neste caso, a destruição do tecido se propaga levando à obstrução do septo nasal, atingindo órgãos como a orofaringe, a faringe e até a traqueia (BALAÑA-FOURCE et al., 1998). Logo, pode causar uma severa desfiguração facial, bem como graves problemas respiratórios. Frequentemente os casos de leishmaniose mucocutânea ocorrem anos após um quadro de leishmaniose cutânea (MARETTI-MIRA et al, 2012). Aproximadamente de 3 a 5% dos indivíduos infectados com L. braziliensis, irão eventualmente desenvolver doença das mucosas ou leishmaniose disseminada, ambas consideradas formas graves de leishmaniose (TURETZ et al., 2002).
2.3 Tratamento das Leishmanioses
As medidas de prevenção e de controle das leishmanioses, devem estar relacionadas ao diagnóstico precoce e ao tratamento adequado dos pacientes, além da redução do contato homem-vetor, por meio de medidas de proteção individual, controle de reservatórios e aplicação de inseticida (ALVAR et al., 2012).
O tratamento dos casos humanos ainda é considerado a principal ferramenta no controle desta doença, devido à ausência de uma vacina eficaz e a dificuldade em controlar os vetores e reservatórios. Portanto, entre os medicamentos mais utilizados e recomendados estão os antimoniais pentavalentes, pois apresentam uma rápida eliminação renal e limitada acumulação desses compostos nos tecidos Contudo, estes antimoniais são de administração parenteral e causam sérios efeitos colaterais. Estes fármacos são considerados de primeira escolha, representados por duas formulações, o antimoniato de meglumina (Glucantime - Sbv) e pelo estibogluconato de sódio (Pentostam), sendo que o Glucantime é a droga comumente utilizada no Brasil (MAGALHÃES et al., 2012). O mecanismo de ação dos antimoniais não é totalmente esclarecido, mas existem evidencias de que agem por meio da interferência no processo de glicólise, gerando depleção dos níveis intracelulares de ATP (Adenosina Trifosfato) (BALAÑA-FOURCE et al., 1998).
Outras drogas alternativas utilizadas como uma segunda escolha, como a Pentamidina e Anfotericina B, também são de uso parenteral (CROFT et al., 2006). A Pentamidina era utilizada inicialmente como agente hipoglicemiante, no entanto, depois de testes, descobriu-se a propriedade quimioterápica, passando assim a ser utilizada como uma terapia alternativa (BALAÑA-FOURCE et al., 1998). O mecanismo de ação dessa classe de substâncias ainda permanece incerto, contudo sugere-se estar relacionado a danos nas mitocôndrias, possivelmente causando colapso na membrana mitocondrial (HUSSAIN et al., 2014).
Novas formulações de fármacos tradicionais, além de medicamentos alternativos, estão sendo disponibilizados atualmente. Em alguns países há estudos acerca de novas formulações de paramomicina e antifúngicos azólicos, porém poucas são as chances de que se chegue ao desenvolvimento de um único fármaco eficaz para todas as variantes da leishmaniose, tendo em vista as diferentes espécies causadoras e os graus distintos de resistência aos medicamentos tradicionais (CROFT et al., 2006).
Há um número limitado e falta de inovação nos programas de desenvolvimento de novos fármacos para as leishmanioses. Assim, no processo de descoberta e desenvolvimento de fármacos, os ensaios biológicos são imprescindíveis para a identificação de compostos bioativos. Os ensaios utilizados para seleção de drogas com atividade citotóxica para protozoários do gênero Leishmania, compreendem processos como o de utilização do parasito (forma livre ou intracelular) ou enzimas específicas de seu metabolismo como alvo celular. Dessa forma, ocorre a triagem de um determinado número de substâncias que apresentam atividade, para então serem submetidas a ensaios secundários confirmatórios para descrição da atividade observada e sua toxicidade (FAGUNDES et al., 2013).
As pesquisas comumente têm buscado fármacos de ação antiparasitária que se acumulem no interior das células. Uma maior atenção deve ser dada às características físico-químicas do suposto fármaco, pois isto influenciará na sua biodisponibilidade (CROFT, 1987). Para uma boa biodisponibilidade, a molécula ideal deve ser rapidamente absorvida e distribuída no organismo, deve ser altamente seletiva em relação ao seu alvo, deve ter uma potência elevada e um alto grau de eficácia terapêutica, para que seja eficaz em doses baixas (CHUNG & FERREIRA, 1999). Adicionalmente a via de administração oral é menos invasiva e pode dar ao paciente mais independência na utilização do fármaco.
2.4 Derivados tiofenos indólicos e seu potencial farmacológico
Figura 3. Estrutura do tiofeno
Fonte: Elaboração própria. Auxílio do programa ChemDraw Ultra 7.0.
Os compostos orgânicos contendo anéis aromáticos, encontram-se em abundância na natureza, apresentando por muitas vezes, um papel importante em vários processos bioquímicos. Isto pode justificar o seu estudo e a sua incorporação nas estruturas químicas de medicamentos sintéticos (DALVIE et al., 2002).
Dentre os heterociclos tiofênicos, destacam-se os compostos 2-aminotiofenos, já bastante relatados nos estudos de investigação de novas drogas (PUTEROVÁ et al., 2010).
Karl Gewald, químico alemão, revolucionou a síntese de tiofenos ao inovar com a síntese multicomponente que fornece 2-aminotiofenos. Nos anos de 1965 e 1966, Gewald sintetizou 2-aminotiofenos através da reação entre compostos carbonílicos (aldeídos e cetonas), nitrilas ativadas e enxofre em presença de aminas secundárias sob temperatura ambiente (GEWALD, 1965; GEWALD et al., 1966; HUANG & DOMLING, 2011).
Tiofenos 2-amino substituídos têm atraído uma grande quantidade de interesse de pesquisa, o que se justifica pela sua grande utilidade como precursores de moléculas com propriedades farmacológicas. Já vem sido relatado na literatura funções como, antituberculose (BALAMURUGAN et al., 2009), anti-inflamatórios (FAKHR et al., 2009), antimicrobiana (ISLOOR et al., 2010) e anti-ansiedade (AMR et al., 2010). Além das atividades já citadas anteriormente, há estudos que relatam que os tiofenos e seus sistemas de anéis fundidos possuem um amplo espectro de atividades biológicas, como antagonistas dos antiarrítmicos e serotonina (AMR et al., 2010).
(2009), relataram atividade antiprotozoária de derivados tiofênicos para promastigotas de L. amazonensis, L. braziliensis e L. infantum com 100% de lise a 100 mg/ml.
Figura 4. Metil- 3-diacetilamino-4,7-dioxo-4,7-di-hidrobenzo[b]tiofeno-2-carboxilato
O
O
S NAc2
CO2Me
Fonte: VALDERRAMA, 1999.
Os 2-amino-tiofenos podem estar condensados ao núcleo indólico, (Figura 5) (2,3-benzopirrol) (C8H7N) que é uma substância cristalina, amarelada, com odor pútrido,
encontrada no alcatrão e muito usada como reagente químico e composto de síntese. O anel de indol é uma subunidade aromática rica em elétrons. É amplamente distribuída nos sistemas biológicos como um constituinte importante de biomoléculas e produtos naturais, tais como o triptofano, aminoácido essencial na nutrição humana, como componente estrutural de muitas proteínas e precursor biossintético do neurotransmissor serotonina. Além disso, está presente em muitos medicamentos (ALVES et al, 2009). Logo, representa uma das subunidades estruturais mais importantes para a descoberta de novos candidatos a fármacos (SMITH et al.,1998; JOULE et al., 1998).
Figura 5. Grupamento Indol.
H N
Fonte: Elaboração própria. Auxílio do programa ChemDraw Ultra 7.0.
Alguns estudos enfatizaram a importância da presença do grupo NH no indol nas interações com os receptores, como relatado por Da Settimo (1996) após a substituição isostérica do núcleo indol em uma série de derivados glioxililamina, caracterizados como supostos ligantes do receptor da benzodiazepina, do benzotiofeno e benzofurano.
derivados, identificaram uma atividade dos compostos contra a fase amastigota do parasita, identificando tais derivados como uma nova classe estrutural de amidas com atividade leishmanicida. A atividade potente e simples síntese desses compostos sugerem que eles são potenciais candidatos para o desenvolvimento de novas drogas leishmanicidas, abrindo assim um novo caminho para uma maior exploração.
Gupta et al. (2010) demonstraram a potencialidade de derivados indólicos utilizando uma série de [1,2,4]triazina[5,6-b]indol-3-iltio-1,3,5-triazinas, onde foi verificado a atividade anti-Leishmania destes compostos para a espécie Leishmania donovani.
Além dos sérios efeitos colaterais das drogas disponíveis para o tratamento das leishmanioses, a evolução da resistência dos parasitas aos medicamentos existentes é também um empecilho no controle da doença. Com isso se faz necessário a descoberta de novos fármacos seguros, eficazes, com efeito colaterais reduzidos para o tratamento contra das enfermidades causadas por Leishmania (RAHMAN et al., 2008).
Neste contexto, recentemente nosso grupo de pesquisa estudando uma pequena série de derivados tiofênicos, identificou que alguns derivados 2-amino-tiofenos, apresentaram relevante atividade in vitro contra formas promastigotas e amastigotas de L. amazonensis (RODRIGUES et al., 2015). Neste estudo, notou-se que os compostos mais efetivos
3.
OBJETIVOS
3.1. Objetivo Geral
Sintetizar, caracterizar e avaliar a potencialidade anti-Leishmania de novos derivados 2-amino-tiofênicos indólicos.
3.2Objetivos Específicos
Sintetizar, purificar e caracterizar novos derivados 2-amino-tiofênicos indólicos;
Avaliar a atividade anti-Leishmania dos derivados 2-amino tiofenos indólicos sobre formas promastigotas de Leishmania (L.) amazonensis;
Analisar a atividade hemolítica dos derivados 2-amino tiofenos indólicos;
Investigar a fragmentação do DNA como um possível mecanismo de ação dos derivados 2-amino tiofenos indólicos associado à atividade anti-Leishmania;
4.
MATERIAL E MÉTODOS
4.1 Obtenção das substâncias avaliadas
Para a síntese dos 2-[(arilideno)amino]-cicloalquil[b]tiofeno-3-carbonitrilas (TN5-1-7, TN6-1-7, TN7-1-7, TN8-1-7), uma mistura equimolar de aductos de Gewald (5CN, 6CN, 7CN e 8CN) e aldeído indólico substituído em etanol absoluto com 0,5 mL de ácido acético, foi agitada sob refluxo durante 2h e depois resfriada à temperatura ambiente. Foi adicionada água e o precipitado foi filtrado sob vácuo, lavado com água, seco e recristalizado utilizando etanol absoluto (Esquema 1) (MENDONÇA JUNIOR et al. 2011). A síntese dos compostos foi realizada no Laboratório de Química e Inovação Terapêutica, na UFPE, e no Laboratório de Síntese e Vetorização de Moléculas da UEPB sob coordenação dos professores Dr. Francisco Jaime Bezerra Mendonça Júnior e Profa. Dra. Maria do Carmo Alves de Lima.
Esquema 1. Procedimento geral de síntese dos compostos tiofênicos com derivados do heterociclo indol.
Compostos n R R´
TN5 1
H -
n(CH2) S
CN NH2 +
HN R O
R2
TN6 2
TN7 3
TN8 4
TN5-1 1
CH H
TN6-1 2
TN7-1 3
TN8-1 4
TN5-2 1
CH -4-OCH3
TN6-2 2
TN7-2 3
TN8-2 4
Áci
d
o
Acé
ti
co
E
tano
4.2 Cromatografia, Purificação e Caracterização dos compostos
As cromatografias analíticas em camada delgada foram efetuadas em placas FLUKA Analytical sílica gel de 0,2 mm de espessura, com indicador fluorescente de 254 nm. As revelações foram feitas por luz ultravioleta (254 ou 365 nm).
TN5-3 1
CH H
TN6-3 2
TN7-3 3
TN8-3 4
TN5-4 1
CH NO
2,
TN6-4 2
TN7-4 3
TN8-4 4
TN5-5 1
CH [g]benzo
TN6-5 2
TN7-5 3
TN8-5 4
TN5-6 1
N -
TN6-6 2
TN7-6 3
TN8-6 4
TN5-7 1
CH -CN
TN6-7 2
TN7-7 3
Após ter sido confirmado o término das reações (através de cromatografia em camada delgada, utilizando um sistema eluente em uma mistura binária 7:3, hexano/acetato de etila), os compostos foram filtrados e purificados por lavagem com etanol gelado.
Depois de confirmada a pureza dos compostos, eles tiveram seus cálculos de rendimento determinados, assim como as características físico-químicas (fator de retenção, ponto de fusão, aparência, solubilidade).
O fator de retenção (Rf) foi obtido a partir da cromatografia em camada delgada pela formula Rf = dc / ds, onde dc é à distância percorrida pelo composto e ds é à distância percorrida pelo sistema.
Para o ponto de fusão, uma pequena amostra do produto foi colocada em um capilar e inserida em um aparelho de ponto de fusão (Ponto de Fusão Microprocessado Q-340 – Quimis).
A aparência dos compostos (cor e textura) foi avaliada apenas por observação visual do produto.
O rendimento foi calculado, pesando-se a massa do produto obtido em gramas e em seguida calculado o número de mols referente à massa através da fórmula nº = m / PM. Por fim foi calculada a porcentagem de rendimento pela fórmula:
Número de mols obtidos x 100
= X Número de mols do produto de partida
4.3 Avaliação da atividade anti-Leishmania
4.3.1 Preparo das soluções das substâncias avaliadas
Para os testes in vitro, as amostras foram pesadas (20mg) e diluídas em 1 ml de dimetilsulfóxido [DMSO (CH3)2SO – Vetec, Brasil] sob agitação em Vortex (DaiggerVortex
4.3.2 Parasitas e sua manutenção in vitro
As formas promastigotas de Leishmania (L.) amazonensis (IFLA/BR/67/PH8) utilizadas neste trabalho foram cultivadas, in vitro, em tubos de ensaio contendo meio de cultura ágar-sangue NNN (Novy-McNeal-Nicolle), associado ao meio líquido Schneider, suplementado com 20% de soro bovino fetal (SBF) e 1% de antibiótico, estreptomicina (100 µg/ml) e penicilina (100 U.I./ml). As células foram incubadas a 25±1°C e repicadas. Foram utilizadas cepas de Leishmania (L.) amazonensis sensíveis e resistentes ao antimônio trivalente. As culturas resistentes (nível de resistência: 22,5x) foram obtidas cultivando o parasito em concentrações crescentes do antimônio conforme descrito por Liarte & Murta, 2010.
4.3.3 Avaliação da atividade antipromastigota dos derivados tiofênicos indólicos por meio do teste de MTT
O ensaio colorimétrico utilizando o MTT (brometo de 3-[4,5-dimetiltiazol-zil]-2,5-difeniltetrazolio) foi realizado de acordo com Mosmann (1983). Utilizou-se uma placa de 96 poços, onde foram feitas diluições seriadas com duas drogas de referência: SbIII e a Anfotericina B. Em seguida foram adicionados 2x107/mL do parasito em 50 µl de meio líquido Schneider e as placas incubadas por um período de 24hrs a 25°C. Posteriormente foi adicionado o MTT e colocado em incubação por mais 4 h. A partir de então, foram adicionados 50 µL de uma solução a 10% de dodecil sulfato de sódio (DSS) e deixado overnight para completa dissolução do formazan. Assim, foi realizada a leitura em espectrofotômetro a 540 nm. Esse método é baseado na atividade de enzimas desidrogenases citosólicas e mitocondriais, que são capazes de reduzir o MTT (coloração amarela) e formar um produto de coloração azul, insolúvel em água, o sal formazan. Os ensaios foram realizados em triplicata.
4.3.4 Avaliação da atividade antipromastigota utilizando a Resazurina
4.3.5 Avaliação da atividade antipromastigota por observação microscópica em câmara de Neubauer
A determinação da inibição do crescimento de formas promastigotas de L. (L.) amazonensis frente às substâncias em estudo foi realizada utilizando tubos de ensaio rosqueados contendo meio líquido Schneider suplementado com 20% de soro bovino fetal (SBF) e 1% de antibiótico [estreptomicina (100 µg/ml) e penicilina (100 U.I./ml)]. Nos tubos de ensaio foram adicionados 1x106 promastigotas/ml de Leishmania (L.) amazonensis em fase logarítmica de crescimento, na ausência (controle) e presença de diferentes concentrações das substâncias avaliadas.
Após 72 horas de incubação a 25ºC±1, alíquotas das culturas foram retiradas, diluídas em solução de isoton (10,5 g de ácido cítrico, 7 g de NaCl, 15 ml de formol em 1 L de água destilada) na proporção de 1:10, em tubos ependorfes, os quais foram submetidos a vigorosa agitação em aparelho vortex. As células foram então quantificadas e analisadas sob microscopia óptica comum com o auxílio de uma câmara de Neubauer. A contagem do número de parasitos/ml de cultura foi realizada utilizando a fórmula: N° de parasitos = média dos quatro (04) quadrantes x inverso da diluição da amostra x 104. Alíquotas das culturas também foram colocadas em lâminas de vidro, cobertas com lamínulas e observadas quanto à morfologia e mobilidade em microscópio óptico.
Paralelamente as culturas de Leishmania (L.) amazonensis foram avaliadas quanto à sensibilidade ao Glucantime® [300mg/mL (Aventis Pharma, Brasil)], a Anfotericina B ® [1mg/mL (Cristália)] e ao Sb III utilizadas como drogas de referência. Drogas estas, cedidas gentilmente pela Farmácia Hospitalar do Hospital Universitário Lauro Wanderley-UFPB. As drogas foram diluídas em meio Schneider completo, de acordo com as concentrações testadas. Os ensaios foram realizados em duplicatas e repetidos pelo menos três vezes.
As culturas controles, cujo crescimento foi considerado 100%, foram mantidas na ausência de substâncias e os cálculos da porcentagem de inibição de crescimento das substâncias avaliadas foram calculados em relação à cultura controle.
4.3.6 Obtenção de eritrócitos de sangue periférico humano
Universidade Federal da Paraíba, local onde foram realizadas todas as etapas desta pesquisa aprovada pelo comitê ético de pesquisa em humanos (Protocolo 0510/15).
Para coleta de sangue dos pacientes foram selecionados com os seguintes critérios: idade compreendida entre 16 e 60 anos, ausência de evidências clínicas e complementares como o acometimento cardíaco, condições que possam alterar a função cardiocirculatória, hipertensão arterial sistêmica (HAS), evidências de hipo ou hipertireoidismo, Diabetes mellitus ou tolerância reduzida à glicose, episódio prévio sugestivo de doença reumática aguda, alcoolismo, gravidez, anemia significativa, distúrbios hidroeletrolíticos como níveis séricos anormais de sódio e potássio e qualquer outra doença sistêmica significativa ou aguda que pudesse interferir nos resultados dos métodos propostos.
Todos os indivíduos que contribuíram para a realização deste trabalho participaram voluntariamente da pesquisa, onde houve um esclarecimento sobre a importância do trabalho, e assinado o termo de consentimento esclarecido (TCLE).
4.3.7 Avaliação da atividade hemolítica
A atividade hemolítica foi avaliada por meio da incubação de 20 µl das substâncias a serem testadas, diluindo-as em uma solução salina tamponada com fosfato (PBS) com 80 µl de uma suspensão de 4% de células vermelhas do sangue humano (O +), durante 1 h a 37 ° C em tubos de ensaio. A reação foi parada pela adição de 200 µl de PBS, e em seguida, a suspensão foi centrifugada a 1000g durante 10 min. A lise celular foi então medida por espectrofotômetro (540 nm). A ausência de hemólise (ensaio em branco) ou a hemólise total (controle positivo) foi determinada substituindo a solução contendo as substâncias testadas, por uma com volume igual de PBS e água Milli-Q estéril, respectivamente. Os resultados foram determinados por meio da comparação da percentagem de hemólise com o controle positivo (100% de hemólise), e estes ensaios foram realizados em triplicata (LOFGREN, et al., 2008).
4.3.8 Determinação do índice de seletividade
Partindo dos dados de atividade antipromastigota (IC50 - concentração capaz de inibir
50% do crescimento) e da atividade hemolítica (HC50 - Concentração capaz de lisar 50% das
hemácias)foi estimado o índice de seletividade de todas as substâncias testadas. O índice de seletividade é a razão dentre HC50/IC50 e representa um indicativo in vitro se a substância tem
4.3.9 Análise de fragmentação de DNA por eletroforese em gel de agarose
A molécula que apresentou um maior índice de seletividade foi selecionada para uma investigação quanto a capacidade de fragmentar o DNA dos parasitas como um indicativo de apoptose. Para isso, as formas promastigotas de L. amazonensis em fase logarítmica de crescimento foram incubadas na ausência (controle negativo) e presença da substância selecionada nas concentrações de 1x, 2x, 4x do IC50. As culturas foram incubadas durante
overnight a 25 ± 1°C, e após este período as células foram submetidas à extração de DNA. A extração de DNA de Leishmania foi realizada através do método clorofórmio/fenol (SAMBROOK et al., 1989). Inicialmente, as culturas (1 ml) foram centrifugadas a 6610 x g [9000 rpm (Microcentrífuga MCD 2000-HT)] durante 10 minutos, sendo o sobrenadante descartado. Adicionou-se 300μL de Tampão de Lise [Tris HCl 1M pH 8,0 (Invitrogen Co. CA); EDTA 0,5M pH 8,0 (SIGMA® Chemical Co., U.S.A); SDS 10% (SIGMA® Chemical
Co., U.S.A) em água miliQ estéril] e 10μL proteoquinase k (SIGMA® Chemical Co., U.S.A)
a 20mg/ml. Solução essa que foi incubada em banho-maria (Nova Ética- 316D) overnight a 37°C. Posteriormente foi adicionado 300ml de fenol, os tubos foram submetidos à agitação por 5 minutos e centrifugados a 8161 x g [10000 rpm (Microcentrífuga MCD 2000-HT)] por 5 minutos. A fase aquosa foi então transferida para um novo tubo, onde foi adicionado 300μl
de Clorofórmio:Álcool isoamílico (24:1) e mantidos sob agitação durante 5 minutos. Os tubos foram centrifugados a 8161 x g [10000 rpm (Microcentrífuga MCD 2000-HT)] por 2 minutos, sendo a fase aquosa removida para um novo tubo. Esse procedimento foi repetido duas vezes. Por fim, foi adicionado 500μl de etanol gelado (2,5 vezes o volume) e 30μl de acetato de
sódio (NaAc 3M) em cada tubo, e estes foram deixados para precipitação do material genético durante 24 horas a -20°C.
No dia seguinte, o material foi centrifugado a 11752 x g [12000 rpm (Microcentrífuga MCD 2000-HT)] por 20 minutos, o sobrenadante descartado e os pellets formados foram secos a temperatura ambiente. Após a secagem total das amostras, as mesmas foram ressuspensas em 50μl de água milliQ estéril e mantidas a -20°C até a sua utilização.
Após a extração, as amostras foram tratadas com a enzima RNase (Ribonuclease A). Dessa forma, adicionou-se 50μl de tampão TE (Tris-HCl 10 mM, pH. 8,0; EDTA 1 mM) e
e o material foi seco e ressuspenso em 50μl de água milliQ estéril. As amostras foram
estocadas a -20°C até sua análise.
A concentração e o grau de pureza do DNA, do extraído das culturas de Leishmania (L.) amazonensis, foi estimado por espectrofotômetro (Thermo Scientific NanoDrop 2000). O DNA juntamente com corante GelRed Nucleic Acid Gel Stain 1:500 (10.000x Biotium®) foi aplicado em gel de agarose 1% (Gibco, USA) e a eletroforese foi realizada em tampão TBE (Tris/Borato/EDTA) a 60V, 50mA por 1h30min. Após a eletroforese, os géis foram então analisados sob luz ultravioleta utilizando-se um transiluminador (ImageMaster®). Tais ensaios foram realizados em duplicatas e repetidos uma vez.
4.3.10 Avaliação da atividade antipromastigota frente a cepas resistentes ao SbIII
5.
RESULTADOS E DISCUSSÃO
5.1 Derivados tiofênicos indólicos sintetizados e suas características físico-químicas
Com o intuito de encontrar novas drogas para serem utilizadas na terapêutica das leishmanioses, foram estudados 31 (trinta e um) novos derivados 2-amino-tiofênicos indólicos de acordo com a metodologia já mencionada, sendo que 5 (cinco) destes foram sintetizados no presente estudo. Adicionalmente, vale ressaltar que o TN7, já havia sido sintetizado em estudos anteriores do nosso grupo (RODRIGUES et al., 2015), portanto ele foi resintetizado e teve radicais adicionados ao seu núcleo. Estes compostos foram divididos em quatro séries: os derivados ciclopenta[b]tiofenos indólicos (TN5) (Tabela 1), ciclohexa[b]tiofenos indólicos
(Tabela 2), ciclohepta[b]tiofenos indólicos (Tabela 3) e os cicloocta[b]tiofenos indólicos
(Tabela 4). Todos tiveram suas características físico-químicas determinadas, além de ter seu potencial anti-Leishmania investigado. Nas tabelas citadas, estão ao resultados referentes às características físico-químicas dos compostos e os rendimentos obtidos.
Tabela 1. Características físico-químicas e rendimentos dos derivados ciclopenta[b]tiofenos indólicos
(Série TN5)
Composto Estrutura F.M. MM PF Rf* Aparência Rendimento
TN5 C17H12N3S 290 150ºC 0,5 Amarelo 57,5%
TN5-1
S CN
N
NH
C18H15N3S 305 235°C 0,4
Marrom 76,7%
TN5-2
S CN
N
NH
O
C18H15N3OS 321 243°C 0,4
Amarelo
Escuro 69,7% S
CN N
* Fator de Retenção
TN5-3 S
CN
N
NH
C18H15N3S 305 285°C 0,4 Amarelo 73,6%
TN5-4 S
CN
N
NH O2N
C17H12N4O2S 336 285°C 0,4 Laranja 80,9%
TN5-5 S
CN
N
NH
C21H15N3S 341 245°C 0,5 Amarelo 58,5%
TN5-6 S
CN
N
NH N
C16H12N4S 292 267°C 0,4
Amarelo
Escuro 52,0%
TN5-7 S
CN
N
NH
CN C
Tabela 2. Características físico-químicas e rendimentos dos derivados ciclohexa[b]tiofenos indólicos
(Série TN6)
Composto Estrutura F.M. MM PF Rf* Aparência Rendimento
TN6 C18H14N3S 304 230ºC 0,5 Amarelo 58,6%
TN6-1 S
CN
N
NH
C19H17N3S 319 220°C 0,4 Amarelo 51,1%
TN6-2 S
CN
N
NH
O C
19H17N3OS 335 200°C 0,4 Amarelo 59%
TN6-3
S CN
N
NH
C19H17N3S 319 263°C 0,5 Amarelo 75%
TN6-4 S
CN
N
NH O2N
C18H14N4O2S 350 295°C 0,5 Laranja 96,4%
TN6-5
S CN
N
NH
C22H17N3S 355 267°C 0,5 Amarelo 83,4%
TN6-6 S
CN
N
NH N
C17H14N4S 306 265°C 0,4 Amarelo 56,0%
S
CN N
* Fator de Retenção
Tabela 3. Características físico-químicas e rendimentos dos derivados ciclohepta[b]tiofenos indólicos
(Série TN7) TN6-7
S CN
N
NH
CN
C19H14N4S 330 270°C 0,4 Amarelo 74,2%
Composto Estrutura F.M. MM PF Rf* Aparência Rendimento
TN7 C19H16N3S 319 110ºC 0,5 Amarelo 61,4%
TN7-1
S CN
N
NH
C20H19N3S 333 200°C 0,5 Amarelo 63%
TN7-2
S CN
N
NH
O
C20H19N3OS 349 195°C 0,6 Amarelo 65%
TN7-3 S
CN
N
NH
C20H19N3S 333 236°C 0,4 Amarelo 77%
TN7-4
S
CN
N
NH O2N
C19H16N4O2S 364 267°C 0,4 Amarelo 68,5%
S
CN N
* Fator de Retenção
Tabela 4. Características físico-químicas e rendimentos dos derivados cicloocta[b]tiofenos indólicos
(Série TN8)
TN7-5 S
CN
N
NH
C23H19N3S 369 282°C 0,6 Amarelo 64,3%
TN7-6 S
CN
N
NH N
C18H16N4S 320 265ºC 0,4 Amarelo 31,7%
TN7-7
S CN
N
NH
CN
C20H16N4S 344 260ºC 0,5 Amarelo 48,7%
Composto Estrutura F.M. MM PF Rf* Aparência Rendimento
TN8 C20H18N3S 332 180ºC 0,5 Amarelo 39,7%
TN8-1
S CN
N
NH
C21H21N3S 347 200°C 0,4 Amarelo
60%
TN8-2 S
CN
N
NH
O C
21H21N3OS 363 170°C 0,5 Amarelo 72%
S
CN N
* Fator de Retenção
Foi observado que as substâncias sintetizadas apresentaram rendimento variando entre 31,7% (TN7-6) e 96,4% (TN6-4), sendo o maior valor considerado um ótimo rendimento e o valor mais baixo, considerado pouco satisfatório. A reação Gewald tem sido crescentemente utilizada devido à sua simplicidade e facilidade de síntese, a exemplo dos amino-tiofenos, que em geral apresentam bons rendimentos (HUANG & DÖMLING, 2011). Assim, para aqueles compostos que não apresentaram um bom rendimento na síntese, cabe uma revisão na metodologia utilizada, ou da qualidade dos reagentes utilizados, conforme já previamente descrito por Mendonça Junior, et al. (2011), visando melhorias no rendimento.
TN8-3 S
CN
N
NH
C21H21N3S 347 228°C 0,5 Amarelo 57%
TN8-4 S
CN
N
NH O2N
C20H18N4O2S 378 264°C 0,5 Laranja 60,5%
TN8-5 S
CN
N
NH
C24H21N3S 383 258°C 0,5 Amarelo 72,9%
TN8-6 S
CN
N
NH N
C19H18N4S 334 244°C 0,4 Amarelo 77,2%
TN8-7
S CN
N
NH
CN
Todos os compostos foram obtidos sob a forma de pó amorfo, com coloração característica, a da maior parte dos produtos foi amarela, tendo oscilações entre o marrom e laranja.
A faixa de fusão variou entre o mínimo de 150ºC (TN5) e o máximo obtido que foi de 295ºC (TN6-4). Os fatores de retenção (RF) variaram entre 0,4 e 0,5 cm, considerados satisfatórios, além disso, tais substâncias foram submetidas à técnica espectroscópica para a comprovação de suas estruturas.
5.2 Análise da atividade antipromastigota por diferentes metodologias
Buscando uma melhor técnica para a investigação da atividade anti-Leishmania dos derivados tiofênicos-indólicos sintetizados, foram utilizadas três metodologias distintas: sendo um método direto por quantificação em câmera de Neubauer sob microscopia óptica e dois métodos colorimétricos, um utilizando a Resazurina e o outro o MTT. Tais ensaios foram comparados analisando a atividade anti-Leishmania de duas drogas de referência, a Anfotericina B® e o SbIII , reconhecidas por apresentarem uma significativa atividade
antipromastigota (DUTRA, et al., 2009). Esses métodos colorimétricos possuem a característica de proporcionarem uma maior rapidez no processamento das amostras.
Na tabela 5 estão os resultados da atividade antipromastigota obtidos pelo ensaio de quantificação em microscopia óptica e na tabela 6 os resultados obtidos com os ensaios colorimétricos.
Tabela 5. Atividade antipromastigota por meio do método de contagem direta utilizando câmara de Neubauer.
Fármaco IC50
Anfotericina B® 0,18 µg/ml
SbIII* 9,07 µg/ml
*Antimonial trivalente
Tabela 6. Atividade antipromastigota determinada por métodos colorimétricos
Fármaco Resazurina (IC50) MTT (IC50)
Anfotericina B® 8,02 µg/ml 1,69 µg/ml
SbIII* 9.849 µg/ml 633 µg/ml
Comparando os resultados obtidos com as três diferentes metodologias, pode-se observar que o ensaio de quantificação direta sob microscopia óptica foi o que apresentou os menores valores de IC50 e a Resazurina foi a que apresentou os maiores valores de IC50.
A Resazurina atua como indicador de óxido-redução (PAGE et al. 1993) e alguns estudos já a utilizam para quantificar a viabilidade de formas amastigotas, sendo um corante solúvel e não tóxico para as células (SHIMONY & JAFFE, 2008; MIKUS & STEVERDING, 2000).
O MTT é um ensaio muito utilizado para mensurar citotoxicidade. Possui aplicabilidade para mensurar sobrevivência e/ou a proliferação de várias células, e avalia a capacidade da enzima mitocondrial, desidrogenase succinato reduzir MTT em formazan, gerando um produto azul escuro (formazan), sugerindo que as células vivas emitem um forte sinal (MOSMANN, 1983).
Diante dos resultados obtidos, pode-se verificar uma maior sensibilidade por parte dos ensaios realizados por contagem direta, seguido do MTT e Resazurina. Com isso, foi escolhido a metodologia por quantificação em câmara de Neubauer sob microscopia óptica para analisar a atividade antipromastigota dos novos derivados 2-amino-tiofenos indólicos.
5.3 Atividade antipromastigota dos 2-amino-tiofenos indólicos sobre Leishmania amazonensis
Todos os derivados tiofenos mostraram atividade frente às formas promastigotas de Leishmania amazonensis em diferentes concentrações, como exposto a seguir:
5.3.1 Atividade antipromastigota dos derivados ciclopenta[b]tiofenos indólicos (Série
TN5)
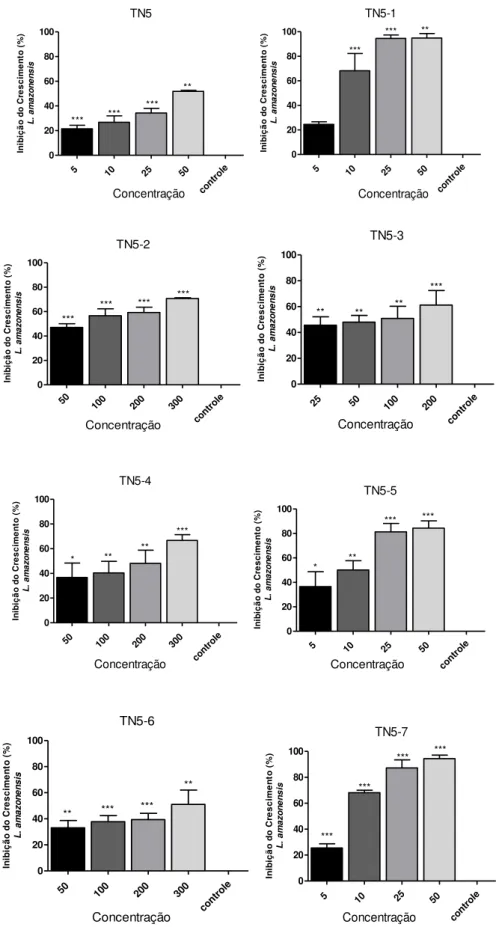
Gráfico 1. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na presença
de diferentes concentrações das substâncias testes (série TN5).
5 10 25 50
contr ole 0 20 40 60 80 100 ** TN5 *** *** *** Concentração In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is
5 10 25 50
cont role 0 20 40 60 80 100 ** TN5-1 *** *** *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração 50
100 200 300 cont role 0 20 40 60 80 100 *** TN5-2 *** *** *** *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
25 50 100 200
cont role 0 20 40 60 80 100 *** TN5-3 ** ** ** ** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
50 100 200 300
cont role 0 20 40 60 80 100 ** TN5-4 *** *** ** * In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
5 10 25 50
cont role 0 20 40 60 80 100 TN5-5 *** *** ** * *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
50 100 200 300
cont role 0 20 40 60 80 100 TN5-6 ** ** *** ** *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
5 10 25 50
Fonte: Elaboração própria. As formas promastigotas de Leishmania amazonensis (1x106 células/mL) foram
cultivadas em meio Schneider completo por 72 horas a 26ºC na presença das substâncias avaliadas. O gráfico representa à média ± erro padrão da média de três experimentos independentes realizados em duplicata. * P ≤
0,05; ** P ≤ 0,01; *** P≤ 0,001(Significância em relação ao controle). Valores em µg/ml.
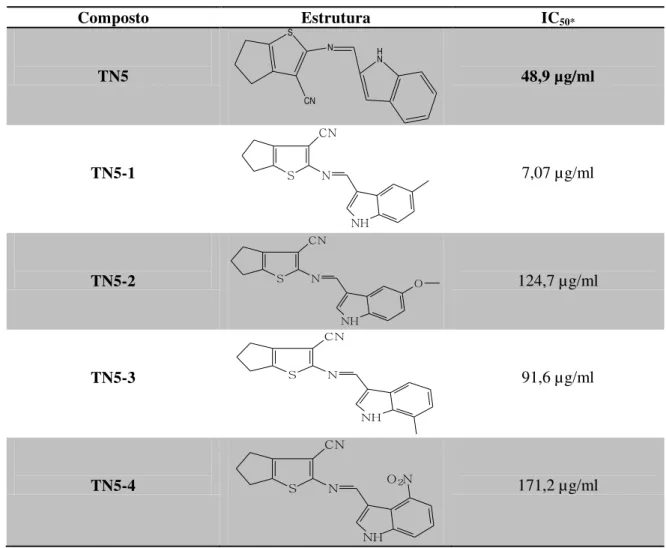
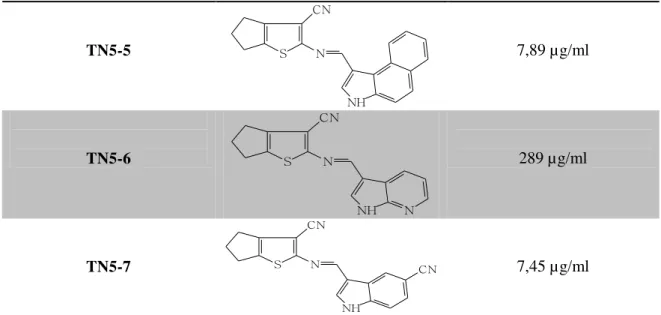
Sete das drogas testadas apresentaram atividade anti-Leishmania, com valores de IC50 variando de 7,07 a 171,2 µg/ml (Tabela 7). Dentre estes, os que apresentaram uma
maior atividade antipromastigota, foram os que contêm os radicais 1 (TN5-1), 5 (TN5-5) e 7 (TN5-7). Além disso, observa-se que a incorporação destes radicais promoveu um aumento significativo da atividade anti-Leishmania quando comparados ao núcleo base não substituído (TN5). Em contrapartida, a incorporação dos radicais 2 (TN5-2), 3 (TN5-3) e 4 (TN5-4) promoveu uma diminuição da atividade, e esta última foi praticamente anulada na presença do radical 6 (TN5-6).
Tabela 7. Dados de IC50 dos compostos da série nomeada TN5.
Composto Estrutura IC50*
TN5
S
CN
N H
N
48,9 µg/ml
TN5-1 S
CN
N
NH
7,07 µg/ml
TN5-2 S
CN
N
NH
O 124,7 µg/ml
TN5-3 S
CN
N
NH
91,6 µg/ml
TN5-4 S
CN
N
NH
TN5-5 S CN
N
NH
7,89 µg/ml
TN5-6 S
CN
N
NH N
289 µg/ml
TN5-7 S
CN
N
NH
CN 7,45 µg/ml
*IC50: Concentração inibitória de 50% do crescimento da população.
5.3.2 Atividade antipromastigota dos derivados ciclohexa[b]tiofenos indólicos (Série
TN6)
Analisando os compostos da série TN6, é possível constatar que, com exceção da TN6-7, todas as substâncias avaliadas apresentaram resposta inibitória a partir da menor concentração testada, sendo esta diferente em cada substância, como exposto no Gráfico 2. Complementarmente, é importante ressaltar que há um aumento da atividade a medida que há um aumento das concentrações investigada.
Gráfico 2. Inibição do crescimento das formas promastigotas de Leishmania amazonensis na presença
de diferentes concentrações das substâncias testes (série TN6).
1,25 2,5 5 10
cont role 0 20 40 60 80 100 TN6 * ** ** ** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
1,25 2,5 5 10
2,5 5 10 25 cont role 0 20 40 60 80 100 TN6-2 *** ** ** *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
50 100 200 300
cont role 0 20 40 60 80 100 TN6-3 * ** ** * In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
25 50 100 200
cont role 0 20 40 60 80 100 TN6-4 ** *** *** ** ** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
5 10 25 50
cont role 0 20 40 60 80 100 TN6-5 ** * * *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
25 50 100 200
cont role 0 20 40 60 80 100 TN6-6 *** * * *** In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is Concentração
2,5 5 10 25
cont role 0 20 40 60 80 100 TN6-7 ** *** ** ** Concentração In ib iç ã o d o C re s c im e n to ( % ) L . a m a z o n e n s is
Fonte: Elaboração própria. As formas promastigotas de Leishmania amazonensis (1x106 células/mL) foram
cultivadas em meio Schneider completo por 72 horas a 26ºC na presença das substâncias avaliadas. O gráfico representa à média ± erro padrão da média de três experimentos independentes realizados em duplicata. * P ≤
0,05; ** P ≤ 0,01; ***P≤ 0,001(Significância em relação ao controle). Valores em µg/ml.
Tabela 8. Dados de IC50 dos compostos da série nomeada TN6.
Composto Estrutura IC50*
TN6
S
CN
N H
N
4,5 µg/ml
TN6-1 S
CN
N
NH
2,32 µg/ml
TN6-2 S
CN
N
NH
O 5,99 µg/ml
TN6-3 S
CN
N
NH
322 µg/ml
TN6-4 S
CN
N
NH
O2N 299 µg/ml
TN6-5 S
CN
N
NH
29,7 µg/ml
TN6-6 S
CN
N
NH N
228 µg/ml
TN6-7 S
CN
N
NH
CN 4,72 µg/ml
![Tabela 1. Características físico-químicas e rendimentos dos derivados ciclopenta[b]tiofenos indólicos (Série TN5)](https://thumb-eu.123doks.com/thumbv2/123dok_br/15265948.540275/36.892.77.854.674.1145/tabela-características-químicas-rendimentos-derivados-ciclopenta-tiofenos-indólicos.webp)
![Tabela 2. Características físico-químicas e rendimentos dos derivados ciclohexa[b]tiofenos indólicos (Série TN6)](https://thumb-eu.123doks.com/thumbv2/123dok_br/15265948.540275/38.892.59.863.214.1185/tabela-características-químicas-rendimentos-derivados-ciclohexa-tiofenos-indólicos.webp)
![Tabela 3. Características físico-químicas e rendimentos dos derivados ciclohepta[b]tiofenos indólicos (Série TN7) TN6-7 S CNN NH CN C 19 H 14 N 4 S 330 270°C 0,4 Amarelo 74,2%](https://thumb-eu.123doks.com/thumbv2/123dok_br/15265948.540275/39.892.58.862.159.288/características-químicas-rendimentos-derivados-ciclohepta-tiofenos-indólicos-amarelo.webp)
![Tabela 4. Características físico-químicas e rendimentos dos derivados cicloocta[b]tiofenos indólicos (Série TN8) TN7-5 S CNN NH C 23 H 19 N 3 S 369 282°C 0,6 Amarelo 64,3% TN7-6SCNNNHNC18H16N4S 320 265ºC 0,4 Amarelo 31,7% TN7-7SCNNNHCNC20H16N4S 344](https://thumb-eu.123doks.com/thumbv2/123dok_br/15265948.540275/40.892.69.864.129.509/características-químicas-rendimentos-derivados-cicloocta-indólicos-scnnnhnc-scnnnhcnc.webp)