Leishmania amazonensis
prejudica resposta de
células dendríticas via inibição da expressão de
CD40 mediada por ectonucleotidases e pela
ativação do receptor de adenosina A
2BPROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Leishmania amazonensis
prejudica resposta de
células dendríticas via inibição da expressão de
CD40 mediada por ectonucleotidases e pela
ativação do receptor de adenosina A
2BAUTORA: AMANDA BRAGA DE FIGUEIREDO
ORIENTADOR: PROF. DR. LUÍS CARLOS CROCCO AFONSO
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Biológicas do Núcleo de
Pesquisas em Ciências Biológicas da
Universidade Federal de Ouro Preto, como parte integrante dos requisitos para a obtenção do título de Mestre em Ciências Biológicas, área de concentração: Imunobiologia de Protozoários.
Catalogação: sisbin@sisbin.ufop.br
F475l Figueiredo, Amanda Braga de.
Leishmania amazonensis prejudica a resposta de células dendríticas via inibição da expressão de CD40 mediada por ectonucleotidases e pela
ativação do receptor de adenosina A2B : [manuscrito] / Amanda Braga de Figueiredo. - 2012.
xiv, 101f. , il.
Orientador: Prof. Prof. Dr. Luís Carlos Crocco Afonso.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto.
Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas.
Área de concentração: Imunobiologia de Protozoários
1.Leishmaniose amazonensis - Teses. I. Universidade Federal de Ouro Preto. II. Título.
iii
Trabalho desenvolvido no Laboratório de
iv
“We do need time to think. We do need time to digest. We do need time to
misunderstand each other, especially when fostering lost dialogue
between humanities and natural sciences. We cannot continuously tell
you what our science means; what it will be good for; because we simply
don’t know yet. Science needs time.”
v
AGRADECIMENTOS
Aos meus pais, que eu amo tanto, meus grandes exemplos de vida, pelo apoio e incentivo incondicionais e por sempre torcerem por minhas conquistas. Dedico a eles este trabalho. Aos meus irmãos pela força e às minhas sobrinhas por sempre me trazerem alegria.
Ao professor Luís Carlos, meu querido chefe, exemplo de caráter e profissionalismo, um dos grandes responsáveis pelo prazer que sinto com a ciência. Agradeço pela amizade, oportunidade, confiança, paciência e dedicada orientação. Seus ensinamentos, que vão muito além de como realizar bem um experimento ou escrever bem uma dissertação, jamais serão esquecidos.
Aos companheiros do Laboratório de Imunoparasitologia por tornarem agradáveis as horas de trabalho. Ao Leandro e ao Marcorélio pelo apoio técnico. Aos colegas e ex-colegas de bancada, pela ajuda na realização de grande parte dos experimentos. À Míriam e à Priscila, pelo suporte no dia-a-dia. Ao Eduardo, pelo treinamento e disponibilidade. Em especial, aos amigos Tiago, Pauline e Rodrigo, inseparáveis no trabalho e na diversão, e parceiros de grandes momentos.
Aos meus amigos, em especial Aline, Daniella, Darília e Elienay, por perdoarem meus momentos de ausência, por gentilmente ouvirem nas horas de estresse e desabafo, pelas mensagens de apoio e, principalmente, pelos incríveis momentos de descontração.
Aos professores Milton de Oliveira e Fátima Dias (UFG) pelo auxílio com a diferenciação de células dendríticas, Leda Quercia Vieira (UFMG) por gentilmente ceder o corante PKH26 e o anticorpo anti-CD40, tão importantes para que essa história fosse assim contada, Ricardo Gonçalves (UFMG) pela ajuda com a microscopia de fluorescência e com a citometria de fluxo e pelas sugestões, e José Roberto Meyer Fernandes (UFRJ) pela contribuição com os experimentos de dosagem da atividade ectonucleotidásica.
À CAPES, à FAPEMIG e ao CNPq pelo financiamento.
vi
RESUMO
Infecções por Leishmania podem resultar num amplo espectro de manifestações clínicas, e o resultado da doença é determinado pela espécie do parasito e a resposta imune do hospedeiro. Células dendríticas desempenham um papel essencial na modulação da resposta imune, incluindo durante a infecção por Leishmania. O ATP extracelular exibe propriedades pró-inflamatórias, enquanto a adenosina é um importante mediador anti-inflamatório. Baseados nessas observações, nosso objetivo foi investigar os efeitos da infecção por Leishmania na resposta de células dendríticas e a participação da sinalização purinérgica nesse processo. Células dendríticas derivadas de medula óssea de
camundongos C57BL/6J foram infectadas com promastigotas metacíclicas de L.
amazonensis, L. braziliensis ou L. major marcadas com CFSE (numa proporção de 3
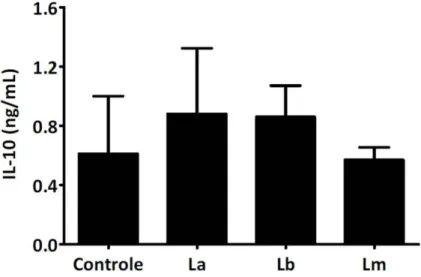
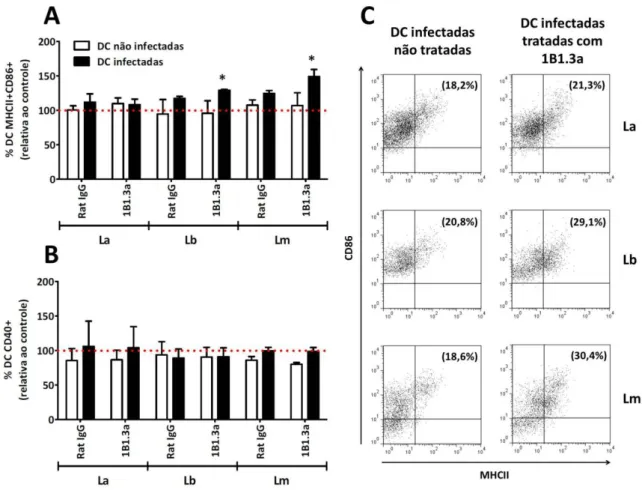
parasitos por célula dendrítica). Células infectadas reduziram a expressão de MHCII e CD86, independentemente da espécie de parasito utilizada. A expressão de CD40 foi significativamente maior em células dendríticas infectadas com L. braziliensis ou L. major, quando comparadas a células dendríticas não infectadas. Por outro lado, a expressão de CD40 não foi alterada em células dendríticas infectadas com L. amazonensis, e estas células apresentaram uma capacidade reduzida de induzir a proliferação de linfócitos T, durante a reação mista de leucócitos e o ensaio de proliferação antígeno-específica. Para tentar descrever os mecanismos envolvidos nesses processos, inicialmente analisamos a produção de IL-10 em sobrenadantes de cultura por ELISA e não encontramos diferenças entre culturas controles e culturas de células dendríticas infectadas. O bloqueio do receptor de IL-10 pelo anticorpo 1B1.3a restaurou parcialmente a expressão de MHCII e CD86 em células dendríticas infectadas com L. braziliensis ou L. major, mas não em células dendríticas infectadas com L. amazonensis. A co-expressão das ectonucleotidases CD39 e CD73 e a atividade enzimática destas enzimas foram significativamente aumentadas em células infectadas e a inibição da hidrólise do ATP extracelular por suramina aumentou a expressão de MHCII e CD86 nestas células, independentemente da espécie de parasito utilizada. Curiosamente, a presença de MRS1754, um antagonista altamente seletivo do receptor de adenosina A2B, no momento da infecção, aumentou a expressão de MHCII,
vii ectonucleotidásica e a ativação do receptor A2B de células dendríticas podem ser utilizadas
por L. amazonensis para esse fim.
viii ABSTRACT
Leishmania amazonensis impairs dendritic cells response via inhibition of CD40
expression mediated by ectonucleotidases and activation of A2B adenosine receptor
Leishmania infections can result in a wide spectrum of clinical manifestations, and
the outcome of disease is determined by parasite species and the host immune response.
Dendritic cells play an essential role in the modulation of immune response including
during Leishmania infection. Extracellular-ATP exhibits pro-inflammatory properties
whereas adenosine is an important anti-inflammatory mediator. Based on these
assumptions, our objective was to investigate the effects of Leishmania infection on
dendritic cells response and the participation of purinergic signaling in this process.
C57BL/6J bone marrow dendritic cells were infected with CFSE-labeled metacyclic
promastigotes of L. amazonensis, L. braziliensis or L. major (1:3 cell to parasite ratio).
Infected cells decreased the expression of MHCII and CD86, independent of the parasite
specie. The expression of CD40 was significantly increased in dendritic cells infected with
L. braziliensis or L. major, when compared with uninfected dendritic cells. On the other
hand, CD40 expression was not changed in L. amazonensis infected dendritic cells, and
these cells presented a reduced ability to induce T cell proliferation, in mixed leukocyte
reaction and antigen-specific proliferation assays. To describe the mechanisms involved in
this process, we initially analyzed the production of IL-10 in culture supernatants by
ELISA and found no differences between control and infected dendritic cells cultures.
Blockade of IL-10 receptor by 1B1.3a antibody partially restored the MHCII and CD86
expression in L. braziliensis or L. major infected dendritic cells, but not in L. amazonensis
infected dendritic cells. Co-expression of ectonucleotidases CD39 and CD73 and
enzymatic activity of these enzymes were significantly increased in infected cells and the
inhibition of extracellular ATP hydrolysis by suramin increased the expression of MHCII
and CD86, regardless of parasite specie used. Interestingly, the presence of MRS1754, a
highly selective A2B adenosine receptor antagonist, at the time of infection, increased the
expression of MHCII and CD86 and CD40 only in L. amazonensis infected dendritic cells,
cells with differentiated expression of this receptor, and recovered dendritic cells ability to
induce T cell proliferation. In conclusion, different species of Leishmania use different
mechanisms to evade the immune response, and we propose that ectonucleotidases activity
ix Keywords: Dendritic cells. Leishmania amazonensis. CD40. Ectonucleotidases. Adenosine
x
ÍNDICE
Agradecimentos ... v
Resumo ... vi
Abstract ... viii
Lista de figuras ... xii
Lista de siglas e abreviaturas ... xiii
1. Introdução ... 15
1.1. Leishmania e leishmanioses ... 16
1.2. Resposta imune frente à Leishmania, células hospedeiras e evasão da resposta pelo parasito ... 18
1.3. Células dendríticas ... 21
1.4. Influência da infecção por Leishmania na resposta de células dendríticas .... 24
1.5. ATP, adenosina e resposta inflamatória ... 25
1.6. Sinalização purinérgica ... 27
1.7. ATP e adenosina na resposta de células dendríticas ... 30
1.8. Justificativa ... 30
2. Objetivos ... 31
2.1. Objetivo geral ... 32
2.2. Objetivos específicos ... 32
3. Material e métodos ... 33
3.1. Animais e parasitos ... 34
3.2. Obtenção de células dendríticas derivadas de medula óssea ... 35
3.3. Infecção de células dendríticas in vitro ... 36
3.4. Avaliação da viabilidade celular ... 37
3.5. Determinação da produção de IL-10 ... 37
3.6. Dosagem da atividade ectonucleotidásica ... 38
3.7. Microscopia de fluorescência ... 38
3.8. Ensaio de proliferação antígeno-específica ... 39
3.9. Reação mista de leucócitos (MLR) ... 40
3.10. Citometria de fluxo ... 40
3.11. Análise estatística ... 31
xi
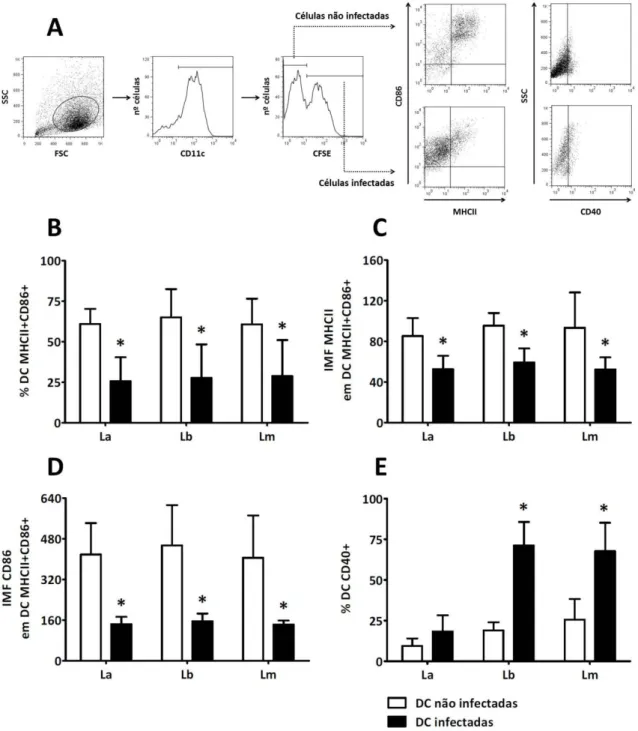
4.1. Leishmania infecta células dendríticas sem alterar a viabilidade celular ... 43
4.2. Promastigotas metacíclicas de Leishmania alteram a expressão de marcadores de superfície em células dendríticas ... 44
4.3. Inibição da ativação de células dendríticas por L. amazonensis é independente de IL-10 e a inibição por L. braziliensis ou L. major é parcialmente dependente dessa citocina ... 47
4.4. Suramina altera o estado de ativação de células dendríticas infectadas por ação na célula e não no parasito ... 49
4.5. Infecção por Leishmania aumenta a expressão e a atividade enzimática de ectonucleotidases em células dendríticas ... 50
4.6. Infecção por L. amazonensis favorece a expressão dos receptores de adenosina A2A e A2B ... 54
4.7. L. amazonensis prejudica funções de células dendríticas por mecanismos dependentes da hidrólise de ATP e da ativação do receptor de adenosina A2B ... 55
5. Sumário dos resultados ... 61
6. Discussão ... 63
7. Conclusão ... 72
8. Referências bibliográficas ... 74
9. Anexos ... 87
9.1. Protocolo de aprovação pelo Comitê de Ética ... 88
xii
LISTA DE FIGURAS
Figura 1. Ciclo de vida do parasito Leishmania ... 17
Figura 2. Efeitos do ATP e da adenosina sobre células do sistema imune ... 26
Figura 3. Influência da sinalização purinérgica sobre a resposta imune ... 29
Figura 4. Marcação de parasitos com CFSE ... 35
Figura 5. Caracterização da população de células dendríticas ... 36
Figura 6. Infecção de células dendríticas com promastigotas metacíclicas de L. amazonensis, L. braziliensis ou L. major ... 43
Figura 7. Viabilidade de células dendríticas infectadas com Leishmania ... 44
Figura 8. Infecção por Leishmania prejudica a ativação de células dendríticas ... 46
Figura 9. Inibição da ativação de células dendríticas por Leishmania é independente da produção de IL-10 ... 47
Figura 10. Inibição da ativação de células dendríticas por L. braziliensis e L. major é parcialmente dependente do receptor de IL-10 ... 48
Figura 11. Suramina afeta o estado de ativação de células dendríticas infectadas com L. amazonensis por ação na célula e não no parasito ... 49
Figura 12. Infecção por Leishmania aumenta a expressão de ectonucleotidases em células dendríticas ... 51
Figura 13. Infecção por Leishmania aumenta a atividade de ectonucleotidases em células dendríticas ... 53
Figura 14. L. amazonensis estimula a expressão dos receptores A2A e A2B em células dendríticas ... 55
Figura 15. L. amazonensis prejudica ativação de células dendríticas via receptor A2B ... 56
Figura 16. Leishmania prejudica ativação de células dendríticas via ectonucleotidases e/ou receptor A2B ... 58
Figura 17. L. amazonensis prejudica a proliferação linfócitos por mecanismos dependentes da hidrólise de ATP e da ativação do receptor A2B ... 60
xiii
LISTA DE SIGLAS E ABREVIATURAS
5’-nucleotidase: fosfohidrolase de nucleosídeos 5’-monofosfatados ADOR: receptor de adenosina
ADP: difosfato de adenosina AMP: monofosfato de adenosina
AMPc: monofosfato de adenosina cíclico ANOVA: análise de variância
APC: aloficocianina
ATP: trifosfato de adenosina BSA: albumina sérica bovina
CFSE: éster de succinimidil-carboxifluoresceína Cols: colaboradores
DC: célula dendrítica
EDTA: ácido etilenodiaminotetra acético ELISA: ensaio imunoenzimático
ENTPDase: ectodifosfohidrolase de nucleosídeos trifosfatados Epac: proteína de troca diretamente ativada por AMPc
ERK: cinase regulada por sinal extracelular FITC: isotiocianato de fluoresceína
GM-CSF: fator estimulador de colônias de granulócitos e monócitos IFN-γ: interferon- γ
IL: interleucina IP3: inositol trifosfato
JNK: cinase c-Jun N-terminal La: Leishmania amazonensis Lb: Leishmania braziliensis Lm: Leishmania major LPS: lipopolissacarídeo
MAPK: proteína cinase ativada por mitógeno
MEK: cinase de proteína cinase ativada por mitógeno
xiv MRS1754: (N-(4-cianofenil)-2-[4-(2,3,6,7-tetrahidro-2,6-dioxo-1,3-dipropil-1H-purina-8-il)fenoxi]-acetamida)
NF-κB: fator de transcrição nuclear κB PBS: salina tamponada com fosfato PE: ficoeritrina
PE-Cy7: ficoeritrina cianina 7 Pi: fosfato inorgânico
PI3K: fosfatidilinositol-3-cinase PIP2: fosfatidilinositol bifosfato
PKA: proteína cinase A PKB/Akt: proteína cinase B PKC: proteína cinase C
ROI: intermediário reativo de oxigênio SFB: soro fetal bovino
TGF-β: fator de transformação do crescimento- β TLR: receptor do tipo Toll
TNF-α: fator de necrose tumoral- α
ZM241385: (4-(2-[7-amino-2-(2-furil)[1,2,4]triazol[2,3-α ][1,3,5]triazina-5-ilamino]etil)fenol)
16
1. INTRODUÇÃO
1.1. Leishmania e leishmanioses
Leishmaniose é um grupo de doenças causadas por protozoários do gênero Leishmania e transmitida entre os hospedeiros mamíferos por insetos flebotomíneos. Possui um amplo espectro de manifestações clínicas, e o resultado da infecção será determinado não só pela espécie do parasito, mas também pela resposta imune montada pelo hospedeiro (Awasthi e cols., 2004).
A leishmaniose visceral representa a forma mais grave da doença. É causada pelas espécies L. donovani e L. infantum e caracterizada pelo acometimento de várias vísceras, principalmente baço e fígado, e medula óssea, podendo levar à caquexia grave e à morte (Herwaldt, 1999). A leishmaniose tegumentar é subdividida em quatro grupos, dependendo dos tipos de manifestações clínicas: (1) leishmaniose cutânea, provocada principalmente
por L. braziliensis e L. guyanensis, no Novo Mundo, e L. tropica, L. major (forma
zoonótica) e L. aethiopica, no Velho Mundo, caracterizada normalmente por úlceras no local da picada do inseto e com resolução espontânea; (2) leishmaniose cutânea disseminada, onde se encontram várias lesões não contíguas formadas pela disseminação
do parasito por vias hematogênica ou linfática, provocada principalmente por L.
braziliensis; (3) leishmaniose mucocutânea, causada normalmente por L. braziliensis e
caracterizada por uma resposta imune exacerbada e ineficaz, com acometimento das mucosas, principalmente da nasofaringe, onde são encontradas lesões destrutivas; e (4) leishmaniose difusa, associada a lesões difusas não ulceradas, ricas em parasitos, e a um processo anérgico, onde a resposta de linfócitos T é ausente ou muito prejudicada, tendo como principais agentes etiológicos L. amazonensis e L. pifanoi (Herwaldt, 1999).
O parasito apresenta um ciclo de vida heteroxênico, com um estágio de desenvolvimento em mamíferos, que é intracelular, e um estágio extracelular em
flebotomíneos dos gêneros Phlebotomus (Velho Mundo) e Lutzomyia (Novo Mundo)
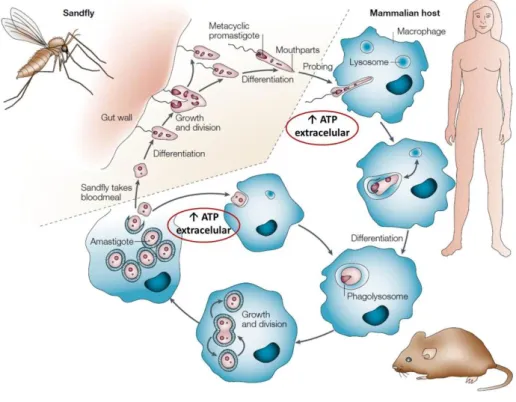
17 altamente adaptadas para a transmissão ao hospedeiro mamífero. Durante um novo repasto sanguíneo, um pequeno número de formas infecciosas é inoculado na pele do hospedeiro vertebrado. Essas formas são eficientemente opsonizadas por componentes do soro e internalizadas por macrófagos, suas principais células hospedeiras, onde residem em fagolisossomos e se transformam em formas amastigotas replicativas. O ciclo se reinicia quando esses macrófagos são ingeridos durante o repasto sanguíneo de flebotomíneos (Kamhawi, 2006; Sacks & Noben-Trauth, 2002).
Figura 1. Ciclo de vida do parasito Leishmania. Parasitos do gênero Leishmania são
transmitidos por fêmeas de flebotomíneos, que durante seu repasto sanguíneo no hospedeiro mamífero, ingerem macrófagos infectados com amastigotas. No intestino desses insetos, os protozoários passam por diversas etapas de diferenciação, originando, por fim, formas promastigotas metacíclicas, que são as formas infecciosas para o hospedeiro vertebrado. Metacíclicas são transmitidas aos mamíferos durante novo repasto sanguíneo do flebotomíneo infectado, infectam células, principalmente macrófagos, e se transformam novamente em formas amastigotas replicativas, que podem infectar novas células ou outro inseto vetor, reiniciando o ciclo. ATP pode ser liberado para o meio extracelular em situações de injúria, como durante a picada do flebotomíneo e o rompimento de macrófagos contendo amastigotas (Adaptada de Sacks & Noben-Trauth, 2002).
18 fosfohidrolase de nucleosídeos 5’-monofosfatados (5’-nucleotidase) (Asai e cols., 1995; Berredo-Pinho e cols., 2001; Coimbra e cols., 2002; Maioli e cols., 2004; Marques-da-Silva e cols., 2008; Meyer-Fernandes e cols., 1997). Essas enzimas são capazes de hidrolisar o ATP extracelular, acumulado em situações de injúria celular (por exemplo, durante a picada do flebotomíneo e durante o rompimento de macrófagos contendo amastigotas de Leishmania, Figura 1), a adenosina, que posteriormente poderá ser utilizada pelas vias de salvação ou se ligar a receptores específicos. Dados já publicados de nosso laboratório também nos permitem fazer uma relação entre o grau de virulência e a atividade ectonucleotidásica de parasitos do gênero Leishmania (Maioli e cols., 2004; Marques-da-Silva e cols., 2008). Estudos em andamento ainda apontam a importância da expressão dessas enzimas em parasitos sobre a modulação de macrófagos pela ativação de algum receptor específico para essa enzima.
Por possuírem graus de virulência variáveis (Marques-da-Silva e cols., 2008), decidimos trabalhar com três espécies de Leishmania, a saber, L. amazonensis, L. braziliensis e L. major. L. amazonensis destaca-se de outras espécies por causar lesões crônicas não-resolutivas em camundongos genuinamente resistentes a outras espécies, como L. braziliensis e L. major (Afonso & Scott, 1993; Maioli e cols., 2004; Marques-da-Silva e cols., 2008), e em seres humanos, L. amazonensis é causadora da leishmaniose cutânea difusa, condição caracterizada por uma falta de resposta de células T específicas contra o parasito (Barral e cols., 1995).
1.2. Resposta imune frente à Leishmania, células hospedeiras e evasão da resposta pelo parasito
Leishmaniose é um ótimo exemplo de interação complexa entre parasito e hospedeiro. A resposta imune frente à Leishmania será dependente da espécie do parasito e da genética do hospedeiro. Embora os macrófagos sejam considerados as principais células hospedeiras, permitindo a sobrevivência e a multiplicação de amastigotas de Leishmania (quando os mecanismos leishmanicidas são incompetentes), neutrófilos e células dendríticas também são infectados e desempenham um papel importante na infecção (Awasthi e cols., 2004; Brandonisio e cols., 2004; Peters e cols., 2008).
19 (ROIs) (Awasthi e cols., 2004). Neutrófilos ainda produzem IL-8, que tem a função de atrair outros neutrófilos para o local, e MIP-1α (CCL3) e MIP-1β (CCL4), que têm a função de atrair monócitos / macrófagos (Awasthi e cols., 2004). Macrófagos ingerem neutrófilos infectados pela identificação de fosfatidilserina em células apoptóticas, e a ingestão de células apoptóticas não ativa funções microbicidas em macrófagos, favorecendo a permanência do parasito no hospedeiro (Laskay e cols., 2003). Nesse momento, neutrófilos apresentam funções contraditórias, ora ajudando e ora prejudicando no combate a infecções por Leishmania (Afonso e cols., 2008; John & Hunter, 2008; Laskay e cols., 2003; Novais e cols., 2009; Peters e cols., 2008).
Macrófagos, as principais células hospedeiras desses protozoários, representam o principal mecanismo de eliminação do parasito, pela produção de ROIs e óxido nítrico. Macrófagos são ativados pela citocina IFN-γ e, a partir de então, tornam-se capazes de produzir as citocinas inflamatórias TNF-α, IL-1 e IL-6, além de IL-12 (Awasthi e cols., 2004). IL-12 é um adjuvante efetivo e um pré-requisito para a montagem de uma resposta Th1 protetora (Afonso e cols., 1994). Células dendríticas também são importante fonte de IL-12 (Awasthi e cols., 2004).
A resposta de linfócitos específicos para Leishmania é essencial para o controle da infecção por esse parasito. Linfócitos T CD4+ se diferenciam em células secretoras de citocinas que exibem fenótipos diferentes dependendo da espécie do parasito e das características genéticas do hospedeiro. Células do tipo Th1 secretam IFN-γ e/ou TNF-α que contribuem para a eliminação do parasito, principalmente pela ativação de macrófagos. Células do tipo Th2, diferenciadas na ausência de IL-12, secretam grandes quantidades de IL-4, IL-5 e IL-13, que inibem a montagem de uma resposta protetora contra patógenos intracelulares. Linfócitos T CD8+ também auxiliam no combate aos parasitos do gênero
Leishmania por serem importante fonte de IFN- γ (Mougneau e cols., 2011). A associação
entre as respostas Th1 e Th2 à resistência e susceptibilidade de camundongos à infecção
por Leishmania foi bem descrita para a espécie L. major (Sacks & Noben-Trauth, 2002).
20 Assim como são capazes de ativar diversos mecanismos microbicidas das respostas
inata e adaptativa, protozoários do gênero Leishmania desenvolveram diversos
mecanismos de evasão para prevenir o desenvolvimento de uma imunidade esterilizante (Olivier e cols., 2005). Inicialmente, promastigotas metacíclicas escapam da lise mediada pelo complemento com o auxílio das moléculas de superfície LPG e gp63; a primeira inibe a formação do complexo de ataque à membrana, e a segunda cliva fragmentos C3b em suas formas inativas C3bi, que opsonizam os parasitos para serem reconhecidos pelos receptores
de complemento CR1 e CR3 e facilitam a fagocitose (Sacks & Sher, 2002). Além disso, a molécula de LPG atrasa a fusão do fagossomo ao lisossomo e a proteína gp63 inibe a atividade de hidrolases lisossomais, prevenindo a destruição dos parasitos (Zambrano-Villa e cols., 2002).
A resposta protetora mediada por macrófagos e células dendríticas é dependente da ativação de diversas vias de sinalização iniciadas pela ativação de um receptor presente na célula hospedeira, e essas vias de sinalização atuam por um balanço entre estímulos negativos e positivos. Leishmania, assim como outros patógenos intracelulares, são capazes de distorcer esse balanço entre influências positivas e negativas e prejudicar a montagem de uma resposta protetora por interferirem sobre as vias de sinalização dependentes principalmente de Ca2+, fator de transcrição nuclear κB (NF-κB), cinase c-Jun N-terminal (JNK), proteína cinase C (PKC) e proteínas cinases ativadas por mitógeno (MAPK) (Olivier e cols., 2005). Como consequências desses processos, teremos, por exemplo, a inibição da produção de moléculas de MHC e co-estimuladores, prejudicando a apresentação de antígenos, inibição da produção de IL-12 e do desenvolvimento da
resposta Th1, estimulação da produção das citocinas imunossupressoras IL-10 e TGF-β e
consequente indução da resposta de células T reguladoras (Mougneau e cols., 2011; Olivier e cols., 2005; Sacks & Sher, 2002; Zambrano-Villa e cols., 2002).
Nos últimos anos, tem-se avaliado a importância da expressão de ectonucleotidases na superfície de parasitos do gênero Leishmania como um mecanismo de escape da resposta imune, já que essas enzimas levarão à hidrólise do ATP, com conhecidas propriedades inflamatórias, até adenosina, uma importante substância anti-inflamatória (Berredo-Pinho e cols., 2001; Maioli e cols., 2004; Marques-da-Silva e cols., 2008). Os efeitos do ATP e da adenosina na resposta imune também serão tratados adiante.
21 significativa propriedade vasodilatadora (Kamhawi, 2000), além de propriedades imunomoduladoras, pelo aumento da síntese de IL-10, IL-6 e TGF-β, e diminuição da síntese de IL-12, TNF-α, IFN-γ e NO (Brodie e cols., 2007; Rogers & Titus, 2003; Soares e cols., 1998; Wheat e cols., 2008). Saliva de flebotomíneos, além de induzir a produção de IL-10 por células dendríticas, estimula a produção de prostaglandinas E2, que atua sobre a
própria célula dendrítica, gerando efeitos anti-inflamatórios (Carregaro e cols., 2008). A saliva contém, ainda, ectonucleotidases capazes de produzir ADP, AMP e adenosina; os dois últimos também estão naturalmente presentes na saliva. O ADP possui propriedade anti-agregação plaquetária. AMP e adenosina inibem a agregação plaquetária, são vasodilatadores e possuem propriedades imunomoduladoras (Ribeiro e cols., 1999).
1.3. Células dendríticas
Células dendríticas são essenciais para a resposta imune inata e para a conexão entre as respostas inata e adquirida, inclusive durante a infecção por Leishmania (Brandonisio e cols., 2004). Essas células foram descritas pela primeira vez na década de 70, por Steinman e colaboradores (Steinman & Cohn, 1973; Steinman & Cohn, 1974; Steinman e cols., 1974). Morfologicamente, foram destacadas das outras células do baço por serem células grandes, com citoplasma arranjado em pseudópodos que variam em comprimento, largura, forma e número, resultando numa variedade de formas celulares, que vão de formas alongadas bibolares a células elaboradas e estreladas. Essas células parecem estender e retrair em resposta a delicados processos celulares. O citoplasma contém muitos grânulos e não há evidência morfológica de atividade endocítica ativa. O núcleo é muito grande e com uma espessa membrana (Steinman & Cohn, 1973). No fim dessa mesma década, essas células assumiram o papel de potentes estimuladoras da reação mista de leucócitos (Steinman & Witmer, 1978).
22 função. Ambas expressam altos níveis da integrina CD11c, da molécula apresentadora de
antígeno MHCII, e dos co-estimuladores CD86 e CD40; CD8α é um marcador específico
de células linfoides. Em camundongos, a relação entre células de Langerhans (população de células dendríticas presentes na pele) e células dendríticas linfoides e mieloides não é completamente compreendida, mas sabe-se que células de Langerhans compartilham a maioria de seus marcadores com células dendríticas mieloides (Banchereau e cols., 2000).
Essas células são particularmente frequentes em tecidos não linfoides que formam uma interface com o ambiente externo, onde funcionam como sentinelas, capturando patógenos para serem levados aos tecidos linfoides (Granucci e cols., 2008). Embora essa seja a via natural de resposta dessas células, um grande número de células dendríticas presentes nos órgãos linfoides são derivadas de células do sangue e são consideradas células residentes, e respondem a antígenos transferidos por células que migraram a partir da periferia ou antígenos que chegaram a esses órgãos pelas vias linfática ou sanguínea, sem serem carreados por células (Coquerelle & Moser, 2010; Reis e Sousa, 2006).
23 internalização de células infectadas ou tumorais; esse tipo de apresentação é essencial para a ativação de linfócitos T citotóxicos contra vírus que não infectam células dendríticas e contra células tumorais (Coquerelle & Moser, 2010).
Após o contato com micro-organismos ou outras substâncias infecciosas ou inflamatórias, as células dendríticas iniciam o processo de maturação. Tal processo é caracterizado pelo aumento da expressão de MHCII e dos co-estimuladores CD40, CD80, CD86 e CD54, diminuição da capacidade fagocítica, aumento da secreção de citocinas, e expressão de diferentes receptores de quimiocinas. Durante o processo de maturação, essas células adquirem, ainda, a capacidade de migrar para as zonas de células T dos órgãos linfoides, onde são capazes de apresentar os antígenos a células T naive e modular a resposta das últimas (Banchereau e cols., 2000; Brandonisio e cols., 2004). Células dendríticas imaturas residentes nos órgãos periféricos expressam vários receptores de quimiocinas, dentre eles CCR1, CCR2 e CCR5. Após a ativação, há diminuição da expressão dessas moléculas e é estimulada a expressão de CCR7, o receptor para as quimiocinas CCL19 e CCL21, que guia a migração das células em questão para os órgãos linfoides. Recentemente, tem sido mostrado que, além da quimiotaxia, o CCR7 controla a cito-arquitetura, a sobrevivência, a velocidade de migração e a maturação de células dendríticas (Sanchez-Sanchez e cols., 2006). CXCR4, o receptor para a quimiocina CXCL12, também tem se mostrado importante para a migração de células dendríticas a partir da pele para os linfonodos (Kabashima e cols., 2007). Essas alterações na expressão
de receptores de quimiocinas ocorrem, principalmente, por intermédio das citocinas IL-1β
e TNF-α, produzidas pelas próprias células dendríticas e por outras células presentes na periferia. Outros eventos são também associados ao processo de migração, dentre eles: a produção de IL-12p40, a ação da colagenase de matriz metaloproteinase-9 e a atividade da
enzima CD38, uma glicoproteína que catalisa a conversão de NAD+ em cADP-ribose, um
mensageiro intracelular (Cumberbatch e cols., 2000; Sanchez-Sanchez e cols., 2006). Células dendríticas são as únicas células capazes de induzir a resposta de células B e T sem o uso de adjuvantes. Produzem uma ampla variedade de citocinas e conseguem direcionar a resposta para praticamente qualquer população de célula T auxiliar, como Th1, Th2 e Th17, que então serão responsáveis por estimularem os inúmeros mecanismos efetores da imunidade adaptativa (Coquerelle & Moser, 2010).
24
auto-imunidade. Citocinas imunossupressoras, principalmente TGF-β e IL-10, produzidas
por células dendríticas, têm ação direta sobre o desenvolvimento, homeostase e/ou funções de células T reguladoras e outros tipos celulares (Coquerelle & Moser, 2010). Existem, ainda, células dendríticas que expressam co-estimuladores negativos, como PD-L1 e
B7-H1, mesmo na presença de co-estimuladores convencionais (CD80, CD86 e CD40) – e que
também são tolerogênicas –, e células que produzem citocinas inflamatórias (TNF-α, IL-1 e IL-12) e citocinas supressoras (IL-10 e TGF-β) simultaneamente – e que por serem produtoras de citocinas são consideradas maduras. Sendo assim, o balanço entre os diversos sinais de co-estimulação positiva e negativa, que muitas vezes se dá de forma quantitativa e sutil e que altera durante a maturação / ativação de células dendríticas, deve controlar as funções opostas dessas células. Resumindo, é um equívoco associar de forma simplista células dendríticas imunogênicas e tolerogênicas a células maduras ou imaturas, respectivamente (Coquerelle & Moser, 2010; Reis e Sousa, 2006).
1.4. Influência da infecção por Leishmania na resposta de células dendríticas
Muitos estudos têm avaliado a interação entre parasitos do gênero Leishmania e células dendríticas, e os resultados dessa interação dependem, principalmente, da espécie do parasito e da população de célula dendrítica utilizadas (Brandonisio e cols., 2004; Soong, 2008). L. amazonensis é capaz de modular diversas funções de células dendríticas, por alterarem a expressão dos marcadores MHCII, CD80 e CD86 e a produção das citocinas IL-10 e IL-12 (Favali e cols., 2007; Prina e cols., 2004; Qi e cols., 2001; Vasquez e cols., 2008; Xin e cols., 2008). L. major também é capaz de modular a resposta de células dendríticas, sendo determinante no balanço entre respostas Th1 e Th2 em camundongos resistentes ou susceptíveis à infecção por Leishmania (Suzue e cols., 2008). Além disso, essa espécie estimula a expressão de MHCII, CD80, CD86 e CD40 e a produção de IL-12p40 (Liu e cols., 2009) e interfere sobre a produção de quimiocinas, bem como a expressão de receptores de quimiocinas, atuando sobre a capacidade migratória de células dendríticas por diminuir a expressão de CCR5 e aumentar a expressão de CCR7 (Steigerwald & Moll, 2005). Infecção por L. braziliensis induz a ativação de células
dendríticas e a montagem de uma resposta imune protetora (Vargas-Inchaustegui e cols.,
2008), assim como mantém essas mesmas células com baixa expressão de marcadores de ativação, mas capazes de produzir TNF-α (Carvalho e cols., 2008). Por fim, um estudo
25 prejudicada, o que pode contribuir para a imunossupressão e para a patogênese da leishmaniose visceral (Ato e cols., 2002).
Embora muito se saiba sobre os efeitos da infecção por Leishmania na resposta de células dendríticas, os mecanismos envolvidos ainda não estão completamente estabelecidos.
1.5. ATP, adenosina e resposta inflamatória
Uma resposta imune adequada se dá pela interação entre mecanismos pró e anti-inflamatórios, uma vez que o controle da inflamação previne um excesso de dano tecidual (Sitkovsky & Ohta, 2005).
O ATP, quando liberado para o meio extracelular, por exemplo, em situações de injúria, tem sido descrito como sinal de perigo, estimulando assim, uma resposta inflamatória, caracterizada principalmente pela produção de IL-12 e TNF-α (La Sala e cols., 2003). Este nucleotídeo estimula a adesão de neutrófilos ao endotélio vascular e consequente migração para os locais de injúria, além de estimular a fagocitose e ativar os mecanismos microbicidas dessas células (Bours e cols., 2006). O ATP extracelular também desempenha um papel importante no recrutamento de monócitos e na produção de imunomediadores por macrófagos, como citocinas (IL-1α, IL-1β, IL-6, IL-18 e TNF-α), quimiocinas e eicosanóides, além de óxido nítrico e ROIs (Bours e cols., 2006). Essa molécula ainda induz a maturação de células dendríticas para um perfil estimulador da resposta Th1 (Bours e cols., 2006; La Sala e cols., 2003). A proliferação de linfócitos e ativação de linfócitos T citotóxicos também é estimulada por ATP (Bours e cols., 2006).
As concentrações extracelulares de ATP e adenosina, produto do catabolismo do
ATP, são controladas pelas enzimas ENTPDase, que hidrolisa ATP até AMP, e 5’
-nucleotidase, que hidrolisa AMP até adenosina. Ambas enzimas estão presentes em diversas populações celulares (Kumar & Sharma, 2009). A expressão das mesmas tem sido apontada como responsável pela resposta imunossupressora de células T reguladoras e células de Langerhans (Borsellino e cols., 2007; Deaglio e cols., 2007; Mizumoto e cols., 2002).
A família de NTPDases compreende um grupo de 8 enzimas, dentre as quais 4 são ancoradas na membrana celular e possuem o sítio catalítico voltado para a face extracelular (NTPDase 1,2 3 e 8). A NTPDase 1, também conhecida como ENTPDase ou CD39,
26 glicosiladas dessas enzimas possuem uma massa molecular predita de 55-60 kDa (Robson e cols., 2006; Zimmermann, 2000). A enzima 5’-nucleotidase, também conhecida como CD73, está presente na superfície celular ou em sua forma solúvel. É uma enzima com
massa molecular de 64-72 kDa e que apresenta o Zn2+ como cofator (Zimmermann, 2000).
A razão de hidrólise do ATP é maior do que a hidrólise do AMP e os valores de Km são
mais elevados para a hidrólise de ATP e ADP que para a hidrólise de AMP (Zimmermann, 1996).
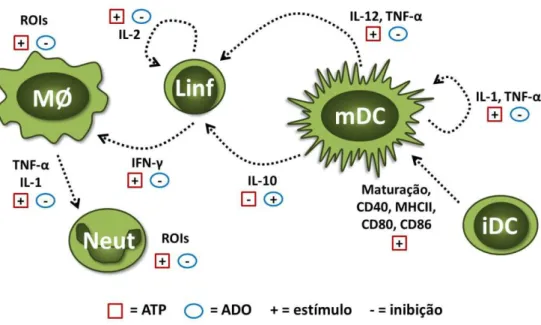
A adenosina, balanceando a atividade pró-inflamatória do ATP, desempenha propriedades imunomoduladoras, pela inibição da produção de citocinas inflamatórias por macrófagos e células dendríticas e da produção de substâncias microbicidas por neutrófilos e macrófagos, e pela estimulação da síntese de IL-10 (Bours e cols., 2006; Deaglio e cols., 2007; Kumar & Sharma, 2009). Uma síntese do papel de ATP e adenosina em diferentes células do sistema imune é mostrada na figura 2.
Figura 2. Efeitos do ATP e da adenosina sobre células do sistema imune. O ATP presente no meio extracelular atua sobre diversas células. É capaz de estimular a produção de ROIs por macrófagos e neutrófilos, a produção de IL-1 e TNF-α por macrófagos e células dendríticas e a
produção de IL-12 por células dendríticas maduras, a produção de IL-12 leva à diferenciação de linfócitos produtores de IFN-γ. A adenosina, produzida a partir da hidrólise do ATP por ectonucleotidases, tem efeitos antagônicos ao ATP, levando à diminuição da produção de citocinas pró-inflamatórias e substâncias microbicidas por neutrófilos e macrófagos, além de estimular a produção de IL-10 por células dendríticas, levando à imunossupressão. iDC: célula dendrítica imatura; inf: linfócito; mDC: célula dendrítica madura; MΦ: macrófago; Neut: neutrófilo; ROIs:
27
1.6. Sinalização purinérgica
Todas as respostas mediadas pelo ATP extracelular são iniciadas pela ativação de receptores purinérgicos conhecidos como receptores P2. Os receptores P2 ainda são subdivididos em dois subgrupos: receptores P2X, que são associados a canais iônicos, e receptores P2Y, que são receptores com sete domínios transmembrana acoplados à proteína G (Bours e cols., 2006; Di Virgilio e cols., 2001). Já foram descritos sete receptores P2X (P2X1-7) e todos eles respondem primariamente ao ATP (Di Virgilio e
cols., 2001). Destacamos o receptor P2X7 porque além de sinalizar a presença de ATP
extracelular, é capaz de mediar a secreção dessa molécula (Pellegatti e cols., 2005). Os
receptores P2Y ainda se subdividem em grupos dependendo de sua especificidade: P2Y1 e
P2Y11 são específicos para purinas, P2Y4 e P2Y6 são específicos para pirimidinas, P2Y2
apresenta seletividade mista, P2Y12 e P2Y13 respondem apenas a ADP e P2Y14 a UDP
(Bours e cols., 2006).
A adenosina exerce seus efeitos por meio de 4 subtipos de receptores – A1, A2A,
A2B e A3 –, que variam em distribuição celular, afinidade e funções. Os receptores A2 são
responsáveis pela resposta anti-inflamatória da adenosina, enquanto os receptores A1 e A3
parecem regular a ação dos receptores A2, com o objetivo de prevenir um excesso de
inibição das células imunes (Abbracchio & Ceruti, 2007). O receptor A2A tem maior
afinidade para adenosina, seguido pelos receptores A2B, A1 e A3, nessa ordem. Como os
receptores A1 e A3 possuem menor afinidade, serão ativos somente em concentrações
elevadas de adenosina, já com o objetivo de regular a ação desse nucleosídeo (Abbracchio & Ceruti, 2007).
Os quatro receptores de adenosina são membros da família de receptores acoplados à proteína G (Abbracchio & Ceruti, 2007), e podem ativar diferentes vias de sinalização. Esses receptores foram originalmente classificados de acordo com sua capacidade de estimular (receptores A2) ou inibir (receptores A1 e A3) a enzima adenilato ciclase, e
consequentemente, estimular ou não a produção de AMPc, respectivamente (Schulte & Fredholm, 2003). O segundo mensageiro AMPc interage com diferentes moléculas efetoras, como proteína cinase A (PKA), proteína de troca diretamente ativada por AMPc (Epac) e a fosfatidilinositol-3-cinase (PI3K) (especialmente para o receptor A2B). Essas
28 Fredholm, 2003; Serezani e cols., 2008). Outras proteínas envolvidas nas cascatas de
sinalização via receptor A2B são a p38, JNK, proteína cinase B/Akt (PKB/Akt) e NF-κB,
mas os efeitos desencadeados pela ativação dessas proteínas ainda não são bem conhecidos (Aherne e cols., 2011; Jacobson & Gao, 2006; Schulte & Fredholm, 2003).
A interação da adenosina ao receptor A2B pode, ainda, ativar a enzima fosfolipase
C, levando a um aumento dos níveis intracelulares de Ca2+ e da ativação da PKC, que também desencadeará suas funções via ERK, inibindo a expressão de CD40, a produção de IL-12p40 e a apoptose (Aherne e cols., 2011; Hasko e cols., 2009). Receptores A1 e A3
também podem levar à ativação da fosfolipase C, mas os efeitos decorrentes dessa ativação sobre a resposta imune ainda não são bem elucidados (Schulte & Fredholm, 2003).
A figura 3 mostra um esquema simplificado dos pontos relevantes da sinalização purinérgica, classificados como relevantes dentro de nosso estudo, e seus possíveis efeitos sobre a resposta imune.
Figura na próxima página.
Figura 3. Influência da sinalização purinérgica sobre a resposta imune. (1) Células dendríticas expressam em sua superfície ectonucleotidases capazes de hidrolisar o ATP extracelular até adenosina, que então poderá ativar 4 tipos de receptores, sendo eles A1, A2A, A2B e A3, e desencadear vários efeitos. (2) O receptor P2X7 pode ter um papel importante
na secreção de ATP, fornecendo substrato para ação das enzimas ectonucleotidases. (3) As subunidades α da proteína G
acoplada aos receptores A2A e A2B são estimuladoras da adenilato ciclase, que leva ao acúmulo de AMPc. Esse
mensageiro ativa as proteínas Epac e PKA, que posteriormente ativam MEK e ERK, levando à inibição da geração de mediadores inflamatórios, da atividade microbicida e da fagocitose. (4) A proteína PKA ainda pode estimular vias com participação da proteína p38 e do fator de transcrição CREB. (5) O acúmulo de AMPc intracelular também pode ativar a proteína PI3K, que por sua vez ativa 2 vias diferentes, a primeira via PKB e NF-κB, e segunda, dependente de MEK e ERK, levando à inibição da expressão de CD40, da produção de IL-12 e da apoptose. (6) As subunidades α da proteína G
acoplada aos receptores A1 e A3 são inibidoras da adenilato ciclase, e esses receptores parecem prevenir um excesso de
inibição de células imunes. (7) A proteína JNK também é ativada pelo receptor A2B, mas por um processo desconhecido.
(8) A ativação do receptor A2B ainda pode levar ao acúmulo de Ca2+ intracelular via fosfolipase C. O Ca2+ acumulado ativa a PKC, que por sua vez ativa as proteínas MEK e ERK, gerando efeitos já descritos. 5’-NT: fosfohidrolase de
nucleosídeos 5’-monofosfatados; AC: adenilato ciclase; DAG: diacilglicerol; ENTPDase: ecto-difosfohidrolase de nucleosídeos trifosfatados; Epac: proteína de troca diretamente ativada por AMPc; ERK: cinase regulada por sinal extracelular; IP3: inositol trifosfato; JNK: cinase c-Jun N-terminal; MEK: cinase de proteína cinase ativada por mitógeno;
NF-κB: fator de transcrição nuclear κB; PI3K: fosfatidilinositol-3-cinase; PIP2: fosfatidilinositol bifosfato; PKA: proteína
29
Fi
gu
ra
3
. In
flu
ên
cia
d
a
si
na
liz
aç
ão
p
ur
in
ér
gica
so
br
e
a
re
spo
st
a
im
un
e.
L
eg
en
da
n
a
pá
gin
a
an
te
rio
30
1.7. ATP e adenosina na resposta de células dendríticas
Células dendríticas expressam em sua superfície ectonucleotidases e receptores funcionais para ATP (Berchtold e cols., 1999), bem como receptores para adenosina (Ben Addi e cols., 2008; Novitskiy e cols., 2008; Wilson e cols., 2009), e, portanto, estão sujeitas aos efeitos desencadeados por nucleotídeos e nucleosídeos presentes no meio extracelular.
Estudos apontam o ATP como uma molécula capaz de induzir a maturação e ativação de células dendríticas, por estimular a expressão de MHCII, CD80, CD83, CD86
e CD54 e a produção de IL-12, IL-1, TNF-α e IL-6, auxiliando no estabelecimento de uma
resposta inflamatória (La Sala e cols., 2001; Schnurr e cols., 2000). Além disso, esse nucleotídeo é capaz de alterar a expressão de receptores de quimiocinas, aumentando a expressão de CCR7 e diminuindo a expressão de CCR5 (La Sala e cols., 2002).
A adenosina, em contrapartida, diminui a migração de células dendríticas (Hofer e cols., 2003), além de reduzir a produção de CXCL10 e estimular a produção de CCL17, favorecendo a atração de células do perfil Th2 (Panther e cols., 2003). A diminuição da
produção de IL-12 e TNF-α e o aumento da produção de IL-10 são observados em células
dendríticas tratadas com adenosina (Panther e cols., 2003), mas dados sobre os efeitos da adenosina sobre a expressão de marcadores de ativação (MHCII, CD80 e CD86) são contraditórios (Hofer e cols., 2003; Panther e cols., 2003; Wilson e cols., 2009).
1.8. Justificativa
A infecção por parasitos do gênero Leishmania causa uma série de manifestações
32
2. OBJETIVOS
2.1. Objetivo geral
Avaliar a participação da hidrólise do ATP extracelular e da ativação de receptores de adenosina na modulação da resposta de células dendríticas de camundongos C57BL/6J infectadas por Leishmania.
2.2. Objetivos específicos
Avaliar o efeito da infecção por diferentes espécies de Leishmania sobre o estado
de ativação de células dendríticas.
Avaliar a participação da citocina IL-10 sobre o estado de ativação de células dendríticas infectadas.
Comparar células dendríticas não infectadas e células dendríticas infectadas em relação à expressão e atividade de ectonucleotidases e expressão de receptores de adenosina.
Avaliar a participação de ectonucleotidases e receptores de adenosina sobre o estado de ativação de células dendríticas infectadas.
Avaliar o efeito da infecção por Leishmania sobre a capacidade de células
34
3. MATERIAL E MÉTODOS
3.1. Animais e parasitos
Camundongos das linhagens C57BL/6J e BALB/c de 2 a 4 meses de idade foram obtidos e mantidos no Centro de Ciência Animal da Universidade Federal de Ouro Preto, onde receberam água e alimento ad libitum. Todos os procedimentos aos quais os animais foram submetidos foram aprovados pela Câmara de Experimentação Animal do Comitê de Ética em Pesquisa, dessa mesma instituição, pelo Ofício CEP n° 005/2009, de 16 de janeiro de 2009, como comprovado pelo documento em anexo.
Promastigotas de Leishmania (Leishmania) amazonensis, cepa PH8
(IFLA/BR/67/PH8 – La), Leishmania (Viannia) braziliensis, cepa M2903
(MHOM/BR/75/M2903 – Lb) e Leishmania (L.) major, cepa Friedlin
(MHOM/IL/80/Friedlin – Lm) foram cultivadas em meio de Grace (Sigma-Aldrich, St. Louis, MO, EUA) suplementado com 10% de soro fetal bovino inativado (SFB – LGC,
Cotia, SP, Brasil), L-glutamina (Gibco BRL, Grand Island, NY, EUA) 2 mM e penicilina G
(USB Corporation, Cleveland, OH, EUA) 100 U/mL, pH 6,5, a 25°C. Promastigotas metacíclicas foram enriquecidas a partir de parasitos de cultura em fase estacionária (5° dia) por centrifugação em gradiente de Ficoll, como previamente descrito por Spath e Beverley (Spath & Beverley, 2001) e adaptado por Marques-da-Silva (Marques-da-Silva e cols., 2008). Os parasitos foram lavados duas vezes com salina tamponada com fosfato (PBS), pH 7,2, a 1540 x g / 4°C / 10 minutos e o precipitado foi ressuspendido em meio DMEM (Sigma-Aldrich), pH 7,2 e sobreposto em Ficoll 400 (Sigma-Aldrich) 10%. A preparação foi centrifugada a 1.070 x g / 25 °C / 15 minutos, o sobrenadante enriquecido de promastigotas metacíclicas foi retirado e os parasitos foram novamente lavados.
Para os experimentos de infecção de células dendríticas in vitro, promastigotas
metacíclicas, ressuspendidas em PBS / 5% SFB, pH 7,2, a uma concentração de 6 x 107
35
Figura 4. Marcação de parasitos com CFSE. Promastigotas metacíclicas de Leishmania
foram incubadas na presença de CFSE, conforme descrito anteriormente. Para avaliar a eficácia do método avaliaram-se os parasitos por citometria de fluxo.
3.2. Obtenção de células dendríticas derivadas de medula óssea
Células dendríticas foram diferenciadas a partir de células da medula óssea, como previamente descrito (Lutz e cols., 1999). Retiraram-se fêmures e tíbias de camundongo C57BL/6J e imergiram-se os ossos em álcool 70°GL por 2 minutos, seguidos por imersão em PBS, pH 7,2. Cortaram-se as duas epífises e injetaram-se, pelas extremidades, 5 mL de PBS / 5% SFB, pH 7,2. A suspensão de células foi centrifugada a 210 x g / 4°C / 10 minutos e as células foram ressuspendidas em meio RPMI-1640 (Sigma-Aldrich)
suplementado com 10% de SFB, L-glutamina 2 mM, penicilina G 100 U/mL e β
-mercaptoetanol (Pharmacia Biotech AB, Uppsala, Suécia) 50 µM, pH 7,2. As células foram plaqueadas em placas de Petri a uma concentração de 3 x 105 células/mL, e
incubadas a 37°C / 5% CO2. O fator estimulador de colônias de granulócitos e monócitos
(GM-CSF – R&D Systems, Minneapolis, MN, EUA) foi adicionado a cada placa nos dias
36
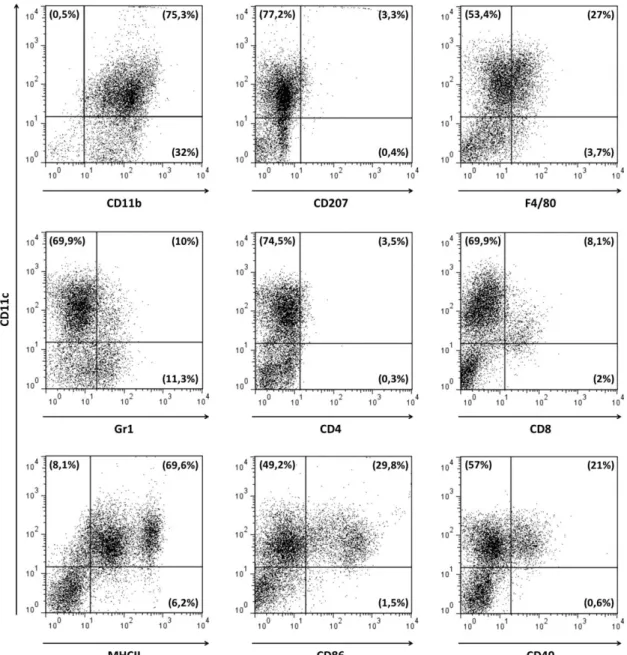
Figura 5. Caracterização da população de células dendríticas. Células dendríticas obtidas após 9 dias de cultivo na presença de GM-CSF foram analisadas por citometria de fluxo. Avaliou-se a expressão dos marcadores de superfície CD11c, CD11b, CD207, F4/80, Gr-1, CD4, CD8, MHCII, CD86 e CD40. Os números entre parênteses representam a porcentagem de células presentes nos respectivos quadrantes.
3.3. Infecção de células dendríticas in vitro
Promastigotas metacíclicas e células dendríticas foram co-incubadas em tubos de polipropileno, numa proporção de 3 parasitos por célula dendrítica, a 33°C / 5% CO2, por 3
horas. Para permitir a completa ativação dessas células, lipopolissacarídeo (LPS – Sigma-Aldrich), a uma concentração de 2 µg/mL, foi adicionado à cultura e as células foram incubadas a 37°C / 5% CO2, por mais 17 horas. Células dendríticas infectadas foram
37 microscopia de fluorescência, ou utilizadas em ensaios de proliferação. Para as análises por dosagem da atividade ectonucleotidásica e microscopia de fluorescência, foi utilizada a proporção de 10 parasitos por célula dendrítica, como explicado no texto.
Em alguns experimentos, células dendríticas foram previamente incubadas por 30 minutos, a 25°C, na presença de 15 µg/mL do anticorpo monoclonal 1B1.3a (Harlan Bioproducts for Science, Indianapolis, IN, EUA) para bloquear o receptor de IL-10, e então submetidas à infecção; IgG de rato (produzida em nosso laboratório) foi utilizada como controle de isotipo. Em outros experimentos, suramina (Sigma-Aldrich) ou antagonistas de receptores de adenosina A2A e A2B, 4-(2-[7-amino-2-(2-furil)[1,2,4]triazol
[2,3-α][1,3,5]triazina-5-ilamino]etil)fenol (ZM241385) e
N-(4-cianofenil)-2-[4-(2,3,6,7-tetrahidro-2,6-dioxo-1,3-dipropil-1H-purina-8-il)fenoxi]-acetamida (MRS1754),
respectivamente (Tocris Bioscience, Park Ellisville, MO, EUA), foram adicionados no momento da infecção de células dendríticas como descrito nas legendas das figuras. Ambos ZM241385 e MRS1754 foram diluídos em dimetilsufóxido, que foi adicionado às culturas controles.
3.4. Avaliação da viabilidade celular
A viabilidade de células dendríticas foi avaliada por coloração com azul de Trypan e por marcação com iodeto de propídeo. Suspensões de células foram diluídas em igual volume de azul de Trypan (Sigma-Aldrich) 0,4% e as células contadas em câmara de Neubauer. Fez-se a contagem diferencial das células vivas (íntegras e não coradas) e das células mortas (permeabilizadas e coradas em azul). Por fim, calculou-se a porcentagem de células viáveis. Células a uma concentração de 107 células/mL, em PBS, pH 7,2, foram incubadas na presença de iodeto de propídeo (Sigma-Aldrich), a uma diluição de 1:500, por 1 minuto, a 25°C. Lavaram-se as células com PBS, pH 7,2, e ressuspendeu-se em uma solução de 1% de paraformaldeído, cacodilato de sódio 47,7 mM e NaCl 113 mM, pH 7,2. Por fim, as células foram analisadas por citometria de fluxo.
3.5. Determinação da produção de IL-10
38
3.6. Dosagem da atividade ectonucleotidásica
As atividades de hidrólise de ATP, ADP e AMP foram medidas pela incubação de 5 x 103 (para ATP ou ADP) ou 5 x 104 (para AMP) células dendríticas intactas por 1 hora a
30°C em tampão de reação (NaCl 116 mM, KCl 5,4 mM, D-glicose 5,5 mM, MgCl2 5 mM
e tampão HEPES-tris 50 mM, pH 7,2), na presença de ATP, ADP ou AMP (Sigma-Aldrich) 5 mM. Para os experimentos de bloqueio da atividade ectonucleotidásica, as células foram incubadas na presença dos inibidores suramina ou α,β-metileno adenosina difosfato (α,β-MAD – Sigma-Aldrich), ambos na concentração final de 200 µM. A reação foi interrompida pela adição, na proporção 2:1, de carvão diluído em HCl 0,1 M (Meyer-Fernandes e cols., 1997). Hidrólise não específica foi determinada pela adição de células após a reação ser interrompida. As suspensões foram centrifugadas e alíquotas dos sobrenadantes foram usadas para a quantificação do Pi liberado adicionando-se 1/3 do
volume do sobrenadante de uma mistura contendo 1 parte de molibdato de amônio 10% diluído em HCl 4M para 3 partes de verde de malaquita 0,2% diluído em HCl 4M. Foi feita uma curva padrão utilizando diferentes concentrações de soluções de Na3PO4, numa
quantidade máxima de 31,25 nmol de Pi, reagindo com a mesma mistura descrita acima. A
quantificação do Pi liberado foi feita após 10 minutos de incubação, a 25°C, por
espectrofotometria sob comprimento de onda de 650 nm (Ekman & Jager, 1993). Por fim, a atividade enzimática, indiretamente determinada pela quantidade de Pi liberado, foi
calculada pela subtração da hidrólise não específica e ajustada para valores gerados por 106 células/hora.
3.7. Microscopia de fluorescência
105 células foram lavadas com PBS, pH 7,2, sedimentadas em lâminas por centrifugação a 300 x g / 10 minutos, a após completa secagem das lâminas, foram fixadas e permeabilizadas com metanol por 2 minutos. Após lavagem com PBS, pH 7,2, realizou-se o bloqueio do receptor para Fcγ na presença do anticorpo anti-CD16/CD32 de
camundongo (eBioscience, San Diego, CA, EUA), a 0,5 µg/106 células, em PBS, pH 7,2,
por 5 minutos. Descartou-se todo o líquido e procedeu-se com a incubação com os
anticorpos de coelho anti-A1 ADOR (policlonal H-40), anti-A2A ADOR (policlonal H-82),
anti-A2B ADOR (policlonal H-40) ou anti-A3 ADOR (policlonal H-80 – Santa Cruz
39 substituindo os anticorpos primários por IgG de coelho normal. Todos os anticorpos foram diluídos a 1:50 em PBS, pH 7,2. Lavaram-se as lâminas duas vezes com PBS, pH 7,2. Seguiu-se com a incubação com o anti-IgG de coelho conjugado a FITC (Sigma-Aldrich), diluído a 1:100 em PBS, pH 7,2, por 30 minutos, a 4°C, ao abrigo da luz. Lavaram-se as lâminas duas vezes com PBS, pH 7,2. Adicionou-se uma solução de iodeto de propídeo, diluído a 1:100 em PBS, pH 7,2, e incubou-se por 1 minuto, a 25°C, ao abrigo da luz. Escorreu-se todo o líquido e aguardou-se a completa secagem, overnight. Fixaram-se lâmina e lamínula com Mowiol® 4-88 (Sigma-Aldrich), preparado seguindo instruções do fabricante, e aguardou-se completa secagem das lâminas para análise ao microscópio de fluorescência. Todas as lâminas foram mantidas a 4°C, ao abrigo da luz, até o momento da análise. As lâminas foram examinadas no microscópio de fluorescência Olympus BX51 e as imagens foram adquiridas com o auxílio do programa Image-Pro Express 4.0 (Media Cybernetics, Bethesda, MD, EUA). Utilizou-se o microscópio do Laboratório de Neuro-Imuno Patologia Experimental (UFMG), coordenado pela professora Rosa Maria Esteves Arantes.
3.8. Ensaio de proliferação antígeno-específica
Camundongos C57BL/6J foram inoculados no coxim plantar esquerdo com 107
promastigotas de L. amazonensis. Os camundongos foram eutanasiados na 10ª semana de infecção, e os baços retirados e macerados em DMEM, pH 7,2. As hemácias foram lisadas com solução de cloreto de amônio e as células lavadas com PBS, pH 7,2, por centrifugação a 210 x g / 4°C / 10 minutos. Ajustou-se a concentração de células para 107/mL, em PBS / ácido etilenodiaminotetra acético (EDTA) 2 mM, pH 7,2, acrescentou-se IgG de rato purificada (produzida em nosso laboratório) a 1 µg/107 células e incubou-se por 30 minutos, a 4°C. Lavaram-se as células com PBS, pH 7,2 e ajustou-se a concentração para 108/mL, em PBS / EDTA 2 mM, pH 7,2. As células foram, então, incubadas com o anticorpo GK1.5-biotinado (anticorpo anti-CD4 de camundongo, produzido em nosso laboratório), a uma concentração de 0,75 µg/107 células, por 30 minutos, a 4 °C. Lavaram-se as células duas vezes com PBS / EDTA 2 mM, pH 7,2 e ressuspendeu-Lavaram-se na mesma
solução, ajustando a concentração de células para 108/900 µL. Acrescentaram-se 100 µL
de estreptoavidina conjugada com beads magnéticos (Miltenyi Biotec GmbH, Bergisch
Gladbach, Alemanha) por 108 células. Incubou-se por 15 minutos, a 4°C e lavaram-se as
40 108/mL, em PBS / EDTA 2 mM / 0,5% albumina sérica bovina (BSA), pH 7,2. A separação magnética de células CD4 foi realizada por passagem das células através de colunas MS acopladas ao separador MiniMACS (Miltenyi Biotec GmbH), seguindo instruções do fabricante. A pureza dos linfócitos T CD4+ foi de aproximadamente 90%, conforme análise por citometria de fluxo. A concentração de linfócitos foi ajustada para 5
x 106 células/mL, em PBS / 5% SFB, pH 7,2. Esta suspensão foi incubada com CFSE 5
µM a 25°C, por 5 minutos, ao abrigo da luz (Quah e cols., 2007). As células foram lavadas duas vezes com PBS, pH 7,2, e ressuspendidas em RPMI-1640 suplementado com 10% de
SFB, L-glutamina 2 mM, penicilina G 100 U/mL, HEPES 25 mM e β-mercaptoetanol 50
µM, pH 7,2. Linfócitos (5 x 105 células) foram co-cultivados com células dendríticas previamente infectadas (5 x 104 células), em placas de 48 poços, num volume total de 500
µL/poço. As co-culturas foram incubadas a 37°C / 5% CO2. Após 4 dias, as células foram
coletadas para serem analisadas por citometria de fluxo.
3.9. Reação mista de leucócitos (MLR)
Para o ensaio de MLR, células de baço de camundongos BALB/c não infectados foram marcadas com CFSE como descrito anteriormente. Leucócitos (5 x 105 células) foram co-cultivados com células dendríticas previamente infectadas (5 x 104 células), em placas de 48 poços, num volume total de 500 µL/poço. As co-culturas foram incubadas a 37°C / 5% CO2. Após 4 dias, as células foram coletadas para serem analisadas por
citometria de fluxo. Analisou-se a proliferação de células CD3+.
3.10. Citometria de fluxo
Células a uma concentração de 107 células/mL, em PBS / 1% BSA, pH 7,2, foram
submetidas ao bloqueio do receptor para Fcγ na presença do anticorpo anti-CD16/CD32 de
camundongo, a 0,5 µg/106 células, em PBS, pH 7,2, por 5 minutos. 25 µL da suspensão de
células foram incubados com a combinação dos anticorpos de interesse a 4°C, por 30 minutos, ao abrigo da luz. Os anticorpos utilizados foram: anti-CD11c (APC, FITC ou PE-Cy7, clone HL3, a 1 µg/106 células), anti-CD40 (FITC, clone 3/23, a 1 µg/106 células –
BD Pharmingen, San Diego, CA, EUA), anti-CD11b (FITC, clone M1/70, a 1 µg/106
células), anti-MHCII (APC, clone M5 114.15.2, a 0,004 µg/106 células), anti-CD86 (PE,
41 µg/106 células), anti-CD73 (PE, clone TY.11.8, a 0,125 µg/106 células), anti-CD4 (FITC, clone RM4-5, a 0,025 µg/106 células), anti-CD8 (PerCP-Cy5.5, clone 53-6.7, a 0,25 µg/106 células – eBioscience), anti-F4/80 (PE-Cy7, clone BM8, a 0,1 µg/106 células), anti-Gr-1 (FITC, clone RB6-8C5, a 0,25 µg/106 células), anti-CD3ε (PE, clone 145-2C11, a 0,25 µg/106 células – BioLegend, San Diego, CA, EUA), e seus respectivos controles de isotipo. Todos os anticorpos utilizados são específicos para camundongos. As suspensões foram centrifugadas e as células lavadas com PBS, pH 7,2 e ressuspendidas em uma solução de 1% de paraformaldeído, cacodilato de sódio 47,7 mM e NaCl 113 mM, pH 7,2.
As amostras foram analisadas no citômetro de fluxo BD FACSCaliburTM. A aquisição de
células foi realizada com o auxílio do programa BD CellQuestTM Pro. A análise dos dados
foi realizada utilizando o programa FlowJo (Tree Star, Ashland, OR, EUA).
3.11. Análise estatística
43
4. RESULTADOS
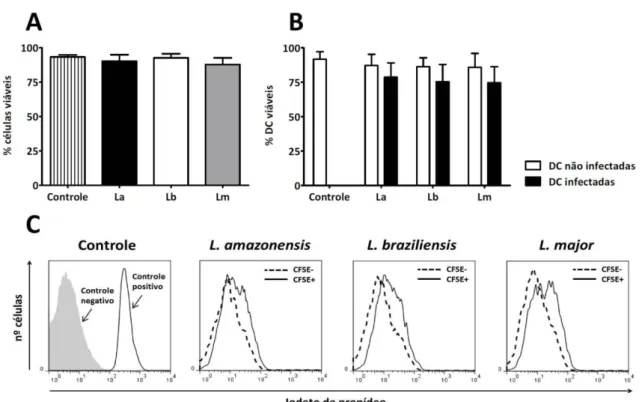
4.1. Leishmania infecta células dendríticas sem alterar a viabilidade celular
Iniciamos este trabalho pela avaliação da capacidade de promastigotas de diferentes espécies de Leishmania de infectar células dendríticas. Células dendríticas derivadas de
medula óssea foram incubadas na presença de promastigotas metacíclicas de L.
amazonensis, L. braziliensis ou L. major previamente marcadas com CFSE, numa
proporção de 3 parasitos por célula dendrítica, e analisadas por citometria de fluxo. Após 3 horas de incubação, L. amazonensis foi capaz de infectar uma maior quantidade de células
dendríticas, quando comparada a L. braziliensis ou L. major (Figura 6A). Após 20 horas,
encontramos uma média de 35 a 45% de células infectadas, e os resultados foram similares entre as 3 espécies de parasitos (Figura 6B). É importante considerar que todos os tratamentos realizados ao longo deste trabalho não interferiram sobre a capacidade de infecção dos parasitos (dados não mostrados).
Figura 6. Infecção de células dendríticas com promastigotas metacíclicas de L. amazonensis, L. braziliensis ou L. major. Células dendríticas obtidas após 9 dias de cultivo com GM-CSF foram incubadas com promastigotas metacíclicas marcadas com CFSE na proporção de 3 parasitos por célula. Incubou-se por 20 h, sendo as 3 h iniciais a 33°C / 5% CO2 e
o restante a 37°C / 5% CO2. Após o primeiro período de incubação, as células foram estimuladas com LPS. Por fim,
analisou-se a porcentagem de células CFSE+ após 3 h (A) ou 20 h (B) de incubação, por meio da citometria de fluxo. Os
resultados representam média e desvio padrão de pelo menos dois experimentos independentes. Asteriscos indicam diferença estatística (p < 0,05, ANOVA one-way seguida pelo pós-teste de Tukey) entre os grupos ligados.
44
Figura 7. Viabilidade de células dendríticas infectadas com Leishmania. Células dendríticas foram infectadas conforme descrito na figura 6. (A) Porcentagem de células viáveis calculada a partir da contagem diferencial das células vivas e das células mortas, coradas pelo azul de Trypan. (B) Células dendríticas foram separadas em populações de células não infectadas (células CFSE-) e de células infectadas (células CFSE+), e a incorporação de iodeto de propídeo foi
avaliada nas duas populações. Por fim, avaliou-se a porcentagem de células que não incorporaram iodeto de propídeo (células viáveis). Os resultados representam média e desvio padrão de três experimentos independentes. (C) Histogramas da intensidade de iodeto de propídeo representativos de três experimentos independentes.
4.2. Promastigotas metacíclicas de Leishmania alteram a expressão de marcadores de superfície em células dendríticas