Universidade de Lisboa
Faculdade de Farmácia
Doença Inflamatória Intestinal
Papel dos Medicamentos Biológicos na Terapêutica
Ana Beatriz Duarte Bonito
Mestrado Integrado em Ciências Farmacêuticas
2
Universidade de Lisboa
Faculdade de Farmácia
Doença Inflamatória Intestinal
Papel dos Medicamentos Biológicos na Terapêutica
Ana Beatriz Duarte Bonito
Monografia de Mestrado Integrado em Ciências Farmacêuticas apresentada à Universidade de Lisboa através da Faculdade de Farmácia
Orientador: Doutor Rui Manuel Amaro Pinto, Professor Auxiliar
3 RESUMO
A Doença Inflamatória Intestinal (DII) é um problema crescente na sociedade atual, sendo uma das patologias com maior prevalência nos países desenvolvidos. Os mecanismos envolvidos na sua etiologia ainda não são totalmente conhecidos, no entanto, sabe-se que a componente genética, as alterações na resposta imunitária e o desequilíbrio do microbioma intestinal desempenham um papel fundamental na fisiopatologia desta doença.
A terapêutica da DII está em constante desenvolvimento, devido ao estudo aprofundado que os mecanismos por detrás da doença têm sofrido ao longo dos últimos anos. Os medicamentos que demonstraram ser, até à data, mais promissores são os agentes biológicos. Estes fármacos apresentam resultados clínicos bastante positivos, conseguindo atingir, na maioria das vezes, as metas terapêuticas mais rápida e eficazmente que os tratamentos convencionais. Todavia, existem alguns obstáculos à utilização dos medicamentos biológicos. O facto de os seus efeitos a longo prazo e do seu modo de ação ainda serem incertos, faz com que alguns médicos prescritores não confiem a 100% nesta terapêutica, usando-a apenas caso a terapêutica convencional não obtenha os resultados esperados. O custo elevado é também uma desvantagem dos biológicos, contudo, começam já a aparecer no mercado fármacos biossimilares que poderão potencialmente eliminar este problema.
No futuro, novas estratégias terapêuticas com novos agentes biológicos estarão disponíveis, o que permitirá colmatar algumas lacunas que ainda existem, especialmente em doentes que não responde ao tratamento que existe atualmente.
O farmacêutico, como profissional de saúde, é um elemento chave no acompanhamento do doente com DII, devendo mostrar-se disponível para esclarecer todas as dúvidas e inseguranças e estar atento a todos os efeitos ou sintomas manifestados ao balcão da farmácia.
Palavras-chave: Doença Inflamatória Intestinal; Doença de Crohn; Colite Ulcerosa;
4 ABSTRACT
Inflammatory Bowel Disease (IBD) is an emerging problem in today’s society, being one of the most prevalent pathologies in the developed countries. The mechanisms involved in its etiology are not yet fully understood, however, it is known that the genetic component, changes in the immune response and imbalance of the intestinal microbiome play a major role in the manifestation of this disease.
IBD therapy is in constant development, since the mechanisms behind this disease have undergone in-depth study in recent years. The drugs that have proven, to date, to be the most promising are the biologic agents. Its clinical results are quite satisfying, as with them we are able to achieve, most of the times, therapeutic goals faster and more effectively than with conventional treatments. However, there are still some setbacks when it comes to biologic drugs. The fact that their long-term effects and their mechanisms are still quite uncertain, makes the prescribing doctors a little insecure as to the reliability of this treatment, so biologics are used only as back-up therapy for when the conventional treatment doesn’t work out. Their high cost is also a disadvantage, but biosimilar drugs have begun to appear on the market, which could resolve this problem. In the future, new therapeutic strategies, along with new biologic agents, will be available, which will fill some gaps that still exist, especially in those patients who don’t respond to the treatment that is currently used.
The pharmacist, as a health professional, plays a key role in the guidance of an IBD patient, and should be available to clarify any doubts and insecurities and be attentive to all the adverse effects or symptoms expressed at the pharmacy.
Keywords: Inflammatory Bowel Disease; Crohn’s Disease, Ulcerative Colitis; Biologic
5 ABREVIATURAS
ACAFs: Anticorpos anti-fármaco ASA: Aminossalicilatos
CU: Colite Ulcerosa DC: Doença de Crohn
DII: Doença Inflamatória Intestinal EMA: Agência Europeia do Medicamento EU: União Europeia
IgG: Imunoglobulina G
IGRA: Ensaio de libertação do INF-ƴ IL: Interleucina
INF: Interferão JAK: Cinase Janus MI: Microbiota Intestinal mTNF: TNF-α transmembranar NK: Natural killer
NOD: Domínio de oligomerização do nucleótido
PPAR: Recetor ativador da proliferação do peroxissoma RCM: Resumo das Características do Medicamento SNS: Sistema Nacional de Saúde
STAT: Transdutor de Sinal e Ativador de Transcrição TB: Tuberculose
Th: Células T helper
TNF: Fator de Necrose Tumoral TNFR: Recetor do fator TNF-α
6 ÍNDICE
Capítulo I: Introdução à Doença Inflamatória Intestinal ---Pág. 8 a. A Epidemiologia da DII --- Pág. 8 b. O Impacto na Saúde Pública da DII ---Pág. 9 Capítulo II: Materiais e Métodos ---Pág. 10 Capítulo III: Fisiopatologia da DII ---Pág. 11
a. Microbiota Intestinal e Epitélio Intestinal ---Pág. 11 b. Sistema Imunitário e Processo Inflamatório ---Pág. 11 c. Componente Genética --- Pág. 12 Capítulo IV: Terapêutica Convencional da DII ---Pág. 13
a. Aminossalicilatos --- Pág. 13 b. Corticosteroides --- Pág. 13 c. Imunomoduladores --- Pág. 14 d. Antibióticos e Probióticos --- Pág. 15 Capítulo V: Terapêutica Biológica da DII ---Pág. 17 a. Definição ---Pág. 17 b. Classes ---Pág. 18 i. Anti TNF-α ---Pág. 18 1. Mecanismo de Ação ---Pág. 18 2. Medicamentos autorizados pela EMA ---Pág. 18 3. Biossimilares ---Pág. 22 4. Contraindicações e Utilização na Gravidez ---Pág. 23 ii. Inibidor das Interleucinas (IL-12/IL-23) ---Pág. 24 1. Mecanismo de Ação ---Pág. 24 2. Medicamentos autorizados pela EMA ---Pág. 25 iii. Inibidor de Moléculas de Adesão ---Pág. 26 1. Mecanismo de Ação ---Pág. 26 2. Medicamentos autorizados pela EMA ---Pág. 26 c. Esquema Terapêutico dos Medicamentos Biológicos na DII ---Pág. 27 d. Eficácia da Terapêutica Biológica ---Pág. 29 e. Complicações da Terapêutica Biológica ---Pág. 30 i. Infeções ---Pág. 30 ii. Imunogenicidade ---Pág. 32 iii. Carcinogénese ---Pág. 33 Capítulo VI: O Futuro da Terapêutica na DII ---Pág. 35 Capítulo VII: O Papel do Farmacêutico na vida do doente com DII---Pág. 37 Capítulo VIII: Conclusão ---Pág. 38 Referências Bibliográficas ---Pág. 40 Anexos ---Pág. 55 A1. Figura 3 --- Pág. 55 A2. Figura 4--- Pág. 55
7
A3. Tabela 1 --- Pág. 56 A4. Tabela 2 --- Pág. 57
Índice de Figuras
Figura 1 – Processo de produção de fármacos biológicos --- Pág. 22 Figura 1 – Novas abordagens terapêuticas da DII --- Pág. 36 Figura 3 - Prevalência global da DII em 2015 --- Pág. 55 Figura 4 - Prevalência da DII nos 20 distritos de Portugal no ano de 2007 --- Pág. 55
Índice de Tabelas
Tabela 1 - Citoquinas com possível envolvimento na patogénese da DII --- Pág. 56 Tabela 2 - Associações genéticas da DC e da CU --- Pág. 57
8 CAPÍTULO I: INTRODUÇÃO À DOENÇA INFLAMATÓRIA INTESTINAL
A DII consiste num grupo de doenças crónicas idiopáticas que afetam o trato gastrointestinal. Dependendo da sua extensão, estas dividem-se em Colite Ulcerosa e Doença de Crohn. Uma combinação de ambas as variantes pode também ocorrer, tratando-se, neste caso, de Colite Indeterminada (1).
A Colite Ulcerosa (CU) é uma doença inflamatória não transmural que está restringida ao cólon. Dependendo da sua extensão, esta pode ser designada de proctite, colite esquerda ou pancolite. Quanto à Doença de Crohn (DC), esta corresponde a uma doença inflamatória transmural que pode afetar o tubo digestivo desde a boca ao ânus. Consoante a porção afetada, ela pode manifestar-se pelo aparecimento de fístulas, abcessos ou estrangulamento do intestino (2).
Tanto a DC como a CU têm manifestações clínicas semelhantes, sendo necessário a realização de uma colonoscopia com biópsia, após a realização de outros testes que apontem para DII, para confirmar qual das variantes está presente (3). Dentro dos sintomas gastrointestinais deste grupo de doenças incluem-se diarreia, obstipação, sangramento ou dor retal, urgência em evacuar, tenesmos, cólicas e dor abdominal e ainda vómitos ou náuseas (4). Além destes, a DII tem também expressão extraintestinal estando frequentemente associada à presença de febre, perda de peso, anemia, atraso no desenvolvimento e maturação sexual em crianças, artralgias, osteoporose e artrite, lesões mucocutâneas como úlceras aftosas, complicações oftálmicas e ainda doença renal e hepática (3,5).
a. A Epidemiologia da DII
A DII é uma doença dos tempos modernos (6). Estudos sugerem que o seu aparecimento está relacionado com a industrialização dos países, tendo ganho maior expressão a partir da Revolução Industrial. O seu grau de incidência e prevalência aumentou significativamente desde o século 20, sendo que atualmente estas taxas são mais elevadas na Europa e na América (7) [ver ANEXOS Figura 3]. Há várias hipóteses que tentam explicar esta distribuição geográfica, como é o caso da Hipótese da Higiene. Esta sugere que uma pessoa menos exposta a infeções e más condições sanitárias perde alguns microrganismos essenciais à defesa do organismo ou não tem o sistema imunitário tão apto para combater possíveis agressões (8,9). Outra hipótese diz respeito às alterações do estilo de vida e da dieta que se verificaram nos países desenvolvidos e à possibilidade de estas diferenças desempenharem um papel importante no desenvolvimento de doenças crónicas (4).
Quando comparado com outros países europeus, Portugal encontra-se a meio da tabela, com tendência a aproximar-se daqueles que registam maior prevalência de DII. Foi realizado um estudo em Portugal, entre os anos de 2003 e 2007, no qual se utilizou uma abordagem fármaco-epidemiológica. Este concluiu que a prevalência aumentou de 86 novos casos em 2003 para 146 em 2007 a cada 100 000 habitantes, sendo este aumento consistente em todos os distritos portugueses [ver ANEXOS figura 4]. Quanto à faixa etária em que a doença tem maior expressão, para a DC concluiu-se que a prevalência é maior entre os 17 e os 39 anos enquanto para a CU se situa entre os 40 e os 46 anos.
9
Ambas das patologias demonstraram ser ligeiramente mais prevalentes na mulher que no homem (10).
b. O Impacto na Saúde Pública da DII
A DII tem uma grande influência na qualidade de vida do doente, tendo um impacto negativo nesta especialmente em casos graves ou em fases ativas da doença (11,12). Está provado que a qualidade dos cuidados prestados, nomeadamente a cortesia, continuidade dos cuidados, informação prestada, autonomia, acomodação e custos, tem um papel importante na qualidade de vida dos doentes. Em muitos casos, esta doença interfere com o trabalho do doente e até mesmo com as suas relações pessoais, uma vez que os sintomas são bastante imprevisíveis e desconfortáveis. Como tal, os profissionais de saúde devem estar atentos e sensibilizados para a carga psicológica adicional associada à DII. É importante que o profissional de saúde reconheça a importância das Associações de doentes com DII e que encaminhe os doentes para estas, pois é-lhes benéfico ter contato com pessoas que sofrem da mesma doença e com as quais se identifiquem e possam partilhar as suas experiências (13,14).
Nem todos os casos são diagnosticados no primeiro ano após a manifestação dos primeiros sintomas, o que também contribui para a diminuição da qualidade de vida. Estes casos de diagnóstico tardio sobrecarregam o sistema de saúde, como tal, é importante que o acesso a médicos especialistas seja facilitado e que protocolos sejam desenvolvidos com o intuito de diminuir o tempo de espera pelo diagnóstico final. Sendo que a maioria doentes que se encontram nesta situação de pré-diagnóstico se dirige às urgências hospitalares várias vezes, é importante que haja uma consciencialização junto dos prestadores destes cuidados para a DII e para os sintomas que a ela possam estar associados (15).
10 CAPÍTULO II: MATERIAIS E MÉTODOS
Os métodos utilizados para a redação da presente monografia foram, na sua maioria, a pesquisa de informação acerca dos vários aspetos da DII, abordados ao longo deste trabalho, em artigos, publicados a partir do ano 2001, disponíveis nas bases de dados dos motores de busca PubMed e Nature. Os referidos motores de busca são considerados fontes fidedignas e atualizadas de informação científica, sendo os adequados para este tema.
Além disso, foram também consultadas plataformas e artigos de entidades e organizações responsáveis pela gestão e coordenação desta matéria, como é o caso do INFARMED, a EMA e o Grupo de Estudo da Doença Inflamatória Intestinal (GEDII). Adicionalmente, foram consultados os RCM dos medicamentos utilizados na terapêutica da DII, obtidos com recurso à plataforma Infomed.
11 CAPÍTULO III: FISIOPATOLOGIA DA DII
Nos últimos anos, inúmeros estudos têm sido desenvolvidos com o objetivo de descobrir a fisiopatologia concreta tanto da DC como da CU. Existem algumas teorias que tentam explicar a origem etiológica da DII, sendo elas:
• Infeção gastrointestinal persistente
• Função barreira da mucosa intestinal anormal • Imunorregulação defetiva
• Depuração microbiana anormal
• Ratio anormal de agentes microbianos comensais benéficos e prejudiciais
O mais aceite atualmente é que a DII deriva de um conjunto de fatores predisponentes num organismo geneticamente suscetível. A suscetibilidade genética é influenciada pela microbiota intestinal que fornece antigénios ou adjuvantes que, por sua vez, estimulam uma resposta imunitária patogénica ou protetora. Fatores ambientais indutores são também necessários para que haja uma ativação física da doença (16).
a. Microbiota intestinal (MI) e o Epitélio Intestinal
A MI diz respeito aos microrganismos que habitam no intestino, existindo aproximadamente 1150 espécies bacterianas identificadas, ainda que cada indivíduo possua apenas cerca de 160 dessas espécies (17). A microbiota intraluminal tem um papel fundamental em vários mecanismos essenciais ao organismo uma vez que afeta o desenvolvimento do sistema imunitário intestinal, fornece nutrientes essenciais e regula o metabolismo energético (18).
De acordo com inúmeros estudos, a flora intestinal dos doentes com DII apresenta-se, tanto nos segmentos inflamados como nos não inflamados, significativamente diminuída no que diz respeito à biodiversidade da microbiota fecal benéfica (19). Num intestino saudável predominam os filos Firmicutes e Bacteroidetes que produzem substratos intestinais metabólicos. Contudo, na DC estes encontram-se diminuídos, havendo uma sobrexpressão de enterobatérias, enquanto na CU há uma redução de
Clostridium spp e um aumento de E. coli (20).
O papel barreira da mucosa intestinal depende de tight junctions e de junções intercelulares. Na DII, o espaço paracelular têm uma permeabilidade aumentada e o mecanismo regulador das tight junctions é anormal (21). Assim sendo, os agentes patogénicos externos têm maior facilidade em penetrar no epitélio intestinal (22).
Existem ainda outros tipos de disfunção intestinal que podem originar inflamação como é o caso de defeitos no desenvolvimento ou proliferação das células epiteliais, na adesão da célula à matriz, na reconstrução epitelial após lesão ou no stress do retículo endoplasmático (23).
b. Sistema Imunitário e Processo Inflamatório
Está provado que disfunções nas vias do sistema imunitário inato e adquirido contribuem para a anormal resposta inflamatória intestinal presente nos doentes com DII (17) [ver ANEXOS Tabela 1]. Quando estamos perante a DII na sua forma ativa verifica-se uma infiltração bastante pronunciada na lâmina própria de células
12
imunitárias inatas, como é o caso dos neutrófilos, macrófagos, células dendríticas e células T natural killers (NK), assim como de células T e células B, pertencentes ao sistema imunitário adquirido (24).
Em pessoas saudáveis, a lâmina própria contém geralmente um conjunto de diferentes células imunitárias e citoquinas. Este inclui mediadores anti-inflamatórios (IL-10 e TGFβ), que fazem a down-regulation da resposta imunitária, e mediadores pró-inflamatórios que limitam a entrada excessiva de microbiota intestinal e protegem contra agentes patogénicos. Deste modo, um balanço homeostático é mantido entre as células T reguladoras e as células T efetoras (Th1, Th2 e Th17). Em pessoas com DII, as células inatas produzem níveis aumentados de TNFα, IL-1β, IL-6, IL-12, IL-13 e quimiocinas que induzem uma marcada expansão da lâmina própria. Um aumento da produção de quimiocinas resulta no recrutamento de leucócitos adicionais, o que dá origem a um ciclo inflamatório (24).
Estudos recentes demonstraram que o comportamento das células que medeiam a imunidade inata e a expressão dos recetores TLRs e NOD (onde ocorre o reconhecimento dos antigénios) está significativamente alterada nos doentes com DII (25). Quanto à resposta imunitária adquirida, esta depende do tipo e quantidade de células T. As células Th1, induzidas pela IL-12, produzem uma grande quantidade de IFNγ, enquanto as células Th2 libertam IL-4, IL-5 e IL-13. Pensa-se que uma resposta imunitária Th1 anormal é a causa da inflamação intestinal na DC, tendo sido observado uma maior produção de IL-12 e IFNγ por parte das células T em comparação com pessoas saudáveis ou com CU (26). Também foi demonstrado que, na CU, células T NK atípicas produzem maiores quantidades de citoquinas IL-13 Th2 quando comparado com a produção das células T do controlo ou da DC (27).
c. Componente Genética
A DII tem uma forte componente genética, estimando-se, no entanto, que apenas se conhecem 20% das associações genéticas que predispõem para esta doença. Estudos recentes associam, até à data, 163 loci genéticos à DII, dos quais 110 estão associados a ambas as patologias, 30 são específicos da DC e 23 são específicos da CU (28) [ver
ANEXOS Figura 2].
Como referido anteriormente, existem múltiplos genes associados tanto à DC como à CU, nomeadamente genes relacionados com a via de sinalização da IL-23, como é o caso dos IL23R, JAK2, STAT3 ou o p40 (29,30).
Por sua vez, as associações genéticas específicas da DC mais importantes incluem o gene autofágico ATG16L1,2 e o gene NOD2, sendo este último o primeiro gene de suscetibilidade identificado para a DII (31).
Quanto à CU, esta patologia tem sido associada a alterações genéticas na região do cromossoma 12q15, que abrange os genes IL-26 e INFγ, e na região do cromossoma 1q32 que contém o gene IL-10 (30,32). No entanto, alterações na região do complexo major de histocompatibilidade classe 2, perto da cadeia alfa, são as que mais significado têm no que diz respeito ao aparecimento desta patologia (33).
13 CAPÍTULO IV: TERAPÊUTICA CONVENCIONAL NA DII
Os objetivos da terapêutica na DII são a redução do processo inflamatório durante a fase reativa e o aumento do período durante o qual o doente se encontra sem sintomas clínicos. Como tal, aquando da escolha do tratamento, há que ter em conta vários fatores, como a extensão e severidade da doença, frequência das recaídas, presença de sintomas extraintestinais, local das lesões e estado clínico geral do doente. A terapêutica escolhida vai depender assim do balanço entre a eficácia e os efeitos secundários causados pelo fármaco utilizado, assim como da resposta do doente à terapêutica (34). Idealmente, a terapêutica deve incluir um imunomodulador que controle eficazmente a inflamação sem que haja, no entanto, uma imunossupressão exacerbada. Além disso, esta deve ter o mínimo de efeitos secundários com poucas ou nenhumas complicações relacionadas com a inflamação, translocação microbiana e sem progressão para cancro (35).
a. Aminossalicilatos (ASA)
Os ASA são um grupo de fármacos cuja substância ativa é o ácido 5-aminosalicílico. A sua ação provém da inibição da quimiotaxia dos macrófagos e do aumento da proliferação de células epiteliais intestinais, que ocorre devido à inibição do TNFα e à sub-regulação das vias de sinalização da MAP e do fator nuclear (NF)-kB (36). Além disso, também exercem o seu efeito na DII através da ativação do PPARc, um fator importante na regulação da doença uma vez que antagoniza importantes moléculas inflamatórias (37).
Os mais usualmente prescritos na DII são a messalazina, sulfassalazina, olsalazina e a balsalazina, sendo a messalazina o ASA de eleição (38). Estes compostos são utilizados habitualmente como primeira linha no tratamento da CU, tanto na indução como na manutenção da remissão da doença. Quanto à sua utilização na DC, esta aparenta ter resultados positivos, no entanto ainda se encontra em estudo (39).
Os ASA são geralmente seguros e bem tolerados pelos doentes, contudo, é comum a presença de vários efeitos secundários. Os mais frequentemente descritos são: diarreia, náuseas e vómitos, cefaleias, dor abdominal, fadiga, mialgias e artralgias, fraqueza e alterações hepáticas (38). Quanto à via de administração, tanto a terapêutica oral como a retal são eficazes, sendo essa eficácia aumentada quando há uma combinação de ambas as terapêuticas (40).
Embora este grupo de fármacos seja a primeira escolha no tratamento da CU, doentes pouco ou nada responsivos à terapêutica ou a existência de efeitos secundários significativos constituem uma barreira importante para o sucesso completo deste tratamento (36).
b. Corticosteroides
Para tratar exacerbações agudas da DII, os corticosteroides representam uma das melhores opções terapêuticas disponíveis. Estes suprimem a inflamação através do bloqueio das manifestações precoces, como a permeabilidade vascular aumentada, a vasodilatação e a infiltração de neutrófilos, e das consequências tardias da mesma, como a ativação dos fibroblastos, proliferação vascular e deposição do colagénio. Além disso,
14
também exercem efeitos na resposta imunitária, influenciando as respostas das células T aos antigénios, regulando negativamente a produção de citoquinas inflamatórias e interferindo na produção do fator nuclear (NF-kB) (41).
Os corticosteroides mais prescritos são a prednisolona, metilprednisolona e a budesonida. Estes podem ser administrados oralmente, na forma de enemas ou sistemicamente, isolados ou em associação com outros fármacos. Estes são amplamente utilizados para induzir a remissão tanto na DC como na CU, conseguindo-se resultados positivos em poucos dias, além de que têm um custo baixo e são de fácil acesso. No entanto, o seu uso prolongado leva a um aumento da ocorrência de efeitos secundários como acne, osteoporose, síndrome metabólico, doença cardiovascular, infeções, osteonecrose e cataratas (42).
Apesar da sua eficácia na fase ativa da doença, os corticosteroides não são utilizados como tratamento de manutenção. Um terço dos doentes submetidos a corticosteroides não responde à terapêutica, como tal é necessário um tratamento alternativo como um biológico ou uma ciclosporina. Além disso, uma vez que esta terapêutica pode originar efeitos adversos variados, é necessário que existam outras opções com atividade sistémica reduzida (43).
c. Imunomoduladores
Os imunomoduladores são fármacos imunossupressores que atuam através da inibição da proliferação e ativação dos linfócitos, diminuindo assim a resposta inflamatória (43). Os mais utilizados na DII são: azatioprina, 6-mercaptopurina, metotrexato, ciclosporina A e tacrolimus. A utilização deste tipo de terapêutica é apropriada:
• Em caso de intolerância ou falta de resposta aos aminossalicilatos, antibióticos ou corticosteroides;
• Na DII dependente de esteroides;
• Na DII perianal que não responde a antibióticos;
• Na presença de fístulas ou para aumentar a eficácia do tratamento biológico (44). A azatioprina é um pro-fármaco que é convertido em 6-mercaptopurina. Da sua metabolização resulta, entre outros, o metabolito 6-tioguanina, sendo este o responsável pela eficácia terapêutica e pelos efeitos secundários da azatioprina (43). Tanto esta como a 6-mercaptopurina são eficazes na indução e na manutenção da remissão na DC e na CU. No entanto, têm um inicio de ação lento (3 a 6 meses para máximo efeito) logo, inicialmente, costumam ser combinados com outro fármaco que tenha um inicio de ação mais rápido, como os corticoides (45). Os seus efeitos secundários incluem cefaleias, náuseas, vómitos, diarreia e mal-estar. Podem também ocorrer outas complicações mais graves como pancreatite e mielossupressão (44).
O metotrexato tem um inicio de ação mais rápido que as tiopurinas, sendo mais eficaz quando administrado semanalmente através de injeções (44). Este é utilizado na indução e manutenção da remissão na DC nos doentes que são intolerantes ou que não respondem à terapêutica com azatioprina ou 6-mercaptopurina (46). Embora seja normalmente bem tolerado, os seus efeitos secundários mais comuns incluem náuseas, estomatite, diarreia, perda de cabelo, leucopenia, fibrose hepática e pneumonite intersticial (47).
15
O tacrolimus é um inibidor da calcineurina usado habitualmente em doentes com DC fistulizante ou com CU refratária (48). Geralmente é bem tolerado, no entanto carece de estudos acerca da sua eficácia e segurança a longo-prazo (49). Os seus efeitos secundários, como a nefrotoxicidade, são dose-dependente mas reversíveis com a redução da dose ou com a cessação da terapêutica (48).
A ciclosporina é um poderoso imunossupressor utilizado em doentes com CU que têm graves episódios ativos da doença e que não respondem ao tratamento convencional. A terapêutica com ciclosporina intravenosa ajuda a evitar a colectomia em muitos doentes com CU severa (50). Os seus efeitos secundários são semelhantes aos do tracolimus e incluem diminuição da função renal, hepatite, aumento do risco de infeções, diabetes, hipercolesterolemia, cefaleias e hipertensão (44).
d. Antibióticos e Probióticos
Considerando a predominância de bactérias intestinais prejudiciais nos doentes com DII, as complicações inflamatórias causadas pela terapêutica imunossupressora e a sub-regulação da imunidade da mucosa, o uso de antibióticos no tratamento da DII não deve ser subestimado (51). Como tal, antibióticos de largo espectro têm sido prescritos como tratamento adjuvante ou de primeira linha, sendo os mais utilizados o metronidazole, ornidazole, ciprofloxacina, tobramicina, claritromicina, cotrimoxazole, rifaximina e o tratamento anti tuberculose (43).
Além da sua mais-valia nas complicações infeciosas da DII, os antibióticos têm sido também usados no tratamento e na prevenção da recorrência pós-operatória da DC perianal. No entanto, a sua aplicação na CU é pouco suportada pela evidência científica, à exceção da sua utilização na pouchite (35).
No geral, os antibióticos constituem uma terapia adjuvante importante, uma vez que reduzem a carga bacteriana intestinal, o risco de recaída e a progressão e severidade da doença. No entanto, esta terapêutica pode originar disbiose, que por sua vez pode levar à expansão das colónias bacterianas nocivas e assim piorar o estado da doença. Como estes fármacos não são capazes, por si só, de restaurar o equilíbrio entre microrganismos prejudiciais e benéficos no intestino, terapias alternativas são necessárias para controlar tanto este aspeto como a inflamação intestinal exacerbada (52).
Outra opção para restaurar a homeostasia intestinal é através da utilização de probióticos (52), que são microrganismos vivos não patogénicos administrados com o intuito de melhorar o balanço microbiano no trato gastrointestinal. Estes consistem em
Saccharomyces boulardii ou bactérias produtoras de ácido láctico, como os Lactobacillus e Bifidobacterium spp (53). Estas bactérias podem ter um papel
importante na alteração da expressão de padrões genéticos, na modulação da resposta imunitária e na modificação dos perfis metabólicos do sangue e tecidos (52). Vários estudos demonstram que uma mistura de probióticos designada de VSL#3 foi capaz de induzir a remissão em doentes com CU leve a moderadamente ativa (54).
Embora os probióticos sejam bem tolerados, podem ocorrer alguns efeitos adversos, como flatulência ou barriga inchada. Estes devem ser usados com precaução em pessoas gravemente doentes, em imunocomprometidos ou em doentes com cateteres venosos, uma vez que podem potenciar o risco de infeções sistémicas (55).
16
Ainda é incerto se a disbiose é causa ou consequência da DII, no entanto todos os estudos realizados sugerem que a manipulação da microbiota poderá ser uma estratégia terapêutica importante para proteger da inflamação intestinal ou até para a tratar (36).
17 CAPÍTULO V: TERAPÊUTICA BIOLÓGICA DA DII
a. Definição
Os medicamentos biológicos são utilizados na prevenção, diagnóstico, tratamento e cura de determinadas doenças. Estes produtos são produzidos com recurso a biotecnologia e a partir de variadas fontes naturais, como culturas celulares, transgénicos, ratinhos, leveduras e até células humanas (56).
Estes fármacos são Medicamentos Sujeitos a Receita Médica restrita e podem ser de diversos tipos, incluindo: isolados e preparações biológicas, como vacinas ou produtos sanguíneos, que contêm microrganismos vivos, atenuados ou mortos; péptidos ou proteínas recombinantes, como a hormona do crescimento ou a eritropoietina; anticorpos ou ácidos nucleicos; terapia celular e genética (57). Atualmente, os fármacos utilizados no tratamento da DII são predominantemente proteínas, administradas intravenosa ou subcutaneamente. Estas são na sua maioria proteínas recombinantes humanas com efeitos imunorreguladores, anticorpos monoclonais e proteínas de fusão (58).
A nível molecular, os agentes biológicos diferem dos agentes químicos em vários aspetos, nomeadamente:
• Geralmente são de alto peso molecular;
• São obtidos a partir de células ou microrganismos vivos; • Envolvem vários passos críticos no processo de produção; • São misturas heterogéneas (pode incluir variantes);
• Não são facilmente identificados e caracterizados; • Geralmente apresentam imunogenicidade (56).
Aquando do início do tratamento com um agente biológico, há determinados fatores que o prescritor tem de ter em conta:
• Caso mais do que um tratamento seja apropriado, deve ser escolhido o menos dispendioso (tendo em conta os custos da administração, a dose e o preço por dosagem);
• Quando o tratamento biológico é selecionado, deve ser prescrito o medicamento mais barato, seja original ou biossimilar;
• Quando o tratamento biológico mais barato não é prescrito, as razões para tal escolha devem ser documentadas;
• A farmacovigilância é essencial para todo o novo medicamento biológico ou biossimilar. Os doentes a fazer este tipo de terapêutica devem ter registos permanentes que permitam recolher dados acerca da sua efetividade e segurança (59).
Comparando com o desenvolvimento da maioria dos fármacos, o dos biológicos tem sido relativamente rápido. O tratamento da DII com este tipo de moléculas apresenta uma grande especificidade, no entanto, o custo elevado da terapêutica é ainda uma barreira à sua utilização. Este aspeto, juntamente com o facto da utilização de fármacos biológicos ainda ser algo recente, faz com que estes sejam usados normalmente apenas
18
como alternativa em doentes refratários aos aminossalicilatos ou aos corticosteroides (60).
b. Classes
i. Anti TNF-α
1. Mecanismo de Ação
Os avanços na terapêutica da DII que resultaram da introdução de anticorpos monoclonais contra a TNF-α comprovaram que esta citoquina exerce um papel fundamental na patologia da doença (61).
A TNF-α é produzida tanto em células imunes como não imunes, incluindo macrófagos, células dendríticas, células T, fibroblastos e células adiposas, na mucosa intestinal inflamada dos doentes com DII (62). Esta citoquina tem os seguintes efeitos na parede intestinal:
• Indução da angiogénese (63);
• Ativação dos macrófagos levando à produção de citoquinas pro-inflamatórias; • Favorece a morte das células de Paneth via necroptose;
• Aumento da apoptose das células epiteliais intestinais;
• Redução da produção do inibidor tecidular das metaloproteinases da matriz pelos fibroblastos (64).
Embora os inibidores da TNF-α apresentem uma grande especificidade no tratamento de doenças inflamatórias crónicas, através da redução rápida do número de células no local da inflamação, até à data ainda não existe consenso quanto aos seus mecanismos de ação. Normalmente, estes enquadram-se em duas categorias: nos mecanismos mediados pelo bloqueio do TNFR e nos mediados pela ligação de um inibidor à mTNF. Independentemente do mecanismo, existirá o bloqueio da ativação da TNF-α, o que por sua vez diminuirá a resposta inflamatória intestinal (65).
2. Medicamentos autorizados pela EMA
• Infliximab
Este fármaco biológico existe sob a forma de pó para concentrado para solução para perfusão sendo que, cada frasco para injetáveis, contém 100 mg de Infliximab (66). Atualmente na UE, incluindo Portugal, existem 4 medicamentos com esta substância ativa a serem comercializados: Flixabi®, Inflectra™, Remicade® e Remsima™.
O Infliximab é um anticorpo monoclonal IgG1 humano (75%) – murino (25%) quimérico produzido em células de hibridoma de murino pela técnica do ADN recombinante. Este anticorpo é o anti-TNF mais estudado com eficácia comprovada, sendo específico apenas para o TNF-α (67). A ligação inibitória do fármaco a esse fator leva ao aumento do tempo de semivida do TNF-α e, contraditoriamente, à diminuição da sua atividade, o que resulta essencialmente na destruição de células efetoras ativadas via apoptose (68).
19
▪ Tratamento da DC ativa:
o moderada a grave, em adultos que não respondem à terapêutica adequada com um corticosteroide e/ou um imunossupressor ou que apresentam intolerância ou contraindicação para os mesmos;
o com formação de fístulas, em adultos que não apresentam resposta após um ciclo completo com terapêutica convencional;
o grave em pessoas com idade entre os 6 e 17 anos (pediatria), que não responderam à terapêutica convencional ou que são intolerantes à mesma. ▪ Tratamento da CU ativa:
o moderada a grave, em doentes que não respondem adequadamente à terapêutica convencional ou que apresentam contraindicações ou intolerância à mesma;
o grave, em doentes com idades entre os 6 e os 17 anos (pediatria) que não respondem adequadamente à terapêutica convencional ou que apresentam contraindicação ou intolerância à mesma (66).
Quanto à posologia, consoante as características da DII apresentada pelo doente, os esquemas terapêuticos serão ligeiramente diferentes entre si:
▪ DC ativa moderada a grave
5mg/kg via perfusão IV, seguidos da repetição da mesma dose 2 semanas após a primeira perfusão.
Caso o doente seja recetivo à terapêutica após as duas administrações pode optar-se por um regime de manutenção (perfusão de 5mg/kg IV 6 semanas após o inicio do tratamento, seguindo-se administrações sequenciais de 8 em 8 semanas) ou de readministração (perfusão de 5 mg/kg em caso de recorrência de sinais e sintomas da doença).
▪ DC ativa com formação de fístulas
O regime terapêutico é semelhante ao anterior mencionado, com a exceção de que a perfusão de 5m/kg 6 semanas após o início do tratamento ainda faz parte da terapêutica inicial e não da de manutenção. Caso o doente não apresente resposta após as 3 doses, não deve ser feito qualquer tratamento adicional com Infliximab.
▪ CU ativa moderada a grave
5mg/kg administrados sob a forma de perfusão IV, seguidos da repetição dessa dose 2 e 6 semanas após o início do tratamento e depois em intervalos de 8 semanas.
A resposta clínica é geralmente alcançada 14 semanas após o início do tratamento, ou seja, após 3 doses. Caso não haja resposta após este tempo, o tratamento não deve ser continuado (66).
Quanto às interações medicamentosas, não foram realizados estudos. No entanto, na DC há alguma evidência que refere a diminuição da formação de anticorpos anti-Infliximab e o aumento das concentrações plasmáticas deste fármaco aquando da sua co-administração com metotrexato ou outros imunomoduladores (66).
São várias as reações adversas que podem resultar da terapêutica com Infliximab, sendo as mais frequentes: infeções virais e bacterianas; neutropenia, leucopenia,
20
anemia e linfadenopatia; sintomas alérgicos respiratórios; depressão e insónias; cefaleias, tonturas; taquicardia e palpitações; hipotensão ou hipertensão, equimoses, rubor e afrontamentos; dor abdominal e náuseas; função hepática anormal; artralgias e mialgias e algumas afeções da pele (66).
• Adalimumab
As três marcas responsáveis pela comercialização do Adalimumab na UE (Amgevita™, Humira® e Solymbic™) disponibilizam este fármaco nas dosagens 20mg/0,4mL e 40mg/0,8mL, sob a forma de dose única em solução injetável de seringa e caneta pré-cheia ou sob a forma de solução injetável em frasco (69). Este fármaco é um anticorpo monoclonal IgG1 totalmente humano e recombinante expresso em células de ovário do hamster chinês. O Adalimumab liga-se com grande afinidade ao TNF-α, bloqueando a sua interação com o p55 e p75 (recetores da superfície celular). Além disso, inibe também outras respostas moduladas pelo fator pro-inflamatório em questão, como por exemplo a migração leucocitária (65). As indicações terapêuticas para este fármaco são semelhantes às do Infliximab, à exceção da DC ativa com formação de fístulas, condição para a qual não é recomendado (66,70).
Quanto à posologia, esta já difere da do Infliximab, incluindo na sua forma de administração. O Adalimumab é de administração subcutânea o que possibilita que os doentes se possam autoinjetar, após receberem treino adequado sobre a técnica de injeção e caso o médico ache apropriado. O regime terapêutico aconselhado difere consoante as características da doença:
▪ DC ativa moderada a grave
Dose de indução: 80 mg na semana 0 e 40 mg na semana 2. Caso haja necessidade de uma resposta mais rápida, é possível duplicar ambas as doses.
Dose de manutenção: 40mg em semanas alternadas. Caso haja diminuição da resposta terapêutica, pode administrar-se 40mg todas as semanas. Os doentes que não responderam à semana 4 podem beneficiar de uma terapêutica de manutenção continuada durante 12 semanas.
▪ DC ativa moderada a grave pediátrica em doentes com peso inferior a 40kg Dose de indução: 40 mg na semana 0 e 20 mg na semana 2. Caso se queira uma resposta terapêutica mais rápida pode duplicar-se ambas as doses, tendo em conta que o risco de efeitos adversos será superior.
Dose de manutenção: 20mg em semanas alternadas, que pode aumentar para uma administração todas as semanas caso se verifique uma diminuição da resposta terapêutica.
▪ CU moderada a grave
Dose de indução: 160mg na semana 0 e 80 mg na semana 2. Dose de manutenção: 40 mg em semanas alternadas.
A resposta clínica é geralmente atingida dentro de 2-8 semanas após inicio do tratamento. Se tal não se verificar, a terapêutica com Adalimumab deve ser descontinuada (70).
21
Quanto às interações medicamentosas, verificou-se que, quando co-administrado com o metotrexato, o Adalimumab apresenta uma eficácia superior, uma depuração diminuída e uma formação de anticorpos também diminuída. A associação com outros medicamentos biológicos modificadores da artrite reumatoide ou antagonistas da TNF-α (p.e. anacinra, abatacept) não é recomendada uma vez que ensaios clínicos demonstraram o desenvolvimento de infeções graves e de toxicidade (70).
Os efeitos indesejáveis do Adalimumab são semelhantes aos do Infliximab, sendo a reação adversa mais comum o aparecimento de infeções. Além de vários sintomas inespecíficos, o aparecimento de cancro de pele (excluindo melanoma) e de neoplasias malignas também ocorre com alguma frequência (70).
• Golimumab
Este fármaco biológico é o mais recente anti TNF-α disponível no mercado e a única marca responsável pela sua comercialização é a Simponi®. Esta disponibiliza o Golimumab em duas dosagens, 100mg/ml ou 50mg/0,5mL, existindo ambas sob a forma de solução injetável em caneta e seringa pré-cheia para administração subcutânea. (71).
O Golimumab é um anticorpo monoclonal IgG1 humano, produzido por uma linha celular de hibridoma murínica, que tem como alvo uma única epítope do TNF-α (72). Este anticorpo tem afinidade tanto para o TNF solúvel como transmembranar e demonstrou neutralizar a expressão das moléculas de adesão vascular (VCAM-1), B-selectina e intercelular (ICAM-1), à superfície das células. Adicionalmente, inibiu a secreção das IL-6, IL-8 e do fator estimulante de colónias de granulócitos-macrófagos. Um estudo realizado demonstrou que sua a capacidade de neutralização do TNF-α, de indução de citotoxicidade, de ativação de células endoteliais e a sua estabilidade conformacional eram superiores tanto às do Infliximab como do Adalimumab (73).
Ao contrário dos dois medicamentos biológicos referidos anteriormente, o Golimumab, na DII, tem apenas indicação terapêutica para a CU ativa moderada a grave, em doentes adultos que não respondem adequadamente às terapêuticas convencionais ou que apresentam contraindicação para as mesmas. Este fármaco não está indicado para doentes com idade inferior a 18 anos (74).
Quanto à posologia, esta varia consoante o peso corporal do doente: ▪ Peso inferior a 80 kg
Administração de uma dose inicial de 200 mg de Golimumab, seguida de uma dose de 100 mg na 2ª semana e, após esta, 50 mg de 4 em 4 semanas.
▪ Peso superior a 80 kg
Regime terapêutico semelhante, excetuando a terapêutica feita a partir da 2ª semana, onde a dose de manutenção deverá passar de 50 para 100 mg.
A resposta clínica é geralmente alcançada em 12 a 14 semanas de tratamento. Caso tal não se verifique, o médico deverá avaliar a situação e ponderar se a terapêutica deve ser descontinuada (74). A grande vantagem do Golimumab é precisamente a
22
sua posologia e via de administração. Ao contrário do Infliximab, este é administrado subcutaneamente tal como a Adalimumab, no entanto a sua dose de manutenção é feita apenas de 4 em 4 semanas, tornando assim a sua utilização mais cómoda (75).
Quanto aos efeitos adversos, entre os mais comuns incluem-se: infeção do trato respiratório superior e, com menos frequência, infeção do trato respiratório inferior, infeção bacteriana e infeção viral; anemia; broncospasmo; depressão e insónia; tonturas, cefaleias e parestesias; hipertensão; dispepsia, dor gastrointestinal e abdominal, náuseas, gastrite, colite e estomatite; aumento das transaminases hepáticas; dermatite e fraturas ósseas (74).
3. Biossimilares
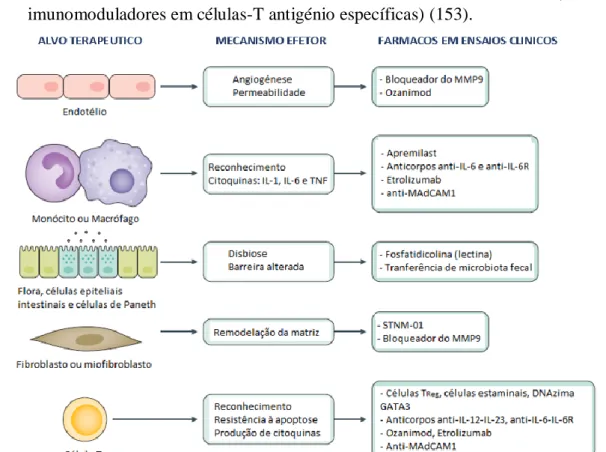
Atualmente, as patentes dos medicamentos biológicos mais antigos já expiraram ou estão prestes a expirar, o que tem permitido o desenvolvimento de biossimilares. Este tipo de moléculas são versões/cópias do biológico original, mas, ao contrário dos genéricos (moléculas químicas), a sua produção é muito mais complexa (76). Os biossimilares dificilmente conseguem replicar de forma exata a molécula original devido ao processo de fabrico complexo, à falta de acesso à linhagem celular original e à sensibilidade dos agentes biológicos. Como tal, é de esperar que existam algumas diferenças funcionais e estruturais entre elas, no entanto, o seu efeito, eficácia, segurança, farmacocinética, potência, pureza e imunogenicidade não podem diferir do biológico de referência (77).
Figura 2 – Processo de produção de fármacos biológicos e possíveis variações entre a produção do
fármaco original e do biossimilar. Adaptado de (78)
Na terapêutica da DII já configuram vários fármacos biossimilares das moléculas Infliximab e Adalimumab (79,80). O Infliximab foi um dos primeiros medicamentos
23
biológicos que viu a sua patente expirar, sendo que, atualmente, 3 dos 4 medicamentos no mercado com esta substância ativa são biossimilares (Inflectra™, Remsima™ e o recente Flixabi®, aprovado em junho de 2016). A molécula biossimilar tem o nome de CT-P13 e foi comprovado por dados do “mundo real” que é efetiva e bem tolerada em doentes com DC e CU, no entanto, na população pediátrica, apenas foi realizado um estudo (79). Mais recentemente, também a patente do Adalimumab expirou, o que levou ao surgimento de duas marcas comerciais de biossimilares, Solymbic™ e Amgevita™, tendo a sua entrada no mercado sido autorizada em março de 2017 (69).
A grande vantagem destas moléculas é, sem dúvida, o seu baixo custo comparado com o do medicamento biológico. O seu preço reduzido, além de permitir uma poupança de milhões de euros aos sistemas de saúde, também aumenta o acesso dos doentes a este tipo de terapêutica, melhorando assim os cuidados de saúde prestados (81). Contudo, os custos elevados, associados à produção, ao controlo de qualidade, ao marketing, ao armazenamento e aos requerimentos especiais de farmacovigilância, não permitem que a diminuição do preço dos biossimilares seja tão acentuada quanto a dos genéricos. Na Europa, essa redução é de, em média, menos 30% que o preço do produto de referência (82).
A aprovação pela entidade reguladora de um biossimilar não significa que este seja permutável com o biológico de referência (83). Na Europa, a substituição automática por biossimilares geralmente não é recomendada. No entanto, como a EMA não tem a autoridade de designar um biossimilar de permutável, essa decisão cabe às entidades nacionais competentes. Estas têm acesso à avaliação cientifica levada a cabo pela EMA e a todos os dados submetidos para fundamentar a sua decisão (84).
Os doentes não estão muito familiarizados com os medicamentos biológicos, incluindo os biossimilares, expressando algumas preocupações quanto à sua eficácia, segurança e a alterações do tratamento. Como tal, é necessário que se forneça informação adequada e de fácil compreensão aos mesmos (78). Por outro lado, os médicos estão mais bem informados acerca do conceito de biossimilar (85). Na DII, eles veem o preço como a principal vantagem, enquanto a imunogenicidade continua a ser a sua principal preocupação (86). Para estes profissionais de saúde poderem prescrever os biossimilares de forma responsável, as entidades científicas devem garantir o seu acesso às guidelines existentes, que estes compreendem o processo legal de obtenção de aprovação destes fármacos e que recebem informação imparcial acerca dos seus benefícios e aplicações terapêuticas (85).
4. Contraindicações e Utilização na Gravidez
Os medicamentos biológicos são geralmente bem tolerados, sendo a sua utilização contraindicada em apenas 3 situações:
• Doentes com antecedentes de hipersensibilidade à substância ativa (Infliximab, Adalimumab ou Golimumab), a outras proteínas murínicas (no caso do Infliximab) ou a qualquer um dos excipientes constituintes do medicamento;
24
• Doentes com tuberculose ativa ou outras infeções graves, como sepsis, abcessos e infeções oportunistas;
• Doentes com insuficiência cardíaca moderada a grave (66,70,74).
Além dessas contraindicações, também não é recomendada a associação do Infliximab, Adalimumab e Golimumab com outros agentes biológicos, incluindo vacinas vivas, nem com agentes terapêuticos infeciosos, uma vez que há um risco aumentado de infeção (66).
Há pouca evidência clínica da utilização destes agentes biológicos em grávidas, como tal não é recomendada a sua administração a este grupo de risco. Devido à inibição do TNF-α e uma vez que estes fármacos atravessam a placenta, é possível que as respostas imunes do recém-nascido sejam afetadas. Desconhece-se também se são excretados no leite materno ou se são absorvidos sistemicamente após ingestão, como tal não é recomendada a amamentação durante pelo menos 6 meses após o tratamento (66).
ii. Inibidor das Interleucinas (IL-12/IL-23) 1. Mecanismo de Ação
Estudos em modelos animais estabelecem uma forte ligação entre a regulação das vias Th1/Th17 e várias doenças inflamatórias, incluindo a DC (87). As citoquinas IL-12 e IL-23, entre outras, são responsáveis pela ativação dessas vias e a sua sobrexpressão leva a uma ativação amplificada do sistema imunitário (88).
A IL-12 é uma citoquina heterodimérica constituída por duas subunidades proteicas, p40 e p35. Esta citoquina liga-se ao complexo recetor IL-12, expresso à superfície de células T e NK. As respostas mediadas pela IL-12 incluem a ativação intracelular da transdução do sinal da transcrição das proteínas STAT4 e STAT6, expressão molecular na superfície celular, atividade lítica das células NK e produção de citoquinas como a IFN-ƴ, TNF, IL-17 e IL-21(89).
A subunidade p40 também se encontra associada à subunidade p19 da IL-23, citoquina esta que, tal como a IL-12, utiliza a cadeia IL-12Rβ1 para se ligar ao recetor expresso na superfície das células efetoras. Tanto a subunidade IL-12p35 como a IL-23p19 apenas são secretadas intracelularmente após associação covalente com a p40. Como tal, os inibidores da IL-12p40 irão inibir também a atividade da IL-23, impedindo a fosforilação intracelular da STAT3, a ativação linfocítica e a produção de citoquinas como a IL-17A (90).
Os inibidores das interleucinas ligam-se seletivamente à subunidade p40 da IL-12 e da IL-23, impedindo assim a sua ligação à cadeia IL-12Rβ1 dos recetores na superfície das células T e NK. Desta forma, as respostas mediadas por estas citoquinas são neutralizadas e as vias inflamatórias e cascatas imunes, que dependem das citoquinas pro-inflamatórias libertadas pelas células Th1 e Th7, são interrompidas (87).
25 2. Medicamentos autorizados pela EMA
• Ustecinumab
O Ustecinumab é um anticorpo monoclonal IgG1 totalmente humano produzido a partir de uma linhagem de células de mieloma murino (91). Na UE existe apenas uma marca autorizada a comercializá-lo, a Stelara™. Esta está disponível no mercado nas dosagens de 45mg/0,5ml ou 90 mg/ml de solução injetável, tanto em frasco para injetáveis como em seringa pré-cheia e, mais recentemente, também na dosagem de 130mg de concentrado para solução para perfusão de 26 ml (5mg/ml). Esta última dosagem é de administração intravenosa, ao contrário das anteriores que são administradas subcutaneamente (92).
Na DII, este biológico apenas está indicado para o tratamento de doentes adultos com DC ativa moderada a grave que apresentaram uma resposta inadequada, deixaram de responder ou demonstraram ter alguma contraindicação ou ser intolerantes à terapêutica convencional ou a um antagonista do TNFα (93).
No que diz respeito à posologia, o tratamento inicia-se sempre com uma administração intravenosa e as seguintes por via subcutânea. A dose recomendada da primeira administração é dependente do peso do doente:
▪ Peso igual ou inferior a 55 kg – 260 mg (2 ampolas); ▪ Peso entre 55 e 85 kg – 390 mg (3 ampolas);
▪ Peso superior a 85 kg – 520 mg (4 ampolas).
É recomendado que a primeira dose subcutânea seja administrada 8 semanas após o início do tratamento e as seguintes em intervalos de 12 semanas. Caso o doente não apresente uma resposta adequada 8 semanas após a primeira dose subcutânea, este pode receber uma segunda dose nessa altura e não apenas passadas 12 semanas. Se houver perda de resposta com a administração em intervalos de 12 semanas, pode ser instituído um aumento da frequência para intervalos de 8 semanas. Caso a resposta clínica não seja alcançada 16 semanas após o início do tratamento ou 16 semanas após a mudança para administrações de 8 em 8 semanas, deve considerar-se descontinuar a terapêutica (93).
O Ustecinumab é contraindicado apenas em casos de hipersensibilidade à substância ativa ou a qualquer um dos excipientes presentes na sua formulação e em doentes que tenham uma infeção ativa clinicamente relevante, como é o caso da tuberculose ativa. Na gravidez, os estudos em animais apontam para que não haja qualquer efeito nefasto para o feto, no entanto, como medida de precaução, não é aconselhada a sua administração a grávidas ou mulheres a amamentar. Não foram realizados estudos em humanos acerca das interações medicamentosas entre o Ustecinumab e outros fármacos. No entanto e, tal como os biológicos anteriores, a administração concomitante de vacinas vivas não é recomendada devido ao risco elevado de infeção (93).
Quanto às reações adversas associadas à terapêutica com Ustecinumab, entre as mais frequentes incluem-se: infeção do trato respiratório superior e nasofaringite; tonturas e cefaleias; dor orofaríngea; diarreia, náuseas e vómitos; prurido; dorsalgias, mialgias, artralgias e fadiga (93).
26 iii. Inibidor de moléculas de adesão
1. Mecanismo de Ação
As integrinas são moléculas de adesão formadas pela heterodimerização de uma subunidade α e outra β, que se encontram à superfície das células (94). Estas moléculas são essenciais ao tráfego linfocitário, uma vez que medeiam a adesão dos linfócitos ao endotélio intestinal, promovendo assim a sua migração para o tecido inflamado (95).
A integrina α4β7 desempenha um papel importante na resposta inflamatória exacerbada dos doentes com DII e, como tal, têm sido desenvolvidos inibidores, nomeadamente o Vedolizumab, que bloqueiam a sua ação no intestino. Um ligando essencial desta integrina é a molécula de adesão celular MAdCAM-1, expressa no endotélio das vénulas presentes tanto na lâmina própria do intestino delgado e cólon como nas placas de Peyer. A sobre-regulação desta molécula ocorre quando esta é exposta a vários estímulos, como por exemplo o fator TNFα, geralmente elevado nos doentes com DC ou CU. A ligação da integrina ao seu respetivo recetor, presente na mucosa intestinal, origina adesão leucocitária e respetiva migração para o local da inflamação (96).
Ao ligar-se com grande afinidade à α4β7, o único ligando conhecido da molécula MAdCAM-1, o Vedolizumab impossibilita a ligação de ambos, bloqueando assim um passo fundamental da infiltração de células α4β7+ (essencialmente células T
CD4+ e CD8+ da lâmina própria) na mucosa intestinal. Após a ligação do inibidor à integrina, esta é internalizada pela célula. Essa internalização, no entanto, não afeta a viabilidade celular, não se observando alterações nas populações de linfócitos periféricos. No intestino, verifica-se uma diminuição de infiltrados celulares monoclonais e de células que expressam a integrina α4β7 (97).
2. Medicamentos autorizados pela EMA
• Vedolizumab
O Vedolizumab é um anticorpo monoclonal humano IgG1 produzido em células de ovário do hamster chinês (98). Existe no mercado apenas uma formulação com esta substância ativa, a Entyvio®, apresentada sob a forma de pó para concentrado para
solução para perfusão (300mg), cuja concentração, após reconstituição, é de 60mg/ml (99).
O Vedolizumab tem indicação tanto na DC como na CU, em adultos com doença ativa, moderada a grave, que são intolerantes, não respondem, deixaram de responder ou apresentam uma resposta inadequada à terapêutica convencional ou a um agente anti-TNFα. A segurança e eficácia deste agente não foi estabelecida para doentes entre os 0 e os 17 anos e, como tal, a sua utilização em pediatria não é recomendada (98).
Este medicamento destina-se a ser utilizado apenas por via intravenosa, sendo administrado por perfusão durante 30 minutos. Quanto à posologia, o regime terapêutico é igual tanto na DC como na CU: 300 mg IV na semana 0, 2 e 6 e depois a cada 8 semanas. A única diferença entre ambos é que na DC, em caso de não resposta, pode ser administrada uma dose adicional na semana 10. Se os
27
doentes não apresentarem benefício clínico na semana 10 e 14, na CU e DC respetivamente, a terapêutica deverá ser descontinuada (98).
A utilização de Vedolizumab é contraindicada em caso de hipersensibilidade ou intolerância a esta substância ou a qualquer um dos excipientes da formulação ou em casos de infeção grave ativa (p.e. tuberculose, septicemia, citomegalovírus, listerose) ou de infeção oportunista (p.e. leucoencefalopatia multifocal progressiva). A sua utilização na gravidez e a amamentação durante o tratamento, ou pouco tempo após o mesmo, não é recomendada uma vez que não existem dados suficientes que atestem a sua segurança tanto na grávida como no feto/bebé (98). A terapêutica continuada com este agente biológico pode dar origem a alguns efeitos adversos, sendo os mais comuns: nasofaringite e outras infeções do trato respiratório; cefaleias; artralgias; parestesias; hipertensão; dor orofaríngea, congestão nasal e tosse; abcesso e fissura anal, náuseas, dispepsia, obstipação, distensão abdominal, flatulência e hemorroidas; erupções cutâneas e outras afeções da pele (98).
A grande vantagem deste medicamento biológico é a sua especificidade, visto que este se liga exclusivamente à integrina α4β7, presente nas células T do intestino, e a mais nenhuma com os heterodímeros α4 ou β7 (100). O facto de o Vedolizumab não inibir outras integrinas como a α4β1 ou αEβ7, presentes em vários tecidos, possibilita a diminuição de efeitos indesejados fora do trato gastrointestinal, onde estas moléculas exercem a sua função (101).
c. Esquema Terapêutico Dos Medicamentos Biológicos Na DII
É importante que existam linhas orientadoras de tratamento pelas quais os prescritores se possam guiar aquando da escolha da terapêutica a implementar. Estas variam consoante a vertente da DII e são uma mais valia, uma vez que permitem uma uniformidade dos regimes terapêuticos, independentemente do médico prescritor.
• Doença de Crohn
No caso da DC ativa moderada a severa, após falha ou intolerância à terapêutica imunossupressora convencional, é indicada terapêutica com Infliximab IV ou Adalimumab SC. Se houver contraindicação para a terapêutica com um anti-TNFα, o Vedolizumab deverá ser escolhido como 1ª linha. Na DC ativa fistulizante, o Infliximab é a 1ª linha de tratamento biológico, mas, caso este seja contraindicado, deve considerar-se a terapêutica com Adalimumab ou Vedolizumab (102).
A resposta ao tratamento deve ser avaliada 12 a 16 semanas após o inicio do mesmo. Pode verificar-se 1 das seguintes 3 situações:
▪ Boa Resposta – continuar a terapêutica como prescrita e passados 12 meses avalia-se novamente a resposta. Se o doente estiver em remissão clínica (assintomático e com evidência biológica, endoscópica e/ou radiográfica de cicatrização), considerar a interrupção da terapêutica biológica, mantendo o imunossupressor.
▪ Resposta Parcial – otimização da terapêutica anti-TNFα e adicionar ou otimizar a terapia imunossupressora concomitante (se adequado). Avaliar novamente a
28
resposta e, se esta for positiva, seguir o esquema terapêutico acima descrito. Caso a resposta seja fraca ou inexistente, escolher um anti-TNFα alternativo ou outro biológico (Vedolizumab ou Ustecinumab) ou ponderar se o doente é elegível para ensaio clínico (com novos agentes terapêuticos) ou para cirurgia.
▪ Sem Resposta Primária – substituir por outro anti-TNFα ou pelo Vedolizumab ou Ustecinumab. Pode também optar-se pela cirurgia (102).
O tratamento com qualquer um dos medicamentos biológicos deverá ser continuado até que deixe de existir resposta ao mesmo, até que seja necessário cirurgia ou até 12 meses após o início do mesmo (avaliação da situação) (102).
• Colite Ulcerosa
Na CU existem duas linhas de tratamento, uma para situações de agudização da doença e outra em caso de doença ativa.
Na CU moderada a severamente ativa, pode optar-se por um biológico anti-TNFα (Infliximab IV, Adalimumab SC ou Golimumab SC) ou pelo Vedolizumab IV. A resposta deverá se avaliada 12 semanas após o inicio do tratamento, podendo obter-se um dos seguintes resultados:
▪ Boa Resposta clínica: desmame da terapêutica com corticosteroides e começar com azatioprina. Se continuar a existir resposta clínica, continuar a terapêutica como prescrita e realizar uma avaliação da resposta passados 12 meses. Se o doente se encontrar estável e sem manifestações da doença durante esse período de tempo, considerar parar a terapêutica biológica mantendo o imunossupressor. Caso a resposta seja parcial, otimizar a terapêutica estabelecida.
▪ Resposta Fraca: otimizar a terapêutica anti-TNFα, adicionar/otimizar a imunossupressão e/ou considerar sigmoidoscopia flexível. Avaliar novamente a resposta passadas 8 semanas. Caso esta continue fraca, escolher um biológico alternativo ou averiguar se o doente é elegível para cirurgia ou ensaio clínico (103).
No caso de agudização da CU severa, o Infliximab (5mg/kg, IV) é a terapêutica de escolha, caso a Ciclosporina (2mg/kg/24h IV) seja contraindicada ou clinicamente inadequada. A avaliação da resposta, em ambos os casos, deverá ser feita diariamente. A linha de tratamento, consoante o medicamento escolhido, será a seguinte:
▪ Com Ciclosporina - em caso de resposta clínica, iniciar Ciclosporina oral 2mg/kg (durante 3-6 meses), iniciar Azatioprina e fazer profilaxia com Cotrimoxazole 480 mg/dia. Avaliar novamente a resposta passados 3 meses. Se houver resposta, parar Ciclosporina e continuar com a Azatioprina. Caso a resposta seja fraca, utilizar uma terapêutica biológica alternativa, como o Infliximab. Se, após a implementação de terapia biológica, a resposta continuar a não ser favorável, realizar uma colectomia. Se se verificar resposta clínica ou resposta parcial, seguir os passos mencionados acima referentes à boa resposta clínica na CU moderada a severamente ativa.
▪ Com Infliximab – a guideline apenas contempla a sua utilização em indução, sendo administradas 3 doses de Infliximab. Em caso de resposta clínica, fazer o
29
desmame dos corticosteroides e iniciar terapêutica com Azatioprina. Seguir a linha de tratamento descrita na CU moderada a severamente ativa (103).
Em caso de não resposta inicial a qualquer uma das terapêuticas realizar uma colectomia, uma vez que não existe benefício clínico em alterar de Ciclosporina para Infliximab, ou vice-versa, caso uma destas falhe (103).
d. Eficácia Da Terapêutica Biológica
Os medicamentos biológicos são uma terapêutica em desenvolvimento e, como tal, os estudos realizados até à data são ainda reduzidos e, na maioria dos casos, pouco robustos. Todavia, todas as meta-análises e ensaios desenvolvidos, tanto para a DC como para a CU, apontam para um benefício terapêutico destes agentes comparativamente com o placebo (104).
Na DC, na indução da remissão da doença, o Infliximab (em monoterapia ou em combinação com a azatioprina), o Adalimumab e o Vedolizumab demonstraram ter >99% de probabilidade de serem superiores ao placebo (105). Também na CU, todos os medicamentos biológicos usados na indução da remissão da doença (Adalimumab, Golimumab, Infliximab and Vedolizumab) despoletaram uma maior resposta clínica, maior remissão clínica e maior cicatrização da mucosa em relação ao placebo. Este estudo também demonstrou a superioridade clínica do Infliximab comparativamente com o Adalimumab na referida situação (106).
Quando a terapêutica biológica é implementada nos estadios iniciais da doença, e não apenas após a falha da terapia não biológica (estratégia “top-down”), verifica-se a diminuição da necessidade de tratamento com corticosteroides, a melhoria da cicatrização da mucosa e a alteração do curso natural da doença, evitando-se o desenvolvimento de fistulas e estrangulamento do intestino (104). No entanto, as vantagens desta abordagem terapêutica são contrariadas pelo seu elevado custo e pelo risco de efeitos adversos. Como tal, é muitas vezes prioritário identificar os preditores de doença agressiva ou adotar uma estratégia terapêutica de controlo rápido dos sintomas (estratégia “step-up”, p.e. com corticosteroides) (107).
▪ Perda de Resposta
Estudos apontam para que a perda de resposta ocorra aproximadamente em 13% dos doentes por ano de tratamento. No entanto, a duração da eficácia irá depender de vários fatores, alguns deles inerentes ao próprio doente. Como tal, o tempo durante o qual existe eficácia terapêutica é indefinido e por isso os doentes deverão ser monitorizados frequentemente, sendo os níveis séricos do fármaco um bom indicador de eficácia (108).
A existência de anticorpos que neutralizam os agentes anti-TNF pode levar à diminuição dos níveis séricos do biológico e, consequentemente, da resposta clínica (109). A co-administração de um segundo agente imunossupressor ou a existência de um esquema terapêutico de manutenção pode reduzir o risco de desenvolvimento desses anticorpos (110).
Quando se verifica a diminuição da resposta podem ser adotadas várias estratégias para recuperar a eficácia clínica inicial, incluindo: aumento da dose, diminuição do