UNIVERSIDADE FEDERAL DO PARÁ NÚCLEO DE MEDICINA TROPICAL
PROGRAMA DE PÓS-GRADUAÇÃO EM DOENÇAS TROPICAL
DETECÇÃO MOLECULAR DO PAPILOMAVIRUS HUMANO (HPV) EM
AMOSTRAS TECIDUAIS DE TUMORES DA MAMA
FRANCIANNE SILVA ROCHA
FRANCIANNE SILVA ROCHA
DETECÇÃO MOLECULAR DO PAPILOMAVIRUS HUMANO (HPV) EM
AMOSTRAS TECIDUAIS DE TUMORES DA MAMA
Dissertação apresentada ao Programa de Pós-graduação em Doenças Tropicais do Núcleo de Medicina Tropical da Universidade Federal do Pará (UFPA), como requisito para obtenção do grau de Mestre em Doenças Tropicais, área de concentração Clínica das Doenças Tropicais.
Orientador: Prof. Dr. Juarez Antônio Simões Quaresma.
Dados Internacionais de Catalogação-na-Publicação (CIP) – Biblioteca do Núcleo de Medicina Tropical / UFPA, Belém-PA
Rocha, Francianne Silva.
Detecção molecular do papilomavirus humano (HPV) em amostras teciduais de tumores da mama / Francianne Silva Rocha; orientador, Juarez Antônio Simões Quaresma. – 2010
Dissertação (Mestrado) – Universidade Federal do Pará. Núcleo de Medicina Tropical. Programa de Pós-Graduação em Doenças Tropicais. Belém, 2010.
1. Tumores. 2. Mamas-doenças. 3. Papilomavírus. I. Quaresma, Juarez Antônio Simões, orient. II. Título.
CDD: 22. ed.616.994
FRANCIANNE SILVA ROCHA
DETECÇÃO MOLECULAR DO PAPILOMAVIRUS HUMANO (HPV) EM
AMOSTRAS TECIDUAIS DE TUMORES DA MAMA.
Dissertação apresentada à aprovação como requisito parcial para obtenção do grau de Mestre em Clínica das Doenças Tropicais do Núcleo de Medicina Tropical da UFPA, pela Comissão formada pelos professores:
Banca Examinadora:
___________________________________________________________
Prof. Dr. Juarez Antônio Simões Quaresma- Orientador: Núcleo de Medicina Tropical, UFPA.
_____________________________________________________________ Profa. Dra. Nara Botelho de Brito – Membro – Instituto de Ciências da Saúde, UFPA.
_______________________________________________________________ Profa. Dra. Rita Catarina Medeiros de Souza– Membro - Núcleo de Medicina Tropical, UFPA.
__________________________________________________________
Profa. Dra. Denise da Silva Pinto- Membro-Instituto de Ciências da Saúde, UFPA
______________________________________________________________ Prof. Dra. Luisa Caricio Martins – Suplente - Núcleo de Medicina Tropical, UFPA
À minha família: meu filho André Luiz, meu marido Paulo Junior, meus pais Juary e Yvany, meus irmãos Sérgio, Rose e Nando, minha cunhada Nazeth, meus queridos sobrinhos pela paciência em todos os momentos, pelo apoio e carinho com que relevaram minhas ausências.
AGRADECIMENTOS
Sobretudo agradeço a DEUS pela assistência e amparo.
Aos meus Orientadores Prof. Dr. Juarez Quaresma e a Profa. Dra. Hellen Fuzii no encaminhamento seguro.
Aos pacientes que aceitaram participar desta pesquisa.
Ao Núcleo de Medicina Tropical – UFPA pela oportunidade de engrandecimento.
RESUMO
A neoplasia maligna da mama é uma das principais causa de mortalidade feminina, considerada como problema de saúde pública. Neste trabalho pesquisamos a presença do Papilomavírus Humano (HPV) nos tumores mamários benignos e malignos e em amostras de tecido mamário normal. Foi utilizada a técnica da Reação em Cadeia de Polimerase (PCR) para detecção molecular do DNA HPV em 63 pacientes, assim distribuídas: 28 tumores malignos, 17 tumores benignos e 18 amostras de tecido retro areolar de mamas normais. Os nossos resultados revelaram positividade para a seqüência do DNA HPV em 11 amostras, todas pertencentes às portadoras de tumores malignos: 17,4% de todas as amostras e 39,2% dos tumores malignos. Todos os tumores positivos revelaram DNA HPV para os tipos oncogênicos 16 e/ou 18, não foi detectado DNA HPV 06 e 11. Os resultados demonstraram elevada positividade para os receptores hormonais nas amostras positivas examinadas e apresentaram um seguimento com prevalência de eventos desfavoráveis como recidivas loco-regionais, metástases e óbito nas portadoras de DNA HPV. Os achados ratificam os dados encontrados na literatura, mostrando uma possível participação deste vírus no desenvolvimento do câncer de mama e possível contribuição desfavorável na evolução clínica.
ABSTRACT
The malignant neoplasm of breast is a major cause of female mortality, considered as a public health problem. In this work researched the presence of human papillomavirus (HPV) in benign and malignant breast tumors and normal breast tissue samples. Was used the technique of Polymerase chain reaction (PCR) for HPV DNA molecular detection in 63 patients, thus distributed: 28 malignant and 17 benign tumors and 18 are samples of normal breast. Our results showed positivity for HPV DNA sequence in 11 samples, all belonging to the bearers of malignant tumors: 17.4% of all samples and 39.2% of malignant tumors. All positive HPV DNA showed tumors for oncogênicos types 16 and/or 18, was not detected HPV 6 and 11 DNA. The results demonstrated high positivity to the hormonal receptors in positive samples examined and presented a follow-up with prevalence of adverse events as relapse loco-regional metastases and death in with HPV DNA. Finds ratify the data found in the literature, showing a possible participation of this virus in the development of breast cancer and possible unfavorable contribution in clinical evolution.
LISTAS DE ILUSTRAÇÕES
Figura 1- Ciclo celular………... 24
Figura 2- Tumor maligno e drenagem linfática... 27
Figura 3- Carcinoma in situ... 29
Figura 4 - Carcinoma invasor da mama... 29
Figura 5- Estimativa de CA de mama e colo do útero no estado do PA.... 38
Figura 6 - Fatores de risco para câncer de mama... 41
Figura 7 - Mastectomia radical Pattey com radio dermite... 47
Figura 8- programação de tratamento conservador e resultado pós- operatório... 48
Figura 9- Relação entre os genes do HPV e suas funções... 51
Figura 10- Organização Genômica do HPV... 53
Figura 11-Replicação Viral do HPV... 55
Figura 12- Faixa etária portadoras de tumor e mamas normais... 76
Figura 13- Faixa etária portadoras de HPV e mamas normais... 76
Figura 14- Paridade e câncer de mama... ... 77
Tabela 1- Estimativa de taxa bruta de Câncer feminino no Brasil... 37
Tabela 3- Seqüência de primers de HPV... 74
Tabela 4- Principais resultados da pesquisa... 80
LISTA DE SIGLAS
ATM Mutado em A-T. Gene com papel na divisão celular e reparo do DNA BRCA1 Gene associado à pré disposição genética ao câncer de mama
BRCA2 Gene associado à pré disposição genética ao câncer de mama e ovário DNA Ácido desoxirribonucléico
E Região precoce do papillomavírus humano E6 Oncoproteína do papillomavírus humano E7 Oncoproteína do papillomavírus humano E2F Fator de transcrição
EGF Receptor do fator de crescimento epidérmico HER1 Receptor de fator de crescimento
EVB Vírus Epstein Barr
HER2 Receptor de fator crescimento, gene que favorece a divisão e proliferação celular
HER3 Receptor de fator de crescimento HER4 Receptor de fator de crescimento HERVs Retrovírus Endógeno Humano HPV Papilomavírus Humano
HPV 16 Papilomavírus Humano Subtipo 16 HPV 18 Papilomavírus Humano Subtipo 18 HPV 33 Papilomavírus Humano Subtipo 33
HR Receptores Hormonais
HTLV Vírus Linfotrópico de Células T Humano INCA
IGF
KSHV Vírus Associado ao Sarcoma de Kaposi L Região Tardia do Papilomavírus Humano MMTV Vírus do Tumor Mamário Murino
NF Kβ Kappa- beta- complexo protéico que atua como fator de transcrição ORF Open Reading Frame
PCR PDGF
Reação em cadeia polimerase
Fator de Crescimento Derivado das Plaquetas P110 Subunidade catalítica da PIK3CA
P53 Proteína supressora tumoral PCR Reação em cadeia polimerase P110 Subunidade Catalítica da PIK3CA P53 Proteína supressora tumoral
PIK3CA Gene responsável pela proliferação e sobrevivência celular, possui duas subunidades: reguladora kDa 85 e catalítica p110
PRb Proteína Retinoblastoma RE Receptor de Estrogênio
RP Receptor de Progesterona SBM
TGF VEGF
Sociedade Brasileira de Mastologia Fator de Crescimento Transformador Fator de Crescimento Endotelial Vascular VHB Vírus da Hepatite B
SUMÁRIO
LISTA DE ILUSTRAÇÕES
LISTA DE SIGLAS
1 INTRODUÇÃO... 14
2 REFERENCIAL TEÓRICO... 18
2.1 NEOPLASIAS MAMARIAS... 18
2.1.1 Definição.... 18
2.1.1.2 Etiologia... 19
2.1.1.3 Biologia... 25
2.1. 1.4 Epidemiologia... 36
2.1.1.5 Fatores de risco... 39
2.1.1.6 Diagnóstico clínico e complementar... 42
2.1.1.7 Tratamento... 46
2.2 PAPILOMA VÍRUS HUMANO... 50
2.2.1 Definição e classificação taxonômica... 50
2.2.2 Organização genômica... 50
2.2.3 Ciclo biológico... 54
2.2.4 Epidemiologia... 59
2.2.5 Relação do Papiloma Vírus Humano e Cânceres Humanos... 60
3 OBJETIVOS... 66
3.1 OBJETIVO GERAL... 66
3.2 OBJETIVOS ESPECÍFICOS... 66
4 MATERIAIS E MÉTODOS... 67
4.1 LOCAL DE ESTUDO... 67
4.2.1 Critérios de inclusão e exclusão... 68
4.2.1.1 Critérios de Inclusão... 68
4.2.1.2 Critérios de Exclusão... 68
4.2.2 Obtenção do material biológico... 69
4.3 M ÉTODO DE DETECÇÃO E TIPAGEM DO HPV... 69
4.3.1 PCR 01... 72
4.3.2 PCR 02... 72
5 RESULTADOS... 75
6 DISCUSSÃO... 83
7 CONCLUSÃO... 87
REFERÊNCIAS... 88
14
1 INTRODUÇÃO
A mama é uma glândula apócrina, modificada, que sofre influências dos hormônios femininos e pode ser sede de patologias infecciosas, inflamatórias e tumorais. Os processos tumorais, benignos e malignos, pela sua grande relevância biológica, são os mais freqüentemente estudados, destacando-se dentre eles as neoplasias malignas, pela grande incidência e mortalidade. Acredita-se que a neoplasia maligna da mama é um dos mais importantes problemas de saúde pública em países desenvolvidos, ocupando os primeiros lugares como causa de mortalidade feminina (LÉON, 2009).
O desenvolvimento tumoral se manifesta por etapas que descrevem o processo de formação da neoplasia e, didaticamente, se classificam em três fases: iniciação, promoção e progressão. Na etapa da iniciação, observamos mutação e erros de reparo do DNA, ativação de protooncogenes, inibição de genes supressores tumorais, mais notadamente o gene p53 e retinoblastoma, envolvidos nos processos de apoptose e parada do ciclo celular e ainda podemos evidenciar a ação de agentes físicos, químicos e vírus oncogênicos. Na etapa da promoção, ocorrem modificações na expressão do genoma, indução do aumento da proliferação celular e hiperplasia. Durante a etapa da progressão, as múltiplas alterações genéticas imortalizam a célula danificada e as ações virais podem promover danos adicionais (GOMES CARNEIRO, 1997).
15
desenvolvimento. Acredita-se que o desenvolvimento da neoplasia da mama é baseado em fatores de risco, atribuídos a agentes não infecciosos, como genes humanos (ação dos protooncogenes e genes supressores tumorais) e fatores epigenéticos. No entanto, evidências têm surgido, ligando agentes infecciosos a essa doença (NACKERDIEN, 2008).
Dentre os agentes infecciosos mais comumente associados às neoplasias em humanos, encontramos certas classes de vírus, chamados vírus oncogênicos. E agora sabemos baseados em evidências científicas, que pelo menos seis vírus humano como Vírus Epstein Barr (EBV), Vírus da Hepatite B (VHB), Vírus da Hepatite C (VHC), Papilomavírus Humano (HPV), Vírus Linfotrópico de células T Humanas (HTLV) e o Vírus associado ao Sarcoma de Kaposi (KSHV), contribuem com 10 a 15% dos cânceres de todo o mundo (MARTIN; GUTKIND, 2008).
A correlação entre o câncer de mama e o HPV tem sido objeto de alguns estudos, assim como do vírus Epstein Barr (EBV) e do equivalente humano do vírus do tumor mamário murino (MMTV), embora a relação da etiologia tumoral e o vírus ainda não estejam bem evidenciados , parece que eles podem ser responsáveis por uma das etapas, de uma série delas, que requerem o desenvolvimento de um câncer (AMARANTE; WATANABE, 2009).
16
longa proviral de MTTV. O gene int-1 foi identificado adjacente a um sítio de integração proviral de MTTV, sua expressão é restrita a tumores e não é encontrada em tecidos normais. E este oncogene causa transformação morfológica de células epiteliais mamárias cultivadas, mas é incapaz de transformar fibroblastos in vitro. Este modelo inspirou a possível etiologia viral do câncer de mama (BLAND; COPELAND, 1994).
Dentre os vírus considerados como oncogênicos, evidencia-se o Papilomavírus Humano (HPV) encontrado em mais de 85% dos cânceres cervicais e também associados a tumores genitais e extragenitais. A infecção pelo HPV, especialmente pelos tipos oncogênicos, 16 e 18, é um importante fator de risco para o desenvolvimento do câncer cervical (CHENG, 2005).
17
O aumento progressivo na incidência do câncer de mama em todo o mundo e, como conseqüência, a elevada mortalidade associada, constitui importante problema de saúde pública e têm movimentado grande soma de investimentos em pesquisas e estudos relacionados, ressaltando a relevância da sua etiologia multifatorial e complexidade biológica, geralmente associada a fatores genéticos e não infecciosos. Além disso, possui grande heterogeneidade no comportamento clínico. Isto significa que a total compreensão da evolução das neoplasias mamárias ainda pode ser realidade algo distante.
18
2. REFERENCIAL TEÓRICO
2.1. NEOPLASIA MAMÁRIA
2.1.1 Definição
As mamas são estruturas complexas consideradas como glândulas sudoríparas especializadas. Apresentam comportamento de órgãos efetores controlados pelo mesmo eixo neuroendócrino que regula o sistema reprodutor. Encontra-se dentro da fáscia superficial da parede torácica anterior e consistem em 15 a 20 lóbulos de tecido glandular do tipo tubuloalveolar, tecido conjuntivo fibroso conectando seus lobos e tecido gorduroso nos intervalos dos lóbulos. Esta glândula pode ser sede de diversas afecções inflamatórias, infecciosas e tumorais.
19
É considerado como um dos tumores mais freqüentes entre as mulheres em todo o mundo. O Brasil apresenta estimativa para 2010 em torno de 49.240 novos casos. Também é uma das principais causas de mortalidade, apresentando 11.860 números de morte em 2008, e na população mundial uma taxa de sobrevida média após 05 anos de 61%, segundo dados do INCA (2004).
2.1.1. 2. Etiologia
Acredita-se que não há uma única causa que possa ser considerada como fator primário para seu início. Existe a idéia da relevância de alterações genéticas pela observação de algumas evidências, como a predisposição familiar, presença de alterações cromossômicas em células tumorais e a ação oncogênica de muitas substâncias com potencial mutagênico (CHAGAS, 1997).
Vários caminhos foram propostos para determinação da etiologia tumoral mamária. Com o modelo murino de tumorigênese, aventou-se a etiologia viral para o câncer de mama e as experiências visando encontrar tal agente focalizaram três áreas. Primeiramente seqüências genômicas humanas endógenas que possuem similaridade com MTTV foram identificadas, mas nenhum deles continha a seqüência proviral em extensão completa e não conseguiram identificá-los em tecidos normais e malignos.
20
rapidamente fatais. Então, avaliando o histórico de concentração geográfica e as características clínicas nesta mesma população, foi proposta a existência de um agente etiológico exclusivo. Além destas, as mulheres parses em Bombaim- Índia têm a mais alta incidência de câncer de mama dentre os muitos grupos étnicos daquela cidade. Durante a década de 70, vários estudos coletaram evidências de partículas semelhantes a retrovírus no leite das mulheres parses, mas naquela ocasião, não conseguiram isolar vírus em nenhum tecido mamário humano. As pesquisas sobre a possível etiologia viral do câncer de mama foram baseadas no modelo murino de tumorigênese mamária induzida por retrovírus. Depois desta pesquisa, se mostrou que a transferência de DNA de células tumorais para células normais poderia conferir um fenótipo tumorigênico e deu origem a uma nova área de pesquisa em oncogenes (BLAND; COPELAND, 1994).
21
Ao efetuar a infusão destes fatores em murino, em vez de estrogênio, os implantes de células MCF-7 crescem para tumores de tamanho limitado e depois regridem. Foi realizado estudo por Kasid (1985) tentando esclarecer se a hormônio- independência era fenotipicamente semelhante ao estado hormônio induzido, então, construíram uma linhagem celular MCF-7 hormônio-independente pela transfecção com clone de DNA v-ras. O gene ras foi escolhido, pois ele é ativado por mutações pontuais em muitos carcinomas humanos e pela sua função transformadora de segunda fase nos modelos de oncogênese em duas etapas. As células resultantes do MCF-7 ras expressaram a proteína mutante p21, tinham tempo de duplicação mais curto do que as células MCF-7 progenitoras e eram resistentes aos efeitos inibidores do crescimento antiestrogênicos. Acredita-se que a introdução de oncogenes específicos dentro de células mamárias primárias cultivadas possa resultar a sua imortalização (BLAND; COPELAND, 1994).
22
das plaquetas (PDGF) e os genes c-erbB e c-fms cuja função é codificar para o receptor ao fator de crescimento epidérmico (EGFR). Estes proto-oncogenes podem afetar o crescimento e a diferenciação celular e podem contribuir para o estabelecimento do fenótipo maligno. A ativação de proto-oncogenes celulares para oncogenes é considerada muito importante na carcinogênese por indução química e irradiação (BLAND; COPELAND, 1994).
A ativação dos oncogenes pode ocorrer tanto na fase de iniciação quanto na fase de progressão tumoral. Esta ativação dos oncogenes ocorre por amplificação gênica, rearranjos cromossômicos estruturais, mutações de ponto nas seqüências reguladoras ou codificadoras e, ainda, por inserção viral. As translocações e mutações podem ocorrer como eventos iniciais ou durante a progressão tumoral, enquanto a amplificação geralmente ocorre durante a progressão. Os oncogenes codificam proteínas responsáveis pelo controle da proliferação, diferenciação e apoptose celular. Atualmente considera-se que os produtos dos oncogenes podem ser classificados em seis grandes grupos: fatores de transcrição, remodeladores da cromatina, fatores de crescimento, receptores de fator de crescimento, transdutores de sinais e reguladores do mecanismo da apoptose (SOARES, 2009).
23
ou mais alterações no seu genoma, usualmente na forma de mutações nos genes envolvidos no ciclo celular, o que leva a um relaxamento dos mecanismos de controle do crescimento e divisão. Células nas quais os mecanismos de controle foram alterados têm maior chance de desenvolver novas anormalidades genéticas, isto é, se tornarem instáveis. A instabilidade do genoma tem sido considerada como importante fator na formação e progressão da neoplasia (WARD, 2002).
24
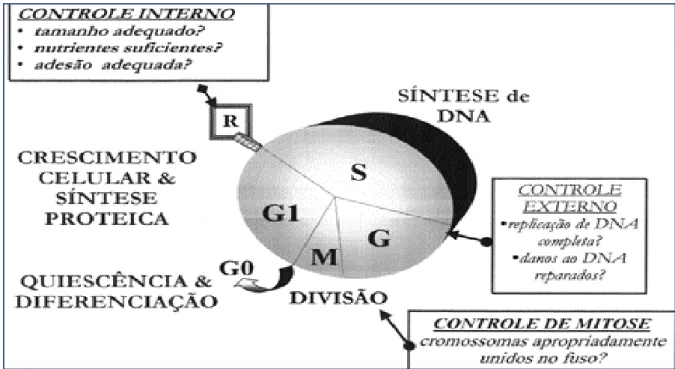
Figura 1- Pontos de controle do ciclo celular. O ciclo celular possui fases ordenadas, em G0 a célula encontra-se diferenciada, em G1 aumenta de tamanho e prepara a síntese protéica, nesta fase a célula está sensível à influências ambientais , se não forem favoráveis à divisão se detêm. Se ultrapassar este ponto de restrição a divisão irá ocorrer independente das condições ambientais. Na fase G2 existe outro ponto de controle importante para avaliação do DNA replicado e antes da fase da mitose existe a checagem de anormalidades na divisão dos cromossomos (WARD, 2002).
25
Outro mecanismo de controle da divisão celular é um mecanismo de contagem do número, limitado, de vezes que determinada célula se reproduz. Neste mecanismo, as pontas dos cromossomos (telômeros) marcam o número de divisões, e no momento apropriado iniciam senescência e morte (WARD, 2002).
2.1.1.3 Biologia
O avanço da biologia molecular tem proporcionado melhor entendimento sobre os mecanismos que regulam a proliferação e diferenciação celular e o desenvolvimento de neoplasias. Considerando a complexidade biológica das neoplasias malignas e a possibilidade de que a presença de fatores ainda não conhecidos possa influenciar direta ou indiretamente na formação e no desenvolvimento tumoral, somos levados a considerar que possa haver outras contribuições à etiopatogenia do câncer de mama. Rauch (2009) realizou estudo demonstrando que a inflamação crônica de longa data está associada com uma gama de neoplasias malignas, sendo agora amplamente aceita como fator de risco para desenvolvimento do câncer e estando implicada como promotora de uma variedade de cânceres. Outros estudos com retrovírus transformando seus oncogenes e os múltiplos mecanismos criados pelo vírus para eclodir o crescimento e a função anti-apoptótica de genes supressores tumorais têm proporcionado fundamentação para a compreensão atual da biologia do câncer (MARTIN; GUTKIND, 2008).
26
proto-oncogenes ou à inativação de genes supressores ou vias anti-oncogênicas (ZHANG, 2010). Estas duas classes de genes, pequenas em relação ao total de genes, têm papel chave no desenvolvimento do câncer. Em suas configurações normais, elas dirigem o ciclo celular em uma intrincada seqüência de eventos, pelos quais as células crescem e se dividem. Proto-oncogenes estimulam, enquanto genes supressores inibem os processos de divisão celular (WEINBERG, 1996).
Na neoplasia de mama, o período crítico de oncogênese parece corresponder ao intervalo entre a menarca e a primeira gestação a termo, pois o lóbulo mamário, na menarca, encontra-se em amplo processo de divisão celular até o final da adolescência. Quando a proliferação é intensa, a célula fica mais susceptível a agentes carcinogênicos, podendo resultar em mutações e transformações malignas. O desenvolvimento tumoral é lento, expressando-se com maior freqüência a partir dos 35 anos, sendo cada vez mais freqüente com o progredir da idade (BARROS; NAZÁRIO, 1994; BERGMANN, 2000).
27
uma divisão binária, ocorrendo duplicação do seu material genético: ciclo celular (CHAGAS, 1997; BERGMANN, 2000).
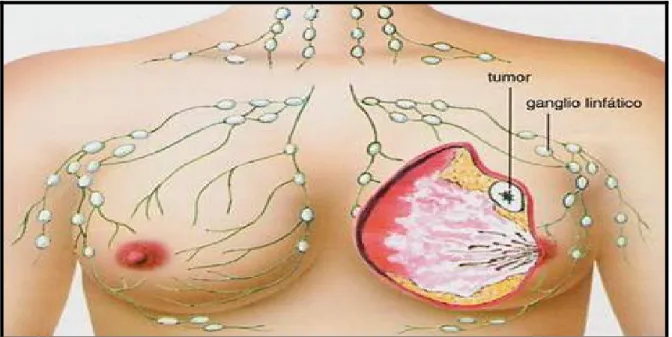
A partir da instalação do tumor primário de mama, ocorrerá a sua propagação às estruturas vizinhas e à distância, podendo esta ser por via direta, atingindo seqüencialmente os ductos, parênquima mamário, podendo progredir até o tecido perimamário, culminando com a invasão de tecidos adjacentes; via linfática, que ocorre concomitante com a disseminação sanguínea, através da embolização das células neoplásicas ao serem veiculadas pela linfa (figura 2); e por via vascular, originando-se a partir de pequenas veias intramamárias (CHAGAS, 1997).
Figura 2- Representação de tumor maligno mamário e sua propagação linfática. Fonte: online: cbfisio, 2005.
28
tem sido uma condição para o diagnóstico do pré- câncer. Empiricamente, pré- câncer está associado com um contínuo morfológico de atipia para displasia e para neoplasia invasiva. Estas lesões são usadas como indicadores precoces de câncer e seu reconhecimento tem dramática redução da mortalidade nos cânceres de cólon, cérvix uterina e mama. Esta progressão tem sido modelada como um processo linear e algumas evidências moleculares apóiam este modelo (CARDIFF; BOROWSKY, 2009).
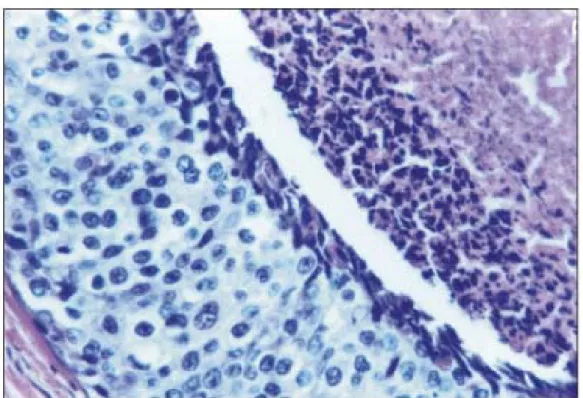
29
Figura 3 -Carcinoma in situ do tipo comedo, alto grau nuclear (hematoxilina e
eosina – 400x) Fonte: http://www.scielo.br/scielo.php?pid=S0100-72032006001200006
Figura 4 Carcinoma invasor da mama (hematoxilina e eosina – 400x)
30
Durante a última década, houve grande desenvolvimento no entendimento molecular do câncer de mama, demonstrando que esta neoplasia não é uma simples doença com uma simples via de tumorigênese, mas uma via heterogênea. A identificação da expressão gênica tem se transformado na chave do entendimento da diversidade biológica dos tumores mamários (VIVANCO, 2010).
Formas agressivas de câncer são freqüentemente definidas pelas alterações cromossomais. Na maioria dos casos, a causa ou contribuição dos componentes genéticos ainda é pobremente entendida (ZHANG, 2009).
Os mecanismos de reparo do DNA são importantes peças para a manutenção da integridade do DNA e proteção contra seus danos. A desregulação desses mecanismos está associada com o desenvolvimento de câncer assim como tumores que apresentam mutação do BRCA1 e BRCA2. Recentes achados biológicos sugerem que tumores nos quais as vias de reparo são deficientes apresentam também inibição de outras vias de reparo e que poderiam agir sinergicamente (AMIR, 2010).
31
Há uma forte evidência de que a influência dos hormônios ovarianos tem ação promotora na patogênese da neoplasia mamária, acreditando-se que eles afetam o risco de câncer de mama ao aumentar a atividade mitótica. O estrogênio sozinho induz a alguma divisão celular, mas, associado à progesterona (o que ocorre durante a fase lútea do ciclo menstrual), a divisão celular é aumentada, levando a um risco maior de desenvolvimento do câncer de mama (KELSEY; GAMMON, 2001).
O efeito paradoxal dos hormônios ovarianos tanto para prevenção quanto para a promoção da neoplasia de mama tem sido debatido há mais de 30 anos. Estudos genéticos demonstram que hormônios ovarianos atuam através da NF-kappa-beta para estimular a proliferação ductal. Considera-se que a proteína p53 (gene supressor tumoral) desempenha um papel central na resistência a tumorigênese mamária. Estudos transcripcionais, agora, sugerem que hormônios ovarianos estimulam uma constelação de genes que interagem com NF-kappa-beta e com p53 para arbitrar demandas competidoras de proliferação e vigilância (JERRY, 2010).
32
estrogênios, através dos receptores alfa, influenciam os níveis de p53 e sua atividade (FERNANDEZ-CUESTA, 2010).
As alterações dos genes p53, BRCA1, ATM, PIK3CA e HER2 estão envolvidos em vários aspectos da carcinogênese mamária. Dentre estes, somente a mutação do p53 mostra significância, embora não independente, no efeito negativo da sobrevida (BOZHANOV, 2010). Glândulas mamárias com p53 deficiente exibem evidências de um epitélio em transição epitélio mesenquimal e estes dados mostram a importância do sinergismo entre o estrógeno e a insuficiência do p53 em determinar propriedades básicas da carcinogênese em tecidos hormoniodependentes como a mama e o trato reprodutor (SHAY, 2008).
O desenvolvimento do câncer depende do comportamento biológico de clones mutados. A maioria das células mutadas é eliminada pelo nosso sistema imunológico, no entanto outras alcançam a progressão tumoral, algumas à leve invasão vascular eclodem como metástases loco-regionais ou à distância, assim como também existem células que caem na circulação, mas não conseguem desenvolver metástase ativa (LI 2007; BARROS, 1994; BUZAID, 2007).
33
Segue-se a esta, a resposta imune adaptativa, onde as células dentríticas apresentam os antígenos tumorais aos linfócitos T que agem por ação citotóxica direta (linfócitos T citotóxicos – CTL) ou através das secreções de citocinas. Os linfócitos B atuam na formação de anticorpos. Os CTLs destroem as células-alvo após o reconhecimento de peptídeos antigênicos apresentados pelas moléculas do Complexo Principal de Histocompatibilidade classe I (MHC-I). Estes peptídeos são provenientes de antígenos tumorais que as células neoplásicas produzem, são degradados no citosol e apresentados em sua superfície citoplasmática, acopladas às moléculas de MHC-I. Para este reconhecimento, é necessária a participação das células apresentadoras de antígenos (APC), co-estimulando a resposta celular. Vindo de monócitos, as células dendríticas expressam moléculas de classe II do Complexo de Histocompatibilidade (MHC), que apresentam os antígenos capturados às células T auxiliares. As células dendríticas têm grande poder de capturar e apresentar os antígenos tumorais em suas superfícies e iniciarem uma resposta imune contra tumores de seus próprios hospedeiros. Atualmente, existem antígenos tumorais já identificados, como a ciclina B1 e o NYESO-1. A identificação destes antígenos tem contribuído para o desenvolvimento de uma nova geração de vacinas contra câncer, é o caso de algumas vacinas contra o câncer de mama, utilizando o antígeno MUC1 (GIACOMINI, 2003).
34
célula normal. Em outras palavras, é uma tentativa para ensinar o sistema imunológico a reconhecer antígenos que escaparam da vigilância imunológica. O fenômeno de tolerância imunológica complica a compreensão de como o sistema imune pode realizar a defesa contra tumores espontâneos. A grande maioria das proteínas expressas pelos tumores é normal, tanto na estrutura quanto nos níveis de expressão. No entanto, dentre as mais 20.000 proteínas expressas por tumores, existem variantes que são produzidas em um ou outro tipo de câncer, em pequeno número e por algumas células tumorais, mas não estão presentes nos tecidos normais. Estas diferenças estruturais, mesmo sutis, são percebidas como estranhas e podem iniciar resposta imune antigênica vigorosa (ROSA, 2006).
35
No entanto, algumas proteínas estruturalmente distintas podem ser ignoradas pelo sistema imune ou simplesmente toleradas por se apresentarem em níveis baixos demais para que haja ativação do sistema imune. Entretanto, se essas proteínas forem expressas em níveis muito elevados por células tumorais, as falhas na tolerância imunológica podem permitir o reconhecimento imunológico de tais células. Em muitos carcinomas de mama, o receptor HER2-Neu é freqüentemente expresso em níveis muito mais elevados que nos tecidos normais, então a reatividade imune pode ser ativada contra essa proteína. Alguns melanomas humanos expressam carboidratos de superfície, chamados gangliosideos, que também são capazes de ativar resposta imune. A expressão de um destes carboidratos, GD3 é, algumas vezes, maior em células de melanoma que em relação aos seus precursores celulares normais, os melanócitos. Nesses casos, as proteínas superexpressas ou as moléculas de carboidratos levam à ativação do sistema imune.
36
contra estes glicolipídeos induzem encolhimento da metástase de melanoma cutâneo humano. Assim, a superexpressão celular e presença de gangliosideos no espaço intersticial podem desempenhar um papel central na regulação de crescimento celular, tolerância imunológica e na angiogênese tumoral e, assim, representaria um novo alvo para terapia contra o câncer (BITTON, 2002).
Existem indivíduos que apresentam deficiência no reconhecimento e na vigilância imunológica, não conseguindo ativar resposta celular imuno-competente para a supressão do crescimento tumoral e conseqüente desenvolvimento do câncer. Segundo Barros e Buzaid (2007) o estado nutricional, hábito e estilo de vida saudável e bem estar emocional contribuem para o bom funcionamento da maquinaria de defesa, não sendo incomum que tumores à distância apareçam após graves situações de estresse.
2.1.1. 4. Epidemiologia
37
aumento de 10 vezes nas taxas de incidência ajustadas por idade nos Registros de Câncer de Base Populacional de diversos continentes. A mortalidade em 2008 foi de 11.860, sendo 11.735 mulheres e 125 homens. A estimativa de novos casos, no Brasil, para 2010 é de cerca de 49.240 (INCA 2010) (tabela 1).
Estimativa dos Casos Novos
Estado Capital
Localização Primária Neoplasia maligna
Casos Taxa
Bruta Casos Taxa Bruta
Mama Feminina 49.240 49,27 17.540 74,56
Colo do Útero 18.430 18,47 5.280 22,50
Cólon e Reto 14.800 14,80 5.530 23,54
Traquéia, Brônquio e Pulmão 9.830 9,82 3.130 13,37
Estômago 7.680 7,70 2.340 9,94
Leucemias 4.340 4,33 1.330 5,52
Cavidade Oral 3.790 3,76 1.090 4,48
Pele Melanoma 2.970 2,92 860 3,38
Esôfago 2.740 2,69 660 2,55
Outras Localizações 78.770 78,83 28.510 121,33
Subtotal 192.590 192,74 66.270 282,03
Pele não Melanoma 60.440 60,51 12.800 54,45
Todas as Neoplasias 253.030 253,23 79.070 336,52
38
No estado do Pará, o câncer de maior incidência é o de colo uterino na população feminina (figura 5), seguido de perto pela neoplasia maligna da mama, apresentando os casos agrupados na capital do estado que, no momento, é única cidade do estado capaz de oferecer tratamento oncológico especializado com as três principais terapêuticas: cirurgia, quimioterapia e radioterapia. A neoplasia mamária ,ao contrário do câncer de colo uterino, está relacionada ao processo de industrialização, com risco de adoecimento associado a elevado status socioeconômico, além de outros fatores de risco clássicos descritos, tais como baixa paridade, idade precoce da menarca e tardia da menopausa, obesidade e consumo de álcool (GUERRA, 2005).
Localização Primária Estimativa dos Casos Novos
Neoplasia maligna Estado Capital
Casos Taxa Bruta Casos Taxa Bruta
Mama Feminina 640 16,77 400 47,90
Colo do Útero 790 20,82 330 39,36
Figura 5- Estimativa das taxas brutas de incidência por 100.000 e de número de casos novos por câncer de mama e colo de útero, no Pará e capital (INCA 2010).
39
somente após a menopausa. O status social elevado também tem sido mais associado à neoplasia de mama. As mulheres solteiras apresentam incidência menor de câncer de mama, quando comparadas com as casadas. O câncer de mama apresenta taxas bem distintas entre os países, sendo maiores nos Estados Unidos, Canadá, e norte da Europa (KELSEY; GAMMON, 2001).
A distribuição familiar no desenvolvimento da neoplasia de mama tem sido freqüentemente estudada, uma vez que o risco de vir a ter câncer de mama entre as mulheres com história familiar de mãe ou irmã com câncer de mama, diagnosticada principalmente quando na pré-menopausa, é mais elevado, quando comparado com o risco da população geral (BERGMANN, 2000).
2.1.1.5 Fatores de Risco
40
de risco, na proporção de 100 mulheres para cada 01 homem, devido à maior quantidade de tecido mamário e a maior exposição ao estrogênio endógeno. Dados indicam que com o aumento da faixa etária, há maior risco de apresentar câncer de mama e que 60%-70% dos casos novos de neoplasia maligna se incidem na faixa etária de 40 a 69 anos de idade (THULER, 2003).
41
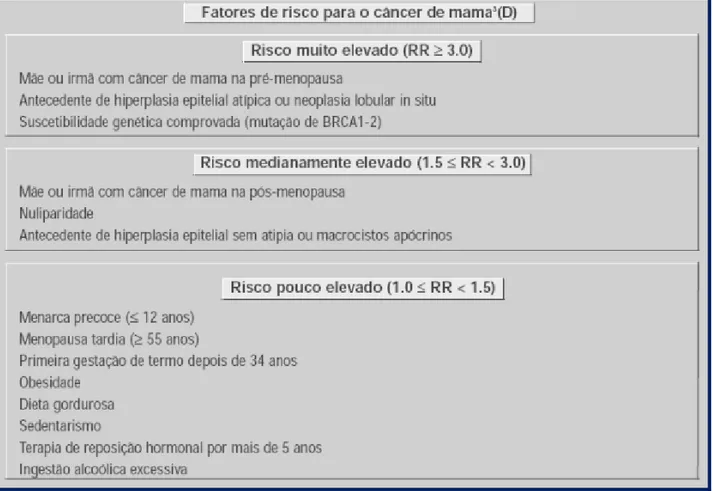
Além destes, são considerados fatores de risco: exposição a radiações ionizantes, ingestão de gorduras saturadas, menarca precoce, menopausa tardia, nuliparidade, primeira gestação após os 30 anos de idade, uso indiscriminado de preparados hormonais, consumo de álcool e antecedentes familiares positivos. As maiores taxas de incidência ocorrem entre mulheres que não tiveram filhos, com situação profissional definida e vivendo em áreas com melhores condições socioeconômicas (MOLINA, 2003).
Figura 6 - Fatores de risco para câncer de mama (SBM- 2001).
42
mama estes fatores não estão bem identificados, sugerindo que novas características possam estar envolvidas com esta neoplasia (LEON, 2009). O conhecimento científico acumulado até agora indica que menos de 50% dos casos de câncer de mama podem ser explicados pelos principais fatores de risco descritos (THULER, 2003).
Na reunião de consenso da Sociedade Brasileira de Mastologia, em 2001, foi aceito que a gênese da neoplasia maligna da mama ocorre pelo resultado da interação de fatores genéticos, com estilo de vida, hábito reprodutivo e meio ambiente. Portanto existe uma tendência a correlacionar a etiologia da neoplasia maligna da mama com agentes não infecciosos e epigenéticos, no entanto, como já referido anteriormente, vários autores há alguns anos têm demonstrado evidências da presença de agentes virais no desenvolvimento da neoplasia mamária (NACKERDIEN, 2008).
2.1.1.6 Diagnóstico Clínico e Complementar
O câncer é uma patologia com localizações e aspectos clínico-patológicos múltiplos e não possui sintomas ou sinais patognomônicos, podendo ser detectado em vários estágios de evolução histopatológica e clínica (INCA 2010).
43
subdividem em musculoesqueléticas e verdadeiras. As mastalgias acíclicas musculoesqueléticas são decorrentes de alterações em estruturas anatômicas vizinhas, como as osteocondrites, afecções de coluna cervical e torácica, vícios de postura, nevralgia do intercostal. Dentre as mastalgias verdadeiras, os processos infecciosos e os tumores são os mais freqüentemente encontrados. Além destes podemos encontrar nos ambulatórios de mastologia as descargas papilares caracterizadas pela eliminação de secreção através da papila, é um sinal inespecífico, que deve ser valorizado apenas quando se apresenta unilateral, uniductal, espontâneo, de cor sanguínea ou em água de rocha (FRANCO, 1997).
Os tumores podem ser císticos ou sólidos. Os cistos são entidades usualmente benignas, podem ser assintomáticos e são definidos pela presença de espaços delimitados por paredes e cheios de líquido, são extremamente variáveis em tamanho e número e podem ser microscópicos ou macroscópicos. Estas lesões são quase sempre multifocais e bilaterais e quase nunca malignas. Os tumores sólidos benignos têm como representante mais comum o fibroadenoma que apresenta aspecto microscópico típico, caracterizado pelo componente epitelial e estromal, manifesta-se como massa esférica circunscrita que pode ser uni lobular ou multilobular. Este tumor é comumente móvel, indolor, esférico e com margens lisas.
Os tumores malignos apresentam características epiteliais, mesenquimais ou mistas, geralmente localizam-se na unidade lóbulo-ductal-terminal e podem manifestar-se como neoplasias in situ ou invasoras. Os carcinomas in situ
44
podem ser ductais ou lobulares, inclui-se nesta classificação a Doença de Paget do mamilo caracterizada por lesão eczematosa do mamilo apresentando células de carcinoma na histologia da epiderme, não é considerada tipo especial, mas fenômeno conseqüente a um carcinoma in situ no qual as células malignas alcançaram a epiderme por epidermotaxia. Podem manifestar-se como massas palpáveis ou apenas como alterações somente diagnosticadas à mamografia. Os tumores malignos invasivos representam 65% a 80% das neoplasias malignas mamárias, classificam-se em ductais, lobulares, tipos especiais como os medulares, mucinosos, papilares, tubulares, adenóide císticos, secretores, apócrinos, cribiformes e também neoplasias sarcomatosas mamárias Manifestam-se como tumores sólidos, com consistência firme, decorrente da fibroplasia estromal induzida pelas células neoplásicas que mostram freqüentemente estrias opacas representativas da elastose periductal e/ou perivascular. Podem, também, ser espiculados, circunscritos, difusos sem limites definidos com o tecido mamário adjacente. Se os carcinomas ductais têm comportamento local previsível com crescimento local expansivo e tendência à disseminação via ductos locais, os lobulares são imprevisíveis, ou seja, crescem de maneira insidiosa por entre as estruturas locais, sem padrão radial, com tendência à multicentricidade (BUZAID; BARROS, 2007).
45
presença de casos de câncer, o grau de parentesco e o órgão afetado; realizar exame físico detalhado através da inspeção estática, dinâmica e manobras de palpação da mama e das cadeias axilares e supra e infra claviculares bilaterais; submeter as pacientes aos exames de rastreamento de mamografia, ultrassonografia e ressonância magnética mamária, se necessário, e então identificar nos exames complementares de imagem os sinais de malignidade diretos e indiretos. Com o aperfeiçoamento das técnicas de ultrassonografia, mamografia e ressonância magnética os diagnósticos precoces dos cânceres de mama tornaram-se mais freqüentes e iniciou-tornaram-se a era do manejo das lesões impalpáveis. Novas tecnologias vêm sendo apresentadas para o diagnóstico pré-cirúrgico, como as punções aspirativas de agulha fina que predizem o diagnóstico citológico, punções aspirativas com agulha grossa (core biopsy e mamotomia) que fornecem fragmentos tumorais para o estudo anatomopatológico, oferecendo possibilidade de adequado planejamento pré- cirúrgico e o estudo imunohistoquímico. Segundo estudo de Giannotti (2003), estas técnicas vêm aumentando ainda mais as chances de cura para os carcinomas mamários, pelo diagnóstico precoce de lesões mínimas, além de evitarem procedimentos cirúrgicos, internações e auxiliarem na diminuição dos custos, tanto nas lesões benignas, como nas lesões pré-cancerosas e neoplasias malignas.
46
College of Radiology aprovou o sistema Breast Imaging Reporting and Data System
(BIRADS™). Este sistema consiste em uma classificação radiológica para as lesões mamárias, com a finalidade de padronizar os achados radiológicos e correlacionar com os aspectos histopatológicos, sendo coerentemente aceita e utilizada (GIANNOTTI, 2003).
2.1.1.7 Tratamento
47
Entretanto, nas avaliações realizadas, percebeu-se que esta técnica não acrescentava benefícios e acrescentava mais morbidade ao procedimento, emergindo, então a fase das mastectomias radicais modificadas, citando como as mais importantes as de Pattey-Dyson (1948) que preserva o músculo do grande peitoral e de Madden-Auchinclos (1958) que preserva os dois músculos peitorais (figura 7). Em 1981, Veronesi publicou um clássico estudo demonstrando a segurança do tratamento conservador da mama quando associamos à ressecção tumoral ampla, à linfadenectomia axilar e à radioterapia. Atualmente, a mastologia evolui para a aplicação das técnicas de oncoplástica nos tratamentos conservadores (figura 8), e no manejo seletivo do esvaziamento axilar, através da proposta do Linfonodo Sentinela (LS) que teoricamente seria o primeiro gânglio a ser acometido na cadeia linfática pelo câncer, o LS é marcado pelo corante azul patente e por procedimentos da medicina nuclear associando à linfocintilografia e à marcação com Tecnécio 99, considerando este gânglio como amostragem representativa do status axilar e indicador da necessidade da abordagem axilar completa ou não.
48
Figura 8- Foto de programação de tratamento cirúrgico conservador e resultado pós- operatório, em paciente do: Hospital Ofir Loyola, em 2008. Acervo pessoal.
49
considerada completamente correta. Acredita-se que há um determinado momento nas fases iniciais da doença onde as células do câncer de mama ainda não possuem capacidade de disseminação pela via hematológica, posto que a diminuição da mortalidade nos diagnósticos realizados em estádios precoces sugere que a metástase pode ser influenciada pelo tempo do diagnóstico. Existe uma grande relação entre controle local da doença e sobrevida global (TIEZZI, 2007).
50
Os carcinomas mamários localmente avançados, segundo Buzaid e Katz, (2007), são um grupo de entidades heterogêneas clínicas, biológicas e anatomopatológicas, necessitando, portanto, de abordagem multidisciplinar e sério planejamento terapêutico. Para esses, é necessário o uso de quimioterápicos antes da cirurgia, ou seja, quimioterapia neo- adjuvante, com intuito de realizar controle precoce da doença micro-metastática, avaliação in vivo da resposta ao tratamento, redução do volume tumoral dentre outros.
2.2. PAPILOMAVÍRUS HUMANO
2.2.1 Definição e classificação taxonômica
Os vírus do papiloma humano (HPV) são patógenos responsáveis pela formação de tumores benignos e malignos de pele e mucosa. São membros da família Papillomaviridae, na qual passou a ser incluído o gênero Papillomavirus e a
espécie Human papillomavirus com mais de 130 genótipos, podendo ser divididos em tipos cutâneos ou de mucosa (SANCLEMENTE; GILL, 2002)
2.2.2 Organização Genômica
51
são classificados como, precoces (early, E) e tardios (late, L) dependendo de quando são expressos. A expressão das proteínas virais é fortemente regulada e dependente da diferenciação celular (CHEN; HUNTER, 2005).
A região E é formada pelos genes E1, E2, E4, E5, E6 e E7, apresentando funções definidas, a E1 tem relação com a replicação viral, E2 com a transcrição e replicação, E4 com a maturação viral e alteração da matriz intracelular. E5, E6 e E7 estão envolvidos na transformação celular. A região L é formada pelos genes L1 e L2, que codificam as proteínas do capsídeo. Somando-se a isso, o genoma é dotado de uma região reguladora LCR (Long Control Region) ou URR (Upstream Regulatory Region), variando de 400 a 1000 pbs, localizadas entre as regiões L1 e E6. Nessa região, existem seqüências estimuladoras e repressoras da transcrição viral, além da origem de replicação (SOUTO, 2005) (figura 9).
Figura 9- Relação entre os genes do HPV e suas requeridas funções (Souto, 2005)
52
regiões E1 e E2 do vírus. O resultado dessa quebra é uma perda de função desses dois genes, acompanhada de uma desregulação dos genes E6 e E7, resultando em transformação da célula hospedeira. A região do cromossomo ao qual o genoma viral se integra não parece ser essencial para o desenvolvimento carcinogênico, uma vez que estas regiões variam muito (RIVOIRE, 2001). Podemos afirmar que o HPV ratifica seu potencial oncogênico agindo no ciclo celular através da inibição dos genes supressores, parece que a chave para a transformação são as oncoproteínas E6 e E7 as quais trabalham para romper a regulação do ciclo celular, inibindo a apoptose e estimulando a progressão do ciclo celular pela associação com a p53 e inibição da p110, genes supressores tumorais (HENG et al. 2009).
Foi demonstrado que a E6 interage com a proteína p53 e a E7 com a proteína pRb, causando desregulação do ciclo celular (KELLEY, 2005). A proteína E7 fosforilada se liga à forma não fosforilada da proteína Rb e esta interação libera o fator de transcrição E2F antes ligado à proteína Rb (figura 10). Assim, a E2F pode se ligar ao DNA, ativando a transcrição dos genes necessários à síntese do DNA, estimulando de maneira ininterrupta a divisão celular, deixando de regular negativamente o ciclo celular de G1 para S. Essas duas proteínas atuam prevenindo a transformação celular, interrompendo sua divisão e proliferação (PINTO, 2002).
53
na sinalização celular, levando à transformação maligna e a tumorigênese (GANGULY; GARINHAR, 2009).
Figura 10-Organização Genômica do HPV.
Fonte: http://www.scielo.br/scielo.php?pid=S1676-24442002000100011&script=sci_arttext
54
2.2.3 Ciclo Biológico
O ciclo de vida produtivo do HPV está diretamente relacionado à diferenciação celular epitelial, à diferenciação celular anormal do epitélio causada pela infecção do HPV. É um processo que é totalmente dependente da expressão de genes virais. A infecção do Papilomavirus pode ocorrer por micro traumas ocorridos no epitélio, expondo as células basais à entrada do virus. Após a entrada do vírus nos queratinócitos, na camada basal, o genoma do HPV se estabelece como epissomo, aproximadamente 50 cópias por célula, que por sua vez se replica em sincronia com o DNA da célula hospedeira. Durante a divisão celular, as células basais deixam a camada basal, migram para a região supra basal e começam a se diferenciar. Os queratinócitos, por sua vez, terminam seu ciclo celular logo que são destacados da membrana e as células infectadas por HPV entram na fase S do ciclo celular uma vez atingida a camada supra basal (figura11).
55
Figura 11-Replicação Viral do HPV.
Fonte: http://www.scielo.br/scielo. Php? pid=S1519-38292006000400012&script=sci_abstract&tlng=pt
56
Uma variedade de condições clínicas pode ser atribuída aos HPV, desde lesões inócuas até lesões como o câncer. A infecção genital pelo HPV pode resultar em três possibilidades de manifestação clínica: (a) verrugas ano genitais, também chamadas de condilomas acuminados, que se localizam ao redor dos genitais e do ânus, estão geralmente relacionadas aos HPV 06 e 11 (baixo risco), e não levam ao câncer, muitas são assintomáticas e podem ter uma resolução espontânea em 03 a 04 meses, caso contrário, podem permanecer na mucosa ou até aumentarem de tamanho e número; (b) infecção latente ou inativa, neste tipo de manifestação o indivíduo não apresenta sintomas aparentes da infecção; (c) infecção ativa, que está associada aos tipos de HPV de alto risco, responsáveis pelas alterações celulares que podem resultar em neoplasias intra-epiteliais (CAVALCANTI, 2006).
Considerando o papel do vírus na indução da carcinogênese, também salientamos que apenas uma pequena fração, menos de 3%, das mulheres portadoras de HPV de alto risco desenvolve lesões de câncer de colo do útero. Além disso, a evolução das lesões de NIC (Neoplasia Intra-epitelial Cervical) para carcinomas cervicais invasivos só ocorre após um longo período de latência, estimado entre cinco a vinte anos, além disto, observamos que as células infectadas com expressão constante dos genes E6 e E7 não se apresentam imortalizadas – sugerem que a presença do vírus é necessária, mas não é suficiente para a transformação celular. Acredita-se na existência de moduladores virais ou celulares agindo como co-fatores. A utilização por longos períodos de contraceptivos orais, a paridade, o tabagismo, o número de parceiros sexuais e a presença de outras infecções sexualmente transmissíveis, como, por exemplo, por Herpesvirus 2 e
57
carcinomas cervicais (MUNOZ, 2003). Entretanto, Bosch (2002) chama a atenção para a possibilidade de que algumas dessas associações, como o número de parceiros ou a presença de outras DST, sejam circunstanciais e não causais, refletindo medidas indiretas de exposição ao HPV. Fatores genéticos do hospedeiro como o polimorfismo no códon 72 da proteína p53, com relevante papel no controle do ciclo celular, e o polimorfismo nos genes MHC (major histocompatibility complex) de classe I (em humanos, HLA-A, HLA-B e HLA-C), com relevante papel em eventos imunológicos, conferem uma menor ou maior susceptibilidade às infecções por HPVs de alto risco (CAMARA, 2000). Portanto, conclui-se que o comportamento biológico das lesões HPV induzidas é pleomórfico, há remissão espontânea em 30% dos condilomas. Os índices de remissão dependem do tipo e do potencial oncogênico viral. Sugere-se que uma deficiência dos mecanismos de imunovigilância seria responsável pelo desenvolvimento de lesões malignas (ROSENBLATT, 2005).
A partir da 3ª década do século passado, estudos epidemiológicos sugeriram o contato sexual como via de transmissão do Papilomavírus Humano baseados nas pesquisas realizadas em esposas dos soldados portadores de verrugas genitais que voltavam das guerras na Coréia e no Japão, demonstrando simultaneidade das lesões (BARRET, 1954).
58
fetal: gestacional, intraparto ou periparto. A via não sexual através dos fômites: toalhas e roupas íntimas podem justificar o aparecimento de verrugas em crianças e mulheres sem atividade sexual, embora se acredite que a resistência do vírus fora do organismo seja por um breve período de tempo. Parece ser a superfície de contato um importante meio de disseminação. Os virions do papiloma vírus são liberados quando o envelope cornificado de células descama. O método de transmissão do Papilomavírus Humano para os tumores mamários poderia ser a partir da atividade sexual ou através de disseminação viral ductal retrógrada. Especula-se que o HPV possa ser transmitido do períneo à mama pelas mãos das mulheres já contaminadas (KAN, 2005).
Os fatores de risco clássicos para a neoplasia cervical são basicamente os mesmos relacionados à infecção pelo HPV. Dentre estes fatores, podemos citar: início precoce da vida sexual; ter vários parceiros sexuais ao longo da vida; multiparidade; tabagismo; outras doenças sexualmente transmissíveis; redução da imunidade celular pelo vírus da imunodeficiência humana (HIV); uso de anticoncepcional oral; variantes do HPV com diferenças nas propriedades biológicas e de patogenicidade; deficiências nutricionais; consumo de álcool; falha da utilização da camisinha; herança genética ligada aos antígenos de histocompatibilidade HLA classe I e II (CAVALCANTE, 2006).
59
incidência geralmente na faixa etária de 45 a 49 anos, sugerindo que as infecções se dão realmente em mulheres mais jovens, e as infecções persistentes provocadas principalmente por HPV de alto risco são responsáveis pela maioria dos casos que evoluem lentamente para o câncer cervical (FEHRMANN, 2003).
2.2.4 Epidemiologia
Considerando os casos de câncer de colo uterino, excetuando-se o câncer de pele não melanoma, observamos que a previsão para 2010, no Brasil, segundo dados do INCA é de aproximadamente 18.430 novos casos, sendo o mais incidente na região Norte(23/100.000), enquanto que as regiões Centro-Oeste (20/100.000) e Nordeste (18/100.000) ocupam a segunda posição mais freqüente e nas regiões Sul (21/100.000) e Sudeste (16/100.000), a terceira posição.
60
É estimado que uma redução de cerca de 80% da mortalidade por esse câncer pode ser alcançada através do rastreamento de mulheres na faixa etária de 25 a 65 anos com o teste de Papanicolau e tratamento das lesões precursoras com alto potencial de malignidade ou carcinoma in situ. Para que tal ocorra, é necessário garantir a integralidade e a qualidade do programa de rastreamento e o seguimento das pacientes. Recentemente, agências de regulamentação de medicamentos de vários países aprovaram para comercialização vacinas contra a infecção pelo HPV. No Brasil, está registrada pela Agência Nacional de Vigilância Sanitária (ANVISA) a vacina quadrivalente contra HPV 06, 11, 16 e 18, desenvolvida para a prevenção de infecção pelos tipos virais mais comuns nas verrugas genitais (HPV 06 e 11) e no câncer do colo do útero (HPV 16 e 18) é indicada para mulheres com idade de 9 a 26 anos; e a vacina bivalente contra HPV tipos 16 e 18, associados ao câncer do colo do útero, é indicada para a mulheres de 10 a 19 anos. A inclusão da vacina contra HPV no Programa Nacional de Imunizações está em discussão pelo Ministério da Saúde e pode se constituir, no futuro, em importante ferramenta no controle do câncer do colo do útero (INCA 2010).
2.2.5 Relação do Papilomavírus Humano e Cânceres Humanos
61
A relação entre HPV e câncer cervical não é mais questionada,ao contrário,evidências moleculares e epidemiológicas indicam claramente que certos tipos de HPV são a principal causa de câncer cervical (MUÑOZ, 2003). O HPV é considerado como principal vírus oncogênico em humanos e tem sido identificado em neoplasias malignas ginecológicas especialmente os de colo uterino e em suas lesões precursoras. Eles são freqüentemente encontrados em outros tumores ano genitais como os de vulva/ vagina, ânus e pênis. Além disto, a associação com os cânceres de cabeça e pescoço está agora bem documentada. No entanto existem trabalhos controversos na detecção do HPV em outros tumores (PETERSEN, 2008).
Dados revelam que, excetuando o coração e o rim, o Papilomavírus Humano foi detectado em todos os outros órgãos: bexiga, próstata, cavidade oral, laringe, esôfago, estômago, cólon, vagina/vulva, pênis, mama, endométrio, ovário e pulmão. Alguns achados correlacionando a presença do HPV em tumores são notáveis: câncer de cólon 97%, câncer de pulmão 80%, câncer de mama 74%. Estes dados apontam para as diferenças geográficas na incidência do HPV em diferentes populações. O HPV é, no entanto, um importante biomarcador em diagnóstico moleculares dos tumores. Os carcinomas HPV positivos têm não somente uma etiologia distinta, mas também um fenótipo morfológico particular (PETERSEN, 2008).
62
29,4% dos carcinomas mamários usando PCR com primers específicos para HPV 11, HPV 16 e HPV18, Beatriz Pogo (1995) do Mount Sinai Hospital, NY, USA identificou seqüências vindas do MMTV em tumores mamários humanos que tinham baixa homologia com a seqüência gênica do HERVs.
No entanto, a recente identificação do HPV por De Villiers (2005), Kan (2005) em tumores mamários tem estabelecido o HPV como um forte oncovírus formador de câncer de mama. Foi demonstrado que nos tumores mamilares, nos quais o HPV tinha sido identificado, havia características histológicas típicas da associação do HPV com o câncer (assim como o câncer cervical). As estas características identificadas incluíam hiperplasia epitelial e aparência sugestiva de coilocitose, que consiste em uma alteração em células escamosas intermediárias maduras, contendo um, dois ou mais núcleos discarióticos, além desta também foram identificadas metaplasias escamosas de ductos lactíferos. Os coilócitos são células epiteliais caracterizadas por um halo perinuclear, condensadas ao redor do núcleo e são especificamente associadas à infecção do HPV e ao processo oncogênico precoce (GLENN, 2009).
63
dos cânceres de mama na China e 11,1% dos cânceres de mama no Japão (YU, 1999).
Examinando aréolas e espécimes de câncer de mama, outra pesquisa detectou HPVs de alto-risco e de baixo-risco em 86% das amostras, utilizando primers GP5+/6+ e primers FAP para tipos de HPV cutâneos e primers CP (DE VILLIERS, 2005). Existe relato de caso demonstrando “lymphoepithelioma-like carcinoma” da mama com encontro de Papilomavírus humano com DNA tipo 18 e 33 na paciente, e cuja histerectomia prévia revelou carcinoma in situ com a presença de HPV-33 (KULKA et al. 2008).
Observa-se, principalmente, a presença do HPV de alto risco nos cânceres mamários. Na maioria das pesquisas, o HPV de alto risco foi encontrado somente em tecidos tumorais, mas não em tecidos normais, com exceção do estudo da Turquia, no qual o vírus também foi detectado em tecido normal, mas em menor percentagem que nos cânceres (GUMUS, 2006).
Estudos prévios demonstraram a presença do HPV de alto risco, tipos 16, 18 e 33 em espécimes de câncer de mama provenientes de diversas populações em todo o mundo. A prevalência do HPV positivo no câncer de mama nestes estudos variou de 4% no México a 86% nas mulheres americanas (HENG, 2009).
64
2007; KHAN, 2008). Falhas na identificação viral são relativamente comuns, por isso alguns estudos mostram que é necessário o uso da reação em cadeia da polimerase (PCR) para detecção do vírus no câncer de mama. A análise da PCR em tempo real confirmou a presença da integração do DNA viral em todas as amostras de HPV16, no estudo de KHAN (2008).
65
presença de um retrovírus que é homólogo ao MMTV em tecidos de câncer de mama humano, em culturas de células normais da mama humana e em culturas de células de câncer de mama humano. As características morfológicas das partículas em ambos, do ser humano e do leite murino parecem ser quase idênticas e são exclusivas entre todos os vírus. Quando estas características são consideradas em conjunto com a homologia de 98% da seqüência de nucleotídeos entre o HHMMTV e o MMTV, parece provável que estes vírus são variantes uns dos outros ( LAWSON,2000).
66
3. OBJETIVOS
3.1 OBJETIVOS GERAIS
Pesquisar a presença do Papilomavírus Humano (HPV) e seus subtipos mais freqüentes em mulheres portadoras de tumores mamários benignos e malignos, assim como tecidos mamários normais.
3.2 OBJETIVOS ESPECÍFICOS
Identificar a presença do DNA HPV nos tumores mamários malignos, benignos e mamas normais
Subtipar o Papilomavírus Humano (HPV) nos tumores mamários que se apresentarem positivos para o DNA HPV através da técnica de PCR em tempo real para os subtipos mais importantes 06, 11, 16 e 18.
67
4. MATERIAIS E MÉTODOS
O comitê de Ética em pesquisa do NMT/UFPA apreciou a proposta da pesquisa sob o protocolo Nº048/2008-CEP/NMT e considerou que foram atendidas as exigências da Resolução 196/96, aprovando a realização do estudo. As pacientes serão beneficiadas com a informação relevante quanto à presença do HPV em suas amostras e os riscos serão mínimos, considerando que o procedimento de coleta de amostras foi realizado durante o tratamento cirúrgico convencional e indicado para o tratamento da doença em cada grupo de pacientes. O sujeito da pesquisa em cada grupo foi incluído somente quando este assinou o termo de consentimento livre e esclarecido, declarando aceitar participar da pesquisa.
Para análise dos resultados usamos os testes: Exato de Fisher, Teste G de independência, Regressão Logística. O valor de alfa: 0,05.
4.1. LOCAL DE ESTUDO
69
4.2 CASUÍSTICA
Grupo de pacientes: selecionamos aleatoriamente 45 pacientes portadoras de neoplasia mamária, constituindo 28 neoplasias malignas e 17 tumores benignos. Grupo controle: Foram coletadas 18 amostras de tecido mamário normal, retro areolares colhidos de peças de mamoplastias redutoras.
As pacientes foram submetidas ao formulário que contém inquérito sobre idade, paridade, antecedentes menstruais, métodos anticoncepcionais, número de parceiros sexuais, hábitos (tabagismo, alcoolismo, uso de drogas), antecedentes pessoais e familiares mórbidos (apêndice A) e ao termo de consentimento livre e esclarecido (apêndice B).
4.2.1 Critérios de Inclusão e Exclusão
4.2.1.1 Critérios de Inclusão
Pacientes do sexo feminino, acima de 18 anos de idade, portadoras de tumores mamários malignos e benignos, pacientes que se submeterem de modo espontâneo à mamoplastia redutora e que aceitem participar de modo livre e esclarecido da pesquisa.
70
Como critérios de exclusão, enumeramos as pacientes que não desejarem participar da pesquisa, que não consigam responder adequadamente o formulário, tumores que sejam provenientes de outros hospitais, tumores que não foram adequadamente congelados.
4.2.2 Obtenção do Material Biológico
As amostras foram colhidas durante o ato cirúrgico; exérese de tumor de mama, biópsias incisionais e biópsias excisionais, previamente indicado para cada paciente, em ambiente hospitalar. Após assepsia da mama, foi retirado o tumor ou fragmento tumoral, e então incisado 0,5cm do tumor para o estudo, que imediatamente foi colocado em tubete, previamente identificado, e enviado ao congelador a 20° negativos. Após o término da cirurgia, o material foi enviado ao Laboratório de Imunopatologia do Núcleo de Medicina Tropical para armazenamento e posterior análise.
As amostras de mamas normais foram coletadas de mamoplastias redutoras, tendo como critério de amostra tecidual 0,5cm do tecido retro areolar, e, então, obedecendo às mesmas etapas já descritas anteriormente.
4.3 MÉTODOS DE DETECÇÃO E TIPAGEM DO HPV
71
O princípio básico da PCR está na capacidade de, a partir de quantidades mínimas de DNA, multiplicarem uma determinada seqüência, de modo que esta se torne majoritária na amostra. Na reação de PCR, o fragmento de DNA que desejamos multiplicar (ou amplificar) é chamado de fragmento alvo ou DNA molde e constitui um pedaço do gene que se pretende estudar. Além do DNA molde há também os oligonucleotídeos (também chamados de primers) que nada mais são do que pequenos fragmentos de DNA complementares às extremidades da região que se pretende amplificar.
O método pelo qual a PCR funciona é descrito como dois pequenos fragmentos de DNA, tipicamente de 20 pares de bases que são sintetizados em laboratório. Esses são os primers, complementares de cada uma das extremidades da seqüência de DNA de interesse, sempre na direção 5' > 3'.
72
Para a detecção do HPV e sua tipagem, foram realizadas duas etapas de PCR, uma para detecção do vírus e a outra análise de PCR em tempo real, apenas para as amostras positivas, para tipagem dos subtipos 06, 11, 16 e 18.
4.3.1 PCR 01
Para cada reação, foi utilizado 100ng de DNA em 20µL de tampão composta por 20 mM Tris-HCL (pH 8.4 ou 8.6), 0,25-1.5mM MgCl2, 50 mM KCl, 0.02mM dNTP, 200 nM de oligos, MY9 e MY11 (específicos para detecção de HPV) e 0,25 unidades de Taq polimerase. A reação foi de um ciclo de desnaturação inicial de 94ºC por 5 minutos, e 35 ciclos da amplificação de PCR serão executados. Cada ciclo consiste em 94ºC por 30 segundos, 52ºC por 30 segundos e 72ºC por 30 segundos. A extensão final ocorrerá à 72ºC por 5 minutos. Em seguida as amostras foram submetidas à eletroforese em gel de agarose a 1% em TBE. As amostras positivas apresentaram uma banda de 440 pb.
4.3.2 PCR 02
73
Para controle da presença de DNA nas amostras e para avaliar se não há inibidor de reação, todas as amostras foram submetidas a PCR para o gene GAPDH (Gylceraldehyde-3-phosphate dehydrogenase), que é um gene constitutivo e deve estar amplificado em todas as amostras. Para evitar contaminação com DNA estranho, foram utilizadas salas independentes para cada uma das etapas: extração do DNA, preparação do mix, procedimento da PCR e eletroforese.
74
Nome do primers Seqüências
b-Globina: F: 5´ TCGGAGTCAACGGATTTGG 3´
R: 5´ GATGGCAACAATATCCACTTTACCA 3´ HPV geral MY09: 5´-CGT CCA AAA GGA AAC TGA GC-3´
MY11: 5´-GCA CAG GGA CAT AAC AAT GG-3´
HPV6: 5- CGGCCCCTGCGTTAATGATTGCG-3´
5´- CTATGGCTCGTCCTCCTGTGG-3´
HPV11: 5´- CGGAGCTTGTAGTTGTCTGATGTCTC G-3´
5´- GATGTGACAGCAACGTCCGACT-3´ HPV16:
HPV18:
5´-: CGGATTGCGTGCAACATATTCATC G-3´ 5´- GCCACTGTCTACTTGCCTCCTG-3´
5´-:CGACCGAGTCCACAGTGTCCAGGT?G-3´ 5´-CGTATTCCAGCACCGTGTCC-3´
75
5. RESULTADOS
Nesta pesquisa, foram examinados 63 espécimes cirúrgicos classificados em 28 tumores malignos, 17 tumores benignos e 18 amostras de mamoplastias. Os tipos histológicos encontrados nos tumores benignos foram 13 fibroadenomas, 01 adenose, 02 tumores filóides benignos, 01 lesão linfoproliferativa, 01 mastite crônica e 01 fibrose. E na histologia dos tumores malignos, encontramos 25 carcinomas ductais invasivos, 01 sarcoma osteogênico, 01 carcinoma apócrino, 01 carcinoma mucinoso e 01 carcinoma cribiforme (tipos especiais).
Foram correlacionadas, nas portadoras de tumor, variáveis como: idade, paridade, número de parceiros, antecedentes mórbidos pessoais, história familiar de câncer, número de parceiros, menarca, imunohistoquímica e follow up e, então, sua relação com o achado de DNA HPV para cada grupo. Nas amostras de mamoplastias redutoras apenas realizamos a tipagem do DNA HPV através da técnica de PCR, servindo como controle.