U
NIVERSIDADEF
EDERAL DAP
ARAÍBA– UFPB
D
EPARTAMENTO DEQ
UÍMICA– DQ/CCEN
FÍSICO-QUÍMICA EXPERIMENTAL
M
ANUAL DEP
RÁTICASC
OMPLETOCONTEÚDO:
UTILIZAÇÃO DESTE MANUAL
P
ARTE1: T
ERMODINÂMICAQ
UÍMICAI
PRÁTICA N° 1: LEI DE BOYLE
PRÁTICA N° 2: LEI DE CHARLES E GAY-LUSSAC PRÁTICA N° 3: LEI DE GRAHAM
PRÁTICA N° 4: CALOR ESPECÍFICO DE UM SÓLIDO
PRÁTICA N° 5: CALOR DE NEUTRALIZAÇÃO, DISSOLUÇÃO E DILUIÇÃO PRÁTICA N° 6: FUNÇÕES TERMODINÂMICAS E SOLUBILIDADE
PRÁTICA N° 7: ENTROPIA DE UM PROCESSO IRREVERSÍVEL
PRÁTICA N° 8: CONSTANTE DE EQUILÍBRIO POR FOTOCOLORIMETRIA PRÁTICA N° 9: CONSTANTE DE EQUILÍBRIO POR TITULOMETRIA
1-18;19-47;103;104;105
P
ARTE2: T
ERMODINÂMICAQ
UÍMICAII
PRÁTICA N° 1: VOLUME MOLAR PARCIAL PRÁTICA N° 2: TENSÃO SUPERFICIAL
PRÁTICA N° 3: VISCOSIDADE DE UM LÍQUIDO PRÁTICA N° 4: EQUILÍBRIO SÓLIDO-LÍQUIDO
PRÁTICA N° 5: DISTRIBUIÇÃO DE SOLUTO ENTRE SOLV. IMISCÍVEIS PRÁTICA N° 6: SOLUBILIDADE LÍQUIDOS (SISTEMA BINÁRIO)
PRÁTICA N° 7: SOLUBILIDADE LÍQUIDOS (SISTEMA TERNÁRIO) PRÁTICA N° 8: CONDUTIVIDADE MOLAR
PRÁTICA N° 9: CONSTANTE DE FARADAY E NÚMERO DE AVOGADRO
1-18;48-72;103;104;106
P
ARTE3: C
INÉTICAQ
UÍMICAPRÁTICA N° 1: PARÂMETROS CINÉTICOS PELO MÉTODO DO ISOLAMENTO PRÁTICA N° 2: ORDEM DE REAÇÃO PELO MÉTODO DAS VELOC. INICIAIS PRÁTICA N° 3: CONSTANTE DE VELOC. POR CONDUTIVIMETRIA
PRÁTICA N° 4: PARÂMETROS CINÉTICOS POR FOTOCOLORIMETRIA PRÁTICA N° 5: CONSTANTE DE VELOC. POR TITULOMETRIA
PRÁTICA N° 6: CONSTANTE DE VELOC. POR POLARIMETRIA PRÁTICA N° 7: CATÁLISE ENZIMÁTICA VIA FOTOCOLORIMETRIA PRÁTICA N° 8: ISOTERMA DE ADSORÇÃO VIA TITULOMETRIA
1-18;73-102;103;104;107
F
ÍSICO-Q
UÍMICAE
XPERIMENTAL: P
RÁTICASS
UGERIDASPRÁTICAS N°: 1.4, 1.5, 1.7, 2.1, 2.2, 2.3, 3.2, 3.3, 3.4
1-18;19;29-31;32-35;38-40;48;49-50;51-53;54-56;73; 77-80;81-84;85-88;103;104;108
F
UNDAMENTOS DEF
ÍSICO-Q
UÍMICA: P
RÁTICASS
UGERIDASPRÁTICAS N°: 1.1, 1.2, 1.4, 1.5, 1.7, 3.2, 3.3, 3.4, 3.6
ORIENTAÇÕES INICIAIS:
ATITUDES SEGURAS NO LABORATÓRIO E TRATAMENTO DE DADOS
O
BSERVAÇÕESI
NICIAIS1. Segurança no Laboratório: A participação nas aulas práticas só será permitida se o aluno estiver portando o seu caderno de laboratório e vestido adequadamente (calça, sapato e bata). É de suma importância que cada aluno se esforce para manter o laboratório limpo e organizado, de forma a permitir o seu uso posterior.
2. Tempo da Atividade: Em todas as aulas práticas os alunos devem trazer seus cadernos de laboratório devidamente organizados, contendo o pré-relatório e as tabelas a serem preenchidas com os dados dos experimentos. A critério do professor, a realização da atividade prática poderá ser suspensa caso o caderno de laboratório pré-organizado não seja apresentado no início da atividade.
3. Avaliação da Prática: O caderno de laboratório também deve conter o tratamento de dados referente a cada prática, cuja cópia deve ser entregue ao professor no início da aula prática seguinte. Este procedimento deve ser feito antes da elaboração do relatório final da atividade prática.
T
RATAMENTO DED
ADOSALGARISMOS SIGNIFICATIVOS
Em matemática 10 é igual a 10,0. Entretanto, nas ciências experimentais esses números não são necessariamente iguais. Por exemplo, quando se expressa a massa de uma amostra como sendo 10 g significa dizer que a quantidade pesada está entre 11 g e 12 g, enquanto que 10,0 g significa algo entre 9,9 g e 10,1 g.
Os algarismos necessários para expressar o resultado de um experimento, com a mesma precisão que as medidas efetuadas, são chamados algarismos significativos. Por exemplo, ao se escrever que a distância entre dois pontos é de 12,00 cm, a medida está sendo representada por quatro algarismos significativos. Escrevendo que a distância é de 0,1200 m ou 0,0001200 km tem-se tem-sempre quatro algarismos significativos. Note-tem-se que os zeros que precedem o algarismo 1 não fazem parte dos algarismos significativos, porque servem apenas para indicar a posição da vírgula. Os dois zeros seguintes aos algarismos 1 e 2 são significativos, porque indicam que a medida foi feita com precisão da ordem de um décimo de milímetro.
O experimentador deve registrar os resultados de tal modo que o último algarismo significativo, e apenas ele, seja incerto. A soma algébrica de um algarismo incerto com algarismos exatos é um algarismo incerto. Por exemplo:
104,65 + 0,2248 ---104,87
.
Neste caso o algarismo incerto é o 7, de modo que o resultado deve ser expresso como 104,87. Na multiplicação e na divisão o raciocínio é análogo. Por exemplo:
12,4 x2,54 496 620 248 ---31, 496
,
de modo que o resultado deve ser representado na forma de 31,5.
PRECISÃO & EXATIDÃO
Os termos precisão e exatidão são usados para dar informações sobre a qualidade das medidas e a confiança que se pode depositar nelas. Por exemplo, pesou-se uma amostra sobre duas balanças, de modo que a primeira pesagem indicou 1,25±0,02 g e a segunda 1,2500±0,0002 g. O resultado apresentado pela segunda balança é mais preciso que o da primeira, mas não se tem certeza de qual resultado é o mais exato, visto que uma das balanças pode apresentar um erro sistemático.
Fala-se de precisão quando se considera o número de algarismos significativos e a reprodutibilidade dos resultados, enquanto a exatidão
representa a diferença entre a medida e o seu valor real. Assim, uma medida pode ser muito precisa e pouco exata, mas se a medida for muito exata é provável que seja muito precisa. A precisão depende dos erros acidentais
(devidos ao operador; esses erros são variáveis em grandeza e sinal, e se compensam quando o número de medidas é grande), enquanto a exatidão depende dos erros sistemáticos (independentes do operador; esses erros são constantes em grandeza e sinal e nunca se compensam).
A determinação da precisão é feita pela percentagem de erro da medida. Por exemplo, duas medidas deram 1,25±0,02 g e 1,2500±0,0002 g, de modo que a precisão das medidas é:
1ª Medida: 0,02
1,25 = 0,016 = 1,6 %
2ª Medida: 0,0002
1,2500 = 0,00016 = 0,016% .
ERRO ABSOLUTO & ERRO RELATIVO
Em uma medida expressa na forma 7,25±0,03 cm, a quantidade 7,25 cm representa o valor absoluto da medida, enquanto que ±0,03 cm representa o
erro absoluto, que é independente do valor da medida. O erro relativo é a fração do erro cometido na medida e depende do valor absoluto. Por exemplo, duas medidas deram 7,25±0,03 cm e 72,50±0,03 cm, de modo que os erros absolutos são os mesmos, mas os erros relativos são:
1ª Medida: 0,03
7,25 = 0,004 = 0,4%
2ª Medida: 0,03
72,50 = 0,0004 = 0,04% .
A análise de erro descrita acima diz respeito a precisão da medida. No entanto, outra análise de erro a ser considerada é feita com base na exatidão, para a qual é necessário um valor de referência (geralmente um valor tabelado em
handbooks ou determinado através de um trabalho científico meticuloso). Para
este tipo de análise, o erro absoluto é determinado pela expressão:
Erro =
|
Medida−Referência|
, e o erro relativo:%Erro =
|
Medida−ReferênciaReferência
|
.FONTES DE DADOS ADICIONAIS
Todos os dados adicionais, necessários para a realização de tratamentos de dados ou determinações de erros experimentais, tais como densidade, tensão superficial e viscosidade em diferentes temperaturas, devem ser obtidos em manuais de constantes físicas e químicas ou em artigos científicos (muitos dos quais são recomendados neste manual, ao final de cada prática).
R
EFERÊNCIAS1. Bueno, W. A.; Degrève, L.; Manual de Laboratório de Físico-Química, São Paulo, McGraw-Hill, 1980.
2. Silva, R. R.; Bocchi, N.; Rocha Filho, R. C.; Introdução à Química Experimental, São Paulo, McGraw-Hill, 1990.
ELABORAÇÃO DE PRÉ-RELATÓRIOS:
DOCUMENTAÇÃO ANTERIOR A REALIZAÇÃO DAS PRÁTICAS
O
BSERVAÇÕESI
NICIAIS1.
Cada aluno deve preparar um pré-relatório manuscrito em seu caderno de laboratório. O objetivo do pré-relatório é o de permitir que o aluno tome conhecimento dos detalhes do experimento antes de sua ida ao laboratório, bem como possibilitar a execução rápida e eficiente da atividade prática. É de suma importância a preparação antecipada do pré-relatório para a compreensão das bases teóricas e do roteiro da prática para o bom aproveitamento acadêmico.2. A realização da prática dependerá, a critério do professor responsável, da apresentação do pré-relatório no início das atividades no laboratório.
C
OMPONENTES DOP
RÉ-R
ELATÓRIOEste material deve conter os seguintes itens: 1. MATERIAIS:
Lista completa de todos os equipamentos e reagentes a serem utilizados.
2. PROCEDIMENTO:
Descrição resumida do procedimento da prática. Deve-se evitar a simples cópia do roteiro da prática.
3. QUESTÕES:
Discussão sobre as questões sugeridas no manual do laboratório. 4. DADOS:
Quando for necessária a preparação de soluções, todos os cálculos relativos a massas e volumes a serem medidos devem constar neste item. Deve-se reservar um espaço para o registro das massas e volumes a serem efetivamente medidos na atividade prática. Quando necessário, tabelas (devidamente legendadas) para o registro dos dados a serem medidos devem ser preparadas e incluídas nesta seção. Deve-se tomar cuidado com o registro correto dos algarismos significativos e unidades de medida.
Materiais: 2 Béqueres de 250 mL;
2 Pipetas Volumétricas de 50±0,1 mL; 2 Termômetros Digitais (0-100 °C±0,1 °C);
100 mL de Ácido Clorídrico (HCl) 1,0 M; 100 mL de Hidróxido de Sódio (NaOH) 1,0 M; ...
Procedimento: Resumido, mas facilmente compreensível...
Questões: Devidamente respondidas...
Dados: 100 mL HCl 1,0 M.
MHCl = 36,46 g/mol, pHCl = 38 %, ρHCl(Conc.) = 1,181 g/mL
mHCl = cHClMHClVsol/p
VHCl = mHCl/ρHCl =cHClMHClVsol/pρHCl
VHCl= (1,0 mol/L)(36,66 g/mol)(0,100 L)/(0,38)(1,181 g/mL)
VHCl= 8,12 mL
100 mL NaOH 1,0 M.
MNaOH = 40,00 g/mol, pNaOH = 99 %
mNaOH = cNaOHMNaOHVNaOH/p
mNaOH = (1,0 mol/L)(40,00 g/mol)(0,100 L)/(0,99)
mNaOH = 4,04 g
VHCl: ±0,1 mL
mNaOH: ±0,0001 g
Reação entre HCl 1,0 M (50±0,1 mL) e NaOH 1,0 M (50±0,1 mL).
Tempo (s) THCl (°C) TNaOH (°C) Tcalorímetro (°C)
10
...
ELABORAÇÃO DE RELATÓRIOS:
DOCUMENTAÇÃO POSTERIOR A REALIZAÇÃO DAS PRÁTICAS
O
BSERVAÇÕESI
NICIAIS1.
O relatório deve ser, preferencialmente, impresso em papel tamanho A4, com fonte Times 12, Arial 11 ou Verdana 11, espaçamento 1,5 e títulos/subtítulos em negrito e letras maiúsculas.2.
O relatório deve ser bem organizado e conciso, sem sacrificar a clareza. Atenção especial deve ser dada ao estilo literário científico compatível ao esperado para a disciplina. Ortografia e regras gramaticais não devem ser negligenciadas e serão penalizadas, a critério do professor responsável, caso não atendam a níveis adequados.3.
Equações matemáticas devem ser acompanhadas de material verbal suficiente para deixar claro os significados dos termos empregados. Gráficos e tabelas devem ser adequadamente legendadas, com especial atenção a algarismos significativos e unidades de medida.4.
O relatório elaborado deve ser, acima de tudo, um material original. Objetiva-se, com isto, o desenvolvimento da habilidade de escrever de forma concisa e eloquente, obedecendo a padrões rígidos impostos a argumentação científica.5. O material deve ser elaborado no formato de “relatório completo” ou “relatório curto”, a critério do professor responsável.
R
ELATÓRIOC
OMPLETOEste formato deve conter os seguintes componentes: 1. CAPA:
Título e número da prática, identificação do(s) aluno(s) e da turma(s) (ex.: Bacharelado em Química), data da realização do experimento e nome do professor responsável.
2. RESUMO:
Texto contendo entre 5 e 10 linhas resumindo todo o relatório (objetivos, procedimentos e resultados).
3. OBJETIVOS:
Com verbo no infinitivo, indicando o(s) objetivo(s) da prática. 4. INTRODUÇÃO:
Teoria necessária para o entendimento da prática e fundamentação da discussão dos resultados, devendo estar referenciada com numeração sequencial, evitando-se cópia de textos da bibliografia consultada.
5. MATERIAIS E MÉTODOS:
5.1.Equipamentos: Informar, na forma de itens, todos os materiais e equipamentos utilizados. Ex.:
◦ Chapa Elétrica Aquecedora (ou Bico de Bunsen + Tripé de Ferro); ◦ Termômetro (0-100 °C±0,5 °C).
5.2.Reagentes: Informar, na forma de itens, todos os reagentes utilizados, com formulação e concentração. Ex.:
◦ Ácido clorídrico concentrado (HCl);
◦ Solução aquosa de ácido clorídrico (HCl) 0,50 mol/L.
5.3.Procedimento: Descrever o procedimento experimental realizado, com detalhes, levando-se em conta as possíveis diferenças do roteiro da prática. Os verbos devem estar no passado e de forma impessoal. Ex.: “colocou-se...” ou “foram colocados...”.
6. RESULTADOS E DISCUSSÃO:
Colocar todos os resultados alcançados na ordem em que foram adquiridos, apresentado-os com clareza e organização.
◦ Fazer uso de quadros, tabelas, gráficos e figuras, quando conveniente, devendo ser numerados e mencionados no texto antes de suas colocações no documento. Quadros apresentam as laterais fechadas e as tabelas apresentam as laterais abertas. Figuras facilitam a ilustração de um esquema ou montagem experimental, e gráficos facilitam a ilustração de uma tendência, devendo ser priorizados se os resultados o permitirem. Gráficos devem conter escalas coerentes aos valores mínimos e máximos dos pontos, com eixos rotulados com o símbolo da grandeza ou palavras que a definam, com as unidades indicadas entre parênteses. Em todos os casos deve-se utilizar legendas autoexplicativas, posicionadas na parte superior em tabelas, e na parte inferior em quadros, figuras e gráficos.
◦ Todos os dados numéricos obtidos através de medidas devem apresentar unidades, fazendo-se o uso correto de algarismos significativos. Deve-se informar nesta seção os erros absolutos e relativos (erros relacionados a precisão das medidas). Todos os cálculos relativos ao tratamento de dados devem ser apresentados neste item, atentando-se rigorosamente as regras operacionais de análise dimensional. No caso de cálculos repetitivos, apenas um deve ser realizado em detalhes, e os demais devem ser apresentados em uma tabela. Quando um valor de referência estiver disponível a partir de dados da literatura, deve-se informar nesta seção os erros absolutos e relativos obtidos (erros relacionados a exatidão dos resultados).
7. CONCLUSÕES:
Apresentar as conclusões de forma clara e resumida a partir dos resultados obtidos. Deve-se indicar os conceitos mais relevantes apreendidos durante a execução do experimento ou durante a elaboração do relatório.
8. QUESTÕES:
Discussão das questões sugeridas no roteiro da prática.
9. REFERÊNCIAS:
Listar as referências consultadas para a realização do relatório de acordo com a ABNT (Associação Brasileira de Normas técnicas), com a numeração adequada. Ex.:
1. SOBRENOME, Iniciais; Título do Livro, Nº da Edição, Local da Publicação, Editora, Páginas Consultadas, Ano.
2. ATKINS, P.W.; Físico-Química, 7ª Ed., RJ, Ed. LTC, p. 84, 2004.
3. CORSARO, G. Colorimetric Chemical Kinetics Experiment. J. Chem. Educ., v. 41, n. 1, p. 48, 1964.
R
ELATÓRIOC
URTOEste formato deve conter os seguintes componentes: 1. CAPA:
Título e número da prática, identificação do(s) aluno(s) e da turma(s), data da realização do experimento e nome do professor responsável.
2. DADOS:
Colocar todos os resultados alcançados na ordem em que foram adquiridos, apresentado-os com clareza e organização.(*)
3. TRATAMENTO DE DADOS:
Todos os cálculos relativos ao tratamento de dados devem ser apresentados neste item.(*)
4. ANÁLISE DE ERROS:
Deve-se informar nesta seção os erros absolutos e relativos (relacionados a precisão e exatidão das medidas).(*)
5. CONCLUSÕES:
Apresentar as conclusões de forma clara e resumida a partir dos resultados obtidos.
6. QUESTÕES:
Discussão das questões sugeridas no roteiro da prática. 7. REFERÊNCIAS:
Listar as referências consultadas para a realização do relatório de acordo com a ABNT, com a numeração adequada.(**)
*(*) Vide recomendações para “Resultados e Discussão” do Relatório Completo.
M
ODELO DER
ELATÓRIOUNIVERSIDADE FEDERALDA PARAÍBA – UFPB
Departamento de Química – DQ/CCEN
Prática Nº 1: Determinação do
Calor de Neutralização
Grupo: Fulano de Andrade Sicrano de Bezerra
Turma: Bacharelado em Química
Data: 27 de agosto de 2014
R
ESUMONeste experimento, utilizou-se um calorímetro adiabático (constituído de uma garrafa térmica e um termômetro digital) para a determinação do calor liberado em uma reação de neutralização entre o ácido clorídrico (HCl 0,1 M) e hidróxido de sódio (NaOH 0,1 M) concentrados. Os resultados obtidos indicam que, apesar da simplicidade da montagem experimental, é possível obter uma boa concordância com resultados tabelados.
O
BJETIVOSDeterminar o calor de neutralização em uma reação ácido-base a partir de um simples experimento de calibração de um calorímetro.
I
NTRODUÇÃOA calorimetria permite determinar a troca de calor envolvida em um processo químico ou físico. O conhecimento deste tipo de dado pe muito importante em diversas áreas, como a indústria química (calor liberado ou absorvido em um processo) e alimentícia (onde se determina o “teor calórico” de alimentos). Um calorímetro é um aparelho simples, termicamente isolado, que possibilita medir a quantidade de calor envolvida em um processo a partir da determinação da variação de temperatura medida em seu interior. Conhecendo-se a capacidade calorífica Ccal do calorímetro é possível determinar
a quantidade de calor qproc envolvida no processo a partir da determinação da
variação de temperatura ΔT medida no calorímetro e da aplicação da 1ª Lei da Termodinâmica, segundo a qual:
Calor do Processo
= −
Calor do Calorímetro
⇒
q
proc= −
C
calΔ
T
.(...)
M
ATERIAIS& M
ÉTODOSEQUIPAMENTOS
• 01 Garrafa Térmica de 500 mL;
• 01 Béquer de 200 mL;
• 01 Proveta de 100 mL;
• 01 Chapa Elétrica Aquecedora;
• 02 Termômetros Digitais (0-100 °C±0,1 °C).
REAGENTES
• HCl 1,0 mol/L;
PROCEDIMENTO
Inicialmente, procedeu-se a calibração do calorímetro, constituído de uma garrafa térmica e 100 mL de água destilada. Colocou-se 100 mL de água destilada, sob temperatura ambiente, no interior da garrafa térmica (recipiente calorimétrico) e anotou-se a temperatura (T1(1)) de equilíbrio. Em seguida,
aqueceu-se 100 mL de água destilada em um béquer de 200 mL até ~80 °C. Transferiu-se 50 mL da água aquecida para uma proveta de 100 mL e devolveu-se a água ao béquer. Repetiu-devolveu-se este procedimento 3 vezes de modo que a proveta entrasse em equilíbrio térmico com a água aquecida. Finalmente, coletou-se 50 mL da água aquecida com a proveta, anotou-se a temperatura (T2(1)) e transferiu-se a água aquecida para o interior do calorímetro. Esperou-se
o equilíbrio térmico ser alcançado e anotou-se a temperatura de equilíbrio (Tf(1)).
Em seguida, esvaziou-se o calorímetro, que foi lavado com bastante água da torneira e depois com água destilada. Com o calorímetro lavado, colocou-se 50 mL de uma solução de NaOH 1,0 mol/L em seu interior e anotou-se a temperatura (Ti(2)). Pegou-se 50 mL de uma solução de HCl 1,0 mol/L, sob a
mesma temperatura do interior do calorímetro (Ti(2)), e colocou-se esta solução
sobre a solução de hidróxido de sódio do calorímetro. Esta última etapa restaurou o volume inicial do calorímetro. Agitou-se suavemente a mistura e anotou-se a temperatura de equilíbrio (Tf(2)).
R
ESULTADOS ED
ISCUSSÃODADOS
VHCl = 8,1 mL (±0,1 mL)
cHCl = VHClpρHCl/MHClVsol
= (8,1 mL)(0,38)(1,181 g/mL)/(36,66 g/mol)(0,100 L) = 0,9916 mol/L
Vsol(1) = 50,0 mL (±0,1 mL)
s(VHCl) = 0,1/8,1 = 1,2 % [Erro Relativo (Precisão)]
mNaOH = 4,0381 g (±0,0001 g) [s(mNaOH) = 0,1/8,1 = 1,2 %]
cNaOH = mNaOHp/MnaOHVsol
= (4,0381 g)(0,99)/(40,00 g/mol)(0,100 L) = 0,9949 mol/L
Vsol(2) = 50,0 mL (±0,1 mL)
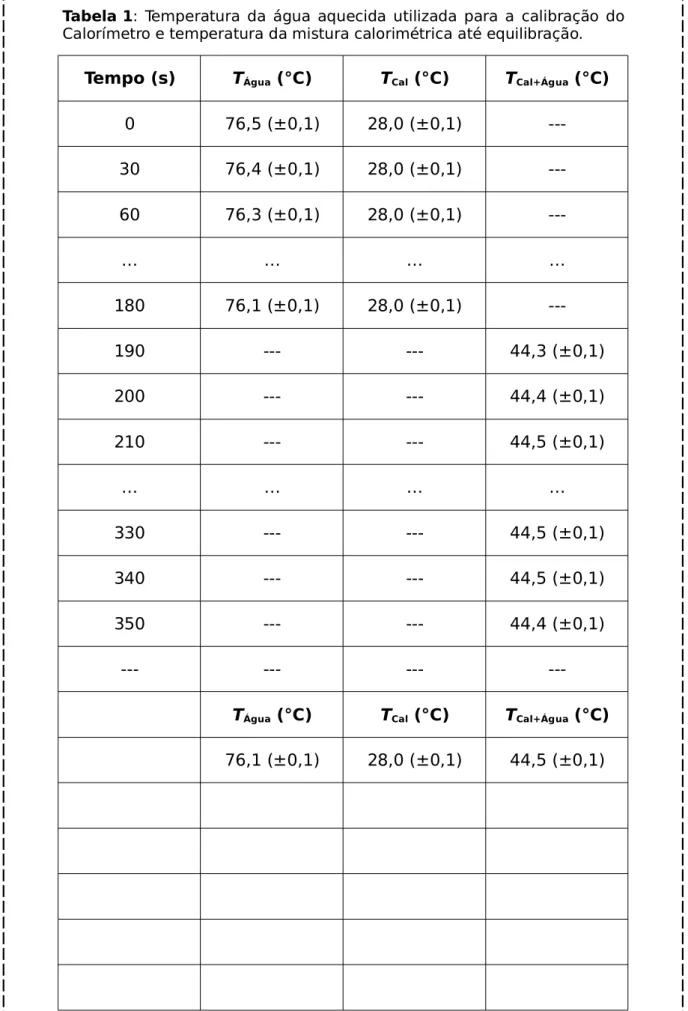
Tabela 1: Temperatura da água aquecida utilizada para a calibração do Calorímetro e temperatura da mistura calorimétrica até equilibração.
Tempo (s) TÁgua (°C) TCal (°C) TCal+Água (°C)
0 76,5 (±0,1) 28,0 (±0,1)
---30 76,4 (±0,1) 28,0 (±0,1)
---60 76,3 (±0,1) 28,0 (±0,1)
---… … … …
180 76,1 (±0,1) 28,0 (±0,1)
---190 --- --- 44,3 (±0,1)
200 --- --- 44,4 (±0,1)
210 --- --- 44,5 (±0,1)
… … … …
330 --- --- 44,5 (±0,1)
340 --- --- 44,5 (±0,1)
350 --- --- 44,4 (±0,1)
--- --- ---
---TÁgua (°C) TCal (°C) TCal+Água (°C)
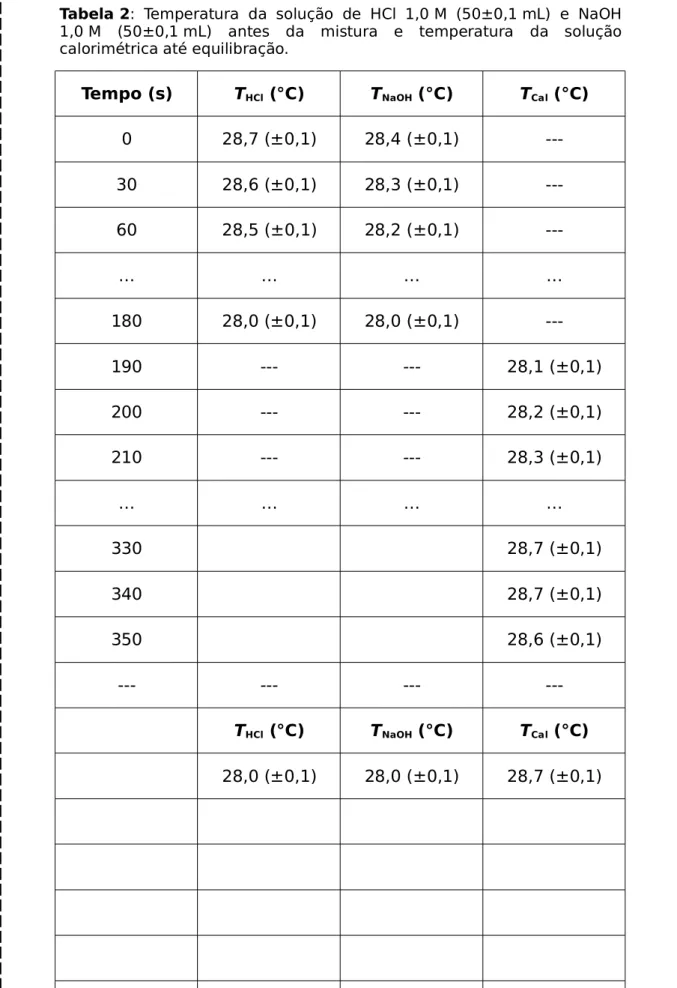
Tabela 2: Temperatura da solução de HCl 1,0 M (50±0,1 mL) e NaOH 1,0 M (50±0,1 mL) antes da mistura e temperatura da solução calorimétrica até equilibração.
Tempo (s) THCl (°C) TNaOH (°C) TCal (°C)
0 28,7 (±0,1) 28,4 (±0,1)
---30 28,6 (±0,1) 28,3 (±0,1)
---60 28,5 (±0,1) 28,2 (±0,1)
---… … … …
180 28,0 (±0,1) 28,0 (±0,1)
---190 --- --- 28,1 (±0,1)
200 --- --- 28,2 (±0,1)
210 --- --- 28,3 (±0,1)
… … … …
330 28,7 (±0,1)
340 28,7 (±0,1)
350 28,6 (±0,1)
--- --- ---
---THCl (°C) TNaOH (°C) TCal (°C)
TRATAMENTO DE DADOS
Capacidade Calorífica do Calorímetro:
cÁgua = 4,201±0,002 J/g°C[1]
ρÁgua = 9,9568±0,0022 g/mL (a 30 °C)[1]
VÁgua = 50,0±0,1 mL
ΔTÁgua = 44,5-76,1 °C = -31,6 °C ± s(ΔT)[*]
ΔTCal(1) = 44,5-28,0 °C = +16,5 °C ± s(ΔT)[*]
Ccal = -ρÁguaVÁguacÁguaΔTÁgua/ΔTCal(1)
= -(4,201 J/g°C)(9,9568 g/mL)(50,0 mL)(-31,6 °C)/ = -(+16,5 °C)
= -4.005,397 J/°C = 4,01 kJ/°C ± s(Ccal)[**]
s(ΔT) = √[(0,1 °C)²+(0,1 °C)²] = 0,1 °C
sr(Ccal) = √[(0,0022/9,9568)²+(0,1/50,0)²+(0,002/4,201)²+ = √(0,1/31,6)2+(0,1/16,5)2] = 0,007
s(Ccal) = Ccal×sr(Ccal)
= 4.005,397 J/°C × 0,007
= 28,0 J/°C → Ccal = 4.005±28 J/°C
[*] Diferença: → desvio padrão absoluto (s)
[**] Produto: → desvio padrão relativo (s r) → (s) Entalpia de Neutralização Molar:
nHCl = cHClVsol(1)
= (0,9916 mol/L)(0,050 mL) = 0,0495 mol ± s(nHCl)
nNaOH = cNaOHVsol(2)
= (0,9949 mol/L)(0,050 mL) = 0,0497 mol ± s(nNaOH)
nNeu = 0,0495 mol ± s(nNeu) [Menor valor]
ΔTCal(2) = 23,7-23,0 °C = +0,7 °C ± s(ΔT)
ΔHNeu(Exp) = -CCalΔTCal(2)/nNeu
= -(4.005 J/°C)(+0,7 °C)/(0,0495 mol) = -56,636 kJ/mol ± s(ΔHNeu)
ΔHNeu(Ref) = -57,300 kJ/mol ± 0,012[2-3]
DISCUSSÃO
A variação temporal abrupta da temperatura é devida a rápida reação de neutralização de um ácido forte e uma base forte. Por outro lado, a relativa estabilidade da temperatura por alguns minutos após a neutralização sugere que, apesar da simplicidade da montagem experimental, a mesma serve para dar um resultado aproximado para a entalpia molar da reação em estudo. O valor negativo obtido para a entalpia molar é consistente com o esperado para uma reação exotérmica como a de neutralização. (...)
Figura 1: Variação temporal da temperatura devida a reação de neutralização HCl 1,0 M + NaOH 1,0 M.[***]
(***) Este gráfico foi utilizado aqui apenas como ilustração. No entanto, neste caso
específico a sua utilização em um relatório real seria inadequada, uma vez que apenas repete os dados da Tabela 2.
ANÁLISE DE ERROS
Uma análise das diversas fontes de erro (a partir dos limites de precisão das diferentes quantidades medidas) indica que as ordens de grandezas das diferentes contribuições são bem diferentes, de modo a contribuírem em diferentes escalas para a exatidão do resultado final. Por exemplo, a incerteza nas medidas de volume (1,2 %) são muito maiores que as relativas as massas (0,0025 %). Portanto, é de se esperar que a utilização de balanças mais precisas não deve contribuir para a melhoria dos resultados experimentais. (...)
e(ΔHNeu) = |ΔHNeu(Exp)-ΔHNeu(Ref)| [Erro Absoluto (Exatidão)]
= |-56,636+57,300| kJ/mol = 0,664 kJ/mol
er(ΔHNeu) = |ΔHNeu(Exp)-ΔHNeu(Ref)|/ΔHNeu(Ref) [Erro Relativo (Exatidão)]
= (0,664)/(57,300) = 0,0116 = 1,16 %
180 200 220 240 260 280 300 320 340 360
28,0 28,1 28,2 28,3 28,4 28,5 28,6 28,7 28,8
Tempo (s)
Te
m
p
e
ra
tu
ra
(
°C
Q
UESTÕES1. Os resultados obtidos são satisfatórios?
Razoáveis, uma vez que o erro obtido para a entalpia molar de neutralização difere do valor de referência na ordem de, apenas, 1 %. (...)
R
EFERÊNCIAS1. LENNON, J.; Handbook of Chemistry and Physics, p. 321, 2001.
2. MCCARTNEY, P.; Thermochemical Experiment, J. Chem. Educ., 1(2), 34, 2002.
3. HARRISON, G.; Experimental Physical Chemistry, J. Chem. Educ., 5(6), 78, 2003.
PARTE 2
PRÁTICA N° 1:
DETERMINAÇÃO DO VOLUME MOLAR PARCIAL
O
BJETIVODeterminar experimentalmente o volume molar parcial dos componentes de uma mistura binária.
I
NTRODUÇÃOO volume molar parcial de um constituinte em uma solução binária representa a variação de volume provocada pala adição à solução de 1 mol deste constituinte, mantendo-se constante a temperatura, a presssão e o número de mols do outro constituinte. Se o aumento do volume é pequeno em relação ao volume inicial V da solução, os volumes molales parciais V1 e V2 dos constituintes
1 e 2 são dados por:
V1 =
(
∂V ∂n1)
n2,p , Te V2 =
(
∂V
∂n2
)
n1,p , T, (1)
onde n1 e n2 são os números de mols dos constituintes 1 e 2, respectivamente. O
volume total da mistura é dado por:
V = n1V1 + n2V2 . (2)
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Balão de 10 mL (Picnômetro); 05 Balões de 25 mL;
05 Béqueres de 20 mL; 01 Balança;
NaCl puro.
P
ROCEDIMENTO1. Prepare cinco soluções de cloreto de sódio dissolvendo 0,550 g, 1,027 g, 1,612 g, 3,257 g e 4,407 g em exatamente 25,0 mL de água. Mantenha os balões volumétricos fechados para evitar evaporação.
2. Pese o picnômetro vazio e seco. Coloque água destilada pura no picnômetro até a marca do menisco. Coloque a tampa, enxugue o excesso do líquido e pese novamente. Anote a pesagem.
T
RATAMENTO DED
ADOS1. Corrija as massas obtidas para o NaCl no item 1 do procedimento (massa aparente, m) para o vácuo (massa no vácuo, m(v)), utilizando a equação:
mNacl
(v) = m
Nacl×
(
1 +ρar ρNaCl −
ρar
ρref
)
, (3)com ρar = 1,22×10-3 g/mL, ρref = 8,50 g/mL e ρNaCl = 2,17 g/mL, a 25 °C.
2. Calcule o volume do picnômetro a partir da massa de água obtida no item 2 do procedimento e da densidade da água, utilizando a equação:
Vpic = mágua
ρágua
. (4)
3. Determine a molalidade e a densidade de cada uma das 5 soluções de NaCl. As molalidades (bsol, em mol/kg: dados do item 1 do procedimento)
são calculadas pela expressão:
bsol = nNaCl
mágua =
mNaCl(v)
MNaClρáguaVágua , (5)
e as densidades (ρsol, em g/mL: dados do item 3 do procedimento):
ρsol = msol
Vpic . (6)
4. Faça um gráfico de volume de solução contendo 1.000 g (mil gramas) de solvente versus molalidade da solução e obtenha a expressão do ajuste (polinomial). O volume de solução é obtido da expressão:
Vsol = msol
ρsol , msol = mágua + mNaCl, mNaCl = MNaClmáguabsol
∴ Vsol = mágua
ρsol
(
1 + MNaClbsol)
. (7)A inclinação da tangente à curva em uma dada concentração fornece diretamente o valor de VNaCl (volume molar parcial do NaCl).(*)
(*) Nota: Isto ocorre porque, para 1.000 g de solvente, a quantidade química de sal é
numericamente igual à molalidade da solução, de modo que VNaCl = ∂Vsol/∂bsol = ∂Vsol/∂nNaCl. A
inclinação é obtida da derivada da função de ajuste polinomial aos dados experimentais.
5. Determine VNaCl em várias concentrações, compare os valores e comente.
Q
UESTÕES PARA OR
ELATÓRIO1. Os valores obtidos são satisfatórios?
2. Quais as possíveis fontes de erro ou limitações neste experimento?
B
IBLIOGRAFIAPRÁTICA N° 2:
DETERMINAÇÃO DA TENSÃO SUPERFICIAL POR ASCENSÃO CAPILAR
O
BJETIVODeterminar a tensão superficial de um líquido a partir do método da ascensão capilar.
I
NTRODUÇÃOUma molécula no interior de um líquido está totalmente envolvida por outras moléculas do líquido, sendo atraída igualmente em todas as direções. Como consequência, a resultante média das forças de atração é nula. No entanto, na superfície a resultante das forças atrativas não é nula, de modo que as moléculas são puxadas para o interior do líquido, fazendo com a superfície se contraia e ocupe a menor área possível. Esta resultante de forças é a origem da
tensão superficial, que tem o mesmo valor em cada ponto da superfície.
A tensão superficial, característica de cada líquido, é uma propriedade intensiva (medida no SI em N·m-1 ou kg·m·S-2m-1). É responsável pela resistência
a penetração da superfície, a forma aproximadamente esférica de gotas de água de chuva, a flutuação de lâminas metálicas sobre superfícies líquidas e a ascensão de líquidos em capilares. Há vários métodos disponíveis para a se obter a tensão superficial de um líquido, dentre os quais se destacam a balança de torsão (método de Nouy), o passo de gota (estalagmômetro de Traube), a
pressão de bolha e a ascensão capilar.
Neste experimento será usado o método da ascensão capilar para a obtenção da tensão superficial de líquidos puros. Este método é baseado no fato de que muitos líquidos, quando postos em contacto com tubos capilares (geralmente de vidro), ascendem as paredes do tubo, apresentado uma superfície côncava dentro do capilar. Quando isto ocorre, diz-se que o líquido molha o tubo. Caso o líquido não molhe o tubo, como no caso do mercúrio, tem-se uma depressão capilar, com formação de uma superfície convexa.
Considere um capilar uniforme com raio interno r, imerso em um recipiente contendo um líquido de densidade ρ, que molha o vidro. Devido a tensão superficial o líquido ascende o capilar. A ascensão cessa quando a força devida à tensão superficial (para cima) se torna igual à força devida ao peso da coluna de líquido de altura h (para baixo). Da igualdade entre estas forças, conclui-se que a tensão superficial γ (gama) é dada por:
γ = 1
2ρg h r , (1)
onde g é a aceleração da gravidade.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Régua;
01 Suporte de ferro e garra; 01 Pisseta com água destilada;
Líquidos para estudo: Água destilada, Álcool Etílico e Acetona.
P
ROCEDIMENTOPARTE A: DETERMINAÇÃO DO RAIO DO TUBO CAPILAR
1. Meça a temperatura da água. Em seguida, introduza o tubo capilar no furo da rolha de borracha existente no tubo de ensaio. Prenda o tubo de ensaio ao suporte de ferro através de uma garra.
2. Coloque água no tubo de ensaio preso ao suporte até que o nível da água esteja ~10 cm acima do traço zero do capilar (traço de referência).
3. Adapte uma seringa plástica a extremidade superior do capilar e aspire com uma pêra de borracha até encher ~2/3 da seringa. Retire a seringa e esvazie seu conteúdo. Repita o procedimento até que todo o capilar esteja limpo, o que é evidenciado por um brilho metálico.
4. Com o capilar limpo, acrescente ou retire água do tubo de ensaio até que o nível da superfície da água coincida com o traço zero do capilar.
5. Insira água com a seringa pela parte superior do capilar até que o mesmo atinja o nível mais alto do capilar. Depois, retire suavemente a seringa e observe a descida da água através do capilar. Anote o traço do capilar que mais se aproxime do nível da água dentro do capilar.
6. Retire suavemente o capilar e, com o auxílio de uma régua, meça a altura, que vai do zero do capilar até o traço anotado no item anterior.
7. Repita o procedimento de três a cinco vezes e obtenha o valor médio da altura da ascensão capilar.(*)
(*) Alternativa: caso ocorram dificuldades de leitura da ascensão capilar a partir do
procedimento descrito acima, utilize um outro capilar e um béquer contendo o líquido de estudo, tendo o cuidado de tomar a leitura a partir da superfície do líquido no béquer até o topo da coluna de líquido no capilar.
8. Utilize a equação (1) para calcular o raio interno do capilar. Considere tabela a seguir, referente à água:
Temperatura (°C)
Densidade
(kg·m-3) Tensão γ (mN·m-1)
25 997,08 71,99
30 995,68 71,20
35 994,63 70,41
PARTE B: DETERMINAÇÃO DA TENSÃO SUPERFICIAL DE UM LÍQUIDO
T
RATAMENTO DED
ADOS1. Utilize a equação (1), com o valor médio da ascensão capilar obtido para a água na parte A, bem como os dados de densidade e tensão superficial na temperatura do experimento, para calcular o raio r do tubo capilar. Considere a aceleração da gravidade como 9,8 m·s-2.
2. Utilize a equação (1), com o raio r determinado anteriormente, bem como o valor médio da ascensão capilar determinado na parte B, para calcular a tensão superficial γ do líquido de estudo.
3. Compare os valores com os da literatura e comente.
Q
UESTÕES PARA OR
ELATÓRIO1. Os valores obtidos são satisfatórios?
2. Quais as possíveis fontes de erro ou limitações neste experimento? Para cada uma, tente dizer que efeito elas terão no resultado esperado dos experimentos.
B
IBLIOGRAFIA1. ATKINS, P.W.; Físico-Química, 7ª Ed., RJ, Ed. LTC, 2004.
PRÁTICA N° 3:
DETERMINAÇÃO DA VISCOSIDADE DE UM LÍQUIDO C/ VISCOSÍMETRO DE OSTWALD
O
BJETIVODeterminar a viscosidade relativa e a viscosidade absoluta de um líquido puro, usando um viscosímetro de Ostwald.
I
NTRODUÇÃOLíquidos e gases possuem uma propriedade conhecida como viscosidade, que pode ser concebida como a resistência ao escoamento. Esta resistência é devida ao atrito interno que surge devido ao movimento relativo de camadas adjacentes do fluído (gás ou líquido). Esta propriedade é expressa quantitativamente através de um índice chamado coeficiente de viscosidade ou simplesmente viscosidade, η (eta, medida no SI em poise ou g·cm-1s-1; lê-se
poási).
Há diversos métodos experimentais para se determinar a viscosidade de líquidos, tais como queda de esferas sólidas através de líquidos (viscosímetro de Hoppler) e escoamento através de tubos capilares (viscosímetro de Ostwald). Neste experimento, a viscosidade relativa de um líquido será encontrada através do uso de um viscosímetro de Ostwald. O princípio do método é baseado na equação de Poiseville, para o coeficiente de viscosidade absoluta de um fluído:
η = πp r
4t
8ℓ V , (1)
onde p é a pressão hidrostática exercida pelo fluido de volume V, que escoa em um tempo t através de um tubo capilar de raio interno r e comprimento ℓ.
Considerando-se um líquido de viscosidade conhecida como padrão (η1),
pode-se determinar a viscosidade de um líquido desejado (η2) a partir do tempo
de escoamento de um volume fixo de líquido através de um determinado capilar. De acordo com a equação de Poiseville, a razão entre as viscosidades dos dois líquidos (viscosidade relativa do líquido “2” em relação ao líquido “1”, η(2,1)) é
dada por:
η(2,1) =
η2
η1 =
(
πp2r4
t2
8ℓV
)(
8ℓV
πp1r 4
t1
)
= p2t2
p1t1 =
ρ2t2
ρ1t1 ⇒ η2 =
(
ρ2t2
ρ1t1
)
η1 , (2)esta última expressão sendo devida a proporcionalidade entre a pressão p e a densidade ρ dos líquidos. Portanto, conhecendo-se a viscosidade η1 de um líquido
padrão e as densidades ρ1 e ρ2 dos líquidos, a medida experimental dos tempos
de escoamento t1 e t2 de um volume fixo de líquido em um dado capilar permite
determinar a viscosidade η2 do fluido de interesse.
outro ramo é constituído por um tubo de diâmetro maior, tendo uma grande dilatação próxima a parte inferior.
Figura 1: Viscosímetro de Ostwald.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Viscosimetro de Ostwald; 01 Suporte com garra; 01 Pêra de borracha; 01 Cronômetro; 01 Termômetro 01 Pipeta; 02 Béqueres; 01 Pisseta;
Líquidos para estudo: Água destilada, Álcool Etílico e Acetona.
P
ROCEDIMENTOPARTE A: DETERMINAÇÃO DO TEMPO DE ESCOAMENTO DO PADRÃO
1. Meça a temperatura de uma amostra de água destilada. Em seguida, introduza certo volume de água destilada no ramo não-capilar do viscosímetro, de modo que o tubo fique cheio até 1/3. O nível do líquido deverá ficar abaixo da extremidade inferior do capilar, contido no outro ramo do viscosímetro.
superior. Reproduza sempre esta mesma posição em todas as medidas subsequentes.
3. Observe a descida do líquido e inicie a contagem do tempo no momento em que a superfície livre da água passe pelo traço de referência superior. Esta observação deve ser realizada colocando-se a visão no plano horizontal do traço de referência. Da mesma forma, desligar o cronômetro quando a superfície livre da água atingir o traço de referência inferior. 4. Repetir a operação 3 vezes, anotando os tempos medidos. Se o aparelho
estiver convenientemente limpo, os tempos não devem diferir de mais do que 0,2 %. Calcule a média dos tempos de escoamento. Denomine esta média de t1 para o líquido padrão.
5. Meça novamente a temperatura do líquido em estudo. Encontrar a média aritmética entre as temperaturas inicial e final. Esta será considerada a temperatura do experimento.
PARTE B: DETERMINAÇÃO DO TEMPO DE ESCOAMENTO DO LÍQUIDO DE INTERESSE
1. Repita o procedimento anterior para o líquido de interesse e obtenha o tempo de escoamento médio t2.
T
RATAMENTO DED
ADOS1. Calcule a viscosidade relativa (η(2,1)) e absoluta (η2) do líquido de interesse
a partir da equação (2), considerando os tempos de escoamento médio t1 e
t2 determinados e a tabela a seguir, referente à água:
Temperatura (°C)
Densidade
(kg·m-3) Viscosidade η (μPa·s)
25 997,08 890,3
30 995,68 797,5
35 994,63 719,5
2. Compare os valores com os da literatura e comente.
Q
UESTÕES PARA OR
ELATÓRIO1. Os valores obtidos são satisfatórios?
2. Quais as possíveis fontes de erro ou limitações neste experimento? Para cada uma, tente dizer que efeito elas terão no resultado esperado dos experimentos.
B
IBLIOGRAFIA1. ATKINS, P.W.; Físico-Química, 7ª Ed., RJ, Ed. LTC, 2004.
PRÁTICA N° 4:
DETERMINAÇÃO DO EQUILÍBRIO SÓLIDO-LÍQUIDO
O
BJETIVODeterminar a faixa de variação da temperatura de fusão para uma mistura sólida binária.
I
NTRODUÇÃOA mudança de estado sólido-líquido de uma substância pura ocorre a uma temperatura bem definida (Tf), enquanto que, em uma mistura, o início da fusão
e o seu término ocorrem a temperaturas bem diferentes, exceto em alguns casos especiais. Para construir um diagrama de fases de um sistema binário condensado, tipo naftaleno-difenilamina, é necessário determinar a temperatura inicial e final de fusão para várias misturas com composições que variem desde 0 até 100 % em cada componente.
O método experimental mais fácil e mais comum é o do capilar. Este consiste em colocar em um tubo capilar, de aproximadamente 1 mm de diâmetro, a amostra a ser estudada e imergir o tubo em um líquido, cuja temperatura é elevada lentamente. Observa-se, então, o início e o final da fusão com o auxílio de uma lupa.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Termômetro de 0-100 °C (± 0,5 °C); 02 Tubos de Thiele;
01 Chapa Elétrica Aquecedora (ou Bico de Bunsen + Tripé de Ferro); 01 Lupa;
01 Tubos capilares;
Glicerina; Naftaleno; Difenilamina.
P
ROCEDIMENTOPARTE A: MONTAGEM EXPERIMENTAL
1 2 3 4 5 6 7 8 9 10 11 Naftal. (g) 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0 Difenil. (g) 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
PARTE B: COLETA DE DADOS
1. Com auxílio de um tubo de vidro, coloque a primeira amostra em um tubo capilar, enchendo-o até a metade. Amarre-o com elástico a um termômetro e suspenda o conjunto em um tubo de Thiele contendo glicerina.
2. Com uma chama branda aqueça suavemente o tubo de Thiele na parte lateral inferior e observe a mistura dentro do capilar com auxílio de uma lupa. Anote a temperatura no início e no final da fusão.
3. Repita o procedimento com todas as misturas e com os componentes puros, de modo a completar a tabela a seguir com as temperaturas de fusão inicial Tf(i) e final Tf(f).
Amostra Naftal. (g) Difenil. (g) Tf(i) Tf(f)
1 1,0 0,0
2 0,9 0,1
3 0,8 0,2
4 0,7 0,3
5 0,6 0,4
6 0,5 0,5
7 0,4 0,6
8 0,3 0,7
9 0,2 0,8
10 0,1 0,9
11 0,0 1,0
T
RATAMENTO DED
ADOS1. Construa o diagrama de fases para este sistema plotando, em um único gráfico, Tf(i)versus %naftaleno e Tf(f)versus %naftaleno.
2. Aplique a regra das fases em cada parte do diagrama.
Q
UESTÕES PARA OR
ELATÓRIO1. Qual a temperatura eutética e qual a composição da mistura eutética? 2. Qual é o comportamento da mistura no ponto eutético.
4. Quais as possíveis fontes de erro ou limitações neste experimento? Para cada uma, tente dizer que efeito elas terão no resultado esperado dos experimentos.
B
IBLIOGRAFIAPRÁTICA N° 5:
DETERMINAÇÃO DA DISTRIBUIÇÃO DE UM SOLUTO ENTRE SOLVENTES IMISCÍVEIS
O
BJETIVODeterminar a constante de distribuição de um soluto entre solventes imiscíveis.
I
NTRODUÇÃOConsidere um sistema formado por dois componentes imiscíveis, por exemplo, água e tetracloreto de carbono (CCl4). Ao se adicionar uma terceira
substância, por exemplo, iodo, solúvel em quantidades diferentes em ambas as fases, no equilíbrio tem-se que as razões entre as atividades do iodo nas duas fases, sob temperatura constante, é constante, ou seja:
a2
a1 = K , (1)
onde K é a chamada constante de distribuição, que pode ser determinada titulando-se diretamente o iodo com tiossulfato em ambas as fases, tal que:
2 S2O32- + I
2 → S4O6
2- + 2 I
-, (2)
2 S2O32- + I 3
-→ S4O62- + 3 I
-. (3)
Neste experimento será determinada a constante de equilíbrio da reação:
KI + I2 → KI3 , (4)
utilizando-se água e tetracloreto de carbono. Este equilíbrio é possível devido ao fato de que o iodeto de potássio é solúvel apenas em água. A constante de equilíbrio da reação é dada por:
Keq =
a(I3 -) a(I-)a(I2)
≈ [I3 -] [I-][I2]
. (5)
Deste modo, conhecendo-se os valores das concentrações das espécies envolvidas no equilíbrio, pode-se estimar o valor da constante de equilíbrio.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Pipetas volumétricas de 10, 15, 20, 25, 50 e 100 mL; 02 Funis de separação de 125 mL;
01 Bureta de 50 mL; 01 Termômetro;
Amido;
Solução de Tiossulfato 0,1 N; Solução de KI 0,1N;
Tetracloreto de Carbono; Iodo;
Água destilada.
P
ROCEDIMENTO1. Prepare uma solução saturada dissolvendo 3 g de iodo em 75 mL de tetracloreto de carbono. Pegue 25 mL desta solução e coloque em um erlenmeyer de 250 mL e adicione 100 mL de água pura. Agite fortemente por dois minutos. Anote a temperatura da mistura e espere 60 minutos para que o equilíbrio seja alcançado, agitando esporadicamente. Enquanto espera execute a etapa 4.
2. Pegue 50 mL da fase aquosa e transfira-a para um erlenmeyer de 250 mL que contenha 10 mL de uma solução de KI 0,1 mol/L (para evitar perdas de iodo durante a titulação). Adicione 0,5 mL de amido e titule com tiossulfato de sódio 0,01 mol/L. Ao final da titulação a cor azul desaparece.
3. Pegue 5 mL da fase do tetracloreto de carbono e titule como anteriormente, só que, desta vez, com tiossulfato 0,1 mol/L. Execute os parágrafos 5 e 6.
4. Em um funil de separação de 250 mL prepare o item 1 ou 2 de acordo com a tabela a seguir:
Funil em CClSol. sat. I2 4 (mL)
CCl4 puro (mL)
Sol. KI 0,1M (mL)
1 25 - 100
2 15 10 100
5. Feche bem o funil e agite-o a cada 5 minutos durante 1 hora. Volte para o parágrafo 2.
6. Pegue 20 mL da fase aquosa do funil e titule com tiossulfato 0,1 mol/L, sem adicionar KI.
7. Pegue 20 mL da fase tetracloreto do funil e titule com tiossulfato 0,1 mol/L, desta vez adicionando 10 mL de solução de KI 0,1 mol/L.
T
RATAMENTO DED
ADOS2. Calcular a constante de equilíbrio Keq, de acordo com a equação (5).
3. Compare seus resultados com os da literatura e comente.
Q
UESTÕES PARA OR
ELATÓRIO1. Os valores obtidos são satisfatórios?
2. Quais as possíveis fontes de erro ou limitações neste experimento? Para cada uma, tente dizer que efeito elas terão no resultado esperado dos experimentos.
B
IBLIOGRAFIAPRÁTICA N° 6:
DETERMINAÇÃO DA SOLUBILIDADE MÚTUA DE DOIS LÍQUIDOS (SISTEMA BINÁRIO)
O
BJETIVODeterminar a solubilidade mútua de dois líquidos parcialmente miscíveis, a partir do sistema binário água-fenol.
I
NTRODUÇÃODiz-se que dois líquidos são parcialmente miscíveis quando as solubilidades mútuas são limitadas. Quando se adiciona uma pequena quantidade de fenol à água sob temperatura ambiente, este se dissolve completamente, resultando em uma única fase líquida. Entretanto, com a adição de quantidades crescentes de fenol, formam-se, em certo ponto, duas camadas líquidas, uma delas consistindo de uma pequena quantidade de água dissolvida em fenol e a outra de uma pequena quantidade de fenol dissolvida em água. O prosseguimento da adição de fenol à mistura leva, por fim, ao surgimento de uma única fase líquida, composta de água em fenol.
Sob determinada temperatura e pressão, as soluções conjugadas, formadas pelos dois líquidos, possuem composições definidas, que podem ser determinadas experimentalmente. As composições das soluções conjugadas variam com a temperatura. O comportamento mais comum de dois líquidos parcialmente miscíveis é o de se tornarem miscíveis em todas as proporções acima de certa temperatura. Esta temperatura é denominada temperatura crítica superior.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Termômetro de 0-100 °C (± 0,5 °C); 01 Béquer de 600 mL;
02 Tubos de ensaio;
02 Pipetas de 10 mL + Pera de borracha ou seringa; 01 Agitador;
Solução fenólica 80 %; Água destilada.
P
ROCEDIMENTOPARTE A: MONTAGEM EXPERIMENTAL
PARTE B: COLETA DE DADOS
1. Pipete na capela, com a pera de borracha ou a seringa, 5 mL de solução fenólica 80 % e transfira para um tubo de ensaio. Adicione 1,8 mL de água destilada de forma a obter uma mistura com 59,4 % de fenol. Esta composição não é totalmente miscível a temperatura ambiente. Aqueça a mistura lentamente, em banho de glicerina, com chama branda, até o desaparecimento da opalescência e anote a temperatura.
2. Retire a mistura do banho e deixe-a resfriar lentamente até o reaparecimento da opalescência. Anote a temperatura.
3. Repita o procedimento, acrescentando à mistura anterior as seguintes quantidades de água, uma de cada vez: 1,0; 1,4; 2,0 e 1,5 mL. A composição de cada mistura, em cada caso, em (% m/m) de fenol, é, respectivamente, 52,0; 44,2; 36,4 e 32,2 %.
4. Pegue outro tubo de ensaio e coloque 2,0 mL de solução fenólica 80 %. Acrescente 4,6 mL de água, de forma a obter uma mistura com 25,0 % em fenol e, seguindo o mesmo procedimento anterior, determine a temperatura de miscibilidade total da mistura. Em seguida, acrescente a esta 2,6 e, posteriormente, 7,7 mL de água destilada, uma quantidade de cada vez, para obter fenol a 20,0 e 10,4 %, respectivamente. Faça determinações de temperaturas de miscibilidade nos dois casos.
T
RATAMENTO DED
ADOS1. Construa um gráfico da temperatura média de miscibilidade versus
composição da mistura e, a partir do gráfico, encontre a temperatura crítica superior e a composição da mistura correspondente a esta. Compare seus resultados com os da literatura.
2. Determine a variância nas diversas regiões do diagrama (regra das fases). 3. Considere uma mistura de fenol e água com 40 % de fenol sob 50 °C.
Determine, para esta mistura, as composições das fases conjugadas e as quantidades relativas destas.
Q
UESTÕES PARA OR
ELATÓRIO1. Os valores obtidos são satisfatórios? Discuta possíveis erros observados.
B
IBLIOGRAFIAPRÁTICA N° 7:
DETERMINAÇÃO DA SOLUBILIDADE MÚTUA DE TRÊS LÍQUIDOS (SISTEMA TERNÁRIO)
O
BJETIVODeterminar a solubilidade mútua de três líquidos parcialmente miscíveis, a partir do sistema ternário água-clorofórmio-ácido acético.
I
NTRODUÇÃODiagrama de fases ou diagrama de equilíbrio é um diagrama que ilustra o equilíbrio entre várias fases de substâncias constituintes de um sistema. Define-se fase como sendo qualquer parte fisicamente distinta e homogênea de um sistema, separada das outras partes do sistema por superfícies definidas.
A regra das fases estabelece a relação entre os números de graus de liberdade (F), componentes (C) e fases (P) do sistema em equilíbrio:
F = C − P + 2 . (1)
Para sistemas de três componentes (C = 3) é possível se ter 4 graus de liberdade (F = 4), pois temperatura, pressão e concentrações de dois componentes podem variar independentemente. Visando a simplificação da representação gráfica das condições de equilíbrio para três componentes, o procedimento usual consiste em se manter o sistema sob temperatura constante (de modo que se eliminar um grau de liberdade) e representar os 3 graus restantes em um diagrama triangular equilátero (de lado é normalizado, de modo a representar a composição do sistema em frações molares, segundo a figura 1). Este diagrama possui uma importante propriedade: a soma das distâncias de um ponto no interior de um triângulo equilátero é igual a seu lado. Este fato é explorado para satisfazer a condição de que a soma das frações molares dos componentes de qualquer mistura é igual a 1.
(1) Vértices representam substâncias puras A, B, e C. (2) Lados representam sistemas binários AB, AC e BC. (3) Pontos internos representam sistemas ternários ABC. (4) A soma dos segmentos a, b e c é igual a 1.
Figura 1: Representação de um diagrama ternário.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES09 Erlenmeyers de 150 mL providos de tampas; 09 Pipetas de 10 mL e 20 mL;
Ácido Acético Glacial (99,5%); Clorofórmio;
Água destilada.
P
ROCEDIMENTOPARTE A: MONTAGEM EXPERIMENTAL
1. Coloque em cada um dos erlenmeyers as seguintes quantidades:
1 2 3 4 5 6 7 8 9
Água (mL)
1
3
6
8
10
12
15
18
19
Clorofórmio (mL)
19
17
14
12
10
8
5
2
1
PARTE B: COLETA DE DADOS
1. Encha a bureta com ácido acético glacial e determine quanto deste deve ser adicionado a cada um dos erlenmeyres para que a turbidez seja completamente eliminada. Durante a adição de ácido acético, os erlenmeyeres devem ser vigorosamente agitados.
T
RATAMENTO DED
ADOS1. Calcule a composição de cada solução nos pontos em que a turbidez desaparece, em percentagem em massa ou em percentagem molar. (Densidades: clorofórmio = 1,48 g/mL; ácido acético = 1,05 g/mL)
2. A partir destes dados construa o diagrama ternário, unindo os pontos obtidos para obter a linha de solubilidade da mistura para a temperatura em que o experimento foi realizado.
3. Identifique cada uma das regiões do diagrama e informe como a solução se comporta nesta região.
Q
UESTÕES PARA OR
ELATÓRIO1. Os valores obtidos são satisfatórios? Discuta possíveis erros observados.
B
IBLIOGRAFIAPRÁTICA N° 8:
DETERMINAÇÃO DA CONDUTIVIDADE MOLAR DE ELETRÓLITOS FORTES E FRACOS
O
BJETIVODeterminar a condutividade molar de solução de eletrólitos fortes e fracos pela técnica de condutivimetria.
I
NTRODUÇÃOUma corrente elétrica pode ser conduzida tanto por elétrons (em condutores metálicos) como por íons (em condutores iônicos e soluções eletrolíticas). A condutância (G, medida em siemens, S) é definida como o inverso da resistência (R, medida em ohms, Ω). Verifica-se experimentalmente que a condutância de uma amostra é proporcional a área da seção transversal (A, medida em metro-quadrado, m2) e inversamente proporcional ao seu
comprimento (ℓ, medido metro, m), a constante de proporcionalidade sendo denominada condutividade (κ, medida em siemens por metro, S·m-1):
G = κ⋅A
ℓ =
κ
K , com: K = ℓ
A , (1)
onde K é a constante de cela (medida em m-1; esta constante é característica da
célula eletrolítica onde se faz a medida e deve ser informada pelo fabricante do equipamento, denominado condutivímetro).
A condutividade κ de uma solução é proporcional a concentração do íon, a magnitude de sua carga e a mobilidade deste. Deste modo, é conveniente só comparar a condutividade de soluções que contenham o mesmo número de cargas. Esta condição é satisfeita definindo-se a condutividade molar ou
condutividade equivalente (Λ , medida em siemens metro quadrado por mol, S·m2mol-1), obtida dividindo-se a condutividade pela concentração da solução:
Λ = κ
c , (2)
onde c é a concentração da solução (em equivalente por litro). A condutividade molar aumenta com a diluição da solução e alcança um valor máximo à diluição infinita, denominada condutividade molar a diluição infinita (Λ0). Para soluções
diluídas de eletrólitos fortes, vale a relação de Kolhrausch:
Λ = Λ0 − kcc½ , (3)
onde kc é uma constante determinada experimentalmente (e que depende mais da proporção entre cátions e ânions por fórmula unitária do eletrólito do que da identidade do eletrólito). Esta relação pode ser usada para a determinação experimental de Λ0.
M
ATERIAIS: E
QUIPAMENTOS& R
EAGENTES01 Pipetas volumétricas de 20 mL, 10 mL, 5 mL; 01 Pipeta graduada de 5 mL;
01 Béquer de 25 mL; 01 Condutivímetro;
Solução de KCl 0,100 mol/L.
P
ROCEDIMENTOPARTE A: DETERMINAÇÃO DA CONDUTIVIDADE DE UM ELETRÓLITO FORTE
1. Ligue o condutivímetro e espere cerca de 1 hora; 2. Prepare 200 mL de uma solução de KCl 0,1 mol/L.
3. Prepare, por diluição, 50 mL das seguintes soluções de KCl: 0,10; 0,02; 0,01; 0,005; 0,002; 0,001; 0,0005 e 0,0002 mol/L.
4. Verifique a constante de célula do aparelho, utilizando o KCl 0,10 mol/L (condutividade: κ = 12,856 mmho/cm, a 25 °C).
5. Meça a condutividade de cada uma das soluções, começando com a mais diluída e finalizando com a mais concentrada. Lave a célula duas vezes com água destilada e uma vez com a solução em estudo antes de cada determinação.
PARTE B: DETERMINAÇÃO DA CONDUTIVIDADE DE UM ELETRÓLITO FRACO
1. Prepare 200 mL de uma solução de ácido acético 0,1 mol/L.
2. Prepare, por diluição, 50 mL das seguintes soluções de ácido acético: 0,05; 0,025; 0,0125; 0,005; 0,0025; 0,00125 e 0,0005 mol/L.
3. Repita o procedimento de medida da condutividade de cada uma das soluções, da mais diluída e para a mais concentrada (item 5 da parte A).
T
RATAMENTO DED
ADOS1. Calcule, para cada concentração de KCl, a condutividade molar e construa um gráfico de Λversus c1/2. Faça uma regressão linear e determine o valor
de Λ0 para o KCl.
2. Calcule, para cada concentração de ácido acético, a condutividade molar e construa um gráfico de Λ versusc1/2. Faça uma regressão linear e compare
este gráfico com o obtido para o KCl e comente.
3. Calcule o grau de dissociação α e a constante de dissociação do ácido Ka
para cada solução de ácido acético.
4. Compare os valores com os da literatura e comente.
Q
UESTÕES PARA OR
ELATÓRIO2. Sugira uma maneira de calcular a condutância equivalente à diluição infinita para o ácido acético.
3. Os valores obtidos são satisfatórios?
4. Quais as possíveis fontes de erro ou limitações neste experimento? Para cada uma, tente dizer que efeito elas terão no resultado esperado dos experimentos.
B
IBLIOGRAFIA1. ATKINS, P.W.; Físico-Química, 7ª Ed., RJ, Ed. LTC, 2004.