82
ESTUDO DA DEGRADAÇÃO DE DIPIRONA SÓDICA
COMERCIAL POR MEIO DE LUZ ULTRAVIOLETA E
VISÍVEL.
DEGRADATION STUDY OF COMMERCIAL SODIC
DIPYRONE THROUGH THE ULTRAVIOLET LIGHT AND
VISIBLE LIGHT.
ESTUDIO DE LA DEGRADACIÓN DE DIPIRONA SÓDICA
COMERCIAL POR MEDIO DE LUZ ULTRAVIOLETA Y
VISIBLE.
Guilherme Isquibola1
Emanuel Carlos Rodrigues2
Resumo: A dipirona sódica é um dos fármacos analgésico e antitérmico mais vendido no Brasil. Diante dessa realidade, pode ocorrer o descarte inadequado do medicamento que ficou fora do prazo de validade ou não foi utilizado, em lixos ou esgoto domésticos, o que pode comprometer os recursos naturais. O uso de luz ultravioleta e visível (UV/Vis) pode promover a degradação da molécula de dipirona sódica. Este trabalho teve como objetivo irradiar soluções aquosas de dipirona sódica comercial com luz UV/Vis em diferentes condições de potencial hidrogeniônico (pH) e verificar a degradação do fármaco.
Palavras-chave: Fármaco. Dipirona. Fotólise. Luz UV/Vis.
Abstract: Sodium dipyrone is one of the most widely used antipyretic and analgesic drugs in Brazil. An inappropriate disposal of the unused or out-of-date drug may occur in domestic waste or sewage, which can compromise natural resources. The use of ultraviolet and visible light (UV / Vis) can promote the photolysis of the molecule, leading to the formation of possible photoproducts less impacting to the environment. The objective of the present work was to irradiate aqueous solutions of commercial sodium dipyrone with ultraviolet and visible light under different conditions of hydrogenation potential (pH) and to verify the degradation of the drug. Keywords: Drug. Dipyrone. Photolysis. UV/Vis light.
Resumen: La dipirona sódica es uno de los fármacos con acción antipirética y analgésica más vendidos en Brasil. Ante esta realidad, puede ocurrir el descarte inadecuado del medicamento que no ha sido utilizado o que ha quedado fuera del plazo de validez. El uso de luz ultravioleta y visible (UV / Vis) puede promover la fotolisis de la molécula, llevando la formación de posibles foto productos menos impactantes al medio ambiente. El trabajo aquí descrito tuvo como objetivo irradiar soluciones acuosas de dipirona sódica comercial con luz UV/Vis en diferentes condiciones de potencial hidrogeniónico (pH) y verificar la degradación del fármaco.
Palabras clave: Fármaco. Dipirona. Fotólisis. Luz UV / Vis.
Envio 28/03/2019 Revisão 28/03/2019 Aceite 14/08/2019
1 Graduando em Licenciatura em Química. Instituto Federal de Educação, Ciência e Tecnologia de São Paulo,
Campus Barretos. E-mail: guilherme_isquibola@hotmail.com.
2 Doutor de Química. Instituto Federal de Educação, Ciência e Tecnologia de São Paulo, Campus Barretos.
83
IntroduçãoA dipirona sódica (também conhecida como metamizol) trata-se de um pó branco e inodoro, solúvel em água e metanol. Possui a fórmula molecular C13H16N3NaO4S.H2O e massa
molar de 351,37 g mol-1 (Brasil A, 2010). Sua estrutura molecular está representada na figura
1:
Figura 1 – Fórmula estrutural da dipirona sódica.
Fonte: Pereira et al., 2002.
A dipirona é o princípio ativo dos medicamentos analgésicos mais utilizados no Brasil, indicada especialmente para o alívio de dores de cabeça, além de ser muito utilizada como antipirético. Cerca de 80% das vendas são realizadas sem prescrições médica, sendo comercializada principalmente na sua forma sódica (Fragoso et al., 1998; Marcolino JR; Bonifácio; Fatibello Filho, 2005; Nascimento, 2005; Pitarello et al., 2005).
O uso terapêutico da dipirona sódica foi proibido em alguns países, incluindo os Estados Unidos da América (EUA), devido a sua associação à agranulocitose, uma rara doença que causa a diminuição dos glóbulos brancos, além de supostamente causar anemia aplástica (Diogo, 2003). Nesse contexto, a Agência Nacional de Vigilância Sanitária (ANVISA) organizou um painel de debates com cientistas nacionais e internacionais, para liberar a comercialização da dipirona no Brasil (Benseñor, 2001).
A ANVISA apresenta em seus estudos que a indústria farmacêutica brasileira obteve nos últimos anos um faturamento na ordem de 70 bilhões de reais anuais com a venda de medicamentos (Anvisa, 2018). Com bases nesses números sobre as vendas de fármacos,
pode-84
se levantar a hipótese de que provavelmente uma parcela desses medicamentos podem não tersido utilizados devido à melhoria dos sintomas ou por terem chegado ao limite do prazo de validade.
Quando o medicamento é descartado de maneira inadequada, ele pode apresentar compostos resistentes à decomposição, colocando em risco a saúde humana e os recursos ambientais, tais como o solo e as águas. O sistema de tratamento de esgoto ainda não está totalmente preparado para a remoção de tais medicamentos, bem como os seus metabólitos, comprometendo ecossistemas aquáticos (Hoppe, 2012; Lameira, 2012; Aquino, Brandt, Chernicharo, 2013).
O descarte inadequado de medicamentos ocorre principalmente pela desinformação do consumidor, que pode dispor o mesmo em lixos comuns ou em vasos sanitários, podendo contaminar o meio ambiente. Essa disposição errada pode ser intensificada pela aquisição de quantidades maiores que a necessária, pela prática de distribuição de amostras grátis, bem como do manejo indevido de medicamentos por parte dos estabelecimentos de saúde (Eickhoff; Heineck; Seixas, 2009; Gasparini; Gasparini; Frigieri, 2011; Hoppe, 2012).
Em 2010, foi publicado o decreto presidencial nº 7.404, que regulamenta a lei no 12.305,
colocando em prática a chamada “logística reversa”, um conjunto de ações que visam a restituição de resíduos sólidos pelos comerciantes e consumidores ao setor industrial visando o seu reaproveitamento ou a destinação final ambientalmente adequada (Brasil B, 2010; Alvarenga; Nicoletti, 2010). A legislação também apresenta que é dever do governo federal a inspeção das empresas farmacêuticas para verificar o gerenciamento correto de seus resíduos, porém, ainda não há preocupação efetiva com o consumidor final para a realização do descarte correto (Anvisa, 2003; Mazzer; Cavalcanti, 2004; Ueda et al., 2009; João, 2011).
Uma das formas de eliminar os resíduos sólidos é a incineração, processo no qual os mesmos são queimados na presença do ar. Entretanto, o investimento elevado para a construção de incineradores e a liberação de gases tóxicos durante o processo, tais como as dioxinas, impede a popularização desse processo (Focant; Pauw, 1999; Ueda et al., 2009).
O sistema de tratamento de esgoto não possui capacidade de eliminar totalmente todas as substâncias presentes no meio aquoso, entre as quais pode-se destacar os fármacos tais como a dipirona sódica, surgindo assim a necessidade do estudo de novas formas de tratamento desses
85
meios. Assim, a problemática do descarte indevido de resíduos, em especial no esgoto comum,acelerou a busca por processos de degradação, em especial os processos oxidativos avançados (POAs) de substâncias em solução aquosa tais como o de Fenton e Foto-Fenton. Nesses são utilizados íons metálicos e peróxido de hidrogênio (H2O2) junto com o substrato, no qual são
gerados radicais hidroxila (HO•), espécie muito reativa e pouco seletiva, que participa da oxidação de diversos compostos orgânicos. (Feng et. al., 2003; Melo et al., 2009).
Uma alternativa para a degradação de substâncias em solução aquosa é a utilização de luz ultravioleta e visível (UV/Vis) para favorecer a quebra das ligações químicas (fotólise), levando a degradação de moléculas (Moriwaki et al., 2001). Quando uma molécula é irradiada pela luz UV/Vis, ocorre vibrações moleculares e saltos dos elétrons de níveis de energia mais baixos para outros mais elevados. No que se refere à dipirona e seus metabólitos, a região do espectro entre 200 e 400 nm é a que apresenta maior absorbância, incluindo quatro comprimentos de onda (λ) característicos de diferentes transições eletrônicas (Habekost, 2018): • λ1 (208 nm): transição dos elétrons não ligantes para orbital molecular sigma antiligante
(n σ*);
• λ2(220 nm), λ3(230 nm) e λ4(263 nm): transições dos elétrons de orbitais moleculares
pi ligantes para orbitais pi antiligantes (π π*).
Cabe destacar que a dipirona é facilmente hidrolisada ao seu principal metabólito em solução aquosa, o 4-metilaminoantipirina (4-MAA), e a fotólise desse pode gerar outros compostos com menor massa molecular e de difícil degradação natural, tais como o N-acetil-4aminoantipirina (AAA) e o N-formil-4-aminoantipirina (FAA), visto que os mesmos podem ser encontrados em concentrações significativamente altas em águas residuais e de estações de tratamento de esgoto. Quando os metabólitos são degradados, temos como possíveis fotoproduto os ácidos carboxílicos, dentre esses, os mais comuns, no processo foto-Fenton, são os derivados do acetato, formiato e oxalato. A fotólise do anel aromático da dipirona e do 4-MAA gera alguns compostos alifáticos (ácidos orgânicos e compostos hidroxilados). A degradação de compostos orgânicos como a dipirona pode ser observada não só apenas pela concentração do fármaco em solução, mas também pela mineralização onde temos a liberação de compostos e íons inorgânicos tais como CO2, Cl-, SO42-, NO3-, PO43-, entre outros. Como
86
consequência do processo de mineralização, tem-se o aumento dos íons hidrogênio (H+) poralgumas espécies anteriormente citadas, podendo levar a variações do pH da solução (Estrada, 2008; Malato et al., 2009). A figura 2 apresenta a fórmula estrutural do 4-metilaminoantipirina. Figura 2 - Fórmula estrutural do 4-metilaminoantipirina.
Fonte: (Habekost, 2018).
Dentro desse contexto, o presente trabalho teve como objetivo verificar a ação da luz ultravioleta e visível (UV/Vis) em soluções aquosas de dipirona sódica comercial proveniente de medicamentos genéricos e de referência.
Metodologia
As amostras dos medicamentos, na forma de comprimidos contendo 500 mg de dipirona sódica foram adquiridas em farmácias do município de Barretos-SP. As mesmas foram analisadas em triplicata (3 comprimidos de um mesmo lote), em diferentes faixas de potencial hidrogeniônico (pH=1; pH=7 e pH=10), com o intuito de verificar o seu efeito no processo de degradação. As amostras foram primeiramente solubilizadas em 25 mL de ácido clorídrico (HCl) 0,1 mol.L-1. Após a total solubilização das amostras, essas foram submetidas a filtração
comum para eliminar o excesso de excipiente, e o conteúdo posteriormente transferido a balões volumétricos de 25 mL e seus volumes foram completados com água deionizada. Desses balões foram retiradas alíquotas de 20 µL, e transferidas para outros balões volumétricos de 25 mL, com ajuste de pH utilizando soluções padronizadas de ácido clorídrico (HCl) 0,1 mol.L-1 e
hidróxido de sódio (NaOH) 0,1 mol.L-1 (BRASIL A.).
As amostras foram transferidas para béqueres de boca larga e expostas sobre ação de duas lâmpadas germicidas de luz ultravioleta visível (UV/Vis), em ambiente aberto para a
87
incidência de luz visível. O tempo total de exposição foi de duas horas, com leituras deabsorbância nos tempos zero, 60 e 120 minutos de exposição em espectrofotômetro Thermo Genesys 10s, de 190 a 1100 nm. Os dados obtidos com a varredura foram posteriormente transformados em gráficos por meio do software Excel. Os valores de concentração do fármaco analisado foram obtidos através da curva analítica utilizando reagente dipirona sódica padrão (Aldrich), com faixa de concentração de 0 a 30 mg.L-1 e leitura de absorbância em 258 nm,
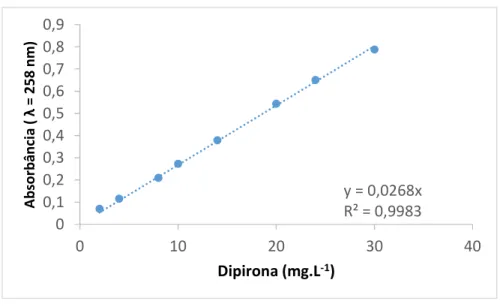
conforme descrito na Farmacopéia brasileira, (BRASIL A, 2010). O cálculo de concentração foi realizado utilizando a equação (1), onde C trata-se do valor de concentração e é expresso em mg.L-1. A figura 3 representa a curva analítica da dipirona sódica padrão.
Abs=0,0268.C (1)
Figura 3 - Curva de calibração da dipirona sódica (λ = 258 nm).
Fonte: arquivo pessoal
Resultados e Discussão
As amostras foram inicialmente analisadas em meio ácido, com pH=1, conforme a metodologia de doseamento de princípio ativo da Farmacopeia Brasileira (Brasil A, 2010). A figura 4 apresenta o gráfico de absorbância em função do comprimento de onda (espectro de absorção) para amostra de dipirona presente em comprimido de fármaco genérico (G1).
Podem-y = 0,0268x R² = 0,9983 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 10 20 30 40 A bsorb ânci a ( λ = 2 58 nm) Dipirona (mg.L-1)
88
se observar diversas regiões de absorção de 200 nm a 400 nm, evidenciando o comprimento deabsorção específico da dipirona, 258 nm.
Figura 4 - gráfico de absorbância x comprimento de onda do medicamento genérico 1 em meio ácido.
Fonte: Arquivo pessoal.
Os valores de concentração de dipirona sódica, inicial e após a incidência de luz UV/Vis, para as amostras de comprimidos de medicamento genérico em meio ácido são apresentados na tabela 1. As concentrações foram calculadas por meio da curva de calibração, com leitura em 258 nm.
Tabela 1 - concentração de dipirona sódica das amostras de medicamento de genérico em função do tempo em meio ácido (pH=1).
Comprimidos C 0h (mg.L-1) C 1h (mg.L-1) C 2h (mg.L-1)
G1 17,08 10,33 8,91
G2 16,86 10,00 8,05
89
Pode-se observar que houve diminuição da concentração da dipirona sódica nassoluções dos comprimidos do fármaco durante o tempo de exposição à luz UV/Vis. Assim, foram obtidas as seguintes porcentagens de degradação do: 47,83% (G1); 52,25% (G2) e 51,00 % (G3), resultando em uma média total de 50,36% de fármaco degradado em meio ácido.
O medicamento comercial de referência foi analisado na mesma condição inicial. A figura 5 apresenta o espectro de absorção do medicamento de referência (R1) com absorbância característica da dipirona de 200 a 400 nm.
Figura 5 - gráfico de absorbância x comprimento de onda do medicamento referência 1 (R1) em meio ácido (pH=1).
Fonte: Arquivo pessoal.
A tabela 2 apresenta a concentração inicial e após a exposição à luz das amostras de dipirona comercial de referência.
Tabela 2 - concentração das amostras de medicamento de referência em função do tempo em meio ácido (pH=1).
Comprimidos C 0h (mg.L-1) C 1h (mg.L-1) C 2h (mg.L-1)
R1 13,40 7,94 6,71
R2 13,20 7,64 6,60
90
Assim como nas amostras do medicamento genérico, a exposição das soluções frente àluz UV/Vis proporcionou a diminuição das absorbâncias, e consequentemente das concentrações de dipirona sódica. Na amostra 1, obteve-se 49,93% de dipirona degradada, 50,00% na amostra 2 e 52,90% na amostra 3, garantindo uma média final de 50,94% de dipirona sódica degradada do medicamento referência em meio ácido.
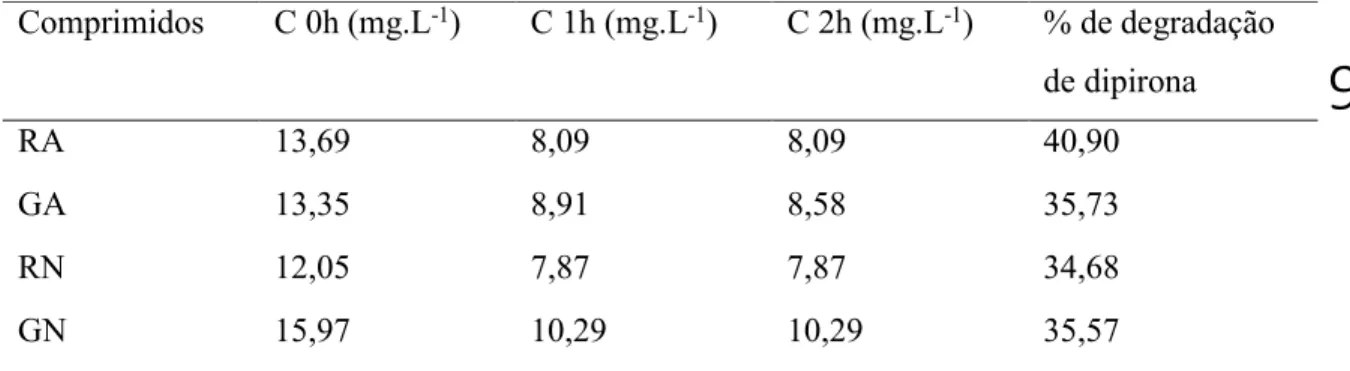
Nos que diz respeito aos comprimidos analisados em meio alcalino, com soluções ajustadas para pH igual a 10, e em meio neutro os resultados foram pouco satisfatórios quando comparados aos de meio ácido. A tabela 3 apresenta os dados de concentração inicial e em função do tempo de exposição à luz UV/Vis, bem como a % de degradação de dipirona.
Tabela 3 - concentração das amostras de medicamento de referência (RA) e genérico (GA) em função do tempo e meios alcalino e neutro.
Comprimidos C 0h (mg.L-1) C 1h (mg.L-1) C 2h (mg.L-1) % de degradação de dipirona RA 13,69 8,09 8,09 40,90 GA 13,35 8,91 8,58 35,73 RN 12,05 7,87 7,87 34,68 GN 15,97 10,29 10,29 35,57
Onde RA representa o fármaco de referência e GA os medicamentos genéricos em meio alcalino, e sendo RN para a formulação referência e GN para o comprimido genérico em solução ajustada para pH neutro (pH=7).
Os melhores resultados obtidos para as soluções preparadas em meio ácido está em consonância com o proposto pela Farmacopeia Brasileira (BRASIL A, 2010) que indica a solubilização das amostras para algumas análises de dipirona sódica em meio com ácido clorídrico a 0,1 mol.L-1.
Uma vez que a dipirona sódica em solução é facilmente hidrolisada ao seu metabólito principal, o 4-metilaminoantipirina (4-MAA), foi realizada a verificação da absorbância para essa substância, em um comprimento de onda específico de 254 nm, conforme apresenta a
91
literatura (Estrada, 2008). A tabela 4 apresenta os valores de absorbância para o 4-MAA emmeio ácido (pH=1).
Tabela 4 - absorbâncias iniciais e após a exposição à luz UV/Vis do 4-metilaminoantipirina (4-MAA) para os medicamentos de referência (R) e genérico (G) em meio ácido (pH=1).
Amostras Abs 0h Abs 1h Abs 2h Porcentagem de
diminuição de absorbância (%) R1MAA 0,350 0,219 0,180 48,57 R2MAA 0,343 0,211 0,174 49,27 R3MAA 0,358 0,220 0,173 51,68 G1MAA 0,444 0,285 0,237 46,62 G2MAA 0,452 0,279 0,215 52,43 G3MAA 0,340 0,215 0,169 50,29
Os dados obtidos permitem observar que houve diminuição média dos valores da absorbância na ordem de 49,84% para os medicamentos de referência e de 49,78% para as formulações genéricas. Isso indica que o processo de fotólise aconteceu para a amostra como um todo, incluindo também o seu principal metabólito. Cabe ressaltar que após 1 hora de luz, houve o decréscimo das absorbâncias de 4-MAA (em 254 nm) em todas as amostras e que as absorbâncias desse metabólito foram maiores que as da dipirona sódica (em 258 nm).
Conclusão
As análises permitiram evidenciar a diminuição da absorbância em 258 nm, o comprimento de onda característico da dipirona sódica, e consequentemente de sua concentração, com a média de degradação de 50,94% (genérico) e 50,36% (referência). Conclui-se também que em soluções alcalinas e neutras, o processo degradativo ocorre, porém, em menores proporções quando comparado às soluções analisadas em meio ácido. O experimento evidenciou a
92
formação do principal metabólito da dipirona sódica devido a sua hidrólise em solução aquosa,o 4-metilaminoantipirina (4-MAA). Foi possível verificar que a aplicação da luz UV/Vis nas soluções das diferentes amostras também proporcionou a diminuição da absorbância específica do 4-MAA, em 254 nm, indicando uma possível degradação para essa substância. Não foi possível degradar totalmente o fármaco utilizando apenas a fotólise com luz UV/Vis, sugerindo a busca por novas metodologias capazes de degradar o medicamento por completo.
Referências
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Resolução nº 33 de 25 de fevereiro de 2003. Dispõe sobre o Regulamento Técnico para o gerenciamento de resíduos de serviços de saúde. Brasília: ANVISA, 2003.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Anuário estatístico do mercado farmacêutico 2017. Brasília: ANVISA, 2018.
AQUINO, S. F.; BRANDT, E. M. F.; CHERNICHARO, C. A. L. Remoção de fármacos e
desreguladores endócrinos em estações de tratamento de esgoto: revisão da literatura. Engenharia Sanitária e ambiental. v. 18, n. 3, 2013.
ALVARENGA, L. S. V.; NICOLETTI, M. A. Descarte doméstico de medicamentos e algumas considerações sobre o impacto ambiental decorrente. Revista Saúde. Guarulhos, v. 4, n. 3, p. 34-39, 2010.
BENSEÑOR, I. M. To use or not to use dipyrone? Or maybe, Central Station versus ER? That is the question… São Paulo Medical Journal. v. 119, n. 6, 2001.
BRASIL A. Farmacopeia Brasileira. Brasília: Fundação Oswaldo Cruz, v.2, 5.ed., p. 912-913, 2010. BRASIL B. Casa Civil. Subchefia para Assuntos Jurídicos. Decreto nº 7404 de 23 dezembro de 2010. Regulamenta a Lei no 12.305, de 2 de agosto de 2010, que institui a Política Nacional de Resíduos Sólidos, cria o Comitê Interministerial da Política Nacional de Resíduos Sólidos e o Comitê Orientador para a Implantação dos Sistemas de Logística Reversa, e dá outras providências. Brasília, DF: 2010.
DIOGO, A. N. M. Dipirona: Segurança do uso e monitoramento da qualidade de comprimidos orais. 2003. 61 f. Dissertação (Pós-graduação em vigilância sanitária). Fundação Oswaldo Cruz, Rio de Janeiro, 2003.
EICKHOFF, P.; HEINECK, I.; SEIXAS, L. J. Gerenciamento e destinação final de medicamentos: uma discussão sobre o problema. Revista Brasileira de Farmácia. v. 90, n.1, p. 64-68, 2009. ESTRADA, L. A. P. Degradación fotoquímica de contaminantes emergentes mediante procesos solares. Evaluación analítica. 2008, 222f. Tese (doutorado em Ciências Químicas) – Universidad de Almería, Espanha, 2008.
FENG, J.; HU, X.; YUE, P. L.; ZHU, H. Y.; LU, G. Q. Discoloration and mineralization of Reactive Red HE-3B by heterogeneous photo-Fenton reaction. Water Research. v. 37, 2003.
93
FRAGOSO, Y. D.; FONSECA, P. L.; FORTINGUERRA, M. B.; COMINATO, L.; MATTE, G. O.;OLIVEIRA, C. M. Management of primary headache in emergency services of Santos and surrounding towns. São Paulo Medical Journal, v. 2, n. 116, 1998.
GASPARINI, J. C.; GASPARINI, A. R.; FRIGIERI, M. C. Estudo do descarte de medicamentos e consciência ambiental no município de Catanduva-SP. Ciência & Tecnologia: FATEC-JB, v.2, n. 1, p. 38-51, 2011.
HABEKOST, A. The Analgesic Metamizole (Dipyrone) and Its Related Products Antipyrine, 4-Aminoantipyrine and 4-Methylaminoantipyrine. Part 1: Mass Spectrometric and Electrochemical Detection. World Journal of Chemical Education, v. 6, n. 3, p. 134-144, 2018.
HOPPE, T.R.G.; ARAÚJO, L. E. B. Contaminação do meio ambiente pelo descarte inadequado de medicamentos vencidos ou não utilizados. Monografias Ambientais, v.6, n.6, 2012.
JOÃO, W. S. J. Descarte de medicamentos. Pharmacia Brasileira, n.82, 2011.
LAMEIRA, V. Estudo dos efeitos ecotoxicológicos dos fármacos paracetamol e dipirona sódica para organismos aquáticos. 2012, 266f. Tese (doutorado em Ciências na área de tecnologia nuclear) – Autarquia Associada a Universidade de São Paulo, 2012.
MALATO, S.; FERNÁNDEZ-IBÁÑEZ, P.; MALDONADO, M. I.; BLANCO, J.; GERNJAK, W. Decontamination and disinfection of water by solar photocatalysis: Recent overview and trends. Catalysis Today. v.149, p. 1-59, 2009.
MARCOLINO JR, L. H.; BONIFÁCIO, V. G.; FATIBELLO FILHO, O. Determinação turbidimétrica de dipirona em fluxo utilizando um reator contendo cloreto de prata imobilizado em resina poliéster. Química Nova. Brasil, v. 28, n. 5, 2005.
MAZZER, C.; CAVALCANTI, O. A. Introdução à gestão ambiental de resíduos. Infarma. v.16, n. 11-12, 2004.
MELO, S. A. S.; TROVÓ, A. G.; BAUTITZ, I. R.; NOGUEIRA, R. F. P. Degradação de fármacos residuais por processos oxidativos avançados. Química nova. v. 32, n. 1, p. 188-197, 2009. MORIWAKI, C.; BRESCANSIN, E. G.; HIOKA, N.; MAIONCHI, F.; MATIOLI, G. Estudo da degradação do fármaco Nabumetona por fotólise direta. Acta Scientiarum. Maringá, v. 23, n. 3, p. 651-654, 2001.
NASCIMENTO, A. P. Desenvolvimento e validação de metodologia para medicamentos contendo dipirona sódica e cloridrato de papaverina isolados e em associação. 2005. 155 f. Tese (Doutorado em Ciências Farmacêuticas) – Universidade de São Paulo, São Paulo, 2005.
PEREIRA, A. V.; PENCKOWSKI, L.; VOSGERAU, M.; SASSÁ, M. F. Determinação
espectrofotométrica de dipirona em produtos farmacêuticos por injeção em fluxo pela geração de íons triiodeto. Química Nova. Brasil, v. 25, n. 4, p. 553-557, 2002.
PITARELLO, A. P.; LINDINO, C. A.; SILVA, C.; FERRI, E. A. V.; SOUZA, M. L.; BARICCATTI, R. A. Estudo fotoquímico da dipirona na presença de β e γ ciclodextrina. Acta Scientiarum. Health Sciences. v. 27, n. 2, 2005.
UEDA, J.; TAVERNARO, R.; MAROSTEGA, V.; PAVAN, W. Impacto ambiental do descarte de fármacos e estudo da conscientização da população a respeito do problema. Revista ciências do ambiente on-line. v. 5, n. 1, 2009.