Síntese de polieletrólito híbrido condutor de íons Li
+para
aplicação em dispositivos eletrocrômicos
Synthesis of a lithium-ion conductive hybrid polyelectrolyte to
be applied in electrochromic devices
Victoria Castagna Ferrari
Flavio Leandro Souza, flavio.souza@ufabc.edu.br
Universidade Federal do ABC, Santo André, São Paulo
Submetido em 01/03/2017 Revisado em 01/03/2017 Aprovado em 02/05/2017
Resumo: O desenvolvimento de eletrólitos sólidos poliméricos tem permitido aumentar a segurança, redução do tamanho e a criação de diferentes formas de dispositivos eletrocrômicos e de baterias. Neste contexto, foram desenvolvidos eletrólitos sólidos híbridos capazes de conduzir íons de lítio com maior eficiência. Os polieletrólitos foram preparados por uma rota química simples de cadeia polimérica constituída de sílicio ou germânio como átomos centrais. Pelas análises de FTIR (Espectroscopia no Infravermelho por Transformada de Fourier) e FT-Raman (Espectroscopia Raman por Transformada de Fourier), foram monitorados os processos de formação e polimerização do citrato metálico, comprovando a formação da cadeia polimérica. Além disso, foi possível identificar que o ion de lítio no espectro de infravermelho está localizado na região entre 1020 e 1080cm-1, que corresponde à vibração de estiramento
O-C-C. Os resultados de DSC (Calorimetria Diferencial de Varredura) ilustraram um único valor de temperatura de transição vítrea de aproximadamente -29°C para o polieletrólito constituído de germânio, o que confere ao material a característica de amorfo em temperatura ambiente, favorecendo a condutividade iônica. Portanto, o material desenvolvido com essas características é considerado um polieletrólito híbrido de fase única (do inglês Single Phase Hybrid Polyelectrolyte – SPHP), o qual possui seu mecanismo de transferência de carga governado por “hopping”, ou seja, o íon se movimenta na cadeia polimérica independentemente do movimento da mesma. Sendo assim, os resultados indicaram que este material é bastante promissor para conduzir íons como Li+ e Na+ de forma rápida.
Abstract: The development of polymeric solid electrolytes have been increased the safety of electrochromic devices and batteries besides the creation of different shapes and their reduction of size. In order to improve their efficiency, lithium-ion conductive hybrid solid electrolytes were developed. They were synthesized by simple chemical route, which the polymer chain containing silicon or germanium as central atoms. FTIR (Fourier Transform Infrared) and FT-Raman (Fourier Transform Raman Spectroscopy) analysis confirmed the polymerization of the metallic citrate and the formation of a polymer chain. From the FTIR results, it was identified the region between 1020 and 1080 cm-1 contains the stretching
vibration of O-C-C. DSC (Differential Scanning Calorimetry) analysis confirmed presence of only one glass transition temperature for the polyelectrolyte made of germanium at -29°C, which confirms the amorphous behaviour of the material at ambient temperature, increasing the ionic conductivity. Thus, the polyelectrolyte synthesized is a Single Phase Hybrid Polyelectrolyte (SPHP), which its charge transfer mechanism occurs by “hopping”, i.e. lithium ions move independent of the polymer chain movement. The results presented here indicated the material developed is promising to a fast ion conduction of Li+ and Na+.
Introdução
Segundo o Anuário Estatístico de Energia Elétrica de 2015 realizado pela Empresa de Pesquisa Energética (EPE), o consumo do setor residencial de energia elétrica no Brasil foi de, aproximadamente, 28% do consumo total deste ano e o consumo do setor comercial foi de 19% do total tendo como ano base o de 2014 [1]. Com a situação precária atual em relação ao aumento do uso da energia e seus efeitos associados ao clima do planeta, alternativas para diminuir a dependência da energia elétrica principalmente proveniente do uso de combustíveis fósseis mostram-se cada vez mais relevantes. Neste sentido, tecnologias capazes de gerar e armazenar energia, como células a combustível [2, 3], supercapacitores, janelas eletrocrômicas ou janelas inteligentes e baterias eletroquímicas são importantes meios de reduzir as emissões de gás carbônico na atmosfera [4]. Dentre as mais diversas tecnologias, tem recebido grande destaque os dispositivos eletrocrômicos, os quais permitem a redução do consumo de energia [5].
O eletrocromismo é definido como uma mudança óptica persistente, mas reversível eletroquimicamente [6]. Este tipo de dispositivo permite que um material que possui características eletrocrômicas possa ter sua coloração alterada com a inserção de íons e de elétrons em sua estrutura através da aplicação de um potencial elétrico externo [6, 7]. Este fenômeno permite que esta tecnologia possa ser aplicada em janelas de prédios, de aviões e de carros a fim de proporcionar conforto térmico com a consequente redução de uso de ar-condicionado e aquecedores [8, 9, 10]. Os dispositivos eletrocrômicos seriam, neste aspecto, uma importante opção para permitir a edifícios residenciais e comerciais uma eficiência energética e deixá-los em harmonia com o meio ambiente [11].
Uma das preocupações do uso comercial de dispositivos eletrocrômicos se refere ao uso de líquidos como responsáveis pelos processos de transferência de carga (eletrólitos). Com intuito de melhorar a segurança dos dispositivos, evitar o efeito da pressão hidrostática e necessidade de vedação, a substituição do eletrólito líquido por um filme polimérico condutor é uma excelente alternativa [12, 13].
Para um eletrólito ser aplicável e promissor, deve atender a alguns requisitos, tais como [14]:
Ter condutividade iônica adequada e alta resistividade eletrônica; Ter alta mobilidade catiônica;
Adquirir boa estabilidade mecânica;
Proporcionar estabilidade na interface eletrodo-eletrólito; Proporcionar estabilidade eletroquímica;
Possuir um processo fácil de síntese; Ter estabilidade química e térmica;
Ser seguro (evitar o risco de vazamentos).
A partir destas características desejadas, várias pesquisas foram implementadas e eletrólitos sólidos poliméricos foram desenvolvidos. O primeiro relato sobre o desenvolvimento de um eletrólito solido polimérico foi em 1973. Peter Wright et al sintetizaram o eletrólito a base de óxido de polietileno com adição de lítio e a condutividade iônica medida foi da ordem de 10-6 S cm-1, um
valor bastante significante [12, 15]. No entanto, comparado aos então comerciais eletrólitos líquidos que possuíam condutividades da ordem de 10-3 S cm-1, sua
aplicação comercial não era viável. Após este estudo, Michel Armand investigou sua implementação em baterias de íons-lítio em 1979 [16], alcançando resultados bastante promissores para uma futura substituição dos eletrólitos líquidos. Desde então centenas de outros eletrólitos tem sido desenvolvidos sob as mais variadas formas a partir de cadeias poliméricas diferentes [16, 17].
No entanto, apesar de bastante atrativos, os eletrólitos sólidos poliméricos possuem baixa condutividade iônica comparados aos eletrólitos líquidos, o que os deixaram distante de uma aplicação comercial. Assim, muitos dos eletrólitos poliméricos estudados deixaram de ser implementados e as tecnologias atuais concentram-se em desenvolver eletrólitos híbridos. Eles consistem em um sistema orgânico-inorgânico no qual cadeias poliméricas são ligadas por átomos inorgânicos como titânio, zircônio e silício [18, 19, 20].
De forma geral, todos os polímeros desenvolvidos por diferentes estratégias apresentaram mecanismo de transferência de carga governado pela teoria de volume livre (VTF), segundo a equação abaixo:
= 0 ( 0)
Em que σ é a condutividade, σ0 é o valor inicial de condutividade, B é a energia
de ativação, R é uma constante que depende do material utilizado, T é a temperatura absoluta e T0 é a temperatura de transição vítrea de equilíbrio, que
pode ser relacionada com a temperatura de transição vítrea Tg pela seguinte
aproximação:
~ 50
Isto tem uma implicação na condutividade iônica, pois a mobilidade dos íons fica restrita ao movimento da cadeia hospedeira ou matriz polimérica. A equação também evidencia a necessidade dos materiais terem baixos valores de Tg para haver um aumento na condutividade iônica.
Neste contexto, o Laboratório de Energias Alternativas e Nanomateriais (LEAN) tem dedicado nos últimos anos esforços para desenvolver novas estratégias para fabricar os componentes de dispositivos eletrocrômicos [10, 21]. Dispositivos eletrocrômicos produzidos pelo LEAN atingiram características desejadas, tais como uma excelente eficiência de coloração, grande número de ciclos (mais de 60000 ciclos) e também a máxima taxa de deintercalação/intercalação de íons [10]. Sabe-se que estes bons resultados atingidos devem-se também a um excelente polieletrólito produzido que permitiu que a condução de íons seja a mais rápida possível. Para conseguir essa rápida condução de íons, foi desenvolvido um eletrólito de cadeia polimérica relativamente curta (também considerada um oligômero) e com estrutura planar devido à sua composição química. Um átomo inorgânico de silício é o átomo central da molécula e, por conta de sua eletronegatividade promove interações fortes (entre o Si e os átomos de carbono) na formação da matriz polimérica desfavorecendo o arranjo comumente observado em polímeros que é o helicoidal [22]. Por conta desta estrutura, este eletrólito apresenta uma fraca interação dos íons lítio (mas podendo ser outros íons tais como: Na+ou K+)
adicionados com a cadeia polimérica, indicando que a mobilidade iônica pode ser desacoplada da movimentação da cadeia [22]. Este fato, permite afirmar que o mecanismo responsável pela mobilidade dos íons na cadeia é por “hopping” [23].
Tal efeito foi compreendido após a confirmação do comportamento do eletrólito onde a condutividade iônica medida em função da temperatura (temperaturas acima da temperatura de transição vítrea) foi perfeitamente analisada pela equação de Arrhenius:
=
Em que σ é a condutividade, σ0 corresponde à condutividade inicial, Ea é a
energia de ativação, K é a constante de Boltzmann (8,617x10-5 eV/K) e T é a
temperatura absoluta. Foi verificado que, para o eletrólito sintetizado, a energia de ativação foi baixa (Ea = 0,21eV), o que corresponde a uma condução rápida
de íons [22].
Neste contexto, o presente trabalho teve como principal objetivo desenvolver um eletrólito híbrido polimérico com condutividade iônica superior e melhor desempenho modificando a eletronegatividade da matriz substituindo o átomo central de silício por um átomo de germânio [24]. Essa substituição teoricamente por conta da maior eletronegatividade do germânio, promoveria uma menor interação dos íons lítio com a matriz hibrida polimérica permitindo maior mobilidade e consequentemente superior condutividade iônica. Para efeito de comparação, os dois eletrólitos foram sintetizados e caracterizados para investigar o efeito da substituição do átomo central (Si por Ge) nas propriedades gerais do novo polieletrólito, tais como conformação estrutural, interação cadeia-íon, estabilidade e histórico térmico, entre outras. Além disso, foi investigado a interação de diferentes íons (lítio e sódio) com ambas as matrizes poliméricas. O intuito foi compreender o efeito e a localização dos íons quando adicionados na matriz e futuramente auxiliar a compreensão e confirmação do mecanismo que governa a mobilidade dos mesmos.
Metodologia
Eletrólito sólido polimérico
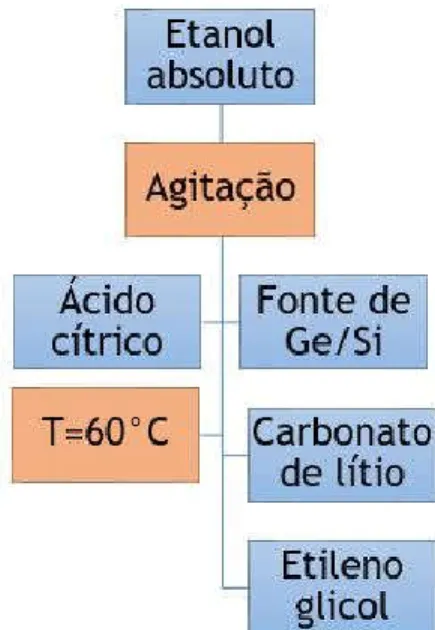
O polieletrólito foi produzido pelo processo sol-gel não hidrolítico, que consiste na preparação de um complexo de ácido cítrico (AC) e silício (Si) ou germânio (Ge) em etanol numa razão molar de 2:1 a fim de formar um citrato metálico. Uma vez obtido esse complexo AC-Ge o passo seguinte será a adição
de carbonato de lítio como fonte desse íon. A solução é mantida sob agitação e a uma temperatura de 60°C. Após total dissolução do sal de lítio foi adicionado
etileno glicol (EG) na razão molar de 77/23 (complexo Si/EG e complexo AC-Ge/EG) com intuito de promover a reação de poliesterificação (formação do poliéster). Após 1 hora essa solução pode ser usada para caracterizações no estado líquido. Para uso como gel ou sólido é necessário manter em estufa a 60
oC para eliminação do solvente por 12 horas. O fluxograma a seguir apresenta
esta síntese:
Figura 1 – Fluxograma da síntese do eletrólito polimérico sob as razões molares estabelecidas previamente.
Caracterização dos eletrólitos sintetizados
Após as amostras sintetizadas permanecerem na estufa pelo tempo determinado, elas ficaram estocadas em um dessecador à vácuo para evitar contato com a umidade até serem utilizadas para as caracterizações. Foram utilizadas as espectroscopias de FTIR e FT-Raman para analisar as vibrações das cadeias formadas e identificar a região em que os íons inseridos tendem a ficar. Análises de DSC também foram feitas para localizar as temperaturas de transição vítrea e verificar o comportamento amorfo das amostras sintetizadas.
Resultados e discussão
FT-Raman (Espectroscopia Raman por Transformada de Fourier)
Para compreender a estrutura molecular do polieletrólito híbrido, a espectroscopia FT-Raman foi utilizada para verificar as vibrações das moléculas para indicar quais grupos moleculares reagem entre si. A Figura 2 a) ilustra os espectros de FT-Raman do etileno glicol (EG), da fonte de silício (Si), do ácido cítrico (AC), do complexo AC-Si formado e o poliéster sintetizado a partir da adição de etileno glicol ao complexo anterior. Já a Figura 2 b) ilustra os espectros de FT-Raman de etileno glicol, da fonte de germânio (Ge), de ácido cítrico, do complexo AC-Ge estabelecido e do produto final ao se adicionar etileno glicol.
Figura 2 – a) Espectros de FT-Raman de EG, fonte de Si, AC, complexo AC-Si e AC/Si/EG; b) Espectros de FT-Raman de EG, fonte de Ge, AC, complexo AC-Ge e AC/AC-Ge/EG.
De acordo com a Figura 2, o espectro do etileno glicol possui somente um pico intenso em 1462 cm-1. Pela Figura 2 a), o espectro da fonte de silício possui
dois picos em 1485 e 1456 cm-1 enquanto que o espectro da fonte de germânio
da Figura 2 b) tem seus picos em 1481 e 1454 cm-1 seguindo o mesmo padrão
que o espectro da fonte de silício. Na região entre 1800 e 1600 cm-1 (Figura 2 a)
e b)), o espectro do ácido cítrico possui três picos indexados pelos números 1 e 2 e por uma seta. O pico 1 em 1738 cm-1 está relacionado à vibração de
estiramento do grupo carboxil central da molécula. O pico 2 em 1693 cm-1 está
relacionado à vibração de estiramento do grupo carboxil terminal da molécula que é apontado pela literatura como o grupo preferencial para reagir e formar o
complexo. O pico indicado pela seta em 1635 cm-1 ocorre por conta de uma forte
interação intramolecular. Entre 1500 e 1300 cm-1, há também outros picos no
espectro do ácido cítrico. O pico indicado pelo número 3 em 1433 cm-1 é
referente ao modo de vibração angular do grupo metil e o pico 4 em 1391 cm-1 é
devido também pelo modo de vibração angular, porém está relacionado com o grupo C-OH.
Por meio dos espectros dos complexos de AC-Si e AC-Ge (Figura 2 a) e b), respectivamente), é possível perceber que há um único pico pouco intenso formado na região onde haviam os picos 1 e 2 correspondentes ao espectro do ácido cítrico. Nesta mesma região, os espectros das fontes de silício (linha tracejada da Figura 2 a)) e germânio (linha tracejada da figura 2 b)) não apresentam picos. Este pico formado indica, portanto, que houve a reação de complexação nos espectros e, sendo assim, há novas ligações moleculares. Na região de 1500 e 1300 cm-1, no entanto, os complexos de AC-Si e AC-Ge
possuem dois picos que possuem o mesmo formato que os picos da mesma região nos espectros das fontes de silício e de germânio, respectivamente, e também um formato similar com os picos do espectro de ácido cítrico nesta região. Isso pode indicar que o grupo CH2 não foi afetado pela reação de
complexação. Com a adição de etileno glicol, houve a reação de poliesterificação evidenciada pelo pico entre 1650 e 1800 cm-1 mais intenso tanto para a amostra
contendo silício quanto para a amostra contendo germânio.
FTIR (Espectroscopia no Infravermelho por Transformada de Fourier) Por meio da espectroscopia FTIR, foi possível indexar as vibrações dos eletrólitos sintetizados de acordo com o que foi previamente estabelecido pela literatura [20]. A Figura 3 apresenta estas vibrações para o polieletrólito constituído de silício (à esquerda) e para o constituído de germânio (à direita). Nestas sínteses apresentadas, foram adicionados íons de lítio em uma porcentagem de 10% em massa:
Figura 3 – a) espectro FTIR do eletrólito constituído de silício; b) espectro FTIR do eletrólito constituído de germânio.
A partir da Figura 3, é possível perceber que as bandas de vibração da amostra contendo germânio (espectro b)) são mais intensas e que há dois grandes picos na região entre 1100 e 1400 cm-1. Essas diferenças nos espectros
podem significar uma interação mais forte da cadeia polimérica com o átomo de germânio, já que a sua eletronegatividade é ligeiramente maior que a do silício (segundo a escala de Pauling). Essa diferente interação da cadeia pode, então, evidenciar que a condutividade dos íons inseridos é maior em relação ao eletrólito contendo silício. Para comprovar este fato, medidas de condutividade por meio de espectroscopia de impedância serão analisadas em breve.
DSC (Calorimetria Diferencial de Varredura)
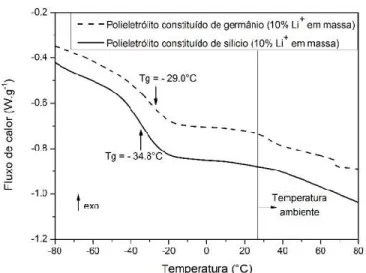
Caracterizações das amostras por análises de DSC também foram executadas a fim de se confirmar se as razões molares estabelecidas conseguiram resultar na formação de uma única cadeia polimérica, isto é, se estas razões fizeram com que o etileno glicol adicionado reagisse com o complexo formado anteriormente. A Figura 4 mostra os resultados obtidos:
Figura 4 – Curvas de DSC dos eletrólitos constituídos de silício (linha sólida) e de germânio (linha tracejada) com 10% de lítio em massa.
Pelas curvas de DSC apresentadas acima, é possível perceber que os seus formatos são similares, que há apenas uma temperatura de transição vítrea para cada polieletrólito estudado e não há picos de cristalização. Portanto, os polieletrólitos sintetizados são completamente amorfos acima destas temperaturas características, o que é desejável para a condução dos íons. Além disso, por haver somente uma temperatura de transição vítrea para cada amostra estudada, pode-se confirmar que houve a formação de somente uma cadeia polimérica em cada amostra e que, portanto, as razões molares pré-estabelecidas foram corretas.
Efeito do tamanho do íon
Foram sintetizados três tipos diferentes de eletrólitos constituídos de silício: um não possuía íons, o segundo tinha 10% de íons de lítio em massa e o terceiro, 10% de íons de sódio em massa. Caracterizações destas amostras foram feitas para avaliar a localidade dos íons na estrutura dos eletrólitos:
Figura 5 – Espectroscopias FTIR (esquerda) e FT-Raman (direita) dos eletrólitos contendo silício com diferentes íons inseridos.
Foi possível perceber tanto na espectroscopia FTIR quanto na espectroscopia FT-Raman que as curvas possuem picos nas mesmas localidades com apenas intensidades diferentes devido ao tamanho dos íons. Pode-se concluir que a banda de vibração de estiramento O-C-C compreendida na região entre 1020 e 1080cm-1 é localizada como o contraíon da cadeia para
os íons de lítio e de sódio, e estes diferentes íons interagem com os mesmos grupos orgânicos da cadeia polimérica. Os resultados obtidos neste trabalho estão, portanto, de acordo com o que foi relatado anteriormente pela literatura [25] e são uma prova de que os íons se movem por “hopping” na cadeia polimérica.
Conclusões
Em resumo os polieletrólitos desenvolvidos neste trabalho mostram-se promissores para suas aplicações em dispositivos eletrocrômicos e em baterias de íons lítio. A síntese realizada em atmosfera aberta foi implementada de maneira simples e rápida, o que é um fator importante para sua aplicação em ampla escala. O polieletrólito sintetizado com germânio ilustrou sensíveis alterações nos resultados quando comparado ao desempenho do polieletrólito de silício. Com base nos resultados de FT-Raman, FT-IR e DSC foi possível concluir que a substituição do átomo central de Si por Ge, mantém a característica do polieletrólito híbrido descrito previamente na literatura [22]. O
que implica em dizer que polieletrólito híbrido com germânio foi identificado como sendo amorfo, contendo uma fase única (SPHP), com cadeia linear e mais rígida e com os íons interagindo com as cadeias carboxílicas da matriz. O aumento significativo nos valores de Tg dos polieletrólitos híbridos com germânio sugerem que a cadeia ficou mais rígida e como consequência se espera uma interação menor do íon com a cadeia promovendo uma superior condutividade iônica. Outras propriedades importantes do material desenvolvido neste trabalho são: consistência do polieletrólito é sólida, flexível e leve podendo ser comparados aos plásticos finos e transparente utilizados para embalagem de comidas rotineiramente nas casas. Essas características permitem a redução do tamanho e peso dos dispositivos, o desenvolvimento de diferentes formas atendendo às necessidades comerciais. Além disso, a rota química utilizada para a síntese é de baixo custo, envolve simples aparatos e materiais abundantes na natureza, tornando-os viáveis ecologicamente e economicamente. Análises de condutividade iônica serão feitas bem como a aplicação do polieletrólito desenvolvido em dispositivos eletrocrômicos. As investigações antes da construção dos dispositivos serão realizadas utilizando uma célula eletroquímica convencional de três eletrodos para verificar a mudança e porcentagem de coloração, estabilidade, tempo de inserção e extração de cargas utilizando o polieletrólito com germânio e eletrodos de óxido de tungstênio, que também serão sintetizados.
Referências
[1] Empresa de Pesquisa Energética – EPE, 2014. (http://www.epe.gov.br/AnuarioEstatisticodeEnergiaEletrica/Forms/Anurio.aspx). Acesso em: 25 de Janeiro de 2016.
[2] Khaselev, O.; Turner, J. A. A Monolithic Photovoltaic-Photoelectrochemical Device for Hydrogen Production via Water Splitting. Science, 280, 425–427, 1998.
[3] Bak, T.; Nowotny, J.; Rekas, M.; Sorrell, C. C. Photo-electrochemical hydrogen generation from water using solar energy. Materials-related aspects. International Journal of Hydrogen Energy, 27, 991–1022, 2002.
[4] Scrosati, B.; Garche, J. Lithium batteries: Status, prospects and future. Journal of Power Sources, 195, 2419-2430, 2010.
[5] Granqvist, C. G. Oxide electrochromics: An introduction to devices and materials. Solar Energy Materials & Solar Cells, 99, 2012.
[6] Granqvist, C. G. Handbook of Inorganic Electrochromic Materials. Amsterdam: Elsevier, 1995.
[7] Monk, P. M. S.; Mortimer, R. J.; Rosseinsky, D. R. Electrochromism: Fundamentals and Applications. Weinheim: VCH, 1995.
[8] Lampert, C. M. Smart switchable glazing for solar energy and daylight control. Solar Energy Materials and Solar Cells, 52, 207-221, 1998.
[9] Selkowitz, S. E.; Lampert, C. M. Large-area Chromogenics: Materials and Devices for Transmittance Control. SPIE – Optical Engineering Press, Bellingham, 22, 1990. [10] Souza, F. L.; Aegerter, M. A.; Leite, E. R. Performance of a single-phase hybrid and nanocomposite polyelectrolyte in classical electrochromic devices. Electrochimica Acta, 53, 1635-1642, 2007.
[11] Granqvist, C. G. Electrochromic for smart windows: Oxide-based thin films and devices. Thin Solid Films, 564, 1-38, 2014.
[12] Wright, P. V. Electrical Conductivity in Ionic Complexes of Poly(ethylene oxide). British Polymer Journal, 7, 319-327, 1975.
[13] Armand, M. B.; Duclot, M. J.; Rigaud, P. H. Polymer solid electrolytes: stability domain. Solid State Ionics, 3/4, 429-430, 1981.
[14] Scrosati, B.; Vincent, C. A. Polymer Electrolytes: The Key to Lithium Polymer Batteries. MRS Bulletin, 25, 28-30, 2000.
[15] Fenton, D. E.; Parker, J. M.; Wright, P. V. Complexes of alkali metal ions with poly(ethylene oxide). Polymer, 14, 589, 1973.
[16] Armand M. B.; Chabagno, J. M.; Duclot, M. J. Fast ion transport in solids. Amsterdam: 1979.
[17] Tarascon, J. M.; Gozdz, A. S.; Schmutz, C.; Shokoohi, F.; Warren, P. C. Performance of Bellcore’s plastic rechargeable Li-ion batteries. Solid State Ionics, 86-88, 49-54, 1996.
[18] Popall, M.; Andrei, M.; Kappel, J.; Kron, J.; Olma, K.; Olsowski, B. ORMOCERs as inorganic-organic electrolytes for new solid-state lithium batteries and supercapacitors. Electrochimica Acta, 43, 1155-1661, 1998.
[19] Di Notto, V.; Zago, V.; Biscazzo, S.; Vittadello, M. Hybrid inorganic-organic polymer electrolytes: synthesis, FT-Raman studies and conductivity of {Zr[(CH2CH2O)8.7]ρ/(LiClO4)Z}n network complexes. Electrochimica Acta, 48, 541-554, 2003.
[20] Souza, F. L.; Bueno, P. R.; Longo, E.; Leite, E. R. Sol-gel non-hydrolytic synthesis of a hybrid organic-inorganic electrolyte for application in lithium-ion devices. Solid State Ionics, 166, 83-88, 2004.
[21] Souza, F. L.; Aegerter, M. A.; Leite, E. R. Solid hybrid polyelectrolyte with high performance in electrochromic devices: Electrochemical stability and optical study. Solar Energy Materials & Solar Cells, 91, 1825-1830, 2007.
[22] Souza, F. L.; Bueno, P. L.; Lazaro, S.; Longo, E.; Leite, E. R. Hybrid Organic-Inorganic Polymer: A New Approach for the Development of Decoupled Polymer Electrolyte. Chemistry of Materials, 17, 4561-4563, 2005.
[23] Souza, F. L.; Longo, E.; Leite, E. R. Ion Relaxation Dynamics in a Decoupled Hybrid Polyelectrolyte. ChemPhysChem, 9, 245-248, 2008.
[24] Souza, F. L.; Longo, E.; Leite, E. R. Lithium ion motion in a hybrid polymer: Confirmation of a decoupled polyelectrolyte. ChemPhysChem, 8, 1778-1781, 2007. [25] Souza, F. L.; Leite, E. R. Hybrid polymer electrolytes for electrochemical devices. Polymer electrolytes Fundamentals and Applications. Abington, Cambridge: Woodhead Publishing Limited, 583-602, 2010.