Avaliação da atividade antibacteriana do óleo da microalga Chlorella
minutissima como alternativa para o tratamento de dermatite atópica
Evaluation of antibacterial activity of Chlorella minutissima microalgae oil as
an alternative for the treatment of atopic dermatitis
DOI:10.34117/bjdv5n11-169
Recebimento dos originais: 07/10/2019 Aceitação para publicação: 16/11/2019
Patrícia da Rocha Simões
Formação acadêmica mais alta: Farmacêutica
Instituição: Centro Universitário Teresa D'Ávila - UNIFATEA
Endereço: Av. Dr. Peixoto de Castro, 539 - Cruz, Lorena - SP, CEP 12606-580 E-mail: patriciarochasimoes@gmail.com
Jaasiel Espindola Villar
Formação acadêmica mais alta: Farmacêutico
Instituição: Centro Universitário Teresa D'Ávila - UNIFATEA
Endereço: Av. Dr. Peixoto de Castro, 539 - Cruz, Lorena - SP, CEP 12606-580 E-mail: jaasiel.villar@hotmail.com
Daniela Ercole Dale Luche
Formação acadêmica mais alta: Especialista em Gestão da Produção Instituição: Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP
Endereço: Av. Dr. Ariberto Pereira da Cunha, 333 - Portal das Colinas, Guaratinguetá - SP, CEP 12516-410
E-mail: daniela.luche@hotmail.com
Messias Borges Silva
Formação acadêmica mais alta: Doutor em Engenharia Química Instituições: Universidade de São Paulo - USP
Endereço: Estrada Municipal do Campinho, s/n - Pte. Nova, Lorena - SP, CEP 12602-810 Universidade Estadual Paulista Júlio de Mesquita Filho - UNESP
Endereço: Av. Dr. Ariberto Pereira da Cunha, 333 - Portal das Colinas, Guaratinguetá - SP, CEP 12516-410
E-mail: messiasusp@gmail.com
Bruna Caroline Marques Gonçalves
Formação acadêmica mais alta: Doutora em Biotecnologia Industrial Instituição: Centro Universitário Teresa D'Ávila - UNIFATEA
Endereço: Av. Dr. Peixoto de Castro, 539 - Cruz, Lorena - SP, CEP 12606-580 E-mail: brunacarolinebcmg@gmail.com
RESUMO
A dermatite atópica é uma doença inflamatória da pele que pode ter caráter crônico e recidivante. A infecção por Staphylococcus aureus é a causa mais comum da doença devido à produção de toxinas por esta bactéria. O uso de antibióticos está aumentando ao longo dos anos, e seu uso indiscriminado está ligado a resistência bacteriana. Portanto, o desenvolvimento de alternativas eficazes à prática do uso de antibióticos é essencial para o controle de infecções. Nesta perspectiva, o objetivo desta pesquisa foi cultivar a microalga Chlorella minutissima sob regime batelada, avaliar a produção de clorofila e a atividade antimicrobiana do óleo microalgal sobre o microrganismo S. aureus. A microalga foi cultivada durante 33 dias sob luminosidade e aeração constantes, com temperatura variando entre 21°C e 33°C. No final deste período, o cultivo foi floculado e filtrado a vácuo para obtenção da biomassa seca. O óleo foi obtido pelo método de extração a quente e sua atividade antimicrobiana contra a bactéria Staphylococcus aureus foi avaliada. Como resultado, a microalga apresentou crescimento durante os primeiros 15 dias de cultivo, quando entrou em fase estacionária; porém, alcançou maior produção de clorofila no 18° dia de cultivo. O óleo e os extrativos obtidos a partir da microalga apresentaram efeito positivo na inibição do crescimento do Staphylococcus aureus. Sendo assim, embora sejam necessários estudos aprofundados, os resultados sugerem que os bioprodutos extraídos a partir da microalga Chlorella minutissima são promissores para o tratamento de dermatite atópica.
Palavras-chave: Staphylococcus aureus, Infecção, Antibiótico, Clorofila.
ABCTRACT
Atopic dermatitis is an inflammatory skin disease that may be chronic and recurrent. Staphylococcus aureus infection is the most common cause of the disease due to toxin production by this bacterium. Antibiotic use is increasing over the years, and their indiscriminate use is linked to bacterial resistance. Therefore, the development of effective alternatives to the practice of antibiotic use is essential for infection control. From this perspective, the objective of this research was to cultivate the microalgae Chlorella minutissima under batch regime, to evaluate the chlorophyll production and the antimicrobial activity of the microalgal oil on the S. aureus microorganism. The microalgae was cultivated for 33 days under constant light and aeration, with temperatures ranging from 21 ° C to 33 ° C. At the end of this period, the crop was flocculated and vacuum filtered to obtain dry biomass. The oil was obtained by the hot extraction method and its antimicrobial activity against Staphylococcus aureus bacteria was evaluated. As a result, the microalgae grew during the first 15 days of cultivation, when it entered the stationary phase. However, it achieved higher chlorophyll production on the 18th day of cultivation. The oil and extracts obtained from microalgae had a positive effect on growth inhibition of Staphylococcus aureus. Thus, although in-depth studies are required, the results suggest that bioproducts extracted from Chlorella minutissima microalgae are promising for the treatment of atopic dermatitis.
Key words: Staphylococcus aureus, Infection, Antibiotic, Chlorophyll.
1 INTRODUÇÃO
A dermatite atópica, também conhecida como eczema atópico ou eczema infantil, é uma doença inflamatória da pele de caráter crônico e recidivante. Manifesta-se normalmente em crianças e é caracterizada por prurido intenso e liquenificação (espessamento e rigidez) da pele afetada (HANIFIN; G., 1980). De acordo com Castro et al (2006) fatores hereditários, imunológicos e ambientais estão relacionados ao desenvolvimento da doença, assim como quadros de asma e rinite.
A colonização e infecção das lesões agudas ou crônicas por Staphylococcus aureus é a causa mais comum de complicação da dermatite atópica devido à produção de toxinas por essa bactéria. O tratamento das lesões é realizado por meio da administração de corticoide ou pela associação de corticoide e antibiótico tópico, como mupirocina, para a erradicação do S. aureus (BREUER et al., 2002; HUANG et al., 2009). Além disso, o uso crônico de banhos de alvejante diluído com aplicação de pomada de mupirocina pode reduzir a gravidade clínica da dermatite atópica em pacientes com sinais clínicos de infecções bacterianas secundárias (HUANG et al., 2009).
Embora a antibioticoterapia seja eficiente no controle da proliferação de microrganismos e sua erradicação, os microrganismos vêm desenvolvendo resistência aos antibióticos. De acordo com Tavares (2002), bactérias gram-positivas têm apresentado consideráveis modificações na sensibilidade aos antimicrobianos com o decorrer dos anos, com destaque para os estafilococos. Além disso, o uso de antibióticos pode causar efeitos colaterais hematológicos, neurológicos, pulmonares, cardíacos, gastrointestinais, hepáticos, nefrotoxicidade, hipersensibilidade, entre outros. A maior parte dos eventos adversos relacionados a antibióticos está relacionada a agentes antimicrobianos específicos e não às classes de antimicrobianos (CUNHA, 2001).
O uso de plantas medicinais e seus extratos como agentes antimicrobianos têm sido explorados ao longo de vários séculos (GYAWALI; IBRAHIM, 2014; RIOS; RECIO; VILLAR, 1988). Além das plantas medicinais, as microalgas têm se demonstrado uma alternativa promissora à antibioticoterapia convencional. As microalgas são microrganismos unicelulares, eucariontes e fotossintéticos com grande variedade de espécies encontradas tanto em ambientes aquáticos (marinhos e/ou dulciaquícolas) e em ambientes terrestres (úmidos); têm a capacidade de se adaptarem em diferentes condições ambientais (NICOLETTI, 2016; RIZWAN et al., 2018).
Estas possuem alto valor biológico e biotecnológico devido a sua composição rica em ácidos graxos poli-insaturados, proteínas, aminoácidos, pigmentos, antioxidantes, vitaminas e minerais. Por essa razão, podem ser utilizadas na indústria alimentícia, farmacêutica e cosmética (CHRISTENSON, SIMS, 2011; NICOLETTI, 2016; PULZ, GROSS, 2004), ou ainda como matéria-prima para a obtenção de biocombustíveis (BRENNAN, OWENDE, 2010) e tratamento de efluentes (DOMINGUEZ, 2013).
Estudos indicaram atividade antimicrobiana de extratos obtidos a partir das células microalgais submetidas ao processo de extração com solventes inorgânicos ou água. De acordo com Parisi et al. (2009), os compostos fenólicos extraídos a partir da Spirulina platensis inibiram o crescimento do S. aureus. Da mesma forma, Cavalcanti et al. (2013) reportaram inibição de cepas de
Staphylococcus sp. frente ao extrato aquoso de Chlorella vulgaris. Embora o sobrenadante das
de S. aureus e Bacillus subtilis por extratos de hexano obtidos a partir de diversas microalgas. Dessa forma, extratos obtidos a partir da biomassa microalgal podem ser utilizados para o tratamento da dermatite atópica, devido ao seu potencial inibitório frente às cepas de S. aureus.
Os pigmentos sintetizados pelas microalgas são responsáveis pela sua coloração característica. As microalgas verdes são amplamente conhecidas pelo seu potencial de sintetizar clorofila, pigmento essencial para obtenção de energia pelos organismos fotossintéticos (SERIVE et al., 2017). Atualmente 5 tipos de clorofila são conhecidos: a, b, c, d e f (CHEN et al., 2010). A clorofila a é o pigmento mais abundante nos organismos fotoautotróficos, correspondendo a 75% dos pigmentos verdes (STREIT et al., 2005), seguida pela clorofila b, comum em algas verdes (FERREIRA & SANT’ANNA, 2017; MULDERS et al., 2014). A clorofila é amplamente utilizada nas indústrias de alimentos, cosméticos e farmacêuticos (PULZ & GROSS, 2004). É considerada um nutracêutico com propriedades antioxidantes, anti-inflamatórias, antimutagênicas e antimicrobianas e por isso o seu consumo é recomendado (FERREIRA; SANT’ANNA, 2017).
Estudos voltados ao desenvolvimento de alternativas eficazes à prática do uso de antibióticos são essenciais para o controle de infecções, e o uso do óleo de microalgas surge como uma delas. Neste sentido, o presente estudo objetivou cultivar a microalga Chlorella minutissima em regime de batelada, avaliar a produção de clorofila e a atividade antimicrobiana do óleo extraído a partir da microalga frente ao microrganismo S. aureus.
2 MATERIAL E MÉTODOS
2.1 Microalga Chlorella minutissima
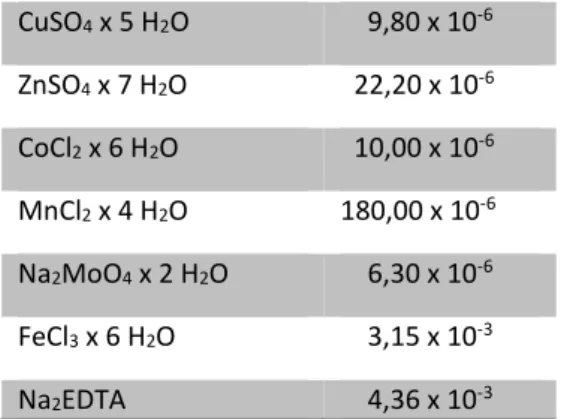
Para o preparo do inóculo e obtenção de biomassa microalgal foi utilizado o meio de cultivo F/2 (GUILLARD; RYTHER, 1962) com modificações (não adição de vitaminas). A composição do meio de cultivo pode ser observada na Tabela 1. Foram preparadas soluções mãe de cada um dos reagentes separadamente para evitar a precipitação dos sais durante o processo de autoclavagem (111°C, 20 min).
Tabela 1 - Composição do meio de cultivo F/2.
Reagentes Concentração (g L-1) NaCl 30,00 NaNO3 75,00 x 10-3 NaH2PO4 x H2O 5,00 x 10-3 Na2Si3 x 9 H2O 30,00 x 10-3
CuSO4 x 5 H2O 9,80 x 10-6 ZnSO4 x 7 H2O 22,20 x 10-6 CoCl2 x 6 H2O 10,00 x 10-6 MnCl2 x 4 H2O 180,00 x 10-6 Na2MoO4 x 2 H2O 6,30 x 10-6 FeCl3 x 6 H2O 3,15 x 10-3 Na2EDTA 4,36 x 10-3
Fonte: Guillard & Ryther, 1962.
Os cultivos foram realizados em regime de batelada em temperatura ambiente (21°C a 33°C). Foram utilizados fotobiorreatores de 5 L com 4,5 L de volume de trabalho. Os experimentos foram realizados em triplicata (Figura 1). A aeração foi realizada por meio de bomba de ar para aquário (Xilong - AP-003, 5 W) e a iluminação por meio de 4 lâmpadas tubulares fluorescentes de cor branca (T8 LED LM 155 22 W) em ciclo de 24 h. Amostras (5mL) foram retiradas periodicamente com o auxílio de seringas de 20 mL.
Figura 1 - Fotobiorreatores.
Fonte: Própria.
2.2 Bactéria Staphylococcus aureus
O disco impregnado com S. aureus foi inoculado em 6 mL de caldo nutriente estéril e incubado a 37°C por 6 h. O caldo com o microrganismo ativo (10 µL) foi inoculado em placa de ágar Muller Hinton e incubado a 37°C por 24 h para o crescimento de colônias. A padronização do número de células foi realizada segundo o protocolo Clinical and Laboratory Standards Institute CLSI (2003). As colônias isoladas da placa de ágar foram suspensas em solução salina (NaCl 0,9%) e a turbidez foi ajustada visualmente com o auxílio da escala Mc Farland. Foi utilizado o padrão de turvação 0,5
com a finalidade de se obter uma suspensão celular com concentração entre 1 e 2 x 108 UFC/mL. A
suspensão foi inoculada na placa dentro de 15 min após o ajuste visual com auxílio de swab de algodão estéril. O swab foi introduzido na suspensão celular e após a remoção do excesso de líquido as células foram semeadas na superfície do ágar de maneira uniforme (Figura 2).
Figura 2 - Esquema utilizado para semear as placas com swab. A placa de Petri com ágar foi semeada em 3 diferentes direções: (a) a partir do ponto 1, em direção ao ponto 3; (b) a partir do ponto 4 em direção ao ponto 2 e (c) a partir do ponto 3 em direção ao ponto 1. A placa foi girada em um ângulo de 60º entre uma semeadura e outra.
Fonte: Própria.
2.3 Determinação do perfil de crescimento da microalga C. minutissima
O crescimento celular foi determinado a partir da suspensão de microalgas por meio de (i) análise espectrofotométrica da densidade óptica da cultura (Sppencer, Espectrofotômetro SP-22) utilizando cubeta de vidro (método indireto) e (ii) contagem de células totais em câmara de Neubauer (método direto). O comprimento de onda máximo (λmax) para leitura das amostras foi definido por
meio de varredura na região da luz visível (400 a 750 nm). Foi utilizado água destilada como branco e o experimento foi realizado em triplicata.
2.4 Determinação da concentração celular por espectrofotometria
Para a determinação da concentração celular por espectrofotometria foi necessário realizar a (i) determinação do peso seco e a (ii) construção da curva padrão. A determinação do peso seco foi utilizada para a conversão do valor de absorvância obtido a partir das medidas espectrofotométricas em concentração celular (g L-1).
2.5 Determinação do peso seco
Foram adicionados 3 mL de suspensão de células em meio F/2 em recipientes construídos com papel alumínio e previamente tarados em estufa a 100oC. Um teste paralelo com 3 mL de solução salina (NaCl 30%) foi realizado com a finalidade de subtrair a massa de NaCl da massa final das amostras de suspensão de células. As amostras foram incubadas em estufa a 100oC até peso constante. Os testes foram realizados em triplicata (Figura 3).
60o
Figura 3 - Amostras de suspensão de microalgas e solução de NaCl 30% incubadas em estufa a 100oC (a) e
resíduos de biomassa microalgal e NaCl após a evaporação da água (b).
(a) (b)
Fonte: Própria.
2.6 construção da curva padrão
Foram realizadas diluições sucessivas de uma amostra de suspensão de células para a construção da curva padrão e obtenção da equação da reta e coeficiente de determinação (R2).
2.7 Contagem de células por microscopia óptica
Para a contagem de células foram adicionados 20 µL da suspensão de microalgas na câmara de Neubauer. Uma lamínula foi cuidadosamente repousada sobre o volume adicionado com o intuito de prevenir a formação de bolhas e garantir o espalhamento do líquido. Foi padronizada a contagem de 5 quadrantes (superior direito e esquerdo, inferior direito e esquerdo e central) conforme destacado em cinza na Figura 4 para cada uma das amostras. O número de células por mL de suspensão foi calculado de acordo com a equação 01. Após ajuste dos parâmetros para a determinação do crescimento celular o cultivo da microalga C. minutissima foi realizado durante 33 dias com a finalidade de identificar as seguintes fases do ciclo de crescimento: (i) adaptação, (ii) aceleração do crescimento celular, (iii) crescimento exponencial, (iv) desaceleração do crescimento e (v) estacionária.
𝑁° 𝐶é𝑙𝑢𝑙𝑎𝑠 𝑝𝑜𝑟 𝑚𝐿 = (𝑁° 𝑐é𝑙𝑢𝑙𝑎𝑠 𝑐𝑜𝑛𝑡𝑎𝑑𝑎𝑠)
Figura 4 - Esquema da contagem de células em câmara de Neubauer.
Fonte: Própria.
2.8 Determinação dos parâmetros cinéticos
Os parâmetros cinéticos foram determinados de acordo com Guimarães (2016).
2.9 Produtividade
A produtividade foi calculada de acordo com a equação 02 (Guimarães, 2016).
𝑃 = (𝑋𝑓−𝑋𝑖)
(𝑡𝑓−𝑡𝑖) Equação 02
Sendo que:
𝑃: produtividade (g L-1dia-1);
𝑋𝑓: densidade celular (g L-1) no tempo 𝑡𝑓;
𝑋𝑖: densidade celular (g L-1) no tempo 𝑡𝑖;
𝑡𝑓: tempo final; 𝑡𝑖: tempo inicial.
2.10 taxa de crescimento
A taxa de crescimento representa a taxa de formação de biomassa por unidade de biomassa existente no biorreator por unidade de tempo e foi calculada de acordo com a equação 03 (Guimarães, 2016).
𝑟 = (ln
𝑁𝑓 𝑁𝑖)
Sendo que:
𝑟 = taxa de crescimento (dia-1);
𝑁𝑖 = densidade celular no tempo 𝑡𝑖(g.L-1);
𝑁𝑓 = densidade celular no tempo 𝑡𝑓 (g.L-1); ln = logaritmo neperiano.
2.11 Tempo de duplicação
O tempo de duplicação, ou tempo de geração, é o tempo necessário para uma população dobrar de número (MADIGAN; MARTINKO; BENDER, 2016) e foi calculado de acordo com a equação 04.
𝑘 = 𝑟
ln 2 Equação 04
Sendo que:
𝑘 = tempo de duplicação (dia-1);
𝑟 = taxa de crescimento (dia-1);
ln 2 = logaritmo neperiano de 2.
2.12 Determinação do conteúdo de clorofila acumulado pelas células microalgais
O conteúdo de clorofila foi determinado de acordo com Lv et al. (2017) e Mera; Torres; Abalde (2016) com algumas modificações. As células foram separadas do meio de cultivo por centrifugação (4000 rpm, 2 min). Após a remoção do sobrenadante o sedimento foi incubado em estufa a 50°C por 1h para remoção da água residual. Foi adicionado álcool etílico 92,8°GL e a mistura foi homogeneizada em ultrassom (Eco-sonics) durante 30 min e mantida a 4°C no escuro por 24h para a extração da clorofila. A absorvância do sobrenadante foi determinada nos comprimentos de onda 645 nm e 660 nm utilizando álcool etílico 92,8°GL como branco. A quantidade de clorofila a e clorofila b foi calculada de acordo com as equações 05 e 06, respectivamente propostas por Jeffrey & Humphrey (1975). De acordo com Humphrey (1980) a clorofila a possui pigmentos azul-esverdeados com absorvância máxima entre 660 e 665 nm, enquanto a clorofila b possui coloração verde amarelada e absorção máxima entre 642 e 652 nm.
𝐶𝑙𝑜𝑟𝑜𝑓𝑖𝑙𝑎 𝑏 = (24,96 × 𝐴645) − (7,32 × 𝐴660) Equação 06
Sendo que:
𝐴660= Absorbância no comprimento de onda 660 nm;
𝐴645 = Absorbância no comprimento de onda 645 nm.
2.13 Obtenção da biomassa microalgal
As células microalgais foram separadas do meio de cultivo por meio de floculação utilizando solução de sulfato de alumínio (Al2SO4) 1 Equivalente g/L (Figura 5 a,b). Foram utilizados 2 mL de
solução para cada litro de meio de cultivo (ZORN et al., 2017). A biomassa floculada foi filtrada à vácuo em papel de filtro previamente tarado e lavada com água destilada para a remoção dos sais (Figura 5 c,d) e submetida a secagem em estufa à 50oC (Figura 5 e).
Figura 5 - Procedimentos utilizados para a separação das células do meio de cultivo (a) adição de Al2SO4 aos meios de
cultivo e (b) células floculadas após 1 h (c) filtração à vácuo do meio cultivo para obtenção das células e (d) lavagem das células com água destilada (e) biomassa microalgal seca em estufa.
(a)
(b)
(c) (d)
(e)
Fonte: Própria.
2.14 Extração do óleo a partir da microalga
O óleo acumulado pelas células microalgais durante o cultivo foi obtido por meio do processo de extração à quente utilizando soxhlet (Figura 6a). Foram acondicionados 2 g de biomassa microalgal previamente seca a 50°C em cartucho confeccionado com papel filtro. A extração foi realizada à 70°C utilizando o hexano como solvente durante 8 h. O balão, com o solvente e com o conteúdo solúvel, foi acoplado em evaporador rotativo, para a remoção do solvente (Figura 6b) (Alves
e Souza, 2014 modificado). Após a evaporação do solvente, o óleo e os extrativos permaneceram aderidos ao fundo do balão (Figura 6 c).
Figura 6 - Procedimentos utilizados para a obtenção do óleo a partir da biomassa microalgal (a) extração de lipídeo em soxhlet (b) remoção do solvente em evaporador rotativo (c) óleo residual e extrativo aderido ao fundo do balão.
(a) (b)
(c)
Fonte: Própria.
2.15 Determinação da atividade antimicrobiana do óleo microalgale dos extrativos
A atividade antimicrobiana do óleo e dos extrativos foi avaliada por meio do método de disco difusão. Para avaliar a atividade antimicrobiana do óleo, os discos foram impregnados em gotículas remanescentes no balão após a evaporação do solvente. Como controle negativo foi utilizado hexano. Os extrativos foram solubilizados em 2 mL de solução Tween 20 a 20%. As soluções de extrativos (concentrada e diluída 1:10 e 1:100) foram esterilizadas por meio de filtração em membrana Millipore 0,20 µm. Como controle negativo foram utilizadas soluções estéreis de Tween 20 a 20% sem a adição de extrativos.
Os discos impregnados com o óleo e com as soluções de extrativos foram submetidos à secagem em estufa a 50oC com a finalidade de evaporar o solvente e a água residual. Após a secagem
foram colocados sobre a superfície do ágar das placas previamente semeadas com S. aureus com auxílio de pinça e pressionados para assegurar o contato completo e a dispersão do óleo e dos extrativos no ágar. As placas foram incubadas a 37oC por 18h e o halo de inibição formado foi medido com régua. Os testes foram realizados em triplicata.
3 RESULTADOS E DISCUSSÃO 3.1 Varredura
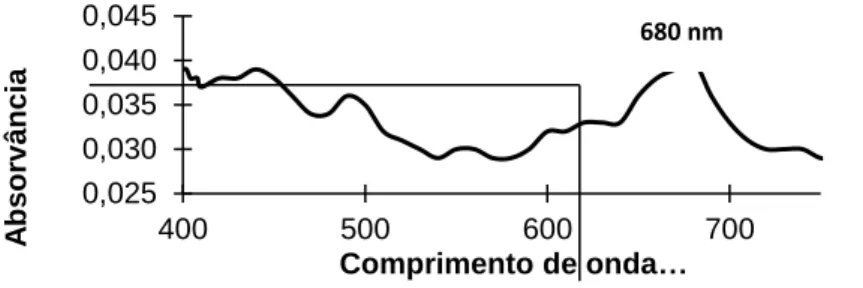
De acordo com a Figura 7, a região de máxima absorção de luz foi em 680 nm, portanto este foi o comprimento de onda utilizado para a determinação da concentração celular e construção da curva de crescimento.
Figura 7 - Espectro de varredura UV vis (400 a 750 nm) da suspensão de células da microalga C. minutissima.
3.2 Curva de calibração
A curva de calibração, o coeficiente de determinação (R²) e a equação da reta para a determinação da concentração de células da microalga C. minutissima podem ser observados na Figura 8.
Figura 8 - Curva de calibração para a determinação da concentração de células de C. minutissima em função da absorvância.
3.3 Perfil de crescimento da microalga C. minutissima
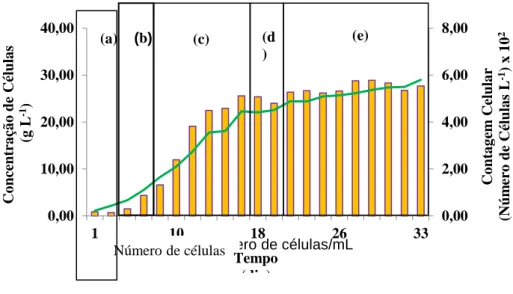
A curva de crescimento da microalga C. minutissima foi elaborada considerando a média dos valores obtidos a partir da triplicata da densidade celular (concentração de células) e da contagem celular. Embora os resultados referentes à contagem celular e à concentração de células tenham indicado o mesmo perfil de crescimento, a identificação das fases do crescimento da cultura foi melhor observada na curva de crescimento obtida por meio da contagem celular (Figura 9 a). Conforme o esperado, a curva de crescimento da microalga apresentou comportamento exponencial e típico de população microbiana em cultura descontínua (batelada). Foram identificadas 4 fases bem definidas: (i) fase de latência, (ii) fase exponencial, fase Log ou fase de crescimento / proliferação celular, (iii) fase de desaceleração, (iv) fase estacionária. A fase de morte celular não foi observada durante o período de experimentação.
0,025 0,030 0,035 0,040 0,045 400 500 600 700 A b sorv ância Comprimento de onda… y = 30,781x - 0,1022 R² = 0,9991 0,00 5,00 10,00 15,00 20,00 25,00 0,00 0,20 0,40 0,60 0,80 Co ncent ra çã o Celula r (g L -1) Absorvância… 680 nm
A fase de adaptação da C. minutissima apresentou curta duração e foi praticamente imperceptível pela determinação por espectrofotometria (Figura 9). Esta situação se deve ao fato do inóculo utilizado ter a mesma composição do meio de cultivo. Por outro lado, a determinação por contagem celular indicou um período de adaptação em torno de 2 dias. Essa divergência de resultados pode ser justificada pela baixa concentração de células aliada à sensibilidade do equipamento. Resultados semelhantes foram observados por Machado (2011) que reportou que a fase de latência da microalga Chlorella sp. crescida em meio Watanabe e em água residuária de petróleo foi de aproximadamente 2 dias.
Figura 9 - Perfil de crescimento da microalga C. minutissima durante 33 dias de cultivo em meio F/2 considerando a média das triplicatas (a) fase de adaptação celular, (b) fase de aceleração do crescimento (c) crescimento exponencial (d) fase de desaceleração e (e) fase estacionária.
Figura 10 - Esquema do fotobiorreator e identificação da zona de iluminação (1), zona intermediária (2) e zona de escuro (3). Fonte: Própria. 0,00 2,00 4,00 6,00 8,00 0,00 10,00 20,00 30,00 40,00 1 10 18 26 33 Co nta g em Celula r (Núm er o de Célula s L -1) x 1 0 2 Co ncent ra çã o de Célula s (g L -1) Número de células/mL (a) (b) (c) (d ) (e)
Número de células Tempo (dia)
Como resultado, tem-se a fase de morte celular, quando o metabolismo não pode ser mais mantido. Neste trabalho, o início da fase estacionária foi identificado a partir do 15º dia de cultivo, estendendo-se até o final do experimento (33 dias, Figura 9). Não foi observada a fase de morte celular.
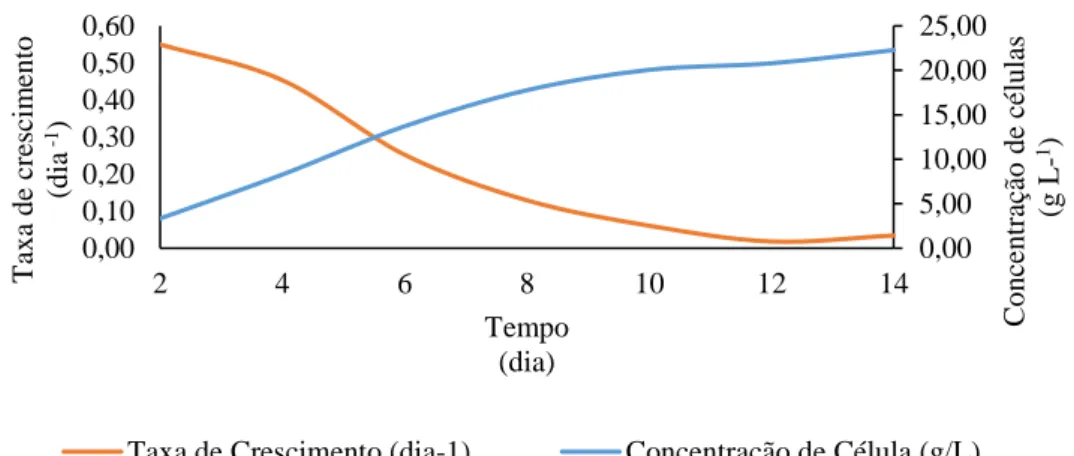
A Figura 11 apresenta a taxa de crescimento celular da microalga C. minutissima e a concentração de células em função do tempo de cultivo relativo à fase de crescimento exponencial. A Tabela 2 apresenta os valores referentes à concentração de células, produtividade, taxa de crescimento e taxa de geração diária, também na fase de crescimento exponencial.
Figura 11 - Taxa de crescimento da microalga C. minutissima e concentração de células durante a fase de crescimento exponencial.
Conforme o previsto, a taxa de crescimento foi inversamente proporcional à concentração de células no meio de cultivo (Figura 11), indicando que, embora as células apresentem crescimento exponencial nesta fase, a velocidade de crescimento reduz ao longo do tempo. Além disso, a taxa de duplicação diária observada no primeiro dia de cultivo (0,94 dia-1) foi cerca de 15 vezes maior quando comparada à taxa de duplicação do final da fase exponencial (0,06 dia-1), indicando redução do número de duplicações (Tabela 2). Os valores de produtividade (Tabela 2) corroboram com os resultados acima, uma vez que a produtividade foi crescente nos primeiros 7 dias de cultivo, apresentando declínio entre o 8º e o 14º dias.
0,00 5,00 10,00 15,00 20,00 25,00 0,00 0,10 0,20 0,30 0,40 0,50 0,60 2 4 6 8 10 12 14 C o n ce n tr aç ão d e cé lu las (g L -1) T ax a d e cr escim en to (d ia -1) Tempo (dia)
Tabela 2 - Produtividade, taxa de crescimento e taxa de geração diários para o cultivo da microalga C. minutissima durante a fase de crescimento exponencial.
Tempo (dias) Concentração de células (g L-1) P (g L-1 dia-1) r (dia-1) k (dia-1) 0 1,09 ± 0,04 - - - 1 2,09 ± 0,12 1,01 ± 0,08 0,65 ± 0,02 0,94±0,03 2 3,26 ± 0,12 1,09 ± 0,04 0,44 ± 0,02 0,64±0,03 3 5,33 ± 0,27 1,41 ± 0,08 0,49 ± 0,02 0,71±0,02 4 8,12 ± 0,26 1,76 ± 0,07 0,42 ± 0,06 0,61±0,09 5 10,75 ± 0,38 1,93 ± 0,07 0,28 ± 0,03 0,41±0,04 6 13,15 ± 0,80 2,01 ± 0,13 0,20 ± 0,05 0,29±0,07 7 15,31 ± 1,12 2,03 ± 0,15 0,15 ± 0,02 0,22±0,02 8 16,92 ± 1,21 1,98 ± 0,15 0,10 ± 0,00 0,14±0,00 9 18,79 ± 1,12 1,97 ± 0,12 0,11 ± 0,05 0,15±0,07 10 20,46 ± 0,81 1,94 ± 0,08 0,09 ± 0,03 0,12±0,04 11 20,21 ± 0,77 1,74 ± 0,07 0,01 ± 0,01 0,01±0,01 12 20,38 ± 1,00 1,64 ± 0,08 0,02 ± 0,01 0,02±0,01 13 21,66 ± 0,57 1,58 ± 0,04 0,06 ± 0,04 0,09±0,06 14 22,55 ± 0,54 1,53 ± 0,08 0,04 ± 0,01 0,06±0,01
P: produtividade; r: taxa de crescimento; k: taxa de geração
3.4 Perfil de crescimento celular e síntese de clorofila pela microalga C. minutissima
Foi observada a produção tanto de clorofila a quanto de clorofila b pela microalga C.
minutissima, de modo que a produção de clorofila b foi maior do que a de clorofila a ao longo do
período experimental (Figura 12). Este resultado se opõe aos resultados reportados por Lv et al. (2017), Mera, Torres e Abalde (2016) e Ördög et al. (2012) que indicaram maior produção de clorofila
a em relação a clorofila b por Chlorococcum sp., Chlamydomonas moewusii e C. minutissima,
respectivamente. A produção de clorofilas pode variar de acordo com a espécie de microalga e condições de cultivo. No presente trabalho foi utilizada iluminação horizontal em ciclo de 24h e meio de cultivo F/2. Por outro lado, Ördög et al. (2012) cultivou as células microalgais em meio nutriente
Tamiya em ausência de nitrogênio, utilizando iluminação vertical (na parte inferior dos cultivos) em ciclo de 14:10h claro/escuro.
A síntese máxima de ambas as clorofilas ocorreu entre o 18º e o 20º dia de cultivo, próximo ao início da fase estacionária (Figura 12). Estes resultados estão alinhados com as observações de Ferreira e Sant’anna (2017). Mera Torres e Abalde (2016) reportaram elevada produção de clorofila
a e clorofila b após 11 dias de cultivo. Da mesma forma, Lv et al. (2017) reportaram aumento da
produção desses pigmentos até o 15º dia de cultivo. Após o 20º dia de cultivo, foi observada a queda da produção de clorofila. Este fato pode ser explicado pela limitação de nutrientes disponíveis no meio de cultivo e também pelo sombreamento das células na região de escuro no fotobiorreator.
Figura 12 - Variação da concentração de clorofila a e clorofila b durante o período de crescimento da microalga C. minutissima.
3.5 Determinação da atividade antimicrobiana do óleo e dos extrativos a partir da biomassa microalgal
A atividade antimicrobiana foi determinada pela menor concentração de agente antimicrobiano necessário para inibição do microrganismo testado. Esse valor é denominado concentração inibidora mínima (CIM). A determinação da CIM em meio sólido consiste na adição de discos de papel filtro impregnados com agente antimicrobiano em placas de Petri preenchidas com ágar. Durante o período de incubação o agente se difunde do disco para o ágar, estabelecendo um gradiente de concentração. Quanto maior o halo formado ao redor do disco, maior é a capacidade de inibição do agente antimicrobiano (MADIGAN; MARTINKO; BENDER, 2016). Os valores da medida do halo de inibição referentes à triplicata dos testes realizados com o óleo e com as soluções de extrativos estão listados na Tabela 3.
0,0 1,0 2,0 3,0 4,0 5,0 0 10 20 30 1 3 4 5 6 10 12 13 14 16 18 20 23 26 28 30 31 33 Co ncent ra çã o de clo ro fila (g L -1) Co ncent ra çã o de cé lul a s (g L -1) Tempo (dia)
Uma vez que a quantidade de óleo obtido foi ínfima, mas suficiente para impregnar os discos, não foi possível calcular o rendimento. Moraes (2019) realizou a extração de óleo da microalga
Haematococcus pluvialis pelo método de Bligh e Dyer (1959) utilizando solvente clorofórmio:
metanol (1:1 v/v) onde obteve conteúdo lipídico significativo em peso seco: 0,113 ± 0,02g (16%) em fase vegetativa e 0,076 ± 0,02g (11%) em fase cística.
No presente estudo, o óleo da microalga C. minutissima apresentou efeito inibitório no crescimento da bactéria S. aureus, conforme ilustrado na Figura 13 a, b e c. Fato não observado nos controles (hexano). Não foram encontrados estudos na literatura que reportassem a avaliação da atividade antimicrobiana do óleo puro de microalgal. Os estudos reportados tratam da avaliação da atividade dos extratos.
Ördög et al. (2012) reportaram inibição do crescimento de S. aureus por extrato metanólico, rico em compostos fenólicos, obtido a partir da microalga Spirulina. Por outro lado, as bactérias
Pseudomonas aeruginosa e Escherichia coli não apresentaram redução ou inibição do crescimento
em presença desse extrato. De acordo com os autores, o S. aureus (gram positivo) foi susceptível à ação do extrato devido à menor complexidade de sua parede celular quando comparado à P.
aeruginosa e E. coli (gram negativos). Kellam e Walker (1989) avaliaram a atividade antibacteriana
de extrato metanólico e de hexano de 132 microalgas marinhas contra 6 bactérias. As cepas de E.
coli, P. aeruginosa, Streptococcus faecalis e Klebsiella pneumoniae não foram inibidas pelos
extratos. Por outro lado, S. aureus e B., subtilis apresentaram inibição, em maior parte, pelos extratos obtidos a partir da extração com hexano.
Embora as soluções de extrativos (concentrada e diluída 1:10) tenham apresentado efeito inibitório, não é possível afirmar que essa atividade esteja relacionada somente aos compostos solúveis no solvente. De acordo com a Figura 13 d a l, os controles (solução Tween 20 a 20%) apresentaram a formação de um halo de inibição fraco. O Tween 20 é um agente detergente (surfactante) que possui a propriedade de dispersar agentes oleosos em soluções aquosas (Nascimento et al., 2007). De acordo com Tortora et al. (2012) detergentes podem agir como agentes bacteriolíticos, danificando a membrana plasmática das células microbianas, resultando em lise celular. Não obstante, além dos extrativos, pequena quantidade de óleo foi dispersa na solução de extrativos. Desta forma, a inibição pode ter sido causada tanto pelo detergente Tween 20, quanto pelo óleo microalgal ou ainda pelo sinergismo entre ambos.
Tabela 3 - Inibição do crescimento de S. aureus pelo óleo e extrativos da microalga C. minutissima. Halo de Inibição (mm) Óleo Solução de extrativos Concentrada Diluída 1:10 Diluída 1:100 12,00 10,00 10,00 - 12,00 10,00 10,00 - 11,50 10,00 10,00 - Fonte: Própria.
Figura 13 - Atividade antimicrobiana do óleo (a, b, c) solução de extrativos concentrada (d, e, f), solução de extrativos diluída 1:10 (g, h, i) e 1:100 (j, k, l).
Óleo
Extrativos Solução concentrada Solução Diluída
(1:10)
Solução Diluída (1:100)
(a) (d) (g) (j)
(c) (f) (i) (l)
Fonte: Própria.
4 CONCLUSÃO
De acordo com os resultados obtidos, para fins de produção de biomassa, a microalga C.
minutissima deve ser cultivada durante 15 dias, uma vez que foi identificada a queda da produtividade
após este período. Por outro lado, para a obtenção de clorofila é indicado que o cultivo seja realizado por cerca de 18 dias. Conclui-se positivamente pela confirmação da atividade antimicrobiana do óleo e dos extrativos obtidos a partir da microalga C. minutissima frente à cepa de S. aureus testada.
REFERÊNCIAS
ALVES, R. S. & SOUZA, A. S., 2014, Comparação entre métodos de extração de óleo de microalgas.
Revista Iniciação Científica, vol. 12, n. 1, p. 43–54.
BLIGH, E. Graham; DYER, W. Justin. A rapid method of total lipid extraction and purification. Canadian journal of biochemistry and physiology, v. 37, n. 8, p. 911-917, 1959. BRENNAN, L. & OWENDE, P., 2010, Biofuels from microalgae-A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable and Sustainable
Energy Reviews, vol. 14, n. 2, p. 557–577.
BREUER, K., HÄUSSLER, S, KAPP, A. & WERFEL, T., 2002, Staphylococcus aureus: Colonizing features and influence of an antibacterial treatment in adults with atopic dermatitis. British Journal
of Dermatology, vol. 147, n. 1, p. 55–61.
BROWN, M. R., 1991, The amino-acid and sugar composition of 16 species of microalgae used in mariculture. Journal of Experimental Marine Biology and Ecology, vol. 145, p. 79–99.
CASTRO, A. P. M., SOLÉ, D.,FILHO, N. A. R., JACOB., C. M. A., RIZZO, M. C., FERNANDES, M. F. M. & VALE, S. O. R., 2006, Dermatite Atópica-opinião conjunta de especialistas em alergologia da Associação Brasileira de Alergia e Imunopatologia e da Sociedade Brasileira de Pediatria. Revista brasileira de alergia imunopatologia, vol. 29, n. 6, p. 268–282.
CAVALCANTI, V. L. R., MOTA, R., A., CARVALHO, J.,C.,M., PORTO, A.,L.,F., MARQUES, D., A., V. & BEZERRA, R., P., 2013, Atividade antimicrobiana do extrato de Chlorella vulgaris frente a cepas de mastite bovina. XIII Jornada de ensino, pesquisa e extensão. Anais. Recife, p. 16-18.
CHEN, M., SCHLIEP, M., WILLOW, R.D., CAI, Z., NEILAN, B. A. & SCHEER, H., 2010, A Red-Shifted Chlorophyll. Science, vol. 329, n. 5997, p. 1318–1319.
CHRISTENSON, L. & SIMS, R., 2011, Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts. Biotechnology Advances, vol. 29, p. 686-702.
CLINICAL AND LABORATORY STANDARDS INSTITUTE CLSI, 2003, Padronização dos testes de sensibilidade a antimicrobianos por disco-difusão, vol. 20, ed. 8°.
CUNHA, B. A., 2001, Antibiotic side effects: General review. Medical clinics of North America, vol. 85, n.1.
DOMINGUEZ, Herminia (Ed.). Functional ingredients from algae for foods and nutraceuticals. Elsevier, 2013.
FERREIRA, V. DA S. & SANT’ANNA, C., 2017, Impact of culture conditions on the chlorophyll content of microalgae for biotechnological applications. World Journal of Microbiology and
Biotechnology, vol. 33, n. 1, p. 1–8.
FREITAS, B. C. B., MORAIS, M. G. & COSTA, J. A. V., 2017, Chlorella minutissima cultivation with CO2 and pentoses: Effects on kinetic and nutritional parameters. Bioresource Technology, vol.
244, p. 338–344.
GUILLARD, R. R. L. & RYTHER, J. H., 1962, Studies of marine planktonic diatoms. I. Cyclotella
nana Hustedt and Detonulaconfervacea. Canadian Journal of Microbiology, vol. 8, p. 229–239.
GUIMARÃES, Bruna da Silveira et al. Estudo da cinética de crescimento da Microalga Scenedesmus sp. em meios de cultivo salobros. 2016.
GYAWALI, R. & IBRAHIM, S. A., 2014, Natural products as antimicrobial agents. Food Control, vol. 46, p. 412–429.
HANIFIN, J. & G., R., 1980, Diagnostic Features of Atopic Dermatitis. Acta Derm Venereol. vol.
HUANG, J. T., ABRAMS, M., TLOUGAN, B., RADEMAKER, A. & PALER, A., S., 2009, Treatment of staphylococcus aureus Colonization in Atopic Dermatitis Decreases Disease Severity.
Pediatrics, vol. 123, n. 5, p. 808–814.
HUMPHREY, B. B., 1980, Chlorophyll. Food Chemistry, vol. 5, p. 57–67.
JEFFREY, S. W. & HUMPHREY, G. F., 1975, New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochemie und
Physiologie der Pflanzen, vol. 167, n. 2, p. 191–194.
KELLAM, S. J. & WALKER, J. M., 1989, Antibacterial activity from marine microalgae in laboratory culture. British Phycological Journal, vol. 24, n. 2, p. 191–194.
LV, J.; GUO, J.; FENG, J.; LIU, Q. & XIE, S. 2017, Effect of sulfate ions on growth and pollutants removal of self-flocculating microalga Chlorococcum sp. GD in synthetic municipal wastewater.
Bioresource Technology, vol. 234, p. 289–296.
MACHADO, M. F., 2011, Cultivo de microalgas (Chlorella sp. e Ankistrodesmus sp. -
Chlorophyceae) em água residuária suplementada com uréia e CO2. [s.l.] Universidade Federal de
Viçosa.
MADIGAN, M., MARTINKO, J. & BENDER, K., 2016, Microbiologia de Brock.; In: Artmed vol. 14, p. 151-155.
MARQUES, J. G., SOARES, A. & D’ALESSANDRO, E., 2014, Avaliação do perfil de pigmentos na biomassa seca e no biodiesel produzido a partir das microalgas Acutodesmus sp. e Chlorella sp.
IISimpósio de Bioenergia e Biocombustíveis do Mercosul. Anais Foz do Iguaçu.
MERA, R., TORRES, E. & ABALDE, J., 2016, Effect of sodium sulfate on the freshwater microalga
Chlamydomonas moewusii: Implications for the optimization of algal culture media. Journal of
Phycology, vol. 52, n. 1, p. 75–88.
MORAES, Laenne Barbara Silva de. Uso de métodos físicos na otimização da extração lipídica
de Haematococccus pluvialis produzida em cultivo mixotrófico visando a obtenção de proteínas e astaxantina da biomassa residual. 2019. Dissertação de Mestrado. Universidade Federal de
Pernambuco.
MULDERS, K. J. M., LAMERS, P. & MARTENS, D., 2014, Phototrophic pigment production with microalgae: Biological constraints and opportunities. Journal of Phycology, vol. 50, n. 2, p. 229– 242.
NASCIMENTO, P. F. C., NASCIMENTO, A. C., RODRIGUES, C. S., ANONIOLLI, A. R., SANTOS, P. O., JUNIOR, A. M. & TRINDADE, R. C., 2007, Atividade antimicrobiana dos óleos essenciais: una abordagem multifatorial dos métodos. Revista Brasileira de Farmacognosia, vol. 17, n. 1, p. 108–113.
NICOLETTI, M., 2016, Microalgae Nutraceuticals. Foods, vol. 5, n. 54, p. 1–13.
ÖRDÖG, V., STIRK, W. A., BALINT, O., STADEN, J. V. & LOVÁSZ, C., 2012, Changes in lipid, protein and pigment concentrations in nitrogen-stressed Chlorella minutissima cultures. Journal of
Applied Phycology, vol. 24, n. 4, p. 907–914.
PARISI, A. S., YOUNES, S. & COLLA, M., 2009, Avaliação da atividade antibacteriana da microalga Spirulina platensis. Revista de Ciências Farmacêuticas Básica e Aplicada, vol. 30, n. 3, p. 297–301.
PULZ, O. & GROSS, W., 2004. Valuable products from biotechnology of microalgae. Applied
Microbiology and Biotechnology, vol. 65, n. 6, p. 635–648.
RAI, A., 1995, Relationship of combined nitrogen sources to salt tolerance in freshwater cyanobacterium Anabaena doliolum freshwater cya no bacterium Anabaena doliolum. Journal of
Applied Microbiology, vol. 78,n. 3, 501-506.
RIOS, J. L., RECIO, M. C. & VILLAR, A., 1988, Screening methods for natural products with antimicrobial activity: A review of the literature. Journal of Ethnopharmacology, vol. 23, n. 2–3, p. 127–149.
RUSSO, D. A. M. T. 2011, Estudo do crescimento da microalga Chlorella vulgaris numa água residual tratada, sob diferentes condições de fotoperíodo e temperatura. (Doctoral dissertation,
Faculdade de Ciências e Tecnologia), p. 1–111.
SERIVE, B., NICOLAU, E., BERARD, J., KAAS, R., PASQUET, V., PICOT, L. & CADORET, J., 2017, Community analysis of pigment patterns from 37 microalgae strains reveals new carotenoids and porphyrins characteristic of distinct strains and taxonomic groups. PloS one, vol. 12, n. 2. STREIT, Nivia Maria et al. As clorofilas. Ciência Rural, v. 35, n. 3, p. 748-755, 2005.
TAKAGI, M., KARSENO & YOSHIDA, T., 2006, Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgae Dunaliella cells. Journal of
Bioscience and Bioengineering, vol. 101, n. 3, p. 223–226.
TAVARES, W., 2002, Problem gram-positive bacteria: Resistance in staphylococci, enterococci and
pneumococci to antimicrobial drugs”. Revista da Sociedade Brasileira de Medicina Tropical, vol.
35, n. 4, p. 409.
TORTORA, G.J., FUNKE, B.R. & CASE, C.L., 2012, Microbiologia. In: Artmed, vol. 10, p. 157-205.
ZORN, S. M. F., PEDRO, G. A., AMARAL, M. S., LOURES, C. C. A. & SILVA, M. B., 2017, Avaliação Dos Fatores Envolvidos Na Extração De Lipídios Da Biomassa Da Microalga Chlorella