AVALIAÇÃO
DA
RESPOSTA
IMUNE
DE
CAMUNDONGOS
BALB/c
VACINADOS
COM
ANTÍGENO
DE
Leishmania
chagasi
DURANTE
UM
PERÍODO
DE
DESNUTRIÇÃO
PROTÉICO
‐
CALÓRICA
FUNDAÇÃO
UNIVERSIDADE
FEDERAL
DE
OURO
PRETO
Reitor
João Luiz Martins
Vice‐Reitor
Antenor Barbosa Junior
Pró‐Reitor de Pesquisa e Pós‐Graduação
Tanus Jorge Nagem
NÚCLEO DE PESQUISA EM CIÊNCIAS BIOLÓGICAS
Coordenador
Prof. Dr. Rogélio Lopes Brandão
PROGRAMA DE PÓS‐GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Coordenador
Prof. Dr. Deoclécio Alves Chianca Júnior
UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS‐GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
AVALIAÇÃO
DA
RESPOSTA
IMUNE
DE
CAMUNDONGOS
BALB/c
VACINADOS
COM
ANTÍGENO
DE
Leishmania
chagasi
DURANTE
UM
PERÍODO
DE
DESNUTRIÇÃO
PROTÉICO
‐
CALÓRICA
Guilherme Malafaia Pinto
Orientadora
Profª. Drª. Simone Aparecida Rezende
Co‐orientadora
Profª. Drª. Maria Lúcia Pedrosa
Colaborador
Prof. Dr. Marcelo Eustáquio Silva
Dissertação de Mestrado apresentada ao Programa
de Pós‐Graduação em Ciências Biológicas do
Núcleo de Pesquisas em Ciências Biológicas da
Universidade Federal de Ouro Preto como requisito
parcial à obtenção do Título de Mestre em Ciências
Biológicas, área de concentração: Imunobiologia de
Protozoários.
Dedico esse trabalho à minha esposa
Aline, que com muito carinho, paciência e
amor me ajudou a conquistar mais esta
AGRADECIMENTOS
Primeiramente agradeço a Deus pelo seu amor imensurável e pelo seu cuidado todo especial
em todas as etapas da minha vida.
Ao avô Nilo e à avó Nilza por tudo que fizeram por mim, pelos esforços sem medida e por
me ensinarem que tudo na vida é uma questão de vontade, trabalho árduo e
determinação. À minha mãe Sônia e ao meu pai Célio por todo apoio a mim dispensado
e, principalmente, por terem me dado a vida.
À Aline, que sempre foi e sempre será o grande amor da minha vida, por todas as vezes em
que me ajudou a solucionar os meus problemas de uma forma mais simples, por todas as
palavras de motivação, pelo companheirismo, cuidado, amor, amizade e por ser o meu
alicerce. Agradeço também a minha segunda família (D. Maria, Sr. Jonas e Júnior) pela
acolhida, confiança e apoio.
Aos meus amigos, em especial à Régia, Fernanda, Claudinha e Bruno pelos estímulos
essenciais para o desenvolvimento deste trabalho.
À minha orientadora, Profª. Drª. Simone Aparecida Rezende, por ter acreditado em mim,
possibilitando que um grande sonho em minha vida começasse a se tornar real. Além
disso, agradeço pelos estímulos em todas as etapas deste trabalho e por me fazer
acreditar que posso ir muito mais além.
Aos colegas do Laboratório de Imunoparasitologia que sempre têm um motivo para
inúmeras conversas e gargalhadas, em especial ao Eduardo, Roberta, Fernanda e Tiago.
À Profª. Drª. Maria Lúcia Pedrosa pela confiança, amizade, privilégio de poder compartilhar
sua sabedoria e pela co‐orientação, tão importante para o delineamento e execução
deste trabalho.
Ao professor Dr. Marcelo Eustáquio Silva por ter disponibilizado, sem ressalvas, o
Laboratório de Nutrição Experimental, contribuindo para a realização deste trabalho.
À estimada Cida, pela atenção dispensada nos momentos que necessitei de seus préstimos e
pelo incentivo. Em suma, sou grato a todas as pessoas que, mesmo em sua mais breve
passagem ou curta convivência me ofereceram sua contribuição, de qualquer natureza,
LISTA
DE
FIGURAS
Figura I.1 ‐ Diagrama esquemático ilustrando a influência da desnutrição protéico‐calórica
sobre o sistema imunológico e, consequentemente, sobre o agravamento do quadro
clínico das doenças ... 03
Figura I.2 ‐ Crianças com leishmaniose visceral provocada por L. donovani apresentando hepatoesplenomegalia (Estado de Bihar, Índia)... 05
Figura I.3 ‐ Infecção in vitro de macrófagos com o parasito L. donovani. (A) Duas formas
promastigotas flageladas (seta) em contato com macrófago humano... 08
Figura I.4 ‐ Ciclo de vida dos parasitos do gênero Leishmania... 09
Figura III.1 ‐ Separação dos grupos experimentais... 20
Figura III.2 ‐ Curva de crescimento de L. chagasi em Grace´s Insect Medium 10% de SFB, cultivada em estufa a 25°C. ... 27
Figura III.3 ‐ Sítio de vacinação por via subcutânea (circulado) na região da base da cauda dos
camundongos... 28
Figura III.4 ‐ Sítio de inoculação de parasitos (circulado) nos animais estudados... 29
Figura IV.1 ‐ Variação da massa corpórea ao longo do período experimental... 34
Figura IV.2 ‐ Aspecto visual dos animais dos grupos controle (A) e desnutrição (B) registrado na 9ª
semana experimental, antes do início da recuperação nutricional... 36
Figura IV.3 ‐ Aspecto visual dos animais do grupo controle (A) e desnutrição (B) sacrificados ao final do
experimento... 37
Figura IV.4 ‐ Massa (g) do fígado (A) e baço (B) dos animais dos grupos controle e desnutrição
determinada no final do experimento... 37
Figura IV.5 ‐ Curva de sobrevivência dos animais dos grupos controle e desnutrição ao longo do
período experimental... 39
Figura IV.6 ‐ Concentração sérica de proteínas totais dos animais dos grupos controle e desnutrição. 41
Figura IV.7 ‐ Concentração sérica de albumina dos animais dos grupos controle e desnutrição... 44
Figura IV.8 ‐ Concentração sérica de globulinas dos animais dos grupos controle e desnutrição, ao
longo do período experimental... 48
Figura IV.9 ‐ Concentração de hemoglobina no sangue dos animais do grupo controle e desnutrição,
ao longo do período experimental. ... 50
Figura IV.11 ‐ Carga parasitária esplênica dos camundongos dos grupos controle e desnutrição... 55
Figura IV.12 ‐ Produção de IFN‐γ pelos esplenócitos de camundongos dos grupos controle e
desnutrição... 60
Figura IV.13 ‐ Produção de IL‐4 pelos esplenócitos de camundongos dos grupos controle e
desnutrição ... 61
LISTA
DE
TABELAS
E
QUADROS
Tabela I.1 ‐ Principais estratégias vacinais contra a leishmaniose visceral ... 10
Tabela III.1 ‐ Informações gerais sobre a dieta comercial (Nuvilab CR‐1) ... 22
Tabela III.2 ‐ Composição das dietas experimentais em gramas para cada 1000 g da dieta ... 23
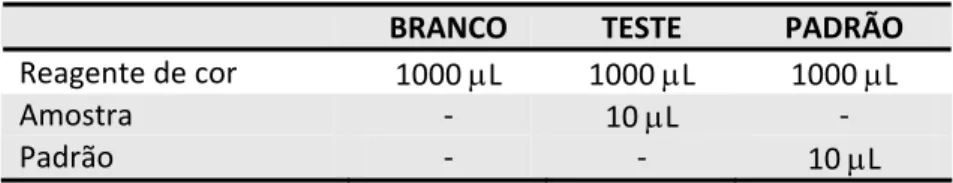
Tabela III.3 ‐ Quantidade de cada componente necessário à avaliação sérica de proteínas... 24
Tabela III.4 ‐ Quantidade de cada componente necessário à avaliação sérica de albumina ... 25
Tabela III.5 ‐ Quantidade de cada componente necessário à avaliação sanguínea de hemoglobina ... 26
Quadro III.1 ‐ Protocolo de vacinação utilizado... 28
Tabela IV.1 ‐ Resultados dos testes estatísticos para a concentração sérica de proteínas totais dos animais dos grupos controle e desnutrição, antes e após a vacinação ... 42
Tabela IV.2 ‐ Resultados dos testes estatísticos para a concentração sérica de albumina dos animais dos grupos controle e desnutrição, antes e após a vacinação... 45
Tabela IV.3 ‐ Resultados dos testes estatísticos para a concentração sérica de globulinas dos animais dos grupos controle e desnutrição, antes e após a vacinação... 49
Tabela IV.4 ‐ Resultados dos testes estatísticos para a concentração sanguínea de hemoglobina dos animais dos grupos controle e desnutrição, antes e após a vacinação... 51
LISTA
DE
SIGLAS
E
ABREVIATURAS
ABTS – 3‐etilbenzil‐thiazol‐6‐sulfônico
AGL – Ácido graxo livre
Ag. Part. L. chagasi + saponina – Antígeno particulado de L. chagasi associado à saponina
CB – Circunferência do braço
CREN – Centro de Recuperação e Educação Nutricional
DMEM – Meio Esssencial Mínimo Dulbecco
DPC – Desnutrição protéico‐calórica
DAT – Teste de hipersensibilidade direta
DTH – Teste de hipersensibilidade tardia
ELISA – Enzyme Linked Immuno Sorbent Assay (Ensaio imunoenzimático) FAO – Organização das Nações Unidas para Alimentação e Agricultura
FUNASA – Fundação Nacional de Saúde
gp: Glicoproteína
Hi – Hemiglobina
HiCN – Cianeto de hemoglobina
IFN‐γ – Interferon gama IL‐4 – Interleucina 4
IMC – Índice de massa corpórea
iNOS – Enzima óxido nítrico sintase induzível
IZINCG – International Zinc Nutrition Consultative Group
KMP‐11 – Proteína 11 de menbrana de kinetoplástidos
LC – Leishmaniose cutânea
LCR1 – Antígeno flagelar 1 de L. chagasi
LV – Leishmaniose visceral
NK – Natural Killer
OMS – Organização Mundial da Saúde
ONU – Organização das Nações Unidas
PBS – Solução salina tamponada com fosfato
PCR – Reação em cadeia da polimerase
RIFI – Reação de imunoflourescência indireta
rIFN‐γ – Interferon gama recombinante
RMBH – Região Metropolitana de Belo Horizonte
RT‐PCR – Reação em cadeia polimerase após transcrição reversa
Sb+5 – Antimoniais pentavalentes
SDS – Metaloenzimas superóxido dismutases
SFB – Soro fetal bovino
SINAN – Sistema de Informação de Agravos de Notificação
Th – Linfócito T “Helper” TNF – Fator de necrose tumoral
RESUMO
A desnutrição protéico‐calórica (DPC), as deficiências dos elementos ferro e zinco e a
leishmaniose visceral (LV ou calazar) constituem importantes problemas de saúde pública, os
quais afetam milhões de pessoas no mundo todo. Apesar de ser amplamente aceito que a
imunidade ou a susceptibilidade a doenças infecto‐parasitárias estão diretamente
relacionadas com o estado nutricional do hospedeiro, os mecanismos que governam a
relação entre a PEM e a LV são múltiplos e pouco explorados. Especificamente sobre os
efeitos da DPC sobre a vacinação contra a LV, nenhum estudo foi encontrado. Assim, foi
avaliado neste estudo os efeitos da DPC associada à deficiência de ferro e zinco na resposta
imune de camundongos BALB/c induzida pela vacinação com antígeno de Leishmania
chagasi administrada durante um período de deficiência nutricional. Inicialmente os animais
foram divididos em dois grupos: desnutrição (alimentados com dieta contendo 3% de
caseína e deficiente em ferro e zinco) e controle (alimentados com dieta contendo 14% de
caseína, contendo concentrações adequadas de ferro e zinco). Após o estabelecimento da
desnutrição (avaliada através do acompanhamento semanal da massa corpórea e da
medição de parâmetros bioquímicos: concentração de proteínas totais, albumina, globulinas
e hemoglobina), os animais receberam os tratamentos. Camundongos dos grupos controle e
desnutrição foram inoculados com solução salina tamponada com fosfato (PBS), saponina
(adjuvante vacinal) ou com antígeno (Ag) de L. chagasi + saponina (vacina) (três doses dos
tratamentos e da vacina foram aplicadas nos animais pela via subcutânea com uma semana
de intervalo). Após uma semana da vacinação, os camundongos desnutridos foram
recuperados nutricionalmente e quatro semanas após a terceira dose da vacina, todos os
animais foram desafiados com 1 x 107 formas promastigotas de L. chagasi pela vida
endovenosa. Quatro semanas após o desafio, os camundongos foram sacrificados e a carga
parasitária hepática e esplênica, bem como a produção das citocinas IFN‐γ e IL‐4 e de óxido
nítrico (NO) por esplenócitos, foram determinadas. Foi observado que a vacina de Ag de L.
chagasi + saponina causou uma redução significativa na carga parasitária hepática e
esplênica nos animais do grupo controle (redução de 96,1% e 94,9%, respectivamente).
Entretanto, nos camundongos vacinados durante a DPC, a vacina causou uma menor
redução) quanto do baço (81,4% de redução). Além disso, observou‐se que a vacina induziu
uma menor produção de IFN‐γ (estatisticamente significativa) nos animais do grupo
desnutrição em comparação com os animais do grupo controle. Com relação à IL‐4, foi
observado que a vacina suprimiu a produção da citocina nos animais do grupo controle e
desnutrição em comparação com os animais inoculados com PBS. Não foram detectados
níveis significativos de NO pelo método utilizado. Os dados deste estudo mostram que a
PEM associada à deficiência de ferro e zinco alteram a resposta imune de camundongos
BALB/c induzida pela vacina de Ag de L. chagasi + saponina, mesmo após a recuperação
nutricional. Considerando que é desejável o desenvolvimento de uma vacina eficaz contra a
LV e que a resposta imune às vacinas depende do estado nutricional dos indivíduos, este
estudo visa contribuir com o entendimento da relação existente entre a DPC e a LV.
Palavras‐chave: desnutrição protéico‐calórica, vacinação, Leishmania chagasi, leishmaniose
visceral, camundongo, recuperação nutricional, BALB/c, IFN‐γ, IL‐4
ABSTRACT
Protein‐energy malnutrition (PEM), zinc and iron deficiency, and visceral leishmaniasis (VL or
kala‐azar) are important problems of public health, which affect millions of people
worldwide. Despite accepted that the immunity or susceptibility to infectious diseases is
directly related with the nutritional status of the host, the immunologic mechanisms that
govern the relationship between the PEM and VL are multiple and little explained.
Specifically on the effect of combined protein, iron and zinc deficiency in the immune
response induced by a vaccine against VL, no study was found. Thus, this study evaluated the
effect of PEM in immune response (of BALN/c mice) induced by Leishmania chagasi antigen
vaccine administrated during a period of nutritional deficiency. Initially the mice were
divided into two groups: malnutrition (fed with diet containing 3% casein and deficient in
iron and zinc) and control (fed with diet containing 14% casein and sufficient in iron and
zinc). After malnutrition establishment (evaluated through the weekly measurement of total
body weight and determination of biochemical parameters: concentration of total proteins,
albumins, globulins and haemoglobin), the animals received the treatments. Control and
malnutrition mice were inoculated with phosphate buffered saline (PBS), saponin (adjuvant)
or with L. chagasi antigen plus saponin (vaccine) (three doses of the treatment and of the
vaccine were administrated by subcutaneous rout with a one week interval). One week after
vaccination, malnourished mice were nutritionally repleted and 4 weeks after the third
vaccine dose, all mice were challenged with 1 × 107 L. chagasi promastigotes given
intravenously in the lateral tail vein. Four weeks after challenge, mice were killed, and spleen
and liver parasite load as well as the production of IFN‐γ and IL‐4 and nitric oxide (NO) by
splenocytes, were determined. It was observed that L. chagasi antigen plus saponin vaccine
caused a significant reduction in parasite load in liver and spleen from mice of control group
(94.9% and 96.1% of reduction, respectively). However, in mice vaccinated during the PEM,
the vaccine caused a smaller reduction (statistical significant) in parasite load in liver (57.7%
of reduction) and in spleen (81.4% of reduction). Furthermore, it was observed that vaccine
induced a smaller production of IFN‐γ (statistical significant) in malnutrition mice in
vaccine suppressed the cytokine production in mice from control and malnutrition groups in
comparison with mice inoculated with PBS. NO was not detected by the method used. These
data suggest that PEM associated with iron and zinc deficiency may alter immune response
of BALB/c mice induced by L. chagasi + saponin vaccine, even after nutritional repletion.
Considering that VL may be one of a few parasitic diseases that are probably controllable by
vaccination and that the response to prophylactic vaccine depends on nutritional status, this
study seeks to contribute with the understanding of the relationship between PEM and VL.
Keywords: Protein‐energy malnutrition, vaccination, Leishmania chagasi, visceral
leishmaniasis, mice, nutritional repletion, BALB/c, IFN‐γ, IL‐4
SUMÁRIO
DEDICATÓRIA ... iv
AGRADECIMENTOS... v
LISTA DE FIGURAS... vi
LISTA DE TABELAS...viii
LISTA DE SIGLAS ... ix
RESUMO... xi
ABSTRACT ...xiii
APRESENTAÇÃO ...xvii
CAPÍTULO I – INTRODUÇÃO ... 01
1 – Desnutrição protéico‐calórica ... 01
1.1 – Aspectos gerais ... 01
1.2 – Desnutrição protéico‐calórica e sua relação com o sistema imune ... 02
2 – As leishmanioses ... 03
2.1 – Leishmaniose visceral: características gerais e epidemiológicas... 4
2.2 – Ciclo biológico dos parasitos do gênero Leishmania... 07
2.3 – Vacinas contra a leishmaniose: uma breve revisão ... 09
3 – O sinergismo entre a desnutrição protéico‐calórica e a leishmaniose visceral ... 13
4 – Deficiências de ferro e zinco e suas relações com a interação “parasito/hospedeiro” ... 16
CAPÍTULO II – OBJETIVOS ... 19
2.1 – Objetivo geral ... 19
2.2 – Objetivos específicos... 19
CAPÍTULO III – MATERIAL E MÉTODOS... 20
3.1 – Modelo animal ... 20
3.2 – Delineamento experimental ... 21
3.3 – Dietas experimentais... 22
3.4 – Avaliação nutricional dos animais ... 23
3.4.1 – Proteínas totais ... 24
3.4.2 – Albumina ... 25
3.4.4 – Hemoglobina ... 25
3.5 – Cultura de L. chagasi... 26
3.6 – Preparo da vacina de antígeno particulado de L. chagasi... 27
3.7 – Vacinação ... 28
3.8 – Inoculação dos camundongos ... 29
3.9 – Quantificação de parasitos... 29
3.10 – Obtenção de células mononucleares do baço para dosagem de citocinas e NO ... 30
3.11 – Dosagem de IFN‐γ, IL‐4 e NO... 31
3.12 – Análises estatísticas... 33
CAPÍTULO IV – RESULTADOS E DISCUSSÃO ... 34
4.1 – Avaliação da massa corpórea dos animais estudados ... 34
4.2 – Avaliação da massa corpórea dos animais recuperados nutricionalmente após a desnutrição protéico‐calórica ... 36
4.3 – Sobrevivência e mortalidade ao longo do período experimental... 39
4.4 – Avaliação dos parâmetros bioquímicos (concentração de proteínas totais, albumina, globulinas e hemoglobina) ... 41
4.4.1 ‐ Avaliação da concentração sérica de proteínas totais ... 41
4.4.2 ‐ Avaliação da concentração de albumina ... 43
4.4.3 ‐ Avaliação da concentração de globulinas... 47
4.4.4 ‐ Avaliação da concentração de hemoglobina ... 49
4.5 – Aspectos relacionados à avaliação da capacidade protetora da vacina e à avaliação da resposta imune ... 52
4.5.1 ‐ Avaliação da carga parasitária hepática e esplênica dos animais vacinados ... 53
4.5.2 ‐ Avaliação da produção das citocinas IFN‐γ e IL‐4 e de óxido nítrico por esplenócitos cultivados in vitro ... 59
CAPÍTULO V – CONCLUSÕES ... 64
CAPÍTULO VI – CONSIDERAÇÕES FINAIS... 66
CAPÍTULO VII – REFERÊNCIAS BIBLIOGRÁFICAS... 67
A desnutrição protéico‐calórica (DPC) e a leishmaniose visceral (LV) constituem
importantes problemas de saúde pública que afetam milhões de pessoas. Quando
analisados em conjunto, os índices epidemiológicos da LV e a prevalência da DPC são
responsáveis por milhões de mortes no mundo todo. No que se refere à DPC, grande
número de pesquisas tem sido conduzido em animais de laboratório permitindo maiores
esclarecimentos sobre os mecanismos complexos que regem as suas conseqüências e as
suas causas. Alguns autores induzem desnutrição nos animais durante a gestação,
diminuindo o teor protéico da dieta das fêmeas grávidas (Neggers & Singh, 2006; Millis &
Offiah, 2007), outros logo após o nascimento e durante a amamentação (Ferreira et al.,
2005), diminuindo o teor protéico da dieta oferecida à ninhada, e ainda outros após o
desmame como nos trabalhos recentes de Lyn et al. (2007), Xavier et al. (2007), Coutinho et
al. (2007), Borelli et al. (2007), Schuler et al. (2008), Fock et al. (2008), Chatraw et al. (2008)
e Vituri et al. (2008).
Entretanto, os mecanismos que relacionam a DPC e a infecção por parasitos
causadores da LV, tampouco entre a DPC e a vacinação anti‐LV, ainda não estão totalmente
compreendidos. Assim, este trabalho propôs um modelo experimental de DPC associada às
deficiências de ferro e zinco que se assemelha em muitos aspectos ao que acontece na
população infantil brasileira, com o intuito de avaliar a relação entre a DPC e a resposta
imune à vacina de antígeno de L. chagasi de camundongos BALB/c, vacinados durante um
período de DPC. A despeito da importância do problema, nenhum trabalho experimental
disponível na literatura, envolvendo as bases imunológicas entre a DPC e a LV, foi
encontrado.
A seguir serão apresentados os capítulos referentes ao presente estudo, os quais
abordarão de forma seqüencial uma revisão da literatura (na qual os aspectos gerais
relacionados com a LV e com a DPC, bem como os efeitos das deficiências de ferro e zinco
sobre o sistema imune, são descritos), os objetivos geral e específico do trabalho, a
metodologia empregada, os resultados e a discussão dos mesmos e, por fim, as conclusões.
Segue ainda um capítulo de considerações finais que antecede a lista de referências
1. Desnutrição protéico‐calórica
1.1. Aspectos gerais
Segundo Hughes & Kelly (2006), o termo desnutrição designa uma desordem
resultante de uma dieta inadequada devido a uma falha na absorção de elementos
dietéticos, ou ainda, com alguma freqüência, devido a um inadequado aproveitamento
biológico dos alimentos ingeridos, geralmente motivado pelo acometimento de doenças
infecciosas (Monteiro, 2003). A DPC, juntamente com a anemia e a deficiência de vitamina A,
representa um dos mais sérios problemas de saúde pública, apresentando grande influência
na qualidade de vida das populações (Castro et al., 2005).
A Organização das Nações Unidas para Alimentação e Agricultura (FAO) estimou em
2004 que 852 milhões de pessoas no mundo apresentavam desnutrição entre os anos de
2000 e 2002, sendo a maioria em países em desenvolvimento (FAO, 2004). Dados mais
recentes da OMS (2005b) mostram que, nestes países, a desnutrição é responsável, direta
ou indiretamente, por 54% das 10,8 milhões de mortes de crianças com idade inferior a 5
anos.
Projeções feitas pela Organização das Nações Unidas (ONU) sugerem que, por volta
do ano de 2025, 1 bilhão de pessoas, de uma população mundial estimada em 8 bilhões,
poderão sofrer de DPC. Enquanto em termos relativos tem‐se notado algum progresso nos
últimos 40 anos, em termos absolutos o número de desnutridos tem diminuído muito
pouco. A situação é particularmente preocupante na África, onde o crescimento
populacional excede a capacidade de produção de alimentos (de Onis et al., 2004).
No Brasil, os dados do Programa Mundial de Alimentos das Nações Unidas divulgados
em 2003, apontam o país como o detentor do maior número de pessoas com deficiência
nutricional da América do Sul: 15,6 milhões de pessoas, ou 8% da população (ONU, 2003).
Embora inquéritos populacionais realizados com a população envolvendo diferentes faixas
Coutinho et al. (2008) confirma o alto índice de desnutridos que ainda é identificado no país.
Ao realizarem uma análise do perfil nutricional da população brasileira, esses autores
concluíram que o conjunto de dados disponíveis sobre diferentes grupos etários confirma a
alta prevalência da DPC no país, principalmente em regiões mais pobres.
1.2. Desnutrição protéico‐calórica e sua relação com o sistema imune
A correlação entre as áreas de nutrição e imunologia, conforme discutido por Field et
al. (2002), foi formalmente reconhecida no início da década de 1970 quando medidas da
função do sistema imunológico foram introduzidas como componentes de avaliação do
estado nutricional de pacientes. Atualmente, tem sido amplamente aceito que a imunidade
ou a susceptibilidade a diversas doenças infecto‐parasitárias estão diretamente relacionadas
ao estado nutricional dos indivíduos. Segundo Schaible & Kaufmann (2007), a DPC é a causa
mais comum de imunodeficiência sendo usualmente complexas, freqüentemente
envolvendo não somente proteínas e calorias, mas também variados níveis de deficiências
de micronutrientes. Estes nutrientes incluem o fosfato, zinco, cobre, ferro, selênio e as
vitamina A, E e vitaminas do complexo B, capazes de influenciar diretamente a
susceptibilidade a diversas infecções humanas.
A DPC é capaz de causar várias alterações no sistema imunológico, as quais são
responsáveis por uma maior susceptibilidade a várias doenças. Chandra (1974) e Keusch et
al. (1987) relataram que crianças desnutridas apresentaram significativa diminuição da
função de células T e um aumento do número de células com falhas no processo de
diferenciação. Resultados similares foram relatados por Parent et al. (1994), os quais
observaram involução do timo em pacientes infantis desnutridos. Todos os componentes do
sistema do complemento – exceto o C4 – estão diminuídos em pacientes desnutridos,
particularmente o C3 e o fator B (Smythe et al., 1971; Sirisinha et al., 1973; Chandra, 1975).
Tanto a resposta imune celular quanto a resposta imune humoral são diretamente afetadas
em situações de DPC (Stiehn, 1980; Suskind, 1980; Mcmurray, 1981; Najera et al., 2004). Em
decorrência da involução do timo, que em geral ocorre mais precocemente no quadro de
DPC, tanto a estrutura quanto a função deste órgão são prejudicadas e, conseqüentemente,
a resposta de células T é reduzida (Najera et al., 2001; Savino, 2002). Outros estudos,
conforme discutido por Cunningham‐Rundles et al. (2005), demonstraram que a deficiência
Vários estudos demonstram que as deficiências nutricionais podem cronificar e/ou
agravar o quadro clínico de algumas doenças, tais como a tuberculose (Metcalfe, 2005), a
infecção pelo HIV (Centeville et al., 2005) e a LV (Harisson et al., 1986; Celf et al., 1987).
Outras doenças podem ser citadas: poliomielite, difteria, tétano, hepatite B e C, hanseníase,
dengue, encefalite japonesa e infecções intestinais por nematóides (OMS, 2005c). Além
disto, vários são os estudos que demonstraram que, além de agravar o quadro clínico de
diversas doenças infecto‐contagiosas, a DPC aumenta as chances de morte prematura em
crianças (Pelletier, 1991; Toole & Malkki, 1992; Man et al., 1998; Buitron et al., 2004). A
figura a seguir sumariza os principais efeitos da DPC sobre o sistema imunológico, os quais
podem agravar o quadro clínico de várias doenças.
Figura I.1. Diagrama esquemático ilustrando a influência da desnutrição protéico‐calórica sobre o sistema
imunológico e, consequentemente, sobre o agravamento do quadro clínico das doenças.
2. As leishmanioses
As leishmanioses constituem um grupo de doenças causadas por protozoários do
gênero Leishmania que afeta milhões de pessoas no mundo, podendo apresentar desde
lesões cutâneas até a forma visceral, a mais grave. Sabe‐se que o amplo espectro de formas
clínicas que pode ser visto nas leishmanioses está estreitamente associado às espécies de
Leishmania e ao estado imunológico do paciente (Desjeux, 2004; OMS, 2005a).
Segundo a Organização Mundial da Saúde (OMS), as leishmanioses ocorrem em 88
observada uma incidência anual de 1‐1,5 milhões de casos de leishmaniose cutânea (LC) e
cerca de 500 mil casos de LV, também conhecida como calazar. Mais de 90% dos casos de LC
ocorrem em países como Irã, Afeganistão, Síria, Arábia Saudita, Peru e Brasil. Com relação à
LV, cerca de 90% dos casos estão concentrados nas áreas rurais e suburbanas de países
como a Índia, Sudão, Bangladesh, Nepal e Brasil. Cerca de 350 milhões de pessoas estão sob
o risco de contrair a doença e estima‐se que um aumento significativo de casos em todo o
mundo poderá ocorrer nos próximos anos, principalmente em regiões tropicais e
subtropicais (Desjeux, 2004; OMS, 2005a; Bern et al., 2008). No Brasil, de acordo com
Gontijo & Melo (2004), em 19 dos 27 estados brasileiros já foram registrados casos
autóctones de LV, e de 1999 a 2004, ocorreram em média 3.500 casos humanos, sendo a
maioria na região Nordeste do país.
Conforme proposto por Levine et al. (1980), os parasitos causadores das
leishmanioses pertencem ao reino Protista, sub‐Reino Protozoa, filo Sarcomastigophora,
classe Zoomastigophora, ordem Kinetoplastida, família Trypanossomatidae e ao gênero
Leishmania. Os insetos vetores são fêmeas de dípteros flebotomíneos pertencentes ao
gênero Phlebotomus, exemplificado pela espécie Phlebotomus (Phlebotomus) papatasi no
Velho Mundo (Ready, 2000; Rogers & Titus, 2003). No Novo Mundo, os insetos vetores
pertencem ao gênero Lutzomyia, exemplificado pelas espécies Lutzomyia longipalpis e
Lutzomyia intermedia, principalmente em países como o Paraguai, Argentina e Bolívia
(Marcondes, et al., 1998; Silva & Gomes, 2001; Ferro, et al., 1995; Rogers & Titus, 2003). No
Brasil, a transmissão da LV se dá principalmente pela picada de fêmeas de insetos da espécie
Lu. longipalpis. A espécie está bem adaptada ao ambiente peridomiciliar, alimentando‐se em
uma grande variedade de hospedeiros vertebrados, incluindo animais domésticos e
silvestres, além do próprio ser humano (Monteiro et al., 2005).
2.1. Leishmaniose visceral: características gerais e epidemiológicas
A LV é uma doença causada por protozoários parasitos constituintes do complexo
Leishmania donovani que inclui três espécies de Leishmania: Leishmania donovani e
Leishmania infantum em países do Velho Mundo e Leishmania chagasi em países do Novo
Mundo (Laison & Shaw, 1987). Vale salientar que, a identidade desta última espécie tem
sido objeto de questionamento desde 1999, com base no estudo de Maurício et al. (1999) e
espécie. No Brasil, a LV é causada pela espécie L. chagasi, como descrito primeiramente por
Evandro Chagas em 1936 (Chagas, 1936) e apenas um estudo no Estado da Bahia relatou
casos de visceralização provocada por L. amazonensis (Barral et al., 1991). Na ocasião, foram
notificados 11 casos.
Quanto às características clínicas, a LV em humanos é uma enfermidade infecciosa
generalizada, tendo sua forma clássica caracterizada por febre irregular e de longa duração,
hepatoesplenomegalia (Figura I.2), linfadenopatia, anemia, leucopenia,
hipergamaglobulinemia, hipoalbuminemia, emagrecimento, edema e estado de debilidade
progressivo levando à caquexia e até mesmo ao óbito caso o paciente não receba
tratamento específico (Galvão‐Castro, 1984). Além disso, observam‐se as formas
oligossintomática (caracterizada por febre baixa ou ausente, hepatomegalia e discreta
esplenomegalia), aguda (caracterizada por início brusco) e a refratária (resultado de
evolução da doença que não respondeu ao tratamento) (FUNASA, 2000).
Figura I.2. Crianças com leishmaniose visceral provocada por L. donovani apresentando
hepatoesplenomegalia (Estado de Bihar, Índia) (Murray et al., 2005).
De um modo geral, o diagnóstico da LV é baseado no exame clínico, no histórico
fornecido pelo paciente e pelo diagnóstico laboratorial. Com relação ao diagnóstico
laboratorial, este pode ser realizado por (i) ensaios sorológicos (pesquisa por anticorpos anti‐
Leishmania), entre os quais se destacam o ensaio imunoenzimático (ELISA) e a reação de
imunofluorescência indireta (RIFI) (Sundar & Rai, 2002; Gontijo & Melo, 2004), e/ou por (ii)
exames parasitológicos, realizados em material coletado por punção da medula óssea
(mielograma), baço, linfonodos ou fígado, onde o material é examinado em lâminas onde se
demonstração do parasito pode ser realizada através do crescimento dos parasitos após
inoculação de material proveniente do paciente em animal susceptível (Sundar & Rai, 2002).
O diagnóstico molecular, utilizado a partir da década de 1980 e realizado sem a necessidade
de isolamento dos parasitos em cultura, pode ser realizado através de métodos de
hibridização com sondas específicas e técnicas de amplificação de ácidos nucléicos, incluindo
a reação em cadeia da polimerase (PCR) para detecção de DNA, e da reação em cadeia da
transcriptase reversa após transcrição reversa (RT‐PCR) para detecção de RNA do parasito
(Schalling & Oscam, 2002; Sundar & Raí, 2002; Gontijo & Melo, 2004).
O tratamento clássico da LV envolve o uso de antimoniais pentavalentes (Sb5+), como
o antimoniato de metilglucamina, considerado a primeira opção terapêutica (Sundar & Rai,
2005; Ministério da Saúde, 2006; Gradoni, 2008). Conforme discutido por Rath et al. (2003),
o composto é obtido sinteticamente a partir do ácido antimônico e da N‐metil‐glucamina,
sendo a última obtida previamente a partir da aminação redutora da glicose em presença de
metilamina. O medicamento provoca regressão rápida das manifestações clínicas da doença,
além de causar a morte do parasito (Rath et al., 2003), sendo observado um alto índice de
cura, podendo alcançar mais de 95% (Berman, 2006).
Quando não há melhora clínica, a droga de escolha é a anfotericina B, usada sob
orientação e acompanhamento médico em hospitais de referência, em virtude da sua
toxicidade (Ministério da Saúde, 2006; Bern et al., 2006; Gradoni, 2008). Em gestantes a
anfotericina B é a droga indicada para o tratamento (Ministério da Saúde, 2006). Trata‐se de
uma droga derivada de uma cepa de Streptomyces nodosus, que pode alcançar um índice de
90% de cura, conforme verificado no estudo desenvolvido por Santos et al. (2002a).
Embora tenham sido adotadas medidas básicas para o controle da doença, tais como
tratamento dos casos humanos, eutanásia de cães soropositivos e a redução da população
de vetores, a importância da LV tem aumentado significativamente em decorrência do
processo de urbanização e das alterações nas condições ambientais naturais (Bevilacqua et
al., 2001). Para se ter uma idéia, em 2005, segundo a OMS, a LV foi responsável por 59 mil
mortes em todo o mundo (OMS, 2005a). No Brasil, no período de 2001 a 2006, foram
notificados 20.635 casos, de acordo com o Sistema de Informação de Agravos de Notificação
(SINAN). Só em 2006, 4.526 casos foram identificados, sendo a maioria (52,9%) no nordeste
brasileiro (Ministério da Saúde, 2009). Em outras regiões, tem‐se observado inúmeros casos
propícias para a manutenção do seu ciclo de vida. Na Região Sudeste, onde 18,5% dos casos
notificados em 2006 foram registrados, um acréscimo nas notificações tem sido observado e
na Região Centro‐Oeste, onde 15,0% dos casos de LV notificados no ano de 2006 foram
registrados, uma tendência similar ao aumento das notificações é observada (SINAN, 2008).
No Estado de Minas Gerais, a maior incidência da LV ocorre na região metropolitana
de Belo Horizonte (RMBH) e no vale dos rios Jequitinhonha, São Francisco e Doce (Silva et
al., 2001). Na capital mineira, é nítido o processo de urbanização da LV, o que pode ser visto
em todas as cidades brasileiras de grande porte. Desde 1993 a população convive com a LV,
introduzida a partir de municípios vizinhos. A proximidade entre as habitações e a alta
densidade populacional contribui para a rápida expansão da LV no ambiente urbano. De
acordo com Gontijo & Melo (2004), na RMBH o percentual de municípios com notificação
elevou‐se de 6, no biênio 1994/1995, para 15 no biênio 1998/1999.
Segundo Kroeger (2007), medidas profiláticas eficazes são requeridas para a
erradicação da LV em áreas endêmicas. Além disso, o referido autor sugere como medidas
importantes no combate à doença o uso de spray residual no interior das casas aliado ao uso
de inseticidas e armadilhas de captura do inseto vetor, bem como estratégias ambientais
governamentais, tais como aquelas ligadas à prevenção dos desmatamentos e queimadas de
áreas naturais. Além disso, deve‐se considerar que a eutanásia de cães soropositivos é
também uma medica recomendada pela OMS para o controle da LV.
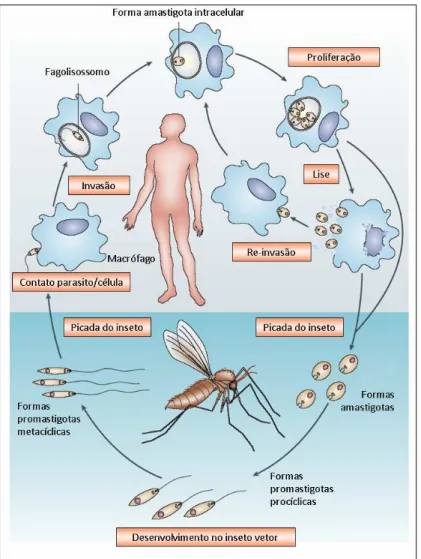
2.2. Ciclo biológico dos parasitos do gênero Leishmania
O ciclo de vida dos parasitos do gênero Leishmania é do tipo heteroxênico, isto é,
envolve hospedeiros mamíferos e o inseto vetor susceptível. No hospedeiro mamífero,
inclusive no homem, o desenvolvimento biológico dos parasitos é similar entre as diferentes
espécies: formas promastigotas metacíclicas (formas infectantes) são introduzidas no
hospedeiro através da picada da fêmea do inseto vetor (Killick‐Kendrick, 1979). No
hospedeiro vertebrado, rapidamente tais formas entram em contato com fagócitos (Figura
I.3A) transformando‐se, no interior destes, em formas ovais não flageladas denominadas
amastigotas (Figura I.3B). As formas amastigotas replicam no interior dos fagolisossomos das
células do sistema fagocítico mononuclear, principalmente macrófagos, e a partir destes os
parasitos são disseminados para macrófagos adjacentes (Gossage et al., 2003).
A B
Figura I.3. Infecção in vitro de macrófagos com o parasito L. donovani. (A) Duas formas promastigotas
flageladas (seta) em contato com macrófago humano. (B) Formas amastigotas (setas) no interior dos
macrófagos de camundongos. (Murray et al., 2005)
Fora do hospedeiro mamífero, o ciclo de vida dos parasitos do gênero Leishmania
ocorre somente no trato digestivo do inseto vetor e o seu desenvolvimento é mais complexo
(Walters, 1993). A infecção inicia‐se quando o inseto ingere sangue contendo macrófagos
infectados com formas amastigotas. Durante o trajeto pela porção anterior do trato
digestivo, ou ao chegar ao estômago, os macrófagos se rompem liberando as amastigotas.
Estas se transformam rapidamente em promastigotas procíclicas que apresentam flagelos
curtos e iniciam a multiplicação no inseto (Kamhawi, 2006). A seguir, as promastigotas que
migram em direção à porção anterior do trato digestivo do vetor atingem um estágio
infectante, ou seja, se transformam em promastigotas metacíclicas. Os mecanismos
envolvidos nesse processo in vivo são pouco elucidados, porém in vitro, sabe‐se que a
metaciclogênese é induzida por baixo pH (Zakai et al., 1998), condições de anaerobiose
(Mendez et al., 1999) e pela diminuição da concentração de tetrahidrobiopterina (co‐fator
essencial para as atividades catalíticas das enzimas oxidonitrito sintase e pteridina redutase)
(Cunningham et al., 2001). A Figura I.4 ilustra de modo esquemático o ciclo de vida dos
parasitos do gênero Leishmania.
Figura I.4. Ciclo de vida dos parasitos do gênero Leishmania. Adaptado de
Chappuis et al. (2007).
Vale salientar que, diferentes espécies de mamíferos, tais como roedores e canídeos,
atuam como reservatórios naturais dos parasitos do gênero Leishmania e servem de fonte
de infecção para o vetor. Enquanto o cão é apontado como o principal reservatório
doméstico para espécies que causam a LV, raposas e lobos funcionam como reservatórios
silvestres (Deane & Deane, 1955a; Deane & Deane, 1955b; Deane & Deane, 1962; Lainson &
Shaw, 1987).
2.3. Vacinas contra a leishmaniose: uma breve revisão
Como já descrito, os antimoniais pentavantes (Sb5+) são a primeira opção terapêutica
utilizada no Brasil em casos de LV, assim como na maioria dos demais países onde a doença
é prevalente. Porém, as doses desses medicamentos indicadas no tratamento da doença
tais drogas têm sido relatadas e frequentemente têm sido associadas à resistência dos
parasitos aos antimoniais pentavalentes (Balaña‐Fouce et al., 1998; Sundar, 2001; Maltezou,
2008; Polonio & Efferth, 2008; Janvier et al., 2008). A segunda linha de tratamento, a
anfotericina B, também tem apresentado falhas no tratamento da doença e muitas vezes
provoca prejuízos ao funcionamento dos rins, órgãos alvo para a toxicidade deste fármaco
(Rath et al. 2003).
Dessa forma, pode‐se notar que a quimioterapia utilizada no tratamento específico
da LV não é completamente eficiente no combate à doença. Portanto, a adoção de medidas
terapêuticas alternativas, aliadas à vacinação, é um ponto crucial e importante a ser
considerado. Diversas preparações têm sido propostas e estudos têm sido conduzidos com a
finalidade de se desenvolver uma vacina que apresente resultados satisfatórios na proteção
contra a infecção por parasitos do gênero Leishmania.
De um modo geral, pode‐se dividir a busca por uma vacina eficaz contra as
leishmanioses em 3 gerações, no que se refere ao processo de produção (Kedzierski &
Handman, 2006; Khamesipour et al., 2006; Tabbara, 2006). A primeira geração se inicia com
o primeiro estudo de vacinação terapêutica desenvolvido por Salles‐Gomes (1939) contra a
LC humana e se estende até os dias atuais. Essa geração é caracterizada pelo emprego de
preparações antigênicas tipicamente constituídas por antígenos brutos, obtidos através de
técnicas de atenuação ou fixação das espécies de interesse. Vale salientar que, no estudo de
Salles‐Gomes (1939), o autor inoculou formas promastigotas de Leishmania ssp.
dermotrópicas mortas pelo fenol, em pacientes com LC e observou uma redução significativa
no diâmetro das lesões e das reações adversas ao tratamento, realizado em paralelo, à
medida que os regimes de vacinação prosseguiram.
No início da década de 1990, com o avanço das técnicas de biologia molecular,
começaram a surgir os primeiros candidatos constituídos por subunidades definidas,
denominados antígenos recombinantes que marcaram a segunda geração de vacinas. Mais
recentemente, no final da década de 1990 e início dos anos 2000, com o avanço dos estudos
do genoma de diferentes agentes infecciosos, começaram a surgir as vacinas de terceira
geração, constituídas de genes que codificam antígenos do parasito, clonados em vetores
contendo promotores eucarióticos, as quais apresentam uma aplicação promissora no
controle das leishmanioses. Além disso, as vacinas de 3ª geração apresentam diversas
facilidade de manipulação e preparação de formas multigênicas; (II) imunização com DNA,
resultando na expressão de antígenos do parasito na sua forma nativa e (III) indução de uma
resposta imune celular e humoral prolongada, devido à persistência da expressão antigênica
(Gurunathan, 1998; Gurunathan, 2000).
O fato é que ao longo destas 3 gerações vacinais diversos estudos investigaram a
possibilidade de criação de uma vacina eficaz contra as leishmanioses. No Brasil, destacam‐
se os trabalhos realizados pelo grupo de pesquisa em leishmaniose do Departamento de
Parasitologia da Universidade Federal de Minas Gerais (UFMG), o qual ganhou destaque
mundial no desenvolvimento de uma vacina contra a leishmaniose. Este grupo desenvolveu
a Leishvacin, uma vacina composta pela espécie L. amazonensis (IFLA/BR/67/PH8) (Mayrink
et al., 1985; Mayrink et al., 2002). Embora promissora na época de sua criação, a vacina
apresentou posteriormente, em estudos de teste clínico III, conduzidos no Equador e na
Colômbia, uma baixa proteção (Armijos et al., 2004; Velez et al., 2005).
Diversos estudos com modelos animais têm apresentado candidatos importantes
para o desesenvolvimento de vacinas contra a LV. Dentre eles destacam‐se: proteína LACK
de 36 kDa (p36/LACK) (Gomes et al., 2007a); cisteína protease (Rafati et al., 2005); proteína
B1 (HASPB), expressa nas formas amastigota e promastigota de várias espécies de
Leishmania (Stager et al., 2000; Moreno et al., 2007); antígeno flagelar de L. chagasi 1 (LCR1)
(Wilson et al., 1995); antígeno leishmanial ORFF (proteína presente nas formas amastigotas
e promastigotas de Leishmania, sobretudo em formas amastigotas de L. dononavi) (Tewary
et al., 2005) e antígeno KMP‐11 (Basu et al., 2005; Carrillo et al., 2008). Destacam‐se ainda
os estudos que utilizaram vacinas de antígeno particulado de L. chagasi, como por exemplo,
os desenvolvidos pelo grupo de pesquisadores em LV do Laboratório de Imunoparasitologia
no Instituto de Ciências Exatas e Biológicas da Universidade Federal de Ouro Preto (UFOP)
(Vilela et al., 2007; Grenfell, 2007).
No estudo de Borja‐Cabrera et al. (2008), os autores relataram o ensaio de
imunogenicidade da vacina Leishmune (FML‐saponina) realizado em 550 cães soronegativos
saudáveis de áreas endêmicas e epidêmicas do Brasil durante 2 anos de experimentação.
Neste estudo, os autores não apenas confirmaram o potencial protetor descrito
previamente para a vacina (da‐Silva et al., 2001; Borja‐Cabrera et al., 2002) como re‐
Ainda sobre o desenvolvimento de uma vacina eficaz contra a LV, há de se ressaltar a
vacina desenvolvida pela Hertape Calier em parceria com a UFMG, denominada Leish Tec®.
Fernandes et al. (2008) investigaram a imunogenicidade e a imunidade protetora (frente à
infecção por L. chagasi) induzida pela vacinação contendo a proteína A2 e saponina em cães
da raça Beagle. Os cães vacinados produziram altos níveis de IgG total e IgG2 anti‐
Leishmania, um aumento significativo da produção de IFN‐γ após incubação de células
mononucleares do peritônio com Ag de Leishmania e permaneceram negativos para os
testes sorológicos convencionais de diagnóstico da LV. Assim esta vacina, permite a
diferenciação sorológica entre os animais vacinados e infectados, uma exigência importante
para o controle da LV canina. Os principais diferenciais desta vacina são: (I) a tecnologia
empregada na sua produção, baseada na moderna técnica de biotecnologia molecular,
fornecendo ao produto recombinante diversas vantagens; (II) a sua composição, antígeno 2
de superfície de parasito (proteína A2), eleito como um dos melhores antígenos capazes de
induzir resposta imune protetora contra a LV; (III) a resposta imune induzida, que faz com
que o animal, mesmo depois de vacinado, continue negativo nos exames sorológicos
utilizados para diagnóstico da doença, não interferindo nos inquéritos epidemiológicos
realizados, bem como (IV) a ausência de reações adversas (dor, queda de pêlo e prostração).
A Tabela I.1 apresenta uma síntese dos trabalhos mencionados, os quais envolveram
o estudo de vacinas contra a LV.
Tabela I.1. Principais estratégias vacinais contra a leishmaniose visceral
Antígeno
Modelo experimental
utilizado
Efeito da
vacinação Referências
Antígeno p36/LACK Camundongo Proteção Gomes et al., 2007
Cisteína protease Cão Proteção Rafati et al., 2005
Antígeno 2 de superfície
do parasito Cão Proteção Fernandes et al., 2008
Proteína B1 (HASPB) Camundongo Proteção Stager et al., 2000; Moreno et
al., 2007
Antígeno flagelar de L.
Tabela I.1. Continuação
Antígeno
Modelo
experimental utilizado
Efeito da
vacinação Referências
Antígeno leishmanial
ORFF Camundongo Proteção Tewary et al., 2005
Antígeno KMP‐11 Hamster Proteção Basu et al., 2005; Carrillo et
al., 2008
Antígeno particulado de
L. chagasi Camundongo Proteção
Vilela et al., 2007; Grenfell,
2007
FML‐saponina Cão Proteção
Da Silva et al., 2001; Borja‐
Cabrera et al., 2002; Borja et al., 2008.
3. O sinergismo entre a desnutrição protéico‐calórica e a leishmaniose visceral
Sabe‐se que a importância da LV reside não somente na sua alta incidência e ampla
distribuição, mas também na possibilidade de assumir formas graves e letais quando
associada a deficiências nutricionais e a infecções concomitantes (Gontijo & Melo, 2004). De
acordo com Gomes et al. (2007b), o estado nutricional dos indivíduos infectados com
Leishmania ssp. tem um papel significativo na evolução clínica da LV, especialmente em
crianças com idade inferior a 5 anos. Estudos têm demonstrado que a alta susceptibilidade a
infecção, neste grupo de risco, pode ser explicada pela imaturidade imunológica típica desta
faixa etária, associada ao quadro de DPC, muito comum em áreas endêmicas de LV (Badaró
et al., 1986; Campos Jr., 1995; Harrison et al., 1986; Celf et al., 1987; 1987; Dye & Willians,
1993; Maciel et al., 2008).
No estudo pioneiro realizado por Actor (1960) envolvendo modelo murino, os
resultados obtidos possibilitaram concluir que a DPC, associada à deficiência de vitaminas,
está diretamente relacionada com o aumento da susceptibilidade a infecção por parasitos
causadores da LV. Harrison et al. (1986) e Badaró et al. (1986), através de observações
epidemiológicas, concluíram que a DPC é um sério fator de risco para o desenvolvimento da
LV em humanos. Badaró et al. (1986) evidenciaram que 45% das crianças com LV sofriam de
desnutrição moderada ou grave antes do aparecimento da LV, sendo, portanto, a
desnutrição considerada fator de risco para o desenvolvimento da doença.
Harrison et al. (1986), em um estudo com crianças brasileiras expostas à infecção por
(CB) e área muscular do braço. Foi verificado que crianças com LV, que foram seguidas após
o tratamento, apresentavam área gordurosa e área muscular do braço que correspondia a
66% e 81% das áreas de seus familiares sadios, pareados por sexo e idade, que viviam na
mesma casa. O estudo encontrou ainda diferenças maiores quando comparou as crianças
que apresentaram LV aos vizinhos sadios, pareados por sexo e idade, encontrando área
gordurosa e área muscular do braço correspondentes a 41% e 75% das áreas encontradas
nos vizinhos sadios.
Cerf et al. (1987) em estudo prospectivo também avaliaram o estado nutricional de
crianças expostas à infecção por L. chagasi no interior da Bahia. O grupo encontrou
similarmente aos achados de Badaró et al. (1986), alta prevalência (77%) de DPC nas
crianças com LV, constatada através de baixo peso para idade. Foi também observado que
82% das crianças com LV possuíam baixa altura para idade, comparado com um percentual
de 55% em crianças não‐infectadas por L. chagasi. Os dados neste estudo mostraram ainda
que, das 31 crianças que após avaliação inicial desenvolveram LV, 45,5% apresentavam DPC
grave ou moderada e, destas crianças desnutridas que desenvolveram LV, somente 22%
apresentavam anticorpos anti‐Leishmania no momento da avaliação nutricional.
Recentemente destaca‐se o estudo de Maciel et al. (2008), no qual os autores
estudaram a influência do estado nutricional de 149 crianças, no Rio Grande do Norte, com
LV na resposta à infecção com L. chagasi e verificaram que modificações nos aspectos
nutricionais estão associadas diretamente com o curso da infecção. Observou‐se que
crianças com LV ativa apresentaram estado nutricional comprometido em relação às demais
crianças estudadas, segundo o índice de massa corpórea (IMC) e a CB/altura. Além disso, o
nível de vitamina A foi menor nas crianças com LV aguda com 43% de prevalência de retinol
sérico < 20 µg/dL. Entretanto, poucos trabalhos desenvolvidos investigaram de modo
específico as bases imunológicas da associação “DPC e LV”.
Apenas um trabalho envolvendo especificamente os aspectos imunológicos entre
esta associação foi encontrado na literatura. Neste estudo, Anstead et al. (2001) avaliaram o
efeito da DPC associada às deficiências de ferro e zinco na resposta imune inata, bem como
na visceralização dos parasitos após infecção experimental (camundongos BALB/c) com
promastigotas metacíclicas de L. donovani. Neste trabalho, os autores estudaram diferentes
grupos, os quais receberam dietas com diferente conteúdo protéico (6, 3 e 1% de proteína),
e zinco em níveis adequados. Os autores constataram que os grupos experimentais
alimentados com as dietas hipoprotéicas e deficientes em ferro e zinco, inoculados com 5 x
106 promastigotas metacíclicas de L. donovani, apresentaram maior carga parasitária no
fígado, baço e linfonodos quando estes foram avaliados 3 dias após a infecção. Além disso,
elevados níveis de prostaglandina E2 (PGE2) e diminuídos níveis de IL‐10 foram observados
nos animais submetidos à DPC associada às deficiências de ferro e zinco. Nos camundongos
do grupo controle, a atividade da enzima óxido nítrico‐sintase induzível (iNOS) no fígado e
baço foi significativamente maior do que a atividade desta enzima nos animais desnutridos.
Com relação às deficiências de micronutrientes, estas estão geralmente associadas à
DPC e também podem agravar o quadro infeccioso pré‐existente (Bhaskaram, 2002). Vários
estudos têm indicado que a deficiência de micronutrientes influencia não somente a
susceptibilidade do hospedeiro a doenças infecciosas, como também o curso destas.
Segundo Blössner & de Onis (2005), mesmo níveis moderados de deficiência de
micronutrientes, tais como ferro, vitaminas, iodo e zinco, detectados por testes bioquímicos,
podem provocar sérios prejuízos à saúde humana. Para se ter uma idéia, estima‐se que
aproximadamente 2 bilhões de pessoas apresentem anemia ferropriva, decorrente da
deficiência do elemento ferro na dieta, enquanto outras 2 milhões consomem dietas
deficientes do elemento iodo e 254 milhões deficientes da vitamina A (Allen et al., 2006). De
acordo com dados da OMS referentes aos índices de mortalidade, por volta de 800 mil
mortes por ano podem ser atribuídas à deficiência de ferro, e um número similar à
deficiência de vitamina A. Estudos desenvolvidos entre 1995 e 2004 mostram que, nas
Américas, 141 milhões de pessoas apresentaram anemia ferropriva, 75 milhões insuficiência
na absorção do iodo e outras 16 milhões apresentaram deficiência da vitamina A (De Benoist
et al., 2004; OMS, 2001).
O estudo de Ames (1999) mostrou que a deficiência de fosfato, ferro, zinco e das
vitaminas B12, B6, C ou E pode causar alterações no DNA das células, lesões oxidativas, ou
ambas, alterando a resposta imunológica do hospedeiro. Baseando‐se em exames
conduzidos na Índia, Europa, Estados Unidos e Canadá, Chandra (2002) constatou que mais
de 35% das pessoas com idade superior a 50 anos apresentaram deficiência de uma ou mais
vitaminas e/ou micronutrientes.