Biologia comparativa de Rhodnius neglectus e Rhodnius robustus (Triatominae) sob condições de laboratório e infecção experimental pelo Trypanosoma rangeli com ênfase nos aspectos ultraestruturais das glândulas salivares infectadas
Texto
(2) DANIELLA BARRETO SANTANA. Biologia comparativa de Rhodnius neglectus e Rhodnius robustus (Triatominae) sob condições de laboratório e infecção experimental pelo Trypanosoma rangeli com ênfase nos aspectos ultraestruturais das glândulas salivares infectadas.. Dissertação apresentada ao Programa de Pós-graduação em Ciências da Saúde da Universidade de Brasília, como requisito à obtenção do grau de Mestre em Ciências da Saúde.. ORIENTADOR: Prof. Dr. Cesar Augusto Cuba Cuba. Brasília 2006. ii.
(3) DANIELLA BARRETO SANTANA. Biologia comparativa de Rhodnius neglectus e Rhodnius robustus (Triatominae) sob condições de laboratório e infecção experimental pelo Trypanosoma rangeli com ênfase nos aspectos ultraestruturais das glândulas salivares infectadas.. Dissertação aprovada como requisito para obtenção do grau de Mestre no curso de Pós-Graduação em Ciências da Saúde da Universidade de Brasília, pelos membros componentes da banca examinadora:. ________________________________________ Prof. Dr. César A. Cuba Cuba (Orientador). ________________________________________ Prof. Dr. Albino Verçosa de Magalhães. ________________________________________ Profª. Dra. Sônia Nair Bao. ________________________________________ Prof. Dr. Gustavo Sierra Romero. Brasília 2006. iii.
(4) Ao meu esposo Marco, que esteve sempre ao meu lado, ajudando no que fosse preciso. Às minhas mamães Rosana e Cristina e ao meu irmão Danillo que mesmo de longe estão presentes na minha vida.. iv.
(5) AGRADECIMENTOS Ao meu orientador César Augusto Cuba Cuba, um agradecimento especial pela confiança, incentivo, apoio e conselhos dados que ajudaram na elaboração do meu trabalho. À Prof. Dra. Sônia Bao, pelo carinho e apoio em todo o processo para a utilização do Microscópio Eletrônico de Varredura. Ao Prof. Dr. Albino Verçosa, pela atenção e auxílio na leitura das lâminas histológicas. À estagiária e amiga Jacqueline, pelo carinho, coleguismo e pela ajuda na coleta de dados e manutenção da colônia de triatomíneos do laboratório. Ao estagiário Jonatas, pelo apoio na coleta de dados, pelo companheirismo e pelas brincadeiras que animam todas as pessoas do Laboratório de Parasitologia Médica. À Daniella de Souza, também mestranda do Laboratório, pelo companheirismo e carinho durante esses dois anos. Ao Rodrigo Gurgel, doutorando do Laboratório, pela ajuda com os dados e com a elaboração do meu trabalho. À Maria de Lourdes Souto (Lurdinha), técnica do Laboratório, pela atenção e pelo ensino. Ao Tércio e à Viviane, do Laboratório de Dermatologia, pela ajuda com materiais e manutenção da cepa criopreservada. À Shirley, técnica do Laboratório de Patologia, também pela ajuda com materiais. Ao Bráulio, técnico do Laboratório de Histologia, pelo preparo das lâminas com cortes histológicos. Ao João Victor, Shélida e Bruno, alunos do Laboratório de Microscopia Eletrônica, pela ajuda com o preparo das amostras e registros das infecções no MEV. Ao Chigueru e ao Walcymar, do Laboratório de Doença de Chagas, pelo apoio na utilização do aparelho de Xenodiagnóstico Artificial. À funcionária D. Maria Fernanda (Mariazinha) pela ajuda na criação dos camundongos. Aos funcionários da pós-graduação que sempre me atenderam com o maior carinho. A todos os meus colegas que passaram esses dois anos caminhando ao meu lado que, de forma direta ou indireta, contribuíram para uma melhor formação, meu muito obrigado.. v.
(6) SUMÁRIO. Resumo. viii. Abstract. x. Lista de Tabelas. xii. Lista de Figuras. xiii. 1. Introdução. 1. 2. Objetivos 2.1 Objetivos Gerais. 9. 2.2 Objetivos Específicos. 9. 3. Material e Métodos 3.1 Material Biológico. 10. 3.2 Identificação dos espécimes de Rhodnius. 10. 3.3 Métodos para o desenvolvimento das colônias de insetos. 12. 3.4 Estabelecimento das estatísticas vitais dos triatomíneos. 13. 3.5 Alguns aspectos de comportamento alimentar experimental. 13. 3.6 Estudo anatômico e histológico das glândulas salivares. 14. 3.7 Suscetibilidade experimental dos triatomíneos ao T. rangeli. 15. 3.8 Infecção in vitro das glândulas salivares. 16. 4. Resultados 4.1 Identificação dos espécimes de Rhodnius. 19. 4.2 Estabelecimento das estatísticas vitais dos triatomíneos. 21. 4.3 Comportamento alimentar em relação à transmissão do T. rangeli. 23. vi.
(7) 4.4 Estudo anatômico e histológico das glândulas salivares. 31. 4.5 Suscetibilidade experimental dos triatomíneos ao T. rangeli. 34. 4.6 Infecção in vitro das glândulas salivares. 35. 5. Discussão 5.1 Identificação dos espécimes de Rhodnius. 42. 5.2 Estabelecimento das estatísticas vitais dos triatomíneos. 43. 5.3 Comportamento alimentar em relação à transmissão do T. rangeli. 44. 5.4 Estudo anatômico e histológico das glândulas salivares. 46. 5.5 Suscetibilidade experimental dos triatomíneos ao T. rangeli. 47. 5.6 Infecção in vitro das glândulas salivares. 49. 6. Conclusões. 51. 7. Referências Bibliográficas. 53. 8. Anexo I : Resumo do pôster apresentado na XXII Reunião de Pesquisa. 64. Aplicada em Doenças de Chagas e Leishmanioses - Uberaba – MG. 9. Anexo II: Cópia do pôster apresentado na XXII Reunião de Pesquisa. 66. Aplicada em Doenças de Chagas e Leishmanioses - Uberaba – MG.. vii.
(8) RESUMO. Triatomíneos do gênero Rhodnius: R. neglectus e R. robustus, vetores naturais do Trypanosoma rangeli, foram identificados utilizando-se as chaves taxonômicas de Lent & Wygodzinsky, 1979 e a morfometria geométrica das asas. Este último confirmou sua utilidade como parâmetro de identificação taxonômica em triatomíneos do gênero Rhodnius. No estudo comparativo das estatísticas vitais e dos aspectos de comportamento alimentar, os triatomíneos das duas espécies foram observados diariamente para se estabelecer: (i) o período de desenvolvimento dos estádios ninfais; (ii) percentual de mortalidade; (iii) detecção do hospedeiro (tempo de aproximação dos triatomíneos ao hospedeiro vertebrado experimental); (iv) número de tentativas de picadas dos insetos no hospedeiro; (v) tempo total do repasto sanguíneo; (vi) índice de picadas; (vii) lapso entre o final do repasto e a primeira defecação; e (viii) quantidade de sangue ingerido. Comparando-se as duas espécies, R. neglectus apresentou um período ninfal significativamente menor que R. robustus, havendo diferença significativa (p<0,001) para todos os estádios, exceto para Ninfa V. Com relação ao comportamento alimentar, as duas espécies apresentaram os parâmetros bem similares, exceto para o número de picadas onde R. neglectus se apresentou significativamente maior para as Ninfas IV e V, e para a quantidade de sangue ingerido onde R. robustus apresentou uma média de ingestão significativamente maior que R. neglectus. Em R. robustus, registrou-se a presença dos dois pares de glândulas (D1 e D2), característica da espécie estudada. Para verificar o potencial vetorial de T. rangeli nas espécies de triatomíneos, utilizou-se três procedimentos laboratoriais com a cepa SC-58: infecção via alimentação em camundongo infectado, via inoculação intracelômica e via xenodiagnóstico artificial, mas não houve infecção das glândulas salivares. Após diversas tentativas, T. rangeli infectou a hemolinfa em apenas dois triatomíneos, sem progresso de infecção. Com a cepa LP-01, isolada recentemente de R. neglectus naturalmente infectado, realizou-se uma tentativa de infecção via alimentação em camundongo infectado, sem demonstrar invasão hemolinfática. Na infecção in vitro das glândulas salivares, foi utilizada uma glândula controle (sem infecção) e mais quatros glândulas, infectadas por quatro tempos distintos (30 minutos, 1, 3 e 24 horas), que foram processadas e levadas ao Microscópio Eletrônico de Varredura para verificar e documentar o processo inicial de adesão e penetração na membrana basal. Após o processamento, observou-. viii.
(9) se que apenas com 30 minutos e 1 hora de infecção, flagelados encontravam-se aderidos na membrana basal, formando “grumos” com aparência de estar penetrando por orifícios grandes e visíveis. Isto poderia sugerir então que de alguma maneira, os flagelados lesam a membrana basal, com a finalidade de atravessá-la e ganhar passo às células do epitélio glandular.. Palavras chaves: Rhodnius neglectus. R. robustus. Estatísticas vitais. Comportamento alimentar. Trypanosoma rangeli. Suscetibilidade. Glândulas salivares. Microscopia Eletrônica de Varredura.. ix.
(10) ABSTRACT. Rhodnius neglectus and Rhodnius robustus (Hemíptera, Triatominae), two species from the genus Rhodnius, were initially identified using the well known taxonomical keys described by Lent and Wygodzinsky ( 1979) and, in addition, techniques of wings geometric morphometry. Both approaches resulted in good agreement confirming the value of the last one in accurate identification of species of Rhodnius spp .Comparative studies on experimental life tables and feeding behavior of R. neglectus and R. robustus important natural vectors of Trypanosoma rangeli in Brazil, were carried out in order to establish: (i) time instars development (ii) mortality (iii) source host detection (iv) average number of bugs’ bite on host (v) bloodmeal spending time (vi) biting rate (vii) elapsed time between bloodmeal intake and first defecation (viii) total bloodmeal ingested . Main results of such comparison were: R. neglectus have shown a faster development of nymphs than R. robustus. during all different stages except nymph V ( p<0,001). Regarding feeding. behavior, if on one hand R neglectus demonstrated a higher number of bites in instar IV and V, on the other hand R. robustus have shown higher average of blood uptake . Two pairs of salivary glands (D1 and D2) were recorded in R. robustus and histologically described .The vector potential of the two species under study were pursued with challenges using two strains of T. rangeli (strains SC58 and LP01). Attempts of experimental infection using mouse infected with the flagellate, artificial xenodiagnosis and intracoelomic injections of cultures of the flagellate, were carried out with partial intestinal and haemolymphatic infections. No invasion of salivary glands were obtained in spite of. our repeated. efforts. Alternatively, salivary glands. “in vitro infections”. procedures, in different time-point( 30’, 1 hour, 24 hours) were performed. Studies on infected glands by light microscopy and scanning electron microscopy (SME) were done. Striking results were the recording of parasites recognition, adhesion and , probably, initial penetration through holes /orifices apparently produce by the flagellum of T. rangeli trypomastigotes/epimastigotes on the basal membrane surface. Our interpretation is that the parasite somehow open holes through the basal membrane of the salivary glands when they form clusters of flagellum first, to gain entry into the adjacent glandular epithelium.. x.
(11) Key words: Rhodnius neglectus. R. robustus. Life cycles. Feeding behavior. Tripanosoma rangeli. Susceptibility. Salivary glands. Scanning Electron Microscopy (SME).. xi.
(12) LISTA DE TABELAS. Tabela 1. Classificação taxonômica das espécies do gênero Rhodnius......................... 3 Tabela 2. Origem, habitat, coordenadas geográficas e número de asas de machos e fêmeas das populações de Rhodnius estudadas por morfometria geométrica.............. 11 Tabela 3: Período de desenvolvimento (em dias) de cada estádio de R. neglectus e percentual de mortalidade por fase de desenvolvimento.............................................. 22 Tabela 4: Período de desenvolvimento (em dias) de cada estádio de R. robustus e percentual de mortalidade por fase de desenvolvimento.............................................. 22 Tabela 5: Período de desenvolvimento (em dias) de cada estádio de R. neglectus e R. robustus........................................................................................................................ 23. xii.
(13) LISTA DE FIGURAS. Figura 1. Ciclo evolutivo de T. rangeli ........................................................................ 2 Figura 2. R neglectus (Lent, 1954)............................................................................... 4 Figura 3. R. robustus (Larousse, 1927)........................................................................ 5 Figura 4. Asa direita de Rhodnius neglectus com os sete pontos de referência usados nas análises morfométricas........................................................................................... 11 Figura 5. Formas epimastigotas e tripomastigotas de T. rangeli da cultura SC58.................................................................................................................................. 15 Figura 6. Protocolo utilizado para a infecção experimental "in vitro" das glândulas salivares........................................................................................................................ 17 Figura 7. Variação do tamanho do centróide entre populações e sexos de espécies de Rhodnius....................................................................................................................... 20 Figura 8. Mapa fatorial mostrando a variação de forma para machos de populações de Rhodnius....................................................................................................................... 21 Figura 9. Valor médio do tempo de aproximação dos R. neglectus e R. robustus...... 24 Figura 10. Valor médio do número de picadas de R. neglectus e R. robustus na fonte alimentar....................................................................................................................... 25 Figura 11. Valor médio do tempo total do repasto sanguíneo para R. neglectus e para R. robustus.................................................................................................................... 26 Figura 12. Índice de picadas para R. neglectus e para R. robustus.............................. 27 Figura 13. Valor médio do número de interrupções durante a alimentação por R. neglectus e por R. robustus. As barras representam o desvio padrão........................... 28 Figura 14. Valor médio do tempo entre o final do repasto até a primeira defecação dos R. neglectus e R. robustus............................................................................................. 29 Figura 15. Percentuais de defecações para R. neglectus e para R. robustus, por estádio ninfal, somando as observações realizadas durante e após o repasto........................... 30 Figura 16. Valores médios (em mg) da quantidade de sangue ingerido por R. neglectus e por R. robustus. .................................................................................……………… 31 Figura 17. Vista interna das glândulas salivares de Rhodnius robustus...................... 32. xiii.
(14) Figura 18. Corte histológico longitudinal pela glândula salivar D1 de Rhodnius robustus corado pelo H. E............................................................................................ 33 Figura 19. Detalhe da extremidade da glândula salivar D1 de R. robustus................ 33 Figura 20. Detalhe da parte central da glândula salivar de R. robustus..................... 34 Figura 21. Microscopia Eletrônica de Varredura (MEV) da glândula salivar não infectada de R. robustus................................................................................................ 35 Figura 22. MEV da glândula salivar com infecção de 30 minutos............................. 36 Figura 23. Flagelados aderidos à membrana basal da glândula salivar infectada por 1 hora............................................................................................................................... 37 Figura 24. Parasitas aderidos em "grumos" na membrana basal da glândula com 3 horas de infecção.......................................................................................................... 38 Figura 25. Flagelado aderido na membrana basal com características de forma tripomastigota............................................................................................................... 39 Figura 26. Parasitas cobrindo a membrana basal da glândula salivar infectada por 24 horas.............................................................................................................................. 40 Figura 27. Glândula salivar de R. robustus utilizada no processo de infecção in vitro em Microscopia Óptica................................................................................................. 41 Figura 28. Glândula salivar de R. robustus com 3 horas de infecção in vitro, visível à Microscopia Óptica....................................................................................................... 41. xiv.
(15) 1. INTRODUÇÃO. Trypanosoma rangeli é um protozoário hemoflagelado, do subgênero Herpetosoma, que infecta diversas espécies de hemípteros hematófagos e mamíferos, incluindo o homem. Este flagelado foi descoberto na Venezuela por Tejera em 1920 e a partir daí, muitos estudos foram realizados em várias regiões, descobrindo-se sua grande distribuição geográfica. O T. rangeli está amplamente distribuído nas Américas Central e Sul, muitas vezes sobrepondo sua distribuição geográfica com outra espécie de tripanosomatídeo, o Trypanosoma cruzi, agente etiológico da Doença de Chagas (Cuba Cuba, 1998). Os insetos triatomíneos principalmente do gênero Rhodnius, representam os vetores biologicamente comprovados para o T. rangeli, sendo capazes de desenvolver tripomastigotas metacíclicos infecciosos em suas glândulas salivares em circunstâncias naturais e experimentais (Guhl e Vallejo, 2003). Mas este protozoário não é considerado patogênico para os hospedeiros vertebrados, incluindo o homem. O T. cruzi pertence à seção Stercoraria de seu gênero e desenvolve seu ciclo biológico no tubo digestivo do hospedeiro invertebrado, eliminando as formas infectantes nas fezes e na urina do inseto vetor, transmitindo assim, por um mecanismo de contaminação, a Doença de Chagas. Já o T. rangeli, que está incluído na seção Salivaria (Hoare, 1972), invade o intestino, coloniza a hemocele do inseto vetor, e posteriormente infecta as glândulas salivares (D’Alessandro & Saravia, 1992), sendo neste caso a transmissão, um mecanismo de inoculação das formas tripomastigotas metacíclicas infectantes pela picada do vetor (Figura 1). O T. rangeli compartilha muitas características Salivaria e Stercoraria, mas está comprovado que o mecanismo principal da transmissão ocorre pela picada dos triatomíneos infectados (Grisard et al., 1999). De maneira geral, os Rhodnius favorecem os estudos da interação parasita/hospedeiro, pois T. cruzi e T. rangeli são dois parasitas distintos quanto ao ciclo de desenvolvimento no inseto. Rhodnius neglectus, Lent, 1954 e Rhodnius robustus, Larrousse, 1927 são espécies silvestres, com invasão esporádica às habitações humanas a partir de seus habitats naturais que são diversas espécies de palmeiras (Arecaceae) (Gurgel-Gonçalves et al., 2004).. 1.
(16) Figura 1. Ciclo evolutivo de T. rangeli.. As espécies do gênero Rhodnius (Tabela 1) possuem uma variedade de hábitos domiciliares, peridomiciliares e silvestres - e assim a presença de algumas espécies em habitações humanas é muito freqüente. Além disso, há relatos de flagelados de T. rangeli em animais e triatomíneos coletados de palmeiras de diferentes regiões do Brasil: R. pictipes, R. robustus, R. neglectus, R. domesticus. As observações de colônias silvestres, em palmeiras e outras plantas como as bromélias, de R. neglectus perto de habitações humanas, como também as visitas freqüentes de adultos de R. prolixus, R. pictipes e R. robustus em habitações humanas, indicariam a formação de uma ligação entre Rhodnius infectados por T. rangeli e as infecções de humanos que foram ou serão estabelecidas (Carcavallo et al., 1998; D’Alessandro e Saravia, 1999; Coura et al., 2002).. 2.
(17) Tabela 1. Classificação taxonômica das espécies do gênero Rhodnius. CATEGORIAS TAXONÔMICAS. TAXA. Filo. Arthropoda. Classe. Insecta. Ordem. Hemiptera. Subordem. Heteroptera. Família. Reduviidae. Subfamília. Triatominae. Tribo. Rhodniini. Gênero. Rhodnius. Espécies. Rhodnius amazonicus, R. brethesi, R. nasutus, R. neglectus, R. colombienses, R. pictipes, R. prolixus, R. robustus, R. domesticus, R. neivai, R. pallescens, R. ecuadorienses, R. stali, R. milesi.. Fonte: Lent & Jurberg, 1969; Galvão et al., 2003.. R. neglectus (Figura 2) é uma espécie considerada silvestre mas, já foi encontrada em habitações humanas. Em estudos realizados nas regiões norte e nordeste do Estado de São Paulo, e no Estado de Minas Gerais, foram encontradas colônias de R. neglectus em domicílios e peridomicílios. Esta espécie está entre as que vem ocupando os nichos vagos, após o controle do Triatoma infestans no Estado de Goiás. No ambiente silvestre, esta espécie está associada a várias espécies de palmeiras como o “babaçu” (Attallea speciosa) e a “macaúba” (Acrocomia aculeata), utilizando como fonte alimentar aves, marsupiais e roedores. No peridomicílio é encontrado principalmente em galinheiros (Barreto et al., 1979; Espínola, 1985; Rocha et al, 2001a).. 3.
(18) Figura 2. R neglectus (Lent, 1954). Fonte: Paulo H. B. Leite.. R. robustus (Figura 3) teve sua descrição original baseada em um espécime coletado na Guiana Francesa. Esta espécie foi encontrada também na Bolívia, Colômbia, Equador, Peru, Venezuela e na região norte do Brasil – município Plácido Castro (Acre), Lago Acari e Rio Madeira (Amazonas) e Belém (Pará). No ambiente silvestre, geralmente é encontrada nas palmeiras Schelea maracaibensis, Attalea speciosa e Acrocomia sclerocarpa e já foi encontrada em peridomicílio e domicílio (Rocha et al., 2001b; Carcavallo et al., 1998).. 4.
(19) Figura 3. R. robustus (Larousse, 1927). Fonte: Paulo H. B. Leite.. A distribuição geográfica de algumas espécies de Rhodnius não é precisa devido à dificuldade de identificação morfológica (Barret, 1988, Soares et al. 1999). O uso da morfometria clássica tem sido uma ferramenta útil na caracterização e identificação de populações de Triatominae há bastante tempo (Galíndez Girón & Torres 1999). Com o desenvolvimento das técnicas de morfometria geométrica, as variáveis de forma e tamanho podem ser analisadas separadamente com grande poder estatístico (Rohlf & Marcus 1993). Dessa forma, utilizaremos a morfometria geométrica para a confirmação das espécies utilizadas nesse estudo. No homem e em reservatórios domésticos ou silvestres a parasitemia do T. rangeli é baixa e de curta duração, existindo controvérsias relacionadas com sua reprodução. Vários pesquisadores investigaram o ciclo de vida do T. rangeli naturalmente e experimentalmente em seu vetor. Destes estudos sabe-se que o ciclo evolutivo do flagelado apresenta uma fase intestinal, com a passagem para a hemolinfa seguido por sua multiplicação nos hemócitos, até chegar às glândulas salivares onde os tripomastigotas metacíclicos são formados e inoculados nos hospedeiros vertebrados durante a alimentação sanguínea (Cuba Cuba, 1998; revisado por Grisard et al., 1999; Guhl & Vallejo, 2003). De acordo com Rocha et al. (2001a), D’Alessandro (1972) infectou o R. neglectus experimentalmente, com T. rangeli, e posteriormente encontrou parasitos nas fezes e. 5.
(20) glândulas salivares e Diotaiuti et al. (1992) o encontraram naturalmente infectado por este parasito no Brasil. Embora as prevalências humana e animal pelo T. rangeli não estejam bem estabelecidas, considera-se ampla a sua distribuição geográfica nas Américas Central e do Sul (Ramirez et al, 1998). De acordo com Guhl & Vallejo (2003), várias publicações têm demonstrado a presença de T. rangeli em humanos por exame direto, hemocultura ou xenodiagnóstico conduzindo para mais de 2.600 casos registrados de infecções em humanos: 1.144 casos na Venezuela; 1.117 na Guatemala; 181 no Panamá; 121 na Colômbia; 61 em El Salvador; 4 em Costa Rica; e 2 casos no Peru (D’Alessandro, 1976, D'Alessandro & Saravia, 1992; Grisard et al, 1999). Coura et al (1996) informou os primeiros casos de infecção humana por T. rangeli no Brasil. A literatura ainda mostra controvérsia quanto à possibilidade das formas intestinais de T. rangeli serem capazes de infectar hospedeiros vertebrados, e, portanto completar o ciclo biológico no hospedeiro invertebrado, via tubo digestivo com formação de tripomastigotas metacíclicos, como ocorre com o T. cruzi. O parasita desenvolve-se no intestino do inseto, em formas epimastigotas e tripomastigotas (Vallejo et al, 1988). A mais notável característica biológica (relativo a T. rangeli no vetor) é apresentada pela penetração do flagelado do intestino para a hemolinfa e invasão das glândulas salivares acompanhado pela formação de tripomastigotas metacíclicos na luz das glândulas e na saliva, ficando infeccioso para o hospedeiro vertebrado através da picada do inseto (Guhl & Vallejo, 2003). Mas apesar de suas características não patogênicas para hospedeiros vertebrados, o T. rangeli induz resposta imune humoral que resulta em elevados níveis de anticorpos (Grisard et al, 1999) que originam reações sorológicas cruzadas com T. cruzi, complicando o diagnóstico do parasitismo e a epidemiologia da Doença de Chagas. Devido à invasão esporádica dos Rhodnius ao domicílio humano e à tendência de sinantropismo, o conhecimento de aspectos do seu ciclo de vida é relevante, uma vez que poderá contribuir de maneira eficaz nos estudos de métodos de controle (Rocha, 1994). Dentre as características que definem um vetor eficiente dos Trypanosomatidae, se incluem entre outros o comportamento alimentar, o número e a freqüência de dejeções e o número de picadas realizadas durante o processo de alimentação (Diotaiuti et al, 1995). Várias publicações têm demonstrado as características do ciclo biológico de algumas espécies como Triatoma infestans, T. pseudomaculata e T. brasilienses (Guarneri et al, 2000); 6.
(21) Rhodnius pallescens (Carcavallo, 2002) e R. neglectus (Rocha et al, 2001a). Silva (1985) estudou o ciclo biológico de 18 espécies de triatomíneos, dentro as quais estavam seis espécies de Rhodnius. Outros autores têm demonstrado características de seus hábitos alimentares e dos padrões de defecação durante e após o repasto sanguíneo (Nogueda-Torres et al, 2000; Crocco & Catalã, 1996; Nattero et al, 2002; Martínez-Ibarra et al, 2003a). Mas os experimentos realizados por estes últimos pesquisadores objetivaram correlacionar comparativamente o potencial vetorial das espécies pesquisadas e, inferir sua potencialidade na transmissão do T. cruzi. Todas as espécies de triatomíneos apresentam três pares de glândulas salivares, com exceção do gênero Rhodnius que não apresenta a típica glândula D3. De um modo geral, o par de glândulas D1 é sempre reniforme em todos os triatomíneos. As glândulas salivares têm grande diversificação quanto ao número, tamanho, forma e situação nos diferentes triatomíneos. Em geral estão situadas no tórax, onde encontram espaço suficiente para seu desenvolvimento. O deslocamento para a região abdominal resulta dos eventuais movimentos peristálticos dos órgãos vizinhos (Lacombe, 1999). Para a confirmação dessas características, foram realizadas observações anatômicas e histológicas das glândulas salivares do R. robustus. De acordo com Kitajima et al. (1998), a invasão das glândulas salivares dos triatomíneos pelo T. rangeli foi estudado primeiro, em nível de microscópio óptico, por Groot (1952), seguido por outros autores (Herrer, 1964; Watkins, 1971; Cuba Cuba, 1975b). Poucos trabalhos foram desenvolvidos utilizando a Microscopia Eletrônica, entre eles, Ellis et al (1980) e Hecker et al (1990) estudaram a infecção das glândulas salivares dos R. prolixus e Kitajima et al (1998) sobre os R. ecuadoriensis. Recentemente, Meirelles et al., 2005 relataram vários aspectos do processo de invasão das glândulas salivares em R. domesticus. Entretanto ainda permanecem pobremente estudados alguns aspectos sobre a morfologia das formas intracelulares (presente nas células glandulares), as características e o processo inicial de penetração das formas (epimastigotas e/ou tripomastigotas) e especialmente o processo de metaciclogênese. Para promover uma informação adicional nos eventos de passagem através dessas células glandulares, foi realizada uma investigação em nível de Microscópio Eletrônico de Varredura, usando-se experimentos in vitro de infecção de glândulas salivares de R. robustus e sua interação com uma cepa brasileira de T. rangeli. 7.
(22) Do ponto de vista epidemiológico, é importante conhecer as características biológicas dos triatomíneos, e uma das maneiras para esse estudo é o estabelecimento das estatísticas vitais obtidas em observações das colônias de laboratório. Em se tratando de um modelo de um tripanosoma como T. rangeli, cujo mecanismo de transmissão é do tipo inoculativo (transmissão pela picada) este comportamento de R. robustus é de importância na caracterização de seu potencial vetorial. Sabendo-se que os triatomíneos retiram o sangue diretamente dos vasos sanguíneos (vênulas e arteríolas), os eventos que ocorrem no processo de alimentação incluiriam: detecção do hospedeiro, chegada até ele, movimento exploratório ativo da probóscide pela superfície da pele do hospedeiro, picada ou penetração, localização do sangue (em um vaso sangüíneo), ingestão do sangue e término da alimentação (Guarneri et al, 2000). Assim como outros artrópodes hematófagos, os triatomíneos desenvolveram nas suas glândulas salivares uma grande diversidade de componentes como anticoagulantes, vasodilatadores e anestésicos, que são introduzidos nos hospedeiros, juntamente com a saliva, no momento da picada. Não está ainda bem esclarecido o papel da saliva dos triatomíneos, porém se supõe que ela altere o sítio da picada, favorecendo a localização dos vasos e aumentando o fluxo sangüíneo na área da pele a ser picada. Isso aumentaria as chances de encontro rápido de um vaso com bom suplemento de sangue, que, em conseqüência, poderia diminuir o tempo de alimentação (Guarneri et al, 2000). Visando compreender ainda mais este processo de alimentação utilizamos experimentos laboratoriais de comportamento que permitiram estabelecer: (i) detecção do hospedeiro (tempo de aproximação dos triatomíneos ao hospedeiro vertebrado experimental); (ii) número de tentativas de picadas dos insetos no hospedeiro; (iii) tempo total do repasto sanguíneo; (iv) lapso entre o final do repasto e a primeira defecação. Todas essas observações de comportamento dos insetos foram realizadas utilizando-se os vetores naturais do T. rangeli, como são R. neglectus e R. robustus.. 8.
(23) 2. OBJETIVOS. 2.1 Gerais: a) Estudar comparativamente os aspectos comportamentais e estatísticas vitais em laboratório de duas espécies do gênero Rhodnius: R. neglectus e R. robustus. b) Verificar o potencial vetorial das espécies de triatomíneos para o T. rangeli através do estudo da infecção experimental.. 2.2 Específicos: a) Descrever as estatísticas vitais dos triatomíneos mencionados; b) Descrever comparativamente as durações do ciclo evolutivo, o tempo e os padrões de alimentação e defecação; c) Estudar a suscetibilidade experimental dos triatomíneos ao T. rangeli, a taxa de mortalidade e a infecção das glândulas salivares; d) Observar as características das glândulas salivares de R. robustus, quanto ao número, tamanho e forma; e) Analisar histologicamente as glândulas salivares de R. robustus; f) Realizar tentativas de transmissão do T. rangeli através da picada de insetos infectados; g) Realizar experimentos de infecção in vitro das glândulas salivares pelo T. rangeli e análise através de estudos morfológicos pela Microscopia Óptica e Microscopia Eletrônica de Varredura; h) Contribuir ao conhecimento do fenômeno inicial de adesão e documentação, pela Microscopia Eletrônica de Varredura, dos estágios iniciais da penetração das glândulas salivares.. 9.
(24) 3. MATERIAL E MÉTODOS. 3.1 Material Biológico Os insetos utilizados para os experimentos foram provenientes das colônias mantidas no Laboratório de Parasitologia Médica e Biologia de Vetores (FM/UnB). Os R. neglectus foram coletados originalmente na área de Brasília – DF na Reserva Ecológica do IBGE, Córrego Taquara (Gurgel-Gonçalves et al., 2004) e os R. robustus na área de Benfica, Marabá – PA (Mejía, 2005). Os parasitas utilizados para as infecções experimentais foram provenientes de uma cepa brasileira de Trypanosoma rangeli (SC-58), que foi isolada por Steindel et al (1991), de um roedor selvagem, Echimys dasythrix (Grisard et al., 1999) e mantida criopreservada no Laboratório de Parasitologia Médica e a cepa LP-01, isolada muito recentemente de R. neglectus naturalmente infectado, procedente de Ituiutaba – MG (Gurgel-Gonçalves et al., 2006a).. 3.2 Identificação dos espécimes de Rhodnius. A identificação das espécies foi realizada utilizando-se as chaves taxonômicas para espécies da subfamília Triatominae de Lent & Wygodzinsky, 1979. Para confirmar e tornar mais precisa a identificação dos espécimes de Rhodnius usados neste estudo, foram aplicadas técnicas de morfometria geométrica de asas reconhecidas na literatura (Matias et al., 2001; Villegas et al., 2002; Schachter-Broide et al., 2004), de acordo com o protocolo desenvolvido por Gurgel-Gonçalves et al., 2006b. Foram utilizadas 145 asas provenientes de quatro populações de Rhodnius sp (R. neglectus, R. prolixus, R. robustus e R. nasutus). A origem, o habitat, as coordenadas geográficas e o número de asas de machos e fêmeas das populações de Rhodnius estudadas estão representados na Tabela 2.. 10.
(25) Tabela 2. Origem, habitat, coordenadas geográficas e número de asas de machos e fêmeas das populações de Rhodnius estudadas por morfometria geométrica.. Populações. Origem. Coordenadas. Nº. Machos. Nº. Fêmeas. Habitat. R. neglectus1. Brasília, DF, Brasil. 15º55’S, 47º54’W. 20. 20. Laboratório. 1. Ibague, Tolima, Colômbia. 2º59’N, 74º29’W. 20. 20. Laboratório. 2. R. robustus. Benfica, Pará, Brasil. 5º16’S, 49º50’W. 20. 20. Palmeiras (Attallea speciosa). R. nasutus2. Curaçá, BA, Brasil. 8º59’S, 39º54’W. 14. 11. Palmeiras (Copernicia cerifera). R. prolixus. 1. Colônias estabelecidas há mais de 2 anos em laboratório; 2. Geração 1 misturada com Geração 2.. Primeiramente os triatomíneos foram separados por espécie e por sexo e depois as asas (hemiélitros) foram dissecadas e montadas entre lâmina e lamínula com resina (Entellan®). Sete pontos de referência das asas de cada inseto foram tomados por captura de imagem digital usando um scanner de mesa com resolução de 1200 dpi e cor escala de cinza (Figura 4). Para cada indivíduo as asas esquerdas foram refletidas para também serem utilizadas na análise. Destes pontos, cinco foram considerados marcos anatômicos do tipo 1 (inserção de veias das asas) e dois marcos anatômicos do tipo 2 (extremidade da asa) segundo a classificação de Bookstein (1990). A análise morfométrica incluindo variação de tamanho e forma foi realizada de acordo com a orientação de Gurgel-Gonçalves, 2006 (comunicação pessoal) e com os softwares adequados para interpretação, o programa tpsDig (Rohlf, 1999a) e o programa tpsRegr (Rohlf, 1999b).. Figura 4. Asa direita de Rhodnius neglectus com os sete pontos de referência usados nas análises morfométricas.. 11.
(26) 3.2.1 Análise estatística. As diferenças de tamanho entre espécies e sexos foram ilustradas por diagramas de caixas e a significância das comparações foi testada por análises de variância (ANOVA) e Teste t.. 3.3 Métodos para o desenvolvimento das colônias de insetos Inicialmente foram selecionadas aleatoriamente 60 ninfas de quinto estádio (30 ninfas de R. neglectus e 30 ninfas de R. robustus), para obtenção de adultos virgens. Após a muda, foram formados 3 grupos compostos de 4 fêmeas e 3 machos, para cada espécie. Os casais de cada espécie foram mantidos em conjunto para a obtenção de ovos em recipientes de plástico (9,5 cm de altura x 5,5 cm de diâmetro), com tampas com uma abertura de 4,5 cm de diâmetro forrado com uma malha de arame. Os recipientes de plástico tinham o fundo forrado com papel filtro e contendo tiras do mesmo papel, dobradas em sanfona, para aumentar a superfície de contato e para absorver a umidade (Rocha et al, 1997). Após a postura, 80 ovos foram agrupados pela data de oviposição para determinar o período de eclosão (embrionamento). Após a eclosão, as ninfas de primeiro estádio foram separadas individualmente em outros recipientes para as posteriores ecdises. As observações foram conduzidas sob condições controladas de temperatura (28ºC ± 2ºC) e umidade relativa (75% ± 10%). A fim de documentar o comportamento dos insetos “uma arena experimental” foi preparada, consistente em uma cuba de vidro transparente de 30 cm de diâmetro. No interior de cada um desses recipientes colocávamos, individualmente um camundongo albino (Swiss 44, macho, com 30 dias de nascido) que foram imobilizados com a ajuda de uma malha de arame (9cm de largura x 10cm de comprimento) (Rocha et al, 1997). Frente a esse hospedeiro foi colocado um espécime, para o registro dos padrões de alimentação e defecação. Todas as observações foram acompanhadas e cronometradas pela autora por um período de até uma hora.. 12.
(27) 3.4 Estabelecimento das estatísticas vitais dos triatomíneos. O número de ovos produzidos está diretamente relacionado à quantidade de sangue ingerido (Buxton, 1930; Friend et al, 1965; Regis, 1979). Por isso, na fase inicial, os insetos adultos dos seis grupos compostos formados, foram alimentados duas vezes por semana para aumentar a produção de ovos. Os insetos foram observados diariamente a fim de determinar os percentuais de mortalidade, o período de embrionamento dos ovos e o período total de evolução das espécies em condições de laboratório. A alimentação foi oferecida, aproximadamente, 7 dias após a cada ecdise e o tempo de oferecimento da fonte sanguínea foi de no máximo 35 minutos. Somente aqueles exemplares que se recusavam a sugar ou sugavam pouca quantidade de sangue eram submetidos à nova tentativa de alimentação.. 3.5 Alguns aspectos de comportamento alimentar experimental. Para ambas as espécies foram estudadas as seguintes variáveis relacionadas com a caracterização das duas espécies em seu papel como transmissoras de T. rangeli, através da observação direta por parte da autora e registro do tempo: a) Tempo de aproximação: Tempo (em minutos) desde que o inseto foi colocado na vasilha até o momento de introdução da probóscide na pele do camundongo ("probing"); b) Número de picadas: Foi registrado o número de vezes que o inseto encostou e introduziu a probóscide na tentativa de encontrar vênulas/arteríolas na pele do camundongo, antes do início evidente do seu repasto; c) Tempo do repasto: Tempo em minutos entre a primeira picada e o fim da ingestão de sangue; d) Índice de picadas: Calculado dividindo-se o número de picadas pelo tempo do repasto, resultando no número de picadas por minuto (Botto-Mahan et al., 2006). Os dados foram transformados utilizando Escala Logarítimica para a normalização dos dados e esses foram submetidos a uma Análise de Variância, tendo como fatores espécie e estádio ninfal; e) Número de interrupções: Contabilizou-se o número de interrupções espontâneas do inseto, após a verificação do início do repasto; 13.
(28) f) Lapso entre o final do repasto e a primeira defecação: Este intervalo de tempo também foi registrado (em minutos); g) Defecação: Verificou-se o número de defecações por inseto durante e até 10 minutos após o repasto por observação direta do inseto; h) Quantidade de sangue ingerido em cada estágio ninfal: Todos os insetos foram pesados antes e imediatamente após o repasto em balança analítica AND HR-200, graduada em mg para designar a quantidade de sangue ingerido. Para a análise estatística dos resultados, primeiramente foi utilizado o Teste de Kolmogorov-Smirnov, para verificar a normalidade. Para os parâmetros com distribuição normal, utilizou-se o Teste t, e para os parâmetros que não apresentaram distribuição normal, utilizou-se o Teste de Mann-Whitney.. 3.6 Estudo anatômico e histológico das glândulas salivares. Para este estudo utilizamos exemplares de R. robustus, adultos e de ambos os sexos e foi utilizada somente a glândula D1, pelo fato da glândula D2 ser mais frágil, dificultando assim a sua extração. Primeiramente, o exemplar foi narcotizado com éter, cortou-se os bordos laterais dos esternitos, aprofundando até à região cervical. Fixou-se o exemplar, em uma placa de Petri forrada com uma camada de parafina. A seguir retirou-se os tergitos expondo as glândulas salivares, parte do aparelho digestivo, o vaso dorsal, o corpo gorduroso, o sistema traqueal e a musculatura. Após a exposição das glândulas instilou-se solução salina para não provocar o ressecamento. Os exemplares utilizados estavam de jejum prolongado (aproximadamente 30 dias), para não dificultar o encontro das glândulas pela presença do repasto sanguíneo. Após a exposição das glândulas, fotos digitais (Coolpix 5700, 5.0Mpx da Nikon) foram tiradas para documentar as características morfológicas das glândulas salivares dos R. robustus. Para o estudo histológico, as glândulas salivares foram extraídas, colocadas em formol a 10% e levadas ao Laboratório de Patologia da Faculdade de Medicina para o processamento, onde foram feitos cortes histológicos de 5 μm, com coloração H.E. (Hematoxilina – eosina).. 14.
(29) 3.7 Suscetibilidade experimental dos triatomíneos ao T. rangeli. A suscetibilidade das duas diferentes espécies de Rhodnius para T. rangeli foi avaliada usando-se camundongos, que foram inoculados por via intraperitoneal com altas concentrações (5x107 flagelados/ml) dos isolados brasileiros de T. rangeli (Figura 5), a cepa SC-58 (Grisard et al, 1999) e a cepa LP-01, isolada recentemente de R. neglectus naturalmente infectado, procedente de Ituiutaba – MG (Gurgel-Gonçalves et al., 2006a).. A. B. Figura 5. Formas epimastigotas e tripomastigotas de T. rangeli da cultura SC-58 (100x). A. Epimastigota; B. Tripomastigota.. Vinte e quatro horas após a inoculação, uma amostra de sangue foi retirada através de um corte na cauda do camundongo e foi analisada para verificar a positividade da infecção. Como houve negatividade para SC-58, novas amostras foram coletadas a cada 48 horas após a inoculação. Também foi realizada uma inoculação intracelômica nos insetos, onde uma certa quantidade da cultura da cepa SC-58, foi injetada diretamente na parte torácica dorsal abaixo da asa do inseto (D’Alessandro & Saravia, 1992).. 15.
(30) Xenodiagnósticos artificiais foram realizados com 30 espécimes de R. neglectus e 20 espécimes de R. robustus, que formaram os grupos experimentais, A e B. Para isso, foram selecionadas ninfas de IV e V estádios. Para o xenodiagnóstico artificial, 3 ml da cultura da cepa SC-58 foram adicionados a 5 ml de sangue humano em um tubo com heparina. O sangue infectante foi levado ao Laboratório de Doença de Chagas no Núcleo de Medicina Tropical, onde foi primeiramente colocado em banho-maria para atingir a temperatura corporal (36,5°C). Depois foi levado ao aparelho de Xenodiagnóstico Artificial, onde as ninfas foram colocadas para a realização do repasto sanguíneo infectante. Ao término do procedimento, cada inseto foi colocado individualmente em um recipiente apropriado e identificado. Os insetos foram observados diariamente para verificar a taxa de mortalidade, estabelecendo assim o grau patogênico do T. rangeli sobre os triatomíneos. Depois de sete dias do repasto infectante, os conteúdos intestinais foram examinados microscopicamente. Como houve negatividade, novas amostras foram coletadas com 15 dias após o repasto infectante. Após a comprovação da infecção intestinal, amostras hemolinfáticas foram coletadas para comprovar a invasão da hemolinfa. Com a cepa LP-01, foi realizada uma inoculação intraperitoneal em camundongos de laboratório. Vinte e quatro horas após a inoculação, uma amostra de sangue foi retirada através de um corte na cauda do camundongo e foi analisada para verificar a positividade da infecção.. 3.8 Infecção in vitro das glândulas salivares. Baseando-se em De Oliveira & De Souza (2001) que aplicaram o modelo de estudo para intestino de R. prolixus, utilizamos um método modificado para o estudo da infecção in vitro das glândulas salivares através da Microscopia Eletrônica de Varredura. Primeiramente 20 adultos de R. robustus foram mantidos em jejum por um período de um mês, para a remoção das glândulas salivares. Para o controle, uma glândula salivar foi extraída e colocada diretamente no fixador para o processamento. Uma cultura da cepa SC-58 foi incubada por 14 dias em Agar sangue, até apresentar altas concentrações de tripomastigotas/epimastigotas. O protocolo usado para a infecção experimental das glândulas salivares está ilustrado na Figura 6. 16.
(31) Acrescentou-se 500 µl de tampão (200 mM NaCl, 5,4 mM KCl, 1 mM CaCl2, 2 mM NaHCO3, pH 6.8) no sedimento e agitou-se. Colocou-se em 8 eppendorfs 500 µl da cultura + 1.000 µl de PBS. 2. 1. 3. Centrifugou-se por 10 minutos a 2.000 rpm, desprezando-se o sobrenadante. Repetiu-se os procedimentos 1 e 2.. Após a agitação, colocou-se uma glândula salivar em cada eppendorf e a partir daí foram utilizados os 4 tempos.. 4. 30’. 1h b. a. 3h c. 24h d. Figura 6. Protocolo utilizado para a infecção experimental "in vitro" das glândulas salivares.. Após o término dos 4 tempos (a, b, c e d), as glândulas salivares foram processadas para a Microscopia Eletrônica de Varredura: 1. Ao final de cada tempo o sobrenadante foi retirado e foi colocado 150 µl do fixador (2% glutaraldeído, 2% paraformaldeído, 3% de sacarose); 2. O fixador foi retirado e foram feitas 4 lavagens de 15 minutos com o tampão cacodilato de sódio 0,1 M, pH 7,2; 3. O tampão foi retirado e colocou-se 2 gotas de ferricianeto de potássio e 2 gotas de tetróxido de ósmio; 4. Após a inoculação por 1 hora, lavou-se as amostras 3 vezes com água destilada; 17.
(32) 5. Iniciou-se o processo de desidratação com acetona 30%, 50%, 70% e 90% por 15 minutos cada uma, e 3 lavagens com acetona 100% por 10 minutos cada uma; 6. As amostras foram colocadas num suporte e levadas ao aparelho de secagem ao ponto crítico da Balzers CPD 30; 7. Após a secagem, as amostras foram presas em stubs e levadas ao aparelho Sputter Coater, Balzers SCD 050, para metalização.. Após a metalização, as amostras foram levadas ao Microscópio Eletrônico de Varredura JEOL JEM 840A (x13 – x3.000) para o registro das infecções. Para a Microscopia Óptica, foram utilizados 2 eppendorfs com 500 µl de cultura e seguiu-se os passos do 1 ao 3 do protocolo utilizado para a infecção. Uma glândula foi extraída, colocada numa lâmina escavada e acrescentou-se 0,03 ml de cultura. Registrou-se a infecção durante os quatro tempos.. 18.
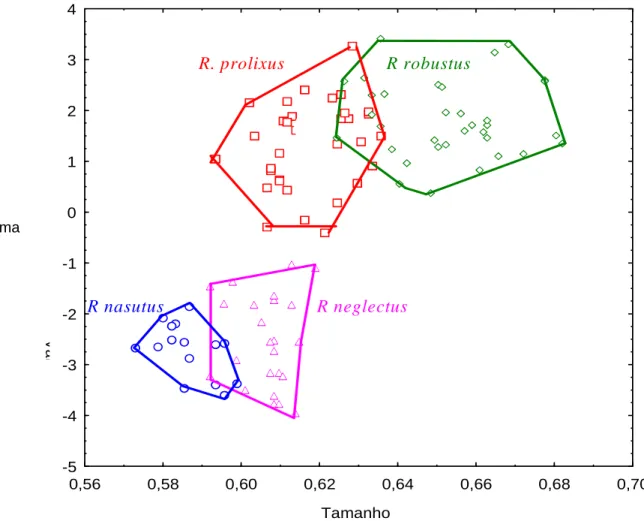
(33) 4. RESULTADOS. 4.1 Identificação dos espécimes de Rhodnius Comprovou-se através da utilização das chaves descritas por Lent & Wygodzinsky (1979) tratar-se das espécies R. neglectus e R. robustus. Essa identificação foi confirmada através das técnicas de morfometria geométrica de asas, conforme resultado abaixo. O dimorfismo sexual foi observado nas análises de variação de tamanho: asas das fêmeas foram significativamente maiores que as dos machos. Analisando as populações separadamente por sexo foi observado que as asas menores pertenceram as espécies de R.nasutus e R. neglectus e as maiores a R. robustus e R. prolixus. As menores asas pertenceram aos machos de R. neglectus ( x = 0,57 ± 0,015) e as maiores pertenceram às fêmeas de R. robustus ( x = 0,69 ± 0,020), sendo significativamente diferentes (p<0,001) (Figura 7). Essas diferenças foram mais significativas para asas de machos (ANOVA, F=168,8; p<0,001) que de fêmeas (ANOVA, F=58,9; p<0,001).. 19.
(34) 0,76 0,74 0,72 0,70. Tamanho. 0,68 0,66 0,64 0,62. T. 0,60 0,58 0,56 0,54 0,52 RM. RP RNA. RN RR. Sexo: F. RM. RP RNA. RN RR. Mean ±SD Min-Max. Sexo: M. Figura 7. Variação do tamanho da asa entre populações e sexos de espécies de Rhodnius. Cada caixa mostra a média, o desvio padrão e o mínimo e máximo para cada população. Legenda: RNA (R. nasutus), RN (R. neglectus), RP (R. prolixus) e RR (R. robustus).. Analisando as asas dos machos, os resultados da morfometria geométrica de asas de Rhodnius mostram que é possível diferenciar as espécies, formando dois agrupamentos morfológicos: um formado por (R.neglectus + R.nasutus) e outro por (R.robustus + R.prolixus), permitindo dessa forma a diferenciação entre os espécimes de R. neglectus e R. robustus usados no presente estudo (Figura 8).. 20.
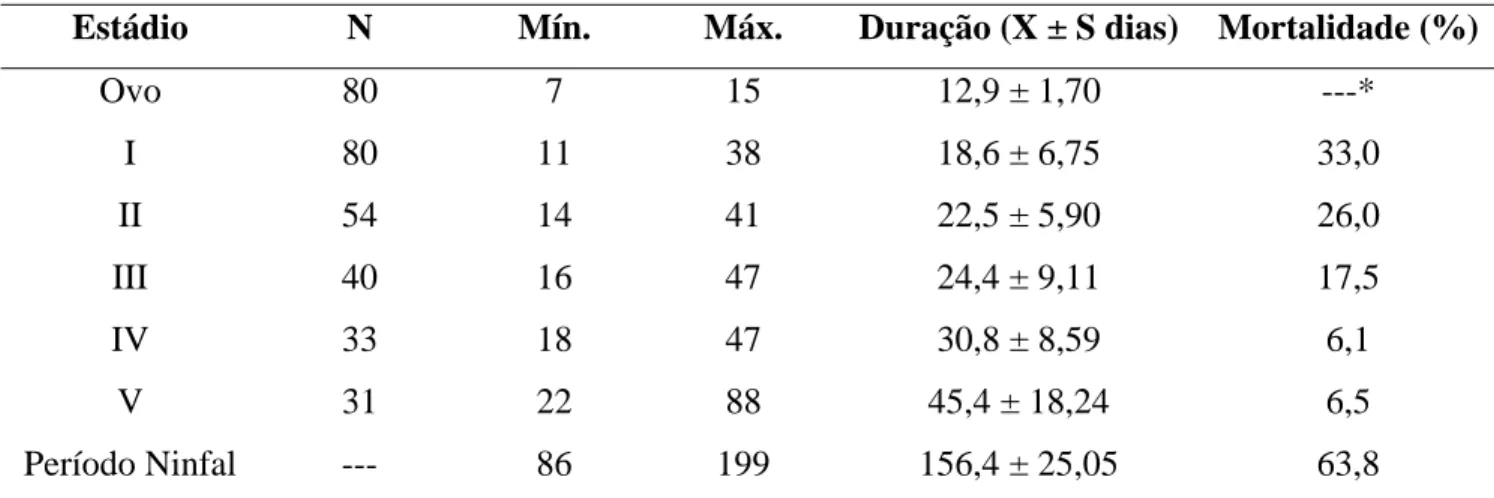
(35) 4 3. R. prolixus. R robustus. 2 1 0. Forma -1 -2. R nasutus. R neglectus. Var. -3 -4 -5 0,56. 0,58. 0,60. 0,62. 0,64. 0,66. 0,68. 0,70. Tamanho. Figura 8. Mapa fatorial mostrando a variação de tamanho e forma para machos de populações de Rhodnius. Os polígonos correspondem às diferentes populações estudadas.. 4.2 Estabelecimento das estatísticas vitais dos triatomíneos Como os ovos não embrionados foram substituídos, dos 80 espécimes de R. neglectus, 31 (38,8%) atingiram a fase adulta (Tabela 3). Da Ninfa I à Ninfa III, os insetos necessitaram, em média, de menos de um mês para alcançarem o estádio seguinte. As médias obtidas estão distribuídas de forma crescente de acordo com a muda ninfal até o estádio adulto. Os percentuais de mortalidade variaram em relação aos estádios de desenvolvimento. Os maiores percentuais de mortalidade foram registrados para as Ninfas I e II. As Ninfas IV e V apresentaram quase o mesmo percentual.. 21.
(36) Tabela 3: Período de desenvolvimento (em dias) de cada estádio de R. neglectus e percentual de mortalidade por fase de desenvolvimento. Estádio. N. Mín.. Máx.. Duração (X ± S dias). Mortalidade (%). Ovo. 80. 7. 15. 12,9 ± 1,70. ---*. I. 80. 11. 38. 18,6 ± 6,75. 33,0. II. 54. 14. 41. 22,5 ± 5,90. 26,0. III. 40. 16. 47. 24,4 ± 9,11. 17,5. IV. 33. 18. 47. 30,8 ± 8,59. 6,1. V. 31. 22. 88. 45,4 ± 18,24. 6,5. Período Ninfal. ---. 86. 199. 156,4 ± 25,05. 63,8. N: número de insetos; X: média; S: desvio padrão; I: 1° estádio; II: 2° estádio; III: 3° estádio; IV: 4° estádio; V: 5° estádio. * Os ovos não embrionados foram descartados e substituídos.. Dos 80 espécimes de R. robustus, 38 (47,5%) chegaram à fase adulta (Tabela 4). Se comparado com R. neglectus, o período de desenvolvimento foi maior em todos os estádios. Apenas as Ninfas I e II, levaram em média, menos de um mês para atingir o estádio seguinte. Os percentuais de mortalidade também tiveram uma variação diferente de R. neglectus, onde os maiores percentuais pertenceram às Ninfas I e V.. Tabela 4: Período de desenvolvimento (em dias) de cada estádio de R. robustus e percentual de mortalidade por fase de desenvolvimento. Estádio. N. Mín.. Máx.. Duração (X ± S dias). Mortalidade (%). Ovo. 80. 14. 23. 17,5 ± 1,57. ---*. I. 80. 18. 48. 23,4 ± 4,92. 33,8. II. 53. 23. 45. 28,5 ± 4,83. 7,5. III. 49. 32. 53. 40,7 ± 5,85. 14,3. IV. 42. 30. 63. 46,3 ± 11,06. 9,5. V. 38. 32. 59. 47,2 ± 8,92. 26,3. Período Ninfal. ---. 182. 228. 204,7 ± 13,22. 65,0. N: número de insetos; X: média; S: desvio padrão; I: 1° estádio; II: 2° estádio; III: 3° estádio; IV: 4° estádio; V: 5° estádio. * Os ovos não embrionados foram descartados e substituídos.. 22.
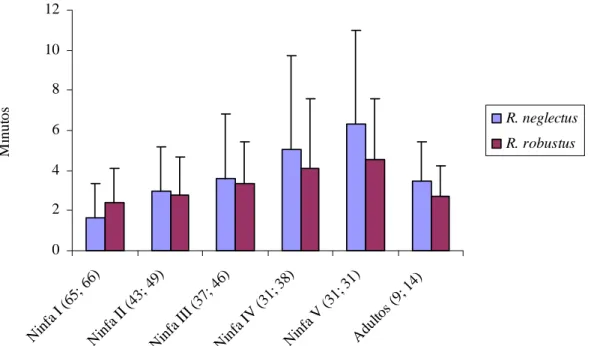
(37) A Tabela 5 mostra comparativamente o período de desenvolvimento (em dias) de cada estádio, das duas espécies utilizadas. Nota-se que o período foi muito maior para R. robustus, sendo que apresentaram quase o mesmo tempo no período de embrionamento e na muda do 2º para o 3º estádio e na última muda. Houve diferença significativa (p<0,001) para todos os estádios, exceto para as Ninfas V.. Tabela 5: Período de desenvolvimento (em dias) de cada estádio de R. neglectus e R. robustus. Estádio. Duração R. neglectus (X ± S dias). Duração R. robustus (X ± S dias). Ovo. 12,9 ± 1,70. 17,5 ± 1,57. I. 18,6 ± 6,75. 23,4 ± 4,92. II. 22,5 ± 5,90. 28,5 ± 4,83. III. 24,4 ± 9,11. 40,7 ± 5,85. IV. 30,8 ± 8,59. 46,3 ± 11,06. V. 45,4 ± 18,24. 47,2 ± 8,92. Período Ninfal. 156,4 ± 25,05. 204,7 ± 13,22. X: média; S: desvio padrão; I: 1° estádio; II: 2° estádio; III: 3° estádio; IV: 4° estádio; V: 5° estádio.. 4.3 Comportamento alimentar em relação à transmissão do T. rangeli. 4.3.1 Tempo de aproximação dos insetos à fonte alimentar – Para R. neglectus, o tempo aumentou de acordo com a mudança de estádio, sendo que na fase adulta o tempo foi de quase 50% a menos que na Ninfa V, mas não houve diferença significativa entre as médias. Já as Ninfas III e os adultos apresentaram praticamente o mesmo tempo, 3,6 e 3,5 respectivamente (Figura 9). A ninfa I foi a única que apresentou diferença significativa com relação à todas as outras médias (p<0,001). Para R. robustus, as variações foram muito parecidas, até na fase adulta também ocorreu uma redução de quase 50% se comparado à Ninfa V, e nessa espécie houve diferença significativa (p<0,05). A Ninfa I também apresentou diferença significativa, com relação às Ninfas III, IV e V (p<0,05).. 23.
(38) 12 10. Minutos. 8 R. neglectus. 6. R. robustus 4 2. 4) 9; 1. 31 ) aV. in f N. du lto s(. (3 1;. 1; (3 V. N. in f. aI. aI in f N. A. ) 38. ) 46 7; (3 II. I( aI in f N. N. in fa. I(. 43 ;. 65 ;6. 49 ). 6). 0. Estádios evolutivos dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 9. Valor médio do tempo de aproximação dos R. neglectus e R. robustus. As barras representam o desvio padrão da média.. 4.3.2 Número de picadas – O número de picadas foi variável. Tanto para R. neglectus quanto para R. robustus, as Ninfas I foram as que apresentaram o maior número de picadas ( x = 7,4 e x = 5,6), seguido da Ninfa II ( x = 4,3 e x = 3,4). Mas as Ninfas III, IV e V apresentaram praticamente o mesmo número de picadas, com uma média de 4 picadas para R. neglectus e 3 picadas para R. robustus. O que apresentou menor número de picadas até o início do repasto foram os triatomíneos da fase adulta (Figura 10). As Ninfas I e os insetos adultos das duas espécies apresentaram diferença significativa com todas as outras médias (p<0,001).. 24.
(39) Número de picadas. 14 12 10 8 6 4. R. neglectus R. robustus. II (4 3; 49 N ) in fa III (3 7; 46 N ) in fa IV (3 1; 38 N ) in fa V (3 1; 31 ) A du lto s( 9; 14 ). in fa N. N. in fa. I( 65 ;6 6). 2 0. Estádios evolutivos dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 10. Valor médio do número de picadas de R. neglectus e R. robustus na fonte alimentar. As barras representam o desvio padrão das médias.. 4.3.3 Tempo do repasto sanguíneo – O valor médio foi similar para as duas espécies estudadas, mas não apresentaram diferença estatística (p>0,001). A duração do repasto aumentou com a aproximação da fase adulta, mas as Ninfas V foram as que apresentaram a maior média. Na fase adulta ocorreu uma redução no período de repasto (Figura 11).. 25.
(40) 35 30 R. neglectus. 4) (9 lto s. du A. aV in f N. aI in f N. ;1. 31 (3. 1; (3 V. II aI in f N. 1;. 38. 46 7; (3. 43 I( aI in f N. ). ). 9) ;4. 66 5; (6 aI in f N. ). R. robustus. ). Minutos. 25 20 15 10 5 0. Estádios evolutivos dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 11. Valor médio do tempo total do repasto sanguíneo para R. neglectus e para R. robustus. As barras representam o desvio padrão das médias.. 4.3.4 Índice de picadas – Comparando-se a média geral das duas espécies, o índice de picadas é 60% maior para R. neglectus (0,35 ± 0,03, N = 216). R. robustus apresentou uma média de 0,22 ± 0,01, N = 244. Para as duas espécies, a Ninfa I apresentou o maior índice de picadas por minuto, e esse parâmetro diminuiu com o desenvolvimento do inseto, atingindo na fase adulta o menor índice (Figura 12).. 26.
(41) Picadas por minuto. 0,70 0,60. R. neglectus. 0,50. R. robustus. 0,40 0,30 0,20 0,10. ;1 (9. 1; du A. aV in f N. lto s. (3. 1; (3 V aI in f N. 4). ) 31. ) 38. ) 46 7; (3 II. N. in f. aI. aI in f N. N. in f. aI. I(. (6. 43. 5;. ;4. 66. 9). ). 0,00. Estádios evolutivos dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 12. Índice de picadas para R. neglectus e para R. robustus. As barras representam o erro padrão.. 4.3.5 Número de interrupções – Em R. neglectus, o número de interrupções foi maior para as Ninfas I com a média de 2,3 interrupções por repasto (Figura 13). As Ninfas IV e V apresentaram a mesma média de interrupções (1,33). Em R. robustus, o número de interrupções foi muito parecido para as Ninfas I, II e IV, com a média de 2 a 3 interrupções por repasto.. 27.
(42) R. neglectus. N. in f. (6 5; 6 in fa I N. aI I( 43 ;4 N 9) in fa III (3 7; 46 N ) in fa IV (3 1; 38 N ) in fa V (3 1; 31 ) A du lto s( 9; 14 ). R. robustus. 6). Número de interrupções. 4,5 4 3,5 3 2,5 2 1,5 1 0,5 0. Estádios evolutivos dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 13. Valor médio do número de interrupções durante a alimentação por R. neglectus e por R. robustus. As barras representam o desvio padrão.. 4.3.6 Lapso entre o final do repasto e a primeira defecação – Para R. neglectus as Ninfas I não defecaram durante o período de 10 minutos, estabelecido para avaliar esse experimento. Os adultos apresentaram um tempo maior para a primeira defecação, em média 5 minutos, mas não houve diferença significativa entre a média dos adultos e dos outros estádios ninfais (Figura 14). Para R. robustus, as Ninfas I apresentaram o maior tempo para a defecação (quase 8 minutos), e houve diferença significativa com as Ninfas II, III, IV e adultos (p<0,05).. 28.
(43) R. neglectus. in fa N. du lto s( 9; 14 ). (3 V. (3 V aI. in f. A. 38 ) 1;. (3 7; 46 ) III N. N. in fa. I( 43 ;4 9). N. in f. aI. I( in fa N. 1; 31 ). R. robustus. 65 ;6 6). Minutos. 9 8 7 6 5 4 3 2 1 0. Estádio de desenvolvimento dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 14. Valor médio do tempo entre o final do repasto até a primeira defecação dos R. neglectus e R. robustus. As barras representam o desvio padrão das médias.. 4.3.7 Defecação – Os percentuais de defecações observados durante todo o ciclo em um período de até 10 minutos após o término da alimentação foram variáveis. Tanto para R. neglectus e R. robustus, o maior percentual de defecações observadas em até 10 minutos, ocorreu com as Ninfas V, com uma média de 90% (Figura 15). Para R. neglectus, o menor percentual foi registrado para as Ninfas II (35%), seguido dos adultos (44%). As Ninfas III e IV apresentaram aproximadamente a mesma média, 63 e 67% respectivamente. Para R. robustus, o menor percentual foi registrado nas Ninfas I (3%), seguido em ordem crescente das Ninfas II (22%), III (41%), IV (53%) e adultos (60,8%).. 29.
(44) R. neglectus. (9 ;1 4). A. du lto s. (3 1; V. N. aI N. in f. in f N. in fa. V. (3 aI. II. II ( in fa N. (3 1; 38 ). 7; 46 ). 9) 43. ;4. 65 ;6 I( in fa N. 31 ). R. robustus. 6). Porcentagem. 1 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0. Estádios evolutivos dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 15. Percentuais de defecações para R. neglectus e para R. robustus, por estádio ninfal, somando as observações realizadas durante e após o repasto.. 4.3.8 Quantidade de sangue ingerido em cada estádio ninfal – Para as duas espécies, a quantidade de sangue ingerido foi crescente com o decorrer do desenvolvimento dos insetos, alcançando o pico pelas Ninfas V. Houve uma diferença acentuada entre as médias das duas espécies (p<0,001). Para R. neglectus, na fase adulta houve um decréscimo na quantidade de sangue ingerido, com a diminuição de quase 50% do volume (Figura 16). Houve diferença significativa entre a quantidade de sangue ingerido por todos os estádios ninfais. Para R. robustus, também houve um decréscimo na fase adulta, mas não houve diferença significativa entre a quantidade de sangue ingerida pelos dois últimos estádios ninfais.. 30.
(45) Quantidade de sangue ingerido (mg). 250 200 150. R. neglectus R. robustus. 100 50. 49 ) in fa III (3 7; 46 N ) in fa IV (3 1; 38 N ) in fa V (3 1; 31 ) A du lto s( 9; 14 ) N. in fa N. N. in fa I. (6. II (4 3;. 5; 6. 6). 0. Estádio evolutivo dos insetos (número de indivíduos R. neglectus e R. robustus ). Figura 16. Valores médios (em mg) da quantidade de sangue ingerido por R. neglectus e por R. robustus. As barras representam o desvio padrão das médias. 4.4 Estudo anatômico e histológico das glândulas salivares Após a retirada dos tergitos e esternitos de R. robustus, foi possível observar com clareza os dois pares de glândulas, D1 e D2 (Figura 17). De forma geral, as glândulas são alongadas e de cor avermelhada, o que facilita a sua visualização. A coloração resulta da presença de uma proteína de pigmento vermelho presente nas glândulas do gênero Rhodnius.. 31.
(46) CA TO D1. D1 D2. D2. Figura 17. Vista interna das glândulas salivares de Rhodnius robustus. CA: cabeça; TO: tórax; D1 e D2: glândulas salivares.. Os cortes histológicos mostraram uma nítida vacuolização citoplasmática no corpo e nas extremidades e lúmen preenchido parcialmente com material granular, indicando vestígios de saliva (Figura 18). A maioria de suas células são colunares com núcleo ovóide e cromatina finamente granular. Apresenta ducto com células colunares baixas com núcleo ovóide menor que as células secretoras e citoplasma claro (Figura 19).. 32.
(47) Figura 18. Corte histológico longitudinal pela glândula salivar D1 de Rhodnius robustus corado pelo H. E. (x100).. Se. Cc Dc. Figura 19. Detalhe da extremidade da glândula salivar D1 de R. robustus. Cc: células colunares; Dc: ducto Se: secreção (x400)..
(48) Observou-se também a presença de uma pequena zona com lúmen virtual, onde as células apresentam a sua máxima balonização. Duas estruturas papilares precedem essa zona, com eixo conjuntivo sem balonização citoplasmática (Figura 20).. Ep. Cb. Figura 20.. Detalhe da parte central da glândula salivar de R. robustus. Cb: células. balonizadas no lúmen virtual; Ep: estruturas papilares (x400).. 4.5 Suscetibilidade experimental dos triatomíneos ao T. rangeli Não houve positividade nas tentativas de inoculação intraperitoneal em camundongos e de inoculação intracelômica em insetos com a cepa SC-58. Com a cepa LP-01, um camundongo apresentou formas tripomastigotas no sangue, 48 horas após a inoculação. Após a confirmação, foi realizado um xenodiagnóstico com 20 espécimes (Ninfa V) de R. robustus. Após 15 dias, eles foram examinados e 45% dos espécimes estavam infectados ao nível do intestino e amostras de hemolinfa foram recolhidas e examinadas. Não houve positividade da hemolinfa e não houve positividade intestinal nos outros espécimes. A maioria dos insetos não conseguiu emergir da exúvia e acabaram morrendo. Três xenodiagnósticos artificiais com a cepa SC-58, foram realizados com R. neglectus, que foram examinados 15 dias após o processo e apresentaram 100% de infecção intestinal. Após a confirmação da positividade, amostras da hemolinfa foram recolhidas e.
(49) examinadas. Dos 90 insetos utilizados para o xenodiagnóstico, apenas 1 apresentou hemolinfa positiva, mas não houve infecção das glândulas salivares. Com R. robustus, foi realizado um xenodiagnóstico artificial em 30 espécimes e com 15 dias observou-se 100% de infecção ao nível de intestino. Desses infectados, apenas 1 apresentou hemolinfa positiva, mas como rejeitou a alimentação acabou morrendo sem a progressão da infecção.. 4.6 Infecção in vitro das glândulas salivares Após o preparo, as amostras foram levadas ao Microscópio Eletrônico de Varredura, e imagens foram obtidas para verificar o processo inicial de penetração do T. rangeli em glândulas salivares. A glândula salivar utilizada como controle, apresentou a maior parte da lâmina basal lisa, com pequenos enrugamentos visíveis e com pequenas fissuras (Figura 21).. Figura 21. Microscopia Eletrônica de Varredura (MEV) da glândula salivar não infectada de R. robustus (x140). Em destaque, pequenas fissuras na lâmina basal (x1.600).. 35.
Imagem




Documentos relacionados
Na vertente prática, foi feito o acompanhamento da implementação dos módulos já adjudicados à iPortalMais de Gestão de Correspondência Recebida e Gestão de Reuniões da
Os resultados revelam que os estudantes apresentaram dificuldades na elaboração dos mapas conceituais devido a não utilização deste instrumento no processo de ensino, porém
Entender e responder questões sobre a influência do cigarro, com inalação predominante de monóxido de carbono (CO) associadas às baixas tensões de oxigênio (O2)
Considerando a importância dos tratores agrícolas e características dos seus rodados pneumáticos em desenvolver força de tração e flutuação no solo, o presente trabalho
A simple experimental arrangement consisting of a mechanical system of colliding balls and an electrical circuit containing a crystal oscillator and an electronic counter is used
Foram aleatoriamente amostrados de 6 a 20 indivíduos por população nativa de Hancornia speciosa, num total de seis populações e 94 indivíduos, sendo 59 naturais
[r]