Lillian Rabelo Lopes
Influência de Fatores Biológicos na Mobilidade de Arsênio
Presente em Solos da Cidade de Ouro Preto – Estudos “
in vitro
”
Orientadora: Profa. Dra. Mônica Cristina Teixeira
Ouro Preto, MG
Março, 2014
Catalogação: sisbin@sisbin.ufop.br L864i Lopes, Lillian Rabelo.
Influência de fatores biológicos na mobilidade de arsênio presente em solos da cidade de Ouro Preto – Estudos “in vitro” [manuscrito] / Lillian
Rabelo Lopes - 2014.
104f.: il., color.; grafs.; tabs.
Orientadora: Profa. Dra. Mônica Cristina Teixeira.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Mestrado em Engenharia Ambiental.
Área de concentração: Tecnologias Ambientais.
1. Matéria orgânica - Teses. 2. Arsênio - Teses. 3. Ouro Preto (MG) - Teses. 4. Solo - Teses. I. Teixeira, Mônica Cristina. II. Universidade Federal de Ouro Preto. III. Título.
apoiaram e ouviram mesmo que algumas vezes não entendiam muito bem sobre o que falava; Às minhas irmãs, Livian e Meire, e sobrinhas, Júlia e Maria Eduarda;
Ao meu avô Vicente, que sempre se orgulhou de mim;
À minha orientadora Profa. Mônica Cristina Teixeira, pelos ensinamentos e confiança;
Aos professores Hubert Matias Peter Roeser, Leonardo Evangelista Lagoeiro e Robson José de Cássia Franco Afonso por auxiliarem em minhas análises;
Aos Laboratórios de Geoquímica Ambiental, Difratometria de Raio X e Microscopia e Microanálise da Universidade Federal de Ouro Preto por realizarem as análises das minhas amostras;
Ao PROAMB, Capes e FAPEMIG pelos auxílios financeiros fundamentais para a realização deste trabalho e participação em eventos de divulgação de parte desta pesquisa;
À todos que de alguma maneira colaboraram para que este trabalho fosse realizado e concluído;
Enfim, agradeço especialmente ao meu marido Juliano, que nunca deixou faltar o apoio nos momentos em que mais precisei, sempre ouvindo e me incentivando a seguir em frente, por mais que eu duvidasse que não conseguiria;
À minha filha Luísa, que deu outro sentido à minha vida e me mostrou o que realmente importa.
principalmente de ouro, associado a minerais como a arsenopirita (AsFeS). O As é tóxico e carcinogênico e a exposição crônica ao elemento resulta em vários problemas de saúde. A cidade de Ouro Preto está localizada no Quadrilátero Ferrífero de Minas Gerais, região com formações rochosas ricas em minerais contendo As que, uma vez solubilizado, pode contaminar a água ou os alimentos. O objetivo deste trabalho é estudar a mobilidade do arsênio presente em amostras de solo na presença de matéria orgânica e bactérias redutoras de sulfato (BRS). Além disso, visa-se obter culturas de bactérias resistentes ao metalóide e fornecer subsídios para estudos futuros de remediação/biorremediação de áreas contaminadas por As. Para tanto, amostras de solo foram coletadas em minas de ouro abandonadas (Mina Velha, Chico Rei e Santa Rita). As composições química e mineralógica das amostras foram determinadas. Alíquotas de 5 g de amostras sólidas previamente dessecadas foram colocadas em contato com diferentes meios lixiviantes: (A) 35 ml de CaCl2 , 2,5 mM; (B) 35 ml de CaCl2, 2,5 mM + 5 g de pó de penas de galinha; (C) 35 ml de CaCl2, 2,5 mM + 5 ml de inóculo bacteriano e (D) 35 ml de CaCl2 ,2,5 mM + 5 g de pó de penas de galinha + 5 ml de inóculo bacteriano. Os tubos lacrados foram agitados por 5 minutos e deixados em repouso por 1, 30, 60, 90 e 120 dias a 21,0°C. O inóculo bacteriano foi obtido a partir de enriquecimento de 5 g de solo em 45 ml de meio líquido Postgate B, pH 5,0, sem adição de ácido ascórbico, incubados a 35°C sob condições anaeróbias. Após os tempos de contato pré-definidos os sobrenadantes foram analisados quanto à sua composição química, principalmente os teores de As residual, pH e Eh. Os teores de As total encontrados nas amostras sólidas variaram entre 1048 e 1829 mg.L-1 e os principais minerais identificados foram: quartzo, caulinita, muscovita, clorita, diopsídio e biotita. Quanto aos experimentos de mobilização de As, contrariamente ao esperado, a presença do pó de penas de galinhas aumentou a mobilidade do As em todas as amostras submetidas às condições B e D, em comparação às condições A e C. Amostras provenientes da Mina Velha chegaram a apresentar teores de As 600 vezes superiores na condição B (presença de pó de penas) em relação à condição A. As amostras contendo apenas células bacterianas (C) apresentaram menores níveis de As no sobrenadante se comparadas aos testes B e D, porém estes valores foram maiores aos observados durante os testes A, evidenciando o papel dos micro-organismos empregados na mobilização do As. Pode-se concluir que, nas minas estudadas, a deposição de matéria orgânica no solo e a população bacteriana do local podem favorecer a solubilização do As naturalmente presente nos minerais.
mines, associated with minerals such as arsenopyrite (AsFeS). The element is toxic and carcinogenic and a chronic exposure to As results in several health problems. Ouro Preto city is located within the Iron Quadrangle (Minas Gerais province) the main mining district of Brazil, the region is rich in As containing minerals that once solubilized, could contaminate water or food. The objective of this work is to study the mobility of the As present in soil samples as a function of the presence of organic matter and sulfate-reducing bacteria (BRS). Furthermore, the aim is to obtain As-resistant bacteria cultures and also provide information for remediation/bioremediation of contaminated areas studies in the future. For that, soil samples were collected from abandoned gold mines (Mina Velha, Chico Rei and Santa Rita). The chemical and mineralogical composition of the samples were determined. Aliquots of 5 g of previously desiccated solid were put in contact with different leaching media: (A) 35 ml, CaCl2, 2.5 mM; (B) 35 ml, CaCl2, 2.5 mM + 5 g of powdered chicken feathers; (C) 35 ml, CaCl2, 2.5 mM + 5 ml of bacterial inoculum and, (D) 35 ml, CaCl2, 2.5 mM + 5 g of powdered chicken feathers + 5 ml of bacterial inoculum. The sealed tubes were shaken for 5 minutes and left to stand for 1, 30, 60, 90 and 120 days at 21.0 ° C. The bacterial inoculum was obtained by the enrichment of 5 g of soil in 45 ml of Postgate B liquid medium, pH 5.0 without the addition of ascorbic acid, incubated at 35 ° C under anaerobic conditions. After the pre-defined contact times supernatants were analyzed for their chemical composition, especially for their content of residual As, pH and Eh. The As content found in the original solid samples were in a range of 1048-1829 mg.l-1, the minerals identified were quartz, kaolinite, muscovite, chlorite, biotite and diopside. As for experiments mobilization of As, contrary to expectations, the presence of powdered chicken feathers increased As mobility for all the samples submitted to experiments B and D, when compared to experiments A and C. Samples from Mina Velha presented solubilized As contents 600 times higher than those observed during experiments A. Samples containing only microbial cells (C) showed lower As concentration in the supernatant when compared to tests B and D, however, these values were higher than those observed during test A, thus demonstrating the role of microorganisms in the mobilization of As. Concluding, in the case of the studied mines, the organic matter deposition and also the microbial population may favor the solubilization of the As in the naturally occurring minerals.
Figura 3.2 – Diagrama Eh-pH das espécies aquosas de As no sistema As–O2–H2O a 25ºC e a
uma pressão total de 1bar (SMEDLEY; KINNIBURGH, 2002)...17
Figura 3.3 – Processos biológicos envolvidos nas transformações do As no ambiente (LLOYD; OREMLAND, 2006)...27
Figura 3.4 – Principais processos físico-químicos e biológicos de imobilização do As em meio aquoso (LIZAMA et al, 2011)...30
Figura 4.1 – Vista do interior da Mina Velha. (a) Superfície - S; (b) Profundo – P...32
Figura 4.2 – Fluxograma representando os procedimentos experimentais...31
Figura 4.3 - Montagem dos frascos utilizados na condição B...37
Figura 5.1 – Frascos de cultivo contendo amostras sólidas e meio Postgate B após 15 dias de incubação...43
Figura 5.2 – Frascos de cultura da amostra SRS mostrando crescimento de bactérias em pH 5,0 e ausência de ácido ascórbico...44
Figura 5.3 – Variação média do pH em função do tempo de contato – Condição Controle (CaCl2 + amostra sólida) – Amostras SRP, SRS, MVP e CRP...46
Figura 5.4 – Variação média do Eh em função do tempo de contato – Condição Controle (CaCl2 + amostra sólida) – Amostras SRP, SRS, MVP e CRP...47
Figura 5.5 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras SRP – Condição Controle...48
Figura 5.6 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras SRS – Condição Controle...48
Figura 5.7 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras MVP – Condição Controle...49
Figura 5.8 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras CRP – Condição Controle...50
Figura 5.9 – Variação média do Eh em função do tempo de contato – Condição B (CaCl2 + amostra sólida + pó de penas de galinha) – Amostras SRP, SRS, MVP e CRP...51
Figura 5.10 – Variação média do pH em função do tempo de contato – Condição B (CaCl2 + amostra sólida + pó de penas de galinha) – Amostras SRP, SRS, MVP e CRP...52
atm – atmosfera
ATP – Adenosina Trifosfato
BRS – Bactéria Redutora de Sulfato
CETESB - Companhia De Tecnologia De Saneamento Ambiental cm – centímetro
CONAMA – Conselho Nacional de Meio Ambiente CRP – Chico Rei Profundo
EDS – Espectroscopia de Energia Dispersiva Eh – Potencial de Oxirredução
g – grama
ICPOES – Espectrofotômetro de Emissão Óptica com Plasma Indutivamente Acoplado kg – quilograma
MEV – Microscopia Eletrônica de Varredura mg – miligrama
ml – mililitro mm – milímetro mM – milimol
MVP – Mina Velha Profundo pH – Potencial Hidrogeniônico QF – Quadrilátero Ferrífero rpm – rotações por minuto SRP – Santa Rita Profundo SRS – Santa Rita Superficial
USEPA – United State Environmental Protection Agency v/v – volume por volume
XRD – Difração de Raio-X µL - microlitro
1 – INTRODUÇÃO
O arsênio (As) é um elemento natural encontrado em muitos compartimentos ambientais que pode ser liberado através de vários processos naturais ou antropogênicos. Um dos principais minerais de arsênio é a arsenopirita (AsFeS), um sulfeto comumente encontrado em áreas de minas, associado a minerais auríferos. Sua oxidação, por ação de O2 ou Fe3+ produz os íons As(III) (arsenito) e As(V) (arsenato), que por sua vez, em ambientes aquosos, dão origem aos ácidos arsênico (H3AsO4) e arsenioso (H3AsO3), respectivamente (BORBA; FIGUEIREDO, 2004).
Em ambientes oxidantes, há predominância da espécie oxidada do As, o arsenato, que pode estar fortemente adsorvido em argilas ou óxidos-hidróxidos de ferro e manganês e ainda matéria orgânica enquanto que, em condições redutoras, a espécie reduzida, arsenito, é a forma predominante de As (TSAI et al, 2009). A espécie trivalente do As é mais estável quimicamente e portanto, menos reativa, permanecendo solúvel em ampla faixa de pH sendo por isso, mais dificilmente imobilizada.
No Brasil, o Quadrilátero Ferrífero é uma das regiões que apresentam as maiores concentrações de As no solo devido à presença de minas de ouro, principalmente nas cidades de Nova Lima e Santa Bárbara (MELLO et al, 2006), Mariana e Ouro Preto (BORBA et al, 2004).
O As é tóxico e uma exposição crônica a este elemento resulta em uma ampla gama de efeitos adversos aos humanos e outros seres vivos. A inibição das reações de fosforilação oxidativa durante o metabolismo da glicose é um dos efeitos à saúde causados pela espécie arsenical pentavalente. Por outro lado, a afinidade da espécie trivalente para grupamentos tióis em proteínas tornam o As(III) altamente tóxico. O As(III) também age como um perturbador endócrino pois, por exemplo, pode interferir no sistema de glicocorticoides e levar a problemas de metabolismo de proteínas (TSAI et al, 2009). Devido à sua toxicidade, no Brasil, o nível máximo tolerado para o arsênio em água potável é 10 µg.L-1 (MINISTÉRIO DA SAÚDE DO BRASIL, 2011).
ao fato dos contaminantes poderem ser tratados no próprio local da contaminação, mantendo assim baixos os custos com manutenção e operação e, por se tratar de um processo natural, trazer menores impactos ao meio ambiente (REYNOLDS; SKIPPER, 2005).
Fungos e bactérias são alguns micro-organismos com grande potencial biotecnológico de utilização na biorremediação de locais contaminados por elementos tóxicos, por possuírem crescimento acelerado, tolerância a condições ambientais extremas e baixo custo de cultivo (TURPEINEM et al, 1999). Além de micro-organismos, plantas, matéria orgânica, algas e fibras vegetais podem ser utilizadas no processo de biorremediação de arsênio, pois podem servir como material adsorvente e auxiliar na sua imobilização, tanto em meio aquoso quanto no solo.
2 – OBJETIVOS
2.1 – Geral
Avaliar, por meio de experimentos “in vitro”, a mobilidade de arsênio presente em solo e a influência de bactérias anaeróbias e de biomassa proteica sobre esta mobilidade.
2.2 – Específicos
Obter culturas de bactérias anaeróbias redutoras de sulfato (BRS) a partir das amostras de solo coletadas.
Verificar a eficiência das culturas bacterianas obtidas sobre a mobilidade do arsênio presente nas amostras sólidas.
3 – REVISÃO BIBLIOGRÁFICA
3.1 - Considerações sobre o Arsênio e sua relação com o solo
O arsênio (As) é um metalóide que pode ser encontrado na natureza na forma de sulfuretos, arsenietos, sulfoarsenetos e arsenitos (GARCIA-MANYES et al, 2002). Ele pode ocorrer em solos agrícolas de algumas regiões, como consequência do uso de pesticidas e herbicidas. Pode-se também encontrá-lo em quantidades variáveis na água, solo e rochas e até mesmo na atmosfera na forma de arsina (AsH3) e ainda fazendo parte da composição de tecidos de organismos vivos. Compostos gasosos de arsênio podem ser produzidos por fungos (Penicillium brevicaule), sendo que já foi relatado que algumascepas de Scopulariopsis fungi produziram gás arsina a partir de soluções de ágar que continham arsênio inorgânico (MANDAL; SUZUKI, 2002). Este gás, extremamente tóxico, é formado principalmente em ambientes redutores e anóxicos (TURPEINEM et al, 1999). O meio industrial representa outra fonte significativa de As, especialmente as fundições de chumbo para fabricação de ligas metálicas para vários fins, assim como em fundições de ouro, prata, cobre, zinco e cobalto devido à presença do As nos minerais de onde estes metais são extraídos. Outras fontes de exposição incluem a manufatura de vidros, esmaltes, tintas, tecidos e couros, produtos agrícolas como inseticidas, formicidas, herbicidas e conservante de madeira (GONTIJO; BITTENCOURT, 2003).
Figura 3.1 – Ciclo biogeoquímico do arsênio
Fonte: JONES, 2007
Muitos problemas ambientais com o As resultam de sua mobilização em condições naturais, no entanto o homem tem causado um importante impacto adicional através do uso descontrolado de compostos que contenham este metalóide (SMEDLEY; KINNIBURGH, 2002).
A solubilidade e biodisponibilidade do As estão intimamente relacionadas com sua especiação. O conhecimento sobre as concentrações das formas individuais, em vez da concentração total, é de crucial importância para a avaliação da toxicidade deste elemento (TURPEINEM et al, 1999). Estudos tem demonstrado que a redução de arsenato para arsenito resulta na solubilização desta última espécie. Já o arsenato pode ser imobilizado por co-precipitação com ferro ou enxofre (O’DAY et al, 2004 apud LIÈVREMONT et al, 2009), ou adsorvido por argila, calcita, matéria orgânica ou hidróxidos, em particular oxi-hidróxidos de ferro.
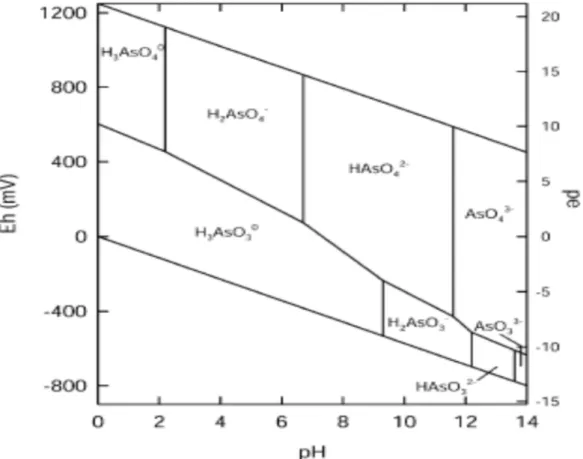
A Figura 3.2 mostra o diagrama de pH-Eh para as espécies de arsênio em meio aquoso. Ele representa graficamente as possíveis fases de equilíbrio em um sistema eletroquímico e mostra a forma química do elemento em determinadas condições de pH e Eh, ou seja, a forma termodinamicamente mais estável e, teoricamente, mais abundante.
Figura 3.2 – Diagrama Eh-pH das espécies aquosas de As no sistema As–O2–H2O a 25ºC e a uma pressão total de 1bar
O diagrama apresenta linhas que representam as fronteiras entre as áreas de estabilidade das várias espécies iônicas. As horizontais correspondem às espécies em equilíbrios redox que se formam a partir de reações que não dependem do pH. As verticais separam espécies que estão em equilíbrio ácido-base, ou seja, correspondem às reações que dependem do pH mas são independentes do Eh. Já as linhas inclinadas separam espécies em equilíbrios redox que se formam a partir de reações que dependem tanto do Eh quanto pH. Como pode ser visualizado no diagrama, o As(III) pode ser encontrado em ambientes redutores em que a espécie neutra H3AsO3 predomina até o pH em torno de 9,2 e as espécies aniônicas H2AsO3-, HAsO32- e AsO33- irão predominar em valores de pH maiores que 9,2. Já o As(V) é encontrado sob condições predominantemente oxidantes sendo que na faixa de pH entre 2 e 7, a espécie dominante é o H2AsO4- e em valores de pH maiores que 7 a espécie dominante é o HAsO42-. As espécies H3AsO4 e AsO43- estão presentes em condições extremamente ácidas ou alcalinas, respectivamente. (CORSINI, 2010; SMEDLEY; KINNIBURGH, 2002).
Os níveis de arsênio em solos de vários países encontram-se na faixa de 0,1 a 40 mg.kg-1 de solo (média de 6 mg.kg-1) mas variam consideravelmente entre as regiões geográficas (BOWEN, 1979 apud MANDAL; SUZUKI, 2002). Ao contrário dos rios e ar onde os efeitos da poluição são mais visíveis, pode haver dificuldade em identificar a contaminação do solo e isto pode causar sérios danos à biota e ao homem (MOURA, 2006). Em solos arenosos e nos derivados de granitos a concentração de As é menor, enquanto que as maiores são encontradas em solos aluviais e orgânicos. Fatores como clima, pH, componentes orgânicos, inorgânicos e potencial redox afetam o nível de arsênio em solos (MANDAL; SUZUKI, 2002).
Porém há relatos de que ela pode aumentar a liberação de As de sedimentos e solos, principalmente através da competição por sítios de adsorção disponíveis, formação de complexos solúveis matéria orgânica-arsênio e mudanças químicas na superfície das espécies arsenicais (WANG; MULLIGAN, 2006 apud LIZAMA et al, 2011). Durante a mineralização da matéria orgânica, íons arsenato podem servir como aceptores de elétrons, sendo então reduzidos a arsenito. Assim, a matéria orgânica pode remover arsênio da água, mas também liberá-lo da fase sólida e então aumentar sua concentração na fase aquosa (LIZAMA et al, 2011). O efeito da matéria orgânica sobre a mobilidade do As depende um pouco da sua solubilidade: quando dissolvida, ela tende a mobilizá-lo, enquanto que na forma particulada, o As é mais facilmente imobilizado (SHARMA; SOHN, 2009).
Nos solos e sedimentos, tanto o arsenato quanto o arsenito estão ligados a óxidos metálicos, particularmente os de Fe, Al e Mn. Destes, os óxidos de ferro são provavelmente os mais importantes por causa da sua maior afinidade de ligação, porém os óxidos de Al podem também ter um papel significativo quando presentes em maiores quantidades (SMEDLEY; KINNIBURGH, 2002).
Solos aerados com pH entre 7 a 9 justificam o predomínio de As(V) como ânions do ácido arsênico. A atividade microbiana também pode definir a especiação e o comportamento do As no solo, pois podem mudá-lo da fase inorgânica para orgânica, por um processo de metilação, produzindo o MMA (ácido de As monometílico), DMA (ácido de As dimetílico) e TMA (óxido de trimetilarsina). Dentre os organismos que realizam este processo podem ser citados bactérias como Escherichia coli, Flavobacteriun sp, Methanobacterium sp e alguns fungos como Aspergillus glaucus, Humicola candida (MATSCHULLAT, 2007).
formações rochosas associadas ao arsênio (arsenopirita, pirita e pirrotita) e a junção desse perfil aos sistemas aquíferos existentes leva à ocorrência da solubilização do As e sua liberação para o meio ambiente (GONÇALVES et al, 2007).
Dependendo de sua forma química, o As pode ser carregado pela água e contaminar alimentos ou ser ingerido. Em pesquisas anteriores, realizadas no Quadrilátero Ferrífero, foram relatados casos de ocorrências de As total de 2 a 2980 µg.L-1 em água de algumas minas auríferas subterrâneas e nascentes das regiões de Ouro Preto e Mariana (BORBA et al, 2004). Em regiões contaminadas pelo elemento deve-se monitorar sua presença na água potável e alimentos produzidos, pois estes podem contê-lo, além da poeira que pode ser inalada ou ingerida, principalmente por crianças, que costumam frequentemente colocar a mão na boca (WIELE et al, 2010).
Em um de seus trabalhos, Borba et al (2004) citam uma pesquisa sobre contaminação humana por As realizada na região do Quadrilátero Ferrífero (QF) por Matschullat et al (2000). Nela, é relatada a presença de As na urina de crianças de 7 a 12 anos. Entre a população infantil avaliada foram encontradas concentrações de As total entre 2 e 106 µg.L-1 nas amostras de urina, sendo que 22% das crianças apresentaram concentrações superiores a 40 µg.L-1 para as quais efeitos adversos não podem ser excluídos.
Vários estudos que tem como foco a região do Quadrilátero Ferrífero (QF) (GONÇALVES et al, 2007; MELLO et al, 2006; BORBA, 2002) relatam concentrações elevadas de As tanto nos solos e sedimentos quanto em águas subterrâneas. Concentrações de 7 µg.L-1 e 69 µg.L-1de As total foram encontradas em amostras de água nas minas de Chico Rei (Ouro Preto/MG) e da Passagem (Passagem de Mariana/MG) (BORBA et al, 2009). Outros trabalhos identificaram concentrações de As da ordem de 1588 mg.kg-1 em amostras de solo em Paracatu e 33133 mg.kg-1 em Santa Bárbara (ANDRADE et al, 2008) e 2691 mg.kg-1 em amostras de sedimento na bacia do Ribeirão do Carmo (COSTA et al, 2010).
3.2 – Toxicidade do As
Os efeitos toxicológicos do arsênio dependem de sua forma química. A forma trivalente é muito mais tóxica, solúvel e móvel do que a pentavalente. A toxicidade do arsênio trivalente está relacionada com a sua elevada afinidade para os grupos sulfidrila de biomoléculas, tais como a glutationa e os resíduos de cisteína de muitas enzimas. A formação As(III)-SH resulta em vários efeitos prejudiciais, como a inibição das atividades de enzimas, tais como a glutationa redutase e glutationa peroxidase (SHARMA; SOHN, 2009). A toxicidade também depende de outros fatores tais como o estado físico em que se encontra o elemento (gás, solução), taxa de absorção nas células, taxa de eliminação, dentre outros (MANDAL; SUZUKI, 2002). Os compostos inorgânicos trivalentes e pentavalente são bem absorvidos no trato gastrointestinal humano em poucas horas, principalmente no intestino delgado. No corpo humano, o As é rapidamente distribuído pelo sangue e acumula-se inicialmente no fígado, rins e pulmões. No fígado, o As(III) passa por um processo de metilação, tornando-o menos reativo aos tecidos, o que diminui sua toxicidade e facilita sua eliminação por excreção renal. Uma dieta pobre em alimentos que contém grupamentos metil pode limitar a taxa de metilação do As(III) no fígado, dificultando sua eliminação. Além da dieta, a idade também é um fator que interfere neste processo de metilação, sendo que crianças são mais susceptíveis à toxicidade do As que adultos. A excreção do As por vias urinárias ocorre em uma taxa de 45 – 70% nos primeiros 4 dias após a ingestão e o restante pode chegar a demorar mais de um mês. Após 4 ou 5 semanas, a maior parte do As remanescente no corpo encontra-se em tecidos ricos em proteínas que contém cisteína como a pele, cabelos e unhas (CAPITANI, 2007).
A longo prazo, efeitos à exposição ao As incluem tumores dos tratos digestivo, gênito-urinário, pulmonar, respiratório superior e cutâneo. Os transtornos gastrointestinais são característicos da forma aguda. “O As também é considerado um veneno protoplasmático que exerce sua toxicidade através da inativação de cerca de 200 enzimas, em particular aquelas envolvidas na produção de energia celular e as relacionadas à síntese e reparo do DNA” (GONTIJO; BITTENCOURT, 2003). Apesar desta toxicidade, as propriedades do arsênio têm sido alternativamente exploradas para fins medicinais e toxicológicos. O trióxido de arsênio, por exemplo, é atualmente utilizado para tratamento de certas formas de leucemia (DEGOS, 2003 apud GONTIJO; BITTENCOURT, 2003).
Por ser estruturalmente muito semelhante ao íon fosfato (PO43-), o arsenato (AsO43-) interfere no metabolismo do fósforo (NIES, 1999 apud TEIXEIRA, 2004). Essa interferência se dá pela competição com o fosfato pelos sítios ativos das enzimas fosforilativas, comuns a todos os seres vivos e essenciais ao metabolismo da glicose. A forma pentavalente do As também pode substituir o fosfato na dupla hélice do DNA, o que pode explicar seus efeitos mutagênicos, carcinogênicos e teratogênicos (MANDAL; SUZUKI, 2002). A redução intracelular de As(V) a As(III) também pode levar à formação de radicais livres responsáveis por danos cromossômicos e celulares.
A forma trivalente do As interfere com enzimas pela ligação em grupos -SH, especialmente quando há dois grupos -SH adjacentes na enzima. Com isso, enzimas essenciais do ciclo do ácido cítrico poderão ter suas atividades prejudicadas. A ação inibitória do arsenito baseia-se na inativação da piruvato desidrogenase por complexação com As(III) inorgânico, que poderá, por sua vez impedir a geração de adenosina-5-trifosfato (ATP) (MANDAL; SUZUKI, 2002).
3.3 - Organismos vivos e sua relação com o solo e o As
O termo biorremediação pode ser definido de muitas maneiras e muitas destas incluem o conceito do uso de micro-organismos para degradar contaminantes. A agência americana de proteção ambiental (USEPA) definiu a biorremediação como um processo de tratamento que usa micro-organismos de ocorrência natural (fungos, bactérias e leveduras) para quebrar ou degradar substâncias perigosas tornando-as menos ou não tóxicas (REYNOLDS; SKIPPER, 2005).
Em solos contaminados por metais pesados, a biorremediação ocorre no sentido de transformar estes metais em suas formas menos tóxicas ou inertes. Um dos grandes problemas da presença de metais pesados no ambiente é o fato de que eles não sofrem decomposição e, portanto, não podem ser destruídos. Além disso, eles são recalcitrantes e podem acumular nos seres vivos, causando distúrbios nas cadeias alimentares (GUEDES, 2011).
Os processos biológicos oferecem também possibilidades para remediação de metais e outros elementos tóxicos, baseando-se na utilização de seres vivos (plantas e micro-organismos) que possuem a habilidade de modificar os compostos arsenicais para um estado de oxidação menos tóxico ou imobilizá-los, garantindo assim um ambiente aquático ou terrestre mais seguro. A eficiência da biorremediação está associada a uma população microbiana adaptada, ao consumo dos contaminantes e como esta pode ser enriquecida e mantida no ambiente. Entre as estratégias utilizadas nos solos destacam-se a bioestimulação, bioaumentação e a fitorremediação.
A bioestimulação envolve algum estímulo na quantidade de populações naturais de micro-organismos e suas atividades, normalmente bactérias ou fungos, para que eles possam melhor quebrar e/ou transformar poluentes em produtos inofensivos. A bioestimulação basicamente parte do pressuposto de que um ambiente poluído já contém os micro-organismos capazes de remediar locais contaminados bastando apenas adicionar nutrientes tais como nitrogênio e fósforo para melhorar o desempenho destes micro-organismos. Já a bioaumentação é a inoculação de micro-organismos em um local contaminado para facilitar a biodegradação. Estas abordagens são usadas no sentido de converter contaminantes para intermediários menos tóxicos ou mineralizá-los para suas formas inorgânicas (REYNOLDS; SKIPPER, 2005).
A fitoextração refere-se à utilização de plantas para a remoção de materiais inorgânicos, combinando uma alta produtividade com elevada absorção e translocação dos poluentes para a biomassa (REYNOLDS; SKIPPER, 2005). Algumas plantas retem quantidades significativas de nutrientes em sua biomassa, com isso, elas podem acumular diferentes compostos, tais como metais, em uma concentração maior que a naturalmente presente no solo. As samambaias (Pteris vittata, P. biaurita, P. cretica, P. logifolia) têm sido amplamente utilizadas para estudos de biorremediação de As (OLIVEIRA, 2012), assim como outras espécies de plantas que incluem Sorghum bicolour e Helianthus annuus (WEI; CHEN, 2006; BALDWIN; BUTCHER, 2007 apud CORSINI, 2010). Plantas contendo metais acumulados em seus tecidos podem ser colhidas para eliminação ou, em alguns casos, a recuperação dos metais, se viável.
A fitoestabilização é um processo de remediação que reduz a mobilidade e dispersão do poluente no ambiente através da utilização de plantas em conjunto com micro-organismos. No caso do As, o processo de imobilização ocorre nas raízes das plantas tolerantes, que são capazes de adsorver, precipitar e acumular, sem permitir que ele alcance a parte aérea da planta. Neste processo o As não é retirado do local contaminado, porém ocorre uma redução de sua mobilidade, diminuindo assim o risco de contaminação do lençol freático e de entrada na cadeia alimentar (CORSINI, 2010; OLIVEIRA, 2012).
O sucesso da recuperação de áreas impactadas com metais, metais pesados e metalóides depende do desenvolvimento de comunidades microbianas que podem remediar estes locais por diferentes mecanismos, incluindo, dentre outros, a adsorção ou a complexação na superfície celular, a biossorção, a bioprecipitação e a acumulação intracelular (bioacumulação).
podem acontecer vários processos de transformação destes metais para formas menos tóxicas que incluem: biometilação, desmetilação, complexação, co-precipitação e processos de oxidação-redução, Este processo é mais lento do que a biossorção superficial devido à necessidade de atividade metabólica (GUEDES, 2011).
Os micro-organismos capazes de reduzir o sulfato podem participar ativamente dos processos biológicos de remoção de imobilização de As e biorremediação de áreas, solos e águas contaminadas com este elemento devido à produção de H2S que promove a precipitação de vários íons, metálicos ou não, na forma de seus sulfetos pouco solúveis.
Em ambientes anaeróbios, as Bactérias Redutoras de Sulfato (BRS) podem ser efetivas no processo de remoção de arsênio. BRS são micro-organismos anaeróbios encontrados em ambientes anóxicos que, durante o processo respiratório, usam sulfato como aceptor final de elétrons para a degradação de compostos orgânicos. O processo resulta na produção de sulfetos (MUYZER; STAMS, 2008), que podem se ligar ao arsênio solúvel e precipitá-lo (Equações 3.1 e 3.2). Em um de seus trabalhos utilizando culturas mistas de BRS, Teclu et al, (2008) chegaram a uma remoção de As3+ em meio aquoso de aproximadamente 55% e 77% de As5+, ambos na forma de sulfeto.
Matéria orgânica (C, H, O) + SO42- HS- + HCO3- Eq. 3.1 Me2+ + HS- MeS(s) + H+ Eq. 3.2
As BRS podem ser encontradas nos mais diferentes ambientes. Já foram identificadas em sedimentos marinhos, fontes hidrotermais, lagos salinos e drenagem ácida de minas, onde pode-se encontrar pH 2. A melhor técnica para identificar as BRS é a utilização de marcadores de genes, especialmente o que codifica a subunidade 16S do RNA ribossomal. Já foram identificados vários gêneros, incluindo Desulfotomaculum, Desulfosporosinus e Desulfosporomusa (MUYZER; STAMS, 2008).
Em ambientes anaeróbios, essa degradação completa da matéria orgânica até CO2 realizada pelas BRS é mais complexa, necessitando que outros grupos de micro-organismos realizem uma oxidação parcial da matéria orgânica para que seus produtos metabólicos sejam assimilados por outros grupos, até a completa oxidação do composto orgânico. Compostos de alto peso molecular como proteínas, ácidos nucléicos, carboidratos e lipídeos não são substratos diretos para BRS. Antes, esses compostos precisam ser degradados por outros micro-organismos, para que os produtos sejam utilizados pelas BRS (MUYZER; STAMS, 2008).
Como dito anteriormente, o As é tóxico e sua presença no ambiente representa um fator de estresse à comunidade microbiana local. Para que micro-organismos possam sobreviver em ambientes contaminados, são necessários mecanismos que lhes garanta resistência ao metalóide. Algumas bactérias, inclusive BRS, possuem genes específicos que possibilitam sua sobrevivência em tais ambientes pela presença de um gene de resistência ao As, o operon ars, composto por três a cinco subunidades (arsR, arsD, arsA, arsB e arsC), que podem estar localizados nos plasmídeos ou cromossomo (LIÈVREMONT, 2009). Destes, arsA e arsB são responsáveis por formar um canal transmembrana que expulsa o As(III) do citoplasma, reduzindo sua concentração intracelular e arsC codifica a enzima As(V) redutase, que é responsável pela biotransformação de As(V) em As(III) no interior da célula (ACHOUR et al, 2007 apud LIÈVREMONT et al, 2009). Esta redução do arsenato para arsenito pode ocorrer por dois mecanismos principais no interior da célula (Figura 3.3). O primeiro está relacionado com a desintoxicação da célula e se inicia quando o íon arsenato entra através de transportadores de fosfato, devido à homologia estrutural com este íon. Depois de atingir o citoplasma, o As(V) liga-se a um resíduo de cisteína na porção terminal da arsenato redutase e, então, é reduzido a As(III) é excretado através de uma proteína transmembrana dependente de ATP. Este processo tem sido observado em várias bactérias de solos contaminados por As e em rejeitos de minas, sugerindo que esta resistência ao As(V) desempenha um papel importante na ciclagem deste elemento na natureza (OREMLAND; STOLZ, 2003).
compostos aromáticos) ou inorgânicos (hidrogênio e sulfeto) doadores de elétrons, resultando no crescimento celular (AHMANN et al, 1994 apud LIÈVREMONT et al, 2009).
Além destes processos, o As pode ser convertido para o gás arsina (AsH3), e então liberado para a atmosfera. Este é um fenômeno que ocorre em ambientes aquáticos sob condições redutoras e altamente anóxicas. Além do mais, micro-organismos como fungos e bactérias, através de processos biológicos, podem formar compostos metilados de arsina como a metilarsina (CH3(AsH2), dimetilarsina ((CH3)2AsH) e trimetilarsina ((CH3)3As) (LIZAMA et al, 2011).
Figura 3.3 – Processos biológicos envolvidos nas transformações do As no ambiente
Fonte: LLOYD; OREMLAND, 2006
sentido, as BRS possuem um importante papel na remedição de áreas contaminadas, pois mesmo que ocorra a liberação do As(III) para o ambiente, o sulfeto produzido por elas pode precipitar este As(III).
Existem ainda bactérias capazes de oxidar o As(III) por via enzimática. Além do gênero Achromobacter também foram identificados micro-organismos heterotróficos e quimioautotróficos. O As(III) serve como um doador de elétrons, reduzindo oxigênio ou nitrato e fixando CO2, que fornece o carbono necessário para crescimento (BATTAGLIA-BRUNET et al, 2002 apud LIÈVREMONT et al. 2009).
Além da utilização de micro-organismos para remediar áreas contaminadas por As, o uso de materiais naturais para adsorver o As, tornando-o menos disponível no ambiente também, têm sido empregado. Guedes (2011) relata o uso de materiais como fibras vegetais (REDDY et al, 2010), carcaças de crustáceos (GUPTA et al, 2009), esterco de ovinos (WILOPO et al., 2008) e resíduos de indústria de fertilizantes (LUDWIG et al, 2009). Teixeira e Ciminelli (2005) utilizaram em seu trabalho o pó de penas de galinha, que é uma biomassa rica em queratina e contém grupos sulfidrila (-SH) em sua estrutura. O As(III) reage com estes grupos, sendo então imobilizado.
3.4 – Remediação de áreas contaminadas por As
Além de processos biológicos, a remediação do As presente em sedimentos dos rios, solo, rochas e águas também pode acontecer através de processos físico-químicos. Um esquema com os principais processos que ocorrem em meio aquoso pode ser visualizado na figura 3.4. Dentre estes é possível citar a precipitação, sorção, co-precipitação.
A precipitação do As geralmente ocorre entre espécies solúveis, tais como H2AsO4- e HAsO42-, que reagem com Fe(III) e Ca e formam precipitados insolúveis. Em ambientes oxidantes, o As(V) pode precipitar com o Ca, Mg, Fe e Al(III) e em redutores, na presença de S e Fe, podem ser formados sulfetos insolúveis, tais como As2S3 (ouropigmento) e FeAsS (arsenopirita) (HENKEN; HUTCHISON, 2009 apud LIZAMA et al, 2011).
adsorvidas sobre superfícies de sólidos com carga positiva, por exemplo, óxidos metálicos (MATSCHULLAT, 2007). Já o processo de absorção é a assimilação de espécies químicas no interior de substâncias sólidas. Várias superfícies são capazes de reter arsênio e esta capacidade depende das suas propriedades, das espécies, da concentração de arsênio, da presença de íons competidores e do pH (STOLLENWERK, 2003 apud LIZAMA et al, 2011). “A sorção de oxiânions arsenicais é sensível à presença de ânions competidores, como por exemplo, fosfato (PO43-, HPO42-, H2PO4-), sulfato (SO42-), carbonato (CO32-) e bicarbonato (HCO3-)” (LIZAMA et al, 2011).
A co-precipitação é um processo de remoção, por precipitação, do As em que este é adsorvido superficialmente ao precipitado em formação de uma outra espécie química. Isto pode ocorrer ao mesmo tempo em que o precipitado é formado ou logo após, sendo que para o As isso ocorre mais facilmente com oxi-hidróxidos de ferro.
Figura 3.4 – Principais processos físico-químicos e biológicos de imobilização do As em meio aquoso
4 – MATERIAIS E MÉTODOS
A figura 4.1 apresenta os procedimentos experimentais realizados ao longo de todo o trabalho.
4.1 - Amostras sólidas - Coleta
As amostras sólidas utilizadas foram coletadas em 3 (três) minas de ouro desativadas, localizadas na cidade de Ouro Preto/MG, utilizadas apenas para atividades relacionadas ao turismo. Destas, coletou-se um total de 05 (cinco) amostras simples, utilizando trado manual, retiradas nos túneis no interior das minas, raspando-se a parede, no caso das amostras superficiais, e a 20 cm de profundidade no chão, no caso das amostras profundas. As coletas foram feitas onde havia presença de água e foram retirados cerca de 200 g de solo de cada local. As amostras foram acondicionadas em potes plásticos e transportadas ao laboratório para processamento. As áreas da coleta estão descritas a seguir:
a) Mina Velha, Ouro Preto/MG. A Mina Velha está localizada em um quintal de uma residência na Rua Santa Rita, número 21, bairro Padre Faria, Ouro Preto/MG, a 20º38’73.72’’ de latitude S e 43º49’02.25’’ de longitude O. É uma mina desativada que possui 2 km de extensão, sendo 370 metros iluminados e abertos à visitação. Nesta mina foram escolhidos dois pontos de coleta (figura 4.2), assim identificados: MVS (Mina Velha - Superficial) e MVP (Mina Velha - Profundo).
Figura 4.2 – Vista do interior da Mina Velha. (a) Superfície - S; (b) Profundo - P
Fonte: Próprio autor
Figura 4.1 – Fluxograma representando os procedimentos experimentais
b) Mina do Chico Rei, Ouro Preto/MG. A Mina do Chico Rei está localizada na Rua Dom Silvério, número 108, bairro Antônio Dias, Ouro Preto/MG, a 20°38’62.25’’ de latitude S e 43°49’8255’’ de longitude O. Esta mina foi uma das maiores do estado de Minas Gerais e pertenceu a Chico Rei, um escravo que adquiriu a sua liberdade e a própria mina. A mina, que tem 1.500 metros de extensão, foi desativada em 1888 e a visita guiada percorre somente alguns túneis. Nesta mina foi coletada apenas uma amostra identificada como CRP (Chico Rei – Profundo).
c) Mina Santa Rita, Ouro Preto/MG. A mina de Santa Rita está localizada na Rua Santa Rita, número 172, bairro Padre Faria, Ouro Preto/MG, a 20º38’65.02’’ de latitude S e 43º49’29.57’’ de longitude O. Esta mina foi escavada por escravos no período do ciclo do ouro em Ouro Preto e hoje está desativada, servindo apenas para visitação. Nesta mina foram coletadas duas amostras em pontos diferentes, identificadas como: SRS (Santa Rita – Superficial) e SRP (Santa Rita – Profundo).
4.2 - Preparação e caracterização das amostras sólidas
Preparação:
As amostras minerais coletadas foram secas à temperatura ambiente. Para a homogeneização, as amostras foram colocadas em potes plásticos tampados e agitados manualmente por cerca de 2 minutos. Logo após, elas foram peneiradas em um tamis para posterior utilização. Para os testes, foram selecionadas as frações com granulometria inferior a 1mm.
Análises:
A determinação da composição química quantitativa das amostras por meio da quantificação dos elementos solubilizados após a digestão em Água Régia conforme protocolo descrito no Anexo 1 foi feita por espectrometria de emissão óptica com plasma indutivamente acoplado (ICP-OES), utilizando-se o equipamento da marca Spectro, modelo Ciros CCD. As análises foram executadas pelo Laboratório de Geoquímica Ambiental do Departamento de Geologia da Universidade Federal de Ouro Preto.
A determinação da composição mineralógica das amostras foi feita por difração de raio-X, utilizando-se o equipamento modelo Empyrean da Panalytical, com a colaboração do Professor Dr. Hubert Matias Peter Roeser, do Laboratório de Difratometria de Raio X do Departamento de Geologia da Universidade Federal de Ouro Preto.
Foram feitas análises microscópicas do material em Microscópio Eletrônico de Varredura (MEV) acoplado a “energy dispersive system” (EDS) utilizando-se o equipamento modelo JSM-5510 e aceleração de voltagem 20 kV, com a colaboração do Professor Dr. Leonardo Evangelista Lagoeiro do Laboratório de Microscopia e Microanálise do Departamento de Geologia da Universidade Federal de Ouro Preto.
4.3 - Obtenção dos inóculos bacterianos
Para o enriquecimento das amostras de bactérias anaeróbias naturalmente presentes nos locais das coletas (minas), uma fração da amostra sólida, superficial e profunda, foi coletada nos mesmos pontos descritos anteriormente utilizando-se potes plásticos esterilizados. Os potes contendo o material foram acondicionados, em refrigeração, a 4ºC até o processamento.
Utilizou-se o meio de cultura líquido Postgate B específico para bactérias anaeróbias, cuja composição está descrita na Tabela 4.1. O pH da solução foi ajustado para 7,0 + 0,2 com adição de HCl ou NaOH na concentração de 0,1 mol.L-1. Em seguida, a solução foi autoclavada sob calor úmido (120ºC, 1,5 atm, 20 minutos). A solução de sulfato ferroso pH 7,0 foi autoclavada, separadamente, para evitar a precipitação do ferro e depois adicionada ao meio de cultura.
evidenciado pela presença de precipitado negro, resultante da reação entre o ferro presente no meio e o sulfeto produzido biologicamente. Após esses 15 dias, foi feito um primeiro repique a partir de 10 ml deste meio com crescimento bacteriano e 40 ml de um novo meio Postgate B em frascos de vidro com capacidade para 50 ml. Estes novos frascos foram lacrados conforme os anteriores e colocados em estufa a 35ºC durante 15 dias ou até a detecção de crescimento bacteriano (enegrecimento do meio). Pelo menos outros dois repiques seguidos foram feitos desta maneira a fim de obter uma cultura bem adaptada às condições de cultivo, antes da realização dos ensaios.
Tabela 4.1 – Composição do meio de cultura Postgate B utilizado no experimento
Composição Concentração em 1 litro de água destilada
KH2PO4 0,5 g
NH4Cl 1,0 g
Sulfato de cálcio 1,26 g
MgSO4.7H2O 2,0 g
Extrato de levedura 1,0g
FeSO4.7H2O 0,5 g
Tioglicolato de sódio 0,5 g
Ácido ascórbico 0,1 g
Lactato de sódio 7 ml
Fonte: POSTGATE, 1963 apud GUEDES, 2011
4.4 - Matéria orgânica
Este material orgânico foi escolhido em função da sua composição química. Outros autores, ao utilizar material biológico semelhante (TEIXEIRA, 2004) discutem que a presença dos grupos -SH na estrutura da queratina do pós de penas de galinhas pode contribuir para a imobilização do arsênio solubilizado no meio por meio de adsorção específica. Além disso, segundo Costa (2012) este material biológico poderia funcionar como fonte nutricional para o crescimento bacteriano, servindo como fonte de carbono e outros elementos. Este mesmo material foi caracterizado previamente por Costa (2012) que obteve os resultados descritos a seguir na Tabela 4.2. Durante a realização deste trabalho foi utilizado apenas a porção do material orgânico com granulometria inferior a 0,71 mm.
Tabela 4.2 – Caracterização físico-química do pó de penas quanto à fração solúvel e insolúvel
Fração insolúvel Fração solúvel
Composição química (mg.L-1)
Granulometria <24 mesh Tyler Sulfato 84 Cobre 0,013 Ferro 0,47 Densidade 1,242 g.cm-3 DBO 6661 Fósforo 71,1 Enxofre 340
Área
superficial 0,787 m2.g-1 DQO 7601 Potássio 163 Silício 3 Volume de
microporos 0,00037 cm3.g-1 DQO/DBO 1,14 Magnésio 36,65 Zinco 0,94 Área de
microporos 1,038 m2.g-1 TOC 2302 Manganês 0,67 Cálcio 15,6 Fonte: COSTA, 2012
4.5 - Estudos de mobilização de arsênio em solo
Na segunda bateria de testes, além da mistura descrita acima foram adicionados 5 g do pó de penas de galinha à solução lixiviante para verificar seu efeito sobre a solubilização do As. Tal bateria de testes foi denominada Condição B. Os frascos foram submetidos às mesmas condições e tempos de reação.
Para os testes visando evidenciar o papel do inoculo microbiano na solubilização do As, além da amostra sólida e das soluções 5 ml de inóculo bacteriano foram adicionados a cada frasco de reação. Tal condição experimental foi denominada Condição C.
Figura 4.3 - Montagem dos frascos utilizados na condição B
Fonte: Próprio autor
Uma quarta bateria de testes foi montada utilizando-se 5 g de pó de penas de galinha e 5 ml de inóculo bacteriano além do solo e da solução de CaCl2 visando avaliar simultaneamente, o efeito da adição de micro-organismos e matéria orgânica ao sistema. Tais testes foram denominados Condição D.
concentrações do As e das demais espécies químicas são dadas em mg.L-1 e estão apresentadas em escala logarítmica. O protocolo experimental pode ser resumido conforme a tabela 4.3.
Tabela 4.3 – Resumo do experimento de mobilização do arsênio
Condições Amostra sólida (g) CaCl2 (ml) Pó de penas de galinha (g) Inóculo bacteriano (ml)
Controle 5 35 - -
B 5 35 5 -
C 5 35 - 5
D 5 35 5 5
5 – RESULTADOS E DISCUSSÃO
Neste tópico serão apresentados e discutidos os resultados de mobilização de As à partir das amostras sólidas coletadas nas minas abandonadas, Mina Velha, Chico Rei e Santa Rita, objetos deste estudo.
Inicialmente, será apresentada a caracterização físico-química do material coletado. Em seguida será comentado o procedimento de obtenção de inóculos bacterianos a partir das amostras sólidas para realização dos testes de mobilização de As em presença de bactérias anaeróbias. Posteriormente, serão comentados os resultados referentes aos experimentos de mobilização de As propriamente, dando atenção especial às variações nos teores de As e outros elementos em solução em consequência do contato das amostras sólidas coletadas com os diferentes meios lixiviantes em intervalos de tempo de exposição variando entre 1 e 120 dias.
5.1 - Caracterização físico-química das amostras sólidas
Após a extração por água régia, seguindo o procedimento descrito no Anexo 1, a determinação da composição química qualitativa e quantitativa dos materiais sólidos coletados foi realizada por espectroscopia de emissão ótica com plasma indutivamente acoplado (ICP-OES). Trinta e um elementos foram detectados nas amostras minerais coletadas e o resultado completo das análises encontra-se no Anexo 2.
As concentrações de As total variaram entre 465 mg.kg-1 (MVS), e 1829 mg.kg-1 (MVP). Assim, a amostra coletada na Mina Velha apresentou os teores de As mais baixos, nas amostras coletadas superficialmente, e também os mais altos, naquelas amostras mais profundas.
Segundo a portaria CONAMA 420/2009, o valor de 15 mg.kg-1 de As em solo seco seria o valor de prevenção para o metalóide. Ainda segundo a mesma portaria, para áreas residenciais, valores acima de 55 mg.kg-1 são considerados valores de investigação.
Segundo a definição da CETESB (2005) valor de prevenção (VP) “é a concentração de determinada substância, acima da qual podem ocorrer alterações prejudiciais à qualidade do solo e da água subterrânea” e valor de intervenção (VI) “é a concentração de determinada substância no solo ou na água subterrânea acima da qual existem riscos potenciais, diretos ou indiretos, à saúde humana, considerando um cenário de exposição genérico.” Ainda segundo o mesmo órgão, para o estado de São Paulo, a área será considerada contaminada quando os valores detectados de uma substância, na água ou no solo, forem superiores ao limite de intervenção (VI), indicando assim a necessidade de implantação de procedimentos de gerenciamento destas áreas a fim de resguardar os receptores de risco de contaminação.
Além do arsênio, as amostras também apresentavam altos teores de alumínio (Al) - 1340 a 3035 mg.kg-1; ferro (Fe) - 8964 a 103462 mg.kg-1 e manganês (Mn) - 524 a 6961 mg.kg-1. Os teores de cálcio (Ca) encontrados foram da ordem de 238 a 743 mg.kg-1. Outros elementos encontrados nas amostras em menores proporções incluem bismuto (Bi), cádmio (Cd), escândio (Sc), estrôncio (Sr), tório (Th), vanádio (V) e ítrio (Y).
Segundo a Decisão de Diretoria nº 195-2005- E, de 23 de novembro de 2005 da CETESB, que dispõe sobre valores orientadores para solo e água subterrânea no estado de São Paulo os valores de prevenção (VP) para o Al, Fe e Mn no solo ainda não foram estabelecidos. Faltam, portanto, parâmetros de normalidade para a discussão quanto aos riscos a eles associados. Entretanto, em águas subterrâneas, os valores de 0,2, 0,3 e 0,4 mg.L-1 para Al, Fe e Mn, respectivamente, são considerados limites para a intervenção. No sobrenadante das amostras sólidas utilizadas neste trabalho após serem submetidas às condições experimentais propostas, tais espécies químicas apresentaram concentrações bem acima destes valores, que serão discutidos nas próximas seções.
químicas presentes em solo são os mesmos estabelecidos pela Decisão de Diretoria nº 195-2005- E, de 23 de novembro de 2005 da CETESB, até que os valores específicos para Minas Gerais sejam determinados.
A análise por Difração de Raios-X para identificação de fases cristalinas dos minerais nas amostras sólidas utilizadas demonstrou tratarem-se, na verdade, de amostras de rochas em processo de intemperização, de acordo com os minerais encontrados (Quadro 5.1). Pode-se observar que as amostras sólidas apresentam minerais micáceos como a muscovita e a biotita. As micas são altamente degradadas na natureza, são boas adsorventes de metais e podem adsorver arsênio na presença de Fe2+ e formar precipitados (CHAKRABORTY et al, 2007). A muscovita esteve presente em todas as amostras enquanto a biotita foi encontrada apenas na amostra SRS. A caulinita, por sua vez, foi encontrada nas amostras SRP, CRP e MVP.
Quadro 5.1 – Análise mineralógica das amostras coletadas, minerais predominantes.
Amostra Mineral encontrado Fórmula
SRP
Quartzo Caulinita Muscovita
Clorita
SiO2 Si2Al2O5(OH)4 KAl2Si3AlO10(OH,F)2 (Mg, Al, Fe)12(Si, Al)8 O20(OH)16 SRS
Quartzo Muscovita
Diopsídio Biotita
SiO2
KAl2Si3AlO10(OH,F)2 MgCaSi2O6
K(Mg, Fe)3(OH,F)2(Al, Fe)Si3O10 CRP Caulinita Quartzo
Muscovita
SiO2 Si2Al2O5(OH)4 KAl2Si3AlO10(OH,F)2 MVP Caulinita Quartzo
Muscovita
SiO2 Si2Al2O5(OH)4 KAl2Si3AlO10(OH,F)2 Fonte: Próprio autor
Mina Velha (MVP) apresentavam valores de pH ácidos (3,48 em CRP e 4,81 em MVP). Ao contrário de outros elementos cuja solubilidade diminui à medida que o valor de pH do meio se eleva, as espécies arsenicais possuem reconhecida mobilidade na faixa de pH próxima da neutralidade, ou seja, entre 6,5 e 8,5, independentemente do potencial de oxidação do meio (SMEDLEY; KINNIBURGH, 2002). Ainda segundo os mesmos autores, a mobilidade da maioria dos íons de metais traço diminui à medida que se eleva o pH do meio devido à sua imobilização por precipitação ou co-precipitação na forma de óxidos, hidróxidos, carbonatos ou fosfatos metálicos ou ainda devido à sua forte adsorção na superfície de óxidos e matéria orgânica sob tais condições. Esta realidade é diferente para os oxiânions arsenicais.
Considerando-se o diagrama Eh-pH das espécies arsenicais (figura 3.2) observa-se que as espécies arsenicais pentavalentes adquirem duas ou três cargas superficiais negativas, tornando-se mais reativas e, portanto menos solúveis, apenas em pH superior a 6. As espécies trivalentes permanecem em seu estado neutro, sem cargas superficiais negativas, em toda a faixa de valores de pH inferior 9,0. Portanto, os valores de pH medidos nas amostras analisadas eram baixos o suficiente para permitir a mobilização das espécies arsenicais pentavalentes e, mais marcantemente as trivalentes, principalmente em condições de Eh mais redutoras.
Tabela 5.1 – Valores de pH e Eh das amostras sólidas.
Amostras pH Eh
SRP 7,31 323,4
SRS 6,46 304,00
CRP 3,48 479,9
MVP 4,81 421,9
Fonte: Próprio autor
5.2 - Enriquecimento bacteriano
crescimento bacteriano, conforme figura 5.1. A partir destes frascos, um primeiro repique foi feito, utilizando 5 ml do cultivo e 45 ml de meio Postgate B, pH 7,0. Após 15 dias de cultivo à temperatura de 35ºC nenhum frasco demonstrou crescimento bacteriano, a turvação do meio de cultura, característica do crescimento de bactérias redutoras de sulfato, não foi observada.
Um segundo repique foi feito a partir do frasco da primeira tentativa de cultivo, novamente utilizando-se 5 ml de cultivo e 45 ml de Postgate B, pH 7,0. Após 15 dias de cultivo as amostras SRP e SRS demonstraram crescimento. O procedimento foi repetido, a partir destes frascos que mostraram crescimento positivo, porém sem sucesso.
Figura 5.1 – Frascos de cultivo contendo amostras sólidas e meio Postgate B após 15 dias de incubação
Fonte: Próprio autor
Uma segunda tentativa de enriquecimento a partir de cada amostra sólida foi feita, utilizando-se 5 g do sólido e 45 ml de meio Postgate B, pH 7,0 e apenas a amostra SRS mostrou um possível crescimento. A partir dela, foi feito um repique com meio Postgate B, pH 5,0 sem adição de ácido ascórbico. Após 12 dias de incubação, o crescimento bacteriano foi evidenciado e um novo repique foi feito nestas mesmas condições, confirmando o resultado. Novamente foi detectado crescimento de bactérias conforme visualizado na figura 5.2.
experimentos. Devido à formação de precipitado negro no meio, é possível induzir tratar-se de uma cultura mista de micro-organismos, provavelmente bactérias com capacidade promover a redução de sulfato a sulfeto. O precipitado de cor escura observado nos frascos de cultura se deve à formação de sulfeto de ferro (FeS) resultante da reação química entre o ferro presente no meio de cultura e o H2S produzido microbiologicamente.
Figura 5.2 – Frascos de cultura da amostra SRS mostrando crescimento de bactérias em pH 5,0 e ausência de ácido ascórbico
Fonte: Próprio autor
5.3 – Estudos de mobilização de Arsênio nas amostras sólidas coletadas
5.3.1 - Condição Controle – Amostras sólidas + CaCl2
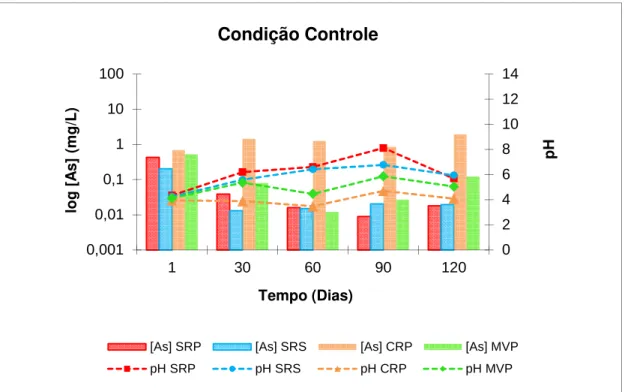
Na condição Controle, após 1 dia de contato com o CaCl2, as amostras da mina Santa Rita, anteriormente com pH neutro, apresentaram uma acentuada acidificação com pH variando entre 4,35 a 5,7 ao longo dos 120 dias na amostra SRP e de 4,25 a 5,9 na SRS. As amostras MVP (pH entre 4,11 e 5,04) e CRP (pH entre 3,95 e 4,09) mantiveram valores ainda mais ácidos (figura 5.3). Em seu trabalho sobre adsorção de As em muscovita e biotita, Chakraborty et al (2007) discutiram que a máxima adsorção de arsenato em muscovita ocorre na faixa de pH entre 4,2 e 5,5 e em biotita entre 4,6 e 5,6. Já o arsenito é mais bem adsorvido em biotita em pH de 4,1 a 6,2. Os mesmos autores também concluíram que a capacidade de adsorção destes dois minerais segue a seguinte ordem: As(V)-biotita > As(III)-biotita > As(V)-muscovita ~ As(III)-muscovita, deixando clara a maior afinidade do arsenato pelos minerais. Segundo ainda os mesmo autores, no caso da caulinita, o arsenato, assim como o fosfato, é mais eficientemente adsorvido em pH 5,0.
0 2 4 6 8 10 12 14
0,001 0,01 0,1 1 10 100
1 30 60 90 120
p
H
lo
g
[
A
s
]
(m
g
/L
)
Tempo (Dias)
Condição Controle
[As] SRP [As] SRS [As] CRP [As] MVP pH SRP pH SRS pH CRP pH MVP
Figura 5.3 – Variação média do pH em função do tempo de contato – Condição Controle (CaCl2 + amostra sólida) – Amostras SRP, SRS, MVP e CRP
Fonte: Próprio autor
Uma análise do diagrama pH-Eh para as espécies arsenicais (figura 3.2), sugere a predominância da espécie neutra e, consequentemente, mais móvel do arsênio trivalente, o arsenito (H3AsO3) nas amostras SRP e SRS, dentro da faixa dos valores de Eh e pH observados experimentalmente. No entanto, ao longo dos 120 dias percebeu-se que a concentração de As na fração solúvel diminuiu, sugerindo sua imobilização.
Geralmente o As(III) é melhor adsorvido com o aumento do pH, porém, isso pode variar segundo os diferentes tipos de solos e superfícies minerais. Esta relação do As com o pH foi verificada nas amostras submetidas à condição Controle. No primeiro dia de contato com a solução de CaCl2 as amostras SRP e SRS apresentaram valores de pH muito baixos, em torno de 4,3 e as maiores concentrações de As na fração solúvel. Com o decorrer do experimento, observou-se elevação nos valores de pH, em torno de 6.6, e a diminuição dos teores de As na fração solúvel.
-50 50 150 250 350 450 550 0,001 0,01 0,1 1 10 100
1 30 60 90 120
E h ( m V ) lo g [ A s ] (m g /L ) Tempo (Dias) Condição Controle
[As] SRP [As] SRS [As] CRP [As] MVP
Eh SRP Eh SRS Eh CRP Eh MVP
304,0 mV para 443,1 mV, no caso da amostra SRS. Ao final dos 120 dias de experimento, estas amostras apresentaram uma ligeira queda do valor de Eh porém, este permaneceu ainda acima de 358,0 mV. As amostras MVP e CRP mantiveram seus valores de Eh próximos aos iniciais, em torno de 428,0 mV, mesmo na presença do cloreto de cálcio.
Figura 5.4 – Variação média do Eh em função do tempo de contato – Condição Controle (CaCl2 + amostra sólida) – Amostras SRP, SRS, MVP e CRP
Fonte: Próprio autor
Todas as amostras, independentemente das condições experimentais, inclusive os testes controle, apresentaram As em fase móvel desde o primeiro dia de contato com o meio lixiviante. De acordo com Mello et al (2006), este As em fase móvel pode ter sido extraído da amostra sólida “devido a uma troca aniônica o com Cl- fornecido pela solução de CaCl2, em vez de dissolução redutiva, uma vez que nenhuma reação redox significativa provavelmente ocorreu durante este curto período de incubação”.
0,01 0,1 1 10 100 1000 0,001 0,01 0,1 1 10 100
1 30 60 90 120
lo g [ F e ], [ M n ], [ S ] (m g /L ) lo g [ A s ] (m g /L ) Tempo (Dias)
SRS - Condição Controle
As Fe Mn S
Figura 5.5 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras SRP – Condição Controle
Fonte: Próprio autor
Figura 5.6 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras SRS – Condição Controle
Fonte: Próprio autor
Em um de seus trabalhos, Mello et al, (2006) comparam a relação entre As, Fe e Mn em condições similares às desenvolvidas neste trabalho. Como resultado, tais autores concluíram que a mobilidade do As está principalmente relacionada à presença de oxi-hidróxidos de Fe e Mn e matéria orgânica. Sob condições redutoras, o As é mobilizado pela
0,01 0,1 1 10 100 1000 0,001 0,01 0,1 1 10 100
1 30 60 90 120 lo
g [ F e ], [ M n ], [ S ] (m g /L ) lo g [ A s ] (m g /L ) Tempo (Dias)
SRP - Condição Controle
0,01 0,1 1 10 100 1000 0,001 0,01 0,1 1 10 100
1 30 60 90 120 lo
g [ F e ], [ M n ], [ S ] (m g /L ) lo g [ A s ] (m g /L ) Tempo (Dias)
MVP - Condição Controle
As Mn Fe S
dissolução redutiva de óxidos de Fe e/ou Mn e sua readsorção para a fase sólida depende das propriedades do solo.Sob condições anóxicas, a matéria orgânica pode favorecer a liberação do As para o ambiente, além de prejudicar a interação do As com, por exemplo, a gibisita. Durante a degradação da matéria orgânica, o ambiente fica mais redutor, que favorece a predominância da espécie As(III), que é mais móvel.
Apenas a amostra CRP apresentou aumento de As na fração solúvel entre 1 e 120 dias de contato com o CaCl2: de 0,694 mg.L-1 para 1,94 mg.L-1 (figura 5.8). Esta amostra, durante os 120 dias, apresentou também valores de pH bem mais ácidos do que as demais, o que pode explicar o aumento da dissolução do As.
Figura 5.7 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras MVP – Condição Controle
Fonte: Próprio autor
0,01 0,1 1 10 100 1000 0,001 0,01 0,1 1 10 100
1 30 60 90 120 lo
g [ F e ], [ M n ], [ S ] (m g /L ) lo g [ A s ] (m g /L ) Tempo (Dias)
CRP - Condição Controle
As Fe Mn S
As, Fe e Mn para o sobrenadante. O arsênio tem uma elevada afinidade pelas superfícies de óxidos, podendo adsorver principalmente nos óxidos de ferro e manganês (SMEDLEY; KINNIBURGH, 2002).
Figura 5.8 – Variação média das concentrações de As, Fe, Mn, S na fração solúvel ao longo do tempo – Amostras CRP – Condição Controle
Fonte: Próprio autor
5.3.2 – Condição B – Amostras sólidas + CaCl2 + matéria orgânica
orgânica, e seus produtos metabólicos são assimilados por outros grupos, até sua oxidação completa. A oxidação química espontânea do pó de penas também não pode ser descartada.
Figura 5.9 – Variação média do Eh em função do tempo de contato – Condição B (CaCl2 + amostra sólida + pó de penas de galinha) – Amostras SRP, SRS, MVP e CRP
Fonte: Próprio autor
As amostras submetidas à Condição B apresentaram pH próximo da neutralidade (entre 6,0 e 7,0) ao longo dos 120 dias, inclusive as amostras MVP e CRP que apresentaram-se inicialmente ácidas (figura 5.10). Ackermann et al (2008) discutem em seu trabalho que solos originalmente ácidos podem chegar a valores de pH entre 6,5 e 7,0 em condições de baixo potencial redox. Este aumento do pH pode ser causado pelo consumo de H+ a partir da redução de oxi-hidróxidos de Fe e Mn ou pelo aumento da pressão parcial de CO2 formado através da fermentação da matéria orgânica, neste caso o pó de penas de galinha.
A primeira etapa da fermentação da matéria orgânica é a hidrólise do material particulado complexo (carboidratos, proteínas, lipídeos) em material dissolvido simples (açúcares, aminoácidos, ácidos graxos de cadeias longas e álcoois). Este material dissolvido é convertido, por ação de bactérias, em compostos de cadeias carbônicas ainda mais simples (ácidos orgânicos voláteis, álcoois, ácido lático, hidrogênio e dióxido de carbono), que, então, são convertidos por outros organismos em acetato, hidrogênio e dióxido de carbono (BERTOLINO, 2007). -50 50 150 250 350 450 550 0,001 0,01 0,1 1 10 100
1 30 60 90 120
E h ( m V ) lo g [ A s ] (m g /L ) Tempo (Dias) Condição B
[As] SRP [As] SRS [As] CRP [As] MVP