RESUMO
Objetivo: Determinar a prevalência de desnutrição em pacientes de um programa para adultos com ibrose cística (FC) e investigar a relação da desnutrição com as características clínicas desses pacientes. Métodos: Trata-se de um estudo transversal com pacientes com FC clinicamente estáveis (com 16 anos de idade ou mais). Os pacientes foram submetidos a avaliação clínica, avaliação nutricional, testes de função pulmonar e avaliação da função pancreática. Eles também preencheram um questionário sobre sua adesão à dieta proposta. Os pacientes foram divididos em três grupos, de acordo com seu estado nutricional: nutrição adequada, risco nutricional e desnutrição. Resultados: O estudo incluiu 73 pacientes (média de idade: 25,6 ± 7,3 anos), dos quais 40 (54,8%) eram do sexo feminino. A média do índice de massa corporal foi de 21,0 ± 3,0 kg/m2, e a média do VEF
1 foi de 59,7 ± 30,6% do previsto. Nessa amostra de pacientes, 32 (43,8%) icaram no grupo com nutrição adequada, 23 (31,5%) icaram no grupo com risco nutricional e 18 (24,7%) icaram no grupo com desnutrição. A análise de regressão logística identiicou três fatores independentes relacionados com o risco de desnutrição: escore de Shwachman-Kulczycki, VEF1 em % do previsto e idade. Conclusões: A desnutrição ainda é uma complicação comum em adolescentes e adultos com FC, não obstante o aconselhamento dietético. A desnutrição está relacionada com a idade, a gravidade clínica e o comprometimento da função pulmonar.
Descritores: Fibrose cística; Desnutrição; Insuiciência pancreática exócrina; Testes de função respiratória.
Fatores associados à desnutrição em
pacientes adolescentes e adultos com
ibrose cística
Gabriela Cristofoli Barni1, Gabriele Carra Forte1, Luis Felipe Forgiarini1,2, Claudine Lacerda de Oliveira Abrahão3, Paulo de Tarso Roth Dalcin1,4
Endereço para correspondência:
Gabriela Cristofoli Barni. Rua João Berutti, 492, Chácara das Pedras, CEP 91330-370, Porto Alegre, RS, Brasil. Tel.: 55 51 9191-9307. E-mail: gabicbarni@hotmail.com
Apoio inanceiro: Este estudo recebeu apoio inanceiro do Fundo de Incentivo à Pesquisa do Hospital de Clínicas de Porto Alegre (FIPE-HCPA). Gabriela Cristofoli Barni foi bolsista da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
INTRODUÇÃO
A fibrose cística (FC) é a mais comum doença autossômica recessiva limitante da vida em indivíduos brancos e é causada pela ausência ou disfunção da proteína cystic ibrosis transmembrane conductance regulator (CFTR, reguladora de condutância transmembrana da ibrose cística). Sabe-se que mutações no gene CFTR
alteram a via aérea e o microambiente intestinal.(1,2) A proteína CFTR consiste em um canal de cloreto na membrana apical das células das vias aéreas, bem como no intestino, fígado e tecidos reprodutores; ela afeta a função pancreática exócrina e os ductos sudoríparos. A proteína CFTR regula o transporte de eletrólitos através das membranas dessas células e dele participa. Assim, há uma relação entre sua ausência ou funcionamento parcial e a isiopatologia da FC.(3,4)
As manifestações clínicas da doença resultam do aumento da viscosidade das secreções, que resulta em obstrução das células epiteliais dos ductos. O fenótipo clássico da FC ou mucoviscidose é caracterizado por infecções pulmonares, insuiciência pancreática, má absorção de nutrientes, doença hepática, infertilidade masculina e perda de eletrólitos no suor.(5)
Nos últimos anos, avanços médicos e tecnológicos aumentaram as médias das taxas de sobrevida em todo
o mundo, principalmente por meio do diagnóstico precoce da FC, da contribuição de especialistas, de melhores tratamentos e de transplantes de órgãos. Quase metade da população com FC tem 18 anos de idade ou mais.(5)
O curso clínico da FC e a qualidade de vida dos pacientes são diretamente afetados por seu estado nutricional, e a desnutrição é um dos desaios mais graves e difíceis do tratamento da FC.(6) A desnutrição resulta de uma discrepância entre as necessidades energéticas/nutricionais e a ingestão alimentar, que pode ser causada por má absorção.(7)
A desnutrição e a doença pulmonar estão inextricavelmente entretecidas na FC. Estudos demonstram que o declínio da função pulmonar e a desnutrição estão relacionados e são fatores dependentes. A desnutrição está relacionada com redução da função pulmonar e da sobrevida. Infecções pulmonares crônicas e diminuição da função pulmonar resultam em aumento das necessidades calóricas e diminuição do apetite, que pioram o estado nutricional dos pacientes com FC.(8,9) Embora haja um crescente número de estudos sobre desnutrição e FC, esses estudos estão relacionados principalmente com pacientes pediátricos.(10,11)
Os objetivos do presente estudo foram determinar a prevalência de desnutrição em pacientes de um programa
1. Programa de Pós-Graduação em
Ciências Pneumológicas, Universidade Federal do Rio Grande do Sul – UFRGS – Porto Alegre (RS) Brasil.
2. Laboratório de Vias Aéreas e Pulmão, Hospital de Clínicas de Porto Alegre – HCPA – Universidade Federal do Rio Grande do Sul – UFRGS – Porto Alegre (RS) Brasil.
3. Serviço de Nutrição, Hospital de Clínicas
de Porto Alegre – HCPA – Universidade Federal do Rio Grande do Sul – UFRGS – Porto Alegre (RS) Brasil.
4. Serviço de Pneumologia, Hospital de
Clínicas de Porto Alegre – HCPA – Universidade Federal do Rio Grande do Sul – UFRGS – Porto Alegre (RS) Brasil.
Recebido: 27 outubro 2016. Aprovado: 26 fevereiro 2017.
para adultos com FC e investigar a relação da desnutrição com as características clínicas desses pacientes.
MÉTODOS
Desenho do estudo
Trata-se de um estudo transversal, realizado em um único centro, de dados coletados prospectivamente. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital de Clínicas de Porto Alegre, em Porto Alegre (RS). Todos os participantes assinaram um termo de consentimento livre e esclarecido.
População
O estudo incluiu pacientes com FC que tinham 16 anos de idade ou mais. Só foram incluídos pacientes cujo diagnóstico havia sido baseado em critérios de consenso.(12) Além disso, só foram incluídos pacientes clinicamente estáveis, isto é, aqueles sem nenhuma mudança atual de medicamentos e sem uso de antibióticos por via intravenosa ou oral em virtude de exacerbações pulmonares nos últimos 30 dias. Foram excluídos os pacientes que não aceitaram participar do estudo, aqueles que não preencheram os critérios de inclusão e as gestantes.
Variáveis clínicas
Foram registrados os seguintes dados: idade, sexo, etnia, presença da mutação F508del (homozigótica, heterozigótica ou outras mutações), presença de diabetes mellitus e escore hepático (normal ou anormal).(13)
Avaliação nutricional
O estado nutricional foi avaliado pelo índice de massa corporal (IMC) e seu percentil. O IMC foi calculado pela relação peso/altura2 (kg/m2). Em pacientes com menos de 20 anos, foi calculado o percentil do IMC. Com base em seu estado nutricional, os pacientes foram divididos em três grupos: nutrição adequada (NA): IMC > 22 kg/m2 para mulheres e IMC > 23 kg/ m2 para homens (idade ≥ 20 anos) ou percentil do IMC > 25 (para pacientes com idade < 20 anos); risco nutricional (RN): IMC = 19-22 kg/m2 para mulheres e 19-23 kg/m2 para homens (idade ≥ 20 anos) ou percentil do IMC = 10-25 (para pacientes com idade < 20 anos); desnutrição: IMC < 19 kg/m2 (para pacientes com idade ≥ 20 anos) ou percentil do IMC < 10 (para pacientes com idade < 20 anos).(6,14)
Estado bacteriológico
Os isolados bacterianos de culturas de escarro dos participantes foram avaliados no Departamento de Microbiologia do Hospital de Clínicas de Porto Alegre. Foi registrada a presença de Staphylococcus aureus, Pseudomonas aeruginosa e Burkholderia cepacia. A presença de qualquer um dos patógenos supracitados foi conirmada por seu isolamento em amostras de escarro rotineiras no laboratório em pelo menos duas ocasiões, com pelo menos 12 meses de intervalo.
Escore clínico
O escore clínico usado foi o escore de Shwachman-Kulczycki (S-K),(15) avaliado pelo médico da equipe de FC em regime ambulatorial.
Testes de função pulmonar
Os testes de função pulmonar foram realizados com um espirômetro computadorizado (MasterScreen v4.31; Jaeger, Würzburg, Alemanha). Foram obtidas pelo menos três curvas, sendo as melhores selecionadas para determinar a CVF e o VEF1, tanto em l como em porcentagem dos valores previstos para a idade, a estatura e o sexo.(16)
Avaliação da função pancreática
O teste da elastase-1 fecal foi realizado por meio de ELISA monoclonal. As amostras de fezes foram coletadas e armazenadas a −22°C até o momento do teste. O ponto de corte de 200 µg/g foi usado para classiicar a função pancreática exócrina dos pacientes (≥ 200 μg/g: suiciência; < 200 μg/g: insuiciência). Os pacientes cujos resultados foram ≥ 100 µg/g, porém < 200 µg/g, foram considerados pacientes com insuiciência pancreática exócrina moderada. Os pacientes com níveis de elastase-1 < 100 µg/g foram considerados pacientes com insuiciência pancreática exócrina grave.(17)
Adesão ao tratamento dietético
Os pacientes preencheram um questionário (adaptado de outro estudo)(18) com três perguntas sobre sua adesão à terapia de reposição enzimática pancreática, ingestão de suplementos multivitamínicos (vitamina A, D, E e K) e dieta hipercalórica (uma dieta rica em energia, proteína e gordura, baseada em um plano de tratamento nutricional e adaptada para atender às necessidades nutricionais de cada indivíduo). Cada pergunta deveria ser respondida com base na frequência semanal de ingestão, da seguinte forma: a) todos os dias ou quase todos os dias; b) 3-5 dias por semana; c) menos de 3 dias por semana ou nunca; d) não se aplica.
Análise estatística
Variáveis selecionadas com p < 0,10 foram introduzidas na regressão logística binária controlada por sexo e idade. Foram então criadas curvas ROC para cada variável preditora identiicada na análise de regressão logística, as quais foram usadas para o cálculo da sensibilidade, especiicidade e valores preditivos das variáveis clínicas relacionadas com a desnutrição. Todos os testes estatísticos usados foram bicaudais. O nível de signiicância adotado foi de p < 0,05.
RESULTADOS
No período entre maio de 2013 e maio de 2014, 104 pacientes foram convidados a participar do estudo. Destes, 6 morreram antes que todos os testes fossem concluídos, 1 mudou-se para outro país, 6 não aceitaram participar do estudo e 18 não realizaram o teste da elastase-1 fecal; portanto, a amostra compreendeu um total de 73 pacientes que completaram o estudo. O resultado do teste da elastase-1 fecal foi inconclusivo em 7 pacientes (n = 66), embora o teste tenha sido executado duas vezes. A média de idade dos participantes foi de 25,6 ± 7,3 anos (19 adolescentes e 54 adultos), dos quais 40 (54,8%) eram do sexo feminino e 33 (45,2%) eram do sexo masculino. Todos os participantes eram brancos. A média do IMC foi de 21,0 ± 3,0 kg/ m2, e a média do VEF
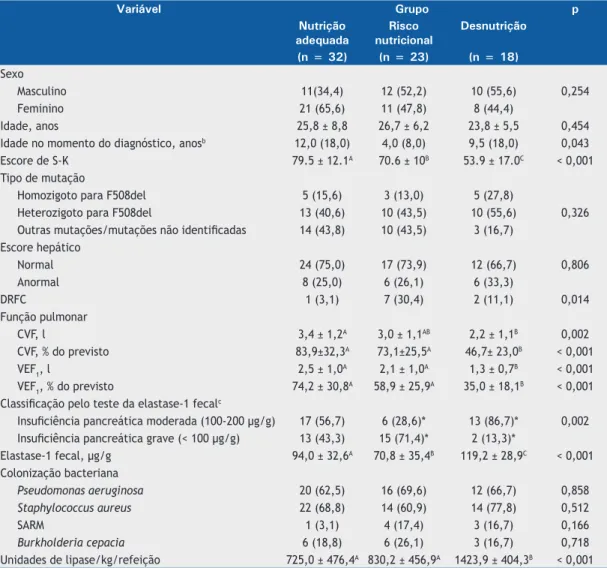
1 foi de 59,7 ± 30,6% do valor previsto. Os grupos foram formados com base no estado nutricional dos pacientes: NA (n = 32; 43,8%); RN (n = 23; 31,5%) e desnutrição (n = 18; 24,7%; Tabela 1). A Tabela 2 apresenta uma comparação das características clínicas dos grupos supracitados. Não houve diferenças signiicativas entre os grupos quanto ao sexo, idade, presença da mutação F508del e escore hepático. A proporção de pacientes com diabetes mellitus foi signiicativamente maior no grupo RN que nos grupos NA e desnutrição (p = 0,014). O escore de S-K foi signiicativamente menor nos grupos RN e desnutrição que no grupo NA (p < 0,001). Os valores de CVF e VEF1 em % do previsto foram signiicativamente menores no grupo desnutrição que nos grupos NA e RN (p < 0,001 para ambos). Os níveis de elastase-1 fecal foram signiicativamente mais baixos no grupo RN que nos grupos NA e desnutrição (p < 0,001 para ambos). Cinquenta e seis pacientes estavam em terapia de reposição enzimática pancreática, e o número de unidades de enzima/kg/refeição foi signiicativamente maior no grupo desnutrição que no grupo NA (p < 0,001) e no grupo RN (p = 0,001).
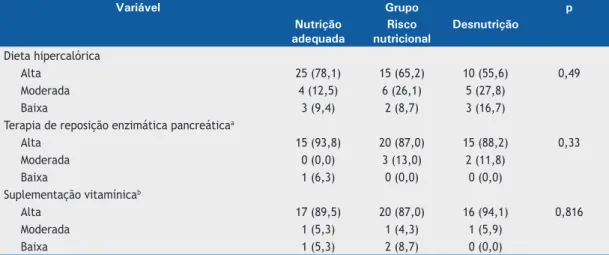
A Tabela 3 mostra a adesão, segundo o relato dos próprios pacientes, à dieta hipercalórica, terapia de reposição enzimática pancreática e ingestão de suplementos vitamínicos nos três grupos nutricionais. Não foram encontradas diferenças signiicativas entre os grupos quanto a essas variáveis.
A análise de regressão logística identiicou três fatores independentes relacionados com a desnutrição: idade (OR = 0,78; p = 0,013), escore de S-K (OR = 0,90; p = 0,015) e VEF1 em % do previsto (OR = 0,95; p = 0,046; Tabela 4).
A análise da curva ROC mostrou que a área sob a curva para o escore de S-K foi de 0,85. Usando um valor de corte ≤ 65 pontos como preditor de desnutrição, observamos sensibilidade de 78,8%, especiicidade de 67,3%, valor preditivo positivo de 43,8% e valor preditivo negativo de 90,2%. A área sob a curva para o VEF1 em % do previsto foi de 0,83. Usando um valor de corte ≤ 40% como preditor de desnutrição, observamos sensibilidade de 67,7%, especiicidade de 81,8%, valor preditivo positivo de 54,5% e valor preditivo negativo de 88,2%. Quanto à idade, a área sob a curva foi de 0,57. Usando um valor de corte ≤ 22 anos de idade como preditor de desnutrição, observamos sensibilidade de 50,0%, especiicidade de 58,2%, valor preditivo positivo de 28,1% e valor preditivo negativo de 78,1%.
DISCUSSÃO
O presente estudo transversal forneceu informações relevantes sobre a prevalência de desnutrição
Tabela 1. Características clínicas dos pacientes incluídos
no estudo (N = 73).a
Variável Resultado
Sexo
Masculino 33 (45,2)
Feminino 40 (54,8)
Idade, anos 25,6 ± 7,3
IMC, kg/m2 21,0 ± 3,0
Classiicação nutricional
Nutrição adequada 32 (43,8)
Risco nutricional 23 (31,5)
Desnutrição 18 (24,7)
DRFC 10 (13,7)
Tipo de mutação
Homozigoto para F508del 13 (17,8)
Heterozigoto para F508del 33 (45,2)
Outras mutações/mutações não identiicadas
27 (37,0)
Idade no momento do diagnóstico, anosb
8 (16)
Escore de S-K 70,41 ± 16,4
Função pulmonar
CVF, l 3,0 ± 1,24
CVF, % do previsto 71,3 ± 31,5
VEF1, l 2,1 ± 1,1
VEF1, % do previsto 59,7 ± 30,6
Elastase-1 fecal, µg/g 92,3 ± 36,8
Colonização bacteriana
Pseudomonas aeruginosa 48 (65,8)
Staphylococcus aureus 50 (68,5)
SARM 8 (11,0)
Burkholderia cepacia 15 (20,5)
IMC: índice de massa corporal; S-K: Shwachman-Kulczycki; DRFC: diabetes relacionado com a ibrose cística; e SARM: Staphylococcus aureus resistente a
meticilina. aValores expressos em forma de n (%) ou
média ± dp, exceto onde indicado. bValor expresso em
e as características clínicas relacionadas com a desnutrição em pacientes com FC em um programa para adultos em um grande centro terciário no sul do Brasil. Em primeiro lugar, metade dos pacientes apresentava nutrição adequada, e um quarto estava desnutrido. Em segundo lugar, identiicamos alguns fatores independentes relacionados com o risco de desnutrição: escore de S-K, VEF1 em % do previsto e idade. Portanto, nossos achados contribuem para a conscientização a respeito dos aspectos multifatoriais da desnutrição em pacientes adolescentes e adultos com FC. Na tentativa de melhorar a nutrição na prática clínica, a equipe multidisciplinar de FC deve levar em conta pacientes mais jovens, com baixo escore clínico e função pulmonar comprometida.
É desaiador discutir o estado nutricional, já que os pesquisadores usam diferentes parâmetros para avaliá-lo. Além disso, a deinição de desnutrição varia
na literatura. Embora as diretrizes recomendem o uso do IMC como um indicador antropométrico simples para classiicar o estado nutricional com a inalidade de melhorar o tratamento nutricional dos pacientes com FC, o uso de múltiplos indicadores nutricionais adequados pode ser de grande importância para melhorar o tratamento individual de pacientes com FC nas práticas de saúde.(7,14,19,20)
A proporção de pacientes com FC com desnutrição no presente estudo (24,7%) é semelhante a achados relatados em outros estudos.(21-24) Um estudo transversal realizado na Grécia(21) com a mesma metodologia e os mesmos pontos de corte para classiicar o estado nutricional mostrou que 23% dos 68 pacientes com FC estavam desnutridos. No entanto, o estudo envolveu 37 crianças e adolescentes.(21) Por outro lado, um estudo com 163 pacientes em um centro terciário para adultos com FC na França mostrou que 49,7% Tabela 2. Comparação dos grupos estudados quanto às características clínicas.a
Variável Grupo p
Nutrição adequada
Risco nutricional
Desnutrição
(n = 32) (n = 23) (n = 18)
Sexo
Masculino 11(34,4) 12 (52,2) 10 (55,6) 0,254
Feminino 21 (65,6) 11 (47,8) 8 (44,4)
Idade, anos 25,8 ± 8,8 26,7 ± 6,2 23,8 ± 5,5 0,454
Idade no momento do diagnóstico, anosb 12,0 (18,0) 4,0 (8,0) 9,5 (18,0) 0,043
Escore de S-K 79.5 ± 12.1A 70.6 ± 10B 53.9 ± 17.0C < 0,001
Tipo de mutação
Homozigoto para F508del 5 (15,6) 3 (13,0) 5 (27,8)
0,326
Heterozigoto para F508del 13 (40,6) 10 (43,5) 10 (55,6)
Outras mutações/mutações não identiicadas 14 (43,8) 10 (43,5) 3 (16,7)
Escore hepático
Normal 24 (75,0) 17 (73,9) 12 (66,7) 0,806
Anormal 8 (25,0) 6 (26,1) 6 (33,3)
DRFC 1 (3,1) 7 (30,4) 2 (11,1) 0,014
Função pulmonar
CVF, l 3,4 ± 1,2A 3,0 ± 1,1AB 2,2 ± 1,1B 0,002
CVF, % do previsto 83,9±32,3A 73,1±25,5A 46,7± 23,0B < 0,001
VEF1, l 2,5 ± 1,0A 2,1 ± 1,0A 1,3 ± 0,7B < 0,001
VEF1, % do previsto 74,2 ± 30,8A 58,9 ± 25,9A 35,0 ± 18,1B < 0,001
Classiicação pelo teste da elastase-1 fecalc
Insuiciência pancreática moderada (100-200 µg/g) 17 (56,7) 6 (28,6)* 13 (86,7)* 0,002
Insuiciência pancreática grave (< 100 µg/g) 13 (43,3) 15 (71,4)* 2 (13,3)*
Elastase-1 fecal, µg/g 94,0 ± 32,6A 70,8 ± 35,4B 119,2 ± 28,9C < 0,001
Colonização bacteriana
Pseudomonas aeruginosa 20 (62,5) 16 (69,6) 12 (66,7) 0,858
Staphylococcus aureus 22 (68,8) 14 (60,9) 14 (77,8) 0,512
SARM 1 (3,1) 4 (17,4) 3 (16,7) 0,166
Burkholderia cepacia 6 (18,8) 6 (26,1) 3 (16,7) 0,718
Unidades de lipase/kg/refeição 725,0 ± 476,4A 830,2 ± 456,9A 1423,9 ± 404,3B < 0,001
S-K: Shwachman-Kulczycki; DRFC: diabetes relacionado com a ibrose cística; e SARM: Staphylococcus aureus resistente a meticilina. aValores expressos em forma de n (%) ou média ± dp, exceto onde indicado. bValores
expressos em forma de mediana (intervalo interquartil). cn = 66. *Resíduo-padrão ajustado > 1,96 ou < −1,96
implica porcentagens signiicativamente diferentes. ANOVA de uma via com teste posthoc de Tukey e teste de
sofriam de desnutrição.(22) O estudo também usou a mesma metodologia e os mesmos pontos de corte para classiicar desnutrição.(22) Um estudo transversal retrospectivo realizado em São Paulo (SP) com 30 adolescentes (na faixa etária de 10,1 a 19,8 anos) usou uma metodologia diferente (o IMC para a idade) para avaliar o estado nutricional dos participantes.(23) Os pontos de corte foram os seguintes: ≥ escore z −3 e < escore z −2 (magreza); escore z −2 e ≤ escore z +1 (peso normal); > escore z +1 (sobrepeso ou obesidade). A mediana (mínimo; máximo) do escore z para o IMC para a idade foi de −0,6 (−3,7; +2,6), o que corresponde a estado nutricional adequado de acordo com os parâmetros da Organização Mundial da Saúde.(23) Em 2007, um estudo realizado em nosso hospital incluiu 41 pacientes com FC (na faixa etária de 16 a 47 anos), usou a mesma metodologia e o mesmo ponto de corte para desnutrição e identiicou 9 pacientes desnutridos (22%).(24) Essas discrepâncias notáveis quanto à prevalência de desnutrição em pacientes com FC podem ser atribuídas à heterogeneidade da doença, ao efeito de sobrevida observado em coortes de indivíduos adultos, a variações interpopulacionais e a diferenças na qualidade da assistência à saúde ou no desenho do estudo (seleção da amostra, faixas etárias incluídas, indicadores de desnutrição e valores de corte).
Há muito se reconhece a relação entre o estado nutricional e a função pulmonar. Numerosos estudos apontaram o efeito negativo da desnutrição na função
respiratória e no prognóstico.(25,26) Os resultados do presente estudo conirmam que nutrição e função pulmonar são variáveis codependentes em pacientes com FC: função pulmonar ruim prediz desnutrição. Em um estudo recente, Hulzebos et al.(27) mostraram que o uso do IMC com o VEF1 poderia prever com precisão a mortalidade em pacientes com FC. Outro estudo recente, com 14.732 pacientes (com idade ≥ 6 anos) do European Cystic Fibrosis Society Patient Registry, conirmou a relação signiicativa entre IMC ruim e função pulmonar ruim.(28) Os autores enfatizaram que o IMC é um fator evitável ou potencialmente tratável; entretanto, apesar das diretrizes disponíveis para a prevenção e correção de deiciências nutricionais na FC, 9,5% dos pacientes com FC na Europa ainda sofrem de desnutrição grave crônica.(28)
A insuiciência pancreática exócrina é um fator prognóstico da desnutrição. Couper et al.,(29) em um estudo longitudinal, mostraram que pacientes com suiciência pancreática apresentaram insuiciência pancreática em uma idade mais avançada. No presente estudo, o teste da elastase-1 fecal foi usado para quantiicar a gravidade da insuiciência pancreática e prever desnutrição. Todos os pacientes de nossa amostra apresentaram níveis de elastase-1 fecal < 200 µg/g. Surpreendentemente, os níveis de elastase-1 fecal foram mais elevados no grupo desnutrição que no grupo NA e mais elevados no grupo NA que no grupo RN. Uma possível explicação para esse achado é que a diferença entre os grupos quanto à média do Tabela 3. Adesão, segundo o relato dos próprios pacientes, à dieta hipercalórica, terapia de reposição enzimática
pancreática e ingestão de suplementos vitamínicos, por grupo.
Variável Grupo p
Nutrição adequada
Risco nutricional
Desnutrição
Dieta hipercalórica
Alta 25 (78,1) 15 (65,2) 10 (55,6) 0,49
Moderada 4 (12,5) 6 (26,1) 5 (27,8)
Baixa 3 (9,4) 2 (8,7) 3 (16,7)
Terapia de reposição enzimática pancreáticaa
Alta 15 (93,8) 20 (87,0) 15 (88,2) 0,33
Moderada 0 (0,0) 3 (13,0) 2 (11,8)
Baixa 1 (6,3) 0 (0,0) 0 (0,0)
Suplementação vitamínicab
Alta 17 (89,5) 20 (87,0) 16 (94,1) 0,816
Moderada 1 (5,3) 1 (4,3) 1 (5,9)
Baixa 1 (5,3) 2 (8,7) 0 (0,0)
an = 56; terapia de reposição enzimática pancreática não indicada em 17 pacientes. bn = 59: suplementação
vitamínica não indicada em 14 pacientes.
Tabela 4. Análise de regressão logística da desnutrição (pelo método enter).
Variável Beta p OR IC95% da OR
Sexo masculino −0,41 0,961 0,96 0,19-4,95
Idade −0,24 0,013 0,78 0,65-0,95
Escore de S-K −0,11 0,015 0,90 0,82-0,98
VEF1, % do previsto −0,05 0,046 0,95 0,90-0,99
Constante 14,65 0,002 2.312.450,04
nível de elastase-1 fecal, embora estatisticamente signiicativa, foi de baixa magnitude e não teve impacto no desfecho nutricional.
Outro achado do presente estudo foi que as doses de reposição enzimática pancreática foram signiicativamente maiores nos pacientes desnutridos que nos pacientes dos outros grupos. Esse achado vai de encontro aos de uma recente análise retrospectiva feita por Haupt et al.,(30) que sugeriram que a dose de reposição enzimática pancreática está relacionada com um estado nutricional melhor; no entanto, o estudo em questão só incluiu crianças. A média da dose de reposição enzimática em nossos pacientes foi coerente com as recomendações das diretrizes(7): não superior a 2.500 unidades de lipase/kg/refeição.
O escore de S-K(15) é um escore de gravidade clínica geral com quatro domínios: atividade geral, exame físico, nutrição e achados radiológicos. Cada domínio varia de 0 a 25 pontos, e as pontuações dos domínios são somadas a im de obter a pontuação global (de no máximo 100). Pontuações mais altas reletem um estado clínico melhor. No presente estudo, escores clínicos baixos previram desnutrição. O escore de S-K não foi usado em três estudos prévios sobre o estado nutricional de pacientes com FC.(21-23) Por outro lado, não houve relação signiicativa entre desnutrição e o escore de S-K no estudo de Ziegler et al.(24)
Estudos longitudinais demonstraram que se pode esperar que a desnutrição aumente com o envelhecimento.(31,32) No entanto, é interessante que nossos resultados tenham mostrado que ser jovem foi um preditor de desnutrição apenas na análise multivariada. Não obstante, é provável que a idade e a preservação do estado nutricional estejam relacionadas com doença mais leve, e que um início
mais tardio da doença tenha um impacto positivo no estado nutricional dos pacientes. Uma hipótese para esse achado é o viés de sobrevivência na população de pacientes com FC no presente estudo. Pacientes com função pulmonar ruim e desnutrição não atingiram a faixa etária investigada no presente estudo.
Em nosso estudo, a adesão, segundo o relato dos próprios pacientes, à dieta hipercalórica, terapia de reposição enzimática pancreática e ingestão de suplementos vitamínicos foi alta e não apresentou relação com o estado nutricional. Em um estudo anterior,(33) 65,8%, 96,3% e 79,4% dos pacientes, respectivamente, relataram boa adesão à dieta hipercalórica, terapia de reposição enzimática pancreática e ingestão de suplementos vitamínicos. Arias Llorente et al.(34) sugeriram que a adesão dos pacientes ao tratamento seria melhor se eles acreditassem que o tratamento seria benéico e melhoraria sua qualidade de vida. Além disso, estudos anteriores demonstraram que pacientes que compreendem a importância de seguir instruções médicas e que coniam em seus médicos provavelmente apresentam maior adesão. O fato de que a adesão ao tratamento tende a diminuir com a idade também já foi mencionado.(18,35)
O presente estudo tem potenciais limitações. Por se tratar de um estudo transversal, foi impossível estabelecer a sequência temporal dos fatores estudados e a desnutrição. Além disso, nossa amostra de pacientes foi pequena.
Em suma, o presente estudo demonstrou que a desnutrição ainda é uma complicação comum em adolescentes e adultos com FC, não obstante o aconselhamento dietético. A desnutrição está relacionada com a idade, a gravidade clínica e o comprometimento da função pulmonar.
REFERÊNCIAS
1. Madan JC, Koestler DC, Stanton BA, Davidson L, Moulton LA, Housman ML, et al. Serial analysis of the gut and respiratory microbiome in cystic ibrosis in infancy: interaction between intestinal and respiratory tracts and impact of nutritional exposures. MBio. 2012;3(4):e00251-12. pii: e00251-12.
2. Davies JC, Alton EW, Bush A. Cystic ibrosis. BMJ. 2007;335(7632):1255-9. https://doi.org/10.1136/bmj.39391.713229. AD
3. Cohen-Cymberknoh M, Shoseyov D, Kerem E. Managing cystic ibrosis: strategies that increase life expectancy and improve quality of life. Am J Respir Crit Care Med. 2011;183(11):1463-71. https://doi. org/10.1164/rccm.201009-1478CI
4. Strausbaugh SD, Davis PB. Cystic ibrosis: a review of epidemiology and pathobiology. Clin Chest Med. 2007;28(2):279-88. https://doi. org/10.1016/j.ccm.2007.02.011
5. Boyle MP. Adult cystic ibrosis. JAMA. 2007;298(15):1787-93. https://doi.org/10.1001/jama.298.15.1787
6. Milla CE. Nutrition and lung disease in cystic ibrosis. Clin Chest Med. 2007;28(2):319-30. https://doi.org/10.1016/j.ccm.2007.02.006 7. Stallings VA, Stark LJ, Robinson KA, Feranchak AP, Quinton H;
Clinical Practice Guidelines on Growth and Nutrition Subcommittee; et al. Evidence-based practice recommendations for nutrition-related management of children and adults with cystic ibrosis and pancreatic insuficiency: results of a systematic review. J Am Diet Assoc. 2008;108(5):832-9. https://doi.org/10.1016/j.jada.2008.02.020 8. Peterson ML, Jacobs DR Jr, Milla CE. Longitudinal changes in growth
parameters are correlated with changes in pulmonary function in children with cystic ibrosis. Pediatrics. 2003; 112(3 Pt 1):588-92.
https://doi.org/10.1542/peds.112.3.588
9. Konstan MW, Butler SM, Wohl ME, Stoddard M, Matousek R, Wagener JS, et al. Growth and nutritional indexes in early life predict pulmonary function in cystic ibrosis. J Pediatr. 2003;142(6):624-30. https://doi.org/10.1067/mpd.2003.152
10. Ranganathan SC, Parsons F, Gangell C, Brennan S, Stick SM, Sly PD, et al. Evolution of pulmonary inlammation and nutritional status in infants and young children with cystic ibrosis. Thorax. 2011;66(5):408-13. https://doi.org/10.1136/thx.2010.139493 11. Sheikh S, Zemel BS, Stallings VA, Rubenstein RC, Kelly A. Body
composition and pulmonary function in cystic ibrosis. Front Pediatr. 2014;2:33. https://doi.org/10.3389/fped.2014.00033
12. Rosenstein BJ, Cutting GR. The diagnosis of cystic ibrosis: a consensus statement. Cystic Fibrosis Foundation Consensus Panel. J Pediatr. 1998;132(4):589-95. https://doi.org/10.1016/S0022-3476(98)70344-0
13. Williams SG, Evanson JE, Barrett N, Hodson ME, Boultbee JE, Westaby D. An ultrasound scoring system for the diagnosis of liver disease in cystic ibrosis. J Hepatol. 1995;22(5):513-21. https://doi. org/10.1016/0168-8278(95)80444-7
14. Borowitz D, Baker RD, Stallings V. Consensus report on nutrition for pediatric patients with cystic ibrosis. J Pediatr Gastroenterol Nutr. 2002;35(3):246-59.
https://doi.org/10.1097/00005176-200209000-00004
16. Pereira CA, Barreto SP, Simões JG, Pereira FW, Gerstler JG, Nakatani J. Valores de referência para espirometria em uma amostra da população brasileira adulta. J Pneumol. 1992;18(1):10-22. 17. Löser C, Möllgaard A, Fölsch UR. Faecal elastase 1: a novel, highly
sensitive, and speciic tubeless pancreatic function test. Gut. 1996;39(4):580-6. https://doi.org/10.1136/gut.39.4.580
18. Conway SP, Pond MN, Hamnett T, Watson A. Compliance with treatment in adult patients with cystic ibrosis. Thorax. 1996;51(1):29-33. https://doi.org/10.1136/thx.51.1.29
19. Sinaasappel M, Stern M, Littlewood J, Wolfe S, Steinkamp G, Heijerman HG, et al. Nutrition in patients with cystic ibrosis: a European Consensus. J Cyst Fibros. 2002;1(2):51-75. https://doi. org/10.1016/S1569-1993(02)00032-2
20. Yankaskas JR, Marshall BC, Suian B, Simon RH, Rodman D. Cystic ibrosis adult care: consensus conference report. Chest. 2004;125(1 Suppl):1S-39S. https://doi.org/10.1378/chest.125.1_suppl.1S 21. Panagopoulou P, Fotoulaki M, Nikolaou A, Nousia-Arvanitakis S.
Prevalence of malnutrition and obesity among cystic ibrosis patients. Pediatr Int. 2014;56(1):89-94. https://doi.org/10.1111/ped.12214 22. Dray X, Kanaan R, Bienvenu T, Desmazes-Dufeu N, Dusser D,
Marteau P, et al. Malnutrition in adults with cystic ibrosis. Eur J Clin Nutr. 2005;59(1):152-4. https://doi.org/10.1038/sj.ejcn.1602039 23. Del Ciampo IR, Del Ciampo LA, Sawamura R, de Oliveira LR,
Fernandes MI. Nutritional status of adolescents with cystic ibrosis treated at a reference center in the southeast region of Brazil. Ital J Pediatr. 2015;41:51. https://doi.org/10.1186/s13052-015-0159-x 24. Ziegler B, Rovedder PM, Lukrafka JL, Abrahão CL, Dalcin PT. Estado
nutricional em pacientes atendidos por um programa de adultos para
ibrose cística. Rev HCPA. 2007;27(3):13-9.
25. Corey M, McLaughlin FJ, Williams M, Levison H. A comparison of survival, growth, and pulmonary function in patients with cystic ibrosis in Boston and Toronto. J Clin Epidemiol. 1988;41(6):583-91. https://doi.org/10.1016/0895-4356(88)90063-7
26. Zemel BS, Jawad AF, FitzSimmons S, Stallings VA. Longitudinal relationship among growth, nutritional status, and pulmonary function in children with cystic ibrosis: analysis of the Cystic Fibrosis
Foundation National CF Patient Registry. J Pediatr. 2000;137(3):374-80. https://doi.org/10.1067/mpd.2000.107891
27. Hulzebos EH, Bomhof-Roordink H, van de Weert-van Leeuwen PB, Twisk JW, Arets HG, van der Ent CK, et al. Prediction of mortality in adolescents with cystic ibrosis. Med Sci Sports Exerc. 2014;46(11):2047-52. https://doi.org/10.1249/ MSS.0000000000000344
28. Kerem E, Viviani L, Zolin A, MacNeill S, Hatziagorou E, Ellemunter H, et al. Factors associated with FEV1 decline in cystic ibrosis: analysis of the ECFS patient registry. Eur Respir J. 2014;43(1):125-33. https:// doi.org/10.1183/09031936.00166412
29. Couper RT, Corey M, Moore DJ, Fisher LJ, Forstner GG, Durie PR. Decline of exocrine pancreatic function in cystic ibrosis patients with pancreatic suficiency. Pediatr Res. 1992;32(2):179-82. https://doi. org/10.1203/00006450-199208000-00011
30. Haupt ME, Kwasny MJ, Schechter MS, McColley SA. Pancreatic enzyme replacement therapy dosing and nutritional outcomes in children with cystic ibrosis. J Pediatr. 2014;164(5):1110-1115.e1. https://doi.org/10.1016/j.jpeds.2014.01.022
31. Steinkamp G, Wiedemann B. Relationship between nutritional status and lung function in cystic ibrosis: cross sectional and longitudinal analyses from the German CF quality assurance (CFQA) project. Thorax. 2002;57(7):596-601. https://doi.org/10.1136/thorax.57.7.596 32. Nir M, Lanng S, Johansen HK, Koch C. Long-term survival and
nutritional data in patients with cystic ibrosis treated in a Danish centre. Thorax. 1996;51(10):1023-7. https://doi.org/10.1136/ thx.51.10.1023
33. Dalcin Pde T, Rampon G, Pasin LR, Ramon GM, Abrahão CL, Oliveira VZ. Adherence to treatment in patients with cystic ibrosis [Article in Portuguese]. J Bras Pneumol. 2007;33(6):663-70.
34. Arias Llorente RP, Bousoño García C, Díaz Martín JJ. Treatment compliance in children and adults with cystic ibrosis. J Cyst Fibros. 2008;7(5):359-67. https://doi.org/10.1016/j.jcf.2008.01.003 35. Abbott J, Dodd M, Gee L, Webb K. Ways of coping with cystic