UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE FARMÁCIA, ODONTOLOGIA E ENFERMAGEM
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
LARISSA QUEIROZ ROCHA
INTERFERÊNCIA DO ÓLEO ESSENCIAL DE FOLHAS DO QUIMIOTIPO II DE
Lippia alba (MILL.) N.E. BROWN NA ATIVIDADE ANTIMICROBIANA DA
OXACILINA SOBRE Staphylococcus aureus OXACILINA-RESISTENTE
LARISSA QUEIROZ ROCHA
INTERFERÊNCIA DO ÓLEO ESSENCIAL DE FOLHAS DO QUIMIOTIPO II DE Lippia alba (MILL.) N.E. BROWN NA ATIVIDADE ANTIMICROBIANA DA OXACILINA
SOBRE Staphylococcus aureus OXACILINA-RESISTENTE
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Ciência Farmacêuticas da Faculdade de Farmácia, Odontologia e Enfermagem da Universidade Federal do Ceará, como parte dos requisitos necessários à obtenção do título de Mestre em Ciências Farmacêuticas.
Orientadora: Profª.Dra. Nádia Accioly Pinto Nogueira
FORTALEZA
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
R574i Rocha, Larissa Queiroz
Interferência do óleo essencial de folhas do quimiotipo II de Lippia alba (MILL.) N.E. Brown na atividade antimicrobiana da oxacilina sobre Staphylococcus aureus oxacilina-resistente/ Larissa Queiroz Rocha. – 2012.
125 f. : il.
Dissertação (Mestrado) – Universidade Federal do Ceará, Faculdade de Farmácia, Odontologia e Enfermagem, Programa de Pós-Graduação em Ciências Farmacêuticas, Fortaleza, 2012. Orientação: Profª Dra Nádia Accioly Pinto Nogueira
1. Lippia 2 Óleos Voláteis 3. Sinergismo Farmacológico 4. Staphylococcus aureus 5. Oxacilina I. Título.
LARISSA QUEIROZ ROCHA
INTERFERÊNCIA DO ÓLEO ESSENCIAL DE FOLHAS DO QUIMIOTIPO II DE Lippia alba (MILL.) N.E. BROWN NA ATIVIDADE ANTIMICROBIANA DA OXACILINA
SOBRE Staphylococcus aureus OXACILINA-RESISTENTE
Dissertação apresentada ao Programa de Pós Graduação em Ciência Farmacêuticas da Faculdade de Farmácia, Odontologia e Enfermagem da Universidade Federal do Ceará, como parte dos requisitos necessários à obtenção do título de Mestre em Ciências Farmacêuticas.
Aprovada em 19/01/2012.
Banca examinadora:
__________________________________________ Profª.Dra. Nádia Accioly Pinto Nogueira (Orientadora) Departamento de Análises Clínicas e Toxicológicas (UFC)
__________________________________________ Profª.Dra Maria Goretti Rodrigues de Queiroz Departamento de Análises Clínicas e Toxicológicas (UFC)
__________________________________________ Profª.Dr. Thalles Barbosa Grangeiro
Dedico primeiramente este trabalho aos meus pais, Leto e Rita, pelo apoio incondicional, incentivo, pela minha formação e acima de tudo
por terem me ensinado que a felicidade está na simplicidade da vida.
Aos meus queridos avós (in memorian) “Seu” Alcides e “Dona” Rosa… … a lembrança de vocês nunca se apagará,
AGRADECIMENTOS
À minha orientadora, Profª. Dra. Nádia Accioly Pinto Nogueira, pela excelente orientação, confiança depositada em mim, carinho e amizade, mas principalmente pelos seus ensinamentos e exemplo de uma grande mestre. Quando se admira o mestre, o coração dá ordens à inteligência para aprender o que o mestre faz.
À Silvia Belchior, pelo companheirismo, incentivo, carinho e amizade. Por todas as correções feitas, por todas as vezes que forneceu apoio e suporte nos momentos de fragilidade, pela paciência, e principalmente pelo apoio incondicional.
Aos amigos do Laboratório de Microbiologia Aplicada, Andréa Bessa, Adriana Albuquerque, Rafael Mendes, e principalmente Andressa Moraes, Eric Tobaruela, Gleilton Weyne e Fabrício César, pelos momentos de seriedade, pelos momentos de descontração, pelas madrugadas e finais de semana. O sucesso desse trabalho não seria alcançado sem a ajuda de vocês!
Aos amigos da pós-graduação, Vanessa, Clarissa, Mariana, Aline, Milena, Thisciane, Davi
e Luciana, teria sido bem mais difícil sem a companhia de vocês.
Ao meu pai, Leto Rocha, Dra. Rita de Cássia e a EMBRAPA, pelo fornecimento das folhas de Lippia alba necessárias à realização deste estudo.
À secretária Raimundinha pela colaboração e amizade.
Aos professores que Profª.Dr. Thalles Barbosa Grangeiro e Profª.Dra Maria Goretti Rodrigues de Queiroz por aceitarem o convite de participação da banca e pelas importantíssimas considerações feitas.
Ás minhas eternas amigas, Gisele Serpa e Rochelle Benevides – “Heleninhas”, pela a amizade cultivada ao longo desses anos. Obrigada por todos os momentos de brincadeiras e descontração.
Ao amigo Paulo Enrique por ter cedido um cantinho tranquilo para a elaboração final deste trabalho.
Aos meus irmãos, João e Raissa, pelo apoio sempre.
À Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico -FUNCAP, pelo apoio financeiro com a manutenção da bolsa de auxílio.
“A vida não dá e nem empresta, não se comove e
nem se apieda. Tudo quanto ela faz é retribuir e transferir
aquilo que nós lhe oferecemos.”
RESUMO
cepas ORSA, verificou-se que o OELaII reduziu o número de células viáveis em qualquer estágio de crescimento. O mesmo não foi verificado quando a divisão celular foi interrompida pela presença de cloranfenicol, sugerindo que o OE age, principalmente, na fase exponencial de crescimento (intensa divisão celular). A curva de morte microbiana pela atividade do OELaII e Oxacilina, mostrou um efeito sinérgico para a associação OELaII-OXA, com uma redução logarítima significativa, quando comparado ao tratamento feito isoladamente. Diante desse importante potencial biológico, este estudo sugere que a Lippia alba possa ser utilizado como insumo farmacêutico em preparações de associação com medicamentos antimicrobianos visando a diminuir a toxicidade e aumentar o seu espectro de ação. Todavia, surge a importância de estudos sobre a elucidação dos diferentes alvos moleculares através do conhecimento do seu mecanismo de ação, bem como testes de toxicidade in vitro, oferecendo assim, segurança e eficácia terapêutica aos usuários dessa importantes espécie vegetal.
ABSTRACT
The Lippia alba (Mill.) N. E. Brown species inhabits almost all regions of Brazil, which is plenty used in popular medicine. Studies show that between the Brazilian Northeast three chemotypes of L. alba, the chemotype II (OELaII), produces in its leaves, essential oil with the largest and broadest antimicrobial potential. The objective of this study was to evaluate the interference of the OELaII in the Oxacillin activity and its mechanism of action against Staphylococcus aureus. The antimicrobial activity was performed by determining the Minimum Inhibitory Concentration (MIC) and minimum bactericidal concentration (MBC) by broth microdilution methods of culture and spreading on the surface of agar Plate-Count, respectively. The evaluation of the OELaII interference on antimicrobial oxacillin activity and other antibiotics was performed by using methodology changed disk diffusion. The checkerboard method, calculation of Fractional Inhibitory Concentration Indices and graphing Isobologramas was used to assess the interference OELaII the antimicrobial activity oxacillin. The study of the OELaII mechanism of action on strains of S. aureus was performed by evaluating the OE antimicrobial activity in the phases of exponential growth and stationary as well as by the action of chloramphenicol on the exponential growth. The effect of OELaII, oxacillin and OELaII-OXA exposure time, on strains of S. aureus was observed by tracing curves time of death, was considered synergistic association was found that a reduction in the number of viable cells after 24-48 hours when compared to each compound alone. The results revealed that the MIC and MBC OELaII to the strains of S. aureus oxacillin resistant (ORSA) are equal or very close to those observed for susceptible strains (UR) ranging from 0.312 to 1.25 mg / ml and 1.25 to 5.0 mg / mL for the first, and 0.312 -0.625 mg / mL and 0.625 to 2.5 mg / mL for the second. Oxacillin to the values obtained were 6.25 to 200 mg / ml and 25 and 400 mg / mL and 0.390 to 3.12 for ORSA mg / mL and 0.781 to 6.25 mg / mL for the UR. The study of the evaluation of synergism using the Kirby-Bauer method and checkerboad showed that the interference exerted by the essential oil on the antimicrobial action vary with the type of antibiotic and the type of strain tested. Isobologram charts obtained by checkerboard method suggests a synergism between good and OELaII Oxacillin for all the microorganisms tested. The study of the mechanism of action on inhibition OELaII /death ORSA strains, it was found that the OELaII reduced the number of viable cells in any growth stage. The same was not observed when cell division was halted by the presence of chloramphenicol, suggesting that OE acts mainly in the exponential growth phase (intense cell division). The death curve by microbial activity and OELaII Oxacillin showed a synergistic effect for the association OELaII-OXA, with a logarithmic decrease significantly when compared to treatment done alone. Given this biological potential, this study suggests that the Lippia alba can be used as a pharmaceutical ingredient in preparations of association with antimicrobial drugs in order to diminish the toxicity and increase its spectrum. However, there is the importance of studies on the elucidation of the different molecular targets through knowledge of its mechanism of action and toxicity testing in vitro, thus providing the safety and therapeutic efficacy of this important plant species users.
LISTA DE FIGURAS
Figura 1 - Distribuição mundial da espécie Lippia alba (Mill.) N. E. Brown 27
Figura 2 - Quimiotipo II de L. alba N.E Brown em cultivo no Campo Experimental de
Paraipaba/CE, da Embrapa Agroindústria Tropical 31
Figura 3 - Estrutura química dos isômeros Geranial (Citral a) e Neral (Citral b) 32
Figura 4 - Estrutura química dos isômeros R-Limoneno e S-Limoneno 33
Figura 5 - Estrutura química da Penicilina. Primeiro antimicrobiano descoberto proveniente de um fungo pertencente ao gênero Penicillium, em 1928
35
Figura 6 - Estrutura química da Oxacilina 37
Figura 7 - Sítios e mecanismos de ação dos OE na célula bacteriana 40
Figura 8 - Espécimes de L. alba cultivados no Campo Experimental de Paraipaba, da Embrapa Agroindústria Tropical
46
Figura 9 - Fluxograma da Estratégia Experimental 48
Figura 10 - Obtenção de diluições seriadas de OELaII (1.Solução mãe -200 mg/mL até
diluição 1/2048, correspondendo a 0,0976 mg/mL) 50
Figura 11 - Esquema para a determinação da Concentração Inibitória Mínima (CIM) 52
Figura 12 - Esquema para a determinação da Concentração Bactericida Mínima (CBM) 53
Figura 13 - Esquema utilizado para avaliação da interferência do OELaII na atividade antimicrobiana da Oxacilina sobre cepas de S. aureus, pelo método de Checkerboard
55
Figura 15 - Esquema para a determinação do efeito do OELaII sobre cepas-padrão de S. aureus na fase de crescimento exponencial na presnça de cloranfenicol
60
Figura 16 - Esquema para determinação do efeito do tempo de exposição do OELaII,
Oxacilina e OELaII-OXA sobre S. aureus 62
Figura 17 - Cromatograma do OELaII realizada por meio de cromatografia gasosa acoplada a espectrometria de massa (CG-MS)
66
Figura 18 - Determinação da Concentração Inibitória Mínima (CIM) por inspeção visual 68
Figura 19 - Interferência do OELaII na atividade antimicrobiana de antibióticos de uso
clínico 81
LISTA DE GRÁFICOS
Gráfico 1 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus ATCC 6538P (cepa OSSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
70
Gráfico 2 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus ATCC 6538P (cepa OSSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
70
Gráfico 3 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus ATCC 14458 (cepa OSSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
71
Gráfico 4 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus ATCC 14458 (cepa OSSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
71
Gráfico 5 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus ATCC 33591 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
72
Gráfico 6 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus ATCC 33591 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
72
Gráfico 7 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus CCBH 5330 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
73
Gráfico 8 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus CCBH 5330 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
73
Gráfico 9 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus LM01 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
74
Gráfico 10 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus LM01 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
Gráfico 11 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus LM02 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
75
Gráfico 12 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus LM02 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
75
Gráfico 13 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus LM03 (cepa OSSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
76
Gráfico 14 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus LM03 (cepa OSSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
76
Gráfico 15 - Concentração Inibitória Mínima (CIM) do OELaII para cepa S. aureus LM04 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
77
Gráfico 16 - Concentração Inibitória Mínima (CIM) da OXA para cepa S. aureus LM04 (cepa ORSA), determinada por medida de densidade ótica em leitora de ELISA (Bio-Tek), a 620nm
77
Gráfico 17 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus ATCC 6538P
83
Gráfico 18 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus ATCC 14458 83
Gráfico 19 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus ATCC 33591 84
Gráfico 20 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus CCBH 5330
84
Gráfico 21 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus LM01
85
Gráfico 22 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus LM02
Gráfico 23 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus LM03
86
Gráfico 24 - Curva do Isobolograma mostrando o efeito sinérgico da combinação OELaII-OXA na inibição do crescimento do Staphylococcus aureus LM04 86
Gráfico 25 - Efeitos do OELaII sobre a cepa Staphylococcus aureus ATCC 6538P em diferentes fases de crescimento
89
Gráfico 26 - Efeitos do OELaII sobre a cepa Staphylococcus aureus ATCC 14458 em diferentes fases de crescimento
89
Gráfico 27 - Efeitos do OELaII sobre a cepa Staphylococcus aureus ATCC 33591 em diferentes fases de crescimento
90
Gráfico 28 - Efeitos do OELaII sobre a cepa Staphylococcus aureus CCBH 5330 em diferentes fases de crescimento
90
Gráfico 29 - Efeitos do OELaII sobre a Staphylococcus aureus ATCC 6538P na presença de cloranfenicol
91
Gráfico 30 - Efeitos do OELaII sobre a Staphylococcus aureus ATCC 14458 na presença de cloranfenicol
92
Gráfico 31 - Efeitos do OELaII sobre a Staphylococcus aureus ATCC 33591 na presença de cloranfenicol
92
Gráfico 32 - Efeitos do OELaII sobre a Staphylococcus aureus CCBH 5330 na presença
de cloranfenicol 93
Gráfico 33 - Efeito do tempo de exposição ao OELaII, a Oxacilina e a associação
OELaII-OXA sobre cepas de S. aureus ATCC 6538P (OSSA) 95
Gráfico 34 - Efeito do tempo de exposição ao OELaII, a Oxacilina e a associação OELaII-OXA sobre cepas de S. aureus ATCC 6538P (OSSA)
96
Gráfico 35 - Efeito do tempo de exposição ao OELaII, a Oxacilina e a associação OELaII-OXA sobre cepas de S. aureus ATCC 33591 (ORSA)
97
Gráfico 36 - Efeito do tempo de exposição ao OELaII, a Oxacilina e a associação OELaII-OXA sobre cepas de S. aureus ATCC 33591 (ORSA)
LISTA DE TABELAS
Tabela 1 - Relação de cepas de Staphylococcus aureus descritas quanto a origem e perfil de sensibilidade à Oxacilina
45
Tabela 2 - Constituintes químicos do óleo essencial de folhas do quimiotipo II de Lippia alba (MILL.) N.E.Brow identificados através da cromatografia gasosa com detecção por espectrometria de massas (CG-MS)
67
Tabela 3 - Concentração Inibitória Mínima (CIM) e Concentração Bactericida Mínima (CBM) do óleo essencial das folhas do quimiotipo II de Lippia alba N.E. Brown e da Oxacilina sobre cepas de S. aureus
69
Tabela 4 - Perfil de sensibilidade/resistência de cepas de S. aureus a Oxacilina e diferentes antimicrobianos de uso clínico
79
Tabela 5 - Interferência do OELaII sobre a ação antibacteriana de antibióticos utilizados na clínica
80
Tabela 6 - Concentração Inibitória Mínima (CIM), Concentração inibitória fracionada (CIF) e índice CIF
LISTA DE ABREVIATURAS E SIGLAS
AMI Amicacina
ANOVA Análise da Variação
ATCC American Type Culture Collection ATM Antimicrobiano
BHI Brain Heart Infusion
CBM Concenytação Bactericida Mínima
CFO Cefoxitina
CIF Concentração Inibitória Fracionada
CG/EM Cromatografia Gasosa Acoplada a Espectrofotometria de Massa
CIM Concentração Inibitória Mínima
CLI Clindamicina
CLO Cloranfenicol
CLSI Clinical and Laboratory Standarda Institute CPM Cefepime
DACT Departamento de Análises Clínicas e Toxicológicas
DB Dimetil-polisiloxane
eV elétron Volt
EPM Erro Padão da Média
°C Grau Celsius
HI Halo de inibição
HUWC Hospital Universitário Walter Cantídio
FFOE Faculdade de Farmácia Odontologia e Enfermagem
FIOCRUZ Fundação Oswaldo Cruz
FUNCAP Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico
ICIF Índice da Concentração Inibitória Fracionada
LabMicro Laboratório de Pesquisa em Microbiologia Aplicada
LACT Laboratório de Análises Clínicas e Toxicológicas
L. alba Lippia alba
mg miligrama
µg micrograma
Min Minuto
mL mililitro
µL microlitro
MPM Meropenem
NCCLS National Committee for Clinical Laboratory Standards
ng nanograma
OELaII Óleo Essencial de Lippia alba II
OELaII-ATM Óleo Essencial de Lippia alba II em associação com Antimicrobiano
OELaII-OXA Óleo Essencial de Lippia alba II em associação com a Oxacilina
ORSA Oxacillin Resistent Staphylococcus aureus
OSSA Oxacillin Sensitive Staphylococcus aureus
OXA Oxacilina
PADETEC Parque de Desenvolvimento Tecnológico do Ceará
S. aureus Staphylococcus aureus
UFC/mL Unidade Formadora de Colônia por mililitro
LISTA DE SÍMBOLOS
* Asterisco
α Alfa
Β Beta
Gama
ᶲ Fi
ᵑ Etá
ᵋ Épsilon
Delta
ᵡ Chi
SUMÁRIO
1 INTRODUÇÃO 25
2 REVISÃO BIBLIOGRÁFICA 27
2.1 Lippia alba e seus quimiotipos 27
2.2 Óleos essenciais 29
2.2.1 Óleo essencial de folhas do quimiotipo II de Lippia alba e seus constituintes majoritários, Citral e Limoneno
31
2.3 Antimicrobianos: A ameaça da Resistência bacteriana 34
2.3.1 Oxacilina e Staphylococcus aureus Oxacilina-Resistente (ORSA) 36
2.4 Mecanismo de ação antimicrobiana de plantas medicinais 38
2.5 Associações de Óleos essenciais a agentes Antimicrobianos 40
3 OBJETIVOS 43
3.1 Objetivo Geral 43
3.2 Objetivos específicos 43
4 MATERIAIS E MÉTODOS 45
4.1 Cepas microbianas 45
4.2 Material vegetal 46
4.3 Estratégia experimental 47
4.4 Óleo essencial de folhas do quimiotipo II de L. alba (OELaII) 49
4.5 Antibióticos, Diluentes e meios de cultura 49
4.6 Obtenção das diluições do OELaII 50
4.7 Avaliação da Atividade Antimicrobiana do OELaII 51
4.7.1 Determinação da Concentração Inibitória Mínima – CIM 51
4.7.2 Determinação da Concentração Bactericida Mínima – CBM 52
4.8 Avaliação da interferência do OELaII na atividade antimicrobiana da Oxacilina e outros antibióticos de uso clínico sobre cepas de S. aureus
54
4.9 Avaliação da interferência do OELaII na atividade antimicrobiana da Oxacilina sobre cepas de S. aureus
54
4.10 Estudo do Mecanismo de Ação do OELaII sobre cepas de S. aureus 56
4.10.1 Efeito do OELaII sobre cepas de S. aureus nas fases de crescimento exponencial e estacionário
57
4.10.2 Efeito do OELaII sobre cepas de S. aureus na fase exponencial de crescimento, na presença de cloranfenicol
4.11 Efeito do tempo de exposição ao OELaII, a Oxacilina e as associações OELaII-OXA sobre cepas de S. aureus
60
4.12 Análise Estatística 63
5 RESULTADOS 65
5.1 Rendimento e composição química óleo essencial das folhas do quimiotipo II de Lippia alba N. E. Brown (quimiotipo Citral – Limoneno)
65
5.1.1 Rendimento do OELaII 65
5.1.2 Composição química do OlaII 66
5.2 Atividade Antimicrobiana 72
5.2.1 Concentração Inibitória Mínima (CIM) e Concentração Bactericida Mínima (CBM) do óleo essencial das folhas do quimiotipo II de Lippia alba e da oxacilina
72
5.3 Interferência do OELaII na atividade antimicrobiana da Oxacilina e outros antibióticos de uso clínico
78
5.4 Interferência do OELaII na atividade antimicrobiana da Oxacilina pelo Método de Checkerboard
82
5.5 Estudo do Mecanismo de Ação do OELaII 88
5.5.1 Efeito do OELaII sobre S. aureus nas fases de crescimento exponencial e de crescimento estacionário
88
5.5.2 Efeito do OELaII sobre S. aureus na fase exponencial de crescimento na presença de cloranfenicol
91
5.6 Efeito do tempo de exposição ao OELaII, a Oxacilina e as associações OELaII-OXA sobre cepas de S. aureus
94
6 DISCUSSÃO 100
7 CONCLUSÃO 112
REFERÊNCIAS 114
1 INTRODUÇÃO
Por muitos séculos, o uso de plantas medicinais era a única fonte de agentes terapêuticos para o ser humano. Baseado no conhecimento empírico da ação dos vegetais nas doenças por diferentes grupos étnicos ocorreu uma grande diversidade na utilização desses agentes. Muitas dessas plantas estão incluídas na terapêutica convencional para o tratamento de várias doenças (VIEIRA, 2005; MANTILLA, 2005).
As estimativas apontam que cerca de 80% da população mundial empregam as medicinas indígenas ou tradicionais em cuidados básicos da saúde, especificamente àquelas que fazem uso de terapias que envolvem o uso de fitoterápicos (BAGETTA et al., 2010).
O interesse popular e institucional aponta para a necessidade de investir na pesquisa e desenvolvimento de tecnologia para a produção de medicamentos a partir de espécies disponíveis exóticas ou silvestres, favorecendo a produção nacional e a implantação de programas para maior utilização dos medicamentos fitoterápicos e de seus insumos, bem como para a adoção de políticas de geração de empregos e renda, com qualificação e fixação de produtores, baseadas no incentivo à produção nacional, com a utilização da biodiversidade existente no país (MATTOS et al., 2007).
Estudos de Sousa et al. (1991), Matos (1998), Albuquerque e Andrade (1998) demonstraram que o principal uso de plantas medicinais é no tratamento das doenças respiratórias, seguido das inflamações em geral e das diversas formas de doenças intestinais. Quanto à efetividade terapêutica das plantas documentadas por esses autores, muitas já possuem informações farmacológicas que podem justificar o seu uso popular, entre elas destacam-se algumas espécies do gênero Lippia.
A espécie Lippia alba (Erva-cidreira), encontrada por toda a América tropical e subtropical, é amplamente distribuída em todo o território brasileiro, como planta espontânea em terrenos abandonados, ou cultivada em hortas medicinais. Largamente utilizada por suas propriedades digestivas, é indicada, tradicionalmente, no tratamento de hemorroidas, dor de dente, resfriados e afecções hepáticas. Testes farmacológicos realizados a partir das folhas comprovaram suas atividades analgésica, espasmolítica, antibacteriana e peitoral, sem que nenhum efeito tóxico tenha sido verificado em animais tratados com extratos da planta (CORRÊA, 1992; CARRICONDE, 1996; AGUIAR e COSTA, 2005).
Nas últimas décadas as pesquisas sobre a atividade antimicrobiana de extratos de plantas, óleos essenciais e seus componentes têm-se centralizado no campo da medicina e terapêutica, mais especificamente, óleos essenciais aromáticos, que tem apresentado bons efeitos contra bactérias, leveduras, fungos filamentosos e vírus (REICHLING et al., 2009).
Recentemente, tem sido verificado um crescente interesse em plantas medicinais como alternativa às drogas sintéticas, especialmente contra micro-organismos, devido a um aumento da resistência por patógenos associados a doenças infecciosas a drogas antimicrobianas comumente empregadas na prática clínica (TAVARES et al., 2005).
Os estudos relacionados a Etnobotânica e/ou a Etnofarmacologia são importantes para a aquisição de dados sobre as plantas medicinais, preservação do ecossistema, e procura por substâncias naturais com ação terapêutica (ALBUQUERQUE et al., 2004).
2 REVISÃO BIBLIOGRÁFICA
2.1 Lippia alba e seus quimiotipos
A espécie L. alba (Mill.) N. E. Brown pertence a família Verbenaceae. Essa família possui cerca de 175 gêneros e 2800 espécies, ocorrendo nas Américas, Central e Sul (Figura 1), habitando praticamente todas as regiões do Brasil, onde é muito empregada na medicina como analgésica, sedativa, carminativa, febrífuga, anti-inflamatória, espasmolítica, antigripal e nas afecções hepáticas (MATOS, 1996; MARTINS et al., 1995; MATOS, 2000).
É um arbusto rústico e vigoroso, perene e ramificado, de morfologia variável, com cerca de um metro e meio de altura, conhecida popularmente como erva cidreira de arbusto, erva cidreira do campo, alecrim do campo, alecrim selvagem, cidreira brava, falsa melissa, erva cidreira brasileira, cidró, cidrão e salsa limão entre outros (ZÉTOLA et al., 2002; VALE et al., 1999; MATOS et al., 1996; TAVARES et al, 2005; AGUIAR et al, 2008).
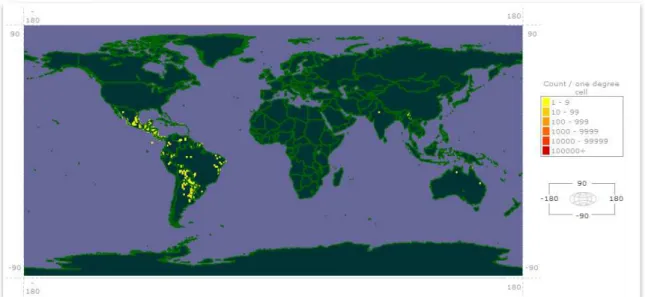
Figura 1 - Distribuição mundial da espécie Lippia alba (Mill.) N. E. Brown.
Fonte: Global Biodiversity Information Facility - GBIF (2011).
não-adocicado. O autor também caracterizou os grupos com base no odor, textura e forma das folhas, tamanho e número de flores das inflorescências. No mesmo ano, em outra publicação, caracterizou os grupos pela composição dos seus OEs: tipo I tendo como constituintes majoritários Mirceno e Citral; tipo II, Limoneno e Citral; tipo III, Limoneno e Carvona e ausência de Citral (MATOS et al., 1996b).
O estudo químico do OE de L.alba realizado por Pascual et al. (2001) e Teixeira (2009) mostrou a presença de monoterpenos (Borneol, Cânfora, 1,8-Cineol, Citronelol, Geranial, Linalol, Mirceno, Neral, Piperetona, Sabineno, 2-Undecanona) e sesquiterpenóides (a-Muroleno, b-Cariofileno, b-Cubebeno, b-Elemeno, Gcadieno, Alo-aromadendreno, Óxido de Cariofileno) na sua composição.
Em estudo realizado na Guatemala para o tratamento de doenças respiratórias, utilizando-se três cepas Gram-positivo (Staphyloccocus aureus, Streptoccocus pyogenes e S. pneumoniae), a investigação da atividade antimicrobiana da L. alba revelou que seu óleo essencial é capaz de inibir principalmente S. aureus e S. pneumoniae e moderadamente S. pyogenes (CÁCERES et al.,1991).
Alea et al. (1997) em ensaio utilizando OE extraído de várias partes de L. alba, testaram sua atividade sobre cepas Gram-positivo de interesse clínico. O OE apresentou concentração inibitória mínima na faixa de 0,3 a 0,63 mg/mL, sendo a menor CIM verificada para S.aureus, e Pseudomonas aeruginosa a única cepa resistente ao OE de L. alba.
Em estudos anteriores, nosso grupo de pesquisa constatou que entre os três quimiotipos de L. alba do Nordeste Brasileiro, o quimiotipo II produz, em suas folhas, um óleo essencial (OELaII), rico em Citral e Limoneno, como maior e mais amplo potencial antimicrobiano. Os resultados obtidos revelaram que as concentrações inibitórias e letais mínimas de OELaII para cepas de S. aureus Oxacilina-Resistente (ORSA) são iguais ou muito próximas àquela constatadas para as cepas sensíveis (TEIXEIRA, 2009).
2.2 Óleos essenciais
Os óleos essenciais (OEs) são compostos naturais complexos de substâncias voláteis, caracterizados por um forte odor sendo sintetizados por plantas aromáticas durante o metabolismo secundário e extraídos de plantas geralmente encontradas em locais quentes, como o mediterrâneo e os trópicos, onde está representada parte importante da farmacopéia tradicional (MACHADO; FERNANDES JUNIOR, 2011).
Seus constituintes incluem hidrocarbonetos terpênicos, álcoois simples, aldeídos, cetonas, fenóis, ésteres, ácidos orgânicos fixos, entre outros, presentes em diferentes concentrações (SANTURIO et al., 2007).
Os OE de plantas aromáticas são utilizados há séculos para conferir sabor a comidas e bebidas, para disfarçar odores desagradáveis, atrair outros indivíduos e controlar problemas sanitários, contribuindo também para a comunicação entre os indivíduos e influenciando o bem-estar dos seres humanos e animais, demonstrando assim uma antiga tradição sociocultural e socioeconômica da utilização destes produtos (FRANZ, 2010).
São inúmeras as propriedades farmacológicas atribuídas aos OE, algumas são preconizadas por apresentarem vantagens importantes, quando comparadas a medicamentos tradicionais, por exemplo, a volatilidade característica, os torna ideal para o uso em nebulizações, banhos de imersão ou inalações. Devido a um baixo peso molecular e volatilidade de seus constituintes, os OE são rapidamente eliminados do organismo através das vias metabólicas (BANDONI; CZEPAK, 2008).
Estudos já realizados constatam a diversidade dos efeitos biológicos apresentado pelos OE, tais como atividade antioxidante (WANNES et al., 2010), ação larvicida (RAJKUMAR et al., 2010), ações analgésica e anti-inflamatória (MENDES et al., 2010), atividade antimicrobiana (TEXEIRA, 2009), fungicida (CARMO et al., 2008) e atividade antitumoral (SILVA, 2008).
A ação antibacteriana de óleos essenciais tem sido demonstrada, através da susceptibilidade de bactérias Gram-positivo e Gram-negativo, como por exemplo, o OE de cravo da Índia para o qual foram evidenciados baixos valores de concentrações inibitórias mínimas (MACHADO; FERNANDES JUNIOR, 2011).
Em ensaios laboratoriais, o Camazuleno demonstrou uma evidente atividade antiasmática e antialérgica, e Dose Letal (DL50) de 3g/kg para ratos por via intramuscular (SAFAHYI et al., 1994; BOLDINA, 1966).
Quando administrado por via oral, o α-Bisabolol revelou baixa toxicidade em animais (cães, macacos, ratos e camundongos), com valores da DL50 de 11350 e 14850 mg/kg, para camundongos e ratos, respectivamente (SOUSA et al., 2004).
Diversas preparações farmacêuticas para tratamento de acne, herpes e outros estados inflamatórios da pele são feitas à base de bisabolol (JELLINEK, 1995; HANGAY et al., 1993).
A Mentha arvensis, popularmente conhecida como Hortelã-do-Brasil, possui em seu OE, elevados teores de Mentol (70%). Tem como atividades farmacológicas o aumento da secreção gástrica, ação local antialérgica e anti-infecciosa contra bactérias do gênero Staphylococcus e Neisseria, e leve atividade anestésica local ou antipruriginosa (MATOS, 2002).
Coutinho et al. (2008) avaliando a resistência de Escherichia coli, constatou que a M. avensis possui uma potente ação antimicrobiana, sendo considerada uma nova arma contra esses micro-organismos.
No ano seguinte, Coutinho et al. (2009), através da avaliação da ocorrência de sinergismo entre antimicrobianos convencionais (Gentamicina, Canamicina e Neomicina) em associação com Turnera ulmifolia L (Chanana), sugeriram um efeito potencializador contra cepas S. aureus Meticilina-Resistente (MRSA), constituindo uma nova arma contra o problema da resistência bacteriana.
Sousa et al. (2008) constataram ação antimicrobiana contra fungos e bactérias, principalmente nas frações contendo Tumerona e Zingibereno do extrato etanólico e OE de Zingiber officinale (Gengibre).
Vários relatos indicam diferentes ensaios de combinações entre antibióticos in vitro e aplicados à clinica, mas as combinações entre produtos naturais e medicamentos sintéticos são pouco relatados. Resultados do efeito sinérgico entre Croton zehntneri (Canela de Cunhã) e a gentamicina sugerem que os compostos voláteis presentes no OE podem suprimir o crescimento de patógenos responsáveis por infecções respiratórias, podendo ser utilizado como adjuvantes à terapia contra micro-organismos (RODRIGUES et al., 2009).
polissacarídeos servindo de barreira fisiológica contra os compostos ativos presentes no óleo essencial (MANN et al. 2000; TASSOU; NYCHAS 1995).
Espera-se que os OEs atinjam, nos micro-organismos, alvos moleculares diferentes dos antibióticos convencionais, e sejam ativos contra patógenos atualmente resistentes à terapêutica (DUARTE, 2008). Por esse motivo, os óleos essenciais assumem importante papel na prevenção ao desenvolvimento de resistência microbiana, que vem sendo causa de preocupação constante no tratamento das doenças infecciosas.
2.2.1 Óleo essencial de folhas do quimiotipo II de Lippia alba e seus constituintes majoritários, Citral e Limoneno
A Lippia alba (Mill.) N. E. Brown quimiotipo II, popularmente conhecida como cidreira-carmelitana, e cientificamente chamada de quimiotipo Citral-Limoneno, apresenta como indicações, ação calmante, anticonvulsivante e espasmolítica suave. Sendo largamente utilizada para estados de intranquilidade e nervosismo, como também bastante útil no alívio do mal estar gástrico (MATOS, 2002; MATTOS et al., 2007) (Figura 2).
Figura 2 - Quimiotipo II de L. alba N.E Brown em cultivo no Campo Experimental de Paraipaba/CE, da Embrapa Agroindústria Tropical.
Fonte: Leto Rocha (2011).
O óleo essencial obtido das folhas, frescas ou secas de L. alba, exibe um aroma agradável que muito se assemelha ao de limão, devido as grandes quantidades de Citral e Limoneno presentes na sua composição química (MATTOS et al., 2007).
Matos (1996b) identificou espécimes de L. alba com 62% de Citral e 12,06% de Limoneno em seu OE. Já Texeira (2009) encontrou 78,98% de Citral e 4,35% de Limoneno. Essas diferenças podem ser atribuídas às diferentes nas épocas de cultivo, na composição do solo, nas condições atmosféricas, entre outros fatores.
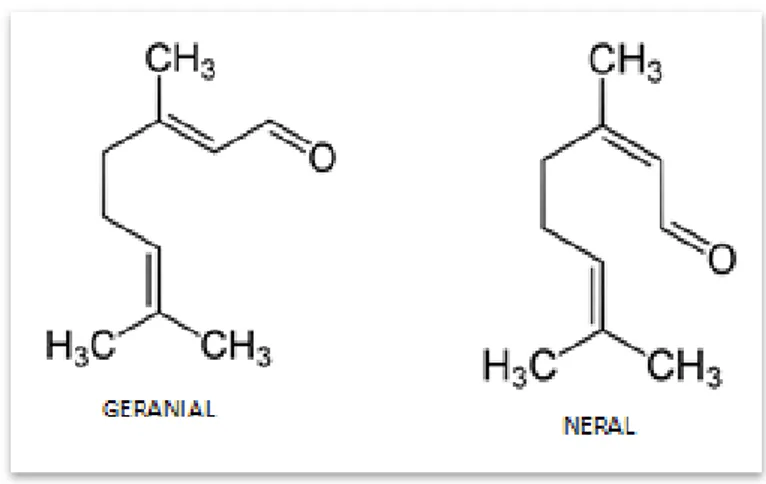
O Citral é um líquido oleoso com odor forte, composto por uma mistura de isômeros com fórmula molecular C10H16O, chamados de Geranial e Neral, Citral a e Citral b, respectivamente, (Figura 3). Apresenta atividades antitrombótica, antimicrobiana, inseticida e repelente contra insetos e é muito utilizado no tratamento da tosse em preparações farmacêuticas (SOUSA et al., 2004).
Figura 3 - Estrutura química dos isômeros Geranial (Citral a) e Neral (Citral b).
Fonte: Sousa et al. (2004).
Dentre as propriedades biológicas do Citral, popularmente conhecidas, destacam-se as atividades antimicrobiana e antifúngica. Guimarães et al. (2011) em estudo sobre a atividade fungitóxica, revelaram que o Citral apresenta maior atividade do que o óleo essencial puro.
Silva et al. (2008) verificou que o Citral possui uma potente ação, in vitro, contra fungos do gênero Candida. Saddiq e Khayyat (2010) constataram uma boa atividade do Citral contra os fungos Penicillium italicum e Rhizopus stolonifer. Observaram, também, que o epóxido-Citral apresenta uma excelente atividade sobre cepas de MRSA, sendo mais eficaz do que os antimicrobianos Ácido Nalidíxico, Ampicilina e Nitrofurantoína.
produção mundial do Limoneno foi estimada em torno de 50 mil toneladas/ano, mais de 50% do total era produzida no Brasil. Esta grande disponibilidade do Limoneno chamou a atenção de vários grupos de pesquisa, a fim de transformá-lo em derivados de maior valor econômico (THOMAS; BESSIÉRE, 1989).
No período de 2005 a 2008, o Limoneno se tornou o principal produto obtido do beneficiamento de OE no Brasil. Foram exportados cerca de 475 toneladas de Limoneno, 70% para a União Europeia. Suas principais aplicações são para produtos de limpeza e como solvente (BIZZO; REZENDE, 2009). De forma molecular C10H16, o Limoneno possui centro quiral, apresentando isomeria óptica, na forma de duas moléculas D-Limoneno e L-Limoneno, sendo a primeira mais estável, e comumente isolada (Figura 4). A IUPAC (União Internacional de Química Pura e Aplicada) preconiza como nomenclatura correta para os isômeros R-Limoneno e S-Linomeno, embora os prefixos “D” e “L” sejam mais comumente empregados (PAKIDELA, 2001).
Figura 4 - Estrutura química dos isômeros R-Limoneno e S-Limoneno
Fonte: Pakidela (2001).
Arruda et al. (2006) em estudo sobre a atividade antimicrobiana do óleo essencial do Mentha x villosa Huds (hortelã da folha miúda) constatou que o Limoneno apresenta potencial antimicrobiano semelhante ao OE sobre cepas Gram-positivo.
Schuck et al. (2001) constataram a atividade antimicrobiana do óleo essencial de Cymbopogon citratus (D.C.) Stapf. (capim-limão), assim como de seus constituintes Citral e Limoneno, sobre cepas de Staphylococcus aureus, Escherichia coli e Candida albicans. O Citral quando comparado ao Limoneno apresentou melhor atividade antimicrobiana e, a maior atividade do Limoneno foi constatada para a levedura C. albicans, determinando halos de inibição entre 17 e 21 mm.
Desta forma, justifica-se a busca e o uso substâncias e terapias alternativas, possibilitando a inclusão de produtos naturais como, por exemplo, os óleos essenciais e seus constituintes, em alternativa a terapêutica convencional como agentes com potencial antimicrobiano contra doenças infecciosas (SILVA et al., 2008).
2.3 Antimicrobianos: A ameaça da Resistência bacteriana
Alexandre Fleming, médico, bacteriologista, foi o primeiro a utilizar vacinas como terapia para doenças. No início de sua vida médica, tornou-se interessado pela ação natural de bactérias no sangue e por antissépticos. Ao longo da carreira investigou substâncias antibacterianas que não fossem tóxicas para os tecidos animais. Em 1921, ele descobriu (em tecidos e secreções) uma substância importante bacteriolítica que ele chamou de lisozima. Sete anos mais tarde, enquanto desenvolvia pesquisas utilizando estafilococos, Fleming tirou férias e acidentalmente esqueceu placas de cultura sobre a mesa. Ao retornar as atividades ele observou que as placas esquecidas estavam contaminadas com mofo, e que curiosamente na placa de cultura de Staphylococcus havia um círculo bem delimitado livre de bactérias. Inspirado e curioso, Fleming observou que mesmo diluída em 800 vezes, a substância inibitória continuava impedindo o crescimento bacteriano. Nomeou, então, a substância de Penicilina, por ser produzida por um fungo pertencente ao gênero Penicillium (NOBEL LECTURES, 1964; RESENDE, 2005) .
Figura 5 - Estrutura química da Penicilina. Primeiro antimicrobiano descoberto proveniente de um fungo pertencente ao gênero Penicillium, em 1928.
Fonte: Nobel Lectures (1964).
Durante muitos anos a Penicilina foi usada como antimicrobiano de primeira escolha para infecções contra micro-organismos Gram-positivo. Porém, o uso indiscriminado de antimicrobianos, provocou a partir da década de 70, um processo de aceleração do aparecimento e seleção de cepas bacterianas resistentes aos antimicrobianos, especialmente em ambientes hospitalares (LINARES-RODRIGUES et al., 2005; WAGENLEHNER et al., 2005).
As penicilinas naturais (Penicilina G e Penicilina V) são inativadas por enzimas
bacterianas, denominadas β-lactamases. Cerca 100% das linhagens de Staphylococcus aureus e aproximadamente 80% das outras linhagens de Staphylococcus são produtoras de β -lactamases. A maioria dos bacilos Gram-negativo, principalmente os anaeróbicos, são naturalmente resistentes à Penicilina G, com exceção do gênero Pasteurella (ANDRADE, 2002).
A resistência bacteriana aos antimicrobianos é um tema amplamente pesquisado por diversos autores devido à grande importância desta condição para a saúde. À medida que os antimicrobianos vão sendo utilizados indiscriminadamente, aumenta também o número de bactérias resistentes às drogas mais utilizadas na terapia humana (FRANCO et al., 2010).
uma determinada espécie bacteriana. A resistência adquirida é aquela que surge em uma bactéria, primitivamente sensível ao mesmo antimicrobiano, devido a mutações ou por meio de transferências do material genético, pelos mecanismos de transdução, transformação e conjugação (TORTORA 2003, KONEMAN et al., 2001, TAVARES 2001).
Através de vários mecanismos de resistência o micro-organismo pode resistir total ou parcialmente à ação de um ou mais antimicrobianos pertencentes a mesma ou a diferentes classes terapêuticas (OTAIZA, 2002). Dessa forma é preocupante o atual quadro de resistência dos micro-organismos aos atuais antibióticos, por isso surge a importância de formas terapêuticas alternativas para combatê-los.
2.3.1 Oxacilina e Staphylococcus aureus Oxacilina-Resistente (ORSA)
A bactéria Gram-positivo Staphylococcus aureus é um importante patógeno causador de infecções adquiridas na comunidade e em ambiente hospitalar. É um dos agentes mais comumente isolados em infecções da corrente sanguínea, infecções da pele e tecidos moles e em casos de pneumonia (NABER et al., 2009). Sempre esteve presente na história das infecções e foi capaz de desenvolver rapidamente resistência aos antibióticos. Nos anos 40, logo após o surgimento das penicilinas, já foram identificados estafilococos capazes de produzir penicilinases (FILE, 2000).
Com o isolamento do ácido 6-aminopenicilânico (6-APA) a real produção de penicilinas semissintéticas aconteceu. Modificações feitas na cadeia da penicilina resultaram em proteção do anel beta-lactâmico resistente a ação hidrolítica das β-lactamases. Os primeiros desses agentes antimicrobianos disponíveis para uso clínico foram a Meticilina e a Oxacilina, que solucionaram temporariamente o problema causado pela resistência do S. aureus à Penicilina (MIMICA; MENDES, 2007).
Figura 6 - Estrutura química da Oxacilina.
Fonte: MERC INDEX (2006).
A partir da década de 60, o uso frequente das penicilinas penicilinase-estáveis, como a Meticilina e a Oxacilina, no tratamento das infecções estafilocócicas, favoreceu o surgimento de cepas resistentes a estes antimicrobianos, denominadas Staphylococcus aureus Resistente à Oxacilina/Meticilina (Oxacillin-Resistant Staphylococcus aureus – ORSA/Methicillin-Resistant Staphylococcus aureus - MRSA) (Hiramatsu et al., 2002). Cepas de S. aureus foram capazes de desenvolver rapidamente resistência a esses antibióticos devido à presença do gene mecA (MARK et al., 2002; ROHRER et al., 2003).
As cepas ORSA/MRSA geralmente apresentam resistência estendida a todos os
antimicrobianos βlactâmicos e foram primeiramente reconhecidos como patógenos
hospitalares. Entretanto, nos últimos anos, eles emergiram em infecções comunitárias (SOUSA et al., 2011). Em dez anos as infecções por ORSA passaram de estritamente nosocomial, e da situação de um dos patógenos mais importantes em infecções hospitalares, a de adquirido na comunidade, potencialmente emergente e apresentando frequência crescente de isolados (ROSSI e PICOLI, 2007).
A resistência a múltiplas classes de antimicrobianos tem sido uma característica das cepas de ORSA/MRSA hospitalares, o que pode levar a falha terapêutica em virtude da dificuldade de se encontrar a antibioticoterapia ideal (MIMICA et al., 2007; CUEVAS et al., 2004; KAISER et al., 2010).
tratamentos causados por ORSA, embora cepas resistentes a Vancomicina já tenham sido isoladas (WEBWE et al., 2000). Outros fatores a ser considerado são a pouca difusão da Vancomicina nos tecidos, sua toxicidade e sua atividade bactericida moderada, limitando o sucesso da terapia (BRUMIFITT; HAMILTON-MILLER, 1989).
Considerando esses fatos, Baquero e Blázquez (1997) alertam sobre o perigo da ocorrência de um retorno à era pré-antibiótico, particularmente porque nenhuma nova classe de antibiótico foi descoberta nos últimos anos, apesar da realização intensa de pesquisas nas indústrias farmacêuticas, centros de pesquisas e Universidades.
A busca por novos compostos bioativos provenientes de produtos naturais tem sido considerada uma forma bastante promissora no combate à bactérias causadoras de infecções, principalmente daquelas em que o uso indiscriminado de antibióticos contribuiu para a seleção de cepas resistentes à terapêutica convencional (CARVALHO et al., 2010).
2.4 Mecanismo de ação antimicrobiana de plantas medicinais
Diante de um interesse crescente em torno de fitomedicamentos, justificado pelas inúmeras vantagens, quando comparados aos fármacos sintéticos utilizados na terapêutica convencional, possuem menor incidência de efeitos colaterais e adversos, toxicidade relativa diminuída, baixo custo, tudo isso aliados a enorme biodiversidade brasileira. O uso de plantas pode ser uma alternativa para a substituição de antissépticos e desinfetantes sintéticos convencionais, visando evitar o desenvolvimento de resistência bacteriana a esses compostos, já que metabólitos vegetais podem atuar por variados tipos de mecanismos (SOUSA et al., 2007; SANTOS et al., 2006).
Muitos óleos essenciais são conhecidos por exercer atividade antimicrobiana, mas seus mecanismos de ação não são totalmente compreendidos.
Considerando o grande número de diferentes substâncias presentes em óleos essenciais, provavelmente a sua atividade não é atribuída a um mecanismo de ação específico, mas por diversas ações sobre a estrutura dos micro-organismos (TRAJANO, 2008).
Uma característica importante dos óleos essenciais e de seus constituintes é a sua hidrofobicidade, o que lhes permite partição nos lipídios da membrana celular das bactérias e mitocôndrias desarranjando as estruturas, tornando-os mais permeáveis (LEE et al., 2007 apud ALVIANO, D. S.; ALVIANO, C. S., 2009).
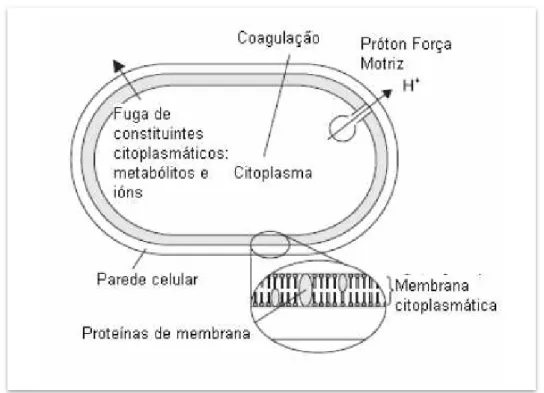
moleculares dessas substâncias na célula bacteriana (Figura 7). Uma característica importante observada nos OEs é a hidrofobicidade, que promove uma partição nos lipídeos de membrana tornando-a mais permeável, ocorrendo então extravasamento do conteúdo celular e juntamente com íons, embora em alguns casos não aja a perda da viabilidade celular. Outra questão levantada é a quantidade de compostos fenólicos presentes na composição do OE, que causa uma perturbação na membrana interrompendo a força motriz de prótons, o fluxo de elétrons, o transporte ativo e ocorrendo a coagulação do conteúdo celular. Os OEs também parecem agir nas proteínas de membrana, enzimas como as ATPases cercadas por moléculas lipídicas sugerem mais dois possíveis mecanismos: os hidrocarbonetos cíclicos, lipofílicos, poderiam acumular-se na bicamada lipídica, distorcendo a interação lipídeo-proteína, a outra hipótese seria a da interação direta dos compostos lipofílicos com as partes hidrofóbicas das proteínas.
Em estudos anteriores foi verificado que a presença de óleos essenciais interfere também com o mecanismo de reparo necessário para a divisão celular dos micro-organismos, atuando sobre a sua membrana, promovendo, assim, a sua ruptura (FARIAS; LIMA, 2000). O mecanismo de ação antimicrobiana do óleo essencial de Melaleuca alternifolia foi parcialmente elucidado por Carson et al. (2006), ao constatar a lise e perda da integridade da membrana, devido a saída de íons e inibição da respiração.
Figura 7 - Sítios e mecanismos de ação dos OE na célula bacteriana.
Fonte: Burt (2004)
2.5 Associações de Óleos essenciais a agentes Antimicrobianos
O uso de combinações de agentes antimicrobianos é extensivamente utilizado na terapia de doenças infecciosas, como por exemplo, no tratamento da tuberculose e hanseníase, especialmente para evitar a seleção de cepas resistentes. Além do efeito sinérgico alcançado pela utilização de combinações de dois ou mais compostos no tratamento de doenças infecciosas, essa prática geralmente é superior à utilização de um único composto, por evitar ou impedir o surgimento de cepas resistentes, e diminuir a toxicidade relacionada à dose utilizada, já que possibilita o uso de dosagens reduzidas, e por alcançar um amplo espectro de ação (ELIOPOULOS; MOELLERING, 1991).
O efeito da combinação de agentes antimicrobianos, também foi estudado por Gallucci et al. (2006). Utilizando terpenos comuns, presentes em óleos essenciais, como Carvona, Carvacrol, Timol, Eugenol e Mirceno, em associação com Penicilina, testaram seus efeitos sobre MRSA e E. coli. Para a cepa MRSA verificaram sinergismo apenas para Carvona-Penicilina e antagonismo para Timol-Carvona-Penicilina. Em relação a E. coli, os autores relataram a ocorrência de sinergismo para Eugenol-Penicilina e Timol-Penicilina, e antagonismo para Mirceno-Penicilina. Em Conclusão, os autores relatam que este tipo de combinação entre terpenos e antibióticos apresenta um aspecto promissor para uso no tratamento desses agentes infecciosos (GALLUCCI et al., 2006).
O uso de associações de antibióticos com produtos de plantas medicinais, com ação sinérgica sobre linhagens microbiana resistentes, pode ser uma nova estratégia para o tratamento de infecções, possibilitando o uso de agentes antimicrobianos ineficazes quando utilizados isoladamente.
3 OBJETIVOS
3.1 Objetivo Geral
Avaliar o mecanismo de ação do óleo essencial de folhas do quimiotipo II de Lippia alba (MILL.) N.E. BROWN (OELaII) e sua interferência na atividade da oxacilina sobre Staphylococcus aureus oxacilina-resistente.
3.2 Objetivos específicos
o Determinar a Concentração Inibitória Mínima (CIM) e Concentração Bactericida Mínima (CBM), in vitro, do OELaII e da Oxacilina (OXA) sobre cepas-padrão de S. aureus (cepas ATCC e CCBH) sensíveis e resistentes a oxacilina (OSSA e ORSA);
o Determinar a Concentração Inibitória Mínima (CIM) e Concentração Bactericida Mínima (CBM), in vitro, do OELaII e da OXA sobre cepas OSSA e ORSA isoladas de espécimes clínicos;
o Avaliar da interferência do OELaII na atividade antimicrobiana da OXA e de outros antibióticos de uso clínico sobre cepas-padrão de S. aureus ATCC e CCBH (cepas OSSA e ORSA) e isoladas de espécimes clínicos (cepas ORSA e OSSA);
o Determinar o mecanismo de ação do OELaII na inibição/morte de cepas-padrão ATCC e CCBH (ORSA e OSSA) nas fases de crescimento exponencial e estacionário;
o Determinar o mecanismo de ação do OELaII na inibição/morte de cepas-padrão ATCC e CCBH (ORSA e OSSA) nas fases de crescimento exponencial, na presença de cloranfenicol;
4 MATERIAIS E MÉTODOS
4.1 Cepas microbianas
As cepas de S. aureus utilizadas foram cepas-padrão (cepas ATCC e CCBH) e cepas anteriormente isoladas de espécimes clínicos em ambiente hospitalar (Tabela 1). Todas as cepas foram submetidas a coloração de Gram, provas bioquímicas e teste de sensibilidade a antimicrobianos para confirmação de identificação, e os procedimentos experimentais foram realizados no Laboratório de Pesquisa em Microbiologia Aplicada (LabMicro) (DACT-FFOE-UFC).
Tabela 1 - Relação de cepas de Staphylococcus aureus descritas quanto a origem e perfil de sensibilidade à Oxacilina
Cepa Origem Resistência/sensibilidade a
Oxacilina
Cepas-padrão
S. aureus ATCC 6538P Fiocruz OSSA
S.aureus ATCC 14458 Fiocruz OSSA
S. aureus ATCC 33591 Fiocruz ORSA
S. aureus CCBH 5330 Fiocruz ORSA
Isolados clínicos
Sa-LM01 HUWC ORSA
Sa-LM02 HUWC ORSA
Sa-LM03 HUWC OSSA
Sa-LM04 HUWC ORSA
ORSA: Staphylococcus aureus oxacilina-resistente OSSA: Staphylococcus aureus oxacilina-sensível Fiocruz: Fundação Osvaldo Cruz
4.2 Material vegetal
As amostras de folhas do quimiotipo II de Lippia alba (MILL.) N.E.Brown (Verbenaceae) foram obtidas de plantas matrizes do Campo Experimental de Paraipaba da Embrapa Agroindústria Tropical (Figura 8) e uma amostra da espécie foi depositada no herbário da Embrapa Recursos Genéticos e Biotecnologia com o número de tombo CEN 73.791.
Figura 8 - Espécimes de L. alba cultivados no Campo Experimental de Paraipaba, da Embrapa Agroindústria Tropical
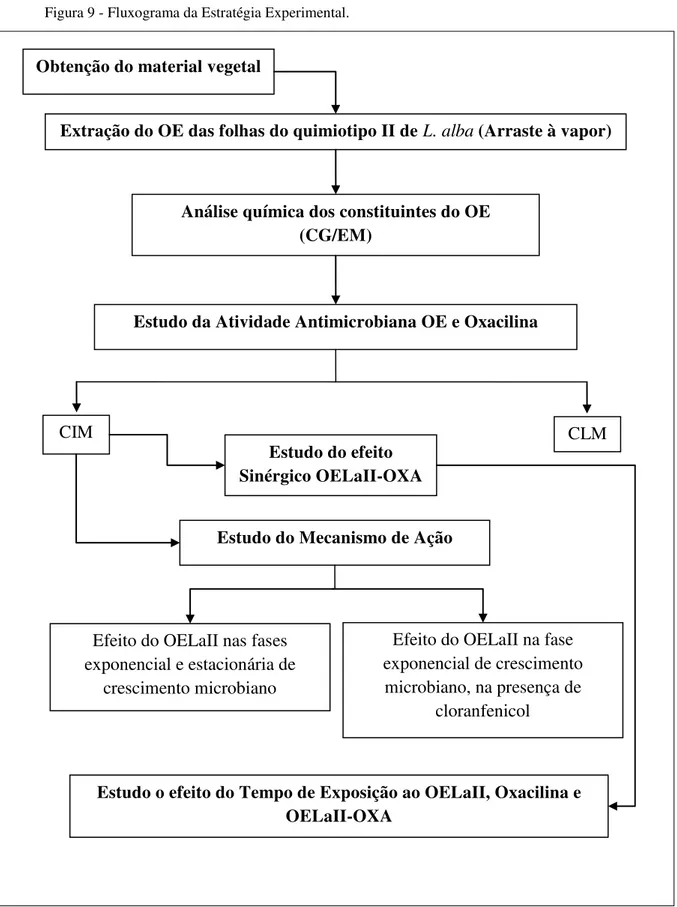
4.3 Estratégia experimental
Para a realização desse trabalho, inicialmente foram determinadas as CIM e CBM de OELaII e de OXA para as cepas de OSSA e ORSA, estudadas. Após a obtenção dessas concentrações, foram formuladas combinações OELaII-OXA para a avaliação do sinergismo, pelo método de Chekerboard e pelo método de Kirby-Bauer, 1966), modificado, e do efeito do tempo de exposição ao OELaII, a OXA e as combinações OELaII-OXA sobre inibição/morte microbiana.
Para determinar o mecanismo de ação do OELaII sobre S. aureus foi avaliada a ação do OELaII sobre cepas-padrão de S. aureus nas fases de crescimento exponencial e estacionária e na fase de crescimento exponencial na presença de cloranfenicol.
Figura 9 - Fluxograma da Estratégia Experimental.
Fonte: O Autor (2012)
Estudo da Atividade Antimicrobiana OE e Oxacilina
Estudo do Mecanismo de Ação
Estudo o efeito do Tempo de Exposição ao OELaII, Oxacilina e OELaII-OXA
Estudo do efeito Sinérgico OELaII-OXA
CLM CIM
Efeito do OELaII nas fases exponencial e estacionária de
crescimento microbiano
Efeito do OELaII na fase exponencial de crescimento
microbiano, na presença de cloranfenicol
Obtenção do material vegetal
Extração do OE das folhas do quimiotipo II de L. alba (Arraste à vapor)
4.4 Óleo essencial de folhas do quimiotipo II de L. alba (OELaII)
OELaII foi extraído de folhas frescas utilizado o método de destilação por arraste a
vapor d’água em aparelho tipo Clevenger (CRAVEIRO et al., 1976). O tempo médio de extração foi de aproximadamente 2 horas. Em seguida o OE passou por um processo de retirada da água residual com sulfato de sódio (Na2SO4) anidro e transferido para frascos de vidro âmbar com tampa rosqueada e armazenado a 2°C até o momento da análise. Seu rendimento foi calculado e expresso em g/g % de peso fresco.
A análise dos constituintes do OELaII foi realizada no Parque de Desenvolvimento Tecnológico do Ceará (PADETEC - UFC), através do método de cromatografia gasosa acoplada à espectrometria de massa (CG/EM), em aparelho da Hewlett-Packard 5971, nas seguintes condições: coluna capilar de DB-1 (dimetil-polisiloxane) com 30 m de comprimento e 0,25 mm de diâmetro interno; gás de arraste: Hélio (1 mL/min); programa: 50-180°C a 4°C/min e, depois, 180-280°C a 20°C/min; temperatura do injetor: 220°C; modo de injeção: 0,1 µL (solução 10%), split 1:20, 500 ng na coluna. Os espectros de massas foram produzidos por impacto eletrônico (70 eV) e comparados com os padrões existentes no computador no aparelho. Em seguida, foram feitas comparações visuais com espectros de massa de substâncias encontrados na literatura. Os tempos de retenção dos picos maiores, mais facilmente identificados pelo espectro de massa, foram comparados com os tempos de retenção destas substâncias registradas em catálogos, observando-se a diferença que se manteve aproximadamente constante para as demais substâncias identificadas pelo computador (ADAMS, 2001 apud MORAIS et al., 2006).
4.5 Antibióticos, Diluentes e meios de cultura
Os sais de Oxacilina e Cloranfenicol foram adquiridos da Sigma-Aldrich Co. LLC. (St Louis, MO, USA) e o Tween 80 a 1% (Polisorbato 80), utilizado em todos os experimentos realizados como diluente do OELAII, foi adquirido da Inlab – Interlab Distribuidora de Produtos Científicos S.A. (São Paulo, SP).
Clindamicina 2µg (CLI02) obtidos da DME – Diagnósticos Microbiológicos Especializados (Araçatuba, SP).
Os meios de cultura utilizados (Agar Mueller-Hunton, Agar Sabouraud dextrose, Agar Plate-count, Caldo Infusão de Cérebro e Coração) foram adquiridos da Merck
4.6 Obtenção das diluições do OELaII
As diluições seriadas foram obtidas a partir de uma solução mãe de OELaII partindo de 200 mg/mL, obtida pesando-se 200 mg de OE e adicionado em solução de Tween 80 a 1% em água destilada estéril (Figura 10).
Figura 10 - Obtenção de diluições seriadas de OELaII (1.Solução mãe -200 mg/mL até diluição 1/2048, correspondendo a 0,0976 mg/mL).
4.7 Avaliação da Atividade Antimicrobiana do OELaII
Para os ensaios para a determinação da atividade antimicrobiana foram utilizadas as cepas ORSA e OSSA (Tabela 1) descritas no item 4.1., todos os ensaios foram realizados em triplicata.
4.7.1 Determinação da Concentração Inibitória Mínima – CIM
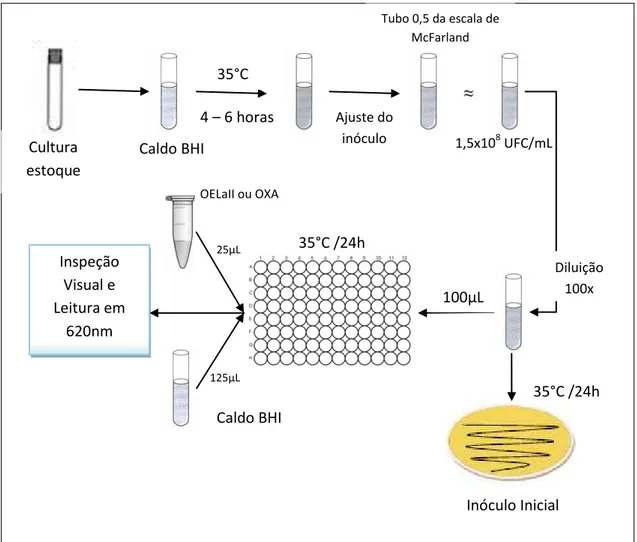
Os valores de CIM de OELaII e da Oxacilina para as cepas de S. aureus testadas foram determinados pelo método de microdiluição em caldo de cultura como descrito na Norma M7-A6, Vol. 23 N°2, peloClinicalandLaboratory Standards Institute - CLSI (antigo NCCLS 2003), utilizando-se, para isso, placas de cultura com 96 poços de fundo redondo, estéreis e com tampas apropriadas.
Culturas microbianas puras mantidas em ágar estoque sob refrigeração, foram repicadas para caldo Infusão de Cérebro e Coração (Caldo BHI) e incubadas a 35ºC até atingirem o início da fase exponencial de crescimento (16-18h). Após esse período, as culturas tiveram sua densidade celular ajustada em solução salina 0,85% estéril, de modo a se obter uma turvação visível equivalente à do tubo 0,5 da escala de McFarland, o que corresponde a uma suspensão microbiana contendo aproximadamente 1,5 x 108 UFC/mL.
A suspensão obtida foi diluída 100 vezes, em solução salina 0,85% estéril, em condições assépticas, resultando em uma cultura com aproximadamente 106 UFC/mL. Alíquotas 100µL dessa suspensão foram retiradas e adicionadas a cada poço da placa, já preenchidos com 125µL de caldo BHI. Em seguida, alíquotas de 25µL de OELaII (concentração final de 20 a 0,00976 mg/mL) ou de OXA (concentração final de 800 a 0,390 µg/mL para as cepas ORSA e de 200 a 0,0976 µg/mL para as cepas OSSA) foram adicionadas, totalizando um volume final de 250µL por poço.
Tween 80 1% foi usado na obtenção das soluções de OELaII e como controle de experimento. A determinação da população microbiana presente no inóculo inicial foi realizada por contagem em Ágar Plate-Count e utilizada para determinação da CBM.
As placas de culturas, fechadas por tampas apropriadas, foram incubadas durante 24 horas em estufa bacteriológica a 35ºC. Após esse período foi realizada a inspeção visual do crescimento microbiano e a leitura das absorbâncias em leitora de Elisa Bio-Tek a 620nm.
visual do crescimento microbiano (Figura 11). As placas de cultura foram submetidas à leitura de absorbância a 620nm para confirmação dos valores de CIM, assim como para excluir a interferência da turvação determinada pela presença do OE.
Figura 11 - Esquema para a determinação da Concentração Inibitória Mínima (CIM).
Fonte: O autor (2012).
4.7.2 Determinação da Concentração Bactericida Mínima – CBM
A determinação da CBM foi realizada de acordo com a metodologia descrita por Baron, Peterson e Finegold (1994). Para isso, alíquotas de 50 μL e 10 μL obtidas, de forma
asséptica, dos poços que não apresentaram turvação visível na determinação da CIM, foram semeadas, com auxilio de alças bacteriológicas calibradas, pelo método de espalhamento em estrias, na superfície no Ágar Plate-Count. Após incubação durante 24 horas a 35°C foi realizada a contagem das colônias crescidas sobre a superfície do meio sólido (Figura 12). A
35°C /24h
OELaII ou OXA
1,5x108 UFC/mL Tubo 0,5 da escala de
McFarland
125µL 25µL
Cultura estoque
Caldo BHI 35°C
4 – 6 horas Ajuste do inóculo
Diluição 100x
100µL
Caldo BHI Inspeção
Visual e Leitura em
620nm
35°C /24h
CBM foi considerada a menor concentração de OELaII ou OXA capaz de determinar uma redução no crescimento microbiano superior a 99,9% do inóculo inicial.
Figura 12 - Esquema para a determinação da Concentração Bactericida Mínima (CBM).
Fonte: o autor (2012).
Plaqueamento em Agar Plate-CIM
35°C/24
LEITURA E INTERPRETAÇÃO DOS RESULTADOS
50 e 10µL