ESTUDO DO ENVOLVIMENTO DOS RECEPTORES DA
ADENOSINA SOBRE A AÇÃO CARDIOPROTETORA DA
ESPIRONOLACTONA E EPLERENONA EM
CARDIOMIÓCITOS DE RATO
ESTUDO DO ENVOLVIMENTO DOS RECEPTORES DA ADENOSINA
SOBRE A AÇÃO CARDIOPROTETORA DA ESPIRONOLACTONA E
EPLERENONA EM CARDIOMIÓCITOS DE RATO
Orientador: Prof. Dr. Mauro César Isoldi
Ouro Preto – MG 2016
Dedico este trabalho aos meus pais Agenor e Iolanda,
à minha irmã Aline e ao Gustavo pelo amor e apoio
durante essa caminhada. Dedico também à Milla pela
Agradeço primeiramente a Deus pelo dom da vida e pelas bênçãos concedidas.
À minha família, em especial ao meu pai Agenor por me proporcionar incondicional apoio, orientação e incentivo para realizar meus sonhos, sempre com sabedoria e pés no chão. À minha mãe Iolanda, minha irmã Aline pelo apoio nas horas difíceis e por compartilhar as alegrias nas vitórias.
Agradeço de forma muito especial ao Gustavo que, mesmo de longe, desde o início dessa caminhada me apoiou em cada situação adversa, me dando seus sábios conselhos, ombro amigo sempre disponível, carinho e amor que foram imprescindíveis para conseguir continuar a caminhar. Sua paciência e apoio foram fundamentais para chegar ao fim dessa trajetória. Muito obrigada amor!
Agradeço a meu orientador Prof. Dr. Mauro César Isoldi pela oportunidade de iniciar no trabalho científico. Com sua filosofia de trabalho aprendi e cresci muito nesses anos de laboratório. Meu imenso obrigada à Milla, minha “mãe” na ciência. Milla, foi um prazer trabalhar com você! Passamos muitos apertos juntas, mas com certeza aprendemos e amadurecemos muito! Serei sempre grata por sua disponibilidade para ajudar, ensinar, fazer companhia que seja. Você é um exemplo de dedicação e amizade e sentirei sua falta. Obrigada por tudo!
Obrigada a toda equipe do Laboratório de Hipertensão pelos ensinamentos, ajuda sempre disponíveis e pela boa companhia. Durante meus 6 anos de LH, o laboratório foi uma segunda casa para mim e vocês, definitivamente colaboraram para isso tornando meus dias muito mais agradáveis.
muito especial à professora Dra. Silvana de Queiroz Silva, demais professores e equipe do
Laboratório de Biologia e Tecnologia de Microrganismos (LBTM) da UFOP pelo apoio e empréstimos realizados. Me sinto praticamente parte dessa equipe! Muito obrigada!
Agradeço aos professores do NUPEB que de alguma forma contribuíram para a realização deste trabalho tirando dúvidas, dando conselhos ou até mesmo emprestando algum material necessário para a execução dos experimentos. Agradeço ainda ao Centro de Ciência Animal da UFOP, em especial à Lorena, pelo cuidado correto para com os animais, proporcionando um bom trabalho.
À FAPEMIG e ao CNPq pelo apoio financeiro, e à Fundação Gorceix, em especial à
Aline que tanto ajudou durante o processo de aquisição de materiais e controle dos gastos do projeto, muito obrigada.
Agradeço também à Ana Cláudia, Karininha, Jéssica, Renatinha, Laila e Brab que, nesses últimos 2 anos, em momentos diferentes, foram mais do que colegas de república e sim amigas e companheiras para todas as horas. Com vocês dividi minhas lutas, vitórias, alegrias e tristezas. Vocês são muito importantes pra mim!
Meu sincero obrigada ao “PIVICantina” pelos momentos descontraídos, sempre com discussões de alto nível, apesar de bem mais raros que na época da graduação. Ao nosso professor orientador Dr. Fábio, à Ana Maria Sampaio Rocha, eterna Miss Mariana, Brab, Léozinho,
Felipe, Nalaura, Silêncio e Bruninha à distância. Ter vocês como amigos é uma honra. Passamos muitos momentos sensacionais juntos e, com certeza vocês serão o maior motivo de saudade que já sinto em não estar mais em Ouro Preto. Amocês demais da conta!!!
Brab, te agradeço de forma especial, pois, além da parceria (sempre certa e eficaz) nos trabalhos desde os tempos da graduação, enfrentamos o desafio do mestrado juntas. Você se tornou uma grande amiga e, convivendo com você no dia-a-dia aprendi que a vida é muito mais do que fazemos dentro da universidade. Obrigada por me ouvir nos momentos difíceis, por sua sinceridade nas opiniões e sincera disposição a ajudar sempre, enfim, pelo companheirismo que foi mais importante para mim do que possa imaginar. Muito obrigada!
Fármacos com esse perfil costumam mimetizar a ação da adenosina, que pode interagir com cardiomiócitos através de quatro receptores (A1R, A2AR, A2BR e A3R). Nosso objetivo foi testar
a ação de dois conhecidos cardioprotetores, os antagonistas do receptor MR espironolactona e eplerenona, assim como da adenosina e seus antagonistas como controle. Culturas primárias de cardiomiócitos de ratos neonatos da linhagem Wistar foram utilizadas em ensaios onde foram simuladas as condições de pré- e pós-condicionamentos isquêmicos. Nossos resultados demonstraram que, por meio de análise de viabilidade celular por MTT, os danos sofridos pelos cardiomiócitos, impostos pela isquemia, foram igualmente revertidos por espironolactona, eplerenona e pela adenosina. Entretanto, ao associa-los a antagonistas dos receptores da adenosina A1R, e A3R no pré-condicionamento e A2AR e A2BR no pós-condicionamento, não
houve diferença significativa na proteção das células em condições isquêmicas. Ao dosar a adenosina por espectrometria de massas nas amostras de cardiomiócitos submetidos a isquemia, observamos adenosina detectada e mostramos, pela primeira vez, que houve aumento na concentração de adenosina nas células tratadas com espironolactona no pré-condicionamento e no tratamento com eplerenona no pós-condicionamento farmacológico. As amostras do grupo normóxia, no entanto, não apresentaram adenosina detectada. A análise conjunta dos nossos resultados comprova o efeito protetor da espironolactona, eplerenona e adenosina em condições de isquemia, além disso, na presença desses antagonistas do MR houve uma maior disponibilidade de adenosina, agente associado a todo um quadro direto e indireto de proteção cardíaca em estados de isquemia. Esses resultados nos levam a crer que há mediação entre a ação da espironolactona e eplerenona com a adenosina, contudo parece ocorrer por outro mecanismo
que não via ligação aos receptores da adenosina. Adicionalmente, nossos resultados são
consequentes de uma análise aguda, feita 18 horas após os tratamentos, podendo não ter sido tempo suficiente para observar os resultados consequentes dessa possível mediação de ação entre receptores da adenosina e espironolactona e eplerenona.
Adenosine as well as eplerenone and spironolactone display cardioprotective effects. Drugs with this profile tend to mimic the actions of adenosine, which interact with cardiomyocytes via four receptors (A1R, A2ARs, A2BR and A3R). Primary neonatal rat cardiomyocyte cultures from
Wistar rat were used in trials where the conditions of pre- and postischemic conditioning was simulated. Our aim was test the cardioprotective effect of two known MR antagonists, spironolactone and eplerenone, as well as adenosine and its antagonist as a control. Per cell viability analysis by MTT, our results demonstrated that the damage sustained by cardiomyocytes, imposed by ischemia, were equally reversed by spironolactone, eplerenone and by adenosine. However, by associating them to A1R and A3R antagonists at preconditioning and
A2ARs and A2BR at postconditioning, there was no significant difference in protecting cells in
ischemic conditions. Adenosine was dosed by mass spectrometry in the samples of cardiomyocytes underwent ischemia, where adenosine was detected and, for the first time, we show there was an increase of the concentration of adenosine in cells treated with spironolactone at preconditioning and posttreatment with eplerenone as pharmacological postconditioning. However, samples of normoxia group showed no detected adenosine. The analysis of our results demonstrates the protective effect of spironolactone, eplerenone and adenosine in ischemic conditions. In addition, the presence of these MR antagonists there was a greater availability of adenosine, agent associated directly and indirectly with protection to the heart ischemic. These results lead us to believe that there is a mediation between the action of spironolactone and eplerenone with adenosine however it seems to occur by other mechanism than via binding to adenosine receptors. In addition, our results are consequent of an acute analysis made 18 hours after treatment and may not have been enough time to observe the consequent results of possible mediation action of adenosine receptors and spironolactone and eplerenone.
Figura 1: Fotos de dois corações de porcos submetidos ao infarto evidenciando a área infartada
em cor mais clara (coloração trifenil tetrazólio). ... 20
Figura 2: Esquema ilustrativo dos ciclos de isquemia-reperfusão do pré-condicionamento isquêmico. ... 21
Figura 3: Esquema da ativação da via RISK induzida por receptor opióide. ... 22
Figura 4: Esquema ilustrativo dos ciclos de isquemia-reperfusão do pós-condicionamento isquêmico. ... 23
Figura 5: Vias de sinalização desencadeadas no pré- e pós-condicionamento isquêmico. ... 24
Figura 6: Esquema resumindo as vias de sinalização envolvidas no condicionamento isquêmico ... 25
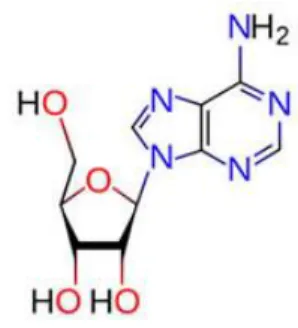
Figura 7: Estrutura química da adenosina. ... 26
Figura 8: Esquema ilustrativo das vias de produção e degradação da adenosina. ... 27
Figura 9: Vias de sinalização envolvidas na ativação dos receptores de adenosina. ... 28
Figura 10: Fórmulas estruturais dos antagonistas do receptor mineralocorticóide da aldosterona. ... 30
Figura 11: Cromatograma e espectro de massas obtidos da amostra “espironolactona” do pré-condicionamento. ... 47
Figura 12: Cromatograma e espectro de massas obtidos da amostra “controle” do pré-condicionamento. ... 48
Figura 13: Cromatograma e espectro de massas obtidos da amostra “controle” do pós-condicionamento. ... 48
Gráfico 1: Análise do dano isquêmico mediante exposição dos cardiomiócitos a condições de isquemia ... 46
Gráfico 2: Análise da ação da espironolactona, eplerenona e adenosina no pré-condicionamento e no pós-condicionamento farmacológico ... 50
Gráfico 3: Análise da ação dos antagonistas dos receptores A1Re A3R da adenosina no
pré-condicionamento farmacológico ... 51
Gráfico 4: Análise da ação dos antagonistas dos receptores A2ARe A2BR da adenosina no
pós-condicionamento farmacológico ... 51
Gráfico 5: Análise da ação dos antagonistas dos receptores A1Re A3R da adenosina associados
à espironolactona no pré-condicionamento farmacológico ... 52
Gráfico 6: Análise da ação dos antagonistas dos receptores A2ARe A2BR da adenosina associados
à espironolactona no pós-condicionamento farmacológico ... 53
Gráfico 7: Análise da ação dos antagonistas dos receptores A1Re A3R da adenosina associados
à eplerenona no pré-condicionamento farmacológico ... 53
Gráfico 8: Análise da ação dos antagonistas dos receptores A2ARe A2BR da adenosina associados
Tabela 1: Composição da solução de BRDU [10-2M] (5-Bromo-2'-deoxiuridina) ... 38
Tabela 2: Composição do meio de cultura normal ... 38
Tabela 3: Composição da solução tampão de digestão ... 38
Tabela 4: Composição do meio de cultura para isquemia ... 38
Tabela 5:Composição da solução de parada para evitar degradação da adenosina ... 38
Tabela 6: Concentração de adenosina detectada nos cromatogramas para amostras dos grupos normóxia, pré-condicionamento e pós-condicionamento ... 49
A1R Receptor da adenosina subtipo A1R
A2AR Receptor da adenosina subtipo A2AR
A2BR Receptor da adenosina subtipo A2BR
A3R Receptor da adenosina subtipo A3R
AC Adenilato Ciclase
ADA Adenosinas deaminase
ADO Adenosina
Akt Serina/Treonina Quinase (ou Proteína Quinase B – PKB)
AMP Adenosina monofosfato
AMPc Adenosina monofosfato cíclico ANOVA Análise de variância
AP1 Ativador de proteína 1 ATP Adenosina trifosfato
AVE Acidente Vascular Encefálico
BAY60-6583 Agonista do receptor A2A da adenosina
BAY94-8862 Antagonista do MR Finerenona BRDU 5-Bromo-2'-deoxyuridine Ca2+ Íon cálcio
CCA Centro de Ciência Animal
CCPA Agonista do receptor A1 da adenosina
CEUA Comitê de Ética de Uso Animal
CI-IB-MECA Agonista do receptor A3R da adenosina
CO2 Dióxido de Carbono
COX-2 Ciclooxigenase (também conhecida como prostaglandina G/H sintetase) DPCPX Antagonista do receptor A1R da adenosina
DAG Diacilglicerol
DMEN Dulbeco´s Modified Eagle Medium
DMSO Dimetilsulfóxido
ERK 1/2 Quinase regulada por sinais extracelulares tipo 1/2 FMUSP Faculdade de Medicina da Universidade de São Paulo
Gi Proteína G inibitória
GMPc Guanosina 3’,5’-monofosfato cíclico
Gq Proteína G tipo q
GR Receptor glicocorticoide
Gs Proteína G estimulatória
H+ Íon hidrogênio
HC Hospital das Clínicas
HPLC-MS High performance liquid chromatography- mass spectrometry – Cromatografia Líquida de Alta Performance – Espectometria de Massas
HSPs Heat shock protein – Proteínas de choque térmico IAM Infarto Agudo do Miocárdio
IC Insuficiência cardíaca
InCor Instituto do Coração IP3 Inositol trifosfato
I-R Isquemia-Reperfusão
KATP Canais de potássio sensíveis a ATP
LDH Enzima Lactato Desidrogenase
MAPK Proteína quinase ativada por mitógeno
MEK 1/2 Proteína quinase ativada por mitógeno tipo 1/2
MR Receptor mineralocorticoide
MRS 1523 Antagonista do receptor A3R da adenosina
MRS 1706 Antagonista do receptor A2BR da adenosina
MTT Brometo de 3-4,5-dimetil-tiazol-2-il-2,5-difeniltetrazólio
m/z Massa/carga
N2 Gás nitrogênio
n.d. Não detectado
NFκB Fator de transcrição NF-kappaB
NO Óxido nítrico
NrF2 Fator nuclear eritróide 2 relacionado ao fator 2
PCI Pré-condicionamento isquêmico PCIR Pré-condicionamento remoto PI3K Enzima fosfatidilinositol-3-quinase
PIP2 Fosfatidilinositol 4,5-bifosfato
PKA Proteína quinase A PKC Proteína quinase C
PLC Fosfolipase C
PTK Proteína tirosina quinase
PTPM Poros de transição de permeabilidade mitocondrial q.s.p Quantidade suficiente para
RAF Proteína quinase específica para Ser/Thr
RALES Randomized Aldosterone Evaluation Study – Principal estudo clínico sobre espironolactona
RISK Reperfusion Injury Salvage Kinase – Quinases de salvamento da lesão de reperfusão
ROS Espécie reativa de oxigênio
rpm Rotações por minuto
SAH S-adenosil-homocisteína
SCH58261 Antagonista do receptor A2A da adenosina
SD Linhagem de rato – Spreague Dawley
SEM Erro padrão da média
SRAA Sistema Renina-Angiotensina-Aldosterona STAT Transdutor de sinal e ativador de transcrição
T1/2 Tempo de meia-vida
tr Tempo de retenção
UFOP Universidade Federal de Ouro Preto
1- INTRODUÇÃO ... 18
1.1- Epidemiologia ... 19
1.1. Condicionamento Isquêmico ... 20
1.2. Adenosina ... 26
1.3. Receptores da adenosina ... 28
1.4. Antagonistas do receptor mineralocorticoide da aldosterona (MR) ... 29
1.5. Antagonistas do receptor mineralocorticóide (MR), receptores de adenosina e o condicionamento isquêmico ... 31
2- OBJETIVOS ... 34
OBJETIVO GERAL ... 35
3- METODOLOGIA ... 36
3.1. Animais ... 37
3.2. Cultura Primária de Cardiomiócitos... 37
3.3. Soluções Utilizadas nos Ensaios ... 37
3.4. Desenho experimental ... 39
3.5. Indução da isquemia in vitro ... 40
3.6. Validação do método de isquemia in vitro ... 41
3.7. Determinação da adenosina em cardiomiócitos ventriculares de ratos neonatos sob condições de isquemia ... 42
3.8. Avaliação da possível ação da espironolactona e eplerenona mediada pelos receptores da adenosina (A1R, A2AR, A2BR e A3R) em condições de isquemia ... 43
3.9. Análise estatística ... 44
4- RESULTADOS ... 45
4.1. Validação do método de Isquemia in vitro ... 46
5- DISCUSSÃO ... 55
6- CONCLUSÃO ... 60
7- REFERÊNCIAS ... 62
1.1- Epidemiologia
Doenças cardiovasculares estão entre as doenças não contagiosas que mais levam a óbito segundo a Organização Mundial da Saúde. Estimativa feita no ano de 2012 mostrou que das 56 milhões de mortes no mundo, cerca de 36 milhões foram consequentes de doenças não contagiosas como diabetes (4%), doenças respiratórias crônicas (10,7%), câncer (21,7%) e doenças cardiovasculares (46,2% ou 17,6 milhões de pessoas). Uma projeção estima que o número de mortes por doenças cardiovasculares passará de 17,6 milhões ocorridas em 2012 para 22,2 milhões no ano de 2030 (WHO – World Health Organization, 2014).
Dados do Ministério da Saúde mostram que as doenças cardiovasculares foram responsáveis por 29,4% das mortes no Brasil, isto é, 308 mil pessoas morreram principalmente por infarto e acidente vascular encefálico (AVE) no ano de 2007 (Portal da Saúde). Segundo o DATASUS/MS, o número de óbitos causados por doenças cardiovasculares entre 2006 a 2013 foi de 3.153.175, equivalente a 40 mortes por segundo (Portal da Sociedade Brasileira de Cardiologia – Cardiômetro).
Diante destes números, é evidente que doenças cardiovasculares são um problema de saúde pública importante e, estudos voltados à prevenção e tratamento são essenciais para reduzir a morbidade e mortalidade dos pacientes.
Encontrar uma forma de tornar as células cardíacas resistentes à morte por isquemia-reperfusão (I-R) é um alvo terapêutico pertinente para promover cardioproteção. Dentre as formas de minimizar esses efeitos estão o uso de antagonistas do receptor mineralocorticoide da aldosterona (MR) e o condicionamento isquêmico.
1.1. Condicionamento Isquêmico
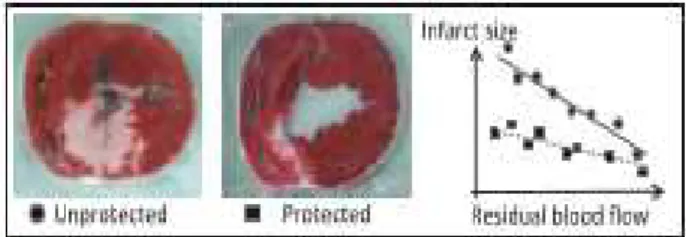
Condicionamento isquêmico é o termo usado, atualmente, que engloba estratégias cardioprotetoras endógenas, baseadas em ciclos breves de isquemia-reperfusão, sejam elas aplicadas diretamente no coração como no pré-condicionamento isquêmico e no pós-condicionamento isquêmico, ou indiretamente como é o caso do pré-pós-condicionamento remoto. Além da completa reperfusão, o condicionamento isquêmico é conhecido como a intervenção mais poderosa na redução da área infartada (Figura 1) (Hausenloy e Yellon, 2016).
Figura 1: Fotos de dois corações de porcos submetidos ao infarto evidenciando a área infartada em cor mais clara (coloração trifenil tetrazólio). A primeira imagem mostra um coração onde não houve proteção e a segunda de um coração protegido. Ao lado, um gráfico mostra a área infartada em relação ao fluxo sanguíneo residual. Fonte: (Heusch, 2015).
1.1.1. Pré-condicionamento isquêmico (PCI)
Figura 2: Esquema ilustrativo dos ciclos de isquemia-reperfusão do pré-condicionamento isquêmico.
Após sua descoberta, a função protetora do PCI foi demonstrada em todas as espécies testadas, como camundongos, ratos, coelhos, gatos, cães, ovelhas, macacos e corações humanos (Hausenloy e Yellon, 2016).
Nos primeiros anos após a descoberta do pré-condicionamento isquêmico, a hipótese mais aceita era a de que o PCI protege por melhorar o equilíbrio metabólico durante o período isquêmico. Vários estudos examinaram os efeitos metabólicos e iônicos do PCI em corações e observaram que o miocárdio apresenta menor concentração do nucleotídeo adenina, um aumento substancial de fosfato de creatina, excesso de glicose intracelular e déficit contrátil (Murry et al., 1991; Jennings et al., 2001). Adicionalmente, durante o período isquêmico prolongado, cardiomiócitos pré-condicionados exibem uma taxa mais lenta de depleção de ATP, assim como de lactato e acúmulo de H+. Por meio desses resultados, os autores concluíram que a redução da
procura de energia é um componente essencial para o mecanismo de proteção cardíaca no pré-condicionamento (Jennings et al., 2001).
Tem sido descrito que o pré-condicionamento atua por duas janelas de cardioproteção distintas, caracterizadas como precoce e tardia devido ao tempo que perdura a proteção promovida em cada uma delas. O pré-condicionamento precoce ocorre imediatamente após os estímulos de isquemia-reperfusão e dura de 2 a 3 horas. O pré-condicionamento tardio, por sua vez, tem início entre 12 e 24 horas mais tarde e dura entre 48 e 72 horas (Hausenloy e Yellon, 2016).
ERK1/2 (proteína quinase regulada por sinal extracelular), PKC (proteína quinase C) e tirosina quinase (PTK). Esse processo permite que o efeito cardioprotetor possa durar de 2 a 3 horas, caracterizando assim o pré-condicionamento precoce (Hausenloy e Yellon, 2016).
Estímulos químicos liberados endogenamente por pequenas moléculas, tais como íons cálcio, espécies reativas de oxigênio (ROS), espécies reativas de nitrogênio e sulfeto de nitrogênio também eliciam a cardioproteção (Heusch, 2015). Íons de cálcio extracelulares podem atuar por meio da adenosina e pela ativação da PKC, no entanto, aparentam possuir um papel menor no pré-condicionamento (Heusch, 2015), uma vez que, segundo Wallbridge e colaboradores, o uso de antagonistas de cálcio não interfere no PCI (Wallbridge et al., 1996; Heusch, 2015).
No pré-condicionamento tardio, proteínas quinase ativam fatores de transcrição como a proteína ativadora-1 (AP-1), o fator de transcrição nuclear NF-κB, o fator NrF2 (fator nuclear eritróide 2 relacionado ao fator 2) e o transdutor de sinal e ativador de transcrição (STAT) 1/3. Estes fatores de transcrição levam à síntese de mediadores como a prostaglandina (G/H) sintetase (também conhecida como COX-2), proteínas heat shock (Hsp72) e óxido nítrico sintase induzível que induzem o efeito cardioprotetor entre 12-24h após o estímulo do PCI (Heusch, 2015).
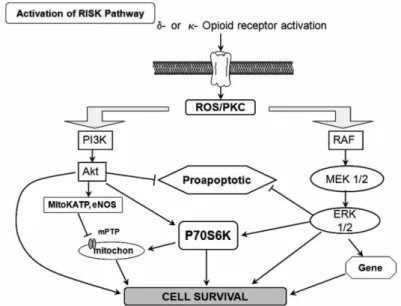
Vias de sinalização também têm sido descritas como atuantes na prevenção da lesão de reperfusão, dentre elas pode-se citar a via RISK (Reperfusion Injury Salvage Kinase). A via quinase de salvamento da lesão de reperfusão (RISK) é um grupo de quinases pró-sobrevivência que incluem as proteínas Akt e ERK 1/2 (figura 3). Quando ativada no início da reperfusão, esta via é capaz de promover cardioproteção (Hausenloy e Yellon, 2010).
Estudos in vitro também têm sido realizados simulando isquemia-reperfusão ao expor células cardíacas mantidas em meio pobre em nutrientes a uma atmosfera de N2 ou mistura gasosa
composta por 95% de N2 e 5% de CO2. Dessa forma, é possível mimetizar a isquemia e buscar
compreender diretamente nas células, os mecanismos envolvidos no condicionamento isquêmico. Safran e colaboradores, por meio de ensaios in vitro, avaliaram o papel dos receptores A1R e A3R da adenosina em cardiomiócitos de ratos e concluíram que ambos receptores,
ativados, são capazes de atenuar a lesão de miócitos durante a hipóxia (Safran et al., 2001).
1.1.2. Pós-condicionamento isquêmico
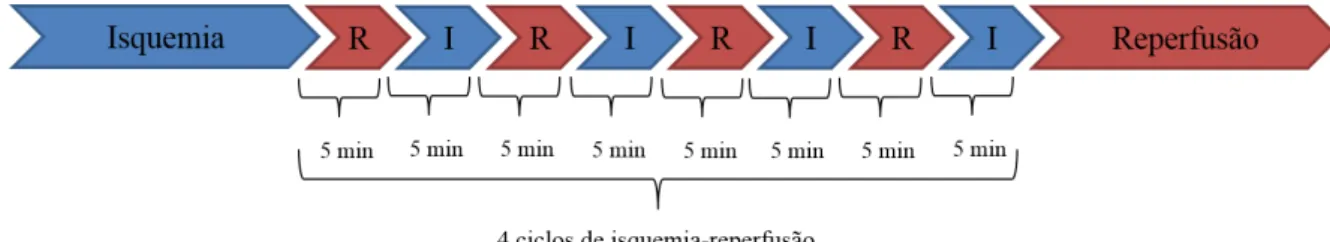
Apesar de sua eficácia em proteger o coração, o pré-condicionamento isquêmico possui uma grande desvantagem: a intervenção deve ser feita antes da isquemia prolongada, tornando-o inviável em castornando-os de infarttornando-o agudtornando-o dtornando-o mitornando-ocárditornando-o. Felizmente, estudtornando-os subsequentes atornando-o PCI demonstraram também que a aplicação de pequenos ciclos de isquemia-reperfusão no início do período de reperfusão também é capaz de reduzir a área do infarto e da apoptose de modo similar ao pré-condicionamento (Zhao et al., 2003); (Crisostomo et al., 2006). A esse fenômeno deu-se o nome de pós-condicionamento isquêmico – Fig. 4.
Figura 4: Esquema ilustrativo dos ciclos de isquemia-reperfusão do pós-condicionamento isquêmico.
Zhao e colaboradores demonstraram que o pós-condicionamento confere uma miríade de efeitos cardioprotetores, como a redução dos níveis de edema do miocárdio, diminuição do estresse oxidativo, acúmulo de neutrófilos polimorfonucleares, e função endotelial preservada (Zhao et al., 2003; Hausenloy e Yellon, 2016).
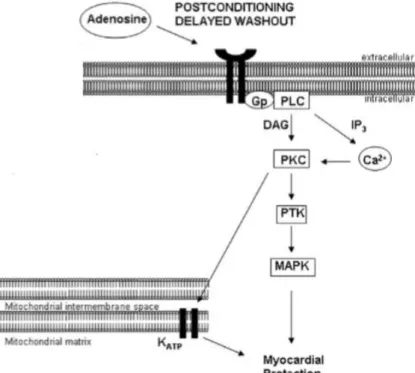
A cascata de sinalização promovida pela ligação da adenosina ao receptor, resulta na ativação de fosfolipase C (PLC). Paralelamente, a hidrólise do fosfatidilinositol 4,5-bifosfato (PIP2) produz inositol trifosfato (IP3) e diacilglicerol (DAG). A PLC ativa o DAG formado e
então, a proteína quinase C (PKC) que é ativada diretamente pelo DAG e indiretamente por Ca2+.
PKC pode promover proteção pela ativação dos canais KATP mitocondriais ou ativação da
proteína tirosina quinase (PTK), que ativa proteínas quinases ativadas por mitógeno (MAPK), família de proteínas conhecida pela promoção da cardioproteção – Fig. 5 (Crisostomo et al., 2006).
Figura 5: Vias de sinalização desencadeadas no pré- e pós-condicionamento isquêmico. Fonte: (Crisostomo et al., 2006)
1.1.3. Pré-condicionamento remoto (PCIR)
O pré-condicionamento remoto recebe atenção especial na prática clínica, pois, em oposição ao pré- e ao pós-condicionamento que exigem uma intervenção direta no coração, no pré-condicionamento remoto o estímulo é realizado em um órgão ou tecido “distante” (Hausenloy e Yellon, 2016).
músculo esquelético, rins e mesentério, são capazes de provocar um fenótipo de proteção no coração, tornando o músculo cardíaco resistente a um episódio longo de isquemia subsequente (Przyklenk e Whittaker, 2011).
Evidências têm indicado que o efeito cardioprotetor subjacente promovido pelo pré-condicionamento remoto, ocorre por uma via neuro-humoral central. A reperfusão do órgão remoto promove a proteção cardíaca por meio de uma “lavagem” que transporta a substância ou o fator humoral gerado pelo PCIR até o coração – Fig. 6 (Hausenloy e Yellon, 2016).
Figura 6: Esquema resumindo as vias de sinalização envolvidas no condicionamento isquêmico. Fonte: (Hausenloy e Yellon, 2016).
1.1.4. Condicionamento farmacológico
pós-condicionamento farmacológico são capazes de reduzir a necrose e apoptose no miocárdio durante isquemia-reperfusão (Li et al., 2015).
Assim como o PCI e o pós-condicionamento isquêmico compartilham de mecanismos de ação semelhantes, no pré- e pós-condicionamento farmacológico também ocorrem semelhanças funcionais. Por exemplo, tem sido relatado que o pré-condicionamento por meio de sevoflurano melhora a função ventricular e recupera o miocárdio, e seu uso no pós-condicionamento reduz arritmias da reperfusão (Tian et al., 2013).
A ativação de mediadores farmacológicos durante isquemia-reperfusão pode mimetizar ou mesmo intensificar os efeitos do condicionamento isquêmico. Desvendar os mecanismos de atuação desses agentes de condicionamento farmacológico pode abrir caminhos importantes para a prática clínica.
Dentre as substâncias envolvidas no condicionamento farmacológico, pode-se citar a adenosina, bradicinina, eritropoietina, óxido nítrico (NO) (Gulati e Singh, 2014), opióides e antagonistas do receptor mineralocorticoide (MR) da aldosterona como espironolactona e eplerenona (Chai, Garrelds, Arulmani, et al., 2005; Chai, Garrelds, De Vries, et al., 2005).
1.2. Adenosina
A adenosina (ADO) é um autacóide que, assim como a bradicinina, é liberado a partir do endotélio e células intersticiais durante os ciclos de isquemia-reperfusão no condicionamento isquêmico (Heusch, 2015). Constituído por uma adenina ligada a uma ribose (Fig. 7), esse nucleosídeo endógeno é um dos moduladores plausíveis para a proteção do miocárdio isquêmico (Safran et al., 2001). Possui papel fundamental no controle da homeostase (Cunha, 2001), é um vasodilatador potente (Berne, 1964; Sollevi, 1986) e neuromodulador importante na regulação da transmissão sináptica e excitabilidade neuronal do sistema nervoso central (Cunha, 2001; Rahman, 2009). Em 1985, foi descoberto que adenosina exerce efeitos cardioprotetores diretos sobre os miócitos (Ely et al., 1985).
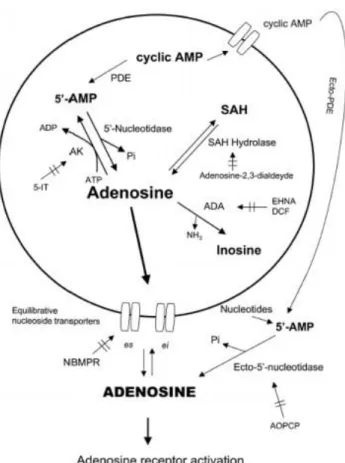
A adenosina é formada a partir de AMP pela família de 5'-nucleotidases – Fig. 8 (Chiu e Freund, 2014). No miocárdio, pode ser produzida pela desfosforilação do AMP promovida intracelularmente pela ação da endo-5’-nucleotidase, localizada no citosol (Sommerschild e Kirkebøen, 2000). A ecto-5’-nucleotidase, por sua vez, é responsável por desfosforilar o AMP no espaço intersticial, gerando a maior parte da adenosina extracelular. Outra maneira de síntese intracelular da adenosina é pela clivagem da S-adenosil-homocisteína (SAH), no entanto é menos comum (Chiu e Freund, 2014). A formação de adenosina a partir de SAH é catalisada pela S-Adenosil-homocisteína hidrolase, no entanto, a taxa de hidrólise de SAH durante a isquemia não aumenta muito, sugerindo que esta via não seja fonte significativa de produção de adenosina no tecido cardíaco nessas condições (Sommerschild e Kirkebøen, 2000).
Além da síntese de adenosina, os processos de degradação podem estar envolvidos no aumento de sua disponibilidade. Sua degradação é feita pelas enzimas adenosina quinase e adenosina deaminase (ADA), que convertem a adenosina em inosina por uma desaminação irreversível – Fig. 8 (Chiu e Freund, 2014).
Figura 8: Esquema ilustrativo das vias de produção e degradação da adenosina. Fonte: (Latini e Pedata, 2001).
adenosina são expressos no coração e estão envolvidos na cardioproteção. Além disso, há evidências de que todos podem ser expressos em miócitos ventriculares (Zhan et al., 2011), no entanto pouco se sabe quanto à suas ações.
1.3. Receptores da adenosina
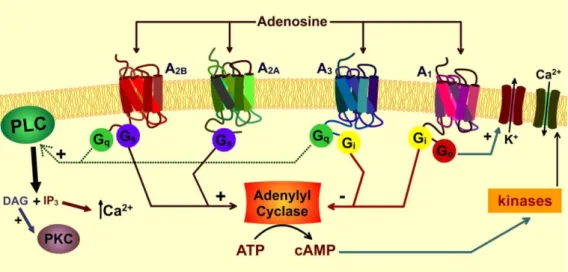
A ligação da adenosina a seus respectivos receptores exerce efeitos por meio da regulação de AMPc (Chiu e Freund, 2014). No entanto, esses efeitos ocorrem de maneira diferente entre os receptores. Enquanto os receptores A1Re A3R, acoplados respectivamente a proteínas Gi e Gq,
inibem adenilato ciclase (AC), receptores A2AR e A2BR, acoplados a proteína Gs, ativam AC,
levando à formação de AMPc e subsequente ativação de PKA (proteína quinase A dependente de AMPc) – Fig. 9. A adenosina também ativa PKC diretamente, que por sua vez, ativa a via RISK protegendo contra lesão de reperfusão (Heusch, 2015).
Figura 9: Vias de sinalização envolvidas na ativação dos receptores de adenosina. Fonte:
https://sites.google.com/a/unicam.it/diego-dal-ben/activities-and-collaborations
Sabe-se que os receptores A1R e A3R são ativados antes da isquemia, portanto, exercem
seus efeitos cardioprotetores no PCI. Em oposição, os efeitos protetores de A2AR e A2BR
aparecem durante a reperfusão, atuando assim, no pós-condicionamento isquêmico (Zhan et al., 2011).
Estudos in vitro simularam a ação dos receptores de adenosina no PCI e pós-condicionamento. Conforme descrito por Leshem-Lev e colaboradores, a ativação dos receptores A1R e A3R por seus respectivos agonistas CCPA e CI-IB-MECA, protege os cardiomiócitos de
ativação do receptor A1R ocorre por meio de sua associação a proteína Gi e efetores como a
MAPK (proteína quinase ativada por mitógeno), Akt e ERK 1/2 (St Hilaire et al., 2009).
O agonista altamente seletivo do receptor A2AR, BAY 60-6583, é capaz de reduzir a área
infartada de corações de coelho quando aplicado durante a reperfusão. O agonista dos receptores A1R/A2R da adenosina, 5’-(N-ethylcarboxamido) aplicado durante a reperfusão limitou a área de
infarto, enquanto os antagonistas SCH58261 e MRS1706 dos receptores A2AR e A2BR,
respectivamente foram capazes de bloquear esse efeito (Xi et al., 2009).
Muitos aspectos da ação dos receptores de adenosina na I-R ainda são pouco compreendidos. É consenso que receptores A1R e A3R são cardioprotetores quando ativados
antes da isquemia e receptores A2AR e A2BR, quando ativados durante a reperfusão. Muitas
questões ainda não estão claras, incluindo os mecanismos de sinalização ativados e se esses são todos mediados via ação direta sobre os cardiomiócitos.
1.4. Antagonistas do receptor mineralocorticoide da aldosterona (MR)
Pacientes que sofrem infarto do miocárdio apresentam elevados níveis de aldosterona e têm associado a isso, um aumento de fibrose, hipertrofia, morte celular, inflamação e estresse oxidativo (Qin et al., 2003; Hayashi et al., 2008).
Aldosterona é um hormônio mineralocorticoide sintetizado na zona glomerulosa da supra-renal sendo o efetor terminal da cascata de sinalização do Sistema Renina-Angiotensina-Aldosterona (SRAA). Entretanto, elevados níveis plasmáticos de aldosterona resultam em complicações vasculares, renal, cardíaca e metabólica independente da pressão sanguínea.
A grande quantidade de efeitos deletérios promovidos pela aldosterona sobre o sistema cardiovascular tem motivado estudos sobre inibidores do receptor mineralocorticóide (MR).
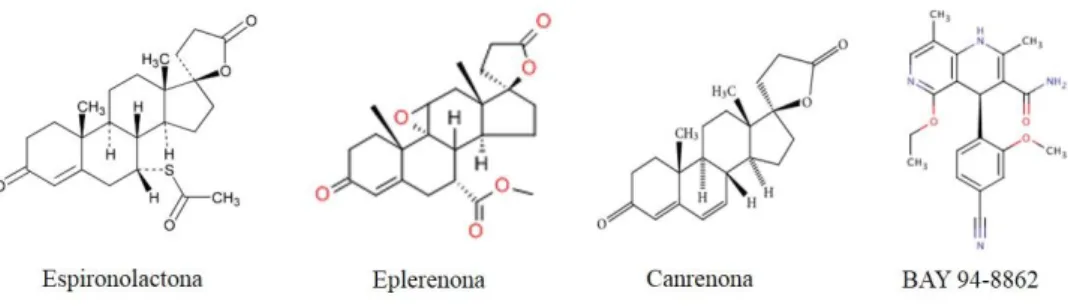
Existem, atualmente, quatro principais antagonistas do receptor mineralocorticoide: Espironolactona (Aldactone®), Eplerenona (Inspra®), Canrenona e o recém-sintetizado
Finerenona (BAY 94-8862) (Figura 10). Cada antagonista possui particularidades quanto às suas características farmacológicas e ação (Tabela 7).
Figura 10: Fórmulas estruturais dos antagonistas do receptor mineralocorticóide da aldosterona. Fonte: Wikipedia
Espironolactona, o primeiro antagonista do MR produzido, é um anti-hipertensivo poupador de potássio sintetizado na década de 1960. Em seu efeito antagonista a espironolactona atua como um inibidor competitivo da aldosterona, contudo possui capacidade para se ligar a receptores progesterônicos e androgênicos, promovendo efeitos adversos tais como ginecomastia, alterações no ciclo menstrual e diminuição da libido (Delyani, 2000). Além de seu papel na redução da pressão sanguínea, estudos clínicos têm mostrado efeitos anti-inflamatórios (Zhang et al., 2014) e antifibróticos da espironolactona (Hermidorff et al., 2015; Zhao et al., 2015).
Sintetizada a partir da espironolactona em 2002, eplerenona é o princípio ativo do fármaco Inspra® (Núñez et al., 2006) que atua como um inibidor específico para o receptor de aldosterona (Specific Aldosterone Receptor Antagonist – SARA). Em oposição à espironolactona, a eplerenona apresenta maior seletividade pelo receptor mineralocorticóide e baixa afinidade pelos receptores de progesterona (GR < 1%) e de andrógenos (0,1%). Essa maior seletividade pelo MR e menor afinidade para os receptores esteroidais reduz os efeitos sexuais secundários observados no tratamento a longo prazo com espironolactona, como ginecomastia, alteração no ciclo menstrual, impotência, mastodinia e sangramento vaginal (Funder, 2013), tornando a eplerenona mais segura para tratamento crônico. Adicionalmente, a eplerenona possui meia-vida (T1/2 = 4 –
6 h) maior que a espironolactona (T1/2 = 1,3 – 1,4 h) (Mcmahon, 2001), porém tem se mostrado
Estudos têm mostrado que a eplerenona atenua a síntese de colágeno induzida pela corticosterona, exercendo, assim como a espironolactona, uma função de prevenir a fibrose cardíaca (Omori et al., 2014; Hermidorff et al., 2015).
Canrenona é um metabólito ativo da espironolactona usado como diurético que possui efeitos antiandrogênicos, demonstrados em pacientes com cirrose hepática (Andriulli et al., 1989). É um fármaco de preço acessível e não tem apresentado limitações em sua prescrição nos países em que está disponível. Estudos têm mostrado que, além de sua ação bloqueadora da aldosterona, canrenona também reduz a progressão da resistência à insulina e de microalbuminúria na diabetes tipo 2 e outras doenças relacionadas (Armanini et al., 2014). Derosa e colaboradores demonstraram que canrenona é capaz de reduzir a pressão sanguínea em pacientes com síndrome metabólica. Maiores estudos, porém, são necessários a respeito desse metabólito da espironolactona (Derosa et al., 2013).
O antagonista Finerenona (BAY 94-8862) foi sintetizado em 2012 como um antagonista não-esteroidal que possui maior seletividade ao MR que a espironolactona e maior afinidade comparado à eplerenona. Um grande estudo clínico (ARTS – MinerAlocorticoid Receptor Antagonist Tolerability Stud: NCT01345656) tem sido realizado para demonstrar a eficácia da finerenona. Pitt e colaboradores demonstraram que doses de finerenona 5-10 mg/dia eram pelo menos tão eficientes quanto a espironolactona 25 ou 50 mg/dia em diminuir biomarcadores do estresse hemodinâmico em pacientes com insuficiência cardíaca, fração de ejeção ventricular esquerda reduzida e doença renal crônica moderada. Entretanto, esse resultado foi associado a menor incidência de hipercalemia e falha renal (Pitt et al., 2013). Por ser um composto recém-sintetizado, mais estudos são necessários para comprovar a eficácia desse antagonista.
O presente trabalho é focado nos antagonistas do receptor mineralocorticoide espironolactona e eplerenona por serem os medicamentos de uso mais comum na prática clínica.
1.5. Antagonistas do receptor mineralocorticóide (MR), receptores de adenosina e o condicionamento isquêmico
A espironolactona foi originalmente desenvolvida para neutralizar os efeitos do hormônio aldosterona, em especial os efeitos relacionados à excreção de potássio. Contudo, durante décadas no mercado sendo usada para esse fim, começou-se a observar um papel secundário para a espironolactona em relação aos diuréticos mais potentes (Nappi e Sieg, 2011).
Ao ligar-se ao receptor MR, a espironolactona promove efeitos benéficos sobre a morfologia e função do ventrículo esquerdo em ratos submetidos a infarto do miocárdio (Nagatomo et al., 2014). O estudo RALES demonstrou que a espironolactona associada ao inibidor da enzima conversora de angiotensina (ECA), reduz significativamente a morbidade e mortalidade em pacientes com insuficiência cardíaca congestiva grave (Ma et al., 2014).
Estudo realizado por Sohn e colaboradores demonstrou que em corações de filhotes de rato da linhagem Spreague Dawley (SD) a expressão da proteína p38 (subfamília de proteína quinase ativada por mitógeno responsável por regular vários processos celulares como diferenciação celular, apoptose, respostas à inflamação e crescimento celular) foi diminuída significativamente após administração de 200mg/kg de espironolactona, além de reduzir a apoptose de cardiomiócitos nesses ratos (Sohn et al., 2010).
Trabalhos experimentais e clínicos demonstraram que a eplerenona promove acentuada proteção cardíaca, cerebral, vascular e renovascular na isquemia cardíaca após infarto do miocárdio (Rudolph et al., 2004). Dentre estes podemos citar os trabalhos nos quais o tratamento por longo prazo com eplerenona promoveu uma melhoria da função ventricular e vascular em ratos cronicamente infartados (Fraccarollo et al., 2003; Schäfer et al., 2003).
Estudo prévio em nosso laboratório, avaliou a ação da espironolactona e eplerenona de maneira comparativa, na presença e na ausência da aldosterona. Os resultados mostraram que ambos promoveram proliferação de cardiomiócitos e reduziram a proliferação de fibroblastos, mesmo na ausência do referido hormônio, sugerindo uma via de sinalização independente do antagonismo sobre aldosterona (Hermidorff et al., 2015).
Possíveis vias de sinalização evocadas por esses fármacos também foram analisadas e constatou-se que, tanto espironolactona quanto eplerenona foram capazes de aumentar os níveis de Ca2+, GMPc e a atividade de ERK 1/2. Também reverteram a ação da aldosterona sobre a
Existem evidências consistentes de que antagonistas do MR agem sobre as células cardíacas, independentemente do bloqueio da ação da aldosterona. No entanto, o mecanismo pelo qual eles promovem cardioproteção ainda é pouco compreendido.
Chai e colaboradores em estudos com corações isolados de ratos submetidos a isquemia e reperfusão, relataram que antagonistas do MR administrados antes da isquemia reduziram a área isquêmica em relação ao grupo controle, sugerindo que, de alguma forma, esses antagonistas promovem pré-condicionamento farmacológico (Chai, Garrelds, Arulmani, et al., 2005; Chai, Garrelds, De Vries, et al., 2005).
Em estudo subsequente, também realizado em coração isolado de ratos submetidos a I-R, Schmidt e colaboradores demonstraram que antagonistas do MR também foram capazes de reduzir a área infartada quando administrados antes da reperfusão (pós-condicionamento), e esses efeitos foram bloqueados por um antagonista não-seletivo de receptores da adenosina. Neste mesmo estudo, o efeito cardioprotetor do canrenoato de potássio (metabólito ativo da espironolactona) foi bloqueado em camundongos knock-outs pela enzima ecto-5’-nucleotidase (enzima envolvida na síntese de adenosina) (Schmidt et al., 2010).
OBJETIVO GERAL
Avaliar o efeito cardioprotetor da espironolactona e eplerenona sobre cardiomiócitos de ratos submetidos à isquemia-reperfusão in vitro, na presença e na ausência de antagonistas dos receptores A1R, A2AR, A2BR e A3R da adenosina.
OBJETIVOS ESPECÍFICOS
1. Indução de isquemia in vitro (isquemia-reoxigenação).
2. Caracterização do dano isquêmico:
2.1. Avaliação da citotoxicidade por meio de ensaio por kit de LDH
3. Determinação da adenosina em cardiomiócitos ventriculares de ratos neonatos 3.1. Identificação do nucleosídeo por Espectrometria de Massas
4. Avaliação da possível ação da espironolactona e eplerenona mediada pelos receptores da adenosina (A1R, A2AR, A2BR e A3R) em condições de isquemia nos miócitos cardíacos.
3.1. Animais
Para obtenção de cardiomiócitos, foram utilizados ratos neonatos da linhagem Wistar, fêmeas, pesando em média 5g. Estes permaneceram juntamente com a mãe até o dia do experimento.
Os animas foram provenientes do Centro de Ciência Animal (CCA) da Universidade Federal de Ouro Preto, com os protocolos CEUA-UFOP de número 2012/22 e 2016/07. As progenitoras foram acomodadas uma por gaiola, com seus respectivos filhotes, mantidas em ambiente silencioso, com temperatura controlada, em ciclos de 12 horas de período diurno (das 07:00 às 19:00 horas) e 12 horas de período noturno (das 19:00 às 07:00 horas) mantidos artificialmente. Receberam água e ração Purina “ad libitum”. Todas as recomendações do Comitê de Ética em Pesquisa Animal (CEUA-UFOP) foram seguidas, conforme protocolo em anexo.
3.2. Cultura Primária de Cardiomiócitos
O protocolo de extração de células cardíacas foi gentilmente cedido pelo Prof. Dr. Eduardo M. Krieger (InCor – HC – FMUSP). Resumidamente, foram utilizados 10 ratos neonatos em cada cultura, os quais foram higienizados com álcool 70% e decapitados. Os corações foram removidos e lavados em solução DMEM enriquecida com glicose 5mg/mL. Em seguida selecionou-se os ventrículos que foram fragmentados e, posteriormente digeridos enzimaticamente em solução tampão de digestão (Tabela 3), agitados em banho maria a 37oC em
4 ciclos de 20 min. A suspensão de células resultante desta etapa foi centrifugada com soro fetal bovino (LGC Biotecnologia) a 1200rpm/10min. O pellet foi ressuspendido com meio de cultura DMEM enriquecido com 5% de soro fetal bovino, 10% de soro de cavalo, 1% de penicilina/estreptomicina e 0,1% de inibidor de fibroblasto BRDU (5-Bromo-2’-deoxiuridina – Sigma-Aldrich) (Tabela 2). As células foram então distribuídas em placa de 24 poços e incubadas em estufa de CO2 (5%) a 37ºC por 60min para adesão preferencial dos fibroblastos e aumentar
assim, a pureza da cultura. O sobrenadante desta etapa (cardiomiócitos) foi retirado e distribuído em uma nova placa de 24 poços. A placa foi acondicionada em estufa de CO2 (5%) a temperatura
constante de 37ºC por 48 horas para adesão completa das células (Barreto-Chaves et al., 2000).
Tabela 1:Composição da solução de BRDU [10-2M] (5-Bromo-2'-deoxiuridina)
Componentes Quantidade
Água Milli-Q 165 mL
BRDU 0,5 g
Tabela 2: Composição do meio de cultura normal
Componentes Quantidade (q.s.p)
DMEN (Sigma-Aldrich) 42,5 mL
Soro de cavalo (LGC) 5,0 mL
Soro fetal bovino (LGC) 2,5 mL
Penicilina-estreptomicina (LGC) 0,5 mL
Solução de BRDU [10-2M] 50 µL
Tabela 3: Composição da solução tampão de digestão
Componentes Quantidade (q.s.p)
Solução de DMEM + Glicose 5mg/mL 50 mL
Colagenase tipo II (Sigma-Aldrich) 10 mg
Pancreatina (Sigma-Aldrich) 30 mg
Tabela 4: Composição do meio de cultura para isquemia
Componentes Quantidade (q.s.p)
DMEN (Sigma-Aldrich) 42,5 mL
Glicose 250 mg
Penicilina-estreptomicina (LGC) 0,5 mL
Solução de BRDU [10-2M] 50 µL
Tabela 5: Composição da solução de parada para evitar degradação da adenosina
Componentes Quantidade (q.s.p)
Dipyridamole 75 µM
EHNA 15 µM
EDTA 3 mM
Solução salina isotônica (pH 6) 1 L
3.4. Desenho experimental
As culturas foram divididas nos grupos Normóxia, Pré-condicionamento e Pós-condicionamento farmacológico e os tratamentos foram igualmente administrados em ambos grupos com as concentrações demonstradas na lista a seguir. Para facilitar a compreensão, os antagonistas seletivos usados de cada receptor da adenosina foram identificados nessa lista (itens de 6 a 9), contudo ao longo do trabalho serão referidos apenas como “antagonista do receptor A1R”,ou simplesmente “ant. A1R”, por exemplo.
1. Controle normóxia: somente as células mantidas em condições normais 2. Controle isquemia: somente as células mantidas em condições de isquemia 3. Células tratadas com Espironolactona [10-9 M]
4. Células tratadas com Eplerenona [10-8 M]
5. Células tratadas com Adenosina [10-8 M]
6. Células tratadas com antagonista do receptor A1R (DPCPX [10-6 M])
7. Células tratadas com antagonista do receptor A2AR (ZM 241385 [10-9 M])
8. Células tratadas com antagonista do receptor A2BR (MRS 1754 [10-6 M])
9. Células tratadas com antagonista do receptor A3R (MRS 1523 [10-6 M])
10. Células tratadas com ant. A1R [10-6 M] + ant. A3R [10-6 M]
11. Células tratadas com ant. A2AR + ant. A2BR [10-6 M]
12. Células tratadas com Adenosina [10-8 M] + ant. A
1R [10-6 M]
13. Células tratadas com Adenosina [10-8 M] + ant. A
3R [10-6 M]
14. Células tratadas com Adenosina [10-8 M] + ant. A
1R [10-6 M] + ant. A3R [10-6 M]
15. Células tratadas com Adenosina [10-8 M] + ant. A
2AR [10-9 M]
16. Células tratadas com Adenosina [10-8 M] + ant. A
2BR [10-6 M]
17. Células tratadas com Adenosina [10-8 M] + ant. A
2AR [10-9 M] + ant. A2BR [10-6 M]
18. Células tratadas com Espironolactona [10-9 M] + ant. A
1R [10-6 M]
19. Células tratadas com Espironolactona [10-9 M] + ant. A
3R [10-6 M]
20. Células tratadas com Espironolactona [10-9 M] + ant. A
1R [10-6 M] + ant. A3R [10-6 M]
21. Células tratadas com Espironolactona [10-9 M] + ant. A
2AR [10-9 M]
22. Células tratadas com Espironolactona [10-9 M] + ant. A
2BR [10-6 M]
23. Células tratadas com Espironolactona [10-9 M] + ant. A
2AR [10-9 M] + ant. A2BR [10-6 M]
24. Células tratadas com Eplerenona [10-8 M] + ant. A
1R [10-6 M]
25. Células tratadas com Eplerenona [10-8 M] + ant. A
26. Células tratadas com Eplerenona [10-8 M] + ant. A
1R [10-6 M] + ant. A3R [10-6 M]
27. Células tratadas com Eplerenona [10-8 M] + ant. A
2AR [10-9 M]
28. Células tratadas com Eplerenona [10-8 M] + ant. A
2BR [10-6 M]
29. Células tratadas com Eplerenona [10-8 M] + ant. A
2AR [10-9 M] + ant. A2BR [10-6 M]
3.5. Indução da isquemia in vitro
Para avaliar a ação da espironolactona e eplerenona, como possíveis agentes de pré- e pós-condicionamento farmacológico, foi necessário mimetizar isquemia in vitro. Isquemia é caracterizada pela falta de sangue local que leva à deficiência na distribuição de O2 e nutrientes
na área afetada. Sendo assim, ao induzir isquemia in vitro, as células foram expostas por 2 horas a uma mistura gasosa composta por 95% de N2 – responsável por substituir o O2 do meio – e 5%
de CO2. Associado a isso, as células também foram tratadas com meio de cultura pobre em
nutrientes, o qual é livre de soro, mas acrescido de 5mg/mL de glicose apenas para manutenção dos cardiomiócitos (Safran et al., 2001).
Visando controlar a eficácia da indução das células à isquemia, em todos os ensaios foram preparadas duas placas, uma submetida a condições ideais de nutrição e oxigênio para controle, e uma para o ensaio de isquemia. Dessa forma, para melhor compreensão, demos os nomes a essas placas de grupo normóxia e grupo isquemia. É importante salientar que, as células do grupo normóxia se mantiveram em meio de cultura enriquecido normalmente, uma vez que o meio pobre em nutrientes se faz necessário apenas para as condições de isquemia.
Em relação aos tratamentos farmacológicos, foram feitos dois grupos: o pré-condicionamento, para as células tratadas antes da exposição ao nitrogênio, e o grupo
pós-condicionamento, para as células tratadas no ato da “reperfusão”. Dessa forma, foi preparada uma placa para cada grupo exposto a condições de isquemia e as células do grupo normóxia, também receberam os tratamentos respeitando os grupos de tratamento pré- e pós-condicionamento para controle.
3.5.1. Preparo das placas
foram ressuspendidas em meio de cultura normal enquanto as do grupo isquemia foram ressuspendidas em meio de cultura próprio para isquemia.
As células foram contadas em câmara de Neubauer e distribuído o equivalente a 105 células
em cada poço em duas placas de 96 poços. As placas foram acondicionadas em estufa de CO2
(5%) a temperatura constante de 37ºC por 24 horas para adesão completa das células.
3.5.2. Tratamentos
As células do grupo pré-condicionamento (tanto das placas isquemia quanto normóxia) receberam o tratamento com espironolactona 10-9 M e eplerenona 10-8 M, cujas concentrações
foram definidas em ensaio de curva de concentração previamente realizado, e foram incubadas por 2h para ação dos fármacos.
Após esse período, as placas isquemia foram colocadas em câmara de hipóxia por 2h em estufa contendo uma mistura de N2 (95%) e CO2 (5%) a 37ºC. As placas normóxia foram
mantidas em estufa a 37ºC e 5% de CO2.
Em seguida, para a reperfusão as células foram expostas a condições normais de oxigênio. Imediatamente, o grupo pós-condicionamento foi tratado com os fármacos espironolactona 10-9
M e eplerenona 10-8 M. As células do grupo pré-condicionamento tiveram o meio de cultura
substituído por meio de cultura normal (DMEM enriquecido de 10% de soro de cavalo e 5% SFB). As placas foram incubadas em estufa a 37ºC e 5% de CO2 por 2 horas para ação dos
fármacos.
Para que ambos os grupos fossem expostos pelo mesmo tempo ao tratamento, passadas as duas horas de tratamento, o meio de cultura contendo os fármacos do grupo Pós-condicionamento foi removido e substituído por meio normal. Essa troca de meio ocorreu para todos os grupos (normóxia e isquemia) para evitar diferença devido à renovação do meio. As células foram incubadas em estufa a 37ºC e 5% de CO2 por 16 horas e posteriormente
prosseguiu-se com os experimentos.
3.6. Validação do método de isquemia in vitro
liberada do citosol no sobrenadante pelas células danificadas. A lactato desidrogenase é uma enzima que atua em condições de anaerobiose, quando catalisa a redução do piruvato em lactato, utilizando o NADH produzido na fase oxidativa, regenerando o NAD+ necessário para a glicólise
na ausência de oxigênio (Lehninger et al., 2005). Dessa forma, quanto maior o dano celular promovido pelo ensaio de isquemia in vitro, maior a quantidade de LDH liberado.
Após o tratamento das células conforme citado na sessão 3.5.2, procedeu-se o ensaio de detecção de citotoxicidade por LDH conforme recomendações do fabricante do kit.
3.7. Determinação da adenosina em cardiomiócitos ventriculares de ratos neonatos sob condições de isquemia
3.7.1. Preparo das amostras
Para determinar se há presença de adenosina nos cardiomiócitos ventriculares, procedeu-se normalmente o ensaio de indução à isquemia como descrito na procedeu-seção 3.5. Imediatamente após as duas horas de exposição das células ao gás nitrogênio, coletou-se o meio sobrenadante das células do grupo pré-condicionamento. As amostras do pós-condicionamento foram tratadas conforme descrição na seção 3.5 e sua coleta foi realizada imediatamente após as 2h de incubação da espironolactona e eplerenona.
Um total de 300 µL de amostra foi coletado para cada tratamento e adicionadas em tubos de vidro contendo 150 µL de solução de parada (descrita na tabela 5) para evitar a degradação da adenosina. Posteriormente, adicionou-se 900 µL de acetona P.A. para precipitação de proteínas, agitou-se em vórtex e, em seguida, centrifugou-se por 10’ a 5.000 rpm. O sobrenadante foi retirado e transferido para um novo tubo de vidro. A acetona presente nas amostras foi retirada por evaporação com auxílio de fluxo de gás nitrogênio.
As amostras foram então concentradas em liofilizador (BenchTop ™ “K” Series – VirTis). O precipitado obtido foi ressuspendido na solução da fase móvel, composta por água e metanol com ácido fórmico 0,1%. Posteriormente, procedeu-se a leitura.
3.7.2. Análise por espectrometria de massa
Observação: Foi separado um tubo apenas com solução de parada para ser lido juntamente com as amostras para avaliar sua interferência na detecção e subtraí-la.
3.8. Avaliação da possível ação da espironolactona e eplerenona mediada pelos receptores da adenosina (A1R, A2AR, A2BR e A3R) em condições de isquemia
Para avaliar se a ação protetora da espironolactona e eplerenona é mediada por receptores da adenosina em condições de isquemia, realizou-se a determinação da viabilidade celular pós-exposição com MTT (Sigma-Aldrich – Catálogo: 298-3-1).
O MTT (brometo de 3-4,5-dimetil-tiazol-2-il-2,5-difeniltetrazólio) é um sal tetrazólio de cor amarela que, quando metabolizado forma cristais de formazan de cor azul. Esse processo ocorre na cadeia respiratória mitocondrial de células metabolicamente ativas, dessa forma, a quantidade de formazan formado é proporcional à quantidade de células viáveis. A análise é feita por espectrofotometria.
Para o ensaio de viabilidade, as células devem estar aderidas em microplaca, sendo assim, a indução da isquemia foi feita diretamente nas placas de ensaio. Após o preparo das células conforme citado na sessão 3.2, os tratamentos foram realizados (sessão 3.5.2), com o diferencial da presença dos antagonistas dos receptores da adenosina. As células do grupo pré-condicionamento foram tratadas com os antagonistas dos receptores A1R e A3R (Zhan et al.,
2011), foram incubadas por 20 min para ligação dos antagonistas a seus receptores, em seguida adicionou-se adenosina, espironolactona ou eplerenona conforme desenho experimental pré-estabelecido (sessão 3.4). O tratamento do grupo pós-condicionamento seguiu o mesmo padrão realizado no grupo pré-condicionamento, contudo, foram utilizados antagonistas para os receptores A2AR e A2BR da adenosina (Zhan et al., 2011).
3.9. Análise estatística
A análise estatística dos resultados foi realizada por meio do software GraphPad Prism®
4.1. Validação do método de Isquemia in vitro
Nos ensaios de validação do método de indução dos cardiomiócitos a isquemia, observamos que a técnica utilizada foi eficaz uma vez que a liberação de LDH foi elevada de maneira significativa no grupo isquemia em relação ao controle normóxia (Gráfico 1).
G r u p o s
P e r c e n tu a l d e L D H l ib e r a d o 0 5 0 1 0 0 1 5 0 2 0 0
C o n tro le N o rm ó x ia
C o n tro le Is q u e m ia
- S ig n ific a tiv a m e n te d ife r e n te d o C o n tr o le Is q u e m ia
Gráfico 1: Análise do dano isquêmico mediante exposição dos cardiomiócitos a condições de isquemia. Percentual de LDH liberado em cardiomiócitos expostos a isquemia comparados a células em condições ideais (controle normóxia). Resultado de três experimentos independentes realizados em triplicatas, n = 3 e expressos em média ± SEM, p<0,05.
4.2. Determinação da adenosina em cardiomiócitos ventriculares de ratos neonatos sob condições de isquemia
Para investigar a presença da adenosina em cardiomiócitos ventriculares submetidos a isquemia, amostras dos seguintes tratamentos foram analisadas: controle, espironolactona, eplerenona e adenosina, dos grupos normóxia, pré-condicionamento e pós-condicionamento. A fim de simplificação, estão representados os cromatogramas apenas dos controles de cada grupo e uma tabela geral (Tabela 6) demonstrando a área dos picos obtidos para todos os tratamentos.
R
esult
4,0 4,5 5,0 5,5 6,0 6,5 7,0 7,5
0 10000 20000 30000 40000 50000 60000 70000 80000 268,10>119,05(+) 268,10>136,05(+) A d e n o si n a /5 ,7 5 7
Espectro contaminante (tr: 5,501 min) Espectro da adenosina (tr: 5,757 min)
60,0 65,0 70,0 75,0 80,0 85,0 90,0 95,0 100,0 105,0 110,0 115,0 120,0 125,0 130,0 m/z
0,0 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 Inten. (x10,000) 119,1 136,1 57,1
60,0 65,0 70,0 75,0 80,0 85,0 90,0 95,0 100,0 105,0 110,0 115,0 120,0 125,0 130,0 m/z
0,0 1,0 2,0 3,0 4,0 5,0 6,0 7,0 Inten. (x10,000) 136,1 119,1 57,1
Na figura 11 estão representados o cromatograma e o espectro obtidos da amostra controle do grupo pré-condicionamento. Ao comparar aos espectros demonstrados na figura 10 é possível comprovar a presença de adenosina pelo padrão dos picos semelhantes aos demonstrados no espectro de detecção do nucleosídeo de interesse.
Figura 12:Cromatograma e espectro de massas obtidos da amostra “controle” do pré-condicionamento. Os picos destacados apresentam a relação massa/carga (m/z) referente à adenosina com os fragmentos iônicos esperados Entre parênteses, é demonstrada a carga positiva adquirida durante a ionização.
De forma semelhante ao resultado encontrado no controle do grupo pré-condicionamento, no controle do pós-condicionamento também foi detectada presença de adenosina (Figura 12).
Figura 13: Cromatograma e espectro de massas obtidos da amostra “controle” do pós-condicionamento. Os picos destacados apresentam a relação massa/carga (m/z) referente à adenosina com a massa molecular esperada. Entre parênteses, é demonstrada a carga positiva adquirida durante a ionização.
60,0 65,0 70,0 75,0 80,0 85,0 90,0 95,0 100,0 105,0 110,0 115,0 120,0 125,0 130,0 m/z
0,00 0,25 0,50 0,75 1,00 1,25 1,50 1,75 2,00 Inten. (x10,000) 136,1 119,1 57,1
60,0 65,0 70,0 75,0 80,0 85,0 90,0 95,0 100,0 105,0 110,0 115,0 120,0 125,0 130,0 m/z
Em oposição aos resultados encontrados nos grupos submetidos a isquemia, o controle normóxia não apresentou presença de adenosina (Figura 13).
Figura 14: Cromatograma e espectro de massas obtidos da amostra “controle” normóxia. Os picos destacados
apresentam a relação massa/carga (m/z) referente ao contaminante com a massa molecular semelhante à esperada para a adenosina. Entre parênteses, é demonstrada a carga positiva adquirida durante a ionização.
A tabela 6 mostra as concentrações de adenosina detectadas em cada amostra. É possível observar diferenças significativas nos valores. A amostra tratada com espironolactona no pré-condicionamento apresentou maior concentração de adenosina em relação ao tratamento com eplerenona e ao controle. Em oposição, no pós-condicionamento a maior concentração ocorreu no tratamento com eplerenona em relação à espironolactona e ao controle.
Tabela 8: Concentração de adenosina detectada nos cromatogramas para amostras dos grupos normóxia, pré-condicionamento e pós-pré-condicionamento.
Amostra Concentração de Adenosina (mg/L)
Pré-condicionamento Pós-condicionamento Normóxia
Controle 0,00332 0,00180 n.d.
Adenosina 0,00744 0,00129 n.d.
Espironolactona 0,00478 0,00096 n.d.
Eplerenona 0,00317 0,00223 n.d.
Legenda: n.d. = não detectado
60,0 65,0 70,0 75,0 80,0 85,0 90,0 95,0 100,0 105,0 110,0 115,0 120,0 125,0 130,0 m/z
0,0 2,5 5,0 7,5
Inten. (x10,000)
119,1
4.3. Espironolactona e eplerenona x Antagonistas da adenosina em condições de isquemia
Para testar nossa hipótese de interação dos antagonistas do receptor mineralocorticoide com receptores da adenosina no condicionamento isquêmico, tratamos os cardiomiócitos ventriculares com espironolactona, eplerenona, adenosina e fizemos associações dos mesmos aos antagonistas dos quatro receptores, A1R, A2AR, A2BR e A3R, da adenosina. Os tratamentos foram
realizados para os grupos pré- e pós-condicionamento.
Conforme demonstrado no gráfico 2, os tratamentos com espironolactona, eplerenona e adenosina foram capazes de proteger as células submetidas a isquemia, mantendo a viabilidade estatisticamente igual ao controle não tratado sob normóxia. Esse resultado foi mantido tanto no pré-condicionamento quanto no pós-condicionamento.
G r u p o s
V ia b il id a d e c e lu la r ( % )
P ré -c on d
icio n am
e nto
P ós -c on d
icio n am
e nto 0
5 0 1 0 0 1 5 0
C o n tro le N o rm ó x ia
C o n tro le Is q u e m ia
E s p ir o
E p le
A D O
- S ig n ific a tiv a m e n te d ife r e n te d o C o n tr o le N o r m ó x ia - S ig n ific a tiv a m e n te d ife r e n te d o C o n tr o le Is q u e m ia
Gráfico 2: Ação da espironolactona, eplerenona e adenosina no pré- e no pós-condicionamento farmacológico.
Percentual de cardiomiócitos viáveis após isquemia, tratados com espironolactona [10-9 M], eplerenona [10-8 M] e
adenosina [10-8 M] como agentes de pré- e pós-condicionamento farmacológico comparados a cardiomiócitos não
tratados expostos a isquemia (controle isquemia) e a células em condições ideais (controle normóxia). Resultado de três experimentos independentes realizados em triplicatas, n = 3 e expressos em média ± SEM, p<0,05.
4.3.1. Adenosina
Pré-condicionamento – Adenosina
Os receptores A1R e A3R da adenosina são conhecidos por atuar predominantemente no
DPCPX [10-6 M] e MRS 1523 [10-6 M] respectivamente, associados à adenosina não houve
diferença com relação às células tratadas apenas com o referido nucleosídeo (Gráfico 3).
T r a t a m e n t o s
V ia b il id a d e c e lu la r ( % ) 0 5 0 1 0 0 1 5 0
C o n tro le
A D O
A D O + A n t. A1R
A D O + A n t. A3R
A D O + A n t. A1R + A n t. A3R
Gráfico 3: Análise da ação dos antagonistas dos receptores A1Re A3R da adenosina no pré-condicionamento
farmacológico. Percentual de cardiomiócitos viáveis após isquemia, tratados com Adenosina [10-8 M], ant. A1R [10
-6 M] e ant. A3R [10-6 M] comparados a cardiomiócitos não tratados expostos a isquemia (controle). Resultado de
dois experimentos independentes realizados em duplicatas, n = 2 e expressos em média ± SEM, p<0,05.
Pós-condicionamento – Adenosina
Os receptores A2AR e A2BR da adenosina são conhecidos por atuar predominantemente no
pós-condicionamento. Ao tratar as células com os antagonistas dos receptores A2AR e A2BR, ZM
241385 [10-9 M] e MRS 1754 [10-6 M] respectivamente,e associá-los à adenosina não houve
diferença com relação às células tratadas apenas com o referido nucleosídeo (Gráfico 4).
T r a t a m e n t o s
V ia b il id a d e c e lu la r ( % ) 0 5 0 1 0 0 1 5 0
C o n tro le
A D O
A D O + A n t. A2 AR
A D O + A n t. A2 BR
A D O + A n t. A2 AR + A n t. A2 BR
Gráfico 4: Análise da ação dos antagonistas dos receptores A2ARe A2BR da adenosina no pós-condicionamento
farmacológico.Percentual de cardiomiócitos viáveis após isquemia, tratados com adenosina [10-8 M], ant. A
2AR [10
-9 M] e ant. A2BR [10-6 M] comparados a cardiomiócitos não tratados expostos a isquemia (controle). Resultado de