3
Resumo
A doença de Crohn (DC) tem sido associada a diminuição da densidade mineral óssea (DMO) e aumento do risco de fractura, com 22 a 55% dos doentes a apresentarem osteopenia e 3 a 6% osteoporose. O TNF-α, activador da osteoclatogénese, está aumentado na DC, colocando-se a hipótese desta citocina inflamatória representar uma via patológica comum à inflamação intestinal e às alterações ósseas na DC. O objectivo desta revisão é verificar se os antagonistas do TNF-α, eficazes na indução e manutenção da remissão da DC, têm um efeito positivo sobre o metabolismo ósseo. De facto, tem sido constatada uma melhoria significativa dos marcadores de formação óssea (b-ALP, OC, P1NP), com diminuição dos marcadores de reabsorção óssea (sNTx, bCL). A melhoria dos marcadores de formação óssea e da DMO por antagonistas do TNF-α parece ser independente da corticoterapia e da resposta terapêutica na DC de comportamento inflamatório, mas dependente da resposta terapêutica na DC fistulizante. A OPG, produzida pelos osteoblastos, está aumentada nos indivíduos com DC, reflectindo provavelmente um mecanismo contra-regulatório de protecção à perda acelerada de massa óssea. Após infliximab e adalimumab, os níveis de OPG diminuíram paralelamente ao aumento da formação óssea e da DMO. Estudos in vitro mostraram um efeito directo do adalimumab nos osteoblastos, com estímulo à síntese de b-ALP, marcador de diferenciação precoce dos osteoblastos. Isto sugere que a terapêutica com antagonistas do TNF-α tem um efeito directo nos osteoblastos humanos in vitro e que o aumento dos marcadores de formação óssea identificados in vivo são provavelmente o reflexo deste efeito benéfico. Para concluir, apesar da evidência disponível na literatura apontar para um efeito benéfico dos antiTNF-α na remodelagem óssea e na DMO, há pouca evidência disponível que sustente a redução do risco de fractura com estes agentes, sendo necessários estudos adicionais.
Palavras chave: Doença de Crohn, antagonistas TNF-α, osteoblastos, marcadores remodelagem óssea, densidade mineral óssea.
4
Abstract
Crohn’s disease (CD) has been associated with a reduced bone mineral density (BMD) and a higher risk of bone fracture with 22 to 55% of patients presenting with ostepenia and 3 to 6% presenting with osteoporosis. TNF-α, an osteoclastogenesis activator, shows increased levels in CD, leading to the belief that it may represent a common pathway between intestinal inflammation and bone disease in CD. The goal of this review is to establish whether TNF-α antagonists, which are effective in inducing and maintaining remission in active CD, are effective in improving markers of bone formation. There was a significant improvement in markers of bone formation (b-ALP, OC, P1NP) and a decrease in bone reabsorption markers (sNTx, bCL). The improvement of bone formation markers and BMD after the use of TNF-α antagonists seems to be independent of corticoid use and of luminal CD response, but dependent on fistulising CD response. OPG, produced by osteoblasts, is increased in patients with CD, probably reflecting a contra-regulatory mechanism in response to accelerated bone loss. After infliximab and adalimumab therapy, OPG levels decreased and there was a simultaneous increase in bone formation and BMD. In vitro studies showed a direct effect of adalimumab on osteoblasts, which started secreting higher levels of b-ALP, a marker of early osteoblastic differentiation, indicating an improvement in their function. This suggests that treatment with TNF-α antagonists has a direct effect on human osteoblasts in vitro and that the rise in bone formation markers detected in vivo is a reflection of this beneficial effect. In conclusion, despite the available evidence pointing towards a beneficial effect of TNF-α antagonists on bone remodelling and BMD, there is little evidence available to support fracture risk reduction and additional studies are needed.
Key words: Crohn’s disease, TNF-α antagonists, osteoblasts, bone remodelling markers, bone mineral density
5
Índice
Introdução ... 6
Epidemiologia e caracterização da DC ... 6
Doença mineral óssea e doença gastrointestinal ... 7
Osteopenia e Osteoporose ... 8 Fisiologia óssea ... 9 Inflamação ... 10 Sistema RANKL-OPG ... 11 Material e Métodos ... 12 Resultados ... 13
Terapêutica com infliximab, marcadores de remodelagem óssea e DMO ... 13
Terapêutica com infliximab e Sistema RANKL/OPG ... 19
Terapêutica com adalimumab ... 21
Discussão ... 22
Agradecimentos ... 26
Bibliografia ... 27
O Trabalho Final exprime a opinião do autor e não da Faculdade de Medicina de Lisboa.
6
Introdução
A Doença Inflamatória Intestinal (DII) engloba um grupo de doenças crónicas imuno-mediadas intimamente relacionadas que afectam o tracto gastrointestinal, entre as quais se destacam a Doença de Crohn (DC) e a Colite Ulcerosa (CU).1 A etiologia destas doenças ainda não é conhecida, mas acredita-se que se desenvolvam por uma resposta inflamatória inapropriada e contínua contra o microbioma intestinal de hospedeiros geneticamente susceptíveis.2
A DC e a CU manisfestam-se por uma variedade de sintomas incluindo dor abdominal, febre, diarreia, vómitos, anemia e perda de peso. No entanto, estas entidades apresentam importantes distinções na incidência, localização da doença, histologia e apresentação endoscópica, reflectindo mecanismos de doença subjacentes diferentes.1
Epidemiologia e caracterização da DC
A DII é mais prevalente nos países industrializados.3 A ocidentalização do estilo de vida levou a um aumento da prevalência global desta patologia e a uma antecipação da doença, manifestando-se em indivíduos cada vez mais jovens,1 sugerindo uma influência importante dos factores ambientais na sua patogenese.3
Relativamente à DC, na Europa esta apresenta uma incidência de 0.0 a 11.5 por 100.000 habitantes/ano e uma prevalência de 1.5 a 213 por 100.000 habitantes/ano.3
A DC pode surgir em qualquer idade, sendo a idade mais frequente de diagnóstico entre os 20 e os 30 anos.3 Não foi encontrada uma diferença significativa quanto ao género mais frequentemente afectado por esta patologia, mas a maioria dos estudos aponta para uma prevalência global superior nas mulheres.2
Macroscopicamente, a DC, afecta o tubo digestivo de forma segmentar e transmural, da boca ao ânus. Cerca de 75% dos doentes apresentam enterite, dos quais 90% com envolvimento do íleon terminal. O processo inflamatório poderá evoluir de acordo com um padrão fibroestenosante (obstrutivo) ou penetrante (fistulizante).4
Para além das manifestações intestinais clássicas como a diarreia, massa palpável na fossa ilíaca direita, dor abdominal, síndrome de má absorção e fístulas, há ainda a considerar as manifestações extra-intestinais. Estas poderão ser dermatológicas, reumatológicas, oftalmológicas, urológicas, tromboembólicas, osteometabólicas, entre
7 outras. De seguida, abordar-se-ão de forma detalhada as manifestações osteometabólicas da DC.4
Doença mineral óssea e doença gastrointestinal
A Fundação Internacional de Osteoporose estima que ocorra uma fractura a cada 3 segundos. Em todo o mundo, uma em cada três mulheres e um em cada cinco homens, estão em risco de sofrer uma fractura osteoporótica. Na União Europeia (UE) ocorrem anualmente 3,5 milhões de fracturas de fragilidade. Em 2010 estimam-se 43.000 mortes, só na UE, relacionadas com fracturas.
A osteoporose pode ser a única manifestação de uma doença primária do tubo digestivo num doente até então assintomático.5
As alterações ósseas secundárias à DC não devem ser desvalorizadas, uma vez que 22 a 55% destes doentes apresentam osteopenia e 3 a 6% osteoporose (DEXA da anca e coluna lombar),5 com um risco relativo de fractura 40 a 60% superior à população geral, sendo este risco maior com o avanço da idade.
A redução da densidade mineral óssea (DMO) na DII é multifactorial.6 Há factores de risco gerais, como idade, sexo, défice de estrogénios, alterações na homeostase do cálcio, carências nutricionais, tabagismo, álcool e imobilidade7 e fatores de risco específicos da DII, nomeadamente a inflamação sistémica, a má-absorção com défice de cálcio, vitamina D e vitamina K, o hipogonadismo secundário e o uso de fármacos com interferência no metabolismo ósseo, sobretudo a corticoterapia prolongada.5,8 A inflamação sistémica e a corticoterapia estão fortemente implicadas na osteoporose. No entanto, os pacientes com um nível de actividade da doença superior são também os mais propensos ao uso de corticóides, sendo difícil distinguir o impacto causal de cada um destes factores na redução da DMO.9 Além disso, embora os corticóides estejam implicados na perda de massa óssea, os pacientes com DC, apresentam uma perda óssea superior à esperada para a exposição a este fármaco.10
Dois trabalhos publicados há mais de duas décadas, reportaram uma diminuição da DMO entre os doentes com DC (mas não CU) não tratada e com diagnóstico recente.11,12 Segundo Ardizzone et al., os mecanismos responsáveis pela perda de massa óssea são diferentes na DC e na CU. Na DC verificou-se uma relação inversa entre DMO e duração da doença e idade dos pacientes, enquanto na CU se verificou uma relação negativa entre DMO e sexo masculino e duração da corticoterapia. Quanto aos
8 marcadores de remodelagem óssea, estavam aumentados na CU, mas não na DC. Toda esta evidência implica então a DII como factor determinante na DMO.13
Numa publicação mais recente, Sakellariou et all, estudaram um grupo de jovens adultos com DII nunca expostos a corticoterapia e verificaram que pacientes com DC, sintomáticos há mais de seis meses apresentavam uma diminuição siginificativa da DMO em relação a jovens saudáveis da mesma idade, não se verificando o mesmo na CU. De acordo com este estudo, na DC, os principais determinantes de diminuição da massa óssea na altura do diagnóstico são a presença de sintomas há mais de 6 meses e baixo índice de massa corporal (IMC).14
Osteopenia e Osteoporose
A massa óssea, representada no adulto pela DMO, aumenta até ser atingido um pico entre a segunda e terceira décadas de vida, diminuindo depois gradualmente ao longo da vida. As mulheres têm uma perda de massa óssea significativamente maior que os homens, especialmente após a menopausa.15 De acordo com a OMS (Organização Mundial de Saúde), a osteoporose é definida como uma doença esquelética sistémica, caracterizada por baixa massa óssea e deterioração da microarquitectura do osso, com consequente aumento da fragilidade óssea e maior susceptibilidade à ocorrência de fracturas.16A osteoporose ocorre quando há um desequilibrio na homeostasia do osso e a reabsorsação óssea excede a formação. Na osteoporose associada à inflamação crónica (“high-turnover” osteoporosis), a actividade dos osteoclastos está aumentada, resultando num predomínio da reabsorção óssea face à formação de matriz. Em contraste, na osteoporose induzida pelos corticóides (“low-turnover” osteoporosis), a reabsorção é normal, enquanto a síntese de matriz óssea está diminuida.15
Há vários métodos para avaliar a DMO. A DEXA (dual-energy X-ray absorptiometry), raio-X de baixa radiação capaz de detectar perdas mínimas de massa óssea, é o teste mais difundido na prática clínica.
A DEXA calcula o T-score, que compara a DMO do paciente com indivíduos saudáveis no pico de densidade óssea. A OMS definiu como T-score normal um valor até 1 desvio-padrão (DP) do valor da DMO média num adulto jovem e saudável, osteopenia quando o T-score está entre -1 e -2,5 DP, osteoporose quando o T-score é menor ou igual a -2,5 DP e osteoporose grave quando o T-score é menor ou igual a -2,5 DP associado a fractura de fragilidade.17
9 A DEXA também permite calcular o Z-score, que compara a DMO do paciente com indivíduos da mesma idade e sexo. Este índice deve ser utilizado nas mulheres pré-menopáusicas, homens com menos de 50 anos e nas crianças.
Os valores de Z-score iguais ou inferiores a -2,0 DP são definidos como "abaixo do intervalo esperado para a idade" e acima de -2,0 DP como "dentro do intervalo esperado para a idade". O diagnóstico de osteoporose nestes grupos não deve ser baseado apenas em critérios densitométricos.16,17
Uma vez que a complicação major da osteoporose é a fractura óssea, é fulcral considerar também os factores de risco de fractura. Assim, a OMS desenvolveu uma ferramenta para cálculo do risco absoluto de fractura a 10 anos, a ferramenta FRAX, disponível on-line desde 2012, com uma versão aplicável à população portuguesa. O risco de fractura é estimado com base no índice de massa corporal, densidade mineral óssea (DMO), idade, sexo, história de fractura patológica, antecedentes de fractura da anca nos pais, tabagismo, história de abuso de álcool, terapêutica crónica com corticóides e presença de co-morbilidades como síndrome de má absorção, desnutrição crónica, doença hepática crónica, artrite reumatoide ou outras patologias passíveis de provocar osteoporose secundária.18
Stockbrügger et all,19 estudaram 271 pacientes com DC ileocecal e procuraram estabelecer uma relação entre baixa DMO e ocorrência de fracturas vertebrais espontâneas. O grupo corticodependente apresentava uma DMO inferior ao grupo livre de corticóides, como era esperado, mas curiosamente a taxa de fracturas vertebrais foi semelhante no grupo corticodependente e no grupo livre de corticóides e independente da DMO na coluna lombar. Não sendo possível estabelecer uma correlação entre osteopenia e risco de fractura na DC, coloca-se a hipótese desta patologia apresentar um risco superior de fractura independente da redução da DMO, especialmente nalguns períodos da vida, como infância, adolescência, pós-menopausa e idade avançada. De modo a compreender a fisiopatologia e a abordagem à osteoporose nos pacientes com DII, será feita de seguida uma breve revisão da fisiologia normal do osso.
Fisiologia óssea
O osso é um tecido vivo em constante mudança. Em condições fisiológicas (homeostasia), os osteclastos dissolvem matriz óssea (reabsorção) e os osteoblastos
10 depositam osteóide (formação). Este processo de reabsorção e formação é conhecido como remodelagem óssea.
Os osteoblastos derivam de uma célula mesenquimatosa multipotencial que pode diferenciar-se quer em célula do estroma da medula óssea quer em adipócito. Os sinais que levam à diferenciação da célula progenitora ainda não são compreendidos, mas pensa-se que há uma sinalização via Wnt10b envolvida na diferenciação em osteoblastos ou adipócitos.15
Os osteoclastos são células gigantes multinucleadas, com origem hematopoiética e derivam do precursor miéloide que também dá origem aos macrófagos e células dendríticas. Os osteoclastos produzem enzimas, como catepsinas e proteases, para digerir os componentes orgânicos do osso e secretam iões de hidrogénio para destruir a componente mineral.5
Inflamação
As citocinas inflamatórias, como o TNF-α (Factor de necrose tumoral α), IL-1β e IL-6 são potentes activadores da reabsorção óssea7,20 e estão aumentadas na DII.5
O TNF-α induz a diferenciação dos osteoclastos a partir da célula progenitora, activa os osteoclastos maduros e inibe a sua apoptose, aumentado a sobrevida destas células.5,21 O TNF-α estimula ainda os osteoblastos a produzirem IL-6, a qual activa os osteoclastos e amplifica a reabsorção óssea.10
Para além de aumentar a reabsorção, o TNF-α contribui para a diminuição da formação óssea, uma vez que inibe a expressão de um factor nuclear de transcrição, o RUNX2-cbfa1,8 necessário à diferenciação dos osteoblastos e, em conjunto com o IL-1β, sensibiliza estas células à apoptose mediada pelo Fas.5
O TNF-α participa no processo inflamatório por três vias: 1) como um estímulo da inflamação aguda nos modelos clássicos de sépsis, 2) contribui para os distúrbios auto-imunes como a DC, artitre reumatóide e artrite psoriática e 3) pode actuar de forma insidiosa como um estímulo de baixo grau que contribui para a osteoporose, resistência à insulina e aterogénese.22 A imunorreactividade ao TNF-α está aumentada na lâmina própria intestinal de pacientes com DC,23 acreditando-se que esta citocina tem um papel central e comum na patogénese da DC e da osteoporose nestes doentes.21 Recentemente notou-se ainda que pacientes com DII tinham níveis elevados de TNF-α não apenas nas fases de doença activa, mas também nas fases de doença inactiva e com biópsias
11 intestinais morfologicamente normais, reforçando a importância deste mediador na perda óssea destes doentes.7
Paradoxalmente, a IL-12 e IL-18, também sobre-expressas na DC, parecem inibir a formação de osteoclastos.5
Sistema RANKL-OPG
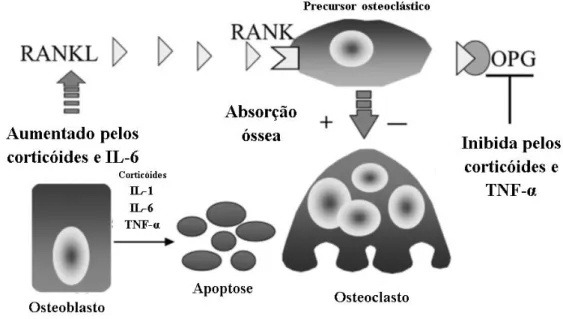
Como referido acima, o TNF-α estimula a osteoclastogénese. O efeito do TNF-α pode ser directo ou indirecto, através de sinais via osteoblastos.22 Os osteoblastos e as células T activadas produzem um ligando activador do receptor do Nf-kB (RANKL), membro da superfamília TNF, que se liga a um receptor de membrana, conhecido como RANK. O RANK, receptor presente nos osteoclastos e seus precursores, estimula a osteoclastogénese na presença de RANKL e de Factor estimulador de colónias de macrófagos (MCS-F), duas citoquinas produzidas pelos osteoblastos24 promovendo a reabsorção óssea.5
Trabalhos recentes sugerem que o sistema RANK/RANKL e a expressão de TNF-α são interdependentes. O TNF-α estimula a expressão de RANK e RANKL, acção que leva à estimulação do TNF-α por um mecanismo do tipo feedback positivo. Apesar de alguns estudos animais mostraram que o RANKL é um estímulo fraco para a osteoclastogénese, há evidência de que quer o RANKL quer o TNF-α são necessários e têm uma acção sinérgica.22
Pode ocorrer sobre-expressão de RANKL na presença de factores de reabsorção óssea, tais como corticóides, 1α,25-dihidroxivitamina D3 (1α,25(OH)2D3), hormona paratiroideia (PTH), interleucinas 1, 6, 11 e 17, TNF-α e prostaglandina E2.24,25
A homeostase do osso depende do equilíbrio entre o efeito do RANKL e o seu bloqueio pela osteoprotegerina (OPG). A OPG deriva maioritariamente dos monócitos/macrófagos e é controlada por várias citocinas pró-inflamatórias.5 A OPG também pertence à superfamília dos receptores TNF e é um antagonista solúvel do RANKL, ao inibir competitivamente a ligação deste aos seus receptores.21
Uma vez que as células T activadas desempenham um papel central na DII,26 é provável que o sistema RANKL-OPG contribua para a perda óssea nesta doença.7,15
Estudos recentes, sugerem um efeito directo dos corticóides na remodelagem óssea, por aumentarem o RANKL ao mesmo tempo que inibem a produção de OPG.5,7 Mesmo doses baixas (<10mg prednisolona/dia), aumentam a actividade dos osteoclastos e
12 suprimem a actividade dos osteoblastos.5
Os corticóides também aumentam o catabolismo da vitamina D, diminuem a absorção gastrointestinal e aumentam a excreção urinária de cálcio, com subsequente hiperparatiroidismo secundário e suprimem produção de hormonas suprarrenais e sexuais em ambos os sexos.5 Assim, apesar dos corticóides diminuirem a inflamação sistémica,10 o balanço final é um defeito qualitativo na resistência óssea e um defeito quantitativo na densidade mineral óssea, conduzindo a um risco aumentado de fractura.5 Não parece haver uma dose completamente segura de corticóides mas, sabe-se que doses mais elevadas e ciclos terapêuticos com duração superior a 3 meses, condicionam um risco elevado de osteoporose e fractura.5
Figura 1: Efeito das citocinas pró-inflamatórias e dos corticosteroides na osteoclastogénese. Adaptado de Abreu et all, Treatment With Infliximab Is Associated With Increased Markers of Bone Formation in Patients With Crohn’s Disease.10
Material e Métodos
Para a realização desta revisão, foi feita uma pesquisa em duas bases dados, Pubmed e Google Scholar, utilizando os seguintes termos de busca: “Crohn’s disease”, “antiTNF-α agents OR infliximab OR adalimumab”, “bone turnover markers”, “osteoporosis”, “osteopenia” e “fracture risk”, para artigos escritos em inglês a partir
13 do ano 2000. Foi feita uma pesquisa manual de artigos relacionados com o tema ou referenciados em artigos pertinentes para a realização do trabalho.
A informação extraída dos artigos inclui a variação dos marcadores de remodelagem óssea e/ou a variação da DMO após terapêutica com um antagonista do TNF-α bem como eventuais factores confundidores, como a actividade da doença ou outras terapêuticas concomitantes.
Resultados
Terapêutica com infliximab, marcadores de remodelagem óssea e DMO O infliximab (Remicade®) é um anticorpo monoclonal quimérico da classe IgG1, com elevada afinidade e especificidade para o TNF-α e foi o primeiro agente biológico a ser aprovado para tratamento da DC.23 Os doentes dependentes ou resistentes aos corticóides e os doentes com doença moderada a severa refractária são candidatos a esta terapêutica com o objectivo de obter e manter remissão clínica, endoscópica e histológica.7,8,27
Em 2004 surgiram os primeiros estudos a sugerir um efeito positivo do bloqueio do TNF-α no metabolismo do osso. Franchimont et al.8 estudaram 71 pacientes com DC corticodependente ou refractária às terapêuticas convencionais, até então nunca expostos a infliximab e compararam-nos a 68 controlos saudáveis. A amostra incluía 50 pacientes com doença luminal, tratados com uma infusão única de 5 mg/kg de infliximab e 21 pacientes com doença fistulizante, tratados com três infusões de 5mg/kg de infliximab. No início do estudo e quatro semanas após completar terapêutica com infliximab avaliaram-se os níveis de proteína C reactiva (PCR) e a actividade da doença, com base no Índice de Actividade da Doença de Crohn (CDAI). No início do estudo e oito semanas após o fim do tratamento, foram medidos três marcadores serológicos de formação óssea, fosfatase alcalina óssea (b-ALP), osteocalcina (OC), colagénio pró-péptido N tipo 1 (P1NP) e um marcador serológico de reabsorção óssea, telopró-péptido carboxiterminal serológico (sCTx). Os níveis de marcadores de formação óssea dos doentes foram comparados com uma população controlo de indivíduos saudáveis e verificou-se que antes do tratamento os níveis destes marcadores eram inferiores no grupo com DC e 8 semanas após completar a terapêutica os níveis eram semelhantes nos dois grupos. Os autores definiram como melhoria um aumento de pelo menos 30%
14 nos marcadores de formação óssea após infliximab, o que se verificou em 30%, 61% e 47% dos pacientes considerando os níveis de b-ALP, OC e P1NP, respectivamente. Da mesma forma, consideraram como melhoria uma diminuição de pelo menos 30% no marcador de reabsorção óssea, a qual se verificou em 38% dos doentes após infliximab. Os dados deste estudo mostraram uma rápida e significativa normalização nos marcadores bioquímicos de remodelagem óssea após terapêutica com infliximab na DC. A melhoria nos marcadores de remodelagem óssea foi independente das características clínicas da doença, número de infusões de infliximab, resposta clínica (variação do CDAI) ou biológica (diminuição da PCR) a este agente e desmame de corticóides. No mesmo ano, Ryan et al.20 fizeram um estudo prospectivo com 24 doentes com DC refractária tratados pela primeira vez com infliximab (5mg/kg). Neste estudo foi considerada a resposta dos pacientes ao infliximab baseada na variação do CDAI. No início do estudo, 42% dos doentes estavam sob corticoterapia e 50% estavam a fazer suplementação com cálcio e vitamina D. Foram avaliados cinco intervalos temporais desde o momento pré-infusão e até às 18 semanas pós-infusão única de infliximab. A terapêutica com infliximab associou-se a um aumento significativo nos marcadores de formação óssea (b-ALP e OC), mantido nos 4 meses pós-infusão. Apesar do valor de telopeptido-N serológico (sNTX), um marcador de reabsorção óssea, ter diminuído no período de 4 meses após a infusão de infliximab, a variação não obteve significado estatístico. O benefício para o metabolismo ósseo foi independente da resposta clínica ao infliximab, contudo, este estudo mostrou uma tendência (sem significado estatístico) para níveis superiores de marcadores de formação óssea e níveis inferiores de marcadores de reabsorção óssea em doentes que responderam ao infliximab quando comparados com não-respondedores. Destaca-se ainda que a redução máxima do CDAI ocorreu entre a oitava e décima semanas, enquanto os marcadores de formação óssea aumentaram continuamente até à décima sexta semana após o tratamento, sugerindo um atraso no efeito do infliximab sobre o metabolismo ósseo.
No seguimento destes dois trabalhos, Abreu et al.10 realizaram um estudo prospectivo de curta duração (2 anos), envolvendo 38 pacientes com DC activa, onde reportaram um aumento significativo da formação óssea (b-ALP) 4 semanas após infusão única de infliximab, enquanto a reabsorção óssea (sNTx) não variou de forma significativa. Foram ainda analisados os níveis séricos de cálcio, que tiveram um aumento significativo, os níveis de hormona paratiroideia imunorreactiva (iPTH), que diminuiu de forma significativa e os níveis de citocinas pró-inflamatórias (IL-1α, IL-6 e TNF-α),
15 que não variaram de forma significativa. Apesar dos achados encontrados neste estudo não terem sido comparados com um grupo controlo, foram analisados em detalhe o efeito dos corticóides e a resposta clínica baseada no CDAI. 58% dos doentes estavam sob corticoterapia quando iniciaram infliximab e o que se verificou foi um aumento na formação óssea quer os indivíduos estivessem sob corticoterapia quer não, concluindo-se assim que o uso de corticóides poderá não concluindo-ser a principal causa de osteoporoconcluindo-se na DC. Tal como nos estudos acima referidos, houve um efeito positivo nos marcadores de formação óssea nos respondedores e nos não respondedores ao infliximab, corroborando um efeito do infliximab no metabolismo ósseo independente da resposta clínica.
Miheller et al.28 por sua vez, trataram 27 pacientes com DC fistulizante, com 3 ciclos de infliximab e mediram os níveis séricos de OC e b-CrossLaps (bCL), um marcador de reabsorção óssea. Neste estudo de curta duração (42 dias), considerou-se como resposta clínica ao infliximab, um encerramento de pelo menos 50% das fístulas. No início do estudo, os valores de OC e bCL do grupo controlo diferiam dos valores do grupo com doença activa mas, no final do estudo, não se verificou uma diferença significativa entre os dois grupos. No entanto, enquanto nos estudos anteriores o efeito do infliximab sobre o osso parecia independente da resposta clínica, neste grupo de doentes com doença fistulizante constatou-se o contrário, ao verificar-se uma melhoria significativa nos marcadores ósseos apenas no grupo respondedor.
Os quatro estudos citados têm em conta a variação dos marcadores de remodelagem óssea após terapêutica com infliximab, mas não avaliam a repercussão desta terapêutica na DMO. Até à data, a evidência na literatura é escassa no que se refere ao efeito do infliximab na DMO em pacientes com DC. Pazianas et al.29 analisaram retrospectivamente 61 pacientes com DC e baixa DMO (osteopénia e osteoporose), no que respeita ao efeito do infliximab, bifosfonatos e corticóides na DMO. A duração entre a primeira e a segunda densitometrias rondou os dois anos. Verificou-se que qualquer doente sob bifosfonatos melhorava a DMO, independentemente do uso de corticóides e que o infliximab em monoterapia não tinha um efeito significativo no aumento da DMO. Ainda assim, entre os paciente tratados com bifosfonatos, houve uma melhoria superior da DMO se tratadados simultanemante com infliximab comparativamente aos doentes tratados apenas com bifosfonatos. Este efeito positivo do infliximab na DMO dos doentes tratados com bifosfonatos só se verificou na ausência de corticoterapia concomitante. Este foi o primeiro estudo a relacionar os efeitos do
16 infliximab em combinação com bifosfonatos e sugere um benefício da adição de infliximab à terapêutica com bifosfonatos.
Bernstein et al.30 avaliaram o impacto da terapêutica de manutenção com infliximab na DMO de 46 pacientes com DC (17 dos quais apresentavam doença fistulizante). Para isso, mediram a DMO antes da terapêutica com infliximab e ao fim de um ano de tratamento (5 mg/kg em intervalos de 6-8 semanas) e verificaram um aumento significativo quer na coluna lombar (DMO aumentou 2.4%±0.7%) quer na anca esquerda (DMO aumentou 2.8%±1.2% no trocânter e 2.6%±0.7% no colo do fémur). No início do estudo, 43% e 46% dos pacientes apresentavam redução da DMO (T-score≤−1) na coluna lombar e na anca esquerda respectivamente, tendo-se verificado que a taxa de ganho ósseo não diferia de forma significativa entre o grupo com e sem osteopenia. Não foi encontrada relação com idade, sexo, ressecção intestinal prévia, tabagismo, variação da proteína C reactiva, suplementação com cálcio e vitamina D, corticóides ou terapia imunomodeladora concomitantes. Ao fim de um ano todos os pacientes apresentavam melhoria clínica e 93% estavam em remissão da doença (CDAI < 150).
Mauro et al.,31 num estudo retrospectivo, compararam 15 pacientes com DC tratados pela primeira vez com infliximab (5mg/kg, em intervalos de 4-8 semanas), submetidos a DEXA antes e durante o tratamento com infliximab, com 30 pacientes com DC nunca expostos a infliximab, com duas avaliações densitométricas com pelo menos 12 meses de intervalo. Entre os factores confundidores analisados neste estudo encontram-se idade, sexo, idade no diagnóstico, anos de doença, peso corporal final, variação de peso, uso concomitante de bisfosfonato ou corticóides e atividade da doença.
Na primeira DEXA do grupo que viria a ser tratado com infliximab, foi diagnosticada osteopenia em 46% dos doentes e osteoporose em 20%, enquanto no grupo controlo 26,6% apresentavam osteopenia e 10% osteoporose. Na segunda DEXA, a osteopenia estava presente em 33% e a osteoporose em 6,6% dos pacientes do grupo tratado, enquanto no grupo não tratado os valores se mantiveram nos 26,6% para a osteopenia e 10% para a osteoporose. O grupo tratado com infliximab demonstrou aumentos significativos na DMO, área óssea lombar e conteúdo mineral ósseo (BMC) comparativamente ao grupo controlo e quando se analisaram apenas doentes com osteopenia ou osteoporose na primeira DEXA, o grupo tratado com infliximab continuava a demonstrar aumentos significativos na DMO, área óssea lombar e BMC.
17 Um subgrupo da população controlo que foi tratado com corticóides entre as duas densitometrias foi comparado com o grupo de doentes que recebeu infliximab. Não foram encontradas diferenças significativas entre os dois grupos na primeira ou na segunda DMO lombar, mas verificou-se um aumento significativo da BMC lombar no grupo tratado com infliximab.
Foram ainda comparados 13 indivíduos do grupo controlo com sinais de atividade de doença com o grupo tratado com infliximab. Não foram encontradas diferenças significativas na primeira e segunda medições da DMO lombar, no T-score ou Z-score mas no subgrupo com doença activa verificou-se um aumento significativamente menor no BMC lombar comparativamente ao grupo tratado com infliximab. Foi concluido então que a terapêuticacom infliximab aumentou significativamente a DMO independentemente da corticoterapia ou actividade da doença.
Não é consensual como a resposta clínica e biológica ao infliximab influencia o seu efeito sobre o osso. Reffitt et al.32 constataram que pacientes com DC em remissão clínica apresentavam um Z-score superior no colo do fémur e coluna lombar quando comparados com pacientes com doença activa e que o aumento do Z-score se correlacionava com a duração da remissão. Para este estudo, os autores consideraram como remissão não apenas poucos sintomas (<3 dejecções/dia), mas também ausência de necessidade de corticóides. Assim, os doentes que entraram em remissão com azatioprina estavam livres dos dois principais determinantes da densidade óssea, nomeadamente a actividade da doença e os corticóides.
Também noutras patologias como a Artrite Reumatóide (AR) e as Espondiloartropatias, o tratamento com antagonistas do TNF-α, tem demonstrado não só diminuição significativa na actividade destas doenças, mas também um efeito positivo sobre o osso, ao diminuir a perda óssea. A maioria dos estudos indica uma melhoria da DMO,33–38 associada à diminuição dos marcadores de reabsorção óssea.33–35 No caso da AR, patologia largamente estudada, o efeito protector do osso parece ser independente da resposta clínica aos antiTNF-α, com não-respondedores a demonstrarem também melhoria da DMO.39 No maior estudo controlado e randomizado do efeito antiTNF-α na DMO, doentes com Espondilite Anquilosante (EA) que receberam infliximab mostraram aumentos significativos da DMO ao longo de 2 anos comparativamente a um grupo placebo. Embora outras correlações significativas tenham sido observadas entre a DMO e os biomarcadores de remodelagem óssea, níveis basais elevados de OC e aumentos de b-ALP associaram-se ao aumento da DMO.40 Tal como os referentes à DC
18 estes estudos apresentam um período de seguimento inferior a 2 anos e não avaliam o risco de fractura.
Sugimoto et al.41, num estudo prospectivo recente, envolvendo 40 pacientes com DC, 80 com CU e 65 indivíduos saudáveis, mostraram que o T-score é mais baixo na DC e na CU quando comparado com o grupo controlo, e que o Z-score é mais baixo na DC, mas não na CU quando comparado com o grupo controlo. Os marcadores do metabolismo ósseo, b-ALP (marcador de formação óssea), NTx (marcador de reabsorção), forma activa da vitamina D (1,25-(OH)2D) e osteocalcina subcarboxilada (ucOC), mostraram-se significativamente aumentados nos pacientes com DC, mas não na CU em relação ao grupo controlo. Em relação ao efeito do infliximab, no grupo com DC, o T-score e o Z-score não diferiram no grupo tratado quando comparados com o grupo não tratado. A osteocalcina subcarboxilada (ucOC) mostrou-se significativamente aumentada na DC independentemente da terapêutica com infliximab, mas o nível de significância foi mais forte no grupo sob infliximab. Também o NTx (marcador de reabsorção óssea) se mostrou significativamente aumentado nos pacientes com DC sob infliximab comparativamente aos não tratados. Para além destes achados, verificou-se uma relação negativa entre os níveis de NTx e o T-score nos pacientes com DC, especialmente se tratados com infliximab, observando-se que ao longo de 6 meses de terapêutica o T-score tendencialmente diminuiu. O achado mais importante deste estudo e que contraria os resultados dos estudos supracitados é a possibilidade dos doentes com DC sob infliximab apresentarem um aumento de reabsorção óssea.
A formação óssea pelos osteoblastos envolve a gamacarboxilação da osteocalcina. Quando a gamacarboxilação é mais baixa do que o normal, a OC é subcarboxilada e tem uma afinidade mais baixa para a hidroxiapatite. As concentrações séricas de ucOC têm uma correlação inversa com as concentrações de vitamina K, sendo considerada um marcador sensível da reserva de vitamina K no osso.42
Pacientes com DC apresentam níveis superiores de ucOC (relativamente a indivíduos saudáveis ou com CU), sugerindo défice de vitamina K.43 Não é consensual na literatura se a concentração sérica de ucOC se relaciona inversamente com a DMO42 ou se são independentes.43 Em publicações anteriores, a vitamina K mostrou inibir o processo inflamatório44 e recentemente estabeleceu-se uma correlação entre os níveis séricos de ucOC e o CDAI na DC.43 Já as concentração sérica de 1,25-(OH)2D encontra-se diminuída na DC, mas este aspecto não se correlaciona de forma significativa com a DMO ou com o CDAI.43
19 Quanto ao risco de fractura em doentes sob antagonista do TNF-α há pouca informação disponível até à data. Kawai et al.45 testaram a hipótese de que iniciar um antiTNF-α reduzia o risco de fractura comparativamente a terapêuticas não biológicas em pacientes com doenças auto-imunes (DII, AR, psoríase, artrite psoriática e EA) e verificaram que o risco de fractura não diferiu entre o grupo exposto a terapêutica biológica e não biológica. Entre os pacientes com DII, a incidência de fracturas combinadas entre os indivíduos tratados pela primeira vez com infliximab/adalimumab não foi significativamente diferente dos tratados com azatioprina/6-mercaptonútria após ajuste para o uso de corticóides. Entre os indivíduos com DII tratados com corticosteroides no início do estudo, não foi encontrado um aumento significativo do risco de fractura quando comparado com o restante grupo. Contrastando, entre os pacientes com AR, doses superiores a 10 mg revelaram aumentar o risco de fractura.
Terapêutica com infliximab e Sistema RANKL/OPG
Tem sido demonstrado nos últimos anos, um aumento da OPG sérica em populações saudáveis ao longo da vida, com um aumento mais acentuado a partir dos 60 anos nas mulheres e dos 70 anos nos homens.46–48 Indivíduos com Colangite Biliar Primária e Hepatite C crónica, ambas associadas a risco aumentado de fractura, apresentam níveis séricos de OPG aumentados.46,49 Na Doença Hepática crónica, os níveis séricos de OPG não se correlacionam com a DMO, mas correlacionam-se directamente com a resposta inflamatória activa.46,49 Na Artrite Reumatóide (AR) os níveis séricos de OPG correlacionam-se directamente com a Velocidade de Sedimentação, apoiando a hipótese de que os níveis de OPG sérica poderão ser influenciados pela resposta inflamatória sistémica.46,50
O nível aumentado de OPG nas patologias referidas e na DC pode parecer paradoxal uma vez que a interferência da OPG na diferenciação dos osteoclastos deveria conferir protecção ao esqueleto, e o que se verifica nestas patologias é uma perda de massa óssea acelerada e um risco aumentado de fractura. É sugerido portanto que o aumento de OPG represente uma resposta contra-regulatória e protectora face ao efeito deletério da inflamação no metabolismo ósseo.46
A OPG pode ser produzida por uma variedade de tecidos e células além dos osteoblastos.46 Collin-Osdoby et al.51 demonstraram que a activação de células endoteliais microvasculares por citocinas pro-inflamatórias provoca uma sobrexpressão
20 de OPG e de RANKL. Há vários anos, surgiu na literatura evidência que sugeria a vasculite da microcirculação intestinal como um processo patogénico primário na DC, após se constatar que a maioria dos granulomas se formavam dentro das paredes dos vasos sanguíneos.52 Deste modo, a elevação da OPG sérica na DC poderá reflectir a liberação vascular de OPG em resposta à inflamação.46 Recentemente, Vidal et al.53 demostraram ainda que a OPG é constitutivamente produzida por células epiteliais intestinais e regulada pelo TNF-α e pode ser importante na imunorregulação da mucosa e na fisiologia óssea.
Apenas um grupo de trabalho avaliou o efeito do infliximab sobre os níveis de marcadores da osteoclastogénese (OPG e RANKL). Miheller et al.21 estudaram 29 pacientes com DC refratactária, dos quais 19 apresentavam doença fistulizante. Antes de iniciar infliximab dosearam os níveis serológicos de OPG, sRANKL, OC e b-CL e avaliaram a DMO. Concentrações mais elevadas de OPG circulante na DC em relação a populações saudáveis, já tinham sido demostradas previamente.46 Neste estudo,21 após 3 infusões de infliximab (semanas 0, 2 e 6) verificaram-se, ao longo de 42 dias, concentrações decrescentes de b-CL (marcador de reabsorção óssea) e OPG (antagonista solúvel de um dos principais activadores da osteoclastogénese, RANKL), possivelmente devido aos efeitos anti-inflamatórios do infliximab. Estas alterações foram particularmente observadas nos doentes respondedores à terapêutica face aos não respondedores. Contrariamente, as concentrações de OC (marcador de formação óssea) e sRANKL aumentaram após infliximab. Quanto à DMO, na cabeça do fémur correlacionou-se com os níveis basais de sRANKL e b-CL, enquanto na coluna lombar não se conseguiu estabelecer uma correlação significativa com os marcadores de remodelagem óssea ou de osteoclastogénese.21
O RANKL é produzido por células T activadas e pode ligar-se à membrana dos osteoclastos (mRANKL) ou permanecer livre em circulação (sRANKL). A libertação do RANKL da membrana celular é determinada por metaloproteases25 e é reconhecido que o infliximab tem capacidade de modificar a actividade de diferentes subgrupos de metaloproteases. Ao mesmo tempo, a OPG pode suprimir a libertação de mRANKL dos osteoblastos.24 Assim, a concentração elevada de sRANKL pode reflectir a diminuição da OPG sérica. Estes mecanismos poderão explicar o aumento do sRANKL após infliximab.
21 Terapêutica com adalimumab
O adalimumab (Humira®) é um anticorpo monoclonal humano, da classe IgG1, específico para o TNF-α. Veerappan et al.,54 realizaram um estudo prospectivo, envolvendo 20 pacientes com DC que iniciaram adalimumab por ausência/perda de resposta à terapêutica convencional ou ao infliximab, comparando-os com 20 indivíduos saudáveis. Foi feito um regime de indução com adalimumab, via subcutânea, com 160mg na semana 0, 80mg na semana 2 e 40mg nas semanas seguintes. Durante os 6 meses de seguimento, os marcadores de formação óssea, OC e P1NP, aumentaram significativamente no primeiro e terceiro meses em comparação com o valor pré-tratamento, mas não se verificou o mesmo ao sexto mês. O marcador de reabsorção óssea, CTx, diminuiu no primeiro mês em relação ao valor inicial e permaneceu diminuído nos seis meses de seguimento, no entanto esta diminuição não atingiu significado estatístico. A concentração sérica de OC antes do tratamento com adalimumab era menor nos pacientes com DC relativamente ao grupo controlo, mas após tratamento atingiu níveis normais. As citocinas pró-inflamatórias, TNF-α, IL-1β e IL-6, não variaram de forma significativa nos 6 meses de seguimento. No início do estudo, os níveis de OPG e RANKL eram superiores na DC quando comparados com o grupo controlo, como já observado em estudos anteriores.21,46 Após terapêutica com adalimumab, os níveis diminuíram para níveis semelhantes entre os dois grupos.54 Estes efeitos foram independentes à exposição prévia a infliximab, terapia concomitante com corticóides e resposta biológica ao adalimumab.
Para além do efeito do adalimumab in vivo, estes autores testaram o efeito desta terapêutica nos osteoblastos in vitro.54
A exposição dos osteoblastos ao soro de pacientes com DC pós-tratamento com adalimumab mostrou consistentemente níveis superiores de células viáveis em comparação com osteoblastos expostos a soro do grupo controlo (indivíduos saudáveis). A viabilidade dos osteoblastos expostos a soro pré-tratamento foi superior e provavelmente traduz uma contra-resposta à inflamação. Estes resultados sugerem um efeito do adalimumab na actividade osteoblástica. No entanto, mais importante do que a viabilidade celular dos osteoblastos isoladamente, é a diferenciação e funcionalidade dos osteoblastos.
A fosfatase alcalina (b-ALP) é um marcador da diferenciação inicial dos osteoblastos e auxilia na formação óssea. Embora a maior viabilidade dos osteoblastos tenha sido
22 demonstrada com o soro pré-tratamento, a quantidade de b-ALP secretada foi significativamente menor nestes osteoblastos em comparação ao grupo controlo. O soro pós-adalimumab também promoveu níveis mais elevados de secreção de b-ALP do que o soro pré-tratamento. A b-ALP é um marcador de diferenciação precoce dos osteoblastos e os níveis mais elevados encontrados após tratamento com adalimumab, indicam melhoria da sua funcionalidade. Isto sugere que o tratamento com adalimumab tem um efeito directo nos osteoblastos humanos in vitro e que o aumento dos marcadores de formação óssea identificados in vivo são provavelmente o reflexo deste efeito benéfico.
Discussão
Apesar do uso generalizado de tratamentos biológicos em doenças inflamatórias, existem dados limitados sobre o efeito dos antiTNF-α no metabolismo ósseo na DC. A descoberta de que pacientes com DC com diagnóstico recente apresentam diminuição da DMO11,12,14 e níveis aumentados de citocinas inflamatórias,5 particularmente TNF-α, sugere que mediadores produzidos durante a inflamação intestinal, podem desempenhar uma papel importante na função osteoblástica e na formação óssea. Os níveis de marcadores de formação óssea (b-ALP, OC e P1NP) encontrados na DC são inferiores aos níveis encontrados nos indivíduos saudáveis.8 O TNF-α inibe a expressão de RUNX2-cbfa1,8 um factor nuclear de transcrição necessário à diferenciação dos osteoblastos, podendo o seu bloqueio explicar a melhoria significativa dos marcadores de formação óssea (b-ALP, OC e P1NP) após terapêutica com infliximab ou adalimumab,10,20,54 atingindo níveis semelhantes aos indivíduos saudáveis.8,28
O TNF-α actua directamente nos osteoclastos ao induzir a diferenciação, activação e inibição da apoptose5,21 e indirectamente, ao estimular os osteoblastos a produzirem IL-6, que amplifica a acção dos osteoclastos10 e por conseguinte a reabsorção óssea. Mais uma vez o bloqueio desta citocina pode explicar a diminuição dos níveis de marcadores de reabsorção óssea (sCTx e sNTX) após terapêutica,8 embora esta diminuição não tenha atingido significado estatístico em todos os estudos.10,20
Os resultados parecem independentes da resposta clínica (variação do CDAI), biológica (variação PCR) e corticoterapia concomitante na DC não fistulizante,8,10,20 enquanto na DC fistulizante apenas se verificou uma melhoria significativa nos marcadores ósseos no grupo respondedor.28
23 Pacientes com DC em remissão clínica apresentam um Z-score superior quando comparados com pacientes com doença activa e o aumento do Z-score correlaciona-se com a duração da remissão.32 Paradoxalmente, a melhoria da DMO após infliximab parece independente da resposta biológica (variação PCR), resposta clínica (variação do CDAI) e da corticoterapia concomitante.30,31 Na subanálise de doentes com osteopenia ou osteoporose diagnosticada antes de infliximab, continua a verificar-se um aumento significativo da DMO.31 Também noutras patologias como a Artrite Reumatóide e as Espondiloartropatias, o tratamento com antagonistas do TNF-α, tem demonstrado não apenas uma diminuição da actividade destas doenças, mas também uma melhoria da DMO, com diminuição dos marcadores de reabsorção óssea, independentemente da resposta clínica à terapêutica.33–35,38–40
Como é sabido os bifosfonatos melhoram a DMO. A associação de infliximab a esta terapêutica trouxe um benefício adicional (na ausência de corticoterapia concomitante), verificando-se uma melhoria superior da DMO no tratamento simultâneo com estes dois fármacos comparativamente ao uso isolado de bifosfonatos.29
Apenas um estudo apresenta resultados discrepantes. Sugimoto et al.41 mostraram que T-score e o Z-score não diferiram nos doentes com DC sob e sem terapêutica com infliximab. A osteocalcina subcarboxilada (ucOC), marcador sensível das reservas de vitamina K no osso, mostrou-se significativamente aumentada na DC independentemente da terapêutica com infliximab, mas o nível de significância foi mais forte no grupo sob infliximab. O NTx (marcador de reabsorção óssea), ao contrário dos resultados anteriores, mostrou-se significativamente aumentado nos pacientes com DC sob infliximab comparativamente aos não tratados e, apesar de não atingir significado estatístico, o NTx apresentou um relação negativa com o T-score, o qual tendencialmente diminuiu ao longo de 6 meses de terapêutica. Este estudo alerta para a possibilidade dos doentes com DC sob infliximab apresentarem um aumento da reabsorção óssea, ao contrário do que mostra a restante evidência disponível.
Pacientes com DC têm níveis superiores de OPG relativamente a indíviduos saudáveis. Níveis elevados de OPG (antagonista solúvel de um dos principais activadores da osteoclastogénese, RANKL) deveria conferir uma protecção adicional ao osso mas, paradoxalmente, o que se verifica na DC é uma diminuição acelerada da massa óssea. Não se sabe ao certo o que causa a sobrexpressão de OPG nestes doentes mas poderá reflectir uma resposta contra-regulatória e protectora do organismos face ao efeito deletério da inflamação sistémica,46 resultar da ativação endotelial por citocinas
24 inflamatórias51 ou do aumento da síntese pelas células epiteliais intestinais por ação do TNF-α.53
Após o início de infliximab e adalimumab verificou-se uma descida dos níveis de OPG,21,54 e no caso do infliximab, estas alterações foram particularmente observadas nos doentes respondedores à terapêutica. Contrariamente, o RANKL aumentou após início do infliximab. O RANKL existe em duas formas, ligado à membrana dos osteoclastos (mRANKL) e livre em circulação (sRANKL) e sabe-se que o infliximab pode modificar a actividade das metaloproteases responsáveis pela libertação do RANKL da membrana celular. Ao mesmo tempo, a OPG pode suprimir a libertação de mRANKL dos osteoblastos.24 Assim, a concentração elevada de sRANKL pode reflectir a diminuição da OPG sérica.
Quanto ao risco de fractura em doentes sob antagonista do TNF-α há pouca informação disponível, mas até à data os dados apontam para na DII e outras doenças auto-imunes, o risco de fractura ser independente da exposição a terapêutica biológica. Entre os pacientes com DII, a incidência de fracturas entre os novos usuários de infliximab/adalimumab não foi significativamente maior do que os novos usuários de azatioprina/6-mercaptonútria.45
O efeito do adalimumab foi testado em osteoblastos em cultura e o que se verificou foi que osteoblastos expostos a soro pré-tratamento apresentam um viabilidade superior aos expostos a soro pós-tratamento e soro de indivíduos saudáveis, traduzindo uma provável contra-resposta dos osteoblastos à inflamação e efeito do adalimumab na actividade osteoblástica. No entanto, mais importante do que a viabilidade celular, é a diferenciação e função dos osteoblastos. A fosfatase alcalina (b-ALP) é um marcador da diferenciação inicial dos osteoblastos e os osteoblastos expostos a soro pós-tratamento secretaram níveis superiores de b-ALP comparativamente a soro pré-tratamento e de indivíduos saudáveis, indicando efeito positivo do adalimumab sobre a actividade osteoblástica.54
Apesar da melhoria clínica da DC e melhoria dos marcadores de remodelagem óssea e DMO após infliximab e adalimumab, não se verificou uma variação significativa dos níveis de citocinas pró-inflamatórias (IL-1α, IL-6 e TNF-α),10,54 o que sugere que haverá outras citocinas e outros mecanismos também envolvidos neste processo.
Existem limitações importantes no que respeita ao desenho dos estudos,7 uma vez que nenhum estudo é randomizado, os dados publicados dizem respeito a amostras de pequena dimensão (a maior com 71 doentes) e o tempo de seguimento é curto (até dois
25 anos). Destaca-se ainda a heterogeneidade dos trabalhos publicados, particularmente em relação à caracterização dos doentes envolvidos, à actividade da doença de base, à presença de osteopenia/osteoporose, bem como terapêutica concomitante com corticóides ou suplementos de cálcio e vitamina D. Apesar da maioria dos estudos realizados até à data apontarem para um efeito positivo do infliximab na remodelagem óssea (com aumento dos marcadores de formação e/ou diminuição dos marcadores de reabsorção óssea), nenhum relaciona directamente os marcadores de remodelagem óssea ou valores de DMO com taxas de fractura.
Os marcadores de remodelagem óssea reflectem o volume total de osso formado e reabsorvido e correlacionam-se com a taxa de perda óssea e fragilidade. Em mulheres pós-menopáusicas mostraram relacionar-se com o risco de fractura de forma independente da DMO.55 No entanto, esta relação ainda não foi validada em doentes com osteoporose e DII, pelo que os dados não podem ser imediatamente extrapolados já que a variação destes marcadores é influenciada pelos diferentes mecanismos subjacentes à perda óssea.55 De facto, em contraste com a osteoporose pós-menopáusica em que os marcadores de formação e reabsorção são frequentemente elevados, os estudos na DC mostraram principalmente níveis normais de formação óssea com aumento da reabsorção óssea.55 O valor preditivo dos marcadores ósseos para o risco de fractura em pacientes com DII requer investigação adicional, bem como da DMO e de factores clínicos independentes como idade, corticoterapia e fractura de fragilidade prévia.
Apesar de não se saber o mecanismo exacto pelo qual os antiTNF-α melhoram os marcadores de formação óssea e a DMO, os resultados foram semalhantes para o infliximab e adalimumab, sugerindo que estas alterações deverão resultar de um efeito de grupo pelo bloqueio do TNF-α, um reconhecido activador da reabsorção óssea.
Conclusão
Os antiTNF-α têm demonstrado um efeito benéfico nos marcadores de remodelagem óssea e na DMO dos pacientes com DC. No entanto, o efeito desta terapêutica na arquitectura óssea e no risco de fractura permanece por esclarecer. São necessários estudos de coorte com mais pacientes e com tempo de seguimento mais longo, para determinar se se verifica uma efectiva redução do risco de fractura. O resultado da
26 cessação do infliximab/adalimumab no metabolismo ósseo está igualmente por determinar.
Agradecimentos
Muitas foram as pessoas com quem tive o prazer de partilhar o meu percurso como aluna da Faculdade de Medicina da Universidade de Lisboa. Ao longo destes 6 anos tive a sorte de me cruzar com colegas e docentes com competências humanas e científicas fantásticas.
Começo por deixar um agradecimento muito especial ao Dr. José Pedro Rodrigues por me ter despertado o interesse por este tema e pela sua dedicação e disponibilidade no acompanhamento deste trabalho.
Gostaria ainda de agradecer aos meus pais, irmãos e avós, pela força, estabilidade emocional e carinho que sempre me deram para viver estes 6 anos de faculdade com ânimo. Agradecer à tia e à prima, pela disponibilidade total para me ajudar em todo o meu percurso académico e por serem um exemplo a seguir no futuro. Agradecer ao Pedro pela paciência e companheirismo, à Sara e à Ana pela amizade e espírito de entreajuda, e ainda a todos os outros colegas que comigo partilharam este difícil mas tão entusiasmante processo de aprendizagem, que ainda agora começou.
27
Bibliografia
1. de Lange KM, Barrett JC. Understanding inflammatory bowel disease via immunogenetics. J Autoimmun. 2015;64:91-100.
2. Szigethy E, McLafferty L, Goyal A. Inflammatory Bowel Disease Historical Perspective, Epidemiology, and Risk Factors. Child Adolesc Psychiatr Clin N Am. 2010;19(2):301-318.
3. Burisch J, Munkholm P. The epidemiology of inflammatory bowel disease. Scand J Gastroenterol. 2015;50(8):942-951.
4. Longo, Fauci, Kasper, Hauser, Jameson, Loscalzo. Harrison’s Principles of Internal Medicine. In: 19th ed. New York: McGraw-Hill Education.; 2015:1947-1959.
5. Katz S, Weinerman S. Osteoporosis and gastrointestinal disease. Gastroenterol Hepatol. 2010;6(8):506-517.
6. Arden NK, Cooper C. Osteoporosis in patients with inflammatory bowel disease. Gut. 2002;50(5):9-10.
7. Veerappan SG, O’Morain CA, Daly JS, Ryan BM. Review article: The effects of antitumour necrosis factor-α on bone metabolism in inflammatory bowel disease. Aliment Pharmacol Ther. 2011;33(12):1261-1272.
8. Franchimont N, Putzeys V, Collette J, et al. Rapid improvement of bone metabolism after infliximab treatment in Crohn’s disease. Aliment Pharmacol Ther. 2004;20(6):607-614.
9. Bernstein CN, Leslie WD, Leboff MS. AGA technical review on osteoporosis in gastrointestinal diseases. Gastroenterology. 2003;124(3):795-841.
10. Abreu MT, Geller JL, Vasiliauskas EA, et al. Treatment with infliximab is associated with increased markers of bone formation in patients with Crohn’s disease. J Clin Gastroenterol. 2006;40(1):55-63.
11. Ghosh S, Cowen S, Hannan WJ, Ferguson A. Low bone mineral density in Crohn’s disease, but not in ulcerative colitis, at diagnosis. Gastroenterology.
28 1994;107(4):1031-1039.
12. Jahnsen J, Falch JA, Aadland E, Mowinckel P. Bone mineral density is reduced in patients with Crohn ’ s disease but not in patients with ulcerative colitis : a population based study. 1997;(April 2008):313-319.
13. Ardizzone S, Bollani S, Bettica P, Bevilacqua M, Molteni P, Bianchi Porro G. Altered bone metabolism in inflammatory bowel disease: there is a difference between Crohn’s disease and ulcerative colitis. J Intern Med. 2000;247(1):63-70. 14. Sakellariou GT, Moschos J, Berberidis C, et al. Bone density in young males
with recently diagnosed inflammatory bowel disease. Joint Bone Spine. 2006;73(6):725-728.
15. Tilg H, Moschen AR, Kaser A, Pines A, Dotan I. Gut, inflammation and osteoporosis: basic and clinical concepts. Gut. 2008;57(5):684-694.
16. Organization WH. Who Scientific Group on the Assessment of Osteoporosis at Primary Health Care Level. World Heal Organ. 2004;May(May 2004):5-7. 17. Monique Bethel, MD Resident Physician, Department of Internal Medicine
GRU. Osteoporosis. http://emedicine.medscape.com/article/330598-overview#showall. Accessed December 23, 2016.
18. Kanis JA, Oden A, Johansson H, Borgström F, Ström O, McCloskey E. FRAX® and its applications to clinical practice. Bone. 2009;44(5):734-743.
19. Stockbrügger RW, Schoon EJ, Bollani S, et al. Discordance between the degree of osteopenia and the prevalence of spontaneous vertebral fractures in Crohn’s disease. Aliment Pharmacol Ther. 2002;16(8):1519-1527.
20. Ryan BM, Russel MGVM, Schurgers L, et al. Effect of antitumour necrosis factor-α therapy therapy on bone turnover in patients with active Crohn’s disease: A prospective study. Aliment Pharmacol Ther. 2004;20(8):851-857.
21. Miheller P, Muzes G, Rácz K, et al. Changes of OPG and RANKL
concentrations in Crohn’s disease after infliximab therapy. Inflamm Bowel Dis. 2007;13(11):1379-1384.
29 22. Nanes MS. Tumor necrosis factor-α: molecular and cellular mechanisms in
skeletal pathology. 2003;321:1-15.
23. Lever E, Sheer D. TNF-mediated inflammatory disease. J Pathol. 2010;220(September):114-125.
24. Nakamichi Y, Udagawa N, Kobayashi Y, et al. Osteoprotegerin reduces the serum level of receptor activator of NF-kappaB ligand derived from osteoblasts. J Immunol. 2007;178(1):192-200.
25. Kanamaru F, Iwai H, Ikeda T, Nakajima A, Ishikawa I, Azuma M. Expression of membrane-bound and soluble receptor activator of NF-κB ligand (RANKL) in human T cells. Immunol Lett. 2004;94(3):239-246.
26. Targownik LE, Bernstein CN, Leslie WD. Inflammatory bowel disease and the risk of osteoporosis and fracture. Maturitas. 2013;76(4):315-319.
27. Dretzke J, Edlin R, Round J, et al. A systematic review and economic evaluation of the use of tumour necrosis factor-alpha (TNF-α) inhibitors, adalimumab and infliximab, for Crohn’s disease. Health Technol Assess (Rockv). 2011;15(6):1-250.
28. Miheller P, Muzes G, Zagoni T, Toth M, Racz K, Tulassay Z. Infliximab therapy improves the bone metabolism in fistulizing Crohn’s disease. Dig Dis.
2006;24(1-2):201-206.
29. PAZIANAS M. The Effect of Anti-TNF-α Therapy on Spinal Bone Mineral Density in Patients with Crohn’s Disease. Ann N Y Acad Sci. 2006;1068(1):543-556.
30. Bernstein M, Irwin S, Greenberg GR. Maintenance infliximab treatment is associated with improved bone mineral density in Crohn’s disease. Am J Gastroenterol. 2005;100(9):2031-2035.
31. Mauro M, Radovic V, Armstrong D. Improvement of lumbar bone mass after infliximab therapy in Crohn’s disease patients. Can J Gastroenterol.
2007;21(10):637-642.
30 Bone density improves with disease remission in patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol. 2003;15(12):1267-1273. 33. Wendling D. Body weight, body composition, and bone turnover changes in
patients with spondyloarthropathy receiving anti-tumour necrosis factor a treatment. J Rheumatol. 2005;32(7):1184-1185.
34. Chopin F, Garnero P, le Henanff A, et al. Long-term effects of infliximab on bone and cartilage turnover markers in patients with rheumatoid arthritis. Ann Rheum Dis. 2008;67(3):353-357.
35. Marotte H, Miossec P. Prevention of bone mineral density loss in patients with rheumatoid arthritis treated with anti-TNFα therapy. Biol targets Ther.
2008;2(4):663-669.
36. Allali F, Breban M, Porcher R, Maillefert JF, Dougados M, Roux C. Increase in bone mineral density of patients with spondyloarthropathy treated with anti-tumour necrosis factor alpha. Ann Rheum Dis. 2003;62(4):347-349.
37. Vis M, Havaardsholm EA, Haugeberg G, et al. Evaluation of bone mineral density, bone metabolism, osteoprotegerin and receptor activator of the
NFkappaB ligand serum levels during treatment with infliximab in patients with rheumatoid arthritis. Ann Rheum Dis. 2006;65(11):1495-1499.
38. Barnabe C, Hanley DA. Effect of Tumor Necrosis Factor Alpha Inhibition on Bone Density and Turnover Markers in Patients with Rheumatoid Arthritis and Spondyloarthropathy. Semin Arthritis Rheum. 2009;39(2):116-122.
39. Marotte H, Pallot-Prades B, Grange L, Gaudin P, Alexandre C, Miossec P. A 1-year case-control study in patients with rheumatoid arthritis indicates prevention of loss of bone mineral density in both responders and nonresponders to
infliximab. Arthritis Res Ther. 2007;9(3):R61.
40. Visvanathan S, van der Heijde D, Deodhar A, et al. Effects of infliximab on markers of inflammation and bone turnover and associations with bone mineral density in patients with ankylosing spondylitis. Ann Rheum Dis. 2009;68(2):175-182.
31 41. Sugimoto K, Ikeya K, Iida T, et al. An Increased Serum N-Terminal Telopeptide
of Type I Collagen, a Biochemical Marker of Increased Bone Resorption, Is Associated with Infliximab Therapy in Patients with Crohn’s Disease. Dig Dis Sci. 2016;61(1):99-106.
42. Veasy LG. Is vitamin K deficiency a risk factor for osteoporosis in Crohn ’ s disease? 2001;357:14-15.
43. Nakajima S, Iijima H, Egawa S, et al. Association of vitamin K deficiency with bone metabolism and clinical disease activity in inflammatory bowel disease. Nutrition. 2011;27(10):1023-1028.
44. Ohsaki Y, Shirakawa H, Hiwatashi K, Furukawa Y, Mizutani T, Komai M. Vitamin K Suppresses Lipopolysaccharide-Induced Inflammation in the Rat. Biosci Biotechnol Biochem. 2006;70(4):926-932.
45. Kawai VK, Grijalva CG, Arbogast PG, et al. Initiation of tumor necrosis factor-α antagonists and risk of fractures in patients with selected rheumatic and
autoimmune diseases. Arthritis Care Res. 2013;65(7):1085-1094.
46. Bernstein CN, Sargent M, Leslie WD. Serum osteoprotegerin is increased in Crohn’s disease: a population-based case control study. Inflamm Bowel Dis. 2005;11(4):325-330.
47. Szulc P, Hofbauer LC, Heufelder AE, Roth S, Delmas PD. Osteoprotegerin serum levels in men: Correlation with age, estrogen, and testosterone status. J Clin Endocrinol Metab. 2001;86(7):3162-3165.
48. Kudlacek S, Schneider B, Woloszczuk W, Pietschmann P, Willvonseder R. Serum levels of osteoprotegerin increase with age in a healthy adult population. Bone. 2003;32(6):681-686.
49. Horiguchi T, Takeshita K. High serum osteoprotegerin and low RANKL in primary biliary cirrhosis. Brain Dev. 2003;25(4):291-293.
50. M Skoumal, G Kolarz, W Woloszczuk, G Hawa AK. Serum osteoprotegerin but not receptor activator of NF-kB ligand correlates with Larsen score in rheumatoid arthritis. Ann Rheum Dis. 2004;63(2):209-210.
32 51. Collin-Osdoby P, Rothe L, Anderson F, Nelson M, Maloney W, Osdoby P.
Receptor activator of NF-kappa B and osteoprotegerin expression by human microvascular endothelial cells, regulation by inflammatory cytokines, and role in human osteoclastogenesis. J Biol Chem. 2001;276(23):20659-20672.
52. Wakefield A, Sankey E, Dhillon A, et al. Granulomatous vasculitis in Crohn’s disease. Gastroenterology. 1991;100(5):1279-1287.
53. Vidal K, Serrant P, Schlosser B, van den Broek P, Lorget F, Donnet-Hughes A. Osteoprotegerin production by human intestinal epithelial cells: a potential regulator of mucosal immune responses. Am J Physiol Gastrointest Liver Physiol. 2004;287(4):G836-44.
54. Veerappan SG, Healy M, Walsh BJ, et al. Adalimumab Therapy Has a Beneficial Effect on Bone Metabolism in Patients with Crohn’s Disease. Dig Dis Sci. 2015;60(7):2119-2129.
55. Compston JE. Can biochemical markers be used to screen patients with inflammatory bowel disease for osteoporosis? Eur J Gastroenterol Hepatol. 2002;14(6):587-589. http://www.ncbi.nlm.nih.gov/pubmed/12072590.