UNIVERSIDADE FEDERAL DA PARAÍBA
CENTRO DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E
TECNOLOGIA DE ALIMENTOS
TALIANA KÊNIA ALENCAR BEZERRA
POTENCIAL FUNCIONAL DE CRISTAS E BARBELAS DE
FRANGO: OBTENÇÃO E CARACTERIZAÇÃO DE
PEPTÍDEOS BIOATIVOS
JOÃO PESSOA - PB
TALIANA KÊNIA ALENCAR BEZERRA
POTENCIAL FUNCIONAL DE CRISTAS E BARBELAS DE
FRANGO: OBTENÇÃO E CARACTERIZAÇÃO DE
PEPTÍDEOS BIOATIVOS
JOÃO PESSOA - PB
TALIANA KÊNIA ALENCAR BEZERRA
POTENCIAL FUNCIONAL DE CRISTAS E BARBELAS DE
FRANGO: OBTENÇÃO E CARACTERIZAÇÃO DE
PEPTÍDEOS BIOATIVOS
Tese de Doutorado apresentado ao
Programa de Pós-graduação em
Ciência e Tecnologia de Alimentos,
do Centro de Tecnologia, da
Universidade Federal da Paraíba em
cumprimento aos requisitos para
obtenção do título de Doutor em
Ciência e Tecnologia de Alimentos.
Orientadora - Prof
a. Dra. Marta Suely Madruga
Co-orientadora - Prof
a. Dr
a. Maria Teresa Bertoldo Pacheco
JOÃO PESSOA - PB
B574p Bezerra, Taliana Kênia Alencar.
Potencial funcional de cristas e barbelas de frango: obtenção e caracterização de peptídeos bioativos / Taliana Kênia Alencar Bezerra. - João Pessoa, 2017.
104 f.: il.
-Orientadora: Marta Suely Madruga.
Coorientadora: Maria Teresa Bertoldo Pacheco. Tese (Doutorado) - UFPB/ CT
1. Tecnologia dos alimentos. 2. Frango - subprodutos. 3. Carne de frango – produção e consumo. 4. Colágeno. 5. Hidrolisado proteico. 6. Peptídeos antioxidantes. I. Título.
A Deus, pelo seu amor incondicional
A minha mãe, Penha Bezerra, pelas suas orações e seu amor
Ao meu marido, Igor Costa, por seu amor e companheirismo
AGRADECIMENTOS
A Deus, pela vida e pela força para enfrentar todas as dificuldades.
A Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela bolsa concedida.
Ao Programa de Pós-graduação em Ciência e Tecnologia de Alimentos, a todos os professores que o compõem e a secretária, Lindalva, por todo apoio e dedicação.
A Profa. Dra. Marta Suely Madruga, pela excelente orientação, pela oportunidade de realização deste trabalho, confiança, por todo o conhecimento repassado e por todo carinho e amizade. Obrigada.
A Profa. Dra. Maria Teresa Bertoldo Pacheco, pela co-orientação, correções e principalmente pelo apoio e dedicação da execução desta tese. Obrigada.
A minha mãe, Penha Bezerra, pelo exemplo de mulher e de honestidade, por todo amor incondicional e orações. Mãe, amor eterno.
Ao meu pai, Severino Bezerra (in memoriam), que onde quer que esteja nunca deixará
de me amar. Pai, amor eterno.
Ao meu marido, Igor Costa, pela força durante todos os momentos, pelo carinho, amor, paciência e compreensão por todos os períodos difíceis e de ausência. Te amo muito. Aos meus irmãos Romulo, Tatiana e Taciana, por todo apoio, confiança e carinho. Amo muito vocês.
Aos meus lindos e amados sobrinhos Guívia, Karol, Lara e Gabriel, por fazerem minha vida mais colorida, feliz e leve.
A toda a equipe MADRUGA (Narciza, Angela, Ana Rita, Fábio, Valquíria, Iris, Leila, Thayse, Darlinne, Sérgio, Ana Maria e Mércia), por toda ajuda e pela amizade, além de tudo. Meus dias ficaram mais alegres com a presença de vocês.
As minhas queridas amigas lindas que enfrentaram junto comigo todas as batalhas do Doutorado, Narciza, Geany e Rayssa e pela amizade.
As minhas Luluzinhas de hoje e sempre, Carine, Diva, Renata, Aline, Adma e Keliane, por todo apoio concedido e amizade.
RESUMO
por redução do Fe3+ (> 95 mg / 100 g equivalente trolox). As cristas e barbelas apresentam potencial para elaboração de hidrolisados, fonte de minerais e peptídeos funcionais com bioatividades, como capacidade antioxidante e capacidade quelante ao mineral ferro. Com isto foi registrado a patente de processo de obtenção dos peptídeos bioativos da mistura de crista e barbela de frango - BR 10 2016 027430 3.
ABSTRACT
The chicken’s comb and wattle are part of the by-products they are composed of a large number of collagenous proteins, they are considered a promising source for obtaining bioactive peptides. The objective of this thesis was to develop a technical procedure aimed at making better use of the chicken’s comb and wattle. For this, the authors carried out studies on the protein hydrolysis of a comb/wattle mixture (1:1 w/w), focusing on the production of peptides with bioactivities such as iron chelation and antioxidant capacity. At first, the following were evaluated: centesimal composition, mineral profile and protein quality (percentage of collagen, percentage of total amino acids and free amino acids, hydrophobicity profile and electrophoretic profile) of the comb, the wattle and a mixture of both (1:1 w/w). These by-products displayed a high protein concentration (61 to 83% dry base), especially proteins of collagenous origin (47 to 51% dry base). The amino acid profile presented a high level of glutamic acid (10.01 g/100g) aspartic acid (7,38 g/100g), glycine (9,05 g/100g). The minerals iron (8 mg/100g), phosphorus (337 mg/100g) and zinc (2,62 mg/100g) were present in high amounts, which emphasizes the byproducts as an excellent sources of these nutrients. Considering the protein quality of the chicken’s comb and wattle, and the absence of studies regarding their use in functional products, a study was then carried out to evaluate the obtaining of peptides from these by-products. Firstly, comparative analysis of proteolytic activity was carried out in order to select the enzyme (Alcalase, Flavourzyme, Protamex, Brauzyn and Colagenase) to be used in the hydrolysis of the comb and wattle mixture (1:1 w/w). The enzyme Alcalase displayed the highest degree of hydrolysis (DH = 19%) when compared to the other proteases (DH < 3%). After selecting the enzyme, the next step was to optimize the Alcalase hydrolysis process. The researchers selected the samples with the lowest degree of hydrolysis (< DG: enzyme substrate ratio of 1% and 60 min of hydrolysis) and the highest degree of hydrolysis (> DG: enzyme substrate ratio of 5% and 240 min of hydrolysis). These experimental samples were analyzed for their protein profile, (percentage of total amino acids and free amino acids, hydrophobicity profile and electrophoretic profile), mineral profile and were characterized according to their iron chelating and antioxidant (ABTS, DPPH e FRAP) capacities. The hydrolysate with the higher DH exhibited a higher quantity of peptides with low molecular weight and hydrophilic character, as well as a higher quantity of free amino acids. The minerals Fe, F and Zn were present in quantities that allow the samples to be characterized as sources. As for bioactivity, they showed excellent Fe2+ chelation capacity (> 94%) and antioxidant activity through the inhibition of ABTS● (> 46%), DPPH● (> 41%) and FRAP through the reduction of Fe3+ (> 95 mg/100g trolox equivalent). Comb and wattle have the potential to be used in the production of hydrolysates and are also sources of minerals and peptides with bioactivities antioxidant capacity and iron chelating. As a result of these studies, the process patent BR 10 2016 027430 3 was registered.
LISTA DE ILUSTRAÇÕES
Figura 1 Delineamento experimental da pesquisa... 29
ARTIGO
Figure 1 Hydrolysis kinetics of the extract from the chicken comb and wattle mixture (1:1 w/w) using different proteases……… 87 Figure 2 A - Response surface for the dependent variable “degree of
hydrolysis”. B - Desirability graph of the degree of hydrolysis…… 88 Figure 3 Hydrophobicity profile at 218 nm... 89 Figure 4 Electrophoretic profile of the comb, wattle, mixture of combs and
wattles (C + W) and protein hydrolysates of the mixture with the highest and lowest degrees of hydrolysis………... 90 Figure 5 A - Reducing capacity of Fe3+ and chelation to the Fe2+ metal of
the chicken comb and wattle mixture (1:1 w/w) and protein hydrolysates; B - Ability of the chicken comb and wattle mixture (1:1 w/w) and protein hydrolysates to eliminate ABTS● and
LISTA DE TABELAS
Tabela 1 Aplicações para utilização de subprodutos do abate de frango... 19 Tabela 2 Descrição de enzimas utilizadas em diferentes fontes proteicas... 23 Tabela 3 Enzimas proteolíticas utilizadas na pesquisa... 30 Tabela 4 Variáveis independentes e níveis do planejamento para obtenção de
hidrolisados proteicos da mistura de crista e barbela de frango (1:1 p/p)... 31 Tabela 5 Planejamento experimental completo 22 + 3 repetições do ponto
central... 31
ARTIGO
Table 1 Chemical characterization of the chicken comb, wattle, and comb +
wattle mixture (1:1 w/w)……….……… 84
Table 2 Full experimental plan involving 22+ 3 repetitions of the central
point………. 85
SUMÁRIO
1 INTRODUÇÃO... 15
2 REVISÃO DE LITERATURA... 17
2.1 PRODUÇÃO E CONSUMO DE CARNE DE FRANGO... 17
2.2 SUBPRODUTOS DO ABATE DE FRANGOS... 18
2.3 HIDROLISADOS PROTEICOS... 21
2.4 ENZIMAS PROTEOLÍTICAS... 22
2.5 PEPTÍDEOS BIOATIVOS... 24
2.5.1 Atividade antioxidante... 25
2.5.2 Capacidade quelante à minerais... 26
3 MATERIAL E MÉTODOS ... 28
3.1 MATERIAL... 28
3.2 DELINEAMENTO EXPERIMENTAL... 28
3.3 OBTENÇÃO DO HIDROLISADO PROTEICO DA MISTURA DE CRISTAS E BARBELAS DE FRANGO (1:1 p/p)... 29
3.3.1 Seleção de enzimas para hidrólise proteica da mistura de cristas e barbelas de frango (1:1 p/p)... 29
3.3.2 Otimização do processo de hidrólise, com protease, do extrato de misturas de cristas e barbelas de frango (1:1) utilizando-se proteautilizando-se microbiana (Alcalautilizando-se)... 31
3.4 PROCEDIMENTOS ANALÍTICOS... 32
3.4.1 Caracterização química da crista e barbela de frango e sua mistura (1:1 p/p)... 32
3.4.2 Determinação de hidroxiprolina / Colágeno... 32
3.4.3 Medida do grau de hidrólise (GH)... 33
3.4.4 Perfil de hidrofobicidade da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteico... 33
3.4.7 Perfil de minerais da mistura de cristas e barbelas de frango
(1:1 p/p) e dos hidrolisados proteicos por ICP OES... 35
3.4.8 Medida da capacidade quelante ao Fe2+da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteicos... 36
3.4.9 Medida da atividade antioxidante da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteica... 36
3.5 ANÁLISE ESTATÍSTICA... 38
REFERÊNCIAS ………….……….... 39
4 RESULTADOS... 48
ARTIGO: Chelating and antioxidant capacity of peptides from chicken combs and wattles... 49
PATENTE: Processo de obtenção de peptídeos bioativos de cristas e barbelas de frango... 92
5 CONSIDERAÇÕES FINAIS... 102
1 INTRODUÇÃO
O aumento da produção de frangos de corte resulta na elevação da quantidade de subprodutos gerados durante o processo de abate e apenas a carcaça é valorizada comercialmente. O aproveitamento integral desses subprodutos com uma tecnologia inovadora, através do processamento e industrialização, reveste-se de uma grande importância econômica, pois agrega valor a toda cadeia produtiva (LAFARGA; HAYES, 2014; MARTÍNEZ-ALVAREZ; CHAMORRO; BRENES, 2015).
No abate de frangos, considera-se apenas a carcaça como objeto de comercialização, subutilizando outras partes do corpo do animal, como a cabeça, as vísceras, os pés, o sangue e as penas, os quais podem representar cerca de 37% do peso vivo total do animal. Estes materiais em geral são destinados para fins pouco nobres (farinha para ração animal, sabão, etc), com baixo retorno econômico, ou são descartados de forma inadequada, gerando impactos indesejáveis ao meio ambiente (UBABEF, 2013; BRASIL, 2014). Dois subprodutos do abate de frango, a crista e a barbela, não são aproveitados em sua potencialidade, embora sejam excelente fonte de proteína colagenosa, > 60% em base seca (ROSA et al., 2008). Tais características os habilitam como excelente matéria-prima para a obtenção de hidrolisados proteicos.
Na literatura encontram-se descritos o aproveitamento de subprodutos da indústria de origem animal para obtenção de peptídeos bioativos com propriedades biológicas e tecnológicas, resultantes da hidrolise enzimática de subprodutos de origem animal: aves (SURÓWKA; FIK, 1994; LEE et al., 2013), bovino (ZHANG et al., 2013), pescado (FERRARO et al., 2013; SILA; BOUGATEF, 2016). No entanto, nenhum trabalho enfocou a potencialidade do aproveitamento da crista e barbelas de frango na obtenção de ingredientes bioativos.
Os hidrolisados proteicos resultam da ação de enzimas proteolíticas clivando ligações peptídicas em diversas regiões da molécula de proteína, liberando peptídeos de diferentes pesos moleculares com sequenciamentos de aminoácidos distintos dependentes da origem da proteína e da enzima utilizada (LARIO et al., 2015).
minerais, melhorando a absorção/biodisponibilidade destes minerais, além de outras propriedades como: antioxidante, anti-hipertensiva, antitrombótica, antiulcerativa, cicatrizantes, efeitos osteoprotetores, dentre outros (CHOI et al., 2012; GÓMEZ-GUILLÉN et al., 2011; LEE et al., 2013).
A capacidade dos peptídeos de quelação a minerais resulta em novas moléculas, que apresentam melhor absorção no trato gastrointestinal, em comparação aos minerais isolados ou na forma inorgânica, a exemplo dos sulfatados ou cloretos; no entanto, uma vez quelatos os minerais perdem a sua atuação pró-oxidante. A obtenção de peptídeos através da proteólise enzimática, com posterior síntese de quelatos e adição em matrizes alimentares, apresentam-se como uma alternativa promissora para o combate de deficiência alimentar de micronutrientes, a exemplo do ferro, melhorando a sua biodisponibilidade (DE LA HOZ et al., 2014).
Atualmente nosso grupo de pesquisa vem realizando estudos com o aproveitamento de subprodutos do abate de frango, obtendo ingredientes com potencialidades funcionais, sejam bioativos e tecnológicos. Dentre os subprodutos pesquisados citam-se a utilização da cartilagem do osso da quilha de frango (ARAÚJO, 2017a) e dos pés de frango (ARAÚJO, 2017b) para a obtenção de colágeno.
2 REVISÃO DE LITERATURA
2.1 PRODUÇÃO E CONSUMO DE CARNE DE FRANGO
A produção de frangos de corte mundial ganha destaque em decorrência de seu elevado consumo, atingindo valores de produção no ano de 2015 de aproximadamente 88 mil toneladas (ABPA, 2016). No Brasil a produção de frangos de corte se sobressai como uma atividade econômica consolidada, ocupando a segunda posição mundial (14,9%) depois dos Estados Unidos da América (20,4%). A cadeia produtiva de frango coloca o Brasil como o maior exportador mundial de carne de frango, alcançando aproximadamente 40% do volume total exportado (ABPA, 2016).
Segundo o Ministério da Agricultura, Pecuária e Abastecimento (MAPA) estima-se que até 2025, o Brasil apresentará um limite de produção de carne de frango superior a 17 milhões de toneladas ao ano, atingindo assim um progresso de 3% durante cada ano. O crescente aumento na produção de frangos de corte no Brasil irá refletir no mercado consumidor deste produto no país. O MAPA registra que 70% da carne de frango destinada ao consumo interno é produzida no país (BRASIL, 2014).
A Associação Brasileira de Proteína Animal (ABPA) relata que no Brasil a carne de frango exibe um maior consumo quando comparado com a carne bovina, suína e de peixe, em decorrência, principalmente do custo (ABPA, 2015). Estima-se que 2016 à 2026 o consumo de carne de frango no Brasil obtenha um aumento de 21,8% atingindo aproximadamente 12.9 mil toneladas (BRASIL, 2016).
As projeções do MAPA para o período de 2014 a 2024 estima um aumento no consumo interno de carne de frango de 2,5% ao ano, totalizando uma elevação de aproximadamente 32% nos próximos 10 anos (BRASIL, 2014). Diante destas projeções, o consumo de carne de frango de 42,1 kg/habitante/ano, em 2014, atingirá em 2024 valores de 54,6 kg/habitante/ano.
2.2 SUBPRODUTOS DO ABATE DE FRANGOS
No abate de frangos, apenas a carcaça é objeto de comercialização, desprezando-se assim outras partes do animal, as quais constituem os subprodutos. Estes podem representar 37% do peso vivo total do animal, sendo compostos por cabeça, pele, penas, crista, barbela, ossos, aparas de carne, sangue, tecidos adiposos, pé e órgãos internos (TOLDRÁ et al., 2012).
Devido à grande quantidade de subprodutos originados, os mesmos acarretam para o abatedouro uma grande quantidade de resíduos (MARTÍNEZ-ALVAREZ; CHAMORRO; BRENES, 2015), fazendo-se necessário o aproveitamento integral dos subprodutos oriundos do abate. Portanto, o processamento e industrialização destes subprodutos se revestem de importância econômica impactante no estabelecimento de abate (LAFARGA; HAYES, 2014).
O valor comercial de uma carcaça, às vezes é insuficiente para cobrir as despesas do abate, deixando aos subprodutos a incumbência de equilibrar a balança econômica e comercial dos abatedouros. Sua utilização se apresenta como uma alternativa de agregação de valor, por apresentar custo praticamente zero (LAFARGA; HAYES, 2014).
Além do mais, os materiais oriundos do abate de frangos apresentam natureza orgânica e são altamente perecíveis, demandando seu aproveitamento correto em relação às questões ambientais. Quando descartados de forma inadequada, a decomposição dos subprodutos pode gerar danos ao meio ambiente, levando à presença de roedores, insetos e odores desagradáveis, por consequência da proliferação microbiana (MORA; REIG; TOLDRÁ, 2014).
Tabela 1. Aplicações para utilização de subprodutos do abate de frango.
Subprodutos Aplicação Referência
Cabeça Hidrolisado proteico SUROWKA; FIK (1994)
Pescoço Hidrolisado proteico NIKOLAEV et al. (2016) Crista Extração de ácido hialurônico ROSA et al. (2008)
Pés Colágeno hidrolisado WATANABE et al. (2010)
Pele Colágeno hidrolisado SAIGA et al. (2008)
Osso Colágeno hidrolisado ZHANG et al. (2010)
Penas Extração de queratina CHENG et al. (2009)
Vísceras Hidrolisado proteico JAMDAR E HARIKUMAR (2008)
Sangue Hidrolisado proteico HUANG E LIU (2010)
Os subprodutos do abate de frango exibem excelentes potenciais de aproveitamento por sua composição química. As penas de frango são consideradas fonte de proteína atingindo 85 à 90%, sendo em sua maior quantidade a queratina. Entretanto, são amplamente utilizadas para elaboração de farinha para ração animal após passar por processamento de hidrólise (LASEKAN; BAKAR; HASHIM, 2013).
O sangue de frango também é comumente utilizado por apresentar elevada concentração de proteínas de alto valor biológico. É empregado na elaboração de farinha para alimentação animal, extração dos constituintes do plasma e obtenção de peptídeos bioativos com potencialidades de inibição da enzima conversora da Angiotensina I (HUANG; LIU, 2010). Os ossos e a pele do frango são subprodutos que também apresentam altas concentrações de proteínas, destacando-se o colágeno. São largamente empregados na elaboração de farinha para alimentação animal, fertilizantes e extração de peptídeos bioativos, com capacidade antioxidante (LEE et al., 2013; MORA; REIG; TOLDRÁ, 2014).
A cabeça do frango é utilizada para elaboração de farinha e graxarias; em alguns casos é descartada de forma inadequada no meio ambiente. Surowka e Fik (1994) utilizaram cabeça de frango para obtenção de hidrolisado e avaliaram as atividades tecnológicas, obtendo peptídeos com boa capacidade de formação de espuma.
(1,3). É amplamente utilizado na indústria de cosméticos, reduzindo efeitos do envelhecimento e na eliminação de radicais livres (KANCHANA et al., 2013).
Devido a abundante constituição de colágeno na crista e nas barbelas estes subprodutos apresentam-se como excelentes fontes de moléculas com propriedades tecnológicas e bioativas, voltadas às aplicações em diversos fins da indústria alimentar e farmacêutica. O colágeno é a proteína mais abundante nos animais, sendo considerado um dos biomateriais de grande aproveitamento e aplicação industrial (CHEN et al., 2012).
O colágeno é uma molécula composta por três cadeias entrelaçadas em forma de tripla hélice, estabilizada por pontes de hidrogênio, apresentando em suas cadeias sequencias repetidas de (Glicina-X-Y)n, onde o X e Y em muitos casos são a prolina e a hidroxiprolina, respectivamente. Existem 29 tipos de colágeno, entretanto os tipos I, II e III são os encontrados e identificados de forma mais abundante, com destaque para o tipo I (MOHAMMADI et al., 2016).
O colágeno do tipo I, que é denominado de colágeno nativo ou tropocolágeno, é encontrado em maior proporção no tecido conectivo como: pele, ossos, tendões, grandes vasos, útero, derme, ligamentos, intestino e fibrocartilagem. O tipo II pertence aos tecidos cartilaginosos, a cartilagem hialina e elástica, e ao disco invertebral; o tipo III localiza-se nos grandes vasos, na parede uterina, na derme (jovem), no intestino, na válvula do coração e na gengiva. Os demais tipos de colágenos são específicos e reduzidos, encontrados, por exemplo, em lâminas basais, cápsula do cristalino, córnea, membranas da placenta, músculo do coração, pulmão, pele fetal, mucosa intestinal, dentre outros (KARIM; BHAT, 2009).
2.3 HIDROLISADOS PROTEICOS DE SUBPRODUTOS DO ABATE
Diversos processos e métodos tecnológicos são aplicados aos subprodutos de origem animal para obtenção de produtos com funcionalidades diversas. Devido ao elevado teor de proteínas de composição aminoacídica diferentes, os subprodutos são amplamente utilizados de forma hidrolisada. O processo de hidrólise consiste na quebra da ligação peptídica das proteínas, resultando na liberação de peptídeos de tamanhos moleculares diversos, com sequenciamento de aminoácidos distintos e aminoácidos livres (MARTÍNEZ-ALVAREZ; CHAMORRO; BRENES, 2015).
A hidrólise pode ser realizada por métodos enzimático, químico ou térmico. Os métodos químico e térmico são considerados como de difícil controle e resultam em produtos de menor qualidade nutricional e bioativa. A hidrólise enzimática é comumente a mais empregada devido à especificidade das enzimas e assim, controle da obtenção do produto final (SCHMIDT; SALAS-MELLADO, 2009).
O processo de obtenção do hidrolisado por via enzimática é realizado controlando as condições para atender especificações técnicas de ação da enzima utilizada para atingir a sua melhor atividade catalítica. Os principais fatores a serem controlados na hidrólise são: temperatura, pH, tempo e relação enzima/substrato, onde essas condições devem ser estudadas e otimizadas para os diferentes substratos, a fim de que se obtenha as melhores condições de atividades de ação enzimática (MORA; REIG; TOLDRÁ, 2014). A seleção da enzima proteolítica deve ser realizada dependendo do produto (tipo de substrato) de origem da proteína a ser clivada e da funcionalidade do peptídeo a ser obtido.
frango cozido. Nikolaev et al. (2016) verificaram a atividade antioxidante em hidrolisado proteico obtido de pescoço de frango.
Além destas funcionalidades os hidrolisados proteicos de subprodutos da indústria de origem animal vêm se destacando quanto a propriedade de quelação à minerais. Pesquisadores encontraram atividade quelante de hidrolisados de pescado, como pele, músculo e escama de peixe à minerais como ferro, cálcio e cobre (LEE; SONG 2009; GUO et al. 2015; HUANG et al. 2015). Na indústria de laticínios encontram-se estudos de quelação à minerais como o ferro e cálcio com hidrolisado proteico obtido através do soro de leite (DE LA HOZ et al. 2014; ZHAO et al. 2014; SILVA et al. 2015).
2.4 ENZIMAS PROTEOLÍTICAS
As proteases são enzimas capazes de hidrolisar proteínas, clivando ligações peptídicas no interior da cadeia proteica ou nas suas extremidades da cadeia lateral, dependendo de sua especificidade catalítica . As enzimas proteolíticas podem ser de origem microbiana, animal ou de fontes vegetais (BOUACEM et al., 2015). Portanto, as enzimas exibem especificidades que possibilitam a ação em regiões diferenciadas da cadeia da proteína, permitindo a liberação de peptídeos com sequenciamentos diferentes (BAH et al., 2015; LARIO et al., 2015).
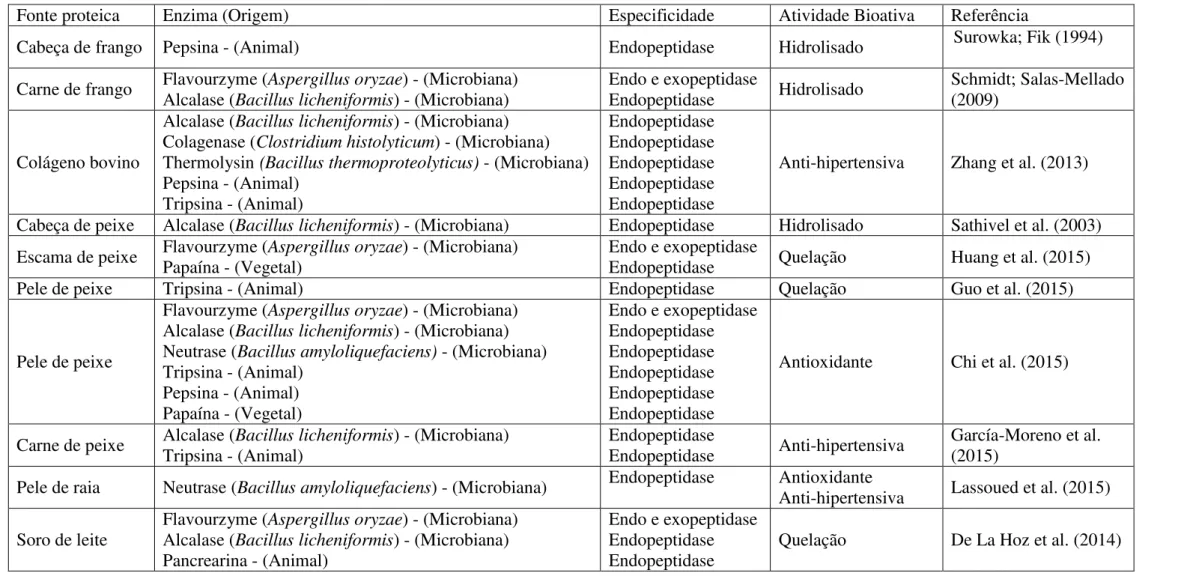
Tabela 2. Descrição de enzimas utilizadas em diferentes fontes proteicas.
Fonte proteica Enzima (Origem) Especificidade Atividade Bioativa Referência
Cabeça de frango Pepsina - (Animal) Endopeptidase Hidrolisado Surowka; Fik (1994)
Carne de frango Flavourzyme (Aspergillus oryzae) - (Microbiana) Alcalase (Bacillus licheniformis) - (Microbiana)
Endo e exopeptidase
Endopeptidase Hidrolisado
Schmidt; Salas-Mellado (2009)
Colágeno bovino
Alcalase (Bacillus licheniformis) - (Microbiana)
Colagenase (Clostridium histolyticum) - (Microbiana)
Thermolysin (Bacillus thermoproteolyticus) - (Microbiana)
Pepsina - (Animal) Tripsina - (Animal)
Endopeptidase Endopeptidase Endopeptidase Endopeptidase Endopeptidase
Anti-hipertensiva Zhang et al. (2013)
Cabeça de peixe Alcalase (Bacillus licheniformis) - (Microbiana) Endopeptidase Hidrolisado Sathivel et al. (2003)
Escama de peixe Flavourzyme (Aspergillus oryzae) - (Microbiana) Papaína - (Vegetal)
Endo e exopeptidase
Endopeptidase Quelação Huang et al. (2015)
Pele de peixe Tripsina - (Animal) Endopeptidase Quelação Guo et al. (2015)
Pele de peixe
Flavourzyme (Aspergillus oryzae) - (Microbiana)
Alcalase (Bacillus licheniformis) - (Microbiana)
Neutrase (Bacillus amyloliquefaciens) - (Microbiana)
Tripsina - (Animal) Pepsina - (Animal) Papaína - (Vegetal)
Endo e exopeptidase Endopeptidase Endopeptidase Endopeptidase Endopeptidase Endopeptidase
Antioxidante Chi et al. (2015)
Carne de peixe Alcalase (Tripsina - (Animal) Bacillus licheniformis) - (Microbiana) Endopeptidase Endopeptidase Anti-hipertensiva García-Moreno et al. (2015) Pele de raia Neutrase (Bacillus amyloliquefaciens) - (Microbiana) Endopeptidase Antioxidante
Anti-hipertensiva Lassoued et al. (2015) Soro de leite
Flavourzyme (Aspergillus oryzae) - (Microbiana)
Alcalase (Bacillus licheniformis) - (Microbiana)
Pancrearina - (Animal)
Endo e exopeptidase Endopeptidase
Dentre as demais origens, as enzimas microbianas são mais comumente utilizadas para obtenção de hidrolisados proteicos, em decorrência a sua fácil aquisição e modificação genética. É consolidado na literatura, que essas enzimas são mais eficazes, principalmente no que se diz respeito ao aumento do grau de hidrólise, tendo como destaque as enzimas Alcalase® (Bacillus licheniformis) e Flavourzyme
(Aspergillus oryzae) (BOUACEM et al., 2015).
A Alcalase® é uma enzima produzida pela fermentação submersa do micro-organismo Bacillus licheniformis, sendo classificada de acordo com o modo de ação,
como endopeptidase e pela natureza química de seu sítio ativo, como serina-protease. Exibe pouca especificidade e também possui ação hidrolítica em moléculas colagenosas, agindo na estrutura da tripla hélice da molécula do colágeno (ZHANG et al., 2013).
A Flavourzyme é considerada um complexo de enzimas resultantes de ação de fúngica de Aspergillus oryzae. De acordo com sua ação catalítica no substrato é
classificada como, endopeptidase e exoproteinase, sendo denominada pelo seu sítio ativo, como proteases aspárticas (TAVANO, 2013; HUANG et al., 2015; PASTORE; BICAS; MARÓSTICA, 2013).
Em geral para o substrato colágeno, utilizam-se enzimas específicas como a colagenase (Clostridium histolyticum), cuja protease é capaz de hidrolisar a tripla hélice
do colágeno nativo ou desnaturado, porém apresenta um valor comercial elevado (ZHANG et al., 2013).
2.5 PEPTÍDEOS BIOATIVOS
Como resultado da hidrolise de proteínas são liberados peptídeos das sequencias proteicas, que podem apresentar atividades biológicas específicas de acordo com o seu sequenciamento de aminoácidos, os quais quando incluídos na cadeia proteica as suas características são inativadas (MORA; REIG; TOLDRÁ, 2014).
Dentre as atividades biológicas mais estudadas encontram-se os efeitos osteoprotetores, antiulcerativos, cicratizantes, antitumorais, além de antimicrobianos, antioxidantes, anti-hipertensivos, imunomoduladores, hipocolesterêmicos, e ainda melhoria da absorção/biodisponibilidade de minerais, quando quelatados (CHOI et al., 2012). Todas essas propriedades fazem com que os hidrolisados de proteínas de origem animal tornem interessantes, com potenciais de aplicação na indústria de alimentos (MARTÍNEZ-ALVAREZ; CHAMORRO; BRENES, 2015).
Neste sentido, diversos peptídeos gerados a partir de subprodutos do abate de animais, como frango, suínos, bovinos e peixes, foram estudados com pesquisas in vitro
e in vivo e suas bioatividades foram comprovadas (ALEMÁN; GÓMEZ-GUILLÉN;
MONTERO, 2013; SAIGA et al., 2008).
2.5.1 Atividade antioxidante
A oxidação está cada vez mais sendo objeto de estudo, devido a sua grande relevância, por estar relacionada a doenças como estresse oxidativo, câncer, diabetes, aterosclerose, doenças neurodegenerativas, inflamatórias e o envelhecimento celular (LEE et al., 2013).
A oxidação ocorre quando alguma molécula perde elétron, como consequência da transferência para outra molécula, gerando os radicais livres. Estes radicais livres podem ser formados em moléculas importantes para o funcionamento do nosso corpo e assim provocar disfunções (estresse oxidativo). Com isto é necessário a utilização de moléculas antioxidantes para impedir reações oxidativas no organimo. A utilização de peptídeos com ação antioxidantes tem a capacidade de cessar reações de peroxidação desencadeadas, através da doação de um par de elétrons para os radicais livres (DUAN et al., 2014).
A capacidade dos peptídeos atuarem como antioxidantes provem da presença de alguns aminoácidos nas cadeias laterais e da sequência destes em sua estrutura. Esses peptídeos quando inseridos na cadeia proteica apresentam-se na maioria das vezes inativados, quanto a bioatividades; podem ser liberados através do processo hidrolítico para desempenhar sua função bioativa (CHI et al., 2015).
Outro fator de grande importância para a capacidade antioxidante está relacionado com o peso molecular da cadeia peptídica. Esta bioativade é intensificada com frações de menores pesos moleculares e devido a isto, a hidrólise deve ser realizada de forma eficaz para a obtenção de peptídeos de fragmentos menores. O peptídeo de menor peso molecular terá a capacidade de absorção e assim exercerem a ação antioxidante no organismos (LEE et al., 2013; SAIDI et al. 2014).
Diversos estudos têm sido descritos sobre obtenção e isolamento de peptídeos antioxidantes em diferentes matrizes proteicas. Nikolaev et al. (2016) obtiveram peptídeos com capacidade antioxidantes, oriundos de hidrolisado proteico de pescoço de frango. Lee et al. (2013) encontraram peptídeos, derivados de hidrolisado proteico de pele de pato, também com capacidade antioxidante. Pan et al. (2016) e Lassoued et al. (2015) estudaram peptídeos com esta mesma bioatividade em hidrolisado proteico de pele de arraia. Abdelhedi et al. (2016), Chi et al. (2015) e Saide et al. (2014) avaliaram a atividade em peptídeos obtidos de produtos do abate de peixe, como vísceras, pele e músculo.
2.5.2 Capacidade quelante à minerais
Os minerais exercem atividades de extrema importância para as funções vitais do humano. O ferro é um mineral essencial no transporte de oxigênio, está envolvido na divisão celular, na síntese de hemoglobina e na síntese do sistema nervoso central (DE; KRISHNA; JETHWA, 2015).
A Organização Mundial de Saúde (OMS) considera a deficiência alimentar de ferro como sendo a mais agravante, pois além da ingestão insuficiente deste mineral na alimentação o ferro apresenta baixa biodisponibilidade na dieta de origem vegetal (HUANG et al. 2015). O ferro quando suplementado em forma de sais exibe baixa biodisponibilidade, devido principalmente à sua interação com outros componentes como ácido fítico, polifenóis e fibras. Além disso, ocorre o risco de ser oxidado no intestino, gerando radicais livres capazes de ocasionar a peroxidação lipídica de proteínas da membrana do enterócito e consequentemente provocar lesões inflamatórias, como gastrite e úlcera (CANÇADO; LOBO; FRIEDRICH, 2010; HUANG et al., 2015).
Os consumidores, principalmente crianças, mulheres grávidas e idosos, estão cada vez mais adquirindo minerais por meio de suplementos alimentares, como alternativas para previnir ou suprir a necessidade devido a carência de minerais (ZHU et al. 2015). A obtenção de peptídeos provenientes da proteólise enzimática, com posterior síntese a minerais (processo de quelação) e adição em matrizes alimentares apresenta-se como uma alternativa promissora para o combate da deficiência alimentar de micronutrientes como o ferro (GUO et al., 2015).
Os peptídeos quelatos à minerais apresentaram melhor absorção no trato gastrointestinal, do que os minerais isolados ou na forma inorgânica, como os sulfatados ou cloretos (DE LA HOZ et al., 2014; HUANG et al., 2015). A ligação dos peptídeos a íons metálicos é baseada na interação entre um grupo doador de elétrons presente na superfície do peptídeo e um íon metálico que apresente um ou mais sítios de coordenação acessíveis, assegurando que o átomo de metal se torne parte de uma estrutura biologicamente estável (UEDA; GOUT; MORGANTI, 2003).
3 MATERIAL E MÉTODOS
3.1 MATERIAL
Cristas e barbelas de frango foram adquiridas em abatedouro localizado no Estado da Paraíba (Brasil) e devidamente fiscalizado pelo Serviço de Inspeção Federal (SIF). As enzimas, Alcalase® (Bacillus licheniformis) e Flavourzyme® (Aspergillus oryzae) foram fornecidas pela Novozymes Latino Americana Ltda (Paraná, Brasil) e a
Protamex (Bacillus licheniformes e Bacillus amyloliquefaciens), Brauzyn
(Caricapapaya) e Colagenase (Clostridium histolyticum) pela Prozyn Biosolutions (São
Paulo, Brasil).
3.2DELINEAMENTO EXPERIMENTAL
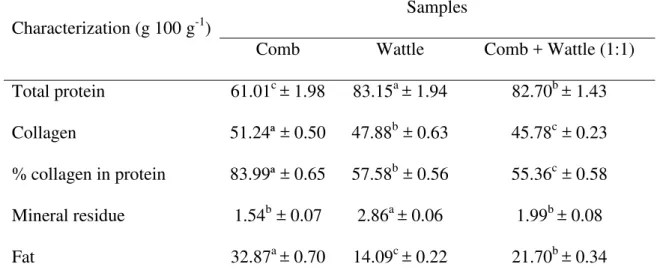
A pesquisa foi executada em três etapas (Figura 1). Inicialmente, foi realizada a composição química parcial dos subprodutos do abate de frangos (crista, barbela e sua mistura 1:1 p/p), através da determinação dos macronutrientes (proteína, lipídeos, umidade e cinzas), perfil de minerais (Fe, Ca, P, Zn, K, Mg, Mn, Na) e do perfil proteico (perfil eletroforético, de hidrofobicidade e de aminoácidos totais e livres). Mediante o resultado dos macronutrientes, que indicou um maior teor lipídico na crista, optou-se por realizar os estudos de hidrolise enzimática e obtenção de peptídeos com a mistura de crista e barbelas na proporção de 1:1 (p/p) reduzindo assim a concentração de lipídeos no hidrolisado, e consequentemente a necessidade de eliminação do material lipídico.
Fe2+, poder de redução do Fe3+ e atividades antioxidantes frente a inibição dos radicais ABTS● e DPPH●.
Figura 1. Delineamento experimental da pesquisa.
3.3 OBTENÇÃO DO HIDROLISADO PROTEICO DA MISTURA DE CRISTAS E BARBELAS DE FRANGO (1:1 p/p)
3.3.1 Seleção de enzimas para hidrólise proteica da mistura de cristas e barbelas de frango (1:1 p/p)
histolyticum)] apresentadas na Tabela 3, onde foi avaliado o desempenho, maior
atividade hidrolítica, tomando-se como base os parâmetros ótimos de pH e temperatura indicados pelas empresas.
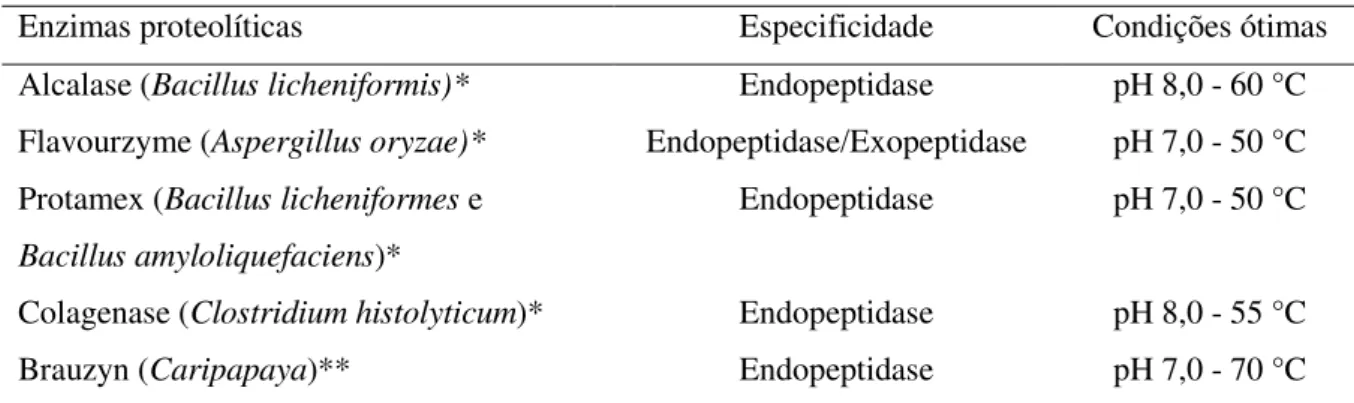
Tabela 3. Enzimas proteolíticas utilizadas na pesquisa.
Enzimas proteolíticas Especificidade Condições ótimas Alcalase (Bacillus licheniformis)* Endopeptidase pH 8,0 - 60 °C
Flavourzyme (Aspergillus oryzae)* Endopeptidase/Exopeptidase pH 7,0 - 50 °C
Protamex (Bacillus licheniformes e Bacillus amyloliquefaciens)*
Endopeptidase pH 7,0 - 50 °C
Colagenase (Clostridium histolyticum)* Endopeptidase pH 8,0 - 55 °C
Brauzyn (Caripapaya)** Endopeptidase pH 7,0 - 70 °C Fonte: Novozyme Latino Americana Ltda (Paraná, Brasil); Prozyn Biosolutions (São Paulo, Brasil). * fonte microbiana; ** fonte vegetal
As cristas e as barbelas de frango foram trituradas e homogeneizadas em proporção 1:1 (p/p). A mistura foi transferida para um béquer encamisado com banho termostatizado e previamente aquecido. Ao sistema foi adicionado água ultra pura na proporção de 1:2 (p/v), com agitação constante. A relação enzima substrato (5%) e o tempo total de hidrólise (240 minutos) foram selecionados de acordo com os níveis máximos a serem utilizados no Planejamento Experimental Fatorial Completo, executado posteriormente à seleção da enzima, tomando-se por base os resultados reportados por Zhang et al. (2013), Saide et al. (2014), Alemán et al. (2013), Chi et al. (2015) e Pan et al. (2016).
Durante a hidrólise o pH foi controlado pela adição de solução de NaOH 0,5 mol / L. Após 240 minutos de hidrólise foi realizada a inativação da enzima, pelo uso de temperatura a 90 °C por 15 minutos (ZHANG et al., 2013). O hidrolisado foi centrifugado (12.000 x g por 30 minutos) e o sobrenadante foi filtrado, liofilizado, com
3.3.2 Otimização do processo de hidrólise, com protease, do extrato de misturas de cristas e barbelas de frango (1:1) utilizando-se protease microbiana (Alcalase)
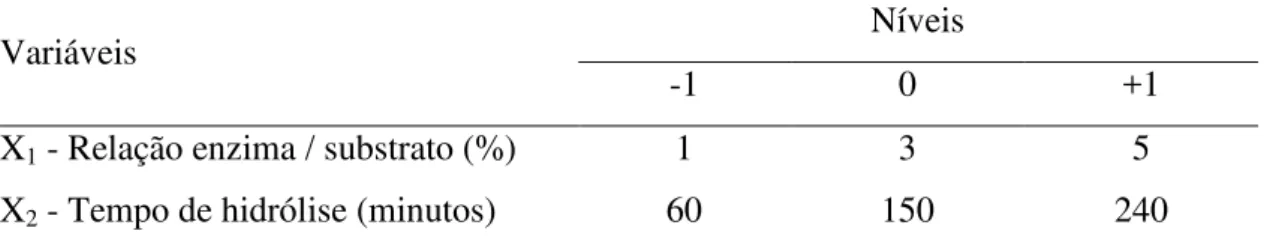
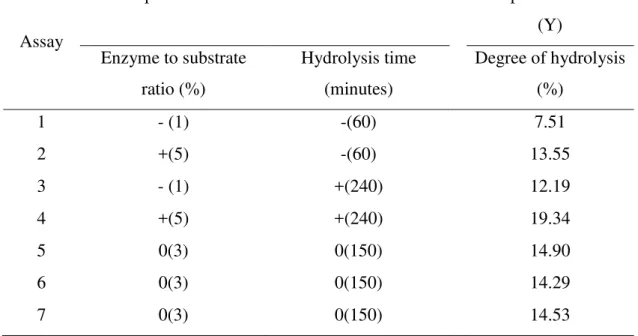
As condições do processo de hidrólise das cristas e barbelas de frango, utilizando-se protease, foram otimizadas mediante um Planejamento Fatorial Completo 22, com 4 pontos fatoriais e 3 pontos centrais, totalizando 7 experimentos (Tabela 4 e 5). As variáveis independentes investigadas foram: X1 ou E:S (Relação enzima/substrato) e X2 ou T (Tempo de hidrólise em minutos) e a função resposta foi medida como % do grau de hidrolise (% GH).
Tabela 4. Variáveis independentes e níveis do planejamento para obtenção de hidrolisados proteicos da mistura de crista e barbela de frango (1:1 p/p).
Variáveis Níveis
-1 0 +1
X1 - Relação enzima / substrato (%) 1 3 5
X2 - Tempo de hidrólise (minutos) 60 150 240
Valores codificados e reais do planejamento experimental.
Tabela 5. Planejamento experimental completo 22+ 3 repetição do ponto central.
Ensaios Relação
enzima/substrato (%)
Tempo de hidrólise (minutos)
Grau de hidrólise
1 - (1) -(60) -
2 +(5) -(60) -
3 - (1) +(240) -
4 +(5) +(240) -
5 0(3) 0(150) -
6 0(3) 0(150) -
7 0(3) 0(150) -
Valores codificados e reais do planejamento experimental.
variável dependente neste estudo é o grau de hidrólise. O modelo ajustado aos dados experimentais foi verificado pela análise de Variância (ANOVA) e o coeficiente de determinação (R2). A superfície de resposta e função desejabilidade foram construídas utilizando STATISTICA 5.0 (Statsoft Inc. Corporativo Tulsa, OK, EUA) (Statsoft, 2004).
Para validação do modelo, um novo ensaio no ponto ótimo foi realizado em triplicata e os resultados foram comparados com a função resposta, estimada pelo modelo, aplicando o teste t (p ≤ 0,05).
Os hidrolisados de maior e menor grau de hidrólise (>GH e <GH) foram selecionados e analisados quanto ao perfil eletroforético, hidrofobicidade, aminoácidos totais e livres e minerais. Também foram avaliadas a capacidade quelante ao mineral ferro e antioxidante (redução ao Fe+3 e inibição dos radicais (DPPH● e ABTS●).
3.4 PROCEDIMENTOS ANALÍTICOS
3.4.1 Caracterização química da crista e barbela de frango e sua mistura (1:1 p/p)
As cristas e barbelas de frango foram caracterizadas pelas determinações dos teores de umidade, cinzas e proteínas conforme a metodologia da AOAC (2010), descrita nos procedimentos n° 39.1.03, 39.1.09 e 39.1.15, respectivamente. Os lipídeos foram realizados utilizando a metodologia de Folch, Lees e Sloane Stanley (1957).
3.4.2 Determinação de hidroxiprolina / Colágeno
leitura da absorbância das soluções contra o branco de reagentes a 558 nm em espectrofotômetro UV-VIS (Quimis, Q798U, São Paulo, Brasil). A quantificação foi realizada utilizando curva padrão preparadas com diferentes concentrações de hidroxiprolina (0,6 à γ,6 μg/mL). A conversão da concentração de hidroxiprolina para colágeno foi realizada multiplicando-se o valor final por 8.
3.4.3 Medida do grau de hidrólise (GH)
O grau de hidrólise das enzimas proteolíticas no extrato da mistura de cristas e barbelas de frango (1:1 p/p) foi determinado através do consumo de base, utilizando a equação descrita por Adler-Nissen (1986).
(Equação 2), onde DH (%) = grau de hidrólise; B = consumo de NaOH (0,5moL L-1) em mL; Nb = normalidade NaOH (0,5moL L-1); 1/α = média de grau de dissocia o do grupo α-NH2; MP = massa da proteína em g; htot = número total de ligações peptídicas no substrato proteico, sendo 7,6 para carnes.
3.4.4 Perfil de hidrofobicidade da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteico
A mistura de cristas e barbelas de frango (1:1 p/p) e os hidrolisados proteicos da mistura, de maior e menor grau de hidrólise foram diluídos em água ultra pura e homogeneizados em Ultra-Turrax tube disperser (Ika, Staufen, Germany) durante 10 minutos à 18.000 rpm. Em seguida a solução foi colocada em banho ultrassônico por 10 minutos (Unique, 1400, São Paulo, Brasil) e centrifugada à 2060 x g por 10 minutos. As
amostras foram filtradas em papel de filtro e transferidas para seringa contendo filtro com poros de diâmetros de 0,45 μm.
foi aplicado durante 60 minutos em fluxo de 1 mL / minuto e a detecção foi realizada a 218 nm.
3.4.5 Eletroforese das cristas e barbelas de frango, de sua mistura (1:1 p/p) e dos hidrolisados proteico
O perfil das frações proteicas e dos peptídeos foi determinado por eletroforese em gel de poliacrilamida contendo SDS para separação das bandas de maior peso molecular (225 kDa à 38 kDa) (LAEMMLI, 1970) e de menor peso (38 kDa à 3,5 kDa) por SDS-PAGE-Tricina (SCHAGGER; JOAGOW, 1987). As amostras foram diluídas em tampão redutor (0,5 mol/L Tris-HCl, pH 6,8, 10% SDS, 10% glicerol, 5% -mercaptoetanol e 0,1% Comassie Blue G250), homogeneizadas com auxílio de vórtex e sonicadas por 10 minutos. Logo após foram aquecidas a 90 °C por 5 minutos em banho à seco (Loccus, São Paulo, Brasil).
Pelo sistema SDS-PAGE o gel de aplicação (stacking gel) foi preparado na
concentração de 3,5% de poliacrilamida em tampão Tris - HCl 0,5 mol/L, pH 6,8 e SDS a 1%, enquanto que o gel de separação foi montado formando um gradiente de 7,5 a 17,5% de poliacrilamida em tampão Tris - HCl 3 mol/L, pH 8,8 e SDS a 1%. A corrida foi realizada sob amperagem constante (25 mA) e ao final da corrida, o gel foi retirado da placa e fixado em TCA 12,5% por uma hora, sendo então corado com Coomassie brilliant blue R250. A remoção do excesso de corante foi realizada com o auxílio de uma solução descorante de metanol, ácido acético e água (1:3,5:8 v/v/v). Os pesos moleculares das frações proteicas foram comparados mediante utilização de marcador de peso molecular (GE Healthcare Life Sciences, Piscataway, NJ, USA).
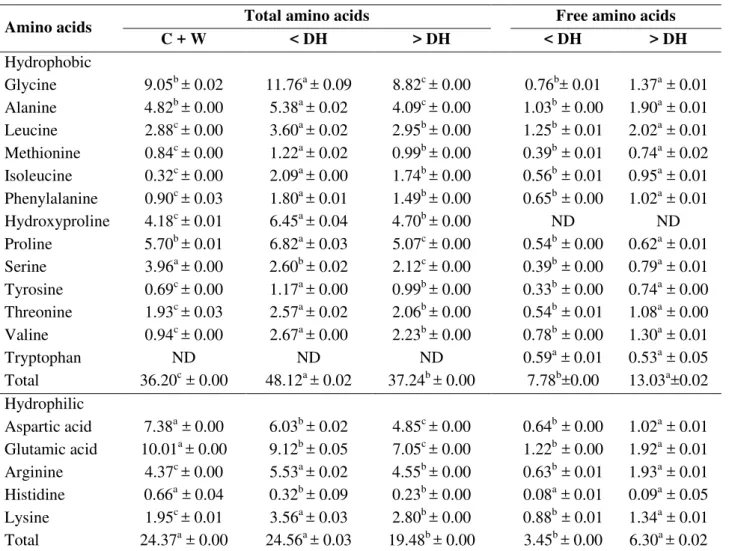
3.4.6 Perfil de aminoácidos totais e livres da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteicos por HPLC
Os aminoácidos totais foram hidrolisados à 105 °C, em seguida derivatizados com fenilisotiocianato (PITC) de acordo com as metodologias propostas por White, Hart e Fry (1986). Os aminoácidos livres foram extraídos mediante um processo mais brando que envolveu a agitação orbital por 60 minutos com ácido clorídrico a 0,1 mol/L, seguida de derivação com fenilisotiocianato (PITC), seguindo o método descrito por Hagen, Frost e Augustin (1989).
A separação dos aminoácidos livres e totais derivatizados (feniltiocarbamil-aminoácidos / PTC-aa) foi realizada em Cromatógrafo Líquido de Alta Resolução (Shimadzu Corporation, Tokyo, Japan) em coluna de fase reversa C18 - Luna - Phenomenex (250 mm x 4,6 mm, 5 µm; Phenomenex Inc., Torrence, CA, USA). As fases móveis empregadas consistiram de um tampão acetato de pH 6,4 e uma solução de acetonitrila a 40%. A injeção da amostra foi efetuada automaticamente (50 µL) e a detecção ocorreu a 254 nm. A separação cromatográfica foi realizada a um fluxo constante de 1 mL / minuto, à temperatura de 35 ºC. O tempo de corrida cromatográfica foi de 45 minutos e os resultados foram expressos em mg de aminoácido por 100 g de amostra. A quantificação foi realizada mediante a adição do padr o interno ácido α -aminobutírico e identificados por comparação a uma mistura de padrões.
3.4.7 Perfil de mineraisda mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteicos por ICP OES
líquido (12 L / min) com pureza mínima de 99,996% (Air Liquide, Brasil) e a visão radial do ICP OES. A quantificação foi obtida através de curva de calibração (colocar o nome e marca dos padrões utilizados) para cada mineral detectado, em faixas de concentrações que variaram de 0,001 à 61 mg / 100 mL.
3.4.8 Medida da capacidade quelante ao Fe2+da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteicos
A capacidade quelante ao Fe2+ foi avaliada com base na interrupção da formação do complexo F2+ - Ferrozina, verificada a 562 nm em espectrofotômetro UV-VIS (Quimis, Q798U, São Paulo, Brasil), seguindo a metodologia descrita por Stookey (1970). Foi realizada a homogeneização do extrato solúvel dos hidrolisados com FeCl2 a 2 mmol / L e posterior leitura no espectrofotômetro. Após primeira leitura de absorbância, foi adicionada uma solução de Ferrozina a 5 mmol / L, agitando-se vigorosamente por 1 minuto. Para a formação do complexo foi aguardado 10 minutos em repouso e em seguida nova leitura de absorbância.
A porcentagem de inibição de formação do íon complexo (F2+ - Ferrozina) foi avaliada pelo decréscimo da intensidade da cor, pois quanto maior for a inibição, maior será a competição dos peptídeos em formar complexos estáveis com Fe2+, imobilizando-o. O EDTA foi utilizado como padrão quelante e o resultado foi expresso em porcentagem de inibição do íon complexo.
3.4.9 Medida da atividade antioxidante da mistura de cristas e barbelas de frango (1:1 p/p) e dos hidrolisados proteica
Poder Antioxidante de Redução do Ferro (FRAP)
A capacidade de redução férrica foi avaliada utilizando a metodologia FRAP (Ferric Reducing Antioxidant Power), conforme descrita por Benzie e Strain (1999). O
Após homogeneização os ensaios em triplicata foram mantidos à 37 °C por 30 minutos. Em seguida, de acordo com o potencial antioxidante, a atividade de redução do ferro (Fe3+) para a forma ferrosa (Fe2+) dos hidrolisados foi verificada a 593 nm em espectrofotômetro UV-VIS (Quimis, Q798U, São Paulo, Brasil), zerando-se o equipamento com o branco, contendo solvente e reagente FRAP. Com base na curva de calibração preparada com diferentes concentrações de Trolox 1000 µmol / L, os resultados foram expressos como mg equivalente Trolox / 100 g de amostra, de acordo com o potencial antioxidante dos hidrolisados.
Atividade Sequestradora do Radical 2,2-difenil-1picrilhidrazila (DPPH●)
A capacidade sequestradora do radical DPPH● dos hidrolisados proteicos avaliados foi determinada seguindo a metodologia descrita por Brand-Williams, Cuvelier e Berset (1995). Uma alíquota de 350 µL foi adicionada à 3,15 mL do radical DPPH (%) em metanol. Após homogeneização, foi realizada a leitura no tempo zero apenas do ensaio branco, contendo radical livre e solvente e todos os ensaios em triplicata foram mantidos a 25 °C por 30 minutos. Em seguida a atividade de eliminação do radical de acordo com a capacidade antioxidante dos hidrolisados foi verificada a 517 nm em espectrofotômetro UV-VIS (Quimis, Q798U, São Paulo, Brasil), em triplicata de ensaio, zerando-se o equipamento com metanol. Os resultados foram expressos em porcentagem de inibição do radical DPPH● em relação ao potencial antioxidante das amostras.
Atividade Sequestradora do Radical 2,2- azino-bis(3-etilbezotiazolina)-6-ácido
sulfônico (ABTS●+)
Brasil), zerando-se o equipamento com etanol. Os resultados foram expressos em porcentagem de inibição do radical ABTS●+em relação ao potencial antioxidante das amostras.
3.5 ANÁLISE ESTATÍSTICA
Os dados obtidos na otimização do processo de hidrolise da mistura de cristas e barbelas de frango (1:1 p/p) foram avaliados por análise de variância (ANOVA) utilizando-se o software Statistica versão 5.0 (STATSOFT, 2004), onde, a partir deste,
foram estimados os efeitos das variáveis estudadas e determinados os coeficientes do modelo para a resposta experimental, utilizando um nível de significância de 5% (p ≤ 0,05).
REFERÊNCIAS
ABDELHEDI, O.; JRIDI, M.; JEMIL, I.; MORA, L.; TOLDRÁ, F.; ARISTOY, M.; BOUALGA, A.; NASRI, M.; NASRI, R. Combined biocatalytic conversion of smooth hound viscera: Protein hydrolysates elaboration and assessment of their antioxidant, anti-ACE and antibacterial activities. Food Research International, v. 86, n. 1, p. 9-23, 2016.
ABPA. Associação Brasileira de Proteína Animal. Cenário, Carnes 2014/2015. São Paulo, 2015.
ABPA. Associação Brasileira de Proteína Animal. Relatório Anual 2016. São Paulo, 2016.
ADLER-NISSEN, J. Enzymic Hydrolysis of Food Proteins. New York: Elsevier Applied Science Publishers, 1986.
ALEMÁN, A.; GÓMEZ-GUILLÉN, M. C.; MONTERO, P. Identification of ace-inhibitory peptides from squid skin collagen after in vitro gastrointestinal digestion. Food Research International, v. 54, n. 1, p. 790-795, 2013.
AOAC. Official Methods of Analysis of AOAC INTERNATIONAL. 18th ed. Gaithersburg, MD, USA, 2010.
AOAC. Official Methods of Analysis of AOAC INTERNATIONAL. 19th ed. Gaithersburg, MD, USA, 2012.
ARAÚJO, A. R. R. Otimização da extração de colágeno da cartilagem do osso da quilha de frango, 2017a. Dissertação (Mestrado em Ciência e Tecnologia de
Alimentos) - Universidade Federal da Paraíba, João Pessoa.
AZUMA, K.; OSAKI, T.; TSUKA, T.; IMAGAWA, T.; OKAMOTO, Y.; MINAMI, S. Effects of fish scale collagen peptide on an experimental ulcerative colitis mouse model. Pharma Nutrition, v. 2, n. 4, p. 161-168, 2014.
BAH, C. S. F.; BEKHIT, A. E. A.; CARNE, A.; MCCONNELL, M. A. Production of bioactive peptide hydrolysates from deer, sheep and pig plasma using plant and fungal protease preparations. Food Chemistry, v. 176, n. 1, p. 54-63, 2015.
BENZIE, I. F. F.; STRAIN, J. J. Ferric reducing/antioxidant power assay: direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration. Methods in Enzymology, v. 299, p. 15-27, 1999.
BOUACEM, K.; BOUANANE-DARENFED, A.; LARIBI-HABCHI, H.; ELHOUL, M. B.; HMIDA-SAYARI, A.; HACENE, H.; OLLIVIER, B.; FARDEAU, M.; JAOUADI, B.; BEJAR, S. Biochemical characterization of a detergent-stable serine
alkalineprotease from Caldicoprobacter guelmensis. International Journal of
Biological Macromolecules, v. 81, n. 1, p. 299-307, 2015.
BRAND-WILIAMS, W.; CUVELIER, M. E.; BERSET, C. Use of a free radical method to evaluate antioxidant activity. Food Science and Technology, v. 28, p. 25-30, 1995.
BRASIL. Ministério da Agricultura e Abastecimento. Projeções do Agronegócio: Brasil 2013/2014 a 2023/2024 projeções de longo prazo. Diário Oficial da União. Brasília, 2014.
BRASIL. Ministério da Agricultura e Abastecimento. Projeções do Agronegócio: Brasil 2015/16 a 2025/26 projeções de longo prazo. Diário Oficial da União. Brasília, 2016.
CHEN, N.; YANG, H.; SUN, Y.; NIU, J.; LIU, S. Purification and identification of antioxidant peptides from walnut (Juglans regia L.) protein hydrolysates. Peptides, v.
38, n. 2, p. 344-349, 2012.
CHENG, S.; LAU, K.; LIU, T.; ZHAO, Y.; LAM, P.; YIN, Y. Mechanical and thermal properties of chicken feather fiber/PLA green composites. Composites Part B:
Engineering, v. 40, n. 1, p. 650-654, 2009.
CHI, C.; WANG, B.; HU, F.; WANG, Y.; ZHANG, B.; DENG, S.; WU, C. Purification and identification of three novel antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) skin. Food Research International, v.
73, n. 1, p. 124-129, 2015.
CHOI, J.; SABIKHI, L.; HASSAN, A.; ANAND, S. Bioactive peptides in dairy
products International. InternationalJournal of Dairy Technology, v. 65, n. 1, p. 1-12, 2012.
DE LA HOZ, L.; SILVA, V. S. N.; MORGANO, M. A.; PACHECO, M. T. B. Small peptides from enzymatic whey hydrolyzates increase dialyzable iron. International Dairy Journal, v. 38, n. 2, p. 145-147, 2014.
DE, S. D.; KRISHNA, S.; JETHWA, A. Iron status and its association with coronary heart disease: Systematic review and meta-analysis of prospective studies.
Atherosclerosis, v. 238, n. 2, p. 296-303, 2015.
DUAN, X.; OCEN, D.; WU, F.; LI, M.; YANG, N.; XU, J.; CHEN, H.; HUANG, L.; JIN, Z.; XU, X. Purification and characterization of a natural antioxidant peptide from fertilized eggs. Food Research International, v. 56, n. 1, p. 18-24, 2014.
EVANGELHO, J. A.; VANIER, N. L.; PINTO, V. Z.; BERRIOS, J. J.; DIAS, A. R. G.; ZAVAREZE, E. R. Black bean (Phaseolus vulgaris L.) protein hydrolysates:
FERRARO, V.; CARVALHO, A. P.; PICCIRILLO, C.; SANTOS, M. M.; CASTRO, P. M. L.; PINTADO, M. E. Extraction of high added value biological compounds from sardine, sardine-type fish and mackerel canning residues - A review. Materials Science and Engineering C, v. 33, n. 1, p. 3111-3120, 2013.
FOLCH, J.; LEES, M.; SLOANE STANLEY, G.H. A simple method for the isolation and purification of total lipids from animal tissues. Journal of Biological Chemistry, v. 226, n. 1, p. 497-509, 1957.
GARCÍA-MORENO, P. J.; ESPEJO-CARPIO, F. J.; GUADIX, A.; M. GUADIX, E. M. Production and identification of angiotensin I-converting enzyme (ACE) inhibitory peptides from Mediterranean fish discards. Journal of Functional Foods, v. 18, n. 1, p. 95-105, 2015.
GÓMEZ-GUILLÉN, M. C.; GIMÉNEZ, B.; LÓPEZ-CABALLERO, M. E.;
MONTERO, M. P. Functional and bioactive properties of collagen and gelatin from alternative sources: A review. Food Hydrocolloids, v. 25, n. 8, p. 1813-1827, 2011.
GUO, L.; HARNEDY, P. A.; O’KEEFFE, M. B.; ZHANG, L.; LI, B.; HOU, H.; FITZGERALD, R. J. Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides. Food Chemistry, v. 173, n. 1, p. 536-542, 2015.
HAGEN, S. R.; FROST, B.; AUGUSTIN, J. Pre column phenylisothiocyanate derivatization and liquid chromatography of amino acids in food. Journal of the Association of Official Analytical Chemists, v. 72, n. 6, p. 912-916, 1989.
HUANG, S.; LIU, P. Inhibition of Angiotensin I-Converting Enzymes by Enzymatic Hydrolysates from Chicken Blood. Journal of Food & Drug Analysis, v. 18, n. 6, p. 458-463, 2010.
JAMDAR, S.N.; HARIKUMAR, P. A rapid autolytic method for the preparation of protein hydrolysate from poultry viscera. Bioresource Technology, v. 99, p. 6934-6940, 2008.
KANCHANA, S.; ARUMUGAM, M.; GIJI, S.; BALASUBRAMANIAN, T. Isolation, characterization and antioxidant activity of hyaluronic acid from marine bivalve mollusc
Amussium pleuronectus (Linnaeus, 1758). Bioative Carbohydrates and Dietary
Fibre, v. 2, n. 1, p. 1-7, 2013.
KARIM, A. A.; BHAT, R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins. Food Hydrocolloids, v. 23, n. 3, p. 563-576, 2009.
LAEMMLI, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, v. 227, n. 5259, p. 680, 1970.
LAFARGA, T.; HAYES, M. Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients. Meat Science, v. 98, n. 8, p. 227-239, 2014.
LARIO, L. D.; CHAUD, L.; ALMEIDA, M. G.; CONVERTI, A.; SETTE, L. D.; PESSOA, A. Production, purification, and characterization of an extracellular acid protease from the marine Antarctic yeast Rhodotorula mucilaginosa L7. Fungal
biology, v. 119, n. 11, p. 1129-1136, 2015.
LASEKAN, A.; BAKAR, F. A.; HASHIM, D. Potential of chicken by-products as sources of useful biological resources. Waste Management, v. 33, n. 3, p. 552-565, 2013.
LASSOUED, I.; MORA, L.; BARKIA, A.; ARISTOY, M.; NASRI, M.; TOLDRÁ, F. Bioactive peptides identified in thornback ray skin's gelatin hydrolysates by proteases from Bacillus subtilis and Bacillus amyloliquefaciens. Journal of Proteomics, v. 128,
LEE, S.; SONG, K. Purification of an iron-binding nonapeptide from hydrolysates if porcine blood plasma protein. Process Biochemistry, v. 44, p. 378-381, 2009.
LEE, S.; CHEONG, S. H.; KIM, Y.; HWANG, J.; KWON, H.; KANG, S.; MOON, S.; JEON, B.; PARK, P. Antioxidant activity of a novel synthetic hexa-peptide derived from an enzymatic hydrolysate of duck skin by-product. Food and Chemical Toxicology, v. 62, n. 1, p. 276-280, 2013.
MARTÍNEZ-ALVAREZ, O.; CHAMORRO, S.; BRENES, A. Protein hydrolysates from animal processing by-products as a source of bioactive molecules with interest in animal feeding: A review. Food Research International, v. 73, p. 204-212, 2015.
MOHAMMADI, R.; MOHAMMADIFAR, M. S.; MORTAZAVIAN, A. M.; ROUHI, M.; GHASEMI, J. B.; DELSHADIAN, Z. Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology (RSM).Food Chemistry, v. 190, n. 1, p. 186-193, 2016.
MORA, L.; TOLDRÁ, F. Proteomic identification of small (< 2000 Da) myoglobin peptides generated in dry-cured ham. Food Technology and Biotechnology, v. 50, n. 3, p. 343-349, 2012.
MORA, L.; REIG, M; TOLDRÁ, F. Bioactive peptides generated from meat industry by-products. Food Research International, v. 65, n. 1, p. 344-349, 2014.
NIKOLAEV, I. V.; SFORZA, S.; LAMBERTINI, F.; ISMAILOVA, D. Y.; KHOTCHENKOV, V. P.; VOLIK, V. G.; DOSSENA, A.; POPOV, V. O.; KOROLEVA, O. V. Biocatalytic conversion of poultry processing leftovers:
Optimization of hydrolytic conditions and peptide hydrolysate characterization. Food Chemistry, v. 197, n. 1, p. 611-621, 2016.
PAN, X.; ZHAO, Y.; HU, F.; WANG, B. Preparation and identification of antioxidant peptides from protein hydrolysate of skate (Raja porosa) cartilage. Journal of
PASTORE, G. M.; BICAS, J. L.; MARÓSTICA, M. R. J. Biotecnologia de Alimentos. 1 ed. São Paulo: Atheneu, 2013, v.12.
RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A.; YANG, M., RICE-EVANS, C. Antioxidant activity applying an improved ABTS radical cation
decolorization assay. Free Radical Biology and Medicine, v. 26, n. 1, p. 1231-1237, 1999.
ROSA, C. S.; HOELZEL, S. C.; VIERA, V. B.; BARRETO, M.; BEIRÃO, L. H. Atividade antioxidante do ácido hialurônico extraído da crista de frango. Ciência Rural, v. 38, n. 9, p. 2593-2598, 2008.
SAIDI, S.; DERATANI, A.; BELLEVILLE, M. P.; AMAR, R. B. Antioxidant properties of peptide fractions from tuna dark muscle protein by-product hydrolysate produced by membrane fractionation process. Food Research International, v. 65, p. 329-336, 2014.
SAIGA, A.; IWAI, K.; HAYAKAWA, T.; TAKAHATA, Y.; KITAMURA, S.; NISHIMURA, T.; MORIMATSU, F. Angiotensin I-converting enzyme-inhibitory peptides obtained from chicken collagen hydrolysate. Journal of Agricultural and Food Chemistry, v. 56, n. 20, p. 9586-9591, 2008.
SANGSAWAD, P; SITTIRUK ROYTRAKUL, S; YONGSAWATDIGUL,
J.Angiotensin converting enzyme (ACE) inhibitory peptides derived from the simulated in vitro gastrointestinal digestion of cooked chicken breast. Journal of Functional Foods, v. 29, p. 77-83, 2017.
SAS INSTITUTE. SAS user's guide: Statistics; version 11.0. Cary, NC, USA: SAS Institute, 2014.
SATHIVEL, S.; BECHTEL, P. J.; BABBITT, J.; SMILEY, S.; CRAPO, C.;
REPPOND, K. D.; PRINYAWIWATKUL, W. Biochemical and functional properties of herring (Clupea harengus) byproduct hydrolysates. Journal Food Science, v. 68, n.
SCHAGGER, H.; JOAGOW, V. Tricine-sodium dodecyl sufate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry, v. 166, n. 1, p. 368-379, 1987.
SILA, A; BOUGATEF, A. Antioxidant peptides from marine by-products: Isolation, identification and application in food systems. A review. Journal of Functional Foods, v. 21, p. 10-26, 2016.
SILVA, M. E. C.; PACHECO, M. T. B.; LEME, A. F. P.; NETTO, F. M. Iron-binding peptides from whey protein hydrolysates: Evaluation, isolation and sequencing by LC– MS/MS. Food Research International, v. 71, n. 1, p. 132-139, 2015.
SCHMIDT, C. G.; SALAS-MELLADO, M. Influência da ação das enzimas alcalase e flavourzyme no grau de hidrólise das proteínas de carne de frango. Química Nova, v. 32, n. 5, p. 1144-1150, 2009.
STATSOFT, INC. Statistica (Data analysis software system), version 5.0. Tusa, OK, EUA (2004).
STOOKEY, L. L. Ferrozine-a new spectrophotometric reagent for iron. Analytical Chemistry,v. 42, n. 1, p. 779-781, 1970.
SUROWKA, K.; FIK, M. Studies on the recovery of proteinaceous substances from chicken heads: II. Application of pepsin to the production of protein
hydrolysate. Journal of the Science of Food and Agriculture, v. 65, n. 1, p. 289-296, 1994.
TAVANO, O. L. Protein hydrolysis using proteases: An important tool for food biotechnology. Journal of Molecular Catalysis B: Enzymatic, v. 90, n. 1, p. 1- 11, 2013.
UBABEF. União Brasileira de Avicultura. Relatório anual 2013. p. 14-19, 2013.
UEDA, E. K. M.; GOUT, P. W.; MORGANTI, L. Current and prospectiveapplications of metalion-proteinbinding. Journal of Chromatography A, v. 988, n. 1, p. 1-23, 2003.
WATANABE-KAMIYAMA, M.; SHIMIZU, M.; KAMIYAMA, S.; TAGUCHI, Y.; SONE, H.; MORIMATSU, F.; SHIRAKAWA, H; FURUKAWA, Y; KOMAI, M. Absorption and effectiveness of orally administered low molecular
weight collagen hydrolysate in rats. Journal of Agricultural and Food Chemistry, v. 58, n. 2, p. 835-841, 2010.
WHITE, J. A.; HART, R. J.; FRY, J. C. An evaluation of the Waters Pico-Tag system for the amino-acid analysis of food materials. Journal of Automatic Chemistry of Clinical Laboratory Automation, v. 8, n. 4, p. 170-177, 1986.
ZHANG, Y.; KOUGUCHI, T.; SHIMIZU, K.; SATO,M.; TAKAHATA, Y.;
MORIMATSU, F. Chicken collagen hydrolysate reduces proinflammatory cytokine production in C57BL/6. KOR-ApoEshl mice. Journal of Nutritional Science and Vitaminology, v. 56, n. 3, p. 208-210, 2010.
ZHANG,Y.; OLSEN, K.; GROSSI, A.; OTTE, J. Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides. Food
Chemistry, v. 141, n. 1, p. 2343-2354, 2013.
ZHAO. L.; HUANG, S.; CAI. X.; HONG, J.; WANG, S. A specific peptide with calcium chelating capacity isolated from whey protein hydrolysate. Journal of Functional Foods, v. 10, p. 46-53, 2014.
ZHU, K.; WANG, X.; GUO, X. Isolation and characterization of zinc-chelating
4 RESULTADOS
Os resultados obtidos nesta Tese estão apresentados em forma de Artigo Científico submetido em periódico de impacto na área de Ciência e Tecnologia de Alimentos e Patente.
Artigo: CHELATING AND ANTIOXIDANT CAPACITY OF PEPTIDES FROM CHICKEN COMBS AND WATTLES.
(Submetido ao Periódico Journal of Functional Food. Fator de impacto: 3,973. Qualis: A1).
Patente: PROCESSO DE OBTENÇÃO DE PEPTÍDEOS BIOATIVOS DERIVADOS DE CRISTAS E BARBELAS DE FRANGO.
Artigo: CHELATING AND ANTIOXIDANT CAPACITY OF PEPTIDES FROM CHICKEN COMBS AND WATTLES
CHELATING AND ANTIOXIDANT CAPACITY OF PEPTIDES FROM CHICKEN COMBS AND WATTLES
Taliana Kênia Alencar Bezerraa*, Ana Maria Barbosa Lima Sousaa, Lorena
Lucena de Medeirosa, Marcelo Antônio Morganob, Maria Teresa Bertoldo
Pachecob, Marta Suely Madrugaa
a Post-Graduate program in Food Science and Technology, Department of Food Engineering, Technology Centre, Federal University of Paraiba, 58051-900, Joao Pessoa, Paraiba, Brazil.
b Institute of Food Technology (ITAL), Applied Chemistry and Nutrition Center, 13073-001 Campinas, São Paulo, Brazil.
* Author to whom correspondence should be addressed; E-mail: taliana.kenia@hotmail.com; Tel.: +55-83-3216-7576; Fax: +55-83-3216-7269.
Abstract
presented the best hydrolytic performance (DH 19%); showing that in an enzyme to substrate (E:S) ratio of 5% and 240 minutes of hydrolysis. Hydrolysates with the > and < degrees of hydrolysis were evaluated, and the hydrolysate of the comb and wattle mixture obtained using the optimal process showed excellent Fe2+ chelating (>94%) and antioxidant capacities. This optimized hydrolysate reduced Fe3+ (>95 mg/100g equivalente trolox) and inhibited ABTS● (>46%) and DPPH● (>41%) radicals.
Keywords: protein hydrolysate, free radicals, chicken by-products, enzymatic process, bioactive compounds.
1 Introduction
The increased production of broiler chickens has resulted in an increase in the quantity of by-products generated during the slaughter process, as only the carcass has commercial value. The full exploitation of these by-products with innovative processing and industrialization technologies is of great economic importance since it adds value to the entire production chain (Lafarga & Hayes, 2014; Martínez-alvarez, Chamorro, & Brenes, 2015).