UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
LUIZ CARLOS PEREIRA ALMEIDA FILHO
SEMENTES DE Lonchocarpus sericeus (Poir) Kunth ex DC COMO REPOSITÓRIO DE INIBIDORES DE PROTEASES: PURIFICAÇÃO E SEUS EFEITOS SOBRE O
CICLO DE VIDA DO MOSQUITO Aedes aegypti
SEMENTES DE Lonchocarpus sericeus (Poir) Kunth ex DC COMO REPOSITÓRIO DE INIBIDORES DE PROTEASES: PURIFICAÇÃO E SEUS EFEITOS SOBRE O CICLO DE
VIDA DO MOSQUITO Aedes aegypti
FORTALEZA 2017
Tese submetida à Coordenação do Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Doutor em Bioquímica. Área de concentração: Bioquímica Vegetal
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
A448s Almeida Filho, Luiz Carlos Pereira.
Sementes de Lonchocarpus sericeus (Poir) Kunth ex DC como repositório de inibidores de proteases : purificação e seus efeitos sobre o ciclo de vida do mosquito Aedes aegypti / Luiz Carlos Pereira Almeida Filho. – 2017.
90 f. : il. color.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Programa de Pós-Graduação em Bioquímica , Fortaleza, 2017.
Orientação: Profa. Dra. Ana de Fátima Fontenele Urano Carvalho.
1. Inibidor de quimotripsina. 2. Lonchocarpus sericeus. 3. Dengue. 4. Zika. I. Título.
SEMENTES DE Lonchocarpus sericeus (Poir) Kunth ex DC COMO REPOSITÓRIO DE
INIBIDORES DE PROTEASES: PURIFICAÇÃO E SEUS EFEITOS SOBRE O CICLO DE
VIDA DO MOSQUITO Aedes aegypti
Tese submetida à Coordenação do Programa de
Pós-Graduação em Bioquímica da
Universidade Federal do Ceará, como requisito parcial para obtenção do título de Doutor em Bioquímica. Área de concentração: Bioquímica Vegetal
Aprovada em _____/______/______.
BANCA EXAMINADORA
_________________________________________________ Profa. Dra. Ana de Fátima Fontenele Urano Carvalho (Orientadora)
Universidade Federal do Ceará (UFC)
_________________________________________________ Profa. Dra. Daniele de Oliveira Bezerra de Sousa
Universidade Federal do Ceará (UFC)
_________________________________________________ Prof. Dr. José Tadeu Abreu de Olivera
Universidade Federal do Ceará (UFC
_________________________________________________ Dra. Carla Freire Celedonio Fernandes
Fundação Oswaldo Cruz (FioCruz)
_________________________________________________ Prof. Dr. Renato de Azevedo Moreira
Dedico este trabalho à memória do meu homem, meu Y, que hoje, não está mais ao meu lado fisico.
Ao meu pai Luiz Carlos P. Almeida, pelo amor, pelo carinho, pelas palavras duras auferidas em momentos certos, pelo cuidado, por ter deixado em mim o desejo de ser tão grande quanto foi, por ter me ensinado a andar pelos bons caminhos, por ter me orientado (...) por ter deixado em mim algo que não há palavras para descrever. Aonde quer que o sr. esteja, sempre te amarei meu “gorduchinho”. Multíssimo obrigado papai!
Ao meu avô Jerônimo Sousa, por ter me propiciado uma infância tão rica e, hoje, saudosa, por ter cuidado, por ter sido exemplo de dedicação para com os compromissos assumidos, pelo amor. Pela saudade que hoje sinto. Multíssimo obrigado vovô!
Ao meu avô Pedro Henrique, por assumir tão prontamente o papel de pai e de avô, diante do que ocorrera nesta minha jornada. Por ter me edificado e se tornado um porto, ainda, mais seguro para o seu neto, seu “pingo-preto”. Muito obrigado vovô!
Às minhas avós Maria Nilce e Luiza Pereira, pelo cuidado e carinho voltados a mim desde pequeno e nesses últimos anos, pelo amor de vó, pelos ensinamentos. Pelo sempre presente seio materno/parteno a acalentar nossas perdas. Vocês fazem parte da sólida base do meu caráter. Muito obrigado vovós!
À minha mãe Lúcia Cristyanne, por todo o amor, carinho e confiança durante todos esses anos, em que crescemos juntos, amadurecemos ideias e aprendemos com nossos erros. Mesmo estando longe, a sra. sempre se fez presente em minha vida. Obrigado pela vida, pelo carinho incondicional, pelo “amor de mãe”. Multíssimo obrigado mamãe!
pelas saudáveis brigas de irmãos, pelo carinho, pela dedicação em cuidar do “irmãozinho”, pelo companheirismo e palavras confortantes em momentos difíceis, por ser minha amiga e fiel confidente, pelo amor. Obrigado pequena, obrigado irmã!
À professora Dra. Ana de Fátima Fontenele U. Carvalho, pela orientação em seu laboratório, por ter me ensinado nesses últimos seis anos valororos saberes, pelas sábias palavras, pelos conselhos sempre bem postulados, pelos ensinamentos de vida e confiança a mim creditada, pelas histórias, pelas risadas, sim RISADAS!, por sempre propiciar um ambiente de trabalho amistoso e por despertar o desejo de seguir seus passos como mestra e tutora. À minha mãe cientifica, o meu muitíssimo obrigado!
À professora Dra. Érika Mota Freitas, pela sempre serena convivência e energia, pelas conversas e conselhos, pelo amor à Imunologia, por me orientar no ensino me fazendo crescer desde a graduação. A ela, meu muito obrigado!
Aos professores Dra. Ilka Maria Vasconcelos e Dr. José Tadeu Abreu de Oliveira, por terem de tamanha prontidão aberto as portas dos seus laboratórios, pelas orientações e contribuições em meus trabalhos de purificação, pelos valiosos conselhos e por terem de maneira tão substancial feito parte da minha formação acadêmica. A eles, meu muito obrigado!
À professora Dra. Denise Hissa Cavalcante, pela alegria e sorriso contagiantes de todos os encontros, pela ajuda com parte da caracterização molecular, pelas dicas e conselhos. Muito obrigado, Denise!
contribuições proferidas, pela alegria constante e por saber como “quebrar o gelo”. Muito obrigado!
À Dra. Carla Celedônio, pela prontidão ao aceitar participar da avalição deste trabalho e pelas valiosas contribuições proferidas. Muito obrigado!
Aos integrantes e amigos do Bioprospec, Davi Farias, Nathanna Mateus, Gabrielle Freire, Leonardo Vieira, Jackeline Medeiros, Thaís Borges, Thiago Almeida, Joaquim Lopes, Cláudio Dahne, Emanuel Francelino, Chayenne Sá, pela convivência sempre harmoniosa, pelas risadas, pelos coffee breaks na copa, momentos esses sempre muito relaxantes, pelas
ajudas em experimentos ou mesmo discussão de resultados. Obrigado a todos vocês!
À doutora Lady Clarissa B. da Rocha Bezerra, por me mostrar que dois teimosos podem ser bons amigos, pelas discussões sobre purificação, pela caracterização, pela convivência amorosa, pelas confidencias, pela amizade sincera. Muito obrigado, Ladyinha!
Ao mestrando Pedro Matheus Sousa Tabosa, por ter me permitido crescer junto a ele no mundo científico como seu coorientador de graduação, pelas ajudas em meus experimentos, pela paciência, pelas dúvidas, pela convivência harmoniosa, pelas saídas relaxantes. Muito obrigado, Pedrinho!
À Berenice Alves, pelos cuidados e carinho com todos nós, integrantes do Bioprospec e ao Sr. Valdenor, por sempre manter o limpo nosso ambiente de trabalho, pelas risadas e por deixar tudo 100! À eles, muito obrigado!
por toda a minha vida, pela fiel amizade, pelas risadas. Não nego ao dizer que vocês fazem parte do meu tesouro da graduação, meu muito obrigado!
Aos AMIGOS, por todos os momentos felizes que vivemos juntos, em especial a Cristiano Regis Freitas e Ivan Sampaio, por serem aqueles irmãos que vida me trouxe, por sempre me fazerem sentir feliz, pelos cuidados, por me fazerem rir mesmo em momentos tristes, por não me deixarem desistir, pelos abraços amigos, pela amizade e amor sinceros. O meu muito obrigado a vocês.
“É tão estranho os bons morrem jovens assim parece ser quando me lembro de você que acabou indo embora cedo demais...” (Renato Russo)
“O sucesso é ir de fracasso em fracasso sem perder entusiasmo.”
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES)
Universidade Federal do Ceará (UFC), Fortaleza, Ceará
Pró-Reitoria de Pesquisa e Pós-Graduação da Universidade Federal do Ceará, Fortaleza,
Ceará.
Departamento de Bioquímica e Biologia Molecular, Centro de Ciências, Universidade Federal
do Ceará, Fortaleza, Ceará.
Departamento de Biologia, Centro de Ciências, Universidade Federal do Ceará, Fortaleza,
Arboviroses como a chikungunya, dengue e zika representam um problema sério em saúde pública devido à ausência de uma vacina aprovada ou medicamentos antivirais específicos para sua prevenção e tratamento. Uma das maneiras de evitar a ocorrência dessas doenças é através do combate ao mosquito vetorial, Aedes aegypti. Este inseto pertence à ordem Diptera que
comumente possui enzimas digestivas similares à tripsina e quimotripsina. Os inibidores de protease são moléculas que podem promover o bloqueio da atividade enzimática prejudicando a digestão e a nutrição. Juntos, esses fatores podem levar à morte de insetos. Neste contexto, purificamos um inibidor de protease de sementes de uma planta sub-explorada, Lonchocarpus
sericeus. Este inibidor foi submetido a caracterização bioquímica e avaliado quanto a atividade
inibitória sobre as proteases digestivas do intestino médio das larvas Ae. aegypti e seu efeito
inseticida sobre a eclodibilidade de ovos, desenvolvimento desse mosquito. O inibidor purificado (LsCTI) mostrou uma única banda de proteína em SDS-PAGE, a massa molecular determinada por MALDI-TOF-MS foi de 8.870,45 Da. LsCTI foi capaz de inibir mais de uma protease serínica. As análises cinéticas revelaram o tipo de inibição não competitivo e o Ki
baixo para a quimotripsina (8,24 x 10-8 M). A resistência térmica do inibidor foi notável,
suportando aquecimento a 100 °C durante 180 min, sem perda de atividade. O valor da CI50 de
LsCTI para as enzimas do intestino médio das larvas de Ae. aegypti foi 4,7 x 10-7 M. O LsCTI
não afetou a eclodibilidade dos ovos quando testado a 0,3 mg.mL-1, mas causou alta taxa de
mortalidade larval (77%) e atraso no desenvolvimento (37%). Assim o LsCTI é um novo inibidor de protease com características bioquímicas notáveis e uma nova ferramenta potencial para controlar o desenvolvimento do mosquito Ae.aegypti.
Palavras-chave: Inibidor de quimotripsina. Lonchocarpus sericeus. Leguminosa. Dengue.
Arboviroses such as chikungunya, dengue and zika represent a serious issue in public health due to the absence of an approved vaccine or specific antiviral drugs for its prevention and treatment. One of the ways to avoid the occurrence of these diseases is by combating the mosquito vector, Aedes aegypti. This insect belongs to Diptera order, which commonly has
digestive enzymes similar to trypsin and chymotrypsin. Protease inhibitors are molecules that can block enzymatic activity leading to an impairment of digestion and nutrition. Together, these factors can lead the insects to death. In this context, we purified a new protease inhibitor from seeds of an underexploited plant, Lonchocarpus sericeus. This inhibitor was subjected to
a biochemical characterization, evaluated for the inbitory activity upon the digestive proteases from Aedes aegypti larvae and its insecticidal effect upon egg hatchability and larvae
development. The purified inhibitor (LsCTI) showed a single protein band on SDS-PAGE, the molecular mass determined by MALDI-TOF-MS was 8,870.45 Da. LsCTI was able to inhibit more than one serine protease. Kinetics analyzes revealed the type of noncompetitive inhibition and a low Ki for chymotrypsin (8.24 x 10-8 M). The stability of the inhibitory activity was
remarkable for the thermal resistance, LsCTI supported heating at 100 ° C for 180 min without losing its activity. The IC50 value of LsCTI was 4.7 x 10-7 M. for Ae. aegypti midgut enzymes.
LsCTI did not affect egg hatchability when tested at 0.3 mg.mL-1, but caused a high larval
mortality rate (77%) and developmental delay (37%). Thus, LsCTI is a novel protease inhibitor with remarkable biochemical characteristics and a novel potential tool to control the Ae. Aegypti
development.
Figura 1 Distribuição geográfica dos mosquitos Aedes aegypti... 23 Figura 2 Distribuição geográfica do mosquito Aedes aegypti e probabilidade de
epidemias no Brasil em 2013... 24
Figura 3 Caracterização esquemática do ciclo de vida de mosquitos pertencentes ao gênero Aedes... 26 Figura 4 Planta Lonchocarpus sericeus. (A) porte arbóreo; (B) flor dotada de
estandarte (pétala modificada); (C) fruto característico, legume seco indeiscente e (D) sementes reniformes de coloração marrom... 36 Figura 5 Chromatographic profile of LsF5 from Lonchocarpus sericeus on trypsin
agarose column equilibrated with 0.05 M Tris-HCl pH 7.5 buffer. Non-adsorbed proteins were eluted by washing with equilibration buffer. Adsorbed proteins were eluted with by adding 0.05 M HCl (arrow tip). Fractions of 1.0 mL were collected at flow rate of 0.5 mL.min-1 and subjected
to chymotrypsin inhibition assay………. 84
Figura 6 Mass spectrum (MALDI-TOF-MS) of Lonchocarpus sericeus chymotrypsin and trypsin inhibitor (LsCTI) under native conditions revealed a major peak at 8,870.45 Da; Inset: SDS-PAGE (15% w/v) profile of LsCTI, 1- molecular
mass markers (kDa), 2- LsCTI……….. 85
Figura 7 Electrophoretic profile on SDS-PAGE (15% w/v) of LsCTI after isoelectric focalization on a 7 cm gel strip with immobilized pH range (3-10). Arrows indicate the isoelectric point for observed isoforms……… 86 Figure 8 Inhibition kinetics. Lineweaver-Burk plot analysis of LsCTI toward (A)
concentrations and times at 37 °C; (C) and (D) after pH incubation at different pH for 16 h at 4 °C; (E) thermal stability after 30 min incubation at different temperatures and (F) after 100 °C in different times. Bars correspond to SD from triplicate measurements……….. 88 Figura 10 Inhibition of Aedes aegypti midgut digestive proteases by different
concentrations of LsCTI. The inhibition percentage was calculated regarding
to midgut proteases in the absence of LsCTI………. 89
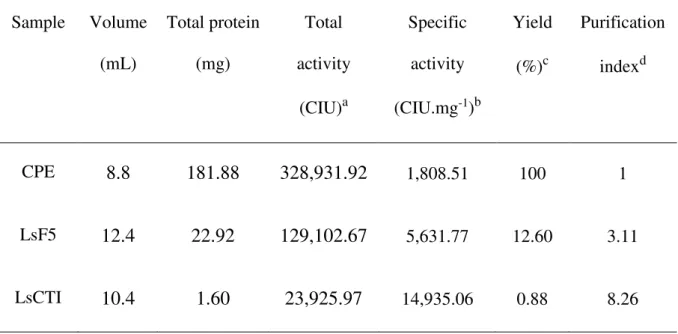
Tabela 1 Purification steps of Lonchocarpus sericeus chymotrypsin/trypsin inhibitor (LsCTI) from 1000 mg defatted seed flour………... 64 Tabela 2 Enzyme specific inhibitory activity of LsCTI toward different enzymes
classes……… 66
Tabela 3 Effect of LsCTI on the development of Aedes aegypti larvae arising from eggs treated with aqueous solution (0.3 mg.mL-1). The mortality, number of
individuals at different stages and delay on development were determined after eleven days of exposure. Bovine serum albumin, Soybean Bowan-Birk inhibitor and LsF5 were used at the same conditions. Distilled water was used as control. The mortality values are present as means and standard deviation of ten replicates. The different letters indicate significant difference assessed
BSA Albumina sérica bovina
BANA N-benzoil-arginina-naftilamida
BApNA Benzoil arginina nitroanilida
SAAVpNA N-succinyl-ala-ala-val-p-nitroanilide
CHAPS 3-[(3-Colamidopropil)-dimetil amônio]-propano- sulfonato EDTA Ácido etilenodiaminotetra acético
SDS Dodecil sulfato de sódio
TCA Ácido tricloroacético
DTT Ditiotreitol
IAA Iodoacetamida
DMAB ρ-dimetilaminobenzaldeido
pI Ponto isoelétrico
1 FUNDAMENTAÇÃO TEÓRICA... 17
1.1 Insetos vetores de doenças... 17
1.2 Arboviroses transmitidas por mosquitos Aedes sp.... 18
1.2.1 Chikungunya... 18
1.2.2 Zika... 19
1.2.3 Dengue ... 21
1.3 Aedes sp. e o ciclo de vida... 22
1.4 Controle dos vetores... 27
1.4.1 Inseticidas químicos... 27
1.4.2 Bioinseticidas... 29
1.5 Proteínas vegetais com potencial inseticida... 30
1.5.1 Inibidores de proteinases... 31
1.5.1.1 Inibidores de proteinases serínicas... 32
1.6 Lonchocarpus sericeus... 34
2 OBJETIVOS... 37
2.1 Objetivo geral... 37
2.2 Objetivos específicos... 37
3 CONSIDERAÇÕES FINAIS... 38
REFERÊNCIAS... 39
1 FUNDAMENTAÇÃO TEÓRICA
1.1 Insetos vetores de doenças
Insetos vetores de doenças (moscas, mosquitos, piolhos e pulgas) são os organismos intermediários no ciclo de vida de alguns patógenos e também os responsáveis pela sua disseminação aos organismos hospedeiros. Esses insetos podem ser apenas um veículo ao patógeno ou participar no seu desenvolvimento e/ou reprodução (REY, 2011).
As doenças transmitidas por insetos vetores representam um dos maiores desafios para o bem-estar humano atual e futuro. Vários insetos são responsáveis pelas transmissões da malária, da febre amarela, da encefalite japonesa, bem como de um grupo assim chamado "doenças tropicais negligenciadas", tais como a dengue, a leishmaniose e a doença de Chagas (HOTEZ et al., 2007; KOODALINGAM; MULLAINADHAN; ARUMUGAM, 2013). Atualmente, 3,9 bilhões de pessoas em mais de 120 países estão nas áreas de risco. Contabilizando, as doenças transmitidas por esses insetos são responsáveis por 17% das doenças infecciosas, causando a morte de mais de 1 milhão de pessoas todos os anos (WHO, 2017)
Nas últimas décadas esses tipos de doenças estão se tornando uma séria preocupação de saúde para os países mais desenvolvidos (HOTEZ, 2008), devido à migração dos vetores para áreas antes não habitadas em resposta às mudanças climáticas e ao desmatamento. Assim, insetos que tinham como hábitat as florestas migraram e adaptaram-se às cidades (GONZÁLEZ et al., 2010). Além disso, o aumento da migração humana internacional e das trocas comerciais
promoveram a introdução acidental de vetores e/ou patógenos entre os continentes (ALTIZER et al., 2011). Dentre os insetos de importância médico-sanitária, os mosquitos dos gêneros
Anopheles sp., Aedes sp. e Culex sp. são considerados os principais vetores de doenças como a
malária, chikungunya, dengue, febre amarela, zika e filariose (RACLOZ et al., 2012; MUSSO;
GUBLER, 2016).
Um grande número de estudos empíricos e teóricos sobre doenças humanas transmitidas por vetores tem contribuído para o entendimento da importância ecológica e evolução dos vetores na transmissão da doença, na evolução do patógeno e para desenho de estratégias de controle eficientes. Esses trabalhos geralmente se concentram em áreas altamente endêmicas, onde as populações dos vetores fundamentais, quer sejam de mosquitos (Anopheles, Aedes ou
Culex), moscas (Glossina), flebotomíneos ou triatomíneos (Triatoma infestans e Rhodnius prolixus) são auto-sustentáveis (RASCALOU et al., 2012). Em áreas como essas, o controle
do vetor é realizado com auxílio de produtos químicos ou de controle biológico e consiste em uma estratégia fundamental para diminuir o impacto dessas doenças em seres humanos. No entanto, campanhas de combate são inevitavelmente limitadas a sua eficácia local (VAN DEN BERG, 2011; PEDRINI et al., 2011).
1.2 Arboviroses transmitidas por mosquitos Aedes sp.
Mosquitos são vetores para muitas doenças importantes, isso significa que podem levar os agentes etiológicos de um hospedeiro para outro. Geralmente, as enfermidades causadas têm ampla distribuição global, altas taxas de mortalidade e elevada incidência. São chamadas de arboviroses as doenças causadas pela picada de artrópodes, como os mosquitos (‘ARthropod -BOrne viruses’). Existem cerca de 30 vírus de maior importância para a saúde pública que são transmitidos por mosquitos. Febre amarela, chikungunya, dengue e zika são as principais doenças transmitidas pelos mosquitos do gênero Aedes, essas ultimas merecem detaque devido
à ausência de vacinas aprovadas para sua prevenção, bem como o número de recentes surtos virais que acomete a população (SAWAR, 2015).
1.2.1 Chikungunya
A febre chikungunya é uma arbovirose causada pelo CHIKV (vírus Chikungunya) pertencente à família Togaviridae, transmitido através da picada de fêmeas de mosquitos do gênero Aedes infectadas. Esse vírus é tipicamente encontrado na África e Sudeste Asiático,
africano Makonde, fazendo referência ao efeito da artralgia incapacitante vista nos pacientes afetados (ENSERINK, 2006).
O vírus CHIKV possui dois ciclos de transmissão distintos: enzoótico e urbano. Na África, o primeiro ocorre em hábitats florestais onde mosquitos arbóreos, principalmente Aedes
spp, servem como vetores. As evidências apontam os primatas não humanos como os reservatórios principais e os hospedeiros de amplificação no ciclo enzoótico. CHIKV é, por sua vez, capaz de iniciar um ciclo de transmissão urbano a partir de pessoas que moram próximo a áreas enzoóticas, sendo esse dependente apenas de mosquitos Ae. aegypti e/ou Ae. albopictus e
hospedeiros de amplificação humana (WEAVER; REISEN, 2010).
Estudos realizados em pacientes infectados durante o surto na ilha La Réunion (ilha situada no Oceano Índico, a leste de Madagascar) indicaram que a artralgia era bilateral e simétrica em 78,4% dos pacientes, sendo capaz de afetar principalmente tornozelos, joelhos, mãos, pulsos, pés, ombros e cotovelos. A erupção cutânea estava presente em 54% dos pacientes, predominantemente no tronco e nos braços. O edema periarticular foi relatado em 45% dos pacientes, afetando os tornozelos em maior proporção. Mialgia e cefaleia ocorreram em 72 e 63% dos pacientes, respectivamente. Sinais hemorrágicos como gengivorragia e epistaxe manifestaram-se em apenas 10,6% dos pacientes (STAIKOWSKY et al., 2009; THIBERVILLE et al., 2013)
Para essa doença ainda não há tratamento antiviral específico. Em virtude disso, as recomendações terapêuticas são para alívio sintomático e de suporte, sendo compostas de repouso e uso de agentes anti-inflamatórios não esteroidais (AINE) em fase aguda e corticoides para aliviar o componente artrítico crônico da doença. Todavia, este é indicado após a exclusão de diagnóstico para doenças mais graves, como a malária, dengue e infecções bacterianas (CAGLIOTI et al., 2013). Na pendência do desenvolvimento da vacina, o controle dos mosquitos vetores é, ainda, o melhor método disponível para prevenir a infecção por CHIKV aliado a individual contra picadas de mosquitos.
1.2.2 Zika
O vírus Zika (ZIKV) é um arborvírus pertencente aos Flavivirus e o responsável por causar a arbovirose que leva o mesmo nome. Foi isolado pela primeira vez em 1947 a partir do soro de macacos Rhesus utilizados como sentinelas na Floresta Zika (Uganda) durante um
da infecção em humanos foi inicialmente evidenciada pela presença de anticorpos neutralizantes nos soros de residentes da África Oriental nas décadas seguintes (ZANLUCA; DOS SANTOS, 2016).
Desde então, ZIKV tem sido descrito como causador de infecções humanas esporádicas na África e na Ásia. Contudo, em 2007, um surto dessa doença foi notificado em Yap Island, Micronésia. Este foi o primeiro surto registrado fora dos continentes africano e asiático. No início de 2015, o Ministério da Saúde do Brasil confirmou um novo surto junto à transmissão autóctone de ZIKV no país. Os primeiros casos foram identificados na região Nordeste do país, onde foram relatados casos de doença exantemática associada a febre, conjuntivite e artralgia. Em 2016, foram notificados casos de zika em mais de 40 países das América e Caribe e, em 2017, foi registrado o primeiro caso na Flórida, Estados Unidos, retratando a dispersão da doença por toda Ámerica continental (ZANLUCA et al., 2015; CAMPOS, BANDEIRA, SARDI, 2015; BAUD et al., 2017)
Assim como ocorre na chikungunya , a transmissão do vírus Zika se dá pela picada de mosquitos, principalmente do gênero Aedes, durante o repasto sanguíneo realizado pelas
fêmeas. Apesar do primeiro vetor documentado para ZIKV ser Ae. Africanus, outras espécies
de mosquitos como o Ae. aegypti e Culex quinquefasciatus já foram capazes de transmitir esse
vírus, mostrando que os surtos podem não estar relacionados apenas aos mosquitos do gênero
Aedes (GUO et al., 2016).
Um ponto de extrema preocupação em saúde pública é a associação desse vírus à ocorrência de casos de microcefalia em neonatos. Isso se deve à capacidade do ZIKV em atravessar a barreira transplacentária e se alojar no sistema nervoso dos fetos, acarretando não apenas microcefalia, como também, problemas de visão, surdez, artrogripose e disfagias (DUARTE et al., 2017). Outro ponto alarmante sobre a transmissão do vírus Zika diz respeito à sua habilidade de se instalar em tecidos imunoprivilegiados, como os tecidos germinativos presente nos testículos. Tal fato foi corroborado pela presença desse vírus no sêmen de um paciente várias semanas após a fase aguda da doença, tornando a zika uma potencial infecção sexualmente transmissível (MUSSO et al., 2015).
distúrbios digestivos, linfadenopatia cervical, hematúria e hematospermia (ZANLUCA; DOS SANTOS, 2016).
Até o presente momento, a vacina para esse vírus está em fase clinica I. Outras estratégias de prevenção para ZIKV incluem as medidas de controle e eliminação de focos de reprodução de mosquitos, bem como o uso de repelentes para proteção pessoal.
1.2.3 Dengue
Dengue é uma doença flaviviral causada por um dos quatro sorotipos do vírus DENV que ocorrem principalmente em áreas tropicais e subtropicais. Seus vetores predominantes são os mosquitos do gênero Aedes, capazes de carrear qualquer um dos sorotipos desse vírus e
transmitir a doença através do repasto sanguíneo em seres humanos (SHEPARD et al., 2011). A incidência da dengue cresceu dramaticamente em todo o mundo nas últimas décadas. Esse aumento pode ser atribuído a vários fatores, que incluem o crescimento da população aliado à urbanização não planejada (e consequente sobrecarga dos sistemas de água e saneamento), aumento das movimentações nacionais e internacionais, o transporte de mercadorias, tais como pneus, além de recursos financeiros limitados para implementação de medidas eficazes de controle dos vetores (SIMMONS et al., 2012).
Estudos recentes indicam que ocorrem cerca de 400 milhões de infecções por dengue/ano e que 3,9 bilhões de pessoas vivem em áreas de risco à infecção. Tais dados fazem desta arbovirose transmitida por mosquitos, a mais difundida, afetando 128 países em todo o mundo (WHO, 2017; BHATT et al., 2013). Contudo, esses números podem aumentar nos próximos anos, pois os mosquitos vetores que antes habitavam as regiões em países de latitudes tropicais e subtropicais passaram a ocorrer em regiões de latitudes temperadas devido ao aumento da temperatura mundial (BOWMAN, DONEGAN, MCCALL, 2016).
elevação do hematócrito (aumento de 20%), podendo causar ascite, derrame pleural e trombocitopenia (<100.000 plaquetas/mm3), este último pode levar o indivíduo a episódios
hemorrágicos. Por fim, a dengue síndrome de choque (DSS) difere da DHF, principalmente, pelo comprometimento do sistema cardiovascular, rápida elevação do hematócrito, dor abdominal intensa, vômitos persistentes e redução da pressão arterial (ZHANG et al., 2014).
Diferente da zika e chikungunya, a dengue possui uma vacina aprovada para uso em áreas endêmicas, sendo esta, uma composição tetravalente de vírus vivos atenuados (Dengvaxia®) capaz de induzir resposta imunológica robusta para os 4 sorotipos da dengue (SCOTT, 2016). Em áreas onde a vacina ainda não é autorizada, o tratamento sintomático é realizado com auxílio de analgésicos e antipiréticos (deve-se evitar o uso de aspirina e outros salicilatos devido ao risco de hemorragias), e é adotada como medida para prevenção desta infecção o controle dos mosquitos e o uso de repelentes para proteção individual (BOWMAN, DONEGAN, MCCALL, 2016).
1.3 Aedes sp. e o ciclo de vida
Os principais vetores da chikungunya, zika e dengue são fêmeas de mosquitos do gênero
Aedes (Diptera:Culicidae), sendo apontados Ae. aegypti, e Ae. albopictus. O primeiro constitui
o principal vetor, enquanto o segundo, mostra-se mais importante em algumas regiões asiáticas. O mosquito Ae. aegypti é adaptado ao ambiente urbano e utiliza os recipientes mais frequentes
no domicílio ou peridomicílio – tanques de armazenamento de água e vasilhames temporários, dentro e fora das casas, como potes, barris, pneumáticos usados, latas, garrafas e vasos de plantas – para o desenvolvimento de sua fase larvária. Já o Ae. albopictus prefere o hábitat
natural da floresta, como buracos em árvores, axilas de folhas, e cascas de coco. Cria-se, mais frequentemente, fora das casas, em jardins (BRAGA; VALE, 2007).
Provavelmente, esses mosquitos foram introduzidos nas Américas a bordo de navios vindos da Europa, que cruzavam o Atlântico durante as primeiras explorações e colonizações europeias (BISSET, 2002). Atualmente, são encontrados em uma larga faixa latitudinal global ocorrendo em todos os continentes, com ênfase ao americano no qual se estende da Argentina ao sul dos Estados Unidos da América (EUA) (Figura 1). No Brasil, o Ae. aegypti está presente
A intensidade de cor vermelha indica densidade populacional de mosquitos Ae. aegypti.
Fonte: Santos; Meneses, 2017.
Fonte: Fundação Oswaldo Cruz (Fiocruz), 2013
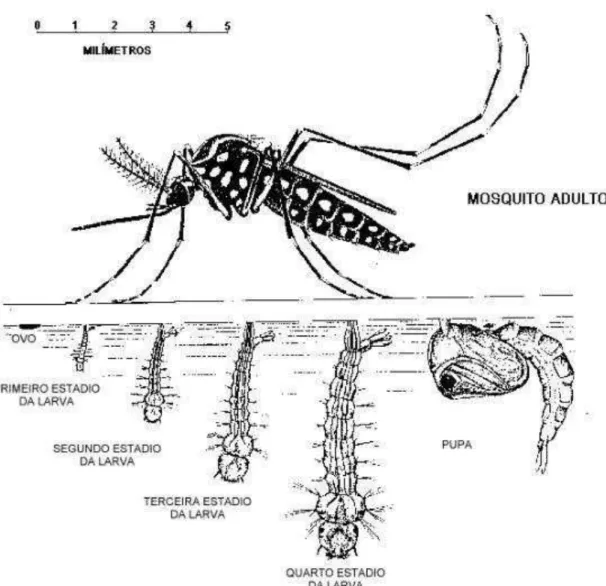
Os mosquitos do gênero Aedes são insetos holometábolos, o que significa que passam
por metamorfose completa: ovo, larva, pupa e fase adulta (Figura 3). A duração da vida adulta pode variar de duas semanas a um mês, dependendo das condições ambientais (PONTUAL et al., 2014). Esses mosquitos possuem hábitos alimentares distintos, já que os machos se alimentam apenas de seiva de folhas e frutos, enquanto que as fêmeas, por sua vez, podem se alimentar tanto de seiva quanto de sangue de animais (ZARA et al., 2016).
Após o repasto sanguíneo, as fêmeas produzem em média de 100-200 ovos. No entanto, este número está diretamente ligado à quantidade de sangue ingerida. As fêmeas podem ovopositar até cinco vezes durante a vida. Os ovos são colocados em superfícies úmidas em zonas susceptíveis de inundação temporária, como buracos de árvores e/ou recipientes feitos pelo homem. A ovoposição pode ser distribuída ao longo de horas ou dias, dependendo da disponibilidade de substratos apropriados. Na maioria das vezes, os ovos são colocados em diferentes distâncias acima da linha de água em dois ou mais locais (FOSTER; WALKER, 2002).
As larvas são providas de grande mobilidade e não selecionam alimentos, podendo filtrar até dois litros de água por dia. Passam por quatro estádios (L1, L2, L3 e L4) e a duração do desenvolvimento larval depende da temperatura, da disponibilidade de nutrientes e da densidade de larvas. Sob condições ótimas, o tempo necessário para completar o ciclo pode ser de somente 7 dias, incluindo os dois dias da fase de pupa (ALMEIDA FILHO, 2013).
A etologia do Ae. aegypti beneficia sua ampla dispersão, favorecida nos ambientes
urbanos, preferencialmente no intra- e no peridomicílio humano. Essa espécie de mosquito, raramente é encontrada em ambientes semissilvestres ou onde não há presença intensa do homem, pois mesmo havendo outras fontes de alimentação, tais como cães, suínos, bovinos, roedores e aves, as fêmeas de Ae. aegypti se alimentam preferencialmente de sangue humano.
Devido à inquietude do hospedeiro humano durante a alimentação sanguínea, a fêmea consegue fazer ingestões múltiplas de sangue durante um único ciclo gonadotrófico, o que amplia a sua capacidade de se infectar e de transmitir os vírus. Este comportamento torna o Ae. aegypti um
vetor eficiente na propagação das arboviroses (ZARA et al. 2016).
Figura 3 – Caracterização esquemática do ciclo de vida de mosquitos pertencentes ao gênero
Aedes
1.4 Controle dos vetores
Os pesticidas ou inseticidas utilizados, atualmente, podem ser classificados em 2 grupos: convencionais e alternativos (seletivos). Os inseticidas convencionais são substâncias químicas que pertencem às classes dos organoclorados, organofosforados, carbamatos e piretroides. Já os alternativos ou biopesticidas são produtos de origem natural que podem ser microorganismos (ex: Bacillus thuringiensis var. israelenses) ou compostos bioquímicos capazes de induzir a
morte ou retardar o desenvolvimento dos insetos (ex: lectinas, inibidores de proteases) (REDDY; TANGTRAKULWANICH, 2014).
1.4.1 Inseticidas químicos
O controle químico, com inseticidas sintéticos de origem orgânica ou inorgânica, é uma das metodologias mais adotadas como parte do manejo sustentável e integrado para o controle de vetores em Saúde Pública. Os inseticidas pertencentes aos organoclorados, organofosforados e piretroides são os mais utilizados e agem sobre o sistema nervoso dos insetos (BALDACCHINO et al., 2015).
Os organoclorados são inseticidas que contêm carbono, hidrogênio e cloro. São classificados em quatro grupos: difenil-alifáticos; hexaclorociclohexanos; ciclodienos; e policloroterpenos. Esses são os mais antigos pesticidas químicos utilizados. Dentre esses encontra-se o DDT (diclorodifeniltricloroetano), o inseticida mais notório do século passado. Esse composto atua sobre os canais de sódio, causando um desequilíbrio no balanço entre os íons sódio e potássio dos axônios impedindo a propagação dos impulsos nervosos em insetos e mamíferos (BRAGA; VALLE, 2007). Embora esses tenham sido largamente adotados pelos programas de controle de mosquitos vetores, tiveram seu uso descontinuado e chegaram, inclusive, a ser proibidos em vários países devido a sua persistência no ambiente e ao acúmulo em tecidos do organismo de animais e de humanos (VENIER; HITES, 2014).
aplicação. Além disso, são mais tóxicos para os vertebrados que os organoclorados, mesmo em doses relativamente baixas (WARE; WHITACRE, 2004).
Os organofosforados têm como mecanismo de ação a ligação irreversível com a acetilcolinesterase, enzima responsável pela quebra do neurotransmissor acetilcolina. O acúmulo de acetilcolina na fenda sináptica impede a interrupção do impulso nervoso causando paralisia seguida de morte (PAILAN et al., 2015). O Temefós é um organofosforado, registrado nos EUA em 1965 para utilização em agricultura e controle de mosquitos, é o único larvicida desse grupo com uso generalizado no controle de larvas de mosquitos, recomendado pela OMS. Contudo, populações resistentes aos organofosforados também foram detectadas, levando à substituição por novos inseticidas, agora da classe dos piretroides (OCAMPO et al., 2011; MAESTRE-SERRANO et al., 2014).
Os piretroides sintéticos, atualmente bastante estáveis, são produzidos em laboratório a partir de uma substância natural, o piretro, extraído de crisântemos. São biodegradáveis, não cumulativos e raramente provocam intoxicações agudas em aves e mamíferos, embora possam causar irritação das mucosas nesses animais. Para os animais aquáticos, entretanto, são extremamente tóxicos (BRAGA; VALE, 2007). Possuem ainda como vantagens, o fato de serem muito ativos (necessidade de pequenas doses) e repelentes. Esses compostos apresentam modo de ação similar ao do DDT, que mantêm abertos os canais de sódio das membranas dos neurônios. Este fenômeno afeta o sistema nervoso dos insetos, fazendo com que as células nervosas produzam descargas repetitivas e, eventualmente, causem a paralisia do inseto (JAN et al., 2015).
Apesar do surgimento de novos compostos químicos, o manejo de forma inadequada ocasionou o surgimento de população de insetos resistentes, e por causa do aumento da resistência dos insetos-praga aos inseticidas químicos, a pesquisa por inseticidas naturais e biodegradáveis tem aumentado, com o objetivo de minimizar o impacto ao ambiente, encontrar novos compostos que promovam a mortalidade das larvas e prevenir surgimento de linhagens resistentes. Alguns extratos de plantas podem ser considerados fitoinseticidas e servir como alternativas para realizar o controle dos mosquitos (PONTUAL et al., 2012).
1.4.2 Bioinseticidas
Os bioinseticidas são desenvolvidos a partir de organismos vivos que ocorrem naturalmente, como animais, plantas e microorganismos. Podem controlar insetos-praga prejudiciais por meio de seu modo de ação eco-friendly, ou seja, baixa toxicidade ao ambiente.
Os bioinceticidas e os seus produtos são utilizados, principalmente, para o manejo de pragas prejudiciais às plantas, todavia, podem também ser empregados no combate de insetos vetores de doenças (MAZID; KALIDA; RAJKHOWA et al. 2011). Eles são frequentemente alvo específicos, inócuos para insetos não-alvo e não causam problemas na qualidade do ar e água no ambiente. Além disso, o uso desses produtos tem outras vantagens, por exemplo, baixa capacidade de indução à resistência das pragas alvo (SENTHIL-NATHAN, 2015).
Esses compostos foram usados nas indústrias comerciais, agrícolas e hortícolas para reduzir o risco gerado pelos pesticidas químicos sobre organismos não-alvo, por possuírem baixa atividade residual para trabalhadores/aplicadores e para os inimigos naturais (ex: parasitoides e predadores) (KHATER, 2012). Quando utilizados como constituintes no manejo de insetos-praga, sua eficácia pode ser igual àquela dos inseticidas convencionais (químicos), particularmente, para culturas como frutas, vegetais, nozes e flores. Ao ponderar o desempenho de inseticidas sintéticos e a segurança ambiental, os bioinseticidas executam de modo eficaz o controle e o surgimento de pragas resistentes (SENTHIL-NATHAN, 2013).
Inseticidas botânicos são compostos resultantes do metabolismo primário ou secundário das plantas. Esses, por sua vez, podem apresentar mecanismos de ação diversos para causar a morte dos insetos, pois podem atuar sobre o sistema nervoso central, dificultando o crescimento e o desenvolvimento e/ou interferindo no metabolismo celular (CORRÊA; SALGADO, 2011).
1.5 Proteínas vegetais com potencial inseticida
As plantas, por serem organismos sésseis, estão expostas a uma grande quantidade de fatores de estresse do meio ambiente. Além das influências impróprias de seus arredores, também estão sujeitas a constante ameaça de predadores e patógenos. Para transpor essa diversidade de condições desfavoráveis, as plantas passaram por adaptações evolutivas que culminaram no desenvolvimento de sofisticadas estratégias de defesa e a síntese de uma impressionante gama de compostos bioativos, sendo alguns tóxicos e/ou capazes de alterar os padrões químicos e físicos das plantas vizinhas (MAAG et al., 2014).
Entre os diferentes compostos tóxicos produzidos pelas plantas, podemos destacar um grande grupo de compostos de baixa massa molecular, como por exemplo, alcaloides, terpenoides, taninos e glicosídeos (MITHÖFER E BOLAND, 2012) e moléculas de alta massa molecular, que incluem proteínas inativadoras de ribossomos (RIPs), lectinas, inibidores de alfa-amilase e inibidores de proteinases (VIRGILIO et al., 2010). Essas classes de proteínas são, particularmente, abundantes em órgãos de reserva tais como tubérculos e sementes e possuem diferentes mecanismos de ação sobre os seres fitófagos, podendo atuar dificultando a absorção de nutrientes ou clivagem de proteínas, bem como interferindo na síntese de proteínas do predador (JABER; HAUBRUGE.; FRANCIS, 2010).
As lectinas são uma classe de proteínas que possuem atividade de ligação a carboidratos com pelo menos um domínio não catalítico, que se liga reversivelmente com mono- ou oligossacarídeos específicos. Embora a maioria das lectinas tenha sido caracterizada a partir de plantas, essas proteínas também foram relatadas em animais, insetos, vírus, fungos e bactérias, podendo atuar como moléculas de reconhecimento do sistema imune, proteínas de reserva e proteínas de adesão da superfície celular (VAN DAMME; LIUYI DANG, 2015). Além disso, também têm sido implicadas nos mecanismos de defesa contra agentes patogênicos invasores e predadores. Em geral, a toxicidade exercida pelas lectinas, para algumas espécies, é devido à sua ligação a estruturas específicas de carboidratos presentes nas células epiteliais do trato digestório do predador. Essa ligação pode causar alterações drásticas na morfologia celular e metabolismo do trato digestório dos animais herbívoros, além de ativar cascatas de sinais bioquímicos que alteram seu metabolismo (YAMAMOTO et al. , 2013).
A toxicidade de lectinas a diferentes ordens de insetos tem sido relatada nas últimas décadas, incluindo Coleoptera, Lepidoptera (CZAPLA; LANG, 1990) e Homoptera (SAUVION et al., 1996). Os efeitos prejudiciais de lectinas sobre parâmetros biológicos de
desenvolvimento e redução na fecundidade das primeira e segunda gerações. Há estudos recentes da toxicidade de lectinas a insetos-praga de importância econômica como o afídeo da ervilha (Acyrthosiphonpisum) (SAUVION et al., 2004), larva da beterraba (Spodoptera
exigua), (SHAHIDI-NOGHABI et al., 2009) e contra o mosquito vetor da dengue (Aedes aegypti) (SANTOS et al., 2012).
As proteínas inativadoras de ribossomos (RIPs) constituem um grupo de proteínas que são capazes de inativar os ribossomos tanto de procariotos quanto eucariotos. Por conta disso, compreendem uma classe de enzimas citotóxicas que possuem atividade específica de rRNA N-glicosidase (PEUMANS; HAO, VAN DAMME, 2001). As RIPs desempenham um papel importante na defesa vegetal, pois, uma vez inativados os ribossomos, a síntese de proteínas é comprometida e, consequentemente, há um desbalanço bioquímico no predador que pode afetar seu desenvolvimento ou ocasionar sua morte. Ricina e abrina constituem exemplos de proteínas que inativam irreversivelmente ribossomos, possuindo efeito tóxico contra uma variedade de insetos, mesmo que esses efeitos sejam variáveis em diferentes ordens de insetos (JABER et al., 2010; AKKOUH et al, 2015).
Os inibidores de alfa-amilase são moléculas conhecidas como bloqueadores de amido. Impedem a quebra desse em moléculas de maltose, amilopectina e glucose, capazes de serem absorvidas pelo organismo tanto do vegetal, desempenhando funções regulatórias endógenas, quanto do predador, atuando como moléculas de defesa. Esses inibidores são extraídos de várias famílias de plantas, em especial, a família Fabaceae. Já há relatos do uso da biotecnologia para a transformação de plantas, tais como a ervilha (Pisum sativum L.) e feijão
azuki (Vigna anguralis L.), a fim de que essas expressem esses inibidores com efeito inseticida
(KLUH et al., 2005).
O potencial inseticida dos inibidores de alfa-amilase é relatado principalmente sobre insetos pertencentes à subfamília dos bruquídeos (Coleoptera: Bruchidae), como os gorgulhos
Callosobruchus maculatus e Zabrotes subfasciatus, uma vez que durante o seu
desenvolvimento larval utilizam como fonte de alimentação majoritária o amido (GUPTA; SHARMA; NATH, 2014).
1.5.1 Inibidores de proteinases
proteinase de origem vegetal, principalmente os encontrados em órgãos vegetativos, reprodutivos e de reserva das famílias Fabaceae, Poacea e Solanaceae são os mais estudados (MACEDO et al., 2009).
Estudos apontam que essas moléculas possuem variadas funções, podendo atuar como reguladores de proteinases endógenas, proteínas de reserva e como agentes na defesa vegetal a microrganismos, insetos e outros animais herbívoros. Essas proteínas são classificadas de acordo com as classes enzimáticas, podendo ser, inibidores de proteinases serínicas, cisteínicas, aspárticas ou inibidores de metaloproteinases (MACEDO et al., 2007).
Os inibidores são tradicionalmente agrupados em famílias conhecidas como Kunitz, Bowman-Birk, Batata I e II, Abóbora, Cevada, Cistatinas, Thaumatin-like e Ragi A1. Dentre estas, as famílias Kunitz e Bowman-Birk são as mais estudadas e melhor caracterizadas (OLIVA et al., 2010).
1.5.1.1 Inibidores de proteinases serínicas
Inibidores de proteinases serínicas são amplamente distribuídos no reino vegetal e já foram descritos em muitas espécies de plantas, principalmente as pertencentes às famílias Brassicaceae, Curcubitaceae, Fabaceae, Salicaceae, Leguminosae e Solanaceae. O papel fisiológico desses inibidores nas plantas inclui a regulação das proteinases endógenas durante a dormência das sementes, imobilização das proteínas de reserva (como forma de preservar os tecidos), proteção contra as enzimas proteolíticas de parasitas e insetos, e como proteínas de reserva (SANTAMARIA et al., 2014).
As famílias do tipo Kunitz e Bowman-Birk constituem as famílias de inibidores de proteinases serínicas mais estudadas. Parte disso, deve-se à descoberta dos inibidores presentes na soja (Glycine max), o SbTI (Soy bean trypsin inhibitor) e BBI (Bowman-Birk inhibitor).
Inibidores do tipo Kunitz, em geral, possuem massa molecular entre 18 a 22 kDa e apresentam estrutura primária constituída por 181 resíduos de aminoácidos, um único sítio reativo que se liga à tripsina, com uma ou duas cadeias polipeptídicas. Esses inibidores usualmente contêm quatro resíduos de cisteína (cys39 – cys86 e cys136 – cys145) em duas pontes dissulfeto que, uma vez rompidas, acarretam a perda de sua atividade biológica (OLIVA et al., 2010). Já os
proteinases serínicas devido à presença de mais de um sítio reativo (CARLINI; GROSSI DE SÁ, 2002).
Durante as últimas décadas, os inibidores de proteinases ganharam bastante atenção devido ao seu envolvimento na defesa vegetal e possíveis aplicações na engenharia de plantas para aumentar a resistência a insetos e outro patógenos. Com relação aos insetos, isso ocorreu devido ao fato de que suas enzimas digestivas passaram a ser um potencial alvo para o seu controle populacional (SENTHILKUMAR; CHENG; YEH, 2010).
Os mecanismos de ação desses inibidores são variáveis entre as diferentes classes de insetos. Essas moléculas podem se ligar às enzimas proteolíticas dos insetos e impedir a digestão de proteínas, acarretando assim um déficit na absorção de aminoácidos essenciais para o desenvolvimento e reprodução dos insetos. Algumas classes de insetos, para compensar o efeito dos inibidores, aumentam a produção de proteinases na tentativa de manter a taxa de digestão e absorção de aminoácidos, porém essa estratégia pode levar à limitação de aminoácidos como cisteina e metionina presentes nas enzimas serínicas. Essa limitação na biodisponibilidade de aminoácidos essenciais pode causar redução da síntese de proteínas utilizadas no crescimento e desenvolvimento, levando o inseto à morte (ANDERSON et al., 2012).
Assim como os insetos possuem mecanismos bioquímicos de escape à ação dos inibidores, as plantas por sua vez, durante essa co-evolução presa-predador, desenvolveram estratégias para contrapor às adaptações dos insetos. Embora as enzimas digestivas dos insetos sejam abundantes em proteinases do tipo tripsina e quimotripsina, sua exposição aos inibidores, por longo prazo, induz os insetos a promoção da síntese de novas isoformas dessas enzimas digestivas que são menos inibidas ou mais eficientes para digerir o inibidor. Essa adaptabilidade dos insetos exige inibidores mais potentes e efetivos. Assim, as plantas desenvolveram a capacidade de produzir diferentes isoformas de um mesmo inibidor, através de modificações pós-traducionais ou por fenômenos de duplicação gênica. Essas isoformas, apesar de bastantes similares, possuem características distintas como ponto isoelétrico, capacidade inibitória e resistência à digestão, podendo ser mais eficazes ao combate das pragas (MACEDO et al., 2002; MORRISON et al., 2007; JAMAL et al., 2013).
O potencial inseticida desses inibidores sobre diferentes classes de insetos vem sendo relatado nas ultimas décadas, como por exemplo, os inibidores das sementes Adenanthera
pavonina (ApTI), Cassia leiandra (ClTI) e Leucaena leucocephala (LTI) sobre as larvas do
mosquito Ae. aegypti (Diptera) (ALMEIDA FILHO, et al., 2017; DIAS et al., 2017; SASAKI
neonatos do lepidóptero Anagasta kuehniella (DA SILVA BEZERRA et al., 2016;
GUIMARÃES et al., 2015) e o inibidor de Dimorphandra mollis (DMTI-II) sobre o inseto
Callosobruchus maculatus (Coleoptera) (MACEDO et al., 2002).
1.6 Lonchocarpus sericeus
A família Fabaceae é a segunda maior família de plantas, possuindo cerca de 600 gêneros e 12.000 espécies. Esta família é dividida em três subfamílias: Mimosoideae, Caesalpinoideae e Faboideae, contendo cerca de 60, 150 e 430 gêneros, respectivamente.
Lonchocarpus sericeus (Poir.) Kunth ex DC é uma leguminosa pertencente às Faboideae.
(EVANS, 2002). No Brasil, pode ser encontrada do norte do estado do Pará ao sul do estado do Rio de Janeiro. Além disso, distribui-se geograficamente na África, América Central, Ásia, Austrália, Colômbia e Caribe (INTERNATIONAL LEGUME DATABASE & INFORMATION SERVICE, 2017).
L. sericeus é comumente conhecida no sertão nordestino por “ingazeiro”, e em
Fortaleza, no Ceará, por “ingá” ou “ingá-bravo”. É encontrada com frequência à margem de cursos d’água e em formações florestais, como mata de galeria e mata costeira (MARTINS DE SOUSA, 2003). É uma árvore caducifólia que atinge 10 a 16 metros de altura, com caule de coloração amarela e copa ampla e densa. Suas inflorescências são racemos pendentes de flores roxas, seu fruto é verde ou marrom e revestido por indumento ferruginoso, apresentando constrições de tamanhos variados entre as sementes, de formato reniforme e coloração amarronzada (Figura 4) (AZEVEDO-TOZZI, 1989).
Na literatura cientifica, é possivel perceber que a planta L. sericeus é bem estudada
quanto a seus metabólitos secundários e suas aplicabilidades. Fitoquímicos como alcaloides, saponinas, carotenoides, flavonoides, taninos, triterpenos e esteroides já foram detectados nos extratos metanólicos da casca do caule, sementes e raiz (OYEDEJI et al., 2015). Estudos mais detalhados mostram que L. sericeus contém os seguintes flavonoides (chalconas): derricina e
lonchocarpina (FONTENELE et al., 2005) que apresentaram atividade citotóxica sobre
diversos tipos celulares (CUNHA et al., 2003).
Além de se apresentar como uma boa fonte de metabólitos secundários, L. sericeus
que incluem sua habilidade em inibir o edema de pata e a migração de neutrófilos para a cavidade peritoneal de ratos (ALENCAR et al., 1999) e a atividade anti-inflamatória e antimicrobiana em modelo de peritonite infecciosa em ratos (ALENCAR et al., 2005).
Tendo em vista que as sementes de L. sericeus possuem 3 classes de proteínas biotivas
Figura 4 – Planta Lonchocarpus sericeus. (A) porte arbóreo; (B) flor dotada de estandarte
(pétala modificada); (C) fruto característico, legume seco indeiscente e (D) sementes reniformes de coloração marrom.
Fonte: Elaborado pelo autor.
A
B
C
2 OBJETIVOS
2.1 Objetivo geral
Purificar um inibidor de proteinase serínica das sementes de Lonchocarpus sericeus e
avaliar seu efeito sobre o desenvolvimento do mosquito Aedes aegypti.
2.2 Objetivos específicos
Este trabalho teve como objetivos específicos:
Purificar o inibidor de quimotripsina/tripsina presente nas sementes de L.
sericeus;
Caracterizar o inibidor purificado quanto à massa molecular, numero de subunidades, ponto isoelétrico e existência de isoformas;
Determinar a especificidade inibitória; cinética de inibição enzimática e constante de inibição frente às enzimas quimotripsina e tripsina;
Avaliar a manutenção da atividade inibitória após exposição a diferentes valores de pH, temperatura e concentrações de ditiotreitol (DTT)
Analisar a capacidade inibitória deste inibidor in vitro sobre as enzimas de larvas
de 3º estádio de Ae. aegypti;
Verificar o efeito deste inibidor sobre o desenvolvimento do mosquito Aedes
3 CONSIDERAÇÕES FINAIS
Neste estudo foi abordada a espécie Lonchocarpus sericeus, uma planta que apesar de
exótica, adaptou-se às condições, drásticas tanto hídrica quanto térmica da Caatinga. Esta planta já possui alguns estudos na literatura sobre o potencial de seus metabólitos secundários. Nosso grupo de pesquisa já realizou algumas investigações sobre o seu potencial nutricional e biotecnológico, mostrando que as sementes dessa planta podem servir como fonte dos macronutrientes proteínas e lipídeos para a alimentação humana e que possui proteínas biotivas com potencial de uso na engenharia de planta, tais como ureases e inibidores de protease.
Neste trabalho foi realizada a purificação de um inibidor de quimotripsina a partir das proteínas presente nas sementes dessa espécie. Este inibidor possui características similares àquelas da família dos inibidores Bowman-Birk, como baixa massa molecular (8,7 kDa), presença de isoformas, habilidade de inibir mais de uma enzima proteolítica, elevada resistência a temperatura e variações de pH. Da mesma forma foi também mostrado o potencial biotecnológico desse inibidor, que foi capaz de atuar sobre o desenvolvimento das larvas do mosquito Ae. aegypti causando elevada taxa de mortalidade. Os inibidores de proteases já vêm
sendo estudados quanto a sua capacidade inseticida para servirem como formas alternativas ao combate de insetos-praga. Essas moléculas inseticidas, além de atuarem diretamente sobre os insetos, ainda podem atuar como potencializadores de inseticidas já comercializados, como é o caso dos produtos à base de proteínas Cry.
Este trabalho pode servir como base para o estudo do potencial inseticida do inibidor de proteases presente nas sementes de L. sericeus. Além de se somar aos outros trabalhos que
REFERÊNCIAS
AKKOUH, O.; NG, T. B.; CHEUNG, R. C.; WONG, J. H.; PAN, W.; NG, C. C.; SHA, O.; SHAW, P. C.; CHAN, W. Y. Biological activities of ribosome-inactivating proteins and their possible applications as antimicrobial, anticancer, and anti-pest agents and in neuroscience research. Applied microbiology and biotechnology, v. 99, p. 9847-9863, 2015.
ALENCAR, N. M. N.; CAVALCANTE, C. F.; VASCONCELOS, M. P.; LEITE, K. B; ARAGÃO, K. S.; ASSREUY, A. M. S.; NOGUEIRA, N. A. P.; CAVADA, B. S.; VALE, M. R. Anti‐inflammatory and antimicrobial effect of lectin from Lonchocarpus sericeus seeds in an experimental rat model of infectious peritonitis. Journal of pharmacy and
pharmacology, v. 57, p. 919-922, 2005.
ALENCAR, N.M.N.; TEIXEIRA, E.H.; ASSREUY, A.M.S.; CAVADA, B.S.; FLORES, C.A.; RIBEIRO, R.A. Leguminous lectins as tools for studying the role of sugar residues in leukocyte recruitment. Mediators of inflammation, v. 8, p. 107-113, 1999.
ALMEIDA FILHO, L. C. P. Efeito de inibidores de tripsina obtidos de sementes de Leucaena leucocephala (Lam) R. de Witt sobre o desenvolvimento de Aedes aegypti.
2013. Dissertação (Mestrado em Bioquímica) – Centro de ciências, Universidade Federal do Ceará, Fortaleza, Ceará, 2013.
ALMEIDA FILHO, L. C.; DE SOUZA, T. M.; TABOSA, P.; SOARES, N. G.; ROCHA‐ BEZERRA, L. C.; VASCONCELOS, I. M.; CARVALHO, A. F. Trypsin inhibitor from Leucaena leucocephala seeds delays and disrupts the development of Aedes aegypti, a multiple‐disease vector.Pest management science, v. 73, p. 181-187, 2017.
ALTIZER, S.; BARTEL, R.; HAN, B. A. Animal migration and infectious disease risk. Science, v. 33, p. 296–302, 2011.
ANDERSON, M.; STEVENS, J.; DUNSE, K.; FOX, J.; EVANS, S. Biotechnological Approaches for the Control of Insect Pests in Crop Plants. In: Pesticides – Advances in Chemical and Botanical Pesticides. InTech, 2012.
AZEVEDO-TOZZI, A. M. G. Estudos taxonômicos dos gêneros Lonchocarpus Kunth e Deguelia Aubl. no Brasil. 1989. Tese de Doutorado, Instituto de Biologia da Universidade
Estadual de Campinas, Campinas, São Paulo, 1989.
BÄCK, A. T.; LUNDKVIST, A. Dengue viruses - an overview. Infection Ecology & Epidemiology, v. 3, e:19839, 2013.
BALDACCHINO, F.; CAPUTO, B.; CHANDRE, F.; DRAGO, A.; DELLA TORRE, A.; MONTARSI, F.; RIZZOLI, A. Control methods against invasive Aedes mosquitoes in
Europe: a review. Pest Management Science, v. 71, p. 1471-1485, 2015.
BAUD, D.; GUBLER, D. J.; SCHAUB, B.; LANTERI, M. C.; MUSSO, D. An update on Zika virus infection. Lancet, England, London. DOI: 10.1016/S0140-6736(17)31450-2, 2017. BHATT, S.; GETHING, P. W.; BRADY, O. J.; MESSINA, J. P.; FARLOW, A. W.;
MOYES, C. L.; DRAKE, J. M.; BROWNSTEIN, J. S.; HOEN, A. G.; SANKOH, O.;
MYERS, M. F.; GEORGE, D. B.; JAENISCH, T.; WINT, G. R.; SIMMONS, C. P.; SCOTT, T. W.; FARRAR, J. J.; HAY, S. I. The global distribution and burden of dengue. Nature, v. 496, p. 504-507, 2013.
BISSET, J. A. Uso correcto de insecticidas: control de la resistencia. Revista Cubana de Medicina Tropical, n. 54, v. 3, p. 202-219. 2002.
BOWMAN, L. R.; DONEGAN, S.; MCCALL, P. J. Is Dengue vector control deficient in effectiveness or evidence?: Systematic Review and Meta-analysis. PLoS Neglected Tropical Diseases, v. 17, e:0004551, 2016.
BRAGA, I. A.; VALLE, D. Aedes aegypti: inseticidas, mecanismos de ação e resistência.
Epidemiologia e Serviços de Saúde, n. 16, v. 4, p. 279-293,. 2007
CAGLIOTI, C.; LALLE, E.; CASTILLETTI, C.; CARLETTI, F.; CAPOBIANCHI, M. R.; BORDI, L. Chikungunya virus infection: an overview. New Microbiology, v. 36, p. 211-227, 2013.
CAMPOS, G. S.; BANDEIRA, A. C.; SARDI, S. I. Zika virus outbreak, Bahia, Brazil. Emerging Infectious Diseases, v. 21, p. 1885-1886, 2015.
CARLINI, C. R.; GROSSI-DE-SA, M. F. Plant toxic proteins with insecticidal properties. A review on their potentialities as bioinsecticides. Toxicon, v. 40, p.1515-1539. 2002.
CARVALHO, A. F. U.; FARIAS, D. F.; DA ROCHA-BEZERRA, L. C. B.; DE SOUSA, N. M.; CAVALHEIRO, M. G.; FERNANDES, G. S.; BRASIL, I. C. F.; MAIA, A. A. B.; SOUSA, D. O. B.; VASCONCELOS, I. M.; GOUVEIA, S. T.; MACHADO, O. L. T. Preliminary assessment of the nutritional composition of underexploited wild legumes from
semi-arid Caatinga and moist forest environments of northeastern Brazil. Journal of food
composition and analysis, v. 24, p. 487-493, 2011.
CORREA, J. C. R.; SALGADO, H. R. N. Atividade inseticida das plantas e aplicações: revisão. Revista Brasileira de Plantas Medicinais, v. 13, p.500-506, 2011.
CUNHA, G.M.A.; FONTENELE, J.B.; NOBRE-JUNIOR, H.V.; MARTINS-DESOUSA, F.C.; SILVEIRA, E.R.; NOGUEIRA, N.A.P.; MORAES, M.O.; VIANA, G.S.B.; COSTA-LOTUFO, L.V. CUNHA, Cytotoxic activity of chalcones isolated from Lonchocarpus sericeus (Pocr.) Kunth. Phytotherapy Research, v. 17, p. 155-159, 2003.
CZAPLA, T. H.; LANG B. A. Effect of plant lectins on the larval development of European corn borer (Lepidoptera: Pyralidae) and southern corn rootworm (Coleoptera:
Crysomelidae). Journal of Economic Entomology, n. 83, v. 6, p. 2480-2485. 1990.
P. M. G.; RIBEIRO, S. F. F.; GOMES, V. M.; SILVA, O. N.; MARIA-NETO, S.; FRANCO, O. L.; MACEDO, M. L. R. Exploiting the biological roles of the trypsin inhibitor from Inga vera seeds: a multifunctional Kunitz inhibitor. Process Biochemistry, v. 51, p. 792-803, 2016.
DANG, L.; VAN DAMME, E. J. M. Toxic proteins in plants. Phytochemistry, v. 117, p. 51-64, 2015.
DIAS, L. P.; OLIVEIRA, J. T. A.; ROCHA-BEZERRA, L. C. B.; SOUSA, D. O. B.; COSTA, H. P. S.; ARAUJO, N. M. S.; CARVALHO, A. F. U.; TABOSA, P. M. S.;
MONTEIRO-MOREIRA, A. C. O.; LOBO, M. D. P.; MORENO, F. B. M. B.; ROCHA, B. A. M.; LOPES, J. L. S.; BELTRAMINI, L. M.; VASCONCELOS, I. M. A trypsin inhibitor purified from Cassia leiandra seeds has insecticidal activity against Aedes aegypti. Process Biochemistry, v. 57, p. 228-238, 2017.
DUARTE, G.; MORON, A. F.; TIMERMAN, A.; FERNANDES, C. E.; MARIANI NETO, C.; ALMEIDA FILHO, G. L.; WERNER JUNIOR, H.; ESPÍRITO SANTO, H. F. B. D.; STEIBEL, J. A. P.; BORTOLETTI FILHO, J.; ANDRADE, J. B. B.; BURLÁ, M.; SILVA DE SÁ, M. F.; BUSSO, N. E.; GIRALDO, P. C.; MOREIRA DE SÁ, R. A.; PASSINI JUNIOR, R.; MATTAR, R.; FRANCISCO, R. P. V. Zika virus infection in pregnant women and microcephaly. Revista Brasileira de Ginecologia e Obstetrícia, v. 39, p. 235-248, 2017. DUPUIS-MAGUIRAGA, L.; NORET, M.; BRUN, S.; LE GRAND, R.; GRAS, G.;
ROQUES, P. Chikungunya Disease: Infection-Associated Markers from the Acute to the Chronic Phase of Arbovirus-Induced Arthralgia. PLoS Neglected Tropical Diseases, v. 6: e1446, 2012.
ENSERINK, M. Infectious diseases. Massive outbreak draws fresh attention to little-known virus. Science, v. 311, p. 1085, 2006.
EVANS, W. C. A taxonomic approach to the study of medicinal plants and animal derived drugs. In: Trease and Evans’ Pharmacognosy. London, Elsevier, 2002, p. 15-40.
FONTENELE, J. B.; LEAL, L. K. A. M.; FERREIRA, M. A. D.; SILVEIRA, E. R; VIANA,
G. S. B. Antiplatelet Effect of Lonchocarpin and Derricin Isolated from Lonchocarpus
sericeus. Pharmaceutical biology, v. 43, p. 726-731, 2005.
FOSTER W.A.; WALKER E.D. Mosquitoes (Culicidae). Medical and veterinary entomology. London: Academic, 2002. p. 203-262.
GALÁN-HUERTA, K. A.; RIVAS-ESTILLA, A. M.; FERNÁNDEZ-SALAS, I.;
FARFAN-ALE, J. A.; RAMOS-JIMÉNEZ, J. Chikungunya virus: A general overview. Medicina
universitaria, v. 17, p. 175-183, 2015.
GUIMARÃES, L. C.; DE OLIVEIRA, C. F. R.; MARANGONI, S.; DE OLIVEIRA, D. G. L.; MACEDO, M. L. R. Purification and characterization of a Kunitz inhibitor from
Poincianella pyramidalis with insecticide activity against the Mediterranean flour moth. Pesticide biochemistry and physiology, v. 118, p. 1-9, 2015.
GUO, X; LI, C.; DENG, Y.; XING, D.; LIU, Q.; WU, Q.; SUN, A.; DONG, Y.; CAO, W.; QIN, C.; ZHAO, T. Culex pipiens quinquefasciatus: a potential vector to transmit Zika virus.
Emerging Microbes and Infections,v. 5, e102, 2016.
GUPTA, M.; SHARMA, P.; NATH, A. K. Purification of a novel α-amylase inhibitor from local Himalayan bean (Phaseolus vulgaris) seeds with activity towards bruchid pests and
human salivary amylase. Journal of food science and technology, v. 51, p. 1286-1293, 2014. HOTEZ, P. J. Neglected infections of poverty in the United States of America. PLoS
Neglected Tropical Diseases, v. 2, e:256, 2008.
HOTEZ, P.J.; MOLYNEUX, D.H.; FENWICK, A.; KUMARESAN, J.; SACHS, S. E.; SACHS, J.D.; SAVIOLI, L. Control of neglected tropical diseases. The New England Journal of Medicine, v. 357, p. 1018–1027, 2007.
INTERNATIONAL LEGUME DATABASE & INFORMATION SERVICE – Reported
generated by Legume web from the ILDIS World Database of legumes, version 10 disponivel em <http://www.ildis.org/AliceWeb/6.00/taxa/3036.shtml> em 21 de fevereiro de 2017.
JABER, K.; HAUBRUGE, E.; FRANCIS, F. Development of entomotoxic molecules as control agents: illustration of some protein potential uses and limits of lectins (Review) Biotechnology, Agronomy, Society and Environment. v. 14, p. 225-241, 2010.
JAMAL, F.; PANDEY, P. K.; SINGH, D.; KHAN, M. Y. Serine protease inhibitors in plants: nature’s arsenal crafted for insect predators. Phytochemistry reviews, v. 12, p. 1-34, 2013. JAN, M. T.; ABBAS, N.; SHAD, S. A.; SALEEM, M. A. Resistance to organophosphate, pyrethroid and biorational insecticides in populations of spotted bollworm, Earias vittella
(Fabricius) (Lepidoptera: Noctuidae), in Pakistan. Crop Protection, v. 78, p. 247-252, 2015. KHATER, H. F. Prospects of botanical biopesticides in insect pest management.
Pharmacology, v. 3, p. 641-655, 2012.
KLUH, I.; HORN, M.; HÝBLOVÁ, J.; HUBERT, J.; DOLECKOVÁ-MARESOVÁ, L.; VOBURKA, Z.; KUDLÍKOVÁ, I.; KOCOUREK, F.; MARES, M. Inhibitory specificity and insecticidal selectivity of a-amylase inhibitor from Phaseolus vulgaris. Phytochemistry, v.
66, p. 31-39, 2005.
KOODALINGAM, A.; MULLAINADHAN, P.; ARUMUGAM, M. Immuno-suppressive effects of aqueous extract of soapnut Sapindus emarginatus on the larvae and pupae of vector
mosquito, Aedes aegypti. Acta tropica, v. 126, p. 249-255, 2013.
LINGARAJU, M. H.; GOWDA, L. R. A. Kunitz trypsin inhibitor of Entada scandens seeds:
Another member with single disulfide bridge. Biochimica et Biophysica Acta, v. 1784, p. 850–855. 2008.
MAAG, D.; ERB. M.; KÖLLNER, T. G.; GERSHENZON, J. Defensive weapons and defense signals in plants: Some metabolites serve both roles. BioEssays v. 37, p. 167-174, 2014.
MACEDO, M. L. R.; GARCIA, V. A.; FREIRE, M. G. M.; RICHARDSON, M.
Characterization of a Kunitz trypsin inhibitor with a single disulfide bridge from seeds of Inga laurina (SW.) Willd. Phytochemistry, v. 68, p. 1104–1111, 2007.
MACEDO, M. L. R.; MELLO, G. C.; FREIRE, M. G. M.; NOVELLO, J. C.; MARANGONI, S.; MATOS, D. G. G. Effect of a trypsin inhibitor from Dimorphandra mollis seeds on the
development of Callosobruchus maculatus. Plant Physiology and Biochemistry, v. 40, p.
891-898. 2002.
MACEDO, M. L. R.; PANDO, S. C.; CHEVREUIL, L. R.; MARANGONI, S. Properties of a kunitz-type trypsin inhibitor from Delonix regia seeds against digestive proteinases of
Anagasta kuehniella (Z.) and Corcyra cephalonica (S.) (Lepidoptera: Pyralidae). Protein and
Peptides Letters, n. 16, v. 12, p. 1459 - 1465. 2009.
MAESTRE-SERRANO, R.; GOMEZ-CAMARGO, D.; PONCE-GARCIA, G.; FLORES, A. E. Susceptibility to insecticides and resistance mechanisms in Aedes aegypti from the
Colombian Caribbean Region. Pesticide Biochemistry and Physiology, v. 116, p. 63-73, 2014.
MARTINS DE SOUSA, F. C. Aspectos químicos do estudo químicofarmacológico de plantas do nordeste: Myracroduon urundeuva (Fr. All.), Lonchocarpus sericeus (Poir.) Kunth e Stachytarpheta sp. 2003. Dissertação de mestrado, Departamento de Química
Orgânica e Inorgânica da Universidade Federal do Ceará, Fortaleza, Ceará, 2003.
MAZID, S.; KALIDA, J. C.; RAJKHOWA, R. C. A review on the use of biopesticides in insect pest management. International Journal of Science and Advance Technology, v. 1, p. 169-178, 2011.
MITHÖFER, A.; BOLAND, W. Plant defense against herbivores: chemical aspects. Annual. Review in Plant Biology, v. 63, p. 431-450, 2012.
MORRISON, S. C.; SAVAGEA, G. P.; MORTONA, J. D.; RUSSELLB, A. C.Identification and stability of trypsin inhibitor isoforms in pea (Pisum sativum L.) cultivars grown in New
Zealand. Food Chemistry. v. 100, p. 1-7, 2007.
MUSSO, D.; GUBLER, D. J. Zika virus. Clinical Microbiology Reviews. n. 29, p. 487–524, 2016.