GISLENE FÁTIMA DA SILVA ROCHA FOURNIER
ESTUDO EPIDEMIOLÓGICO DE Toxoplasma gondii EM ANIMAIS SILVESTRES E
GATOS DOMÉSTICOS DE DUAS UNIDADES DE CONSERVAÇÃO NA CIDADE DE NATAL, RN
Dissertação apresentada ao Programa de Pós‐Graduação em Biologia da Relação Patógeno‐Hospedeiro do Instituto de Ciências Biomédicas da Universidade de São Paulo, para obtenção do Título de Mestre em Ciências.
ESTUDO EPIDEMIOLÓGICO DE Toxoplasma gondii EM ANIMAIS SILVESTRES E
GATOS DOMÉSTICOS DE DUAS UNIDADES DE CONSERVAÇÃO NA CIDADE DE NATAL, RN
Dissertação apresentada ao Programa de Pós‐Graduação em Biologia da Relação Patógeno‐Hospedeiro do Instituto de Ciências Biomédicas da Universidade de São Paulo, para obtenção do Título de Mestre em Ciências.
Área de concentração: Biologia da Relação Patógeno–Hospedeiro.
Orientadora: Profa. Dra. Solange Maria Gennari. Versão original
UNIVERSIDADE DE SÃO PAULO INSTITUTO DE CIÊNCIAS BIOMÉDICAS
___________________________________________________________________________
Candidato(a): Gislene Fatima da Silva Rocha Fournier.
Título da Estudo epidemiológico de Toxoplasma gondii em animais
silvestres e gatos domésticos de duas Unidades de Conservação na cidade de Natal, RN.
Orientador(a): Profa. Dra. Solange Maria Gennari.
A Comissão Julgadora dos trabalhos de Defesa da Dissertação de Mestrado, em sessão pública realizada a .../.../..., considerou
( ) Aprovado(a) ( ) Reprovado(a)
Examinador(a): Assinatura: ... Nome: ... Instituição: ...
Examinador(a): Assinatura: ... Nome: ... Instituição: ...
Presidente: Assinatura: ... Nome: ...
Posso não chegar onde eu quero, mas morreria se não tentasse. (Hilana, 2013) A mon amour, Jean-François, pour tous les jours vécus ensemble et ton amour.
A Profa. Dra. Solange Maria Gennari pela oportunidade e conhecimentos transferidos a mim. A Dra Hilda F. J. Pena pelo ensinamento diário, franqueza, e por todas “hildadas” necessárias
ao meu crescimento profissional.
Ao Dr. Prof. Arlei Marcili pelo apoio, ensinamento e dedicação na elaboração e execução deste projeto.
A minha Maezinha inspiração da minha vida.
Aos meus irmãos e companheiros por toda vida Gilsi, Gilvânia e Gicélio. E ao meu Pai pela compreensão e respeito às minhas decisões.
A minha querida amiga Maria por ter me ensinado, orientado e pela amizade pura e sincera. A amiga Aline Diniz (Fia) por todo ensinamento e amizade. Sem você nada seria possível! A amiga e exemplo de vida Andrea Borges da Costa por todos os ensinamentos e apoio em
todos os momentos. E ao amigo Francisco pelos ensinamentos, paciência e carinho. Ao Dr. Miliano Maximo e aos protetores de Natal, em especial Hilana, por acreditarem em
um mundo mais justo para os animais e pelo belíssimo trabalho realizado.
Ao Dr. Carlos Prudêncio por me apresentar a Prof. Solange juntamente com a Maria. vocês mudaram minha vida!
A Família Lima pela melhor hospedagem do mundo. Vocês são ótimos!!! Ao Dan que sempre “rema” comigo e por toda vida!
Aos amigos: Adriano Pinter; Diego, Paula, Amália, Julinha, Marcos (Piauí), Herbert, Natalia, Willian, Tiago, Igor, Jonas, Renatinho, Juliana, Lipinho, Pedrinho, Marcos, Washington, Tati, Serginho, Fernanda, Maurício pelas doses de risadas diárias.
Aos meus amigos de BH que acreditaram em mim e torceram pelo meu sucesso.
Ao Professor Ricardo Dias, exemplo de Profissional, por ensinar-me a “beleza” da estatística. Aos Professores e funcionários do curso de Pós-Graduação em Epidemiologia Experimental e
Aplicada às Zoonoses.
Ao ICMBio e IDEMA por concederem as licenças necessárias para este trabalho.
Ao CNPq pela bolsa de mestrado e FAPESP pelo auxilio financeiro ao projeto 2012/02556-3. Aos funcionários do Parque da Cidade e Parque das Dunas pelo apoio nas campanhas de
A natureza não é cruel, apenas implacavelmente indiferente. Esta é uma das lições mais duras que os humanos têm de aprender.
FOURNIER, G. F. S. R. Estudo epidemiológico de Toxoplasma gondii em animais
silvestres e gatos domésticos de duas Unidades de Conservação na Cidade de Natal, RN. 2013. 85 f. Dissertação (Mestrado em Biologia da Relação Patógeno-Hospedeiro) – Instituto de Ciências Biomédicas, Universidade de SP, São Paulo, 2013.
Dentre Dentre as diversas doenças zoonóticas de importância destaca-se a toxoplasmose, doença cosmopolita que causa sérios danos à saúde de humanos e animais. Os felídeos têm um papel especial em sua epidemiologia por serem os hospedeiros definitivos do parasita. A ocorrência de Toxoplasma gondii em mamíferos silvestres e domésticos tem sido documentada em diversos estudos indicando valores expressivos de animais que tiveram contato com este coccídio, que pode ser fatal para algumas espécies de mamíferos e aves. No município de Natal, no Estado do Rio Grande do Norte, dois parques se destacam pela importância ecológica e social, o Parque Estadual Dunas de Natal Jornalista Luiz Maria Alves e o Parque da Cidade Dom Nivaldo Monte. Nestes parques, o número de gatos errantes é grande e pouco se sabe quais e como se encontra a saúde das espécies de animais lá existentes. O presente trabalho teve como objetivos investigar, avaliar e comparar a presença de T. gondii em gatos domésticos e em pequenos mamíferos silvestres que habitam estas duas Unidades de Conservação (UCs), bem como tentar o isolamento do parasita em alguns desses animais. Ao todo, foram obtidas amostras biológicas de 154 mamíferos (92 animais silvestres e 62 gatos domésticos). Dos mamíferos silvestres, 34 foram provenientes do Parque da Cidade e 58 do Parque das Dunas. Em relação aos gatos capturados nas Ucs, somente quatro foram provenientes do Parque das Dunas. Foi observada associação entre o número de animais silvestres apresentando anticorpos anti-T. gondii nos parques de origem (p = 0,018), sendo maior a ocorrência no Parque da Cidade (64,3 %) que no Parque das Dunas (34,8 %). A presença de T. gondii, através da amplificação molecular do gene B1, nos dois parques avaliados foi de 16,3% (15/92) nos animais silvestres e de 8,1% (5/62) para os gatos. O DNA de T. gondii obtido nas amostras teciduas foi submetido ao sequenciamento e uma sequência obteve 100% de similaridade a T. gondii de isolados de galinhas da Bahia. Neste estudo, foi possível estabelecer a circulação de T. gondii nas espécies e na população de gatos domésticos presentes nestes dois parques, demonstrando a participação de animais silvestres e domésticos no ciclo do T. gondii e alertando sobre a importância de controle da população de gatos destas Ucs.
FOURNIER, G. F. S. R. Epidemiological study of Toxoplasma gondii in wild mammals
and domestic cats of two protected areas in the city of Natal, RN. 2013. 85 p. Masters thesis (Master in Biology of Host-Pathogen Interactions) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2013.
Among several zoonotic diseases stands toxoplasmosis, a cosmopolitan disease that causes serious damage to the health of humans and animals. The felines have a special role in the epidemiology for being the definitive host of the parasite. The occurrence of Toxoplasma gondii in wild and domestic mammals has been documented in several studies indicating significant values for animals that had contact with this coccidian, which can be fatal for some species of mammals and birds. In Natal, state of Rio Grande do Norte, two parks are characterized by ecological and social importance, the Parque Estadual Dunas of Natal Jornalista Luiz Maria Alves and the Parque da Cidade Dom Nivaldo Monte. In these parks, the number of errant cats is important and little is known of the mammal species existing there. This study aimed to investigate, evaluate and compare the presence of T. gondii in domestic cats and wild small mammals that inhabit these two protected areas, as well as perform the attempted isolation of the parasite. We obtained biological samples from 154 mammals (92 animals and 62 wild cats). 34 of wild mammals were from the Parque da Cidade and 58 from the Parque das Dunas. Regarding cats captured in both protected areas, only four were from the Parque das Dunas. It has been observed association between the number of wild animals presenting anti-T. gondii in the original parks (p = 0.018), with a higher occurrence in the Parque da Cidade (64.3 %) than in the Parque das Dunas (34.8 %). The presence of T. gondii by molecular amplification of B1 gene was 16.3 % (15/92) out of the 92 wild animals analyzed and 8.1% (5/62) of the cats evaluated in the two parks. The samples were subjected to sequencing and one of the sequences obtained a similarity of 100 % T. gondii of isolated from free range hen. In this study, it was possible to establish the circulation of T. gondii in wild and domestic cat population present in these two parks, demonstrating the involvement of wild and domestic animals in the cycle of T. gondii and warning about the importance of controlling the population of these cats in these protected areas.
Figura 1 - Mapa da cidade de Natal indicando os limites das ZPA 1 (Parque da Cidade) e ZPA2 (Parque das Dunas)... 29
Figura 2 - Vegetação típica de Restinga que predomina no Parque da Cidade Dom Nivaldo Monte, Natal, RN, outubro de 2012... 30
Figura 3 - Área selecionada para captura de dos animais no Parque das Dunas com características de Mata Semidecidua, Natal, RN, outubro de 2012... 31
Figura 4 - Corpos d’água registradosRN, 2012... nas duas Unidades de Conservação, Natal – 36
Figura 5 -
Fluxograma ilustrando o direcionamento das amostras biológicas btidas nas duas coletas em campo (período de chuva e seca) no Parque da Cidade e no Parque das Dunas, Natal, RN... 46
Figura 6 -
Número de indivíduos de cada espécie de animal silvestre capturados que apresentaram sorologia positiva para anticorpos anti-T. gondii no Parque da Cidade e no Parque das Dunas, Natal - RN, 2013... 48
Tabela 1 – Formas de obtenção de amostras biológicas, tipos de marcação, tempo de amostragem e local de amostragem para cada grupo de animal nas
duas Unidades de Conservação (UC) estudadas, Natal, RN... 35 Tabela 2 - Ordem, espécies e quantidade de mamíferos silvestres capturados e
amostrados nas Unidade de Conservação (Parque da Cidade e Parque
das Dunas) em Natal, RN (2012 e 2013)... 45 Tabela 3 - Número de indivíduos por espécie examinados e positivos para
presença de anticorpos anti-T. gondii em cada uma das UCs avaliados
pelo MAT (≥25), Natal, RN (2012 e 2013)... 47 Tabela 4 - Distribuição dos títulos de anticorpos anti-Toxoplasma gondii obtidos
pelo teste de aglutinação modificado (MAT) em animais silvestres naturalmente infectados no Parque das Dunas e no Parque da Cidade
nos períodos de chuva e seca. Natal - RN, 2013... 49 Tabela 5 - Número e tipo de amostras de animais e de água obtidas e bioensaios
em camundongos realizados, para o isolamento de T. gondii Natal –
RN (2012 e 2013)... 51 Tabela 6 - Identificação dos animais de cada Parque amostrados e analisados para
o gene B1 utilizando-se diferentes tecidos e sangue relacionados com
os resultados da sorologia e do sequenciamento... 53 Tabela 7 - Resultados da nPCR (B1) de amostras de DNA positivas para T.
gondii obtidas de tecidos e sangue dos gatos domésticos das UCs e a relação com os resultados do MAT, Natal, RN,
AIDS Acquired Immunodeficiency Syndrome
A Arborícola
Ad Adulto
Ba Baço
BE Bioensaio
Ca Campanha
oC Graus celsus
C+ Controle positivo
C - Controle negativo
Co Coração
Cod Código
Ce Cérebro
CI Conteudo Intestinal
CED Capturar-Esterilizar-Devolver
μL microlitro (s)
dNTP deoxinucleotideos 5’-trifosfato
DNA Desoxiribonucleic Acid (ácido desoxirribonucléico) EDTA Ácido etilenodiaminotetracético
et al. et alli (e outros); e colaboradores
Fi Fígado ou Filhote
Fe Feto
FMVZ Faculdade de Medicina Veterinária e Zootecnia
HCl Ácido clorídrico
IBAMA Instituto Brasileiro do Medio Ambiente e dos Recursos Renováveis. IDEMA-RN Instituto de Desenvolvimento Sustentável e Meio Ambiente do Rio Grande do Norte IgG Imunoglobulina de classe G
Jo Jovem
ITS Internal Transcribed Spacer LAT Técnicas de Aglutinação em Látex
Li Língua
KCl Cloreto de potássio
km Quilômetro
kg Quilograma
mm Milímetros
m2 metros quadrados
M Molar
MAT Modified Agglutination Test (teste de aglutinação modificado) MgCl2 Cloreto de magnésio
mM Milimolar
mm Mililímetros
NA Não arborícola
N Negativo
NaCl Cloreto de sódio
No Número
nPCR nested-PCR
PM Marcador de Peso Molecular
PC Parque da Cidade
PD Parque das Dunas
PCR Polymerase Chain Reaction (reação em cadeia pela polimerase)
PK Proteinase K
Pq Parque
pH Potencial hidrogênico
pM Picomol
p valor-p
Pu Pulmão
rDNA DNA ribossomal
Ri Rim
RFLP Restriction Fragment Length Polymorphisms (Polimorfismo de Comprimento de Fragmento de DNA gerados por Enzima de Restrição)
RIFI Reação de Imunoflorescencia Indireta
RNA Ácido ribonucleico
RN Rio Grande do Norte
rpm Rotações por minuto
Sa Sangue
SA Semi arborícola
SAP Shrimp Alkaline Phosphatase
s Segundos
SEMURB Secretaria Municipal de Urbanismo de Natal SISBio Sistema de Autorização e Informação em
Biodiversidade
SP São Paulo
Te Testículo
Taq Termophillus aquaticus
TBE tampão Tris-borato-EDTA
TE tampão Tris-EDTA
Tris Hidroximetilaminometano
U Unidade internacional
Ut Útero
UFRN Universidade Federal do Rio Grande do Norte
UC Unidade de Conservação
v/v Volume por volume
1 INTRODUÇÃO... 16
2 OBJETIVO GERAL... 19
2.1 Objetivos específicos... 19
3 REVISÃO DA LITERATURA... 20
3.1 Toxoplasma gondii... 20
3.2 Toxoplasma gondii e mamíferos silvestres... 23
3.3 Fragmentação florestal e toxoplasmose... 25
4 MATERIAL E MÉTODOS... 28
4.1 Área de estudo... 28
4.2 Coleta de amostras biológicas e esterilização dos gatos... 32
4.3 Captura de pequenos mamíferos terrestres e voadores... 33
4.4 Coleta de água para bioensaio em camundongos... 36
4.5 Exame sorológico para pesquisa de anticorpos IgG anti-T. gondii... 36
4.6 Bioensaio em camundongos ... 37
4.6.1 Digestão péptica de tecidos e filtragem das amostras de água e conteúdo intestinal... 37
4.7 Testes moleculares ... 39
4.7.1 Extração do DNA das amostras de tecido e de sangue ... 39
4.7.2 Extração do DNA das amostras de conteúdo intestinal e de água ... 39
4.7.3 Reação em Cadeia da Polimerase (PCR) ... 40
4.7.4 Purificação, Precipitação do DNA e Reação de sequêncimento ... 41
4.7.5 Alinhamento e análises das sequências ... 42
4.8 Análise estatística dos dados ... 43
5 RESULTADOS ... 44
5.2.1 Diagnóstico sorológico de animais silvestres ... 46
5.2.2 Diagnóstico sorológico em gatos domésticos ... 49
5.3 Bioensaio em camundongos ... 50
5.4 Pesquisa molecular de T. gondii... 52
5.4.1 Testes moleculares de amostras provenientes de animais...... 52
5.4.2 Testes moleculares de amostras provenientes dos gatos .... 54
5.4.3 Testes moleculares realizados nas amostras de água provenientes das UCs ... 55
5.4.4 Testes moleculares dos camungondos utilizados no bioensaio ... 55
6 DISCUSSÃO... 56
7 CONCLUSÕES... 64
REFERÊNCIAS... 65
APÊNDICE A - Amostras de animais silvestres capturados nas duas UCs em outubro de 2012 (campanha 1) e fevereiro de 2013 (campanha 2), Natal-RN... 77
APÊNDICE B - Dados das amostras provenientes de gatos do parque das Dunas e Parque da Cidade em Fevereiro de 2013 (campanha 2)... 80 ANEXO A - Licença Consedida pelo Sistema de Autorização e Informação em Biodiversidade do Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio) para captura e coleta de pequenos mamíferos terrestres, São Paulo, 2013...
1 INTRODUÇÃO
A Mata Atlântica é a segunda maior floresta tropical da América do Sul, cobrindo cerca de 1,5 milhões km ao longo da costa brasileira (RIBEIRO et al., 2011). É de fato um dos Biomas mais heterogêneo do Brasil, apresentando fitofisionomias muito diversas, desde áreas com matas semidecíduas (a mais representativa), e também as florestas caducifólias, manguezais, pântanos e restingas (floresta costeira e matagal em solos arenosos) (RIBEIRO et al., 2011). Este mosaico diversificado de habitats é atualmente o lar de quase 20 mil espécies de plantas, 263 mamíferos, 936 aves, 306 répteis e 475 anfíbios (MITTERMEIER et al., 2005). Além disso, níveis excepcionais de endemismo fazem da Mata Atlântica um dos biomas mais marcante em toda a região neotropical (MULLER, 1973; PRANCE, 1982).
Devido a sua localização e riqueza biológica, a Mata Atlântica é hoje um dos biomas que mais sofre com as mudanças ocorridas pela interferência do homem. A expansão urbana acarretou não só à perda de habitat para as espécies selvagem, mas também, obrigou-as a ocuparem áreas modificadas e a adaptarem-se à presença de espécies domésticas e ao homem (AKCA et al., 2004; FIALHO et al., 2009; SILVA et al., 2007; VITALIANO et al., 2010).
Este efeito tem levado à extinção milhares de espécies nas últimas décadas, bem como, o aumento de patógenos causadores de zoonoses em todo o mundo (ASTRID et al., 2000; CABEZÓN et al., 2004; DUBEY et al., 2003; SILVA et al., 2010).
Em toda costa brasileira o crescimento urbano tem gerado a degradação deste Bioma e em muitas regiões, a presença de fragmentos florestais se tornaram pequenas ilhas de vegetação nos grandes centros urbanos. Neste contexto, o melhoramento do saneamento básico, saúde pública e educação ambiental, algumas vezes, não acompanham o rápido crescimento populacional proporcionando o aparecimento e/ou reaparecimento de diversas zoonoses (DUBEY et al., 2003; LEHMANN et al., 2003; SILVA et al., 2010; VITALIANO et al., 2010).
As principais consequências negativas da interação de animais domésticos versus UCs são a perda da biodiversidade local original e o risco de transmissão de patógenos para os animais (silvestres e domésticos) e pessoas que convivem com estes ou próximo a estes acarretando diversas doenças (SALGADO et al., 2007; SILVA et al., 2010). Estas doenças, conhecidas como zoonoses, são responsáveis por milhões de mortes em todo o mundo (ANGELUCCI et al., 2009; FRAZÃO-TEIXEIRA et al., 2002; PRELEZOV et al., 2008; SILVA et al., 2007). A epidemiologia destas doenças está baseada na relação entre meio ambiente e agentes físico, tais como locais onde o individuo reside; fatores culturais; convivência com possíveis vetores de patógenos; hábitos alimentares, fatores socioeconômicos e religiosos. Este último devido a pratica de algumas religiões não permitirem o consumo de alguns tipos de carne e outros produtos (AGELUCCI et al., 2009; SILVA et al., 2007; TENTER, 2009).
Entre estas doenças a toxoplasmose se destaca por ser uma doença cosmopolita que pode causar sérios danos à saúde de humanos e animais, bem como perdas econômicas (da SILVA et al., 2010; FRAZÃO-TEIXEIRA et al., 2002; LEHMANN et al., 2003; TENTER, 2009).
A prevalência de anticorpos contra Toxoplasma gondii em mamíferos silvestres tem sido documentada em diversos trabalhos em todo mundo (CLIMENI; MONTEIRO, 2009; DARABUS et al., 2011; HEJLICEK et al., 1981; KARATEPE et al., 2004), inclusive entre animais marinhos que nunca tiveram contato com o homem (CABEZÓN et al., 2004; CONRAD et al., 2005; DUBEY et al., 2003; FORMAN et al., 2009).
Embora animais silvestres frequentemente se mostrem reativos em testes sorológicos para T. gondii (GONDIM et al., 2010; HEJLICEK et al., 1981), o papel destes animais na transmissão de T. gondii ainda não é bem conhecido (AFONSO et al., 2007). Porém, é sabido que a presença de surtos desta doença pode afetar populações de espécies silvestres levando à redução no número de indivíduos.
Nas UCs próximas ou dentro de centros urbanos a investigação do ciclo epidemiológico de T. gondii é o primeiro passo para realizar planos de ação na prevenção da toxoplasmose e consequentemente manter a saúde dos envolvidos e o equilíbrio ambiental (GONDIM et al., 2004; TENTER; HECKEROTH; WEISS, 2000).
vida livre. A maioria dos estudos realizados contemplam animais silvestres em cativeiro e domésticos (LEITE et al., 2007; PENA et al., 2006; PIMENTEL et al., 2009; SOARES et al., 2010).
Localizado no extremo nordeste do território brasileiro, o Estado do Rio Grande do Norte ocupa área de 53.306,8 km2 e em todo seu território são encontradas mais de 20 UCs. Na capital Natal, duas destas unidades se destacam em tamanho e importância. A primeira, o Parque Estadual das Dunas de Natal Jornalista Luiz Maria Alves, constitui a maior UC do Município de Natal. Localizado na região metropolitana da cidade abrange uma área de 1.172 hectares de mata nativa sobre dunas (FREIRE, 1990), sendo parte integrante da Reserva da Biosfera da Mata Atlântica. É uma área rica em recursos naturais, sendo propícias atividades de cunho científico, educacional, turístico e de lazer (CARVALHO, 2001).
A segunda UC de grande importância é um parque municipal denominado Parque da Cidade Dom Nivaldo Monte que está situado dentro da Capital com grande importância na preservação do último reduto aquífero limpo da cidade. Porém, nesta UC, nos últimos anos, vem sendo relatado o abandono de gatos domésticos, principal hospedeiro definitivo de T. gondii. Nenhuma das medidas tomadas pelo município foi eficaz para a redução da população destes animais, que vem crescendo gradativamente.
2 OBJETIVO GERAL
Investigar a infecção por T. gondii em pequenos mamíferos silvestres e em gatos domésticos no parque Estadual das Dunas “Jornalista Luiz Maria Alves” e no Parque Municipal Parque da Cidade “Dom Nivaldo Monte”, ambas no Município de Natal, Rio Grande do Norte, Brasil.
2.1 Objetivos específicos
Determinar a ocorrência de anticorpos anti-Toxoplasma gondii nas espécies de pequenos mamíferos capturadas;
Comparar as ocorrências de anticorpos anti-T. gondii encontradas na comunidade de pequenos mamíferos das duas Unidades de Conservação e nos gatos domésticos associados a estas áreas;
Detectar a presença de fragmentos de DNA de T. gondii nas amostras de tecidos de animais silvestres e dos gatos domésticos capturados nas duas Unidades de Conservação.
Comparar a ocorrência de T. gondii na comunidade de pequenos mamíferos das duas Unidades de Conservação nas estações de chuva e seca nas áreas estudadas.3 REVISÃO DA LITERATURA
3.1 Toxoplasma gondii
Toxoplasma gondii é a única espécie do gênero Toxoplasma pertencente à classe Protozoa e à família Sarcocystidae. A primeira descrição do T. gondii foi há mais de 100 anos e ainda hoje o agente é descrito nas mais diferentes espécies de vertebrados das classes Mammalia e Aves (CABRAL et al., 2013; PENA et al., 2013; SIQUEIRA et al., 2013; VITALIANO, 2012).
Em 1908 Nicolle e Manceaux descreveram o parasita em um pequeno roedor originário da África chamado Ctenodactylus gundi. E também em 1908, Splendore descreveu o mesmo parasita em coelhos de laboratório, no Departamento de Bacteriologia do Hospital da Sociedade de Beneficência Portuguesa em São Paulo. Já nesta época este coccídio demonstrava uma grande amplitude de hospedeiros intermediários, uma vez que foi descrito em duas espécies muito distintas de mamíferos e em continentes distintos.
O nome do roedor foi o precursor do nome da espécie do parasita e o nome do gênero deriva das palavras gregas taxon (arco) e plama (forma), devido à forma alongada e arqueada (NETO et al., 1995). T. gondii foi observado em humanos pela primeira vez em 1923 por Janku e o primeiro caso de toxoplasmose no Brasil foi descrito por Magarinos Torres (1927) que descreveu o parasita durante a necropsia de um paciente com meningoencefalite, miocardite e miosite (GUIMARÃES, 1943). O primeiro registro fotográfico foi realizado por Belfort Mattos em 1933 (GUIMARÃES, 1943).
Toxoplasma gondii pode ser classificado como um dos mais complexos protozoários da família Sarcocystidae. É um coccídio intracelular obrigatório que possui um ciclo biológico heteroxeno facultativo. Sua fase assexuada pode ser encontrada nos tecidos de seus hospedeiros intermediários que geralmente resultam na forma de cisto. Já a forma sexuada deste patógeno ocorre somente no intestino delgado de seus hospedeiros definitivos, sendo estes os pertencentes da família Felidae.
como já mencionado, a reprodução sexuada ocorre somente nos felídeos, que junto com suas fezes, liberam milhares de oocistos no ambiente (DUBEY; BEATTIE, 1988; LINDSAY et al., 1997).
Ainda em relação ao ciclo biológico deste parasita, três formas infectantes do T. gondii já foram observadas. Estas são os taquizoítos livres ou em forma de pseudocistos encontrados em diversos tecidos dos seus hospedeiros, os bradizoítos encontrados nos cistos teciduais e os esporozoítos encontrados nos oocistos esporulados após a liberação no ambiente (DUBEY; BEATTIE, 1988).
No organismo dos hospedeiros intermediários, após estes se infectarem com qualquer uma das formas infectantes do coccídio, inicia-se a multiplicação dos taquizoítas por endodiogenia e assim, formam-se os cistos teciduais (PENA, et al., 2006). Geralmente estes cistos ocorrem em tecidos do sistema nervoso e/ou muscular dos hospedeiros e caracterizam-se pela precaracterizam-sença dos bradizoítos dentro dos cistos que caracterizam-se dividem de forma lenta e permanecerão nestes tecidos por toda vida do hospedeiro (DUBEY; BEATTIE, 1988; PENA et al., 2006).
Nas últimas décadas a prevalência de toxoplasmose em populações de humanos e animais tem sido documentada em diversas regiões do globo. Em humanos a taxa de soroprevalência pode chegar a 90% em alguns países (MENESES et al., 2009).
No Brasil a prevalência de anticorpos IgG na população geral varia de 54% na região Centro-Oeste a 75% na região Norte (MENESES et al., 2009). Sabe-se que a prevalência de anticorpos anti-T. gondii em mamíferos aumenta de acordo com a idade, possivelmente devido a um maior tempo de exposição ao parasito (FRANTI et al., 1975; VITALIANO et al., 2010).
A infecção em humanos imunocompetentes é assintomática em 80% a 90% dos casos, sendo a doença uma exceção no homem (FIGUEIRÓ-FILHO et al., 2005; SILVA et al., 2007), entretanto, em pacientes imunossuprimidos, a doença pode ser fatal e em mulheres grávidas que se infectem durante a gestação, graves lesões no feto e abortamentos podem ocorrer (MENESES et al., 2009).
Embora isolados de T. gondii sejam historicamente considerados altamente similares, as últimas análises moleculares tem revelado diferenças marcantes entre as populações deste coccídio em diversos locais do mundo (SU et al., 2011).
limitada. Essa característica poderia ser explicada por uma estrutura populacional clonal muito forte (AJZENBERG et al., 2002; DARDÉ et al., 1992; HOWE; SIBLEY, 1995).
Em 1995, Howe e Sibley diferenciaram T. gondii em três linhagens e as denominaram Tipo I, Tipo II e Tipo III. Recentemente uma quarta linhagem clonal do T. gondii refere-se ao Tipo 12, esta foi recentemente descoberta na América do Norte em animais selvagens (KHAN et al., 2011).
Estudos moleculares de isolados humanos da Guiana Francesa e de galinhas do Brasil foram os primeiros a revelar uma variabilidade genética do parasita maior do que a previamente relatada (AJZENBERG et al., 2004; LEHMANN et al., 2004). Vários estudos posteriores utilizando isolados de diferentes regiões e hospedeiros confirmaram que os isolados de T. gondii do Brasil são biologicamente e geneticamente diferentes daqueles da América do Norte e Europa, apresentando uma alta diversidade (DUBEY et al., 2007; FERREIRA et al., 2006; PENA et al., 2008).
Análises filogenéticas e estatísticas revelaram resultados inesperados mostrando que as três primeiras linhagens descritas se diferem somente em menos de 1% (SU; EVANS; COLE, 2003). Mesmo demonstrando diferenças genéticas mínimas estas cepas se diferem quanto à virulência e quanto ao padrão de ocorrência epidemiológica (SIBLEY; BOOTHROYD, 1992). Até o momento, o que se tem observado é que cepas do Tipo I são extremamente virulentas para camundongos e as cepas Tipo II tem sido associadas aos casos de toxoplasmose em pacientes com a Síndrome da Imunodeficiência Adquirida (AIDS) (BOTHROYD; GRIGG, 2002; KLAREN; KIJLSTRA, 2002). Já as cepas do Tipo III estão presentes em animais e também detectados em pacientes com AIDS, mas não são associadas com a toxoplasmose ocular (BOOTHROYD; GRIGG, 2002).
No Brasil a estrutura populacional do T. gondii tem se demonstrado atípica. O isolamento de cepas em diversos Estados tem sido descritos por autores através de amostras primárias, principalmente para o grupo de aves e mamíferos. A genotipagem multilocus por PCR-RFLP, tem revelado uma grande diversidade de populações de T. gondii (KHAN et al., 2011).
a cepa Br IV, por apresentar uma mortalidade variada em camundongos, foi interpretada como intermediária.
Com a inusitada infecção de T. gondii em diversas espécies de animais em todo o mundo, trabalhos que buscam compreender a estruturação genética do parasita tem se multiplicado (CABRAL et al., 2013; PENA et al., 2008, 2006; VITALIANO et al., 2010).
Até o presente, é possível concluir que dentre as diferenças marcantes na estrutura populacional da América do Norte, Europa e Brasil, o hemisfério norte é local de predomínio das três linhagens clonais de T. gondii. Já no hemisfério sul, principalmente no Brasil, onde há uma maior quantidade de estudos, existe uma estrutura populacional epidêmica com algumas expansões das linhagens clonais (PENA et al., 2008) demonstrando assim, uma rede altamente reticulada e diversificada. Esta descoberta sugere que exista uma alta taxa de recombinação na população do parasita na América do Sul (PENA et al. 2008).
A facilidade de recombinação do parasita na América do Sul pode ser interpretada de várias maneiras, entre elas a alta interação entre os animais silvestres, os domésticos e o homem que é comumente observada nos trópicos, pode ser um fator que facilite a reprodução sexuada do parasita.
3.2 Toxoplasma gondii e mamíferos silvestres
O grupo de pequenos mamíferos silvestres no Brasil é formado pelos marsupiais, roedores que pesam até 1kg e os morcegos (BALKENHOL et al., 2013; GHELER-COSTA et al., 2012). Estes estão presentes em todos os biomas brasileiros ocupando grande parte da base da cadeia alimentar do ecossistema terrestre (BALKENHOL et al., 2013; GHELER-COSTA et al., 2012; PAGLIA et al., 2012).
O papel da vida selvagem na transmissão de T. gondii tem sido estudado por diversos autores em todas as partes do mundo (CABRAL et al., 2013; DUBEY et al., 1992; HUMPREYS et al., 1995; LINDSAY et al., 2001; VITALIANO et al., 2010). Alguns autores tem citado o grupo de pequenos mamíferos como um grupo de animais de grande importância para a saúde pública (CABRAL et al., 2013; HEJLICEK et al., 1981; VITALIANO et al., 2010). Neste contexto, T. gondii, por se tratar de um dos protozoários com maior número de hospedeiros intermediários, tem se destacado nas pesquisas sobre as zoonoses nestes vários tipos de vertebrados endotérmicos presentes no planeta (ANTOLOVÁ et al., 2007; CARME et al., 2009; HEJLICEK et al., 1981; MATTOS et al., 2008; SHAAPAN; KHALIL 2008; TESHALES et al., 2007).
Entre os mamíferos, os grupos mais comumente infectados são: marsupiais, xenartros, roedores, carnívoros, artiodáctilos e primatas (BRAGA FILHO et al., 2011). Os marsupiais apresentam uma ocorrência de 14% e os primatas de apenas 2% de anticorpos anti-Toxoplasma (BRAGA FILHO et al., 2011). Porém é sabido que os primatas do novo mundo são altamente suscetíveis e muitos morrem devido à infecção sendo este o fator provável da baixa prevalência de soropositivos neste grupo de animais (PENA et al., 2013; VITALIANO et al., 2010).
Em 1999, Bouer e colaboradores reportaram a morte de três macacos-barrigudos (Lagothrix lagotricha) em um Zoológico no Brasil com diagnóstico confirmado através de imunoistoquímica. Já os xenartros e os roedores apresentam ocorrência de 25% e os índices mais elevados são os dos carnívoros e dos artiodactilos com 35% e 57%, respectivamente (SILVA et al., 2007; VITALIANO et al., 2010).
Pesquisas nas comunidades de mamíferos silvestres são desenvolvidas em sua generalidade por técnicas de aglutinação em látex (LAT) e técnica de aglutinação modificada (MAT) (DUBEY; DESMONTS, 1987), por apresentarem alta sensibilidade e não necessitarem de conjugados espécie-específicos (AFONSO et al., 2007; GONDIM et al., 2004).
Nos animais, o maior interesse na avaliação da ocorrência de toxoplasmose está relacionado às espécies que coabitam com o homem ou que lhe servem de alimento (SINGH et al., 2003; SOGORB et al., 1972). Assim, as espécies sinantrópicas, incluindo diversos morcegos, têm se destacado entre o grupo de animais que devem ser mais investigados para infecção por T. gondii.
Recentemente Cabral e colaboradores (2013) obtiveram os primeiros isolados de T. gondii em morcegos capturados no Estado de São Paulo. Os isolados são de duas espécies comuns e sinantrópicas de morcegos brasileiros: Desmodus rotundus (GEOFFROY, 1810) um morcego hematófago e Molossus molossus (PALLAS, 1766) um morcego insetívoro. Os isolados foram denominados TgBatBr1 e TgBatBr2, sendo que o genótipo do isolado a partir de M. molossus (TgBatBr1) foi previamente descrito em capivara também do Estado de São Paulo e o genótipo obtido de D. rotundus (TgBatBr2) já foi identificado em isolados de gatos, galinhas, capivaras, ovelha, roedor e coelho de diferentes estados brasileiros. Cabral e colaboradores (2013) sugerem que se trata de uma linhagem comum de T. gondii que circula em algumas regiões brasileiras. Este estudo revela que os morcegos podem compartilhar os mesmos isolados que são encontrados em animais terrestres domésticos ou selvagens sendo incluídos no grupo de hospedeiros intermediários do T. gondii.
3.3 Fragmentação florestal e toxoplasmose
Mudanças na cobertura florestal são conhecidas pelo impacto significante sobre a diversidade da fauna e funcionamento dos ecossistemas (OGRZEWALSKA; UEZU; LABRUNA, 2011; SALAS et al., 2004).
Muitos autores já descreveram impactos causados pelo desmatamento para instalação de plantações, ou urbanização influenciando na transmissão de zoonoses e seus vetores invertebrados (DOBSON; FOUFOPOULOS, 2001; GALVANI, 2003; OGRZEWALSKA et al., 2011). Porém pouquíssimos estudos têm correlacionado a toxoplasmose com áreas de fragmentação florestal, locais estes onde humanos, animais silvestres e animais domésticos geralmente dividem uma mesma área de vida.
não tinha sido considerada: a relação entre o impacto da antropização em ambiente natural e a diversidade de T. gondii.
Ainda são poucos os dados disponíveis sobre cepas circulantes nas áreas antropizadas da Guiana Francesa. A maioria dos animais analizados pelo grupo francês, são originários principalmente de áreas sub-urbanas antropizadas e pontualmente de ambiente selvagem na Guiana, porém os resultados mostram claramente uma diferenciação genética entre as linhagens associadas ao ambiente antropizado e ao selvagem, mas com alguma similaridade entre eles (MERCIER et al., 2011). Os pesquisadores concluiram que as duas populações ambientais "selvagens" e "antropizada" são geneticamente bem diferenciadas e que a antropização do ambiente parece ser acompanhada de uma diminuição da diversidade de T. gondii. Neste trabalho, os autores ainda detectaram um potencial de fluxo gênico entre estas duas populações ambientais e que existe uma patogenicidade muito maior em humanos contaminados com genótipos "selvagens" colocando em risco a saúde dos humanos desta região.
Estes resultados comprovam que as mudanças ocorridas nas áreas florestadas devido a interferência humana afetam a diversidade dos parasitas e seus hospedeiros e também elevam a exposição dos humanos às doenças, como foi verificado por Ogrzewalska e colaboradores em 2012 para a febre maculosa e também a trasformações no ciclo do parasita como observado por Carme e colaboradores em 2009 para a toxoplasmose na Guiana Francesa.
A exposição também pode estar associada à movimentação de animais domésticos em áreas naturais. Doenças específicas desses animais podem ser transmitidas para animais silvestres e vice-versa (MERCIER et al., 2011; OGRZEWALSKA; UEZU; LABRUNA, 2011). Da mesma forma, pode acontecer que animais selvagens, tanto aves quanto mamíferos ao se deslocarem entre fragmentos florestais, utilizando diferentes elementos da paisagem, dispersem e/ou adquiram parasitas ao entrarem em contato com os animais domésticos e com o homem (OGRZEWALSKA; UEZU; LABRUNA, 2011; PENA et al., 2013).
Estes fatores podem explicar a diversidade de isolados provenientes de galinhas caipiras (BELTRAME et al., 2012; DUBEY et al., 2007; PENA et al., 2013; RUIZ; FRENKEL, 1980). Estes animais geralmente são criados em áreas periurbanas ou rurais ao ar livre e frequentemente são infectados por oocistos liberados no ambiente por felinos silvestres ou domésticos e por esse motivo tem sido amplamente utilizados como bioindicadores de cepas de T. gondii predominantes no meio ambiente onde vivem (PENA et al., 2013).
4 MATERIAL E MÉTODOS
As licenças para captura e eutanásia de três espécimes por espécie capturadas em cada uma das áreas de estudo e transporte destes indivíduos foram concedidas pelo Sistema de Autorização e Informação em Biodiversidade (SISBio) sob o número 32104-2 e pelo Instituto de Desenvolvimento Sustentável e Meio Ambiente do Rio Grande do Norte (IDEMA-RN) (Anexo A). Os procedimentos com animais realizados neste estudo foram aprovados pela Comissão de Ética no Uso de Animais do Instituto de Ciências Biomédicas da Universidade de São Paulo, protocolo registrado sob o número 204, na folha 117 do Livro 02 de 14 de fevereiro de 2012 com validade de 4 anos.
4.1Área de estudo
O município de Natal, no Estado do Rio Grande do Norte, possui dez Zonas de Proteção Ambiental definidas pelo Plano Diretor da cidade. Este projeto abrange a Zona de Proteção Ambiental 1 (ZPA 1) e 2 (ZPA2) da cidade de Natal (Figura 1).
A Zona de Proteção Ambiental do Sun Valle (ZPA 1) está localizada na zona sul de Natal e abrange o conjunto Sun Valle, no bairro Pitimbú, é tida como o último reduto de água limpa de Natal, abastecendo 16 bairros da Capital.
Figura 1 – Mapa da cidade de Natal indicando os limites das ZPA 1 (Parque da Cidade) e ZPA2 (Parque das Dunas).
O bioma original do local é a Mata Atlântica constituído por formações dunares cobertas por vegetação de restinga em sua maioria (RAMALHO; PIMENTA, 2010; UFRN, 2007) (Figura 2). O clima local é tropical úmido com temperatura média anual de 26 oC e precipitação pluviométrica anual em torno de 2.500 mm, com período chuvoso mais intenso entre os meses de março a julho (CESTARO et al., 2012; RAMALHO; PIMENTA, 2010).
Figura 2 – Vegetação típica de Restinga que predomina no Parque da Cidade Dom Nivaldo Monte, Natal, RN, outubro de 2012.
O Parque da Cidade promove a integração de dois bairros com características socioambientais e socioeconômicas distintas e na porção norte está rodeado por ocupações clandestinas ocorridas a mais de uma década (RAMALHO; PIMENTA, 2010; SEMURB, 2008). Um dos principais problemas deste parque é a presença de gatos domésticos abandonados. A prefeitura de Natal estimou em 2012 (SEMURB, 2012) que mais de 150 gatos vivem neste local, porém nenhum trabalho abrangente foi realizado para contabilizar o número real de animais presentes em todo o território do parque.
O Parque das Dunas de Natal (5º 48’ 49.81’’ – 5º 52’ 03’’ S e 35º 11’ 36.11’’0) caracteriza-se pela predominância de espécies peculiares aos Tabuleiros Litorâneos, Floresta Atlântica e ainda das Caatingas (FREIRE, 1990). A área selecionada para a captura dos animais silvestres do estudo apresenta fitofisionomia típica de Mata Semidecidua com árvores de grande porte e sub-bosque bem definido (Figura 3).
Figura 3 – Área selecionada para captura de dos animais no Parque das Dunas com características de Mata Semidecidua, Natal, RN, outubro de 2012.
4.2 Coleta de amostras biológicas e esterilização dos gatos.
Foi realizada uma campanha de sete dias para captura de gatos domésticos e coleta de amostras biológicas desses animais.
Duas vezes por dia os gatos que habitam o Parque da Cidade e o Parque das Dunas são alimentados por protetores voluntários que percorrem diversos locais ao entorno das duas UCs para tal finalidade. No momento em que os animais estão se alimentando se torna mais fácil a aproximação e a captura dos mesmos.
Estes gatos foram capturados e acondicionados em caixas transportadoras, levados para um alojamento montado exclusivamente para este fim e mantidos em jejum por 12 horas. Em relação à faixa etária, os animais foram classificados em três grupos: filhotes (com dentes decíduos), jovens (com dentes permanentes e idade aproximada de até um ano) e adultos (com idade maior do que um ano).
Após esse período os animais foram examinados por veterinários, anestesiados e submetidos à cirurgia de esterilização. Durante a cirurgia amostras de sangue foram colhidas de cada um dos animais.
Os úteros foram removidos e conservados refrigerados para realização de bioensaio em camundongos na tentativa de isolamento de T. gondii. Os testículos e uma parte do sangue colhido foram conservados em Isopropanol a 80 % para análises moleculares, outra parte do sangue foi separada para retirada do soro para pesquisa de anticorpos contra T. gondii.
As amostras foram identificadas e encaminhadas ao Departamento de Medicina Veterinária Preventiva e Saúde Animal (VPS) da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo (FMVZ-USP), por via aérea, onde foram realizadas todas as análises.
Os animais permaneceram aos cuidados da equipe veterinária por 48 horas e após avaliação do estado físico foram liberados no mesmo local de captura ou encaminhados para adoção.
4.3 Captura de pequenos mamíferos terrestres e voadores
Para captura dos animais silvestres foram realizadas duas campanhas de campo sendo uma durante o período de seca (outubro de 2012) e outra durante o período de chuva (fevereiro de 2013).
Objetivando a captura dos animais silvestres foram utilizados diferentes métodos de acordo com os grupos pretendidos. Para captura dos animais não voadores foram utilizadas 80 armadilhas do tipo gaiolas com 45 cm de comprimento, 20 cm de altura e 20 cm de largura, (Shermman e Tomahawk). Diferentes atrativos foram utilizados como iscas (uma mistura de fubá, sardinha e pasta de amendoim). Estas armadilhas foram posicionadas em quatro diferentes áreas selecionadas em cada UC (Tabela 1). As armadilhas foram vistoriadas diariamente e os animais capturados foram transportados em sacos de pano para local apropriado nas próprias UCs para realização da coleta de amostras biológicas.
Para a captura de morcegos foram utilizadas três redes de neblina com 3,0 m de altura e 12,0 m de comprimento, que eram armadas no início do entardecer e mantidas abertas por um período de 5 a 6 horas em três diferentes locais em cada UC. Para algumas espécies de morcegos foram realizadas buscas ativas em abrigos e os animais capturados foram transportados em sacos de pano. Os animais foram identificados com o auxílio de diferentes chaves de identificação e descrições originais (BONVICINO; OLIVEIRA; D'ANDREA, 2008; PAGLIA et al., 2012).
Todos os vertebrados foram identificados por especialistas e após identificação, coleta de material e de dados, os animais capturados recebiam uma anilha de marcação numerada e eram soltos no mesmo local de captura. Somente os animais das ordens Carnivora, Primates e Cingulata não foram marcados, porém nestes animais buscas de cicatrizes e outras marcas foram fotografadas para posterior identificação no caso de recaptura.
Quando necessário, os animais silvestres capturados eram anestesiados (com uma dose mínima de Xilasina e Quetamina que variou de acordo com o peso e tamanho do animal) para a coleta de sangue que foi realizada por punção cardíaca, pela veia caudal ou pela veia cefálica.
Alguns exemplares de animais, cuja identificação da espécie não foi possível no campo, foram também submetidos à eutanásia, fixados e depositados no Museu de História Natural da Pontifícia Universidade Católica de Minas Gerais (PUCMinas) após a identificação da espécie.
A amostragem dos animais foi realizada durante 15 dias e noites, dependendo da espécie animal analisada, nos meses de outubro de 2012, período seco na região estudada e fevereiro de 2013, início do período chuvoso.
P á g in a | 35
Tabela 1 – Formas de obtenção de amostras biológicas, tipos de marcação, tempo de amostragem e local de amostragem para cada grupo de animal nas duas Unidades de Conservação (UC) estudadas, Natal, RN.
Animal Forma de coleta Tipo de marcação
Tempo de amostragem em cada UC por campanha
Local de Amostragem – Parque da Cidade
Local de Amostragem – Parque das Dunas
Mamíferos não voadores
Captura Live trap Anilhamento 15 dias/noites
Transecto 1 - 5°51'1.82"S; 35°13'43.12"O Transecto 2 - 5°51'1.08"S;
35°13'40.17"O Transecto 3 - 5°51'6.21"S;
35°13'39.14"O Transecto 4 - 5°50'44.22"S;
35°13'58.77"O
Transecto 1 - 5°48'41.91"S; 35°11'33.91"O Transecto 2 - 5°48'41.17"S;
35°11'32.80"O Transecto 3 - 5°48'47.88"S;
35°11'31.51"O Transecto 4 - 5°48'52.06"S;
35°11'30.16"O
Morcegos Rede-de-neblina Anilhamento 7 noites
Rede 1 - 5°50'49.10"S; 35°13'56.66"O Rede 2 - 5°50'39.71"S;
35°14'0.83"O Rede 3 - 5°50'40.06"S;
35°13'56.29"O
Rede 1 - 5°48'46.02"S; 35°11'31.21"O Rede 2 - 5°48'41.65"S;
35°11'34.54"O Rede 3 - 5°48'45.06"S;
35°11'35.32"O
Gatos domésticos
Captura manual Corte na orelha esquerda 7 dias*
Posto 1 - 5°51'0.78"S; 35°13'34.72"O Posto 2 - 5°50'55.25"S;
35°13'32.01"O Posto 3 - 5°50'47.01"S;
35°13'28.22"O Posto 4 - 5°51'12.02"S;
35°13'36.12"O
Posto único - 5°48'41.91"S; 35°11'33.91"O
4.4Coleta de água para bioensaio em camundongos
Nas duas áreas de abrangência do estudo, não existem corpos d’água naturais, porém em ambas existem dois pequenos lagos artificiais (um em cada parque) que acumulam água da chuva e que servem de bebedouros para os animais destas áreas (Figura 4).
Figuras 4 –Corpos d’água registrados nas duas Unidades de Conservação, Natal– RN, 2012.
Imagem A Imagem B
Legenda: Pequeno acúmulo de água presente no Parque da Cidade Dom Nivaldo Monte, Natal - RN outubro de 2012. (Imagem A). Lago artificial presente no Parque das Dunas de Natal Jornalista Luiz Maria Alves (Imagem B).
Na tentativa de isolamento de T. gondii através de amostras de água destes corpos d’água, na segunda campanha, durante cinco dias consecutivos foram coletadas 10 amostras de água em cada UC, estas foram armazenadas em tubos tipo Falcon de 15 mL. Estas amostras permaneceram em temperatura ambiente durante cinco dias e após esse período, foram encaminhadas para o VPS, FMVZ, USP.
4.5Exame sorológico para pesquisa de anticorpos IgG anti-T gondii
Os soros obtidos foram examinados através do Teste de Aglutinação Modificada – MAT (DUBEY; DESMONTS, 1987). A diluição dos soros foi feita em microplaca (96 poços), usando solução salina tamponada, pH 7,2 (NaCl 0,146 M; NaH2PO4 0,0026 M;
Na2HPO4 0,008 M) filtrada em membrana de policarbonato com 0,45µm de porosidade.
Em seguida, 150µL de antígeno-estoque (taquizoítos inteiros fixados em formalina) foram diluídos em 2,5mL de solução alcalina tamponada, pH 8,95 (NaCl 0,12 M; H3BO3
mercaptoetanol 0,2 M e 50 µL de Azul de Evans 0,2 %. Essa mistura foi então homogeneizada e distribuída imediatamente em uma microplaca (96 poços) com fundo em “U”, resultando em 25 µL de reagentes por poço.
Os soros diluídos foram transferidos para essa microplaca e misturados aos reagentes (v/v). A placa foi selada com plástico adesivo para evitar evaporação e incubada durante a noite em estufa a 37 oC. A formação de um botão de contorno definido na base do poço da placa foi anotado como resultado negativo e um carpete completo ou um véu de contorno pouco definido foi anotado como positivo.
Os animais com títulos maiores ou iguais a 25 foram considerados positivos (FORNAZARI et al., 2009; SILVA et al., 2001). Em todas as reações foram usados controles positivos e negativos previamente conhecidos e controles do antígeno.
4.6Bioensaio em camundongos
Três espécimes de cada espécie animal das ordens Didelphimorphia, Rodentia e Chiroptera foram submetidos à eutanásia para a realização do bioensaio em camundongos, análises moleculares e depósito em coleção científica. Aqueles animais que por ventura vieram a óbito durante os procedimentos de captura e ou coleta de sangue também foram utilizados para este fim. Este procedimento segue regularização da licença obtida no SISBio.
Como modelo experimental, foram utilizados camundongos albinos Swiss, fêmeas e machos, com idade aproximada de dois meses provenientes do biotério do VPS, FMVZ, USP.
4.6.1Digestão péptica de tecidos e filtragem das amostras de água e conteúdo intestinal
Pulmões, rins, baço, coração, língua, fígado e cérebro dos animais foram retirados com auxílio de tesoura e pinça sendo um par para cada animal. Fragmentos de cada um destes órgãos foram removidos e acondicionados, separadamente, em microtubos e identificados com um código de acordo com a espécie do animal e a data de coleta.
Os órgãos de eleição para o bioensaio foram: cérebro, coração e língua. Para as gatas submetidas à cirurgia de esterilização, o útero foi utilizado no bioensaio. As amostras de água coletadas nos dois Parques e amostras de intestino delgado e grosso de três gatos que morreram durante o estudo também foram submetidas ao bioensaio em camundongos.
material picotado foi pesado e a cada 10 g de tecido foi acrescentado 100 mL de solução salina. O material foi mantido em banho-maria à 37 oC e após atingir esta temperatura, foi adicionada pepsina (v/v), permanecendo em banho-maria por uma hora.
Com auxílio de um filtro de gaze estéril o material digerido foi filtrado, homogeneizado e acondicionado em tubos tipo Falcon de 50 mL. As amostras foram centrifugadas em centrífugas refrigeradas por 10 minutos a 2500 g.
O sobrenadante foi descartado e adicionou-se solução salina para ressuspender o sedimento. Esta solução foi neutralizada com bicarbonato de sódio (NaHCO3). Após esse procedimento a solução foi completada com salina 0,85% até 50 mL e novamente esta foi centrifugada por 10 minutos a 2500 g.
O sobrenadante foi novamente descartado, ao sedimento foi adicionada penicilina e estreptavidina (v/v) e, após homogeneizar a solução, o conteúdo foi inoculado em três a cinco camundongos sendo 1 mL por via subcutânea por animal.
Para as amostras de água e do conteúdo intestinal dos gatos que vieram a óbito foi realizada a técnica de filtragem através do uso de peneiras de 70, 100, 200 e 400 nanômetros e centrifugação por 10 minutos à 12.000 rpm. O sobrenadante de cada amostra foi descartado e ao concentrado final foi adicionada uma dose de antibiótico (v/v). Ao final as amostras de água provenientes do mesmo local foram reunidas em somente um tubo Falcon totalizando uma amostra de cada UC e as três amostras de conteúdo intestinal de cada gato foram filtradas separadamente. Estas soluções foram inoculadas através da via oral em dois grupos de cinco camundongos.
Todos os camundongos foram marcados com ácido pícrico (cabeça-cauda-dorso) e acondicionados em caixas de poliestireno com cama de maravalha sendo uma caixa para cada grupo de três a cinco camundongos que correspondiam a um animal examinado e das amostras de água. Os animais eram observados diariamente para a presença de eventuais sintomas da infecção por T.gondii. Após nove semanas, amostras de soro dos camundongos foram obtidas e testadas pelo MAT para pesquisa de anticorpos anti-T. gondii com ponto de corte de 25. O sangue dos camundongos foi obtido através da via submandibular com auxílio de lanceta estéril para cada grupo de camundongos.
4.7 Testes moleculares
A Reação em Cadeia da Polimerase (PCR) foi realizada em material gênico extraído de fragmentos todos os órgãos colhidos e de amostras de sangue total conservados em isopropanol a 80%.
4.7.1 Extração do DNA das amostras de tecido e de sangue
A extração do DNA dos tecidos foi realizada de acordo com o protocolo estabelecido pelo Kit Wizard SV Genomic DNA Purification® (Promega, Fitchburg, Wisconsin, USA) o qual promove a lise das células através da mistura de 0,5 g de tecido e 20 μL da enzima proteinase K® (Promega, Fitchburg, Wisconsin, USA). Esta solução foi mantida por 24 horas na temperatura de 37 oC e após este período foi acrescentado 1 mL de resina. Esta segunda solução foi colocada em uma coluna contendo um filtro onde fica retido o material genômico após a filtragem.
Posteriormente, foram realizadas lavagens para retirada da resina contendo o DNA com soluções descontaminantes. Este eluído foi ressuspendido em tampão apropriado, para a realização das técnicas de amplificação gênica dos fragmentos específicos para diagnóstico do T. gondii e de outros coccídeos da subfamília Toxoplasmatinae.
4.7.2 Extração do DNA das amostras de conteúdo intestinal e de água
extração o produto extraído foi quantificado no aparelho nanodrop® (Hoefer, Wilmington, Delaware, USA).
4.7.3 Reação em Cadeia da Polimerase (PCR)
As amostras foram testadas por meio de uma nested PCR (nPCR) específica para detecção de material gênico de T. gondii, tendo como alvo um fragmento de 155pd do gene B1 deste coccídio(BURG et al., 1989). Para a primeira fase de amplificação da PCR foram utilizados 10μM dos primers externos T1 (5’-AGCGTCTCTCTTCAAGCAGCGTA-3’) e T2 (5’-TCCGCAGCGACTTCTATCTCTGT-3’) e para a reação de nPCR foram utilizados 10μM dos primers internos T3 (5’-TGGGAATGAAAGAGACGCTAAT GTG-3’) e T4 (5’ -TTAAAGCGTTCGTGGTCAACTATCG-3’), utilizando o protocolo descrito por Yai e colaboradores (2003).
Nesta reação foram utilizados para cada amostra 14,1μL de água ultrapura, 2,5 μL de tampão de reação (KCl 50 mM; Tris-HCl 10 mM, pH 9,0), 4,0 μL da mistura de dNTPs – dATP, dTTP, dCTP, dGTP (1,25 μM), 1,25 μL de cada primer (10 μM), 0,75 μL de MgCl2
(50 mM), 0,15 μL de Taq DNA polimerase (5 U/μl) platinum® (Invitrogen, Carlsbad, CA, EUA) e 1,0 μL da amostra de DNA extraído. Para a nPCR foram utilizadas as mesmas quantidades da mistura de reagentes acrescidas de 1,0 μL do produto amplificado na PCR.
A PCR foi realizada com 25 ciclos a 94 °C por 45 segundos, 55 °C por 1 minuto e 72 °C por 1,5 minuto, e a nPCR com 35 ciclos a 94 °C por 45 segundos, 55 °C por 1 minuto e 72 °C por 1,5 minutos. As reações foram precedidas por uma etapa de desnaturação inicial a 94 °C por 3 minutos e extensão final a 72 ºC por 10 minutos. Todas as reações foram reveladas em gel de agarose a 2,0 % corado com Sybr Safe ® (Molecular Probes, Portland, Oregon, USA) e visualizados sobre luz ultravioleta.
As alíquotas das amostras positivas foram submetidas a uma nova nPCR para realização do sequenciamento. Para tanto, foram utilizandos os primers desenhados com base nas sequências conservadas de T. gondii, Hammondia hammondi, Neospora caninum e Sarcosystis neurona, que amplificam um fragmento do gene que codifica RNA ribossômico 18S
(18S rRNA) comum aos parasitas (SU; ZHANG; DUBEY, 2010).
(Integrated DNA Technologies, Coralville, Iowa, USA) que amplifica um produto com 290 pb para as espécies S. neurona, N. caninum, H. hammondi e T. gondii e com 310 pb para Sarcocystis
spp (SU; ZHANG; DUBEY, 2010).
Foi utilizada a seguinte mistura de reagentes na PCR para uma reação de 36 μL: 22,92 μL de água ultrapura, 3,6 μL de tampão de reação (KCl 50 mM; Tris-HCl 10 mM, pH 9,0), 2,8 μL da mistura de dNTPs – dATP, dTTP, dCTP, dGTP (2,5 μM), 0,2 μL de cada primer (25 μM), 2,8μL
de MgCl2 (25 mM), 0,28 μL de Taq DNA polimerase (5 U/μl) e 6,0 μL da amostra de DNA
extraído. Para a nPCR foram utilizadas as mesmas quantidades da mistura de reagentes com primers a 50 μM, utilizando-se 2 μL do produto da PCR diluído em água ultra pura (1:2). Como
controle negativo, foi utilizada água ultrapura.
A PCR foi realizada com 30 ciclos a 94°C por 30 seg, 55 °C por 1 min e 72°C por 2 min, e a nested-PCR com 35 ciclos a 94 °C por 30 seg, 55 °C por 1 min e 72 °C por 1,5 min. As reações
foram precedidas por uma etapa de desnaturação inicial a 94°C por 4 min. Todas as reações foram reveladas em gel de agarose 2,0 % corado com Sybr Safe ® (Molecular Probes, Portland Oregon, USA) e visualizados sobre luz ultravioleta para checar a qualidade do produto da PCR.
4.7.4 Purificação, Precipitação do DNA e reação de sequenciamento
Os produtos da PCR foram purificados utilizando o produto comercial ExoSAP-IT (USB Corporation®, Santa Clara, California, USA), que é composto por Exonuclease I (Exo I) para digerir o excesso de primers e Shrimp Alkaline Phosphatase (SAP) para degradar o excesso de nucleotídeos provenientes da PCR.
Para determinar a sequência genética, o material já purificado foi utilizado como amostra na reação de sequenciamento através do método de Sanger utilizando-se ddNTP marcados. Para tanto, foi preparado um mix com reagentes para o sequenciamento acrescidos de apenas um dos primer e da amostra purificada, para cada amostra duas reações foram executadas, uma com o primer senso e outra com o primer anti-senso.
Cada reação contia:
- 1 µL de primer (senso ou anti senso);
- 2 µL de Tampão Save Money 5 x (Tris-HCl 400 mM; MgCL2 10 mM, pH 9,0); - 2 µL de BigDye (USB Corporation ®, Santa Clara, California, USA) v. 3.1. - 5 µL de amplificado
- Desnaturação inicial: 96 °C por um minuto - Desnaturação: 96 °C por 15 segundos
Rampa: 1,0 °C/s
- Hibridização: 50 °C por 15 segundos Rampa: 1,0 °C/s
- Extensão: 60 °C por quatro minutos Rampa: 1,0 °C/s
Este ciclo se repetiu mais 34 vezes a partir da desnaturação. Finalizando este procedimento, as amostras foram mantidas a 4 °C até a próxima etapa.
O passo seguinte foi a precipitação do material em placa, nessa etapa foram adicionados 5 µL de EDTA (125 mM) e 60 µL de etanol a 100 % em cada poço da placa contendo o material genômicoproveniente da reação de sequenciamento. A placa foi vedada com plástico parafilme; homogeneizada com cuidado e incubada por 30 minutos em ambiente escuro.
Após a incubação a placa foi centrifugada por 30 minutos a 12 oC a 3500 rpm. O sobrenadante foi descartado por inversão e a placa foi centrifugada invertida por 30 segundos a 500 rpm. Foram então, adicionados 60 µL de etanol a 70% em cada poço da placa e feita uma nova centrifugação por 15 minutos a 12 oC. Novamente o sobrenadante foi descartado por inversão e uma nova centrifugação por 30 segundos a 500rpm foi realizada. As amostras eram mantidas a 20 °C até o momento da leitura.
A leitura foi feita em um sequenciador modelo Applied Biosystem® ABI370 (Applied Biosystem, Pasadena, California, USA) e os programas os cromatogramas gerados foram analisados em programas de computador apropriados.
4.7.5 Alinhamento e análises das sequências
A qualidade dos produtos sequenciados foi verificada utilizando-se o programa Clustal X (THOMPSON et al., 1997) e submetidas a alinhamentos múltiplos alterando os parâmetros relativos à presença de “indels” (penalidade para indel=1, extensão=3) e manualmente ajustados no programa GeneDoc v. 2.6.01 (NICHOLAS et al., 1997).
(99 ou 100 %) disponíveis no Genbank foram consideradas como sendo pertencentes à mesma
espécie.
4.8 Análise estatística dos dados
Possíveis associações entre os valores de ocorrência de anticorpos anti-T. gondii nos animais capturados em cada parque foram verificadas através do teste Qui-quadrado de Pearson. Também analizou-se possíveis associações entre a ocorrência de anticorpos anti-T. gondii nos animais que utilizam o mesmo estrato arbóreo (marsupiais, primatas e morcegos) em cada um dos parques pelo mesmo teste.
As mesmas associações foram verificadas para os animais que foram positivos através do diagnóstico molecular utilizando o teste Exato de Fisher.
Em relação aos gatos capturados, associações entre faixas etárias, sexo e a presença de anticorpos anti-T. gondii foram avaliadas através do teste Qui-quadrado de Pearson. Possíveis associações entre número total de amostras positivas para o teste molecular e número total de amostras coletadas foram verificadas através do teste Exato de Fisher.
5 RESULTADOS
No Apêndice A, encontram-se os dados dos 92 animais silvestres capturados sendo: sorologia para T. gondii, pesquisa de T. gondii no sangue por métodos moleculares, além de
análises dos tecidos (bioensaio em camundongos e teste molecular) dos animais necropsiados (69 indivíduos). No Apêndice B, encontra-se o detalhamento das amostras dos gatos capturados (local de captura, sexo e idade) e os resultados da pesquisa de anticorpos anti-T. gondii e das análises
moleculares do sangue e tecidos.
5.1 Número de espécies registradas e número de amostras obtidas
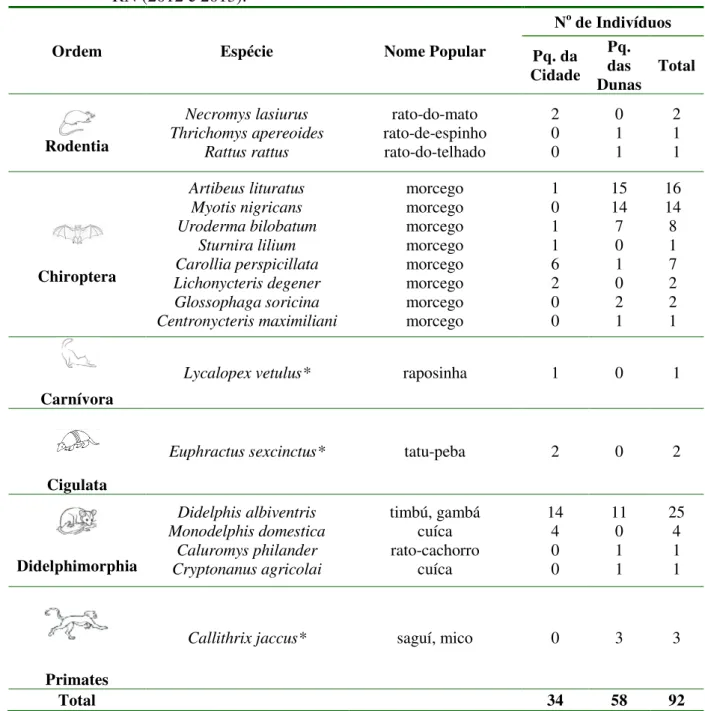
Foram identificadas 18 espécies de mamíferos silvestres, sendo três pertencentes a ordem Rodentia, oito pertencentes a ordem Chiroptera, quatro pertencentes a ordem Didelphimorphia, uma espécie pertencente à ordem Cingulata, uma espécie pertencente à ordem Primates e uma espécie pertenciente à ordem Carnivora (Tabela 2).
No Parque da Cidade foram capturados representantes de dez diferentes espécies e no Parque das Dunas foram capturados indivíduos de 12 diferentes espécies.
Tabela 2 – Ordem, espécies e quantidade de mamíferos silvestres capturados e amostrados nas Unidade de Conservação (Parque da Cidade e Parque das Dunas) em Natal, RN (2012 e 2013).
Ordem Espécie Nome Popular
No de Indivíduos
Pq. da Cidade
Pq. das
Dunas Total
Rodentia Necromys lasiurus Thrichomys apereoides Rattus rattus rato-do-mato rato-de-espinho rato-do-telhado 2 0 0 0 1 1 2 1 1 Chiroptera Artibeus lituratus Myotis nigricans Uroderma bilobatum Sturnira lilium Carollia perspicillata Lichonycteris degener Glossophaga soricina Centronycteris maximiliani morcego morcego morcego morcego morcego morcego morcego morcego 1 0 1 1 6 2 0 0 15 14 7 0 1 0 2 1 16 14 8 1 7 2 2 1 Carnívora
Lycalopex vetulus* raposinha 1 0 1
Cigulata
Euphractus sexcinctus* tatu-peba 2 0 2
Didelphimorphia Didelphis albiventris Monodelphis domestica Caluromys philander Cryptonanus agricolai timbú, gambá cuíca rato-cachorro cuíca 14 4 0 0 11 0 1 1 25 4 1 1 Primates
Callithrix jaccus* saguí, mico 0 3 3
Total 34 58 92
Nota: * = Estas espécies não são consideradas pequenos mamíferos, porém foram capturadas em gaiolas modelo Tomahawk e por esse motivo foram consideradas nas análises.
Figura 5 – Fluxograma ilustrando o direcionamento das amostras biológicas obtidas nas duas coletas em campo (período de chuva e seca) no Parque da Cidade e no Parque das Dunas, Natal, RN.
5.2 Diagnóstico sorológico
5.2.1 Diagnóstico sorológico em animais silvestres
Foram obtidas ao todo 74 amostras de soro de animais silvestres. A relação dos animais silvestres amostrados e os resultados da sorologia para anticorpos anti-T. gondii (MAT) estão apresentados na Tabela 3.
154 mamíferos
92 animais silvestres
74 amostras de sangue
74 amostras de soro para MAT
74 amostras de sangue para testes moleculares
69 animais necropsiados
69 bioensaios
483 amostras de tecidos para testes moleculares
62 gatos
53 amostras de sangue
53 amostras de soro para MAT
53 amostras de sangue para testes moleculares
70 amostras de órgãos
37 úteros para bioensaios e testes moleculares
3 intestinos para bioensaios
25 testículos para testes moleculares