UNIVERSIDADE FEDERAL DA PARAÍBA
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E
SINTÉTICOS BIOATIVOS
ABRAHÃO ALVES DE OLIVEIRA FILHO
PARTICIPAÇÃO DA VIA DO ÓXIDO NÍTRICO E DO
CÁLCIO NO VASORRELAXAMENTO INDUZIDO PELO
FLAVONOIDE 5,7,4
’-TRIMETOXIFLAVONA (TMF) EM
ARTÉRIA MESENTÉRICA SUPERIOR DE RATO
ABRAHÃO ALVES DE OLIVEIRA FILHO
PARTICIPAÇÃO DA VIA DO ÓXIDO NÍTRICO E DO
CÁLCIO NO VASORRELAXAMENTO INDUZIDO PELO
FLAVONOIDE 5,7,4
’-TRIMETOXIFLAVONA (TMF) EM
ARTÉRIA MESENTÉRICA SUPERIOR DE RATO
Dissertação apresentada ao Programa de Pós-graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da Universidade Federal da Paraíba, como parte dos requisitos para a obtenção do título de MESTRE EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS. Área de concentração: FARMACOLOGIA
Orientador: Prof. Dr. Isac Almeida de Medeiros
O48p Oliveira Filho, Abrahão Alves de.
Participação da via do óxido nítrico e do cálcio no vasorrelaxamento induzido pelo flavonoide 5,7,4-trimetoxiflavona (TMF) em artéria mesentérica superior de rato/ Abrahão Alves de Oliveira Filho. - - João Pessoa: [s.n.], 2012.
110f. : il.
Orientador: Isac Almeida de Medeiros. Dissertação (Mestrado)-UFPB/CCS.
1. Produtos naturais. 2. Praxelis clematidea. 3. Cálcio. 4. Artéria mesentérica. 5. Vasorrelaxamento. 6. Óxido nítrico.
ABRAHÃO ALVES DE OLIVEIRA FILHO
PARTICIPAÇÃO DA VIA DO ÓXIDO NÍTRICO E DO
CÁLCIO NO VASORRELAXAMENTO INDUZIDO PELO
FLAVONOIDE 5,7,4
’-TRIMETOXIFLAVONA (TMF) EM
ARTÉRIA MESENTÉRICA SUPERIOR DE RATO
Aprovado em ____/____/____
Banca examinadora
_________________________________________________ Prof. Dr. Isac Almeida de Medeiros
(Universidade Federal da Paraíba) Orientador
_________________________________________________ Profª. Drª.Sandra Rodrigues Mascarenhas
(Universidade Federal da Paraíba) Examinadora Interna
_________________________________________________ Prof. Dr.Márcio Roberto Viana dos Santos
Dedico esta conquista às pessoas mais importantes da minha vida:
Aos meus pais, Raquel e Abrahão, pelo amor, carinho, apoio e dedicação fornecida ao longo de toda a minha vida, buscando sempre o melhor para a minha carreira profissional.
Aos meus irmãos, Vitor e Vinícius, pela
amizade e apoio incondicionais, meus eternos
companheiros de jornada.
Ao meu tio, Normando, pelo exemplo de
coragem, profissionalismo e dedicação, que me
incentivou a lutar sempre em busca do melhor.
A minha namorada, Heloísa, pelo amor,
companhia e compreensão, que foram essenciais
para que eu conquistasse esta grande vitória. Com
certeza sem ter você ao meu lado, eu não estaria
A Deus, por ter me concedido a oportunidade de viver e desfrutar a
minha linda família e amigos. Obrigado Senhor por estar sempre ao meu lado nos
momentos que mais precisei e por mais esta vitória em minha vida.
Ao meu orientador, Prof. Isac Almeida de Medeiros, pela oportunidade,
orientação e confiança em mim depositada.
Ao Prof. José Maria Barbosa Filho e a sua ex-aluna de doutorado, a
Profª. Gabriela Lemos de Azevedo Maia, que não mediram esforços para
tornar possível a realização deste trabalho, disponibilizando-me, sem empecilho,
o flavonoide, que foi o foco do meu mestrado.
Aos professores Sandra Mascarenhas e Márcio Roberto, por terem
aceitado participar da banca de defesa do meu mestrado, contribuindo
significativamente para o meu trabalho.
À equipe do Laboratório de Farmacologia Cardiovascular: Aurylenne
Carlos, Bruna Priscilla, Fabíola Furtado, Islânia Araújo, Jaciclene, José George,
Josimara, Juliane, Kívia, Lays, Leônidas, Marden, Maria Angélica, Maria do
Carmo, Maria do Socorro, Melissa Luciano, Mônica Almeida, Natália Tabosa,
Priscila Maria, Priscila Crispiniano, Thais Josy, Thais Porto, Thyago Queiroz e
Valéria Assis, e aos professores Robson Veras, Valdir Braga e Darizy Flávia; por
toda a ajuda, pela partilha de conhecimentos e companheirismo durante todo
este tempo.
Aos meus eternos amigos do peito e “equipe de apoio”: Carminha,
Fabíola, Natália, Thyago e Raline, que nunca me negaram uma ajuda ou uma
palavra de conforto, mesmo quando eu ligava várias vezes, com toda a minha
insegurança, para discutir os mesmos resultados e chamava todo mundo para
escutar os meus demorados ensaios de defesa. Com certeza, sem vocês do meu
lado, esse mestrado não teria sido o mesmo.
À Thais Josy, minha grande companheira de experimentos, com quem
minha vida: o meu primeiro ano de iniciação científica e o meu segundo ano de
mestrado. Durante todo este tempo, sempre percebi que ali do meu lado existia
não só uma amiga, mas também um exemplo de profissional competente e
decidida em alcançar sempre o sucesso.
À Kivia Sales, que caminhou ao meu lado durante estes dois anos,
torcendo sempre pela minha vitória e me ajudando não só na parte experimental,
mas também nos momentos turbulentos da pesquisa, com palavras de conforto e
amizade.
À Lays, minha aluna de iniciação científica, que me acompanhou na
realização deste trabalho, dividindo os momentos de estudo, descontração e
realização dos experimentos.
À Aldeídia de Oliveira, por todos os ensinamentos transmitidos,
amizade e torcida, que foram indispensáveis para a realização do meu mestrado.
À Islânia, pela amizade, força e disposição em ajudar, sempre quando
necessário.
À Profª Inês, que mesmo nos bastidores, me incentivou sempre a
caminhar na linha da pesquisa e buscar o melhor para a minha carreira
profissional.
À minha turma do Mestrado, em especial: Paula, Fagner, Felipe,
Viviane, Jacqueline, Ítalo, Patrícia, Hellane, Juliana Carreiro, Juliana
Moura, Gregório, Dayenne, Ana Paula, Otemberg, Jéssica, Madalena,
Jeane, Ricardo, Rafaela e Sara; que dividiram comigo alguns dos momentos
mais especiais na minha vida, como os estudos durante as disciplinas e as
comemorações após cada sucesso no mestrado. Com certeza, desta turma sairão
excelentes pesquisadores.
À Valéria, Milena e George, meus companheiros da Farmacologia
À Tatiana de Oliveira Apolinário, minha prima do coração, que mesmo
distante, contribuiu para a realização desta vitória.
Aos meus amigos da Fitoquímica, Viviane Medeiros, Marcelo, Ana
Silvia, Jaqueline, Ana Lúcia, Daysiane, Fábio, Isis e Thaísa, que sempre me
receberam em seus laboratórios, independente das circunstâncias, com muita
alegria e descontração.
À Anne Dayse e Natália Alcântara, que dividiram comigo as várias
fases do meu crescimento intelectual, estando sempre ao meu lado para dar
força, coragem e me incentivar a concluir este trabalho da melhor forma
possível.
Aos meus amigos de graduação, Eduardo, Camilla, Carol Lianza e
Diogo, que sempre torceram pelo meu sucesso e, até hoje, se fazem presentes,
independente dos diferentes caminhos escolhidos.
À Juliana Ramos e Luana, pela amizade e estímulo que me deram
durante toda essa jornada.
Ao companheiro Crispim Duarte, que sempre desempenhou suas
obrigações de uma maneira exemplar, nunca medindo esforços em auxiliar a todos
que precisaram da sua ajuda.
As funcionárias Mônica Rodrigues e Dona Maria, com quem tive o prazer
de dividir, sempre com muita alegria, vários inícios de manhãs dos meus dias; e
aos funcionários Luiz Cordeiro e Adriano Cordeiro, por todo o trabalho,
proporcionando nosso melhor bem-estar.
A todos os professores do mestrado, pelos ensinamentos transmitidos
durante as disciplinas.
À Coordenação e aos funcionários do Programa de Pós-graduação em
Produtos Naturais e Sintéticos Bioativos, pela competência, seriedade e apoio.
Ao CNPq, CAPES, LTF e UFPB pelo apoio financeiro e estrutural para o
“Nas grandes batalhas da vida, o primeiro passo para a vitória é o desejo de vencer.”
RESUMO
OLIVEIRA FILHO, A. A. Participação da via do óxido nítrico e do cálcio no vasorrelaxamento induzido pelo flavonoide 5,7,4’-trimetoxiflavona (TMF) em artéria mesentérica superior de rato. 2012. 11p. Dissertação (Mestrado em Farmacologia de Produtos Naturais e Sintéticos Bioativos), Centro de Ciências da Saúde, Universidade Federal da Paraíba, João Pessoa, 2012.
Os efeitos farmacológicos do extrato etanólico (EPC), fase clorofórmica (FPC) e
5,7,4’-trimetoxiflavona (TMF) provenientes de Praxelis clematidea, sobre anéis de
artéria mesentérica superior de ratos, foram estudados. Experimentos de tensão isométrica revelaram que EPC e FPC (0,001–1000 µg/mL) promoveram relaxamento dependente de concentração em anéis mesentéricos, com endotélio funcional (CE50
= 27,2 ± 6,4 µg/mL; 41,9 ± 11,8 µg/mL, respectivamente, n=7), e estes efeitos foram atenuados após a remoção do endotélio vascular (CE50 = 141,9 ± 19,4 µg/mL, 167,0
± 30,6 µg/mL, respectivamente, n=7), sugerindo que ambos possuem metabólitos secundários vasorrelaxantes. O TMF (10-12 a 10-3 M), composto majoritário isolado de FPC, promoveu um relaxamento em anéis com endotélio intacto (pD2= 5,44±0,12,
n=6), de maneira dependente de concentração, com potência semelhante ao efeito da quercetina, o flavonóide mais abundante no reino vegetal (pD2= 5,71±0,16, n=6).
Após a remoção do endotélio funcional a curva concentração-resposta para o TMF foi deslocada para a direita, com uma diminuição da potência, porém sem alteração no efeito máximo (pD2 = 4,50 ± 0,10, n=6). O relaxamento do flavonóide não foi
modificado pela pré-incubação de indometacina (10 µM). Entretanto, foi atenuado após a pré-incubação de L-NAME (100 µM; pD2 = 4,52 ± 0,08, n=5), PTIO (300 µM;
pD2 = 4,62±0,09, n=5) e ODQ (10 µM; pD2 = 4,36 ± 0,11, n=5), e foi revertido em
preparações com endotélio funcional pré-incubadas com arginina (1mM) mais L-NAME (100 µM) (pD2 = 5,85 ± 0,14, n=5). Demonstrando o não envolvimento dos
metabólitos da COX e a participação da via NOS/NO/CGs no relaxamento produzido por TMF. A presença de KCl 20 mM (pD2 = 4,62 ± 0,08, n = 5) e TEA (3 mM;
pD2 = 4,28 ± 0,10, n=5), atenuou a resposta produzida por TMF, apenas em anéis
com endotélio vascular, demonstrando que este composto produz relaxamento por meio ativação de canais para K+, dependente do endotélio. Além disso, a utilização da Glibenclamida (10 µM) não modificou o efeito do TMF em anéis com endotélio funcional, porém a pré-incubação de 4-aminopiridina (1 mM; pD2 = 4,7 ± 0,08, n = 5),
e TEA (1 mM; pD2 = 4,48 ± 0,04, n=5) atenuaram a potência da resposta
vasorrelaxante do flavonóide, sugerindo o envolvimento dos canais para K+ do tipo
Kv e BKca. TMF promoveu relaxamento em anéis mesentéricos pré-contraídos com
KCl 60 mM e inibiu a vasoconstrição induzida pelo CaCl2 de maneira dependente de
concentração. O efeito máximo de TMF foi atenuado com a pré-incubação de nifedipino (1 µM; Emáx = 56,0 ± 7,9%, n=5), indicando que a vasodilatação induzida
pelo flavonóide está relacionada com a inibição do influxo de Ca2+ via Cav tipo L. Em
conclusão, estes resultados sugerem que o EPC, a FPC e o TMF induzem efeito vasorrelaxante em anéis mesentéricos, e que a resposta produzida pelo flavonóide envolve a via NOS/NO/CGs, com consequente ativação de canais para K+, e a inibição do influxo de Ca2+ via canais para Cav tipo-L.
ABSTRACT
OLIVEIRA FILHO, A. A. Participation of the nitric oxide and calcium pathway in
the vasorelaxant effect induced by flavonoid 5,7,4’-trimethoxyflavone (TMF) in
rat superior mesenteric artery. 2012. 11p. Dissertation (Master in Pharmacology of Natural Products and Bioactive Synthetic), Centre for Health Sciences, Federal University of Paraíba, João Pessoa, 2012.
The pharmacological effects of ethanol extract (EPC), chloroform phase (FPC) and 5,7,4'-trimethoxyflavone (TMF) from Praxelis clematidea on superior mesenteric artery rings of rats, were studied. Isometric tension experiments revealed that EPC and FPC (0.001 to 1000 µg/mL) promoted concentration-dependent relaxation in mesenteric rings with functional endothelium (EC50 = 27.2 ± 6.4 µg/mL, 41.9 ± 11.8
µg/mL, respectively, n = 7), and these effects were attenuated after removal of the vascular endothelium (EC50 = 141.9 ± 19.4 µg/mL,167.0 ± 30.6 µg/mL, respectively,
n = 7), suggesting that both are vasorelaxants secondary metabolites. The TMF (10-12 to 10-3 M), composed mostly isolated FPC, promoted a relaxation in rings with intact endothelium (pD2 = 5.44 ± 0.12, n = 6), concentration dependent manner, with
power similar to the effect of quercetin, a flavonoid abundant in the plant kingdom (pD2 = 5.71 ± 0.16, n = 6). After removal of functional endothelium the
concentration-response curve for the TMF was shifted to the right, with a decrease in potency, but no change in maximal effect (pD2 = 4.50 ± 0.10, n = 6). The relaxation of the
flavonoid was not modified by pre-incubation of indomethacin (10 µM). However, it was attenuated after pre-incubation of L-NAME (100 µM, pD2 = 4.52 ± 0.08, n = 5),
PTIO (300 µM, pD2 = 4.62 ± 0.09, n = 5 ) and ODQ (10 µM, pD2 = 4.36 ± 0.11, n = 5)
and was reversed in preparations with functional endothelium pre-incubated with L-arginine (1 mM) plus L-NAME (100 µM) (pD2 = 5.85 ± 0.14, n = 5). Demonstrating
the non-involvement of COX metabolites and participation of the NOS/NO/CGs pathway in the relaxation produced by TMF. The presence of 20 mM KCl (pD2 = 4.62
± 0.08, n = 5) and TEA (3 mM; pD2 = 4.28 ± 0.10, n = 5) attenuated the response produced by TMF only in rings with endothelium, demonstrating that this compound produces relaxation through activation of K+ channels to endothelium-dependent. In addition, the use of glibenclamide (10 µM) did not modify the effect of TMF on rings with functional endothelium, but the pre-incubation of 4-aminopyridine (1 mM; pD2 =
4.7 ± 0.08, n = 5) and TEA (1 mM; pD2 = 4.48 ± 0.04, n = 5) attenuated the potency
of the flavonoid vasorrelaxant response, suggesting the involvement of the K+ channels to Kv and BKCa type. TMF relaxations in mesenteric rings pre-contracted
with 60 mM KCl and inhibited the vasoconstriction induced by CaCl2 concentration
dependent manner. The maximum effect of TMF was mitigated by pre-incubation of nifedipine (1 µM, Emáx = 56.0 ± 7.9%, n = 5), indicating that the flavonoid-induced
vasodilation is related to the inhibition of the influx of Ca2+ via L-type Ca v. In
conclusion, these results suggest that the EPC, the FPC and TMF inducing effect vasorrelaxante in mesenteric rings, and that the response produced by the flavonoid involves NOS/NO/CGs pathway, with consequent activation of channels for K+, and
inhibition of the influx Ca2+ channels via L-type Cav.
LISTA DE FIGURAS
Figura 1 – Representação esquemática do mecanismo de contração na célula muscular lisa vascular... 26
Figura 2 – Representação esquemática do mecanismo de relaxamento da célula muscular lisa vascular... 28
Figura 3 - Foto de Praxelis clematidea (Griseb.) R. M. King & H. Robinson... 30
Figura 4 - Estrutura química do flavonoide 5,7,4’-trimetoxiflavona ... 31
Figura 5 - Sistema de cubas e aquisição de dados de tensão isométrica para órgão isolado... 40
Figura 6 - Representação da verificação da viabilidade do órgão e da integridade do endotélio vascular... 41
Figura 7 - Representação esquemática do protocolo experimental para avaliação dos efeitos de EPC (0,001 - 1000 µg/mL), FPC (0,001 - 1000 µg/mL) e TMF (10-12–
10-3 M) em anéis de artéria mesentérica superior isolada de rato, pré-contraídos com FEN (1 µM). A) Anéis com endotélio intacto; B) Anéis sem endotélio... 43
Figura 8 - Representação esquemática do protocolo experimental para avaliação dos efeitos de quercetina (10-12 – 10-3 M) em anéis de artéria mesentérica superior
isolada de rato, com endotélio intacto, pré-contraídos com FEN (1 µM)... 44
Figura 9 - Representação esquemática do protocolo experimental para avaliação da participação dos metabólitos do ácido araquidônico no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1µM)... 45
Figura 10 - Representação esquemática do protocolo experimental para avaliação da participação da NOS no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM)... 46
Figura 11 - Representação esquemática do protocolo experimental para avaliação do envolvimento do NO no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM)... 47
Figura 13 - Representação esquemática do protocolo experimental para avaliação da participação dos canais para K+ no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM)... 49
Figura 14 - Representação esquemática do protocolo experimental para avaliação da dos subtipos de canais para potássio no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM)... 50
Figura 15 - Representação esquemática do protocolo experimental para avaliação da ativação direta dos canais para K+ no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato sem endotélio funcional, pré-contraídoscom FEN (1 µM)...
Figura 16 - Representação esquemática do protocolo experimental para avaliação dos efeitos de TMF em anéis de artéria mesentérica superior isolada de rato sem endotélio funcional, pré-contraídos com solução despolarizante (KCl 60 mM)...
52
53
Figura 17 - Representação esquemática do protocolo experimental para avaliação dos efeitos de TMF sobre as contrações induzidas por concentrações cumulativas de CaCl2 (10-6 – 3 x 10-2) em meio despolarizante (KCl 60 mM) nominalmente sem
cálcio... 54
Figura 18 - Representação esquemática do protocolo experimental para avaliação do efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato sem endotélio funcional, pré-encubados com NIF (1 µM)...
Figura 19 - Registros originais das respostas de EPC (0,01 – 1000 µg/mL) em anéis pré-contraídos com FEN (1 µM) com o endotélio intacto (A) ou após sua remoção (B)...
Figura 20 - Registros originais das respostas de FPC (0,01 – 1000 µg/mL) em anéis pré-contraídos com FEN (1 µM) com o endotélio intacto (A) ou após sua remoção (B)...
Figura 21 - Registros originais das resposta de TMF (10-12– 10-3 M) em anéis
pré-contraídos com FEN (1 µM) com o endotélio intacto (A) ou após sua remoção (B)...
55
57
59
LISTA DE QUADROS
Quadro 1 - Composição da solução de Tyrode para artéria mesentérica ... 37
Quadro 2 - Composição da solução de Tyrode livre de cálcio ... 37
Quadro 3 - Composição da solução de Tyrode com KCl a 20 mM ... 37
Quadro 4 - Composição da solução de Tyrode com KCl a 60 mM ...
Quadro 5 - Composição da solução de Tyrode com KCl a 60 mM nominalmente sem cálcio...
38
LISTA DE GRÁFICOS
Gráfico 1 – Curvas concentração-resposta para o efeito relaxante induzido por EPC (0,01 – 1000 µg/mL) em anéis de artéria mesentérica superior isolada de ratos com
endotélio intacto (●) ou endotélio ausente (○), pré-contraídos com FEN (1 µM)... 58
Gráfico 2 – Curvas concentração-resposta para o efeito relaxante induzido por FPC (0,01 – 1000 µg/mL) em anéis de artéria mesentérica superior isolada de ratos com
endotélio intacto (●) ou endotélio ausente (○), pré-contraídos com FEN (1 µM)... 60
Gráfico 3 - Curvas concentração-resposta para o efeito relaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos com
endotélio intacto (●) ou endotélio ausente (○), pré-contraídos com FEN (1 µM)... 62
Gráfico 4 - Curvas concentração-resposta para o efeito relaxante induzido por TMF
(10-12 – 10-3 M) (●), e Quercetina (10-12 – 10-3 M) (▼) em anéis de artéria
mesentérica superior isolada de ratos, com endotélio intacto, pré-contraídos com FEN (1 µM)... 63
Gráfico 5 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na presença de
indometacina (10 µM) (▼)... 64
Gráfico 6 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com
endotélio intacto, na ausência (●) e na presença de L-NAME (100 µM) (▼) ou (□) L
-arginina (1 mM) + L-NAME (100 µM), pré-contraídos com FEN (1 µM)... 65
Gráfico 7 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na presença de
PTIO (300 µM) (▼)... 66
Gráfico 8 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com
endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na presença de
ODQ (10 µM) (▼)... 67
Gráfico 9 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na presença de
Gráfico 10 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na
presença de glibenclamida (▼)... 69
Gráfico 11 -. Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos,
com endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na
presença de TEA (▼)... 70
Gráfico 12 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, com endotélio intacto, pré-contraídos com FEN (1 µM) na ausência (●) e na
presença de 4-AP (▼)... 71
Gráfico 13 - Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, sem endotélio funcional, pré-contraídos com FEN (1 µM) na ausência (○) e na
presença de 20 mM KCl ( ) (A) e na presença de TEA (3 mM) ( ) (B)... 72
Gráfico 14 – Curvas concentração-resposta para o efeito vasorrelaxante induzido por TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de ratos, sem endotélio funcional, pré-contraídos com FEN (1 µM) na ausência (○) ou na
presença de 60 mM de KCl ( )... 73
Gráfico 15 - Curvas cumulativa para CaCl2 na presença de concentrações isoladas
de TMF, em anéis de artéria mesentérica superior isolada de ratos,sem endotélio funcional... 74
LISTA DE ABREVIATURAS E SIGLAS AC ACh Adenilil ciclase Acetilcolina Akt AMPc
Proteína cinase B
Monofosfato de adenosina cíclico
BKCa Canal para potássio sensível ao cálcio de grande condutância BAY K8644 S-(-)-1,4-diidro-2,6-dimetil-5-nitro-4-[2-(trifluorometil)fenil]-3-
Ácidopiridinecarboxilíco éster metílico
CAM Cav CaVL
Calmodulina
Canais para cálcio sensível à voltagem Canais para cálcio sensível à voltagem tipo L
Ca2+ Cálcio
([Ca2+]
i) Concentração de cálcio intracelular
CE50 Concentração que promove 50% do efeito máximo de uma substância CMLV
CGs COX
Célula muscular lisa vascular Ciclase de guanilil solúvel Ciclooxigenase
DC Débito cardíaco
EDHF EDTA
Fator hiperpolarizante derivado do endotélio Ácido etileno-diamino-tetracético
Emax Efeito máximo
EPC e.p.m.
Extrato etanólico de Praxelis clematidea Erro padrão da média
eNOS Enzima sintase de NO endotélial
ET1 FC
Endotelina 1
Frequência cardíaca
FEN Fenilefrina
FPC Fase clorofórmica de Praxelis clematidea
GMPc Monofosfato de guanosina ciclíco
IP3 1,4,5-trisfosfato de inositol
KV Canal para potássio sensível à voltagem KATP Canal para potássio sensível à voltagem Kca Canal para potássio sensível ao cálcio L-NAME NG-Nitro-L-arginina methil ester
MLCK MLC20
Cinase da cadeia leve da miosina Cadeia leve de miosina
N Número de experimentos realizados
NOS Enzima sintase de NO
NO Óxido nítrico
NIF Nifedipino
PGI2 Prostaciclinas PA Pressão arterial
pD2 Logaritmo negativo do valor de CE50 PKA Proteína cinase A
PKC Proteína cinase C
PKG Proteína cinase G
PLC Fosfolipase C
PTIO 2-fenil-4,4,5,5-tetrametilimidazolina-1-oxil-3-óxido
ROC Canal de cálcio operado por receptores
RVPT Resistência vascular periférica total
SERCA SOC
Retículo endosarcoplasmático
Canal de cálcio operado por estoques
TEA TMF TXA2 VS Tetraetilamônio 5,7,4’-trimetoxiflavona
Tromboxano A2
Volume sistólico
SUMÁRIO
1 INTRODUÇÃO... 24 2 OBJETIVOS... 33 2.1 Gerais... 33 2.2 Específicos... 33
3 MATERIAL ... 35 3.1 Animais... 35 3.2 Drogas e reagentes... 35 3.3 Obtenção e preparação das drogas teste... 36 3.4 Soluções fisiológicas... 36
4 MÉTODOS... 40 4.1 Preparação dos anéis de artéria mesentérica superior isolada de rato... 40 4.2 Protocolos experimentais utilizando anéis de artéria mesentérica superior
isolada de rato... 41 4.2.1 Verificação do efeito de EPC ou FPC ou TMF em anéis de artéria
mesentérica isolada de rato pré-contraídos com FEN ... 42 4.2.2 Comparação do efeito de TMF e quercetina em anéis de artéria
mesentérica isolada de rato pré-contraídos com FEN... 44 4.2.3 Investigação do mecanismo vasorrelaxante de TMF em anéis de artéria
mesentérica com endotélio vascular... 45 4.2.3.1
4.2.3.2
Verificação da participação dos metabólitos da via do ácido araquidônico no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato... Verificação da participação da NOS no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato...
45
46 4.2.3.3 Verificação do envolvimento do óxido nítrico no efeito induzido por TMF
em anéis de artéria mesentérica superior isolada de rato... 47 4.2.3.4 Verificação da participação da CGs no efeito induzido por TMF em anéis
de artéria mesentérica superior isolada de rato... 48 4.2.3.5 Verificação da participação de canais para potássio (K+) no efeito induzido
4.2.3.6 Verificação da participação dos subtipos de canais para K+ no efeito
induzido por TMF em anéis de artéria mesentérica isolada de rato... 50 4.2.4 Investigação do mecanismo vasorrelaxante de TMF em anéis de artéria
mesentérica sem endotélio vascular... 51 4.2.4.1 Verificação da ativação dos canais para K+ no efeito induzido pelo TMF
em anéis de artéria mesentérica isolada de rato... 51 4.2.4.2 Verificação do efeito de TMF em anéis de artéria mesentérica superior
isolada de rato pré-contraídos com solução despolarizante de 60 mM de KCl... 52 4.2.4.3 Verificação do efeito de TMF sobre as concentrações induzidas por CaCl2
em anéis de artéria mesentérica superior isolada de rato... 53 4.2.4.4 Verificação do efeito de TMF em anéis de artéria mesentérica superior
isolada de rato pré-encubados com um bloqueador de Cav tipo L... 54
4.3 Análise estatística... 55
5 RESULTADOS... 57 5.1 Efeito de EPC, FPC e TMF em anéis de artéria mesentérica isolada de
rato pré-contraídos com FEN... 57 5.2 Comparação do efeito de TMF e quercetina em anéis de artéria
mesentérica isolada de rato pré-contraídos com FEN... 62 5.3 Efeitos de TMF em anéis de artéria mesentérica com endotélio funcional.. 63 5.3.1 Participação dos metabólitos da via do ácido araquidônico na resposta
vasorrelaxante induzida pelo TMF em anéis de artéria mesentérica superior isolada de rato... 63 5.3.2 Participação da enzina NOS na resposta vasorrelaxante induzida pelo
TMF em anéis de artéria mesentérica superior isolada de rato... 64 5.3.3 Participação do NO na resposta vasorrelaxante induzida pelo TMF em
anéis de artéria mesentérica superior isolada de rato... 65 5.3.4 Participação da CGs na resposta vasorrelaxante induzida pelo TMF em
anéis de artéria mesentérica superior isolada de rato... 66 5.3.5 Participação dos canais para K+ na resposta vasorrelaxante induzida pelo
5.3.6 Participação dos subtipos de canais para K+ no efeito induzido por TMF
em anéis de artéria mesentérica isolada de rato... 69
5.4 Efeitos de TMF em anéis de artéria mesentérica sem endotélio funcional.. 71 5.4.1 Ativação dos canais para K+ no efeito induzido pelo TMF em anéis de
artéria mesentérica superior isolada de rato... 71 5.4.2 Efeito de TMF em anéis de artéria mesentérica superior isolada de rato
pré-contraídos com solução despolarizante de 60 mM de KCl... 73 5.4.3 Efeito de TMF sobre as concentrações induzidas por CaCl2 em anéis de
artéria mesentérica superior isolada de rato... 74 5.4.4 Efeito de TMF em anéis de artéria mesentérica superior isolada de rato
pré-encubados com um bloqueador de Cav tipo L... 75
1 INTRODUÇÃO
O sistema cardiovascular, o qual fornece e mantêm suficiente o fluxo sanguíneo aos diversos tecidos do organismo de acordo com as suas necessidades metabólicas, é o responsável pela regulação e manutenção da pressão arterial (PA), uma das funções fisiológicas mais complexas do sistema biológico; necessitando da ação integrada de outros sistemas como o renal, neural e endócrino (CAMPAGNOLE-SANTOS; HAIBARA, 2001; LANFRACHI; SOMERS, 2002; INOUE et al., 2006). Admite-se que alterações da PA, como as encontradas em várias doenças cardiovasculares, resultariam da disfunção desses sistemas de controle (IRIGOYEN et al., 2001).
A PA corresponde ao produto do débito cardíaco (DC) pela resistência vascular periférica total (RVPT). O DC é definido como a quantidade de sangue bombeado pelo coração a cada minuto, expresso como produto do volume sistólico (VS, em mL) pela frequência cardíaca (FC, em batimentos/minuto). A RVPT por sua vez, é determinada pelo tônus vascular e está diretamente envolvida no controle da pressão arterial (OATES apud HARDMAN et al., 1996).
O tônus vascular das pequenas artérias e arteríolas, o qual é definido como o estado de contratilidade das células musculares lisas vasculares (CMLV), é o maior determinante da resistência ao fluxo sanguíneo na circulação (JACKSON, 2000) e consequentemente da pressão sanguínea sistêmica (CRIBBS, 2006). Assim, o tônus vascular tem um importante papel na regulação da pressão arterial e distribuição do fluxo sangüíneo entre os tecidos e órgãos do corpo (JACKSON, 2000). Estudos mostram que contratilidade das CMLV pode ser regulada pela concentração de cálcio intracelular ([Ca2+]i), de modo que agentes vasodilatadores
exercem seus efeitos por diminuírem a [Ca2+]i. Já as substâncias vasoconstritoras
promovem seu efeito por elevarem a [Ca2+]i, bem como, aumentando a aparente
sensibilidade ao Ca2+ dos processos contráteis na célula muscular lisa (LEDOUX et al., 2006).
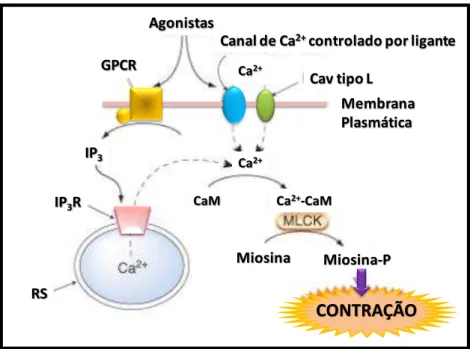
O aumento da [Ca2+]i na CMLV pode ser alcançado por meio de ligação de
mobilização do Ca2+ dos estoques intracelulares e permitindo o influxo de Ca2+ do
fluido extracelular. Assim, a ativação da fosfolipase C (PLC) e formação de 1,4,5-trifosfato de inositol (IP3) medeiam primariamente a liberação do Ca2+ dos estoques
após uma ativação do receptor metabotrópico (BERRIDGE, 2003; VILLALBA et al., 2007). No entanto, em vários vasos de resistência, a liberação sustentada da [Ca2+]i
é gerada por meio da entrada de Ca2+, induzida por agonista, através dos canais voltagem dependentes (CaV): tipo-L sensíveis a diidropiridinas e tipo-T, como
também dos canais não ativados por voltagem (“non-voltage-gated”) que incluem os
canais de Ca2+ operados por estoques (SOC) e os canais de Ca2+ operados por receptor (ROC) (MCFADZEAN; GIBSON, 2002; VILLALBA et al., 2007).
A importância da entrada do cálcio pelos CaV do tipo-L nos miócitos
vasculares, sendo dominantes na maioria dos leitos vasculares, já foi comprovada por vários estudos científicos (JACKSON, 2000). Os CaV do tipo-L são sensíveis a
1,4-diidropiridinas, uma ampla classe de fármacos, que tanto são ativadores (Bay K 8644), como bloqueadores (mimodipino, nisoldipino e nifedipino) do canal (LACINOVÁ, 2005; NAVARRO-GONZALEZ et al., 2009). O nifedipino (NIF) age por interferência alostérica no mecanismo básico de comporta do CaV do tipo-L, evitando
assim, o influxo de Ca2+ necessário para ativar a maquinaria contrátil da célula
(GODFRAIND, 1994; BROADLEY; PENSO, 2006).
Com a entrada de Ca2+, associado ao aumento da [Ca2+]
i, há uma facilitação
da interação do complexo (Ca2+)
4-CaM (calmodulina), que ao sofrer uma alteração
Figura 1 - Representação esquemática do mecanismo de contração na célula muscular lisa vascular via ligante. Fonte: RANG et al., 2007
O endotélio, que faz parte da camada íntima dos vasos sanguíneos, é o maior regulador da homeostase vascular local, não apenas por regular a permeabilidade vascular, mas também por controlar a contratilidade das CMLV e com isso, o calibre dos vasos, de acordo com as demandas hemodinâmicas e hormonais, mantendo, assim, a fluidez do sangue (BRUTSAERT, 2003; FÉLÉTOU; VANHOUTTE, 2006). As células endoteliais executam estas funções pela expressão, ativação e liberação de potentes substâncias (liberadas por nervos autonômicos e sensoriais ou plaquetas), hormônios circulantes, autacoides e citocinas, como também por estímulos físicos e químicos (mudanças na pressão, estresse por cisalhamento e pH) (INAGAMI et al., 1995; FÉLÉTOU; VANHOUTTE, 2006).
Como exemplos de fatores vasoativos liberados pelo endotélio destacam-se: os relaxantes, como por exemplo, o fator hiperpolarizante derivado do endotélio (EDHF), as prostaciclinas (PGI2) e o óxido nítrico (NO), e os contracturantes, como
por exemplo, o tromboxano A2 (TXA2), o ânion superóxido (O2-.), a endotelina-1
(ET-1) e a angiotensina II (LÜSCHER; VANHOUTTE, 1986; FURCHGOTT; VANHOUTTE, 1989; VANHOUTTE; FÉLÈTOU; TADDEI, 2005).
CONTRAÇÃO Miosina Miosina-P
RS IP3R
IP3
CaM Ca2+-CaM
Ca2+
Membrana Plasmática Agonistas
GPCR Ca2+
Cav tipo L
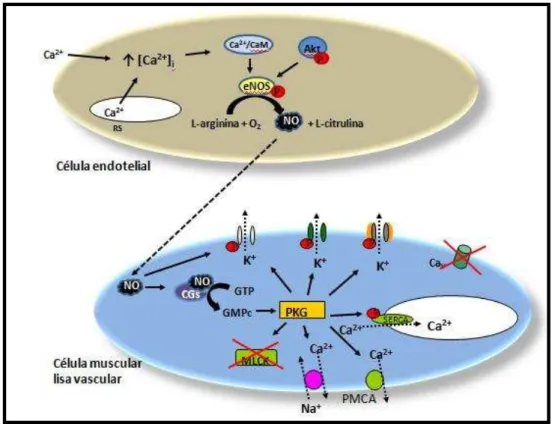
Dentre os fatores relaxantes, o NO é uma importante molécula sinalizadora implicada em diversos processos fisiopatológicos (SCATENA et al., 2010). Grande parte das ações do NO é no sistema cardiovascular, onde este gás é continuamente produzido pelas células endoteliais, a partir da conversão da L-arginina em NO pela enzima sintase do óxido nítrico presente no endotélio (eNOS), em resposta a estímulos mecânicos ou químicos, que podem agir por mobilização do Ca2+ ou por outras proteínas como a proteína cinase B (Akt). O NO difunde-se da célula de origem, passando facilmente através das membranas das células vizinhas, regulando uma série de efeitos fisiológicos (GATH; RADI; AUGUSTO, 1994; FÖRSTERMANN et al., 1995; MILLER; MEGSON, 2007).
Nas células do músculo liso vascular, o NO age ativando a enzima citosólica ciclase de guanilil solúvel (GCs) ao se ligar ao grupo heme desta enzima, resultando no aumento dos níveis do monofosfato de guanosina cíclico (GMPc) (MURAD, 1986; LIU; HUANG, 2008). O segundo mensageiro GMPc ativa a proteína cinase dependente de GMPc (PKG) (CARVAJAL et al., 2000). Isto leva, finalmente, à redução dos níveis de Ca2+ intracelulares das células musculares lisas, diminuição da sensibilidade do sistema contrátil para o Ca2+ (CARVAJAL et al., 2000),
desfosforilação da cadeia leve da miosina (WALDMAN; MURAD, 1987; CARVAJAL et al., 2000), ativação bomba de Ca2+ do retículo endosarcoplasmático (SERCA);
ativando-a e acelerando a recaptação de Ca2+ para os estoques intracelulares
(CORNWELL et al., 1991); da bomba de cálcio da membrana plasmática (PMCA); do trocador Na+/Ca2+, com posterior ativação e de canais para potássio sensíveis ao ATP (KATP), canais para potássio sensíveis ao cálcio (KCa) (ARCHER et al., 1994),
canais para potássio sensíveis a voltagem (Kv) (IRVINE; FAVALORO;
Figura 2 - Representação esquemática do mecanismo de relaxamento da célula muscular lisa vascular via produção de NO. Fonte: FRANÇA-SILVA, 2010
A hiperpolarização dependente das células endoteliais também pode ser mediada pelo fator hiperpolarizante derivado do endotélio (EDHF), caracterizado por ativar canais de K+ e induzir hiperpolarização de membrana das células do músculo
liso vascular (CHEN; SUZUKI; WESTON, 1988; TAYLOR; WESTON, 1988; GARLAND; MACPHERSON, 1992; MOMBOULI; VANHOUTTE, 1997). Além destes, os metabólitos do ácido araquidônico, pela ação da ciclooxigenase, também induz relaxamento dependente de endotélio (SINGER; PEACH, 1983) e independente de NO (PFISTER; CAMPBELL, 1992). As prostaciclinas (PGI2) são formadas no
músculo liso vascular e no endotélio e seus efeitos são mediados pela formação de AMPc (MONCADA; VANE, 1978; VANE; BUNTING; MONCADA, 1982; GRYGLEWSKI; BOTTING; VANE, 1988).
linear, contínua e independente (VI Diretriz da Sociedade Brasileira de Hipertensão, 2010); sendo responsáveis por uma alta frequência de internações, ocasionando custos médicos e socioeconômicos elevados (HIRANO; HIRANO; KANAIDE,2004; MS, 2011).
Muitas alterações cardiovasculares, como hipertensão, angina e falência cardíaca, são frequentemente tratadas com drogas vasodilatadoras, que atuam diretamente no músculo liso vascular causando vasorrelaxamento, ou indiretamente, por meio da estimulação da liberação de fatores vasorrelaxantes endógenos, ou ainda por inibir a liberação de fatores vasoconstritores (GURNEY, 1994).
Aliar o conhecimento popular ao científico em busca de novos medicamentos é um dos principais caminhos para o sucesso de pesquisas na área de plantas medicinais, que tem por objetivo avaliar a atividade biológica de plantas e seus constituintes químicos em vários sistemas, como por exemplo, o cardiovascular, com o intuito de descobrir substâncias que possam ser potencialmente utilizadas na terapêutica e/ou como ferramentas farmacológicas (DI STASI; HIRUMA-LIMA, 2002).
O Brasil, com a grandeza de seu litoral, de sua flora e, sendo o detentor da maior floresta equatorial e tropical úmida do planeta, não pode abdicar de sua vocação para os produtos naturais. Este país possui a maior biodiversidade do mundo, estimada em cerca de 20% do número total de espécies do planeta. Esse imenso patrimônio genético, que nos países desenvolvidos encontra-se escasso, tem na atualidade valor econômico – estratégico inestimável em várias atividades, mas é no campo de novos medicamentos onde reside sua maior potencialidade (ALCÂNTARA; YAMAGUCHI; VEIGA-JUNIOR, 2010).
Diante desta riquíssima flora, destaca-se a família Asteraceae, que é composta por cerca de 1.100 gêneros e 25.000 espécies (EMERECIANO et al., 2007). A América do Sul comporta cerca de 20% dos gêneros existentes. No Brasil, são estimados aproximadamente 180 gêneros e 3.000 espécies distribuídas desde as regiões mais frias e úmidas, como as serras do Sudeste e Sul, até as áreas secas na região do semi-árido nordestino, sendo menos frequentes em formações florestais (SOUSA, 2007).
a espécie Baccharis trimera DC (VERDI; BRIGHENTE; PIZZOLATTI, 2005). Dentre outros constituintes químicos, os flavonoides têm grande destaque, sendo alocados como importantes marcadores quimiotaxonômicos desta família (EMERENCIANO et al., 2001).
Os flavonoides, metabólitos secundários que podem potencialmente interferir em diferentes processos fisiopatológicos (PEREZ-VIZCAINO; DUARTE, 2010), são dotados de uma variedade de atividades biológicas já relatadas na literatura científica, como por exemplo: anti-hipertensiva (VILLAR et al.,2002), moduladora de canais iônicos (FUSI et al., 2003, SATOH; NISHIDA, 2004) e vasorrelaxante, por meio da produção de NO nas células endoteliais (REZENDE; CÔRTES; LEMOS, 2004).
A espécie Praxelis clematidea (Griseb.) R. M. King & H. Robinson (Figura 3), que possui como sinomínias: Eupatorium clematideum Griseb. e Eupatorium urtifolium var. clematideum (Griseb.) Hieron ex. Kuntze; é uma planta da família Asteraceae nativa da América do Sul. No Brasil, ela é encontrada principalmente nos estados da Bahia, Alagoas, Pernambuco, Paraíba, Amazonas e Mato Grosso (POLLOCK; SMITH, 2004). Esta espécie é pouco relatada na literatura, tanto do ponto de vista dos estudos fitoquímicos, como de suas atividades biológicas.
Figura 3- Foto de Praxelis clematidea (Griseb.)R. M. King & H. Robinson
Estudos, utilizando o extrato etanólico bruto das partes areas deste vegetal, realizados no Laboratório de Fitoquímica da Universidade Federal da Paraíba, culminaram no isolamento do 5,7,4’-trimetoxiflavona, um flavonoide do tipo flavona, já isolado em espécies de outras famílias do Reino vegetal, mas pela primeira vez isolado da espécie Praxelis clematidea (Figura 4) (MAIA, 2011).
Figura 4- Estrutura química do flavonoide 5,7,4’-trimetoxiflavona Fonte: MAIA, 2011
2 OBJETIVOS
2.1 Geral
Avaliar o efeito induzido pelo extrato etanólico (EPC), fase clorofórmica (FPC) e flavonoide 5,7,4´-trimetoxiflavona (TMF) de Praxelis clematidea em artéria mesentérica superior isolada de rato, elucidando o possível mecanismo de ação envolvido no efeito do flavonoide.
2.2 Específicos
• Comparar os efeitos farmacológicos induzidos por EPC, FPC e TMF em anéis de artéria mesentérica superior isolada de ratos;
• Investigar o mecanismo de ação do efeito vascular de TMF, avaliando a participação:
a) dos fatores vasoativos liberados pelo endotélio vascular; b) dos canais para K+;
3 MATERIAL
3.1 Animais
Foram utilizados em todos os experimentos ratos Wistar (Rattus novergicus), pesando entre 250 – 300 g. Estes animais foram provenientes do Biotério Prof. George Thomas, da Universidade Federal da Paraíba (UFPB), mantidos sob condições controle de temperatura (21 ± 1 ºC) e ciclo claro-escuro de 12 horas (6 –
18 horas), com livre acesso à água e alimentação (ração Purina®). Todos os experimentos foram aprovados pelo Comitê de Ética em Pesquisa Animal da UFPB, com certidão nº 0204/11 (Anexo).
3.2 Drogas e reagentes
As ferramentas farmacológicas utilizadas foram: 1H-[1,2,4]oxadiazolo[4,3-a]quinoxalin-1-ona (ODQ), 2-fenil-4,4,5,5-tetrametil-imidazolina-1-oxil-3-oxido (PTIO), 4-aminopiridina (4-AP), sulfato de atropina, indometacina (INDO), cloridrato de acetilcolina (ACh), quercetina, cloridrato de L-(-)-fenilefrina (FEN), cloridrato de NG
-nitro-L-arginina-metil éster (L-NAME), glibenclamida (GLIB), cloridrato de L-arginina, nifedipino (NIF), cloreto de tetraetilamônio (TEA), ácido tetraacético (N, N, N’,N’) bis beta amino étil estér etilenoglicol (EGTA). Todos obtidos da Sigma-Aldrich Brasil Ltda (São Paulo-SP, Brasil).
3.3 Obtenção e preparação das drogas teste
As partes aéreas de Praxelis clematidea R.M. King & Robinson foram coletadas no município de Santa Rita, na Lagoa do Paturi, no estado da Paraíba, em maio de 2008 e identificada pela Profª. Drª. Maria de Fátima Agra. Uma exsicata da espécie, sob código M. F. Agra et al. 6894 (JPB), está depositada no Herbário Prof. Lauro Pires Xavier (CCEN/UFPB).
A obtenção do extrato etanólico bruto (EPC), da fase clorofórmica (FPC), e do flavonoide 5,7,4´-trimetoxiflavona (TMF) foi realizada de acordo com o procedimento previamente descrito por Maia (2011).
O extrato, a fase e o flavonoide de Praxelis clematidea foram cedidos pela equipe do professor Doutor José Maria Barbosa Filho do Laboratório de Fitoquímica da Universidade Federal da Paraíba. Para a realização dos ensaios farmacológicos, as substâncias em estudo foram solubilizadas em cremofor e diluídas em água destilada. A concentração de cremofor não ultrapassou 0,018% v/v, concentração que não produz efeito sobre os parâmetros avaliados (dados obtidos em experimentos anteriores em nosso laboratório).
3.4 Soluções fisiológicas
Para a preparação das soluções nutritivas foram utilizadas as seguintes substâncias: cloreto de sódio (NaCl), cloreto de potássio (KCl), cloreto de cálcio (CaCl2), cloreto de magnésio (MgCl2), glicose (C6H12O6), bicarbonato de sódio
(NaHCO3) e fosfato de sódio (NaH2PO4). Todos estes sais foram obtidos da
Sais Concentração (mM)
NaCl 158,3
KCl 4,0
CaCl2 2,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 1 – Composição da solução de Tyrode para artéria mesentérica Fonte: TANAKA et al., 1999
Sais Concentração (mM)
NaCl 158,3
KCl 4,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
EGTA 1,0
Quadro 2 – Composição da solução de Tyrode livre de cálcio Fonte: adaptada de TANAKA et al., 1999
Nas soluções de Tyrode 20 ou 60 mM de KCl, houve uma substituição equimolar do Na+ pelo K+, ajustando isosmoticamente as soluções, conforme os quadros abaixo:
Sais Concentração (mM)
NaCl 142,3
KCl 20,0
CaCl2 2,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Sais Concentração (mM)
NaCl 102,3
KCl 60,0
CaCl2 2,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
Quadro 4 – Composição da solução de Tyrode com KCl a 60 mM Fonte: adaptada de TANAKA et al., 1999
Sais Concentração (mM)
NaCl 102,3
KCl 60,0
MgCl2 1,05
NaHCO3 10,0
NaH2PO4 0,42
Glicose 5,6
4 MÉTODOS
4.1 Preparação dos anéis de artéria mesentérica superior isolada de rato
Os ratos foram eutanasiados, em seguida, após ter sido identificada, a artéria mesentérica superior foi retirada e seccionada em anéis de 1-2 mm. A remoção do endotélio foi realizada por atrito mecânico entre as paredes internas do vaso e uma haste de metal (COX et al., 1989). Os anéis livres de tecido conjuntivo e adiposo foram colocados num sistema de banho para órgãos isolados, em cubas contendo 10 mL de solução de Tyrode (TANAKA et al., 1999), a 37 ºC e gaseificadas com uma mistura carbogênica (95% de O2 e 5% de CO2) para prover um pH
relativamente constante de 7,2 - 7,4 (TEIXEIRA; PRIVIERO; WEBB, 2005) . Os anéis foram suspensos por linhas de algodão fixadas a um transdutor de força (MLT020, ADInstruments, Austrália), que estava acoplado a um sistema de aquisição (ML870/P com LabChart versão 7.0, ADInstruments, Austrália) para o registro das tensões isométricas (Figura 5). Cada anel foi submetido a uma tensão constante de 0,75 g por um período de estabilização de 60 minutos. Durante este tempo, o meio nutritivo (solução Tyrode) foi trocado a cada 15 minutos para prevenir a produção de metabólitos indesejáveis (ALTURA; ALTURA, 1970).
4.2 Protocolos experimentais utilizando anéis de artéria mesentérica superior isolada de rato
Para a realização de todos os protocolos experimentais, após um período de estabilização de 60 minutos, foi obtida uma contração com fenilefrina (FEN) 10 µM,
um agonista dos receptores α1 adrenérgicos (BYLUND, 1992; BÜSCHER et al.,
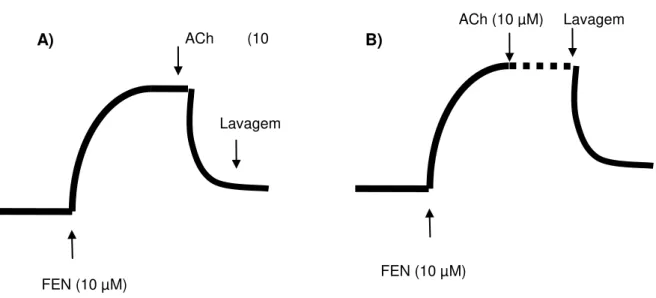
1999), com a finalidade de verificar a viabilidade do órgão. No componente tônico desta contração, foi adicionado um agonista não seletivo dos receptores muscarínicos, acetilcolina (ACh) 10 µM com o intuito de avaliar a integridade do endotélio vascular (FURCHGOTT; ZAWADZKI, 1980). Os anéis que apresentaram relaxamento superior a 90% sobre a pré-contração com FEN, foram considerados anéis com endotélio funcional (Figura 6A), já os anéis com relaxamentos inferiores a 10% foram considerados anéis sem endotélio vascular (Figura 6B) (TOLVANEN et al., 1998).
A) B)
Figura 6- Representação da verificação da viabilidade do órgão e da integridade do endotélio vascular. A) Presença do endotélio e B) Ausência do endotélio funcional
ACh (10 µM)
Lavagem
FEN (10 µM) FEN (10 µM)
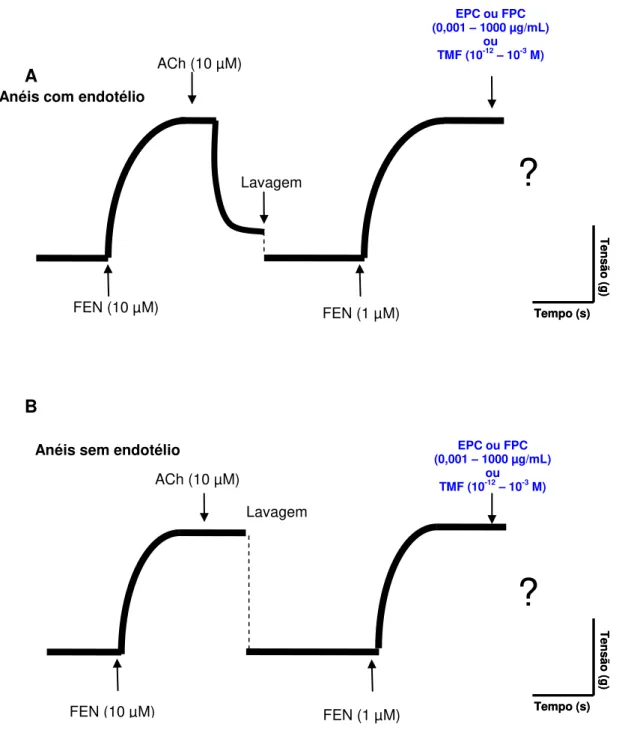
4.2.1 Verificação do efeito de EPC ou FPC ou TMF em anéis de artéria mesentérica isolada de rato pré-contraídos com FEN
Figura 7- Representação esquemática do protocolo experimental para avaliação dos efeitos de EPC (0,001 - 1000 µg/mL), FPC (0,001 - 1000 µg/mL) e TMF (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de rato, pré-contraídos com FEN (1 µM). A) Anéis com endotélio intacto; B) Anéis sem endotélio
A
B
FEN (10 µM)
ACh (10 µM)
EPC ou FPC
(0,001 – 1000µg/mL)
ou
TMF (10-12– 10-3 M)
FEN (1 µM) Lavagem
ACh (10 µM)
FEN (10 µM) FEN (1 µM)
EPC ou FPC
(0,001 – 1000µg/mL)
ou
TMF (10-12– 10-3 M)
Lavagem
Anéis sem endotélio Anéis com endotélio
4.2.2 Comparação do efeito de TMF e quercetina em anéis de artéria mesentérica isolada de rato pré-contraídos com FEN
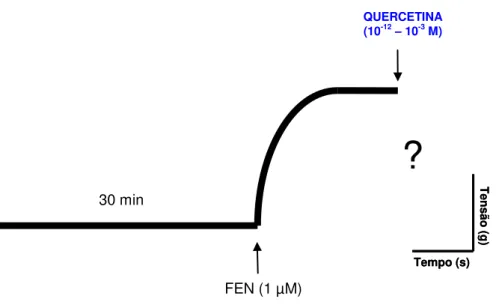
Após a verificação da presença do endotélio, seguida de um processo de estabilização, aproximadamente 30 minutos, foi induzida uma segunda contração de FEN (1 M). No componente tônico desta segunda contração, concentrações crescentes de quercetina (10-12 – 10-3 M), o flavonóide mais abundante nas plantas e mais estudado pela literatura científica (PEREZ-VIZCAINO et al., 2010), foram adicionadas à preparação, de maneira cumulativa, para a obtenção de uma curva concentração-resposta (Figura 8). A resposta foi expressa como porcentagem de relaxamento em relação à contração produzida pela FEN. A potência e eficácia do vasorrelaxamento da substância foram avaliadas por meio dos valores de pD2 e
Emáx, respectivamente.
Figura 8- Representação esquemática do protocolo experimental para avaliação dos efeitos de quercetina (10-12 – 10-3 M) em anéis de artéria mesentérica superior isolada de rato, com endotélio intacto, pré-contraídos com FEN (1 µM).
30 min
FEN (1 µM)
QUERCETINA
(10-12– 10-3 M)
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
4.2.3 Investigação do mecanismo vasorrelaxante de TMF em anéis de artéria mesentérica com endotélio vascular
4.2.3.1 Verificação da participação dos metabólitos da via do ácido araquidônico no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato
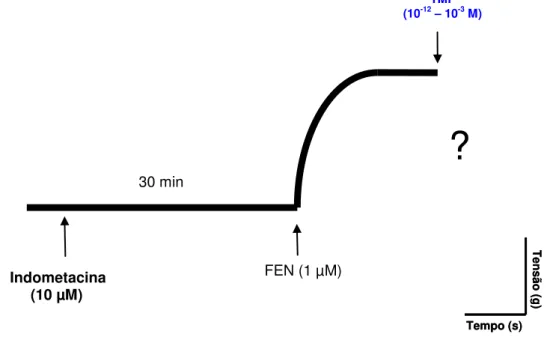
Após a verificação da integridade do endotélio vascular, as preparações foram previamente incubadas com indometacina (10 µM), um inibidor não seletivo da enzima ciclooxigenase (COX) (CLARK; FUCHS, 1997). Após 30 minutos induziu-se uma contração com FEN (1 µM) e na fase tônica desta contração adicionou-se à cuba TMF (10-12 – 10-3 M) cumulativamente (Figura 9). A potência e a eficácia vasorrelaxante do TMF foram avaliadas por meio de comparação dos valores de pD2
e Emáx, respectivamente, na presença e na ausência de indometacina.
Figura 9- Representação esquemática do protocolo experimental para avaliação da participação dos metabólitos do ácido araquidônico no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM).
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
Indometacina (10 µM)
30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)
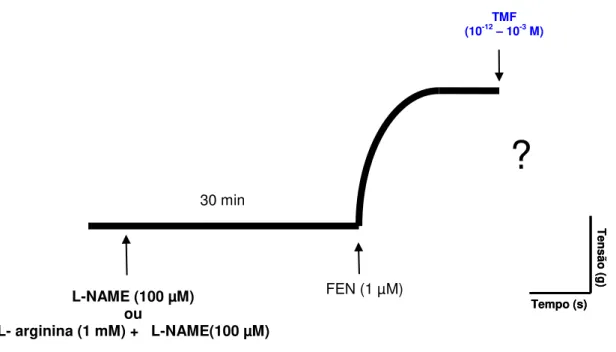
4.2.3.2 Verificação da participação da NOS no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato
Após a verificação da presença do endotélio vascular, as preparações foram pré-incubadas separadamente com L-NAME (100 µM), um inibidor competitivo da enzima NOS, e L-arginina (1 mM), um substrato para a NOS, mais o L-NAME (100 µM) (MONCADA; PALMER; HIGGS, 1993). Após trinta minutos de incubação induziu-se uma contração com FEN (1 µM), na fase tônica e sustentada desta contração adicionou-se cumulativamente TMF (10-12 – 10-3 M) para obtenção de uma curva concentração-resposta. As respostas obtidas foram comparadas com a curva controle (Figura 10). A potência e a eficácia vasorrelaxante do TMF foram avaliadas por meio dos valores de pD2 e Emáx, respectivamente, na presença e na ausência de
L-NAME ou L-arginina + L-NAME .
Figura 10- Representação esquemática do protocolo experimental para avaliação da participação da NOS no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM).
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
L-NAME (100 µM) ou
L- arginina (1 mM) + L-NAME(100 µM) 30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)
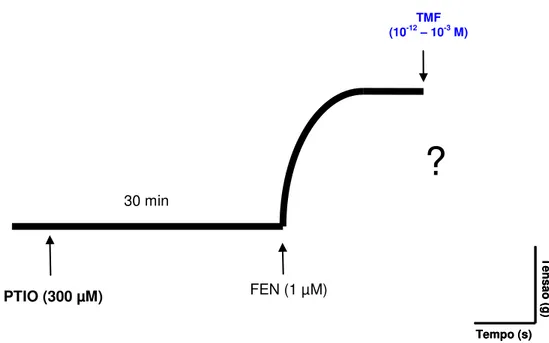
4.2.3.3 Verificação do envolvimento do óxido nítrico no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato
Após a observação da integridade do endotélio vascular, as preparações foram pré-incubadas com PTIO (300 µM), um seqüestrador de NO (IKEDA et al., 1997). Após 30 minutos, as preparações foram submetidas a uma segunda contração com FEN (1 µM) e no componente tônico desta contração, adicionava-se TMF (10-12 – 10-3 M) cumulativamente (Figura 11). A potência e a eficácia do efeito vasorrelaxante do TMF foram avaliadas por meio de comparação dos valores de pD2
e Emáx, respectivamente, na presença ou na ausência PTIO.
Figura 11- Representação esquemática do protocolo experimental para avaliação do envolvimento do NO no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM).
PTIO (300 µM)
30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
4.2.3.4 Verificação da participação da CGs no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato
Após a observação da integridade do endotélio vascular, as preparações foram pré-incubadas com ODQ (10 µM), um inibidor específico da CGS (CERONI, 2007). Decorridos 30 minutos, as preparações foram submetidas a uma segunda contração com FEN (1 µM) e no componente tônico desta contração adcionou-se TMF (10-12 – 10-3 M) cumulativamente (Figura 12). A potência e a eficácia vasorrelaxante do TMF foram avaliadas por meio de comparação dos valores de pD2
e Emáx, respectivamente, na presença e na ausência de ODQ.
Figura 12- Representação esquemática do protocolo experimental para avaliação da participação da CGs efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM).
4.2.3.5 Verificação da participação de canais para potássio (K+) no efeito induzido por TMF em anéis de artéria mesentérica isolada de rato
Para avaliar a participação dos canais para K+ no efeito induzido pelo TMF, utilizou-se uma solução Tyrode modificada com 20 mM de KCl. Isto porque 20 mM
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
ODQ (10 µM)
30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)
de K+ externo são suficientes para impedir parcialmente o efluxo de K+, e atenuar
vasorrelaxamentos mediados pela abertura de canais de K+ (CAMPBELL; HARDER,
1996; CLARK; FUCHS, 1997). E com o mesmo propósito, utilizou-se a ferramenta farmacológica TEA (3 mM), que nesta concentração atua como um bloqueador inespecífico de canais para K+ (ROCHA; BENDHACK, 2009; SILVA et al., 2011).
Após a verificação da presença do endotélio funcional, como descrito no item 4.1.2, a solução de Tyrode foi trocada por uma solução despolarizante de Tyrode com 20 mM de KCl ou foi adicionado o bloqueador (TEA 3 mM). Após 30 minutos foi induzida uma nova contração com FEN (1 M) e, em seguida, uma curva concentração-resposta cumulativa para TMF (10-12– 10-3 M) foi obtida (Figura 13). A potência e eficácia do vasorrelaxamento de TMF foram avaliadas por meio dos valores de pD2 e Emáx, respectivamente.
Figura 13- Representação esquemática do protocolo experimental para avaliação da participação dos canais para K+ no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM).
KCl 20 mM ou TEA (3 mM)
30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
4.2.3.6 Verificação da participação dos subtipos de canais para K+ no efeito induzido por TMF em anéis de artéria mesentérica isolada de rato
Após a verificação da presença do endotélio funcional, as preparações foram incubadas separadamente com 10 M de glibenclamida, um bloqueador seletivo de canais para K+ sensíveis ao ATP (KATP) (OHRNBERGER; KHAN; MEISHERI, 1993;
FAROUQUE; OMAR; MEREDITH, 2003); 1 mM de 4-AP, um bloqueador seletivo de canais para K+ sensíveis a voltagem (Kv) (BERG, 2002); e 1 mM de TEA, que nesta concentração atua como um bloqueador dos canais para K+ sensíveis a cálcio de grande condutância (BKca) (WHITE et al., 2002; SILVA et al., 2011). Após 30
minutos, foi induzida uma nova contração tônica com FEN (1 M) e, em seguida, uma curva concentração-resposta para o TMF (10-12 – 10-3 M) foi obtida (Figura 14). A potência e eficácia do vasorrelaxamento de TMF foram avaliadas por meio dos valores de pD2 e Emáx, respectivamente.
Figura 14- Representação esquemática do protocolo experimental para avaliação dos subtipos de canais para potássio no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato com endotélio funcional, pré-contraídos com FEN (1 µM).
GLIB (10 M) ou 4- AP (1 mM) ou TEA (1 mM)
30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
4.2.4 Investigação do mecanismo vasorrelaxante de TMF em anéis de artéria mesentérica sem endotélio vascular
4.2.4.1 Verificação da ativação dos canais para K+ no efeito induzido pelo TMF em anéis de artéria mesentérica isolada de rato
Com o intuito de evidenciar se o flavonoide em estudo induz relaxamento por ativação direta de canais para K+ na célula muscular lisa vascular, utilizou-se uma solução Tyrode modificada com 20 mM de KCl, condição que promove o bloquei parcial do efluxo de K+ , atenuando os vasorrelaxamentos mediados pela abertura de canais de K+ (CAMPBELL; HARDER, 1996; CLARK; FUCHS, 1997). E com o mesmo propósito, utilizou-se a ferramenta farmacológica TEA (3 mM), que nesta concentração atua como um bloqueador inespecífico de canais para K+ (ROCHA et al., 2009).
Após a verificação da ausência do endotélio funcional, como descrito no item 4.1.2, a solução de Tyrode foi trocada por uma solução despolarizante de Tyrode com 20 mM de KCl ou foi adicionado o bloqueador (TEA 3 mM). Após 30 minutos foi induzida uma nova contração com FEN (1 M) e, em seguida, uma curva concentração-resposta cumulativa para TMF (10-12– 10-3 M) foi obtida (Figura 15). A
Figura 15- Representação esquemática do protocolo experimental para avaliação da ativação direta dos canais para K+ no efeito induzido por TMF em anéis de artéria mesentérica superior isolada de rato sem endotélio funcional, pré-contraídos com FEN (1 µM).
4.2.4.2 Verificação do efeito de TMF em anéis de artéria mesentérica superior isolada de rato pré-contraídos com solução despolarizante de 60 mM de KCl
Para investigar a resposta vasorrelaxante de TMF sobre a contração induzida por um agente contracturante eletroquímico, foi utilizado uma solução com 60 mM de KCl, que promove uma despolarização da membrana plasmática, levando à ativação dos canais para Ca2+ dependentes de voltagem (CaV) e,
consequentemente, à contração do músculo liso vascular (CHEN; REMBOLD, 1995; KRAVTSOV et al., 2003; OLIVEIRA et al., 2006).
Após a verificação da remoção do endotélio funcional (ver 4.1.2), e um período de estabilização de aproximadamente 30 minutos, a solução de Tyrode normal foi substituída por uma solução de Tyrode com 60 mM de KCl. No componente tônico da contração promovida por este agente, foram adicionadas concentrações crescentes de TMF (10-12 – 10-3 M) de maneira cumulativa, para
obtenção de uma curva concentração-resposta (Figura 16). A potência e eficácia do vasorrelaxamento de TMF foram avaliadas por meio dos valores de pD2 e Emáx,
respectivamente.
Tensã
o (
g)
Tempo (s)
Tensã
o (
g)
Tempo (s)
KCl 20 mM ou TEA (3 mM)
30 min
FEN (1 µM)
TMF
(10-12– 10-3 M)