UNIVERSIDADE TÉCNICA DE LISBOA
Faculdade de Medicina Veterinária
RELEVÂNCIA DA DETERMINAÇÃO DE PROTEÍNA C REACTIVA EM CIRURGIA –
ESTUDO PRELIMINAR NO CÃO
CATARINA CORREIA AFONSO ARCHER
CONSTITUIÇÃO DO JÚRI
ORIENTADORA
Professor Doutor Carlos Martins
Dra. Maria João Dinis da Fonseca
Professora Doutora Cristina Lobo Vilela
Professor Doutor José Limão Oliveira
CO-ORIENTADORA
Dra. Maria João Dinis da Fonseca
Professora Doutora Cristina Lobo Vilela
2008 LISBOA
UNIVERSIDADE TÉCNICA DE LISBOA
Faculdade de Medicina Veterinária
RELEVÂNCIA DA DETERMINAÇÃO DE PROTEÍNA C REACTIVA EM CIRURGIA –
ESTUDO PRELIMINAR NO CÃO
CATARINA CORREIA AFONSO ARCHER
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
CONSTITUIÇÃO DO JÚRI
ORIENTADORA
Professor Doutor Carlos Martins
Dra. Maria João Dinis da Fonseca
Professora Doutora Cristina Lobo Vilela
Professor Doutor José Limão Oliveira
CO-ORIENTADORA
Dra. Maria João Fonseca
Professora Doutora Cristina Lobo Vilela
2008 LISBOA
Agradecimentos
Ao terminar este estágio curricular, gostaria de começar por agradecer aos que me incentivaram e apoiaram ao longo destes seis meses e foram determinantes para manter o ânimo e entusiasmo necessários à sua conclusão.
Começaria pelas minhas orientadoras, Dra. Maria João Fonseca e Professora Doutora Cristina Vilela por todo o apoio e paciência manifestadas no acompanhamento, execução e revisão desta tese, sobretudo naqueles momentos em que o trabalho parecia não ter continuação nem saída.
Igualmente a todo o corpo clínico do Hospital Veterinário do Restelo – Dr. Jorge Cid, Dra. Elisabete Capitão, Dra. Paula Santos, Dra. Rita Bonhorst, Dra. Marina Coelho, Dra. Maria Andrade, Dra. Rita Figueiredo, Dr. Joel Silva, Dr. Miguel Ramos, Dra. Ana Valença, Dr. Marco Simões, Dr. Hugo Pereira, Dr. Miguel Malheiro, Dr. Nuno Leite, Dra. Diogo Magno, Dra. Marta Cipriano, Dra. Joana Crisóstomo e Dr. Ribeiro Alves – o meu obrigada pela confiança, disponibilidade e paciência demonstradas durante todo o período de estágio e sem os quais a realização dos estudos clínicos não teria sido possível. Este agradecimento é igualmente extensível às auxiliares do Hospital.
À Dra. Ângela Xufre por toda a disponibilidade e empenho na realização dos protocolos laboratoriais para a determinação da proteína C reactiva.
E por último uma palavra especial à minha família e aos meus amigos por manterem inabalável o seu suporte desde o início do meu percurso académico.
Não posso deixar igualmente de referir e agradecer aos que com o seu prestimoso apoio financeiro foram determinantes para a escolha, realização e conclusão desta tese, agradecendo especialmente a:
• Hospital Veterinário do Restelo; • Laboratório DNAtech;
• Sanifauna – Produtos Veterinários; • Royal Canin
Resumo
A expressão “resposta de fase aguda” refere-se a uma resposta inflamatória do organismo a qualquer alteração tissular. O objectivo desta resposta é a prevenção do desenvolvimento de mais lesões, limitar o crescimento de microorganismos, remover moléculas prejudiciais e activar determinados mecanismos para que o organismo possa retomar a homeostase. Esta resposta caracteriza-se por sinais inflamatórios sistémicos, resultantes de alterações endócrinas, hematológicas, imunológicas, metabólicas e neurológicas e por uma alteração das concentrações de algumas proteínas sintetizadas pelo fígado, denominadas proteínas de fase aguda. Na espécie canídea, entre os diferentes tipos de proteínas de fase agudas existentes, a proteína C reactiva é a que apresenta maior significado.
A proteína C reactiva foi a primeira proteína de fase aguda a ser caracterizada ao verificar-se a sua capacidade de verificar-se ligar ao polissacarídeo C das bactérias Gram+. Pertence à família das pentraxinas, uma vez que apresenta uma estrutura pentamérica. A sua síntese ocorre no fígado como resposta à libertação de mediadores locais de inflamação, atingindo um pico às 24-48 horas após um estímulo inflamatório. As suas principais funções são a fixação a ligandos, tais como fosfocolina, lecitina e esfingomielina, activação da via clássica do complemento, da fagocitose, contribuindo para a eliminação de detritos celulares e protecção contra infecções, protecção de vasos e acção anti-neoplásica. Existem diversos métodos para a sua detecção, sendo a imunoturbidimetria, ELISA e a imunocromatografia, os métodos disponíveis para a prática clínica. A idade, a gestação e a administração de fármacos podem levar a alterações na sua concentração.
Os dois estudos clínicos efectuados confirmaram (i) a ausência de reacções cruzadas entre a proteína C reactiva canina e a sua homóloga humana e (ii) que as concentrações de proteína C reactiva aumentam após uma intervenção cirúrgica de acordo com a intensidade do trauma cirúrgico. Embora a determinação de proteína C reactiva não se tenha revelado de grande utilidade na prática clínica quando determinada 24 horas após a cirurgia, é necessário realizar estudos cinéticos a tempos mais alargados para averiguar a sua relevância.
Uma vez que as concentrações de proteína C reactiva se encontram aumentadas na presença de infecção, lesão tissular, trauma, cirurgia, neoplasia ou alterações inflamatórias, a sua determinação pode ser útil na avaliação da presença, extensão e gravidade de certas alterações orgânicas, contribuindo para o diagnóstico diferencial, para a verificação da eficácia de um tratamento, e com propósitos de prognóstico, uma vez que a duração e magnitude da resposta reflecte a gravidade da doença.
Abstract
The expression of “acute phase response” refers to an inflammatory response of the organism to any tissue alteration. The purpose of this response is to prevent the further development of lesions, to limit the microorganism’s increase, to remove harmful molecules and to specific mechanisms that allow the organism to return to homeostasis. This response is characterized by inflammatory signs following endocrinous, hematologic, immunologic, metabolic and neurologic changes and by a modification of some liver proteins concentration, the acute phase proteins. In the dog, C-reactive protein is the most significant protein amongst the different types of existing acute phase proteins.
C-reactive protein was the first acute phase protein to be characterized when testing its binding ability to C polysaccharide of Gram+ bacteria. It belongs to the pentraxin family, because of its pentameric structure. It is synthesized in the liver, triggered by local inflammatory mediators, reaching a peak at 24-48 hours after an inflammatory stimulus. Its main functions are binding to ligands, such as phosphocoline, lecithin and sphingomyelin, activation of the classic pathway of the complement and of phagocytosis, through contributing to cellular debris elimination, protection against infections, vascular protection and anti-neoplastic action. There are several methods available for its detection, being immunoturbidimetry, ELISA and immunocromatography the more frequently used. Individual differences in age, pregnancy and ongoing medication may lead to concentration changes. The two clinical studies confirmed (i) the absence of crossed reactivity between canine C-reactive protein and the human homologous and (ii) that serum concentration increases after surgery according to the severity of the surgery trauma. Although it was not possible to show a clinical relevance for the C-reactive protein determination 24 hours after surgery, kinetic studies should be performed in order to better evaluate its importance.
Since its concentrations increase in cases of infection, tissue damage, trauma, surgery, neoplastic growth or inflammatory disorders, the quantification of C-reactive protein may be helpful to detect and evaluate the extension and severity of certain changes, contributing to the differential diagnosis and to fundament a prognosis, as the duration and magnitude of the response reflects the illness severity.
ÍNDICE GERAL Agradecimentos... i Resumo... ii Abstract ...iii Índice geral... iv Índice de tabelas... vi Índice de figuras ... vi
Índice de gráficos ...vii
Índice de abreviaturas e símbolos ...viii
Introdução ... 1
Descrição das actividades de estágio ... 3
1. Casuística observada... 3
1.1. Casuística observada na área da clínica médica ... 3
1.2. Casuística observada nos meios complementares de diagnóstico... 5
1.3. Casuística observada na área da clínica cirúrgica ... 6
Monografia. ... 8
1. Resposta de fase aguda ... 8
2. Proteínas de fase aguda... 9
3. Proteína C Reactiva ... 11 3.1. História de PCR... 11 3.2. Estrutura e caracterização de PCR ... 11 3.3. Síntese de PCR... 12 3.3.1. Mediadores de inflamação... 13 3.3.2. Síntese hepática de PCR... 15
3.4. Proteína C reactiva em diferentes espécies animais ... 16
3.5. Antigenicidade de PCR ... 17
3.6. Função de PCR ... 18
3.6.1. Fixação a ligandos ... 18
3.6.2. Activação da via clássica do sistema do complemento ... 19
3.6.3. Fagocitose ... 20
3.6.4. Eliminação de detritos celulares ... 20
3.6.5. Protecção contra infecções... 21
3.6.6. Protecção dos vasos... 21
3.6.7. Acção anti-neoplásica... 21 3.7. Detecção de PCR... 22 3.7.1. Imunodifusão ... 23 3.7.2. Electro-imuno-ensaio ... 23 3.7.3. ELISA... 23 3.7.4. Imunoturbidimetria ... 24
3.7.5. CRPLA ... 24
3.7.6. Imunocromatografia ... 24
3.8. Comparação com outros marcadores de inflamação... 24
3.9. Variações biológicas de PCR ... 25 3.9.1 Valores normais ... 25 3.9.2. Variações fisiológicas ... 26 3.9.2.1. Idade ... 26 3.9.2.2. Género ... 26 3.9.2.3. Ritmo circadiano... 27 3.9.2.4. Gestação ... 27 3.9.2.5. Tipo de vida... 28
3.9.2.6. Influência dos medicamentos... 28
3.10. Variações patológicas de PCR... 29
3.11. PCR como parâmetro laboratorial ... 31
4. Ausência de reacção cruzada entre PCR canina e PCR humana ... 34
4.1 Introdução... 34
4.2 Materiais e métodos ... 35
4.2.1. Animais ... 35
4.2.2. Análises hematológicas ... 37
4.2.3. Recolha de amostras para quantificação de PCR ... 37
4.2.4. Técnica de análise ... 38
4.3. Resultados... 38
4.3.1. Análises hematológicas ... 38
4.3.2. Valores da proteína C reactiva ... 39
4.4. Discussão ... 40
5. Alterações da proteína C reactiva sérica em cães sujeitos a intervenções cirúrgicas ... 42
5.1. Introdução... 42
5.2. Materiais e métodos ... 43
5.2.1. Animais ... 43
5.2.2. Análises hematológicas ... 45
5.2.3. Recolha de amostras para quantificação de PCR ... 45
5.2.4. Técnica de análise ... 45
5.3. Resultados... 46
5.3.1. Análises hematológicas ... 46
5.3.2. Valores da proteína C reactiva ... 47
5.4. Discussão ... 49 Conclusão ... 53 Bibliografia ... 55 Anexo 1... 63 Anexo 2... 74 Anexo 3... 75 Anexo 4... 76 Anexo 5... 81 Anexo 6... 82
Índice de tabelas
Tabela 1: Clínica médica – percentagem relativa das espécies animais observadas ... 3
Tabela 2: Clínica médica – percentagem relativa do género das espécies canina e felina.... 3
Tabela 3: Clínica médica - percentagem relativa dos animais exóticos observados ... 4
Tabela 4: Clínica médica - percentagem relativa das consultas observadas ... 4
Tabela 5: Percentagem relativa das consultas observadas na área da patologia clínica... 4
Tabela 6: Percentagem relativa das consultas de imunoprofilaxia ... 5
Tabela 7: Percentagem relativa das consultas de tratamento e reavaliação... 5
Tabela 8: Percentagem relativa dos meios complementares de diagnóstico observados... 6
Tabela 9: Percentagem relativa dos diferentes tipos de cirurgias observados ... 6
Tabela 10: Percentagem relativa das pequenas cirurgias ... 7
Tabela 11: Percentagem relativa das cirurgias de tecidos moles ... 7
Tabela 12: Características e valores da proteína C Reactiva em diferentes espécies animais ... 17
Tabela 13: Valores da proteína C reactiva em 304 cães saudáveis, de diferentes raças, em função do género... 27
Tabela 14: Género, idade, raça, tipo de cirurgia e outras alterações dos animais utilizados para o estudo clínico... 36
Tabela 15: Género, idade, raça, tipo de cirurgia e outras alterações dos animais utilizados para o estudo clínico... 43
Tabela 16: Relação das concentrações séricas de PCR com as análises hematológicas e bioquímicas para cada animal sujeito a uma intervenção cirúrgica. ... 48
Tabela 17: Valores do hemograma e bioquímicas de rotina referentes aos animais do primeiro estudo clínico... 74
Tabela 18: Concentrações séricas da proteína C reactiva nos animais do 1º estudo clínico75 Tabela 19: Valores do hemograma e bioquímicas de rotina referentes aos animais do segundo estudo clínico. ... 81
Tabela 20: Concentrações séricas da proteína C reactiva nos animais do 2º estudo clínico82 Índice de figuras Figura 1: Características padrão de alterações nas concentrações de algumas proteínas de fase aguda, depois de um estímulo inflamatório ... 10
Figura 2: Activação do sistema do complemento pela via clássica pela proteína C reactiva... ... 20
Figura 3: representação esquemática da reacção de antigenicidade entre os anticorpos anti-PCR humana e a anti-PCR canina ... 35
Índice de gráficos
Gráfico 1: Valores obtidos no hemograma realizados nos animais em estudo... 38
Gráfico 2: Valores obtidos nas bioquímicas realizadas nos animais em estudo... 39
Gráfico 3: Variação da concentração de PCR no animal 1 ... 39
Gráfico 4: Variação da concentração de PCR no animal 2 ... 39
Gráfico 5: Variação da concentração de PCR no animal 3 ... 39
Gráfico 6: Variação da concentração de PCR no animal 4 ... 39
Gráfico 7: Variação da concentração de PCR no animal 5 ... 39
Gráfico 8: Variação da concentração de PCR no animal 6 ... 39
Gráfico 9: Variação da concentração de PCR no animal 7 ... 39
Gráfico 10: Variação da concentração de PCR no animal 8 ... 39
Gráfico 11: Variação da concentração de PCR no animal 9 ... 39
Gráfico 12: Variação da concentração de PCR no animal 10 ... 40
Gráfico 13: Variação da concentração de PCR no animal 11 ... 40
Gráfico 14: Variação da concentração de PCR no animal 12 ... 40
Gráfico 15: Variação da concentração de PCR no animal 13 ... 40
Gráfico 16: Variação da concentração de PCR no animal 14 ... 40
Gráfico 17: Variação da concentração de PCR no animal 15 ... 40
Gráfico 18: Valores obtidos no hemograma realizado nos animais em estudo ... 46
Gráfico 19: Valores obtidos nas bioquímicas realizadas nos animais em estudo... 46
Gráfico 20: Variações de PCR antes (T0) e 24 horas depois da cirurgia (T1) nos animais em estudo ... 47
Índice de abreviaturas e símbolos
HVR Hospital Veterinário do Restelo
% percentagem
PAAF punção aspirativa com agulha fina LDL lipoproteína de baixa densidade HDL lipoproteína de alta densidade ACTH hormona adrenocorticotrópica µg/ml micrograma por mililitro
SDS-PAGE electroforese em gel de poliacrilamida com dodecil sulfato de sódio (sodium dodecyl sulphate-poly acrylamide gel electrophoresis)
IL interleuquina
Phe fenilalanina Glu ácido glutâmico
C1q subcomponente do componente 1
FcγR receptor Fcγ (fragment cristallizable gamma receptor) PCR proteína C reactiva
Asp ácido aspartamico
Tyr tirosina
PAS ácido periódico-Schiff pH potencial hidrogeniónico TNF factor de necrose tumoral
IFN interferon
PFA proteína de fase aguda µg/kg micrograma por quilograma
gp glicoproteína
RNA ácido ribonucleico
STAT sinal transductor e activador de transcrição (signal transducer and activator of transcription )
C/EBP CCAAT/enhancer binding protein Rel-NFκB ren/nuclear factor-κB
LPS lipopolissacarídeo
ELISA enzyme linked immunosorbent assay IgG imunoglobulina G
ITAM immunoreceptor tyrosine-based activation motif ITIM immunoreceptor tyrosine-based inhibition motif
ºC graus Celsius
CRPLA capillary reversed passive latex aglutination
nm nanometro
mg/L miligrama por litro
µm micrómetro
ml mililitro
SIRS síndrome de resposta inflamatória sistémica ALB albumina
SAA proteína amilóide A sérica
HP haptoglobina
CP ceruloplasmina
OVH ovariohisterectomia L6-L7 6ª e 7ª vértebra lombar
µL microlitro
cg/dl centigrama por decilitro mg/dl miligrama por decilitro ALP fosfatase alcalina ALT alanina transaminase
UI/L unidades internacionais por litro dg/dl decigrama por decilitro
CE corpo estranho
GB glóbulos brancos GV glóbulos vermelhos PLA plaquetas
BUN ureia nitrogenada sanguínea (blood urea nitrogen) CREA creatinina
PT proteínas totais GLU glucose
IR insuficiência renal AH alterações hepáticas
Introdução
De acordo com o novo processo de Bolonha, para terminar o curso com o Mestrado Integrado em Medicina Veterinária, é necessário a realização de um estágio curricular e de uma dissertação sobre um tema específico.
Realizei o estágio no Hospital Veterinário do Restelo, na área de clínica e de cirurgia de animais de companhia, sob a orientação científica da Dra. Maria João Fonseca. Os seus objectivos principais foram a aplicação prática dos conhecimentos adquiridos ao longo do curso e a aquisição de novos conhecimentos, preparando-me para a vida profissional. No Hospital do Restelo foi-me atribuído um horário rotativo diário, que abrangia períodos diurnos, nocturnos, fins-de-semana e feriados, de modo a possibilitar o acompanhamento de todo o tipo de situações clínicas, incluindo urgências médicas e cirúrgicas. Durante os diferentes horários, participei em três actividades distintas: consultas, cirurgia e internamento. Nas consultas, que incluíram diferentes especialidades, acompanhei o médico veterinário na realização da história pregressa, do exame clínico e de provas diagnósticas, de forma a chegar a um diagnóstico. Ao longo do período de estágio, foi-me possível realizar todas estas etapas comunicando, depois, ao médico veterinário as informações recolhidas. O internamento, que se encontra dividido em internamento de cães, gatos, exóticos e animais com doenças infecto-contagiosas, foi o local onde pude acompanhar mais de perto cada caso, monitorizando cada animal, administrando a medicação necessária e realizando os exames complementares necessários. Por último, na área de cirurgia, tive a oportunidade de fazer o acompanhamento pré-cirúrgico, cirúrgico ou pós-cirúrgico de cada paciente. Para isso, realizei exames pré-pós-cirúrgicos e pré-anestésicos, administração da pré-medicação e da anestesia, monitorização anestésica, auxílio durante a cirurgia e acompanhamento do animal no período pós-cirúrgico. Os exames complementares de diagnóstico são comuns às três actividades e incluem radiografia, ecografia, análises clínicas, electrocardiograma, entre outros.
Durante o período de estágio foi-me possível contactar com diferentes situações clínicas, tendo tido a oportunidade de participar nas variadas e numerosas actividades que envolvem a medicina veterinária, e tendo ainda apresentado diversos trabalhos, entre os quais uma revisão dos conhecimentos actuais sobre a aplicação prática da determinação dos valores de proteína C reactiva em intervenções cirúrgicas; esta apresentação suscitou-me a ideia e a curiosidade de aprofundar os conhecimentos desta proteína e sua relevância em medicina veterinária, uma vez que a mesma tem grande importância em medicina humana.
Assim decidi escolher para tema da minha monografia de mestrado integrado: “Relevância da determinação de proteína C reactiva em cirurgia – estudo preliminar no cão”.
A presente dissertação está dividida em duas partes. Inicialmente é apresentado um resumo da casuística observada durante o período de estágio, que decorreu de 3 de Setembro de 2007 a 29 de Fevereiro de 2008, excedendo largamente as 500 horas previstas no regulamento. A segunda parte inclui uma monografia sobre a proteína C reactiva que tem por objectivo realizar um estudo aprofundado sobre o comportamento da proteína C reactiva em situações cirúrgicas, de forma a melhor compreender e avaliar a relevância da sua quantificação em medicina veterinária. Esta parte está, por sua vez, dividida em dois capítulos. O primeiro compreende uma revisão bibliográfica, onde são descritas as características gerais, funções e aplicações da quantificação desta proteína na espécie canina. O segundo corresponde à realização de uma avaliação preliminar da relevância da informação que se pode retirar da quantificação de proteína C reactiva em animais submetidos a diferentes tipos de intervenções cirúrgicas, seguidas durante o período de estágio.
Descrição das actividades de estágio
1. Casuística observada
A apresentação estatística da actividade clínica desenvolvida encontra-se dividida em três áreas: clínica médica, meios complementares de diagnóstico e clínica cirúrgica. Em cada uma destas secções será apresentada a respectiva casuística, sob a forma de análise percentual.
1.1. Casuística observada na área da clínica médica
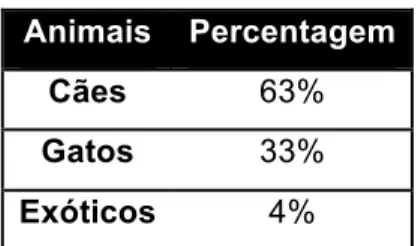
De entre os animais que compareceram às consultas, a espécie canina foi a que apresentou maior prevalência, seguida da felina e dos animais exóticos (Tabela 1).
Tabela 1: Clínica médica – percentagem relativa das espécies animais observadas
Animais Percentagem
Cães 63%
Gatos 33%
Exóticos 4%
Tanto na espécie canídea, como na felina, foram observados mais machos do que fêmeas (Tabela 2). Nos animais exóticos destacam-se os lagomorfos relativamente às aves (papagaio, caturras e periquitos), aos roedores (hamsters, chinchilas e porcos da índia) e aos répteis (tartarugas) (Tabela 3).
Tabela 2: Clínica médica – percentagem relativa do género das espécies canina e felina
Animais Género Percentagem
Cães Machos 56%
Fêmeas 44%
Gatos Machos 55%
Tabela 3: Clínica médica - percentagem relativa dos animais exóticos observados Animais Percentagem Lagomorfos 41% Aves 27% Roedores 27% Répteis 5%
Durante o estágio, assistimos a diferentes tipos de consultas, que se dividiram em consultas de patologia clínica, imunoprofilaxia e outras intervenções que incluem tratamentos e reavaliações (Tabela 4). Como seria de esperar, a patologia clínica concentrou a maior parte dos animais que se apresentaram à consulta, uma vez que o HVR (Hospital Veterinário do Restelo) é uma referência em diversas especialidades clínicas. Deve-se ter em conta que há animais que se apresentaram aos três tipos de consultas.
Tabela 4: Clínica médica - percentagem relativa das consultas observadas
Consultas Percentagem
Patologia clínica 70%
Tratamento/reavaliação 21%
Imunoprofilaxia 9%
Dentro da patologia clínica (Tabela 5) existem diferentes especialidades, onde as mais acompanhadas na espécie canídea foram as de gastrenterologia e, na espécie felina as de nefrologia e urologia. É de salientar que cada animal pode apresentar mais do que uma patologia, sendo por isso observado em mais do que uma especialidade.
Tabela 5: Percentagem relativa das consultas observadas na área da patologia clínica
Patologia clínica Percentagem Patologia clínica Percentagem
Gastrenterologia 18% Reprodução 5% Nefrologia/urologia 14% Neurologia 4% Dermatologia 12% Endocrinologia 4% Hematologia/Infecciosas 10% Toxicologia 4% Cardiologia 8% Oftalmologia 3% Pneumologia 8% Estomatologia 2% Oncologia 6% Outros 2%
A medicina preventiva constitui uma importante área de actuação na clínica de animais de companhia por combater a dispersão de agentes infecciosos. As consultas de imunoprofilaxia foram observadas em todos os tipos de animais, com maior incidência na espécie canídea (Tabela 6). Dentro do grupo dos animais exóticos só se observaram vacinas nos lagomorfos.
Tabela 6: Percentagem relativa das consultas de imunoprofilaxia
Animais Percentagem
Cães 66%
Gatos 29%
Lagomorfos 5%
As consultas de tratamento e reavaliação (Tabela 7) incluíram a revisão ou tratamento dos animais após intervenções cirúrgicas ou consultas prévias. Neste grupo também se incluem algumas intervenções que não foram realizadas durante a consulta propriamente dita, mas que estão relacionadas com ela, como por exemplo as necrópsias, transfusões e eutanásias.
Tabela 7: Percentagem relativa das consultas de tratamento e reavaliação
Tipo de intervenção Percentagem
Pensos 43% Remoção de pontos/agrafos 16% Algaliação 10% Fluidoterapia subcutânea 10% Eutanásia 10% Necrópsia 6% Transfusão 5%
1.2. Casuística observada nos meios complementares de diagnóstico
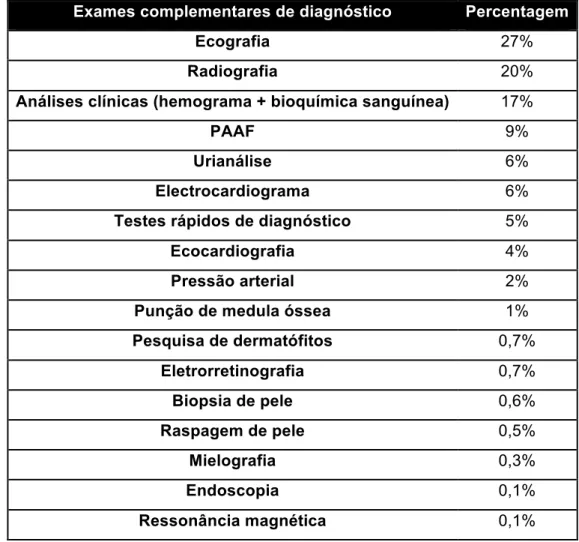
Os exames complementares são muitas vezes imprescindíveis para o estabelecimento de um diagnóstico definitivo e para a monitorização de um paciente em tratamento. A tabela 8 apresenta um resumo dos exames complementares realizados durante o período de estágio. Embora grande parte dos meios de diagnósticos sejam realizados no hospital, algumas análises ou procedimentos têm de ser enviados para laboratórios especializados
que trabalham em colaboração com o mesmo. Deve ter-se em conta que o mesmo animal pode ser sujeito a diferentes exames complementares de diagnóstico.
Tabela 8: Percentagem relativa dos meios complementares de diagnóstico observados
Exames complementares de diagnóstico Percentagem
Ecografia 27%
Radiografia 20%
Análises clínicas (hemograma + bioquímica sanguínea) 17%
PAAF 9%
Urianálise 6%
Electrocardiograma 6%
Testes rápidos de diagnóstico 5%
Ecocardiografia 4%
Pressão arterial 2%
Punção de medula óssea 1%
Pesquisa de dermatófitos 0,7% Eletrorretinografia 0,7% Biopsia de pele 0,6% Raspagem de pele 0,5% Mielografia 0,3% Endoscopia 0,1% Ressonância magnética 0,1%
1.3. Casuística observada na área da clínica cirúrgica
A área de cirurgia inclui três tipos de intervenções (Tabela 9): pequenas cirurgias, cirurgia de tecidos moles e cirurgia ortopédica.
Tabela 9: Percentagem relativa dos diferentes tipos de cirurgias observados
Tipos de cirurgias Percentagem
Pequenas cirurgias 25% Cirurgia de tecidos moles 65% Cirurgia ortopédica 10%
Nas pequenas cirurgias (Tabela 10), estão incluídas aquelas em que o animal, salvo raras excepções, não necessita de uma anestesia profunda, sendo às vezes apenas necessário uma anestesia local ou uma ligeira sedação.
Tabela 10: Percentagem relativa das pequenas cirurgias
Pequenas cirurgias Percentagem
Suturas 28% Cistocentese 26% Abdominocentese 14% Toracocentese 12% Remoção de cavilhas 6% Destartarização 6% Biopsia 4% Pericardiocentese 4%
A cirurgia de tecidos moles (Tabela 11), tipo de cirurgia seguido com maior frequência durante o período de estágio, pode ser dividida consoante a região em que se intervém, ou o tipo de cirurgia que se realiza.
Nalgumas destas cirurgias recolheram-se amostras de sangue para a realização dos estudos clínicos sobre a proteína C reactiva.
Tabela 11: Percentagem relativa das cirurgias de tecidos moles
Cirurgia de tecidos moles Percentagem
Tracto reprodutor feminino 30% Tracto reprodutor masculino 16%
Neoplasias 15% Tracto gastro-intestinal 12% Hérnias 8% Outras cirurgias 7% Oftalmologia 6% Tracto urinário 4% Ouvido 2%
Monografia - Relevância da determinação de proteína C reactiva em cirurgia – estudo preliminar em cão.
1. Resposta de fase aguda
Em situações normais a manutenção da homeostase é garantida por uma série de mecanismos neuroendócrinos, hematopoiéticos e metabólicos. Quando ocorrem alterações que levam a um desvio desta situação, há um comprometimento da saúde do animal, tentando o organismo responder através de modificações metabólicas e sistémicas, ou através de alterações localizadas, como as reacções inflamatórias. O objectivo deste tipo de respostas é tentar restaurar a homeostase e remover a causa da alteração (Moshage, 1997).
A primeira reacção do organismo a uma agressão é uma resposta inata, não específica, que precede as reacções imunológicas específicas. A resposta de fase aguda é uma reacção sistémica do organismo a distúrbios locais ou sistémicos causados por infecção, lesão tissular, trauma ou cirurgia, crescimento de processos neoplásicos ou alterações inflamatórias (Gruys et al., 2005a). No local da lesão tissular e/ou da invasão por microorganismos, a resposta é iniciada no próprio tecido, havendo libertação de citoquinas pró-inflamatórias e activação, tanto do sistema vascular, como de diversas células inflamatórias (Yashamita et al., 1994). Estas respostas levam à libertação de mais citoquinas e outros mediadores inflamatórios que se difundem para o compartimento extracelular e passam para a circulação sanguínea. As citoquinas actuam a nível de diferentes células alvo, conduzindo a uma reacção sistémica que resulta numa activação do eixo hipotálamo-pituitário-adrenal, numa redução da secreção da hormona de crescimento (Gruys et al., 1999 citado por Gruys et al., 2005a) e em inúmeras alterações físicas clinicamente caracterizadas por febre, anorexia, aumento do catabolismo muscular (van Miert, 1995 citado por Gruys et al., 2005a; Yamashita et al., 1994), alterações no metabolismo dos lípidos e alterações hormonais (Moshage, 1997). Além disso, ocorrem alterações que podem ser valorizadas a nível laboratorial, tais como, diminuição de LDL e HDL no plasma sanguíneo, neutrofilia (Moshage, 1997), aumento dos níveis séricos da hormona adrenocorticotrópica (ACTH) e de glucocorticóides, activação do sistema do complemento e do sistema de coagulação sanguíneo, diminuição dos níveis séricos de zinco, ferro, vitamina A e α-tocoferol e alteração da concentração de diversas proteínas plasmáticas (proteínas de fase aguda), devido, principalmente, a uma alteração no metabolismo hepático (Gruys et al., 2005a).
A resposta de fase aguda visa evitar a progressão da lesão num determinado órgão, controlar o microorganismo invasor, remover moléculas e detritos e activar e reparar os
mecanismos necessários para que ocorra um retorno dos órgãos ao seu funcionamento normal (Baumann e Gauldir, 1994 citado por Hirvonen, 2000).
2. Proteínas de fase aguda
As respostas de fase aguda compreendem variações nas concentrações de diversas proteínas plasmáticas, denominadas proteínas de fase aguda, e num número elevado de alterações comportamentais, fisiológicas, bioquímicas e nutricionais, tais como alterações neuroendócrinas, hematopoiéticas, metabólicas, hepáticas e nos constituintes plasmáticos não proteicos (Gabay e Kushner, 1999).
As proteínas de fase aguda são proteínas sanguíneas cuja quantificação permite avaliar a resposta inata do sistema imunitário a determinada alteração no organismo (Eckersall, 2006b). As condições que mais comummente conduzem a variações elevadas na concentração destas proteínas incluem infecção, trauma, cirurgia, queimaduras, isquémia tissular, neoplasia e condições inflamatórias. O exercício físico, golpes de calor, parto e stress levam a um aumento moderado ou ligeiro da sua concentração sérica (Gabay e Kushner, 1999). Nas situações crónicas também se verifica o seu aumento mas de uma forma mais lenta (Petersen et al., 2004). Esta situação pode dever-se a uma insuficiência na síntese de mediadores ou a uma incapacidade do fígado em responder ao estímulo das citoquinas de forma contínua e prolongada (Hanson e Lindquist, 1997 citado por Gillet, 2002). Por vezes, quando o processo inflamatório é mínimo, as concentrações destas proteínas mantêm-se dentro dos valores de referência (Chambers et al., 1991).
Estas proteínas de fase aguda podem ser definidas de acordo com cinco critérios: (1) uma cinética de evolução rápida, (2) um aumento significativo da concentração plasmática, (3) uma variação independente da etiologia do processo inflamatório, (4) uma variação estrita da reacção inflamatória e (5) a possibilidade de uma dosagem rápida e precisa (Hachulla, 1998 citado por Gillet, 2002).
Podem ser classificadas como proteínas de fase aguda positivas ou negativas, uma vez que a sua concentração aumenta ou diminui pelo menos 25% em relação a valores basais, respectivamente (Eckersall, 2006a).
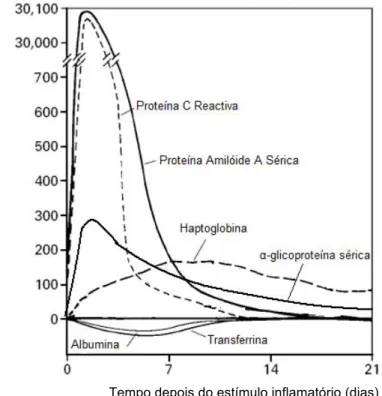
As proteínas de fase aguda positivas são glicoproteínas sintetizadas principalmente ao nível dos hepatócitos depois da libertação para a corrente sanguínea de citoquinas pró-inflamatórias. No cão, estas proteínas podem ser divididas em três grupos (figura 1) de acordo com o aumento da sua concentração aquando da reacção inflamatória. No primeiro grupo, no qual se incluem a proteína C reactiva (PCR) e a proteína amilóide A sérica, a concentração sérica é igual ou menor a 10 µg/ml, podendo aumentar até 100 ou 1000 vezes na presença de um estímulo inflamatório. Estas proteínas atingem um pico cerca das 24-48
horas e retornam rapidamente para os valores normais. A α-glicoproteína sérica, pertencente ao segundo grupo, é uma proteína de fase aguda moderada, e que sofre um aumento de cerca de 5 a 10 vezes após o estímulo, atingindo um pico por volta do 2º-3º dia. O seu retorno a valores normais é mais lento do que nas proteínas pertencentes ao primeiro grupo. Por último, o terceiro grupo, ao qual pertence a haptoglobina, caracteriza-se por apresentar um aumento da concentração de cerca de 2 vezes o valor normal (Eckersall, 2006a).
Figura 1: Características padrão de alterações nas concentrações de algumas proteínas de fase aguda, depois de um estímulo inflamatório (adaptado de Gitlin e Colten citado por Gabay e Kushner, 1999)
Como já foi referido anteriormente, as proteínas de fase aguda negativas são aquelas cuja concentração diminui pelo menos 25% do seu valor basal. Como exemplos deste tipo de proteínas existem a albumina e a transtirretina. Para a síntese de albumina é necessário um elevado número de aminoácidos. Durante uma resposta de fase aguda, as proteínas de fase aguda positivas necessitam destes aminoácidos para a sua síntese, havendo assim uma diminuição da concentração da albumina sérica (Paltrinieri, 2007). Por outro lado, como a transtirretina inibe a produção de interleuquina-1 (IL-1) pelos monócitos e macrófagos, é necessário haver uma diminuição na sua síntese para haver produção das proteínas de fase aguda positivas (Gabay e Kushner, 1999).
Tempo depois do estímulo inflamatório (dias)
C o n ce n tr a çã o p la sm á tic a ( % )
3. Proteína C Reactiva
3.1. História de PCR
A proteína C reactiva foi descrita pela primeira vez por Tillet e Francis, em 1930, durante um estudo em pacientes com infecção por Streptococcus pneumoniae. O soro obtido a partir destes pacientes, durante a fase aguda dos sintomas, apresentava uma substância que fazia precipitar o polissacarídeo C da parede celular do pneumococo. Nessa altura, foram realizados diversos estudos que verificaram que esta substância não era detectável em pacientes saudáveis, mas que atingia concentrações muito elevadas em pacientes com infecções. Quando havia recuperação, os seus valores eram novamente indetectáveis. Esta substância também foi encontrada no sangue de pacientes com outras doenças febris, tais como infecção por Streptococcus hemolíticos, febre reumática e infecção por Staphylococci (Marnell et al., 2005).
A noção de proteína C reactiva como proteína de inflamação foi introduzida quando Abernethy e Avery caracterizaram esta substância como sendo de natureza proteica e demonstraram a necessidade da presença do ião cálcio para a sua reacção com o polissacarídeo C (Pepys, 1981 citado por Vergobbi, 1992).
Na década de 70, Volanakis e Kaplan identificaram um ligando específico para a proteína C reactiva, a fosfocolina, que faz parte do ácido teicóico, constituinte da parede celular do pneumococo. Desde então, foram realizados diversos estudos em que se identificaram outros tipos de ligandos (Black, 2005).
3.2. Estrutura e caracterização de PCR
Ao microscópio electrónico, a proteína C reactiva canina apresenta uma configuração cíclica, plana, simétrica e pentamérica (Eckersall e Conner, 1988 citado por Gillet, 2002). É composta por cinco subunidades polipeptídicas, pertencendo, por isso, à família das pentraxinas. As suas subunidades estão unidas por ligações não covalentes, sendo, apenas, duas das cinco, subunidades glicosadas. Por electroforese em gel de poliacrilamida (SDS-PAGE, -Sodium Dodecyl Sulphate – Poly Acrylamide Gel Electrophoresis) podem observar-se duas bandas, que correspondem aos dois tipos de subunidades, glicosadas ou não glicosadas (Caspi et al., 1984).
Cada subunidade apresenta, na face plana, um receptor para a fosfocolina, composto por dois iões de cálcio, que se ligam ao grupo fosfato e um domínio hidrofóbico onde se encontra o grupo metil da fosfocolina. A união da fosfocolina à proteína C reactiva é
mediada pelos resíduos Phe66 e Glu81, em que o primeiro estabelece as interacções hidrofóbicas com o grupo metil da fosfocolina e o segundo, que se encontra na face oposta do domínio, interage com o grupo colina carregado positivamente. A face oposta da subunidade, a face efectora, é o local onde se liga a fracção C1q do complemento e onde se
pensa que se possa ligar o receptor FcγR. Esta face apresenta uma fissura, que se prolonga do centro da subunidade para o centro da molécula, onde se encontram vários resíduos necessários para ligação de PCR a C1q, como Asp112 e Tyr175 (Black, 2005).
O peso molecular desta proteína varia consoante o método utilizado para a sua detecção. Este, encontra-se entre os 100 000 Dalton (Eckersall e Conner, 1988 citado por Gillet, 2002) e 155 000 Dalton (Yamamoto et al., 1992 citado por Gillet, 2002) com um valor médio de 115 000 Dalton (Caspi et al., 1984). Utilizando a separação por SDS-PAGE seguida de coloração PAS, demonstrou-se que as suas subunidades glicosadas (coradas) e não glicosadas apresentam um peso molecular de 25 000 e 22 000, respectivamente (Fujise et al., 1992; Onishi et al., 1993 citado por Gillet, 2002).
O ponto isoeléctrico da proteína C reactiva canina está compreendido entre pH=5,3 e pH=6,65 (Caspi et al., 1984).
No Homem, tempo de semi-vida de PCR é cerca de 19 horas (Hanson e Lindquist, 1997 citado por Gillet, 2002), embora alguns autores refiram que seja apenas de 6 a 9 horas (Gewurz et al., 1982 citado por Gillet, 2002)
3.3. Síntese de PCR
O início da resposta de fase aguda ocorre no local da lesão tissular. As células mononucleares locais libertam um largo espectro de mediadores inflamatórios, tais como citoquinas, mediadores lipídicos, aminas vasoactivas, proteases e óxido nítrico e activam as cascatas do complemento e da coagulação (Olson et al., 1995 e Monshouwer et al., 1996 citados por Hirvonen, 2000). Estes mediadores de inflamação iniciam as reacções inflamatórias locais e sistémicas. As primeiras incluem um aumento da permeabilidade capilar e uma infiltração de leucócitos na área de inflamação. Enquanto que o aumento da permeabilidade inflamatória permite o transporte de diferentes moléculas entre a circulação sanguínea e a área da lesão tissular, a migração dos leucócitos até ao local inflamatório é regulada pela sua adesão ao endotélio e, na sequência da activação de mediadores de inflamação (Hirvonen, 2000), o que faz com que as reacções inflamatórias locais influenciem, indirectamente, a reacção sistémica.
As citoquinas são polipeptídeos segregados por diversos tipos de células que regulam e determinam a resposta imune, ao promover a sobrevivência, proliferação, diferenciação, activação ou morte das células (Kallio, 2000). Podem ser divididas em três grupos de acordo
com a sua função: citoquinas que actuam como factores de crescimento para diversas células (IL-2, IL-3, IL-4, IL-7, IL-10, IL-11, IL-12 e factor de estimulação de granulócitos-macrófagos), citoquinas com propriedades pró-inflamatórias (TNF-α/β, IL-1 α/β, IL-6, IFN-α/γ, IL-8 e proteína-1 inibidora de macrófagos) e factores com actividade anti-inflamatória (antagonistas dos receptores IL-1, receptores solúveis IL-1, proteína de ligação a TNF- α e proteína de ligação a IL-1) (Gruys et al., 2005a).
Os mediadores de inflamação são factores solúveis produzidos ao nível do local de inflamação por células activadas e são responsáveis por efeitos localizados ou sistémicos, iniciando e mantendo a resposta imune. Estes, para além do grupo das citoquinas com propriedades pró-inflamatórias, das quais, as que têm maior importância na síntese da proteína C reactiva são IL-6, IL-1 α/β e TNF-α/β, também incluem glucocorticóides e factores de crescimento (factor de crescimento semelhante à insulina, factor de crescimento de hepatócitos, factor de crescimento de fibroblastos, entre outros) (Baumann e Gauldie, 1994, citado por Gillet, 2002). Enquanto que as citoquinas estimulam a expressão genómica das proteínas de fase aguda (PFA), os glucocorticóides e os factores de crescimento modulam a actividade das citoquinas (Ceciliani et al., 2002). As concentrações plasmáticas destas moléculas são inferiores aos limites de detecção laboratorial, e o seu tempo de semi-vida é de poucos minutos, podendo ser observados, apenas, ligeiros picos sanguíneos. Assim, não é possível utilizar estas moléculas para comprovar a presença de resposta inflamatória (Bienvenu et al., 2000).
Depois de entrarem na circulação sanguínea, estes mediadores de inflamação chegam ao tecido hepático e, através da activação de receptores nos hepatócitos, ocorre a expressão genómica das PFA que inicialmente é regulada a um nível transcricional, levando assim à sua síntese (Ceciliani et al., 2002).
3.3.1. Mediadores de inflamação
Como já foi referido anteriormente, os principais mediadores de inflamação responsáveis pela síntese de PCR são a IL-6, a IL-1, o TNF-α, os glucocorticóides e os factores de crescimento.
A interleuquina 6 é uma fosfoglicoproteína de 184 aminoácidos com um peso molecular de 21 000. Esta citoquina é produzida no local da lesão tissular ou do trauma por diversas células, tais como macrófagos, fibroblastos, monócitos, linfócitos B e T, células endoteliais, células epidérmicas, células sinoviais, queranócitos, diversas células tumorais e condrócitos (Yamashita et al., 1994). Seis horas após o estímulo inflamatório, esta interleuquina encontra-se em elevadas concentrações a nível hepático, podendo também encontrar-se no líquido sinovial, líquido cefalo-raquidiano ou na urina, mas em concentrações inferiores
(Nijsten et al., 1987 citado por Gillet, 2002). As suas principais funções são a regulação da resposta imune através da diferenciação de timócitos, linfócitos B e precursores de linfócitos T, estimulação da hematopoiese através da proliferação de precursores dos granulócitos e macrófagos, mielopoiese, eritropoiese, aparecimento dos estados febris, acção endócrina através da síntese de adrenocorticóides e glucocorticóides, síntese hepática das proteínas de fase aguda e inibição da síntese de TNF-α (Yamashita et al., 1994). Num estudo experimental, sintetizou-se uma forma recombinante de IL-6 em Escherichia coli. Após a sua purificação, injectou-se por via subcutânea 40 µg/kg a dez cães de raça Beagle, e pôde-se observar um aumento muito rápido da concentração da proteína C reactiva. Seguidamente, administrou-se um anticorpo específico para a proteína “gp 130”, tendo-se verificado a inibição da actividade da IL-6, uma vez que esta proteína é uma subunidade desta interleuquina (Weinhold e Ruther, 1997). Verificou-se que depois desta administração, os valores de PCR baixaram significativamente (Nijsten et al., 1987 citado por Gillet, 2002), podendo concluir-se que a IL-6 activa a síntese desta proteína. Existe um atraso entre o pico de IL-6 e o pico de proteína C reactiva, devido ao tempo necessário para a estimulação hepática, e posterior síntese desta proteína. Quando o nível dos mediadores de inflamação, que se encontram em circulação, diminui, não há estimulação do fígado, não ocorrendo assim, a síntese da proteína C reactiva. Verifica-se, então, que a resposta do fígado depende da quantidade de IL-6 presente no sangue (Liu et al., 2000).
A interleuquina 1 é uma proteína de 152 aminoácidos com um peso molecular de 17 000 e que apresenta dois polipeptídeos (IL-1α e IL-1β) com propriedades semelhantes. Esta molécula é sintetizada por monócitos, macrófagos, neutrófilos polinucleares, linfócitos B e T, células endoteliais, fibroblastos, queranócitos, adipócitos e células dendríticas. As suas funções são principalmente: acção celular (activação de neutrófilos, activação de osteoclastos e destruição da matriz óssea, produção de prostaglandinas e colagenases pelas células sinoviais) (Collet, 1995 citado por Gillet, 2002), acção endócrina (síntese de prostaglandinas e de leucotrienos envolvidos no mecanismo da febre e de vários sintomas de choque séptico (Bienvenu et al., 2000) e secreção de IL-2 responsável pela activação de linfócitos T) e acção sinérgica com a IL-6 na síntese de proteína C reactiva pelo fígado, amplificando a sua actividade (Hachulla, 1998 citado por Gillet, 2002; Yamashita et al., 1994).
O TNF-α é um polipéptido não glicosado composto por 157 aminoácidos (Collet, 1995 citado por Gillet, 2002). Esta citoquina é secretada por monócitos e macrófagos, principalmente, por estimulação por endotoxinas bacterianas (Gruys et al., 1994 citado por Gillet, 2002). As suas principais funções são o efeito citotóxico e citostático, inibição da lipoproteína lipase, que leva a uma diminuição da captação e armazenamento de triglicéridos exógenos pelos adipócitos, activação de osteoclastos e destruição da matriz óssea, desenvolvimento de caquexia nos casos de infecções crónicas e neoplasias, aparecimento de sintomas ligados
ao choque séptico, ao induzir alterações metabólicas, hemodinâmicas e tissulares, activação do metabolismo oxidativo dos neutrófilos polinucleados, acelerando a sua degradação e capacidade de adesão às células endoteliais, e síntese das proteínas de fase aguda em associação com IL-6 e IL-1 (Yamashita et al., 1994; Collet, 1995 citado por Gillet, 2002). Os glucocorticóides e os factores de crescimento podem actuar directamente na produção de proteínas de fase aguda, ou actuar em sinergia com a IL-1 e a IL-6 (Ritchie e Navolotskaia, 1996 citado por Gillet, 2002). Actuam através da inibição da expressão dos genes que codificam as citoquinas, reduzindo, assim, a sua libertação pelos macrófagos e monócitos. Isto leva a que haja um limite da toxicidade das interleuquinas e do TNF-α, diminuindo a síntese das proteínas de fase aguda. As citoquinas, ao estimularem a síntese de adrenocorticóides, desencadeiam um mecanismo de retro-alimentação negativa (“feed-back” negativo) pelo cortisol endógeno (Baumann e Gauldie, 1994 citado por Gillet, 2002). Assim, os glucocorticóides e os factores de crescimento regulam a produção de PCR ao modular a libertação de citoquinas e a resposta do fígado.
3.3.2. Síntese hepática de PCR
Após a indução da sua síntese e libertação, os mediadores de inflamação entram em circulação e atingem o fígado, onde se ligam a receptores membranários. A síntese de PCR inicia-se nos hepatócitos periportais e prossegue, de forma centrípta, pelos lóbulos hepáticos (Kushner e Feldmann, 1978). Há um aumento significativo da concentração de PCR sérica quatro a doze horas após o estímulo (Caspi et al., 1984), que duplica em oito a dez horas (Osmand et al., 1977). A sua concentração atinge um pico às 24-48 horas (Eckersall, 2006c).
Para que haja síntese das proteínas de fase aguda é necessária uma activação das RNA polimerases, que levam a um aumento da síntese do RNA mensageiro. Por sua vez, uma hipertrofia do retículo endoplasmático e do aparelho de Golgi conduz a uma activação das glico-transferases e a uma glicosilação da fracção proteica, que termina numa secreção plasmática de PCR (Vergobbi, 1992).
No Homem, o gene codificante para a proteína C reactiva, localizado no braço curto do cromossoma 1, contém apenas um intrão, que separa a região que codifica o sinal peptídico da que codifica a proteína matura. Como já foi referido, a indução de PCR nos hepatócitos é regulada, a um nível transcricional, principalmente, pela IL-6, cujo efeito pode ser aumentado pela IL-1. Ambas as citoquinas controlam a expressão de vários genes das proteínas de fase aguda através da activação dos factores de transcrição STAT3, membros da família da C/EBP e proteínas rel (NF-κB). A regulação de cada gene codificante das proteínas de fase aguda é devido a interacções induzidas pelas citoquinas e pelos factores
de transcrição, nos seus promotores. Para a PCR, os factores C/EBPβ e C/EBPδ, são essenciais para esta indução. Para além dos locais de ligação para o C/EBP, a região proximal da subunidade do gene codificante de PCR contém locais de ligação para STAT3 e proteínas rel. As interacções entre estes factores vão resultar numa máxima indução da expressão do gene (Black, 2005).
Quando há uma diminuição da resposta inflamatória, a síntese da proteína C reactiva é também diminuída, principalmente por dois mecanismos. Por um lado, o curto tempo de semi-vida dos mediadores de inflamação leva a que a ausência de estimulação por parte do fenómeno inflamatório diminua a libertação de citoquinas, e, assim, a de proteína C reactiva. Por outro lado, há um mecanismo de retro-alimentação negativa na síntese de PCR, através da libertação de uma protease pelos neutrófilos que vai promover a degradação desta proteína (Steel e Whitehead, 1994 citado por Gillet, 2002).
Embora a síntese de PCR seja feita principalmente a nível hepático, também está descrita a sua síntese a nível dos neurónios, monócitos, linfócitos (Murphy et al., 1991), pulmão, adipócitos e intestino (Eckersall, 2006b). Os mecanismos que regulam esta síntese não estão descritos, mas pensa-se que não influenciam substancialmente os níveis séricos de PCR (Black, 2005).
3.4. Proteína C reactiva em diferentes espécies animais
Embora a resposta de fase aguda siga um padrão semelhante nas diferentes espécies animais, existem numerosas diferenças nas suas características. Não obstante, as diferentes proteínas de fase aguda se encontrarem na corrente sanguínea de quase todos os animais, os seus padrões de resposta podem variar grandemente (Hirvonen, 2000). Apesar de ser no cão e no Homem que a PCR tem maior significado como proteína de fase aguda, esta também pode ser encontrada na corrente sanguínea de diversos mamíferos, aves e alguns peixes.
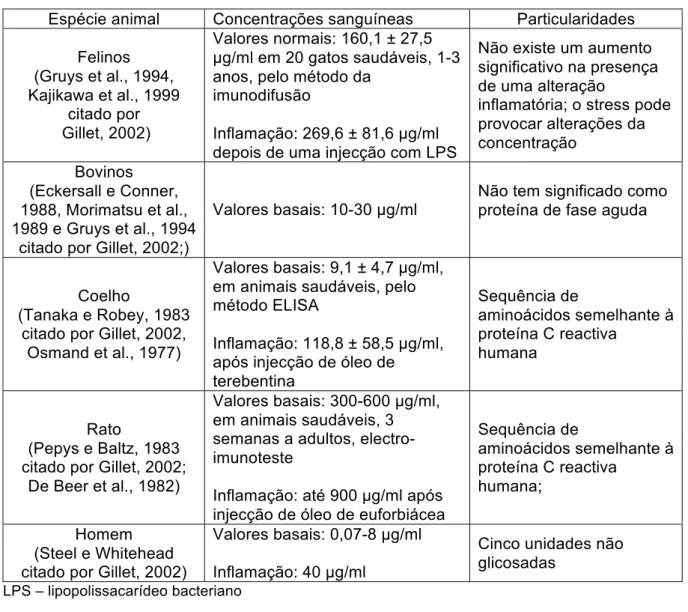
A tabela 12 apresenta as principais características da proteína C reactiva em diferentes espécies animais.
Ao contrário dos canídeos, a proteína C reactiva não é o marcador ideal de inflamação nos felinos e nos bovinos. Devem-se, assim, utilizar outras proteínas de fase aguda, como por exemplo a α-glicoproteína sérica e a proteína amilóide A sérica, respectivamente (Eckersall, 2006a; Hirvonen, 2000).
Tabela 12: Características e valores da proteína C Reactiva em diferentes espécies animais (adaptado de Gillet, 2002)
Espécie animal Concentrações sanguíneas Particularidades Felinos (Gruys et al., 1994, Kajikawa et al., 1999 citado por Gillet, 2002) Valores normais: 160,1 ± 27,5 µg/ml em 20 gatos saudáveis, 1-3 anos, pelo método da
imunodifusão
Inflamação: 269,6 ± 81,6 µg/ml depois de uma injecção com LPS
Não existe um aumento significativo na presença de uma alteração
inflamatória; o stress pode provocar alterações da concentração Bovinos (Eckersall e Conner, 1988, Morimatsu et al., 1989 e Gruys et al., 1994
citado por Gillet, 2002;)
Valores basais: 10-30 µg/ml Não tem significado como proteína de fase aguda
Coelho
(Tanaka e Robey, 1983 citado por Gillet, 2002,
Osmand et al., 1977)
Valores basais: 9,1 ± 4,7 µg/ml, em animais saudáveis, pelo método ELISA
Inflamação: 118,8 ± 58,5 µg/ml, após injecção de óleo de terebentina Sequência de aminoácidos semelhante à proteína C reactiva humana Rato (Pepys e Baltz, 1983 citado por Gillet, 2002;
De Beer et al., 1982)
Valores basais: 300-600 µg/ml, em animais saudáveis, 3 semanas a adultos, electro-imunoteste
Inflamação: até 900 µg/ml após injecção de óleo de euforbiácea
Sequência de aminoácidos semelhante à proteína C reactiva humana; Homem (Steel e Whitehead citado por Gillet, 2002)
Valores basais: 0,07-8 µg/ml Inflamação: 40 µg/ml
Cinco unidades não glicosadas
LPS – lipopolissacarídeo bacteriano
3.5. Antigenicidade de PCR
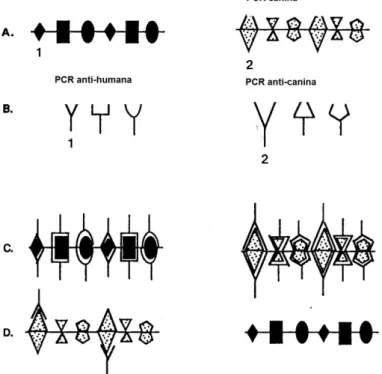
Em 1993, Yamamoto et al. realizaram um estudo de forma a verificar se havia reacções cruzadas entre a proteína C reactiva canina e humana. Foram recolhidos soros de cinco cães que apresentavam um processo inflamatório. Estes foram inoculados em quatro cabras e trinta coelhos, de forma a produzir anti-soros. Por imuno-electroforese, verificou-se que os trinta e quatro anti-soros reagiram com a PCR canina, mas não reagiram com a molécula humana, excepto quando as concentrações de PCR foram elevadas, uma vez que existem alguns epitopos comuns às duas moléculas. Demonstrou-se que, se a concentração de PCR for menor do que 150 µg/ml, não há qualquer tipo de reacção cruzada. Esta, apenas ocorre entre anticorpos anti-proteína C reactiva humana e a proteína C reactiva canina, quando as concentrações de antigénios e anticorpos são muito elevadas (Yamamoto et al., 1993a)
Embora possa ocorrer, em casos de elevados títulos, uma reacção entre a proteína C reactiva canina e anticorpos anti-proteína C reactivos humana, os testes comerciais humanos não devem ser utilizados para amostras caninas (Yamamoto et al. 1993a; Fujise, 1994). Devem-se utilizar anticorpos específicos de forma a obter dados fidedignos (Maudsley e Pepys, 1987).
3.6. Função de PCR
A inflamação é um processo complexo e organizado que envolve vários tipos de células e moléculas. Estas podem iniciar, amplificar ou manter o processo inflamatório, podendo ainda atenuá-lo ou resolvê-lo. Algumas das moléculas envolvidas são multifuncionais e contribuem para o aumento ou diminuição do processo inflamatório em diferentes pontos da sua evolução. Muitas das proteínas de fase aguda, incluindo a proteína C reactiva, têm a capacidade de influenciar uma ou várias etapas deste processo (Gabay e Kushner, 1999). A estrutura pentamérica cíclica de PCR permite a sua ligação a diversas bactérias patogénicas ou antigénios intracelulares de células danificadas, reconhecendo, moléculas estranhas ao organismo. Esta tem, assim, um papel importante na protecção contra processos infecciosos, eliminação de tecidos alterados, prevenção de reacções de auto-imunidade e regulação da resposta inflamatória (Mold et al., 2002). Tem, também, a capacidade de activar o sistema do complemento pela via clássica, interagir com receptores específicos em células fagocíticas e induzir a produção de citoquinas anti-inflamatórias (Du Clos and Mold, 2001 citado por Murata et al., 2004), estimular a fagocitose e ligar-se a receptores de imunoglobulinas IgG (FcγR) (Black, 2005).
3.6.1. Fixação a ligandos
A PCR tem a capacidade de se ligar a um elevado número de ligandos como a fosfocolina, a lecitina, a lisolecitina, a esfingomielina, certos poli-aniões como o ácido desoxirribonucleico, moléculas catiónicas (protamina, histona e heparina), lípidos (lipossomas, lipoproteínas, apoliproteínas como a LDL responsável pelo transporte de colesterol), entre outros (Gillet, 2002), com os quais vai interagir e eliminar através da activação do complemento.
O ligando melhor caracterizado é a fosfocolina. Este encontra-se presente num elevado número de bactérias e é um constituinte da esfingomielina e da fosfatidilcolina das células eucarióticas (Black, 2005). Embora o reconhecimento da fosfocolina ou de outras moléculas presentes nos microorganismos pela proteína C reactiva tenha um papel na defesa do organismo, este ocorre apenas na ligação a células com membranas lesadas, uma vez que
a fosfocolina, normalmente, não se encontra à superfície das células, sendo exposta apenas quando ocorre desintegração da membrana celular (Black, 2005).
A ligação de PCR a um ligando activa a via clássica do complemento através da interacção com C1q (Black, 2005), desempenhando, assim, um papel importante na defesa do
organismo.
3.6.2. Activação da via clássica do sistema do complemento
O sistema do complemento, constituído por cerca de trinta proteínas, tem um papel importante na defesa do organismo contra agentes infecciosos e na resposta inflamatória. Existem três vias pelas quais o complemento pode ser activado: a via clássica, a via alternativa e a via das lectinas, sendo a primeira a utilizada pela PCR. Os componentes mais importantes da via clássica são C1-C9, e esta desencadeia-se pela ligação de
complexos antigénio-anticorpo a C1q. A fase inicial da activação leva à clivagem dos
produtos C3 e C4, que, por sua vez, actuam como opsoninas. A última fase desta via envolve
o complexo de ataque membranário C5-C9, que têm uma elevada acção inflamatória,
gerando péptidos quimiotácticos. Estes levam à lise das bactérias ou das células à qual se ligam (Black, 2005).
A PCR, ao interagir com os ligandos, tem a capacidade de fixar a fracção C1q do
complemento que, por sua vez, activa a C3 convertase. Esta última, transforma a fracção C3
do complemento em C3a, que participa na desgranulação dos mastócitos, e em C3b. O
complexo C3b – ligando – PCR, formado na superfície da célula-alvo, é reconhecido pelos
macrófagos ao nível do receptor membranário do C3b, sendo este fagocitado e opsonizado
(figura 2) (Vergobbi, 1992).
A activação do complemento pela proteína C reactiva limita-se à fase inicial da via clássica, envolvendo apenas C1-C4, com pouca activação das últimas proteínas C5-C9. Isto ocorre
devido à capacidade da proteína C reactiva de interagir com o factor H e com a proteína de ligação a C4b (Sjoberg et al., 2006), levando à inibição das vias que resultam na formação
das C5 convertases. Assim, as respostas inflamatórias associadas a C5a e C5-C9 são
limitadas, o que leva a que a proteína C reactiva participe no sistema de defesa do organismo limitando os efeitos inflamatórios das últimas etapas do sistema do complemento (Black, 2005).
Figura 2: Activação do sistema do complemento pela via clássica pela proteína C reactiva (adaptado de Vergobbi, 1999)
3.6.3. Fagocitose
Embora, como foi explicado anteriormente, a activação do complemento conduza a um aumento da fagocitose, a ligação de PCR a células fagocitárias também é mediada pelos receptores Fc-gamma (Bharadwaj et al., 1999). Os receptores Fc encontram-se na superfície de determinadas células como macrófagos, neutrófilos e mastócitos, contribuindo para a eficácia da protecção pelo sistema imunitário. Existem três classes de receptores Fc-gamma – FcγRI, FcγRII e FcγRIII – tendo a PCR uma baixa afinidade pela FcγRI e uma elevada afinidade pela FcγRII (Stein et al., 2000). Os receptores Fc-gamma apresentam domínios estimulatórios, caracterizados por uma sequência citoplasmática ITAM (immunoreceptor tyrosine-based cativation motif) e um domínio inibitório, caracterizado pela presença de uma sequência ITIM (immunoreceptor tyrosine-based inhibition motif). As respostas biológicas mediadas pelo primeiro incluem fagocitose e secreção de citoquinas, que na presença dos receptores inibitórios irão ser anuladas (Black, 2005).
3.6.4. Eliminação de detritos celulares
Em 1982, Gewurz observou que no Homem, após um enfarte cardíaco, era possível detectar, por imunofluorescência depósitos de proteína C reactiva nas fibras musculares necrosadas do órgão afectado e que as fibras saudáveis não apresentavam qualquer tipo de alteração na coloração, concluindo que a PCR participa no catabolismo e eliminação de detritos celulares ao nível do foco inflamatório (Gewurz et al., 1982 citado pró Gillet, 2002). Quando ocorrem modificações tissulares, as células sofrem alterações que levam à libertação de certas moléculas, como a cromatina (Vergobbi, 1992), a laminina e a fibronectina (Ritchie et al., 1996 citado por Gillet, 2002). Estas, vão formar complexos com a
C4, C2 C1q
Proteína C Reactiva + ligando Ca 2+
C3a Desgranulação dos mastócitos
C3 convertase Proteína C reactiva + ligando + C3b
C3
proteína C reactiva, que serão destruídos por acção do complemento e de nucleases (Du Clos et al., 1988).
3.6.5. Protecção contra infecções
Através da inoculação em animais de laboratório ou transgénicos, foi demonstrado que a proteína C reactiva tem um papel de protecção contra infecções bacterianas. Num grupo de ratos transgénicos infectados com Streptococcus pneumoniae administrou-se proteína C reactiva humana, havendo um grupo controlo que não sofreu qualquer tipo de inoculação. Passadas 24 horas, observou-se que a bacteriémia era significantemente mais baixa nos animais aos quais foi administrada a proteína C reactiva, levando a que estes animais tivessem um tempo de vida maior ou uma taxa de mortalidade menor (Suresh et al., 2007). Verificou-se, assim, que a proteína C reactiva contraria a multiplicação bacteriana nas primeiras fases da infecção ao activar o complemento, o que leva a que a sua patogenicidade e toxicidade sejam limitadas.
3.6.6. Protecção dos vasos
A proteína C reactiva tem um papel protector dos vasos, uma vez que inibe a agregação plaquetária através da sua ligação ao factor de activação plaquetária (PAF) e à membrana fosfolipídica das plaquetas. Esta última ligação vai proteger as membranas dos efeitos dos lisolípidos e das fosfolipases, uma vez que evita o efeito detergente e consequente ruptura das membranas celulares pelos primeiros e conduz à inibição da libertação do ácido araquidónico, bloqueando assim a produção de mediadores de inflamação, no caso das fosfolipases. O facto de PCR se ligar ao PAF vai diminuir a permeabilidade vascular, uma vez que este vai activar as plaquetas e aumentar a ligação dos leucócitos às células endoteliais (Vigo, 1985).
3.6.7. Acção anti-neoplásica
A influência da proteína C reactiva no desenvolvimento de metástases pulmonares na presença de fibrossarcoma foi estudada num modelo em que se induziu a formação deste tipo de tumor nas patas de 250 ratinhos de laboratório (Deodhar et al., 1982) Observou-se que a PCR induzia a lise de células tumorais pelo sistema imunitário. Dezassete dias após a inoculação, e após a amputação da pata, foi administrado por via endovenosa um composto de lipossoma com proteína C reactiva humana a um grupo de animais. Aos grupos controlo
não foi administrado qualquer tipo de tratamento ou administraram-se compostos de lipossoma com IgG humana, LPS ou albumina sérica. No trigésimo quinto dia, depois de eutanasiados, verificou-se que os animais tratados com o composto lipossoma-PCR humano, apresentavam metástases mais pequenas e em menor número em comparação com os grupos controlo. 38% não apresentaram qualquer tipo de metástase pulmonares e a taxa de sobrevivência foi significantemente maior neste grupo (Deodhar et al., 1982).
3.7. Detecção de PCR
A monitorização da concentração sérica da proteína C reactiva permite obter informações sobre a resposta imunitária inata do organismo. Em Medicina Veterinária a detecção desta baseia-se na utilização de testes imunológicos, onde os mais utilizados são: electro-imuno-ensaio, imunodifusão, ELISA, imunoturbidimetria, “capillary reversed passive latex aglutination” (CRPLA) e a imunocromatografia (Hayashi et al., 2001; Parra et al., 2006a). Como já foi referido anteriormente, os reagentes utilizados têm de ser específicos para a proteína C reactiva canina.
A PCR canina pode ser detectada a partir de várias amostras, sendo a mais frequente o sangue venoso. Em Medicina Humana existem diversos estudos nos quais se utiliza líquido ascítico (Claus et al., 1976 citado por Gillet, 2002), líquido pleural (Gewurz et al., 1982 citado por Gillet, 2002), líquido cefalo-raquidiano (Van Lente, 1982 citado por Gillet, 2002), entre outros. Embora em menor número, em medicina veterinária, também existem estudos que utilizam outros líquidos biológicos como líquido bronco-alveolar (Casals et al., 1998), saliva (Parra et al., 2005), líquido sinovial (Hurter et al., 2005) e diferentes tipos de efusões (Parra et al., 2006b)
O sangue obtido, de forma asséptica, a partir de uma veia periférica, deve ser colocado num tubo seco. Após centrifugação, recolhe-se o soro, e a amostra deve ser refrigerada por um período máximo de 24 horas entre 2ºC e 8ºC. Se a análise não for efectuada durante este período, pode-se conservar o soro a uma temperatura inferior a -10ºC (Caspi et al., 1984), durante um tempo superior a três meses (Riley e Zontine, 1972 citado por Kjelgaard-Hansen, et al., 2003).
Para que não haja alterações nos valores de PCR, devem-se evitar amostras de sangue hemolisadas, lipémicas ou bilirrubinémicas. A hemólise leva a aumentos da concentração desta proteína e tanto a bilirrubina como a presença de triglicéridos levam a uma diminuição. Os anticoagulantes também podem alterar os valores, como por exemplo o citrato, que leva a uma diminuição significativa das concentrações de proteína C reactiva (Martínez-Subiela e Céron, 2005a). Para evitar estas alterações, como já foi referido, o sangue deve ser recolhido para um tubo seco, e devem-se realizar análises hematológicas e bioquímicas