i
Mestrado Integrado em Medicina Veterinária
Ciências Veterinárias
Avaliação da analgesia e qualidade da anestesia de duas
doses de dexmedetomidina em infusão venosa contínua em
cadelas submetidas a ovariohisterectomia
José Rafael Correia Pires
Orientador:
Professor Doutor David Orlando Alves Ferreira
Co-Orientador:
Dr. Pedro Olivério Monteiro Sanches Pinto
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
VILA REAL, 2012
ii
Mestrado Integrado em Medicina Veterinária
Ciências Veterinárias
Avaliação da analgesia e qualidade da anestesia de duas
doses de dexmedetomidina em infusão venosa contínua em
cadelas submetidas a ovariohisterectomia
José Rafael Correia Pires
Orientador:
Professor Doutor David Orlando Alves Ferreira
Co-Orientador:
Dr. Pedro Olivério Monteiro Sanches Pinto
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
VILA REAL, 2012
iii
Por muitas vitórias que obtenha a mente, Por muitos dons que enriqueçam a humanidade, Não haverá no decorrer dos séculos Uma hora mais doce do que aquela Em que a esperança, a dúvida e o temor Contemplarão em profundo silêncio, Ao decretar de um cérebro audaz, Com vontade quase divina A morte da dor. WEIR MITCHELL 1896
iv
Esta tese de mestrado foi redigida segundo o novo acordo ortográfico
Todas as doutrinas apresentadas são da exclusiva
v
Resumo
Este estudo baseou-se numa infusão venosa contínua de duas doses diferentes de dexmedetomidina, sem uma prévia dose de ataque, em comparação com um grupo de animais em que era administrada uma dose de ataque. Utilizaram-se escalas de recuperação pós-cirúrgica e de analgesia.
Para o efeito foram utilizadas 21 cadelas hígidas, ASA I, aleatoriamente distribuídas em 3 grupos: o grupo controlo (CTR), com 7 cadelas e os grupos de estudo Dex1 e Dex2 ambos com 7 cadelas também.
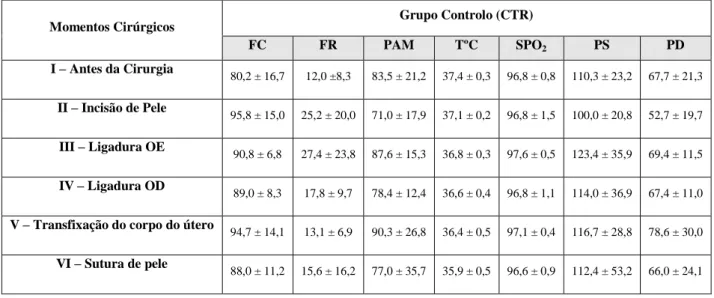
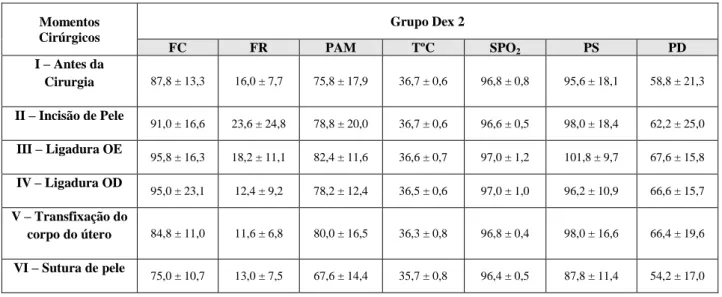
Os 21 animais foram pré-medicados com meloxicam SC (0,2 mg/kg). Após uma hora foram sedados com butorfanol (0,1 mg/kg) IM. Seguidamente os animais do grupo CTR foram pré-medicados com dexmedetomidina IM (5μg/kg). A diferença entre Dex1 (1μg/kg/h) e Dex2 (2μg/kg/h) foi a dose de CRI, mantendo-se durante todo o procedimento cirúrgico. Durante o período intra-operatório foram registados valores de pressão arterial média (PAM), frequência cardíaca (FC) e frequência respiratória (FR) para controlo de analgesia.
A homogeneidade da variância e a normalidade dos dados foram analisadas usando, respetivamente, os testes de Levene e de Shapiro Wilk. A FC, FR, PS, PD e PAM em cada momento cirúrgico foram comparadas com a baseline em cada grupo usando medidas repetidas da ANOVA com correção de Bonferroni nas comparações entre pares.
Como resultados, em relação à escala de recuperação, a média para o CTR foi significativamente mais baixa (2 ± 0,82) que para o grupo Dex 1 (3,29 ± 1,11) e Dex 2 (3,86 ± 1,07); na escala de analgesia, o CTR obteve uma média mais alta (2,43 ± 0,53) que no grupo Dex 1 (1,57 ± 0,53) e Dex 2 (1,14 ± 0,38); em relação à escala de dor da Universidade de Melbourn a média do grupo CTR foi (9,29 ± 3,45), do grupo Dex 1 foi de (6,14 ± 1,68) e do grupo Dex 2 foi (3,43 ± 1,72).
Observou-se, nas condições experimentais utilizadas que as doses de CRI utilizadas neste estudo se traduziram numa boa estabilidade hemodinâmica durante a cirurgia, assim como realizaram uma analgesia adicional em comparação com o grupo CTR.
Palavras-Chave: Dexmedetomidina, analgesia, infusão venosa contínua, ovariohisterectomia,
vi
Abstract
This study was based on continuous intravenous infusion of different doses of dexmedetomidine without a prior loading dose, compared with a group of animals which were administered a loading dose. We used scales to postoperative recovery and analgesia.
For this purpose we used 21 healthy dogs, ASA I, were randomly divided into 3 groups: the control group (CTR) with 7 bitches and study groups, Dex1 and Dex2 both with 7 bitches too.
The 21 animals were premedicated with SC meloxicam (0,2 mg/kg). After an hour were sedated with butorphanol (0,1 mg/kg) IM. Then the CTR group animals were premedicated with dexmedetomidine IM (5μg/kg). The differences between CTR and study groups (Dex1 and Dex2) was the beginning of a CRI without previous attack dose, shortly after sedation with butorphanol. The difference between Dex1 (1μg/kg/h) and Dex2 (2μg/kg/h) was the CRI dose, maintaining throughout the surgical procedure. During the intraoperative period, values were recorded: mean arterial pressure (MAP), heart rate (HR), respiratory rate (RR) to control analgesia.
The homogeneity of variance and normality of data were analyzed by using, respectively, the Levene test of Shapiro Wilk. HR, FR, SP, DP and MAP in each surgical time were compared with baseline in each group using repeated measures ANOVA with Bonferroni correction for comparisons between pairs.
Results: with respect to recovery scale, the average for the CTR was significantly lower (2 ± 0.82) than Dex 1 group (3.29 ± 1.11) and Dex 2 (1 ± 3.86 , 07); analgesia scale, the CTR scores a higher (2.43 ± 0.53) than in the Dex 1 group (1.57 ± 0.53) and Dex 2 (1.14 ± 0.38) , regarding the pain scale at the University of Melbourne the average CTR group was (9.29 ± 3.45), Dex 1 group was (6.14 ± 1.68) and Dex 2 group was (3 43 ± 1.72).
It was observed, under experimental conditions, the doses used in this CRI study was resulted in hemodynamic stability during surgery, as well as one additional analgesia performed compared with CTR group.
vii
Objetivos
O presente estudo teve o propósito de investigar o efeito analgésico, hemodinâmico, a frequência respiratória e a qualidade da anestesia da dexmedetomidina de duas infusões venosas contínuas no período intra e pós-operatório imediato, em canídeos do sexo feminino, ASA I, submetidos a ovariohisterectomia (OVH) eletiva, sob anestesia geral com isoflurano.
A base do estudo foi a comparação de duas doses de CRI de dexmedetomidina, sem dose prévia de ataque, com um grupo em que havia uma dose de ataque.
viii
Índice Geral
Introdução
... ..1I. Revisão Bibliográfica
... 31. Fármacos agonistas dos recetores alfa-2 adrenérgicos ... ..3
1.1. Introdução ... ..3 1.2. Dexmedetomidina ... ..4 1.2.1. Farmacocinética e farmacodinâmica ... ..4 1.3. Recetores alfa-adrenérgicos ... ..5 1.3.1. Classificação ... ..5 1.3.2. Localização e função ... ..6
1.4. Recetores imidazólicos e fármacos alfa-2 antagonistas ... ..8
1.5. Vantagens dos fármacos alfa-2 agonistas ... ..9
1.6. Efeitos dos fármacos alfa-2 agonistas ... ..9
1.6.1. Efeitos hemodinâmicos ... ..9
1.6.2. Efeitos cardiovasculares ... ..9
1.6.2.1. Efeitos no output cardíaco ... ..9
1.6.2.1.1. Efeito depressor direto do miocárdio ... 10
1.6.2.1.2. Diminuição da função em resposta ao aumento da pós-carga ... 10
1.6.2.1.3. Hipóxia do miocárdio e disfunção em resposta à vasoconstrição coronária ... 10
1.6.2.2. Efeitos na vasculatura e fluxo sanguíneo coronário ... 11
1.6.2.3. Ritmo cardíaco ... 12
1.6.3. Efeitos na pressão arterial... 12
1.6.4. Efeitos respiratórios ... 14
1.6.5. Efeitos nas hormonas do stress ... 14
1.6.6. Efeitos no sistema renal ... 15
1.6.7. Efeitos no sistema gastrointestinal ... 15
1.6.8. Ação antinociceptiva dos fármacos alfa-2 agonistas ... 15
1.6.8.1. Mecanismo de ação dos alfa-2 agonistas na analgesia ... 16
1.7. A dor neuropática e os alfa-2 agonistas ... 17
ix
2. Revisão Bibliográfica sobre Dor
2.1. Introdução ... 19
2.2. Definição e conceitos de dor ... 20
2.3. Conceito de nociceção... 21
2.4. Classificação da dor ... 22
2.4.1. Dor inflamatória ... 23
2.4.2. Dor fisiológica ou nocicetiva e dor patológica ... 23
2.4.3. Dor somática e dor visceral ... 23
2.5. Tipos de fibras dos nocicetores ... 24
2.6. Conceito de nocicetor ... 25
2.7. Fisiopatologia da dor ... 25
2.8. A memória da dor e plasticidade do sistema nervoso ... 26
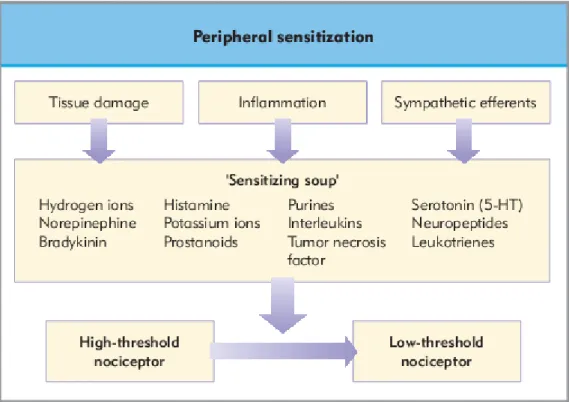
2.8.1. Sensibilização periférica... 27
2.8.2. Sensibilização central ... 28
2.9. A dor e o stress ... 29
2.9.1. Indicadores comportamentais ... 29
2.9.2. Sistema nervoso autónomo ... 30
2.9.3. Eixo neuroendócrino ... 30
2.9.4. Metabolismo ... 30
2.9.5. Sistema imunitário ... 30
2.10. Avaliação da dor ... 31
2.10.1. Examinação ... 31
2.10.2. Métodos de medição da dor ... 31
2.11. Terapêutica analgésica ... 33
2.11.1. Analgesia peemptiva e preventiva ... 34
x
II. Parte Prática
1. Material e métodos ... 36
1.1. Animais ... 36 1.2. Protocolo clínico ... 36 1.3. Análise estatística ... 402. Resultados ... 41
2.1. Resgates analgésicos ... 412.2. Dados referentes ao período intra-operatório ... 42
2.3. Escala de recuperação, escala de analgesia e escala de dor da universidade de Melbourne ... 45
2.4. Resultados relativos à análise estatística ... 46
III. Discussão ... 48
IV. Conclusão ... 53
xi
Lista de figuras e Gráficos
FIGURA 1 - Estrutura química dos enantiómeros da medetomidina. FIGURA 2 - Diferentes tipos de recetores alfa-2.
FIGURA 3 - Localização do Locus Coeruleus no cérebro.
FIGURA 4 – Vias envolvidas no processamento do estímulo doloroso. FIGURA 5 – Esquema de sensibilização periférica.
FIGURA 6 - Monitor Vetcare ® e torre anestésica. FIGURA 7 - Monitor Ohmeda ® 5250 RGM.
FIGURA 8 - Bomba infusora utilizada durante as cirurgias.
GRÁFICO 1 - Frequência respiratória média, registada durantes os momentos cirúrgicos em estudo, ao longo dos grupos.
GRÁFICO 2 – Frequência cardíaca média, registada durantes os momentos cirúrgicos em estudo, ao longo dos grupos.
GRÁFICO 3 – PAM média, registada durantes os momentos cirúrgicos em estudo, ao longo dos grupos.
GRÁFICO 4 – Resultados relativos à escala de recuperação pós-cirúrgica. GRÁFICO 5 – Resultados relativos à escala de analgesia.
GRÁFICO 6 – Resultados reativos à escala de dor da Universidade de Melboune. TABELA 1 - Classificação da dor.
TABELA 2 - Tipos de fibras nervosas responsáveis pelo estímulo nócico.
TABELA 3 - Escala de estado físico da American Society of Anesthesiologists (ASA).
TABELA 4 – Registo individual dos dados do grupo CTR, no período intra-operatório, com as devidas média e desvio padrão .
TABELA 5 – Registo individual dos dados do grupo Dex 1, no período intra-operatório, com as devidas média e desvio padrão.
TABELA 6 - Registo individual dos dados do grupo Dex 2, no período intra-operatório, com as devidas média e desvio padrão.
xii
Lista de siglas e abreviaturas
ACTH – Hormona adrenocorticotrófica ADH – Hormona antidiuréticaAINE – Anti-inflamatório não esteroide AINES – Anti-inflamatórios não esteroides AMP – Monofosfato de adenosina
AMPc – Monofosfato cíclico de adenosina
ASA I - Estado de paciente classificado como American Society of Anesthesiology I – animal saudável
ATP – Trifosfato de Adenosina CO2 – Dióxido de Carbono CRI – InfusãoVenosa Contínua CTR – Grupo Controlo
DEX1 – Grupo sujeito a infusão venosa contínua de dexmedetomidina de 1 μg\kg\h DEX2 – Grupo sujeito a infusão venosa contínua de dexmedetomidina de 2 μg\kg\h ECG – Eletrocardiograma
ETISO – End-tidal de isoflurano (valor expirado de isoflurano) FC – Frequência cardíaca
FR – Frequência Respiratória IM – Via Intramuscular IV – Via Intravenosa LC – Locus Coeruleus
MPS – Escala de dor da Universidade de Melbourne NaCl – Cloreto de sódio
NMDA – N-metil D- Aspartato
NRS -Numeric Rating Scale (Escala numérica) O2 – Oxigénio
OD – Ovário Direito OE – Ovário Esquerdo
xiii
OVH – Ovariohisterectomia PAM – Pressão arterial média PD – Pressão diastólica PS – Pressão sistólica SC - Subcutâneo
SDS - Simple Descritive Scale (Escala descritiva simples) SN – Sistema Nervoso
SNC – Sistema Nervoso Central SPO2 – Saturação parcial de oxigénio
VAS-Visual Analogic Scale (Escala visual analógica)
xiv
Agradecimentos
Gostaria de começar por agradecer a todos os meus professores, que tornaram possível a realização desta tese de mestrado, desde a minha formação até ao culminar da sua realização.
Gostaria de agradecer em especial ao Professor Doutor David Ferreira que me orientou nesta tese e me deu todo o apoio para que esta se realizasse. A si, um muito obrigado. Gostaria também de agradecer ao Dr. Pedro Olivério, pelo apoio e pela dedicação e porque nunca me deixou desistir.
Ao Dr. José Miguel Campos, pelos dossiers e por toda a ajuda que te prestaste a dar-me, um muito obrigado.
Gostaria de agradecer a todo o pessoal do HVBV pelo apoio que me deram porque foram extraordinários na forma como me trataram ao longo de todo o estágio, sem eles não seria possível a realização desta tese de mestrado.
Obrigado Dra. Sónia Miranda porque se desdobrou para que tudo isto fosse possível. Obrigado Dr. Artur Alves, Dr. Pedro Moreira, Dra Inês Fonseca, Dra Mafalda Sardinha, Dr. Hugo Vilhena, Dra Raquel, Dr. João Neves, Dra Mariana, Daniela, Cátia, Lyubov, Luciana, Dona Graça, Daniel, Nuno e dona Ana porque me ajudaram e integraram sempre no vosso grupo de trabalho.
Um obrigado às minhas companheiras de estágio porque foram impecáveis e todos fizemos um dos melhores grupos de trabalho do HVBV. Sem elas não teria sido possível realizar a minha parte prática porque me ajudaram sempre de uma forma incansável com os animais. Obrigado Inês, Marta Domingues, Teresinha, Marta Lemos, Tatiana, Nádia, Joana e Margarida.
Obrigado a todos os meus amigos da universidade porque foram inesquecíveis no meu percurso académico. Em especial quero agradecer ao Marco, Vera, Diana e Inês porque não há palavras para a vossa amizade e para a ajuda que me deram estes anos todos, um muito obrigado a vocês. Agradeço também à Ana da Sebenta por todo o percurso académico.
Por fim, quero agradecer a toda a minha família porque me ajudou neste percurso e tornou possível a realização desta tese. Em especial quero agradecer aos meus avós porque são uma ajuda como não há e quero agradecer aos meus pais porque eu não conseguia superar sem eles.
1
Introdução
Este trabalho foi realizado durante o meu estágio curricular final, parte integrante do plano curricular do Mestrado Integrado em Medicina Veterinária, na instituição de ensino Universidade de Trás-os-Montes e Alto Douro e decorreu no Hospital Veterinário do Baixo Vouga (HVBV), em Segadães, Águeda. A componente prática foi realizada em animais de companhia, durante 6 meses (de 1 de Setembro de 2012 a 1 de Março de 2012), realizados em horários rotativos. Durante este estágio acompanhei as áreas mais generalistas, como medicina interna, cirurgia, anestesia, imagiologia, consultas externas de várias especialidades e mais específicas de fisioterapia, oncologia, oftalmologia, cardiologia, neurologia, dermatologia, gastroenterologia, unidade de cuidados intensivos e recobro, serviço de laboratório e alguns casos de animais exóticos. Durante o estágio foi possível também acompanhar a unidade de emergência do hospital durante os bancos noturnos e consolidar alguns conhecimentos nessa área, assim como ainda tive oportunidade de acompanhar algumas consultas de domicílio.
O estágio na área particular de anestesia foi muito importante para reforçar e consolidar alguns conhecimentos relativamente aos fármacos utilizados, aparelhos de anestesia, monitorização anestésica, planos de analgesia intra e peri-operatória, avaliação de planos anestésicos, intubação, entre outros.
Foi possível assistir a uma anestesia específica de uma cirurgia oftalmológica e também a anestesias específicas para patologia gastrointestinal, hepática, renal, pancreática, esplénica, cardíaca, neurológica, ortopédica, oncológica, reprodutiva, entre outras patologias que afetam vários sistemas e que necessitam de uma anestesia mais cuidada. Tive a oportunidade de assistir à sedação de cães e gatos em situações muito diversas.
Foi importante também observar outras áreas da anestesia, nomeadamente a anestesia loco-regional, principalmente nas cirurgias ortopédicas.
Foi possível também ter uma excelente formação na monitorização anestésica do pré e pós-cirúrgico, bem como do momento cirúrgico e de todos os aparelhos de anestesia e ventilação.
A casuística presente no HVBV foi a base para colocar em prática e conjugar conhecimentos adquiridos durante as aulas teóricas e práticas e ganhar alguma experiência nas mais diversas áreas dos animais de companhia. Através deste contacto com diversos casos
2
clínicos foi possível interligar a componente teórica aprendida durante as unidades curriculares com a componente prática presente no hospital. Assim, tive contacto com os tratamentos instituídos, aplicados a cada caso em particular, bem como com todo o maneio exigido durante o internamento dos animais e durante os períodos cirúrgicos e pós-cirúrgicos. Após a alta dos animais tive a possibilidade de assistir a algumas consultas de controlo para perceber o seu estado de evolução.
Assim, este estágio foi fundamental para me preparar para o futuro enquanto profissional, levando-me também a compreender as particularidades inerentes a cada espécie em particular, tanto canina como felina.
Foi ainda possível a realização de dois posters no âmbito do VIII Congresso do Hospital Veterinário do Montenegro intitulados “Diabetes Mellitus Juvenil: relato de um caso clínico” e “Aspergilose Nasal Canina: Tratamento por infusão de clotrimazol com trepanação dos seios frontais”.
Durante o estágio foi-me dado todo o apoio e foram-me possibilitadas todas as condições necessárias para a realização da tese de mestrado.
3
I. Revisão bibliográfica
1. Fármacos agonistas dos recetores alfa-2 adrenérgicos
1.1. Introdução
Os fármacos agonistas dos recetores adrenérgicos alfa-2, na década de 60, foram maioritariamente utilizados como descongestionantes nasais e uma amostra de um composto novo naquela época, atualmente conhecido como clonidina, foi testado em humanos. Foram colocadas algumas gotas nas narinas de uma mulher com gripe. Ela adormeceu e assim permaneceu por 24 horas, desenvolvendo posteriormente hipotensão e bradicardia severa. Testes seguintes provaram que a clonidina tem uma ação antihipertensiva (Stahle, 1982, citado por Bacchiega et al., 2008).
Desde então, esta classe de fármacos passou a ser utilizada no tratamento de pacientes com hipertensão e em adictos a drogas e álcool. Hoje, as suas aplicações terapêuticas expandiram-se a fim de promover os seus efeitos simpatolíticos, sedativos, hipnóticos, analgésicos, miorrelaxantes e ansiolíticos (Kamibayashi et al., 2000; Tamura et al., 2002). O desenvolvimento destes fármacos altamente seletivos e específicos despertaram na medicina humana o interesse pela sua reintrodução na prática anestésica. No final de 1999, nos Estados Unidos, o Food and Drug Administration (FDA) aprovou o uso da dexmedetomidina para fins sedativos e analgésicos em pacientes do Centro de Terapia Intensiva (CTI) (Scholz et al., 2000, citado por Bacchiega et al., 2008).
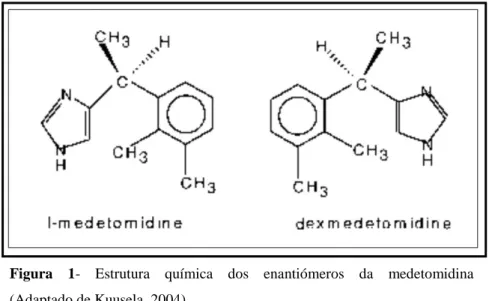
A medetomidina é um potente e seletivo alfa-2 adrenorecetor agonista que contém partes iguais de dois enantiómeros óticos, dexmedetomidina e levomedetomidina.
A dexmedetomidina é o composto farmacologicamente ativo desta mistura racémica (Vickery & Maze, 1988) e em cães os seus efeitos são comparáveis com os da medetomidina (Kuusela, 2004). É considerado o mais potente e seletivo alfa-2 agonista comercializado atualmente (Uilenreef, 2008).
4 1.2. Dexmedetomidina
1.2.1. Farmacocinética e farmacodinâmica
A dexmedetomidina, monocloridrato de (+)-4-[1-(2,3-dimetilfenil)etil]-1H-imidazol; Dexdomitor® é mais seletivo (2:1) que a medetomidina (1640:1), clonidina (200:1),
detomidina ou xilazina (Virtanen et al. 1988;Aantaa et al. 1993).
A dexmedetomidina contém elevada afinidade para os recetores alfa-2 e contém também um grupo imidazol na sua estrutura química, mas a sua afinidade para os recetores imidazóis é mais fraca (Wikberg et al., 1991; Khan et al., 1999b, citado por Kuusela, 2004).
Por outro lado, a levomedetomidina, enantiómero ótico da dexmedetomidina, parece não exercer ação sedativa nem analgésica (Kuusela et al., 2000).
Em anestesia com propofol e isoflurano, em cães, sabe-se que a dexmedetomidina é um fármaco tão seguro e eficaz como a medetomidina para pré-medicação (Kuusela et al., 2001).
Existem também resultados que sugerem que uma combinação de medetomidina com butorfanol ou quetamina resulta numa sedação mais eficaz e confiável que apenas com medetomidina (Ko et al., 2000).
A dexmedetomidina tem uma completa biotransformação, através de glucuronidação e metabolismo pelo citocromo p450, tudo processo hepático, com uma ligeira excreção de moléculas não modificadas nas fezes e na urina. Caso o paciente seja insuficiente hepático a dose de dexmedetomidina terá que ser baixada, dado que tem uma menor taxa metabólica sobre o
Figura 1- Estrutura química dos enantiómeros da medetomidina (Adaptado de Kuusela, 2004)
5
fármaco na forma ativa. Os metabolitos resultantes da biotransformação são 95% excretados na urina e 4 % nas fezes. O tempo de semi-vida de eliminação é aproximadamente 2 horas (Gertler et al., 2001).
A dexmedetomidina exibe uma cinética linear quando infundida nas doses de 0,2 a 0,7 µg/kg/h por mais de 24 horas. A fase de distribuição é rápida, com uma semi-vida de distribuição de 6 minutos (Gertler et al., 2001).
A percentagem de ligação da dexmedetomidina às proteínas plasmáticas é de 94% e foi testado se esta ligação podia ser destabilizada pelo fentanil, teofilina, digoxina e lidocaína e isso não aconteceu. Não houve, também, uma diferença significativa no perfil farmacocinético deste fármaco, baseado no sexo e idade. A farmacocinética da molécula ativa da dexmedetomidina não sofreu alterações em pacientes com insuficiência renal (Gertler et al., 2001).
A farmacodinâmica será avaliada nos tópicos seguintes de uma forma mais pormenorizada, em relação aos fármacos alfa-2 agonistas na generalidade.
1.3. Recetores alfa-adrenérgicos
Os recetores alfa-adrenérgicos medeiam ações de noradrenalina e adrenalina (Kuusela, 2004).
1.3.1. Classificação
Os recetores alfa-adrenérgicos estão divididos em dois tipos diferentes: alfa-1 e alfa-2, de acordo com as suas diferentes afinidades agonista e antagonista (Kuusela, 2004).
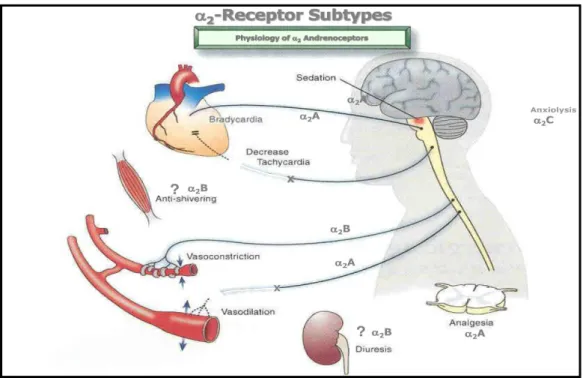
Três diferentes iso-recetores foram definidos em termos de afinidade por ligandos alfa recetores: alfa-2A, 2B e 2C (estabelecidos por diferenças nas propriedades farmacológicas). É sabido também que tanto os fármacos alfa-2 agonistas como os antagonistas têm afinidades semelhantes para estes recetores (Bylund, 1985).
6 1.3.2. Localização e função
A consequência mais importante da estimulação dos recetores alfa-2 é a inibição da Adenil ciclase, resultando na diminuição da formação de AMP cíclico (AMPc), um importante regulador da função celular. Por sua vez, a menor formação de AMPc causa atenuação da ativação das proteínas reguladoras, impedindo a sua fosforilação e a resposta biológica celular é alterada (Aghajanian and VanderMaelen, 1982).
O adrenorecetor alfa-2 é um recetor ligado à proteína da transmembrana G (Khan et al., 1999), encontrada pré, pós e extra-sinaticamente em diferentes tecidos. (Paton & Vizi, 1969; Wikberg, 1979). Mecanismos efetores alternativos incluem ativação da proteína G, que promovem a abertura dos canais de potássio, causando uma hiperpolarização neuronal que vai contribuir para diminuição da excitação dos neurónios do SNC e sedação (por inibição do Locus Coeruleus (LC) no cérebro) (Aghajanian and VanderMaelen, 1982; Bagatini et al., 2002).
Por outro lado, a estimulação dos recetores alfa-2 resulta também na inibição de neurotransmissores, causado pela diminuição na condução nos canais de cálcio (Lipscombe, K. et al., 1989).
Os recetores alfa-2 pré-sináticos regulam a libertação de noradrenalina e ATP, apresentando um mecanismo de retroalimentação negativo, inibindo desta maneira a libertação de noradrenalina quando ativados (Bagatini et al., 2002; Langer, 1981).
Figura 2 – Diferentes tipos de receptores alfa-2.
7
Os recetores alfa-2 pós-sináticos têm uma função distinta consoante o número de recetores no fígado, pâncreas, plaquetas, rim, tecido adiposo e olho (Murrel, J. et al., 2005).
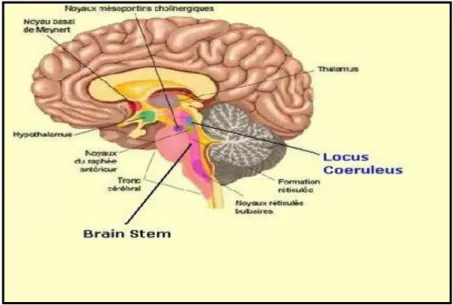
O LC é um pequeno núcleo neuronal localizado bilateralmente e é o local, no cérebro onde existe uma maior quantidade de células noradrenérgicas. É um importante modulador da vigília e um importante centro responsável pela função sedativa destes fármacos (Scheinin and Schwinn, 1992; Williams et al., 1985).
Uma grande densidade de recetores alfa-2 é também encontrada no nervo vago, nas células intermedio-laterais, na substância gelatinosa e no corno dorsal da medula espinhal, onde os neurónios sensoriais primários contêm tanto recetores alfa-2A como alfa-2C (Murrel, J. et al., 2005).
A localização dos recetores alfa-1 é pós-sinática e a sua ativação resulta numa libertação de noradrenalina, enquanto dos alfa-2, resulta numa inibição da libertação de noradrenalina pelos terminais simpáticos (Langer, 1981, citado por Kuusela, 2004). Ambos os recetores têm um papel importante na regulação do tónus vascular e da pressão arterial, mas a sua contribuição para a vasoconstrição e vasodilatação varia consoante as espécies (Piascik et al., 1996, citado por Kuusela, 2004). Sabe-se também que a dexmedetomidina ativa os recetores alfa-2 adrenérgicos no sistema nervoso central e na vasculatura periférica (Coughlan et al., 1992).
Figura 3 – Localização do Locus Coeruleus no cérebro.
8
O subtipo alfa-2A regula principalmente a libertação de neurotransmissores pelos neurónios adrenérgicos (Macdonald & Sheinin, 1995, citado por Kuusela, 2004). Em linhas geneticamente modificadas de ratinhos, verificou-se que os adrenorecetores alfa-2A eram os mais responsáveis pelo efeito sedativo, antinocicetivo, redução de outros anestésicos e ação hipotérmica (Hunter et al., 1997; Lakhlani et al., 1997). Este recetor tem também um papel hipotensor importante (MacMillan et al., 1996). Este subtipo também é considerado o principal mediador para a analgesia espinhal (Stone et al., 1997; Guo et al., 1999), sendo necessário para um sinergismo analgésico com os opióides (Stone et al., 1997).
Segundo alguns autores, o subtipo alfa-2B foi encontrado apenas no tálamo e músculo liso vascular. Contudo, os antagonistas não mostram diferente afinidade para os subtipos dos recetores alfa-2 (MacDonald and Scheinin, 1995). Os recetores alfa-2B presentes no músculo liso vascular são cruciais porque levam a uma hipertensão periférica logo após a administração destes fármacos (Link, D. et al., 1996). Isto contrasta com a ação hipotensora dos recetores alfa-2A (Kuusela, 2004).
Finalmente, o subtipo alfa-2C contribui também para analgesia espinhal e sinergismo adrenérgico-opióide (Fairbanks et al., 2002), ação hipotérmica e modulação da atividade dopaminérgica (Sallinen et al., 1997), mas ao mesmo tempo não produz efeitos hemodinâmicos (Link, D. et al.,1996, citado por Kuusela, 2004).
1.4. Recetores imidazólicos e fármacos alfa-2 antagonistas
A dexmedetomidina pode também exercer a sua ação nos recetores imidazólicos noradrenérgicos presentes no cérebro, pâncreas e rim. Estes estimulam a nível central uma ação hipotensora (por recetores na medula ventral [Ernsberger et al., 1990; Macdonald & Sheinin, 1995; McCallum et al., 1998]) e anti-arritmogénica (Hieble and Ruffolo, 1995; Khan et al., 1999). Outros autores verificaram também uma ação anti arritmogénica induzida por adrenalina (Hayashi et al.,1991; Khan et al., 1999b).
A reversão dos efeitos dos fármacos alfa-2 agonistas com alfa-2 antagonistas (por exemplo: atipamezole; iombina; tolazina; idaxozan), permite uma rápida recuperação e boa qualidade, porém existem grandes diferenças entre eles, principalmente quanto à seletividade alfa-2 adrenérgica destes agentes (Selmi et al., 2001; Uilenreef et al., 2007; Neto, 2009; citado por Campos J., 2010).
9
Existem referências que nos mostram que a recuperação com atipamezole é geralmente rápida e de boa qualidade (Verstegen et al., 1990; Young et al., 1990; Hellebrekers & Sap, 1997; Hellebrekers et al., 1998).
1.5. Vantagens dos Fármacos alfa-2 agonistas
Estes fármacos têm como principais vantagens realizar uma potente ansiólise e sedação (Murrel, J. et al., 2005; Guan-Yulin, 2008), redução da quantidade de outros anestésicos, requisito necessário para produzir condições para a cirurgia (Young, 1990; Ewing et al., 1993; Hammond, 1994), provisão de analgesia (Pypendop, B., 1994) e reversibilidade (Bartram, D., 1994).
1.6. Efeitos dos fármacos alfa-2 agonistas
1.6.1. Efeitos hemodinâmicos
Está comprovado que estes fármacos têm influência no fluxo sanguíneo a nível da artéria coronária e na demanda de oxigénio a nível do miocárdio. Os efeitos hemodinâmicos no cão são descritos como uma resposta bifásica da pressão sanguínea com diminuição do ritmo cardíaco, aumento da resistência vascular periférica e pressão venosa central. São registadas alterações mínimas na pressão arterial pulmonar (Bloor et al., 1992; Pypendop & Verstegen, 1998; Kuusela et al., 2000).
Investigando da dependência da dose de medetomidina em cães, descobriu-se que independentemente da dose ser de 1 até 20 μg/kg (associada a maior resistência vascular periférica) (Kuusela et al., 2000), as alterações hemodinâmicas são similares mas menores nas doses de 1 e 2 μg/kg. Até 5 μg/kg IV as alterações cardíacas são menores. As doses mais elevadas causaram um pequeno efeito adicional na função cardiovascular. Isto demonstrou uma limitada faceta dose-dependente nos efeitos cardiovasculares, por parte deste fármaco (Murrel, J. et al., 2005).
1.6.2. Efeitos Cardiovasculares
1.6.2.1. Efeitos no output cardíaco
Há estudos que indicam que o output cardíaco diminui após a administração de alfa-2 agonistas em cães (Vickery et al., 1988; Bloor et al., 1992; Flacke et al., 1993; Pypendop & Verstegen, 1998). O mecanismo preciso não é conhecido, contudo são sugeridos alguns
10
mecanismos (citado por Murrel, J. et al., 2005): efeito depressor direto do miocárdio, diminuição da função em resposta ao aumento da pós-carga causada pelos efeitos hemodinâmicos; hipóxia do miocárdio e disfunção em resposta à vasoconstrição coronária.
1.6.2.1.1. Efeito depressor direto do miocárdio
Há estudos que sugerem que que os alfa-2 agonistas não possuem realmente um efeito depressor do miocárdio (Housmans, 1990; Coughlan et al., 1992; Flacke et al., 1992). À partida, a depressão não é mediada por alfa-2 agonistas mediante os fatores depressores cardíacos (Flacke et al., 1993).
Assim, e também segundo Housmans et al., 1990, a dexmedetomidina parece não ter efeitos contráteis intrínsecos no miocárdio.
1.6.2.1.2. Diminuição da função em resposta ao aumento da pós-carga
O aumento da pós-carga é resultante de um aumento da resistência vascular periférica. Bloor et al., 1992 estudaram que após a administração de nifedipina os efeitos da diminuição do output cardíaco decresciam, ao diminuir a resistência vascular periférica. Também eram reduzidas as catecolaminas em circulação, diminuindo desta forma a inotropia, limitando assim o volume sistólico em face da pós-carga aumentada. Contudo, a resistência vascular periférica por si só não consegue causar toda esta depressão cardíaca registada em cães, o que é de facto sugerido por vários estudos que indicam que o output cardíaco continua normal mesmo quando há um aumento da pós-carga, até mesmo num coração desinervado (Zandberg et al., 1984; Woodman & Vatner 1986; Flacke et al., 1992). Já Woodman, 1986 referiu que uma estimulação pós-sinática dos recetores alfa-1 e alfa-2 agonistas, com as vias reflexas bloqueadas, aumenta a pressão arterial e a resistência periférica mas não altera de forma significativa o ritmo cardíaco nem o output cardíaco.
1.6.2.1.3. Hipóxia do miocárdio e disfunção em resposta à vasoconstrição coronária
O fluxo sanguíneo coronário é predominantemente determinado pelo metabolismo e não por influências neurológicas. Tanto os recetores alfa-1 como os alfa-2 encontram-se nas veias coronárias e a sua estimulação reduz o diâmetro das artérias e a perfusão sob certas condições (Murrel, J. et al., 2005).
A hipóxia do miocárdio resultante da diminuição do fluxo coronário tem sido estudada como causa de uma disfunção miocárdica, após a administração de dexmedetomidina (Coughlan
11
et al., 1992; Flacke et al., 1993; Lawrence et al., 1996a; Roeckerts et al., 1996b). O efeito direto dos alfa-2 agonistas no fluxo sanguíneo coronário, segundo alguns autores está ainda sob investigação e é um pré-requisito para perceber como eles afetam o relacionamento entre a disponibilidade de oxigénio (O2) e a extração de O2 e como isto influencia a contractilidade
cardíaca. O atipamezole parece reverter todas as alterações (Flacke et al., 1993).
1.6.2.2 Efeitos na vasculatura e fluxo sanguíneo coronário
Os recetores alfa-1 encontram-se na parte proximal e os alfa-2 encontram-se na parte distal das veias coronárias. Uma dose elevada de dexmedetomidina causa vasoconstrição das veias coronárias a nível proximal que não são antagonizáveis pelo atipamezole, sugerindo que uma alta dose de alfa-2 agonistas pode estimular também os recetores alfa-1 a nível proximal (Murrel, J. et al., 2005).
Um estudo refere que uma vasoconstrição causada por doses inapropriadas de dexmedetomidina pode causar hipóxia do miocárdio (Murrel, J. et al., 2005), no entanto, Roeckerts et al., 1996b referem que este fármaco não altera o consumo de oxigénio do miocárdio, reduzindo a deficiência em oxigénio do miocárdio isquémico. Também Lawrence et al., 1996a estudaram que a administração de dexmedetomidina não compromete o fluxo sanguíneo ao cérebro, coração, fígado e rins.
Assim, apesar de todos os efeitos a nível coronário da dexmedetomidina, o fluxo sanguíneo parece permacecer num nível elevado de controlo metabólico, ou seja, parece que existe ainda “estabilidade a nível metabólico”, mas mesmo assim, é importante investigar o estado coronário dos animais antes de os anestesiar (Murrel J. et al., 2005).
Apoiando outros estudos, Roacherts et al., 1996a, descobriram que doses de dexmedetomidina de 1 a 10 μg/kg diminuiram o fluxo sanguíneo em todas as camadas miocárdicas e isto estava associado com um aumento da resistência vascular periférica.
Em contraste com os estudos em animais anestesiados (aumento da resistência vascular periférica e diminuição do fluxo vascular), a dexmedetomidina não provocou efeito a nível coronário em cães conscientes (Shmeling et al., 1991).
A redução no fluxo sanguíneo coronário é identificada em todos os estudos prévios e está associada com um aumento da extração de O2 através da vasculatura coronária, que vai para o
12
miocárdio (Flacke et al., 1993). Isto acontece porque como a reserva de extração é menor, a demanda de O2 para o miocárdio evoca maior fluxo do que o normal, então aumenta a extração
do que seria esperado, justificando desse modo uma grande redução do fluxo sanguíneo. Dentro da mesma ordem de ideias, Roekaerts et al., (1996a) indicam que um fluxo coronário reduzido num miocárdio normal depois da administração de dexmedetomidina não está associado com alterações de extração de oxigénio e de lactato.
Em modo de conclusão, apesar de haver um aumento da pós-carga (que aumenta o trabalho do miocárdio), parece que existe redução da demanda de O2 ao miocárdio com a administração
de alfa-2 agonistas, havendo vários estudos que sugerem que isto não está associado com hipóxia do miocárdio, pelo menos em cães com a função cardiovascular normal (Murrel et al., 2005). Assim, permanece ainda difícil de ligar o uso da dexmedetomidina e a sua vasoconstrição coronária com hipóxia do miocárdio e redução do output cardíaco (Murrel et al., 2005).
Em relação à oxigenação dos tecidos, os dados que existem atualmente indicam que a redução do output cardíaco induzida pelos alfa-2 agonistas não causa hipoperfusão dos órgãos vitais em cães saudáveis (Murrel et al., 2005).
1.6.2.3. Ritmo cardíaco
Uma estimulação vagal aumenta o período refratário do miocárdio e diminui a probabilidade de arritmias (Corr et al., 1986; Kamibayashi et al., 1995a). Existe evidência que o efeito antiarrítmico da dexmedetomidina se deve mais aos recetores imidazólicos que propriamente aos recetores alfa-2. Há uma grande concentração de recetores imidazólicos em áreas do cérebro envolvidas no controlo nervoso autónomo e os efeitos estão provavelmente ligados a estimulação vagal. Isto dá uma razão para evitar a co-administração de fármacos anti-muscarínicos e alfa-2. A segunda razão é baseada nas consequências adversas da cronotropia positiva na oxigenação do miocárdio (Lemke et al., 1992; Alibhai et al., 1996; Kamibayashi et al., 1995a).
A abolição do efeito antiarritmogénico da dexmedetomidina pela atropina sugere que a atividade vagal para o coração é um fator crítico (Kamibayashi et al., 1995a).
1.6.3. Efeitos na Pressão Arterial
Após a administração de alfa-2 agonistas, ocorre inicialmente uma resposta de pressão arterial de forma bifásica, seguida de uma sustentada bradicardia (Shmelling et al., 1991; Flacke et al., 1993; Lawrence et al., 1996b; Pypendop & Vertsegen, 1998).
13
Em cães, estes efeitos podem então resultar numa redução do ritmo cardíaco até 50% e numa redistribuição do fluxo sanguíneo, que causa redução do fluxo a nível dos shunts arteriovenosos e na pele (Bloor et al., 1992; Lawrence et al., 1996b; Pinto et al., 2008).
O inicial aumento na pressão sanguínea deve-se a uma vasoconstrição periférica por ativação dos recetores alfa-2 no músculo liso periférico. Isto está associado a aumento do tónus vagal e também decréscimo da frequência cardíaca (fase 1). Seguidamente a pressão sanguínea baixa por uma diminuição da vasoconstrição, predominando um efeito hipotensivo central (fase 2) (Murrel, J. et al., 2005).
O sistema nervoso simpático está deprimido e esta fase está associada com uma diminuição prolongada do ritmo cardíaco. O local exato dos recetores que causam hipotensão a nível central são desconhecidos, mas em parte podem estar mediados pelos recetores alfa-2 na medula ventral (Ernsberger et al., 1990; Mcdonald & Sheinin, 1995; McCallum et al., 1998, citados por Kuusela, 2004). Os recetores alfa-2 pós-sináticos e os recetores imidazólicos no tronco cerebral também estão provavelmente envolvidos. Em relação ao efeito sedativo os recetores alfa-2 são os que estão provavelmente envolvidos (Tibirica et al., 1991).
A bradicardia, normalmente observada depois da administração dos alfa-2 agonistas durante a fase 2, pode resultar numa ação simpaticolítica central que deixa a atividade eferente vagal não afetada (Murrel, J. et al., 2005).
No entanto, segundo Pypendop & Vertsegen, 1998; Kuusela et al., 2003, os alfa-2 agonistas não foram ligados à hipotensão, o que sugere que mesmo com uma anestesia de isoflurano e propofol, que são vasodilatadores e como tal hipotensores, a pressão arterial média se tenha mantido acima de 80 mmHg a qualquer dose.
A baixas doses, os efeitos centrais predominam e a pressão arterial carotídea e a sanguínea não baixam muito (Pypendop & Verstegen, 1998). Outros autores também encontraram resultados semelhantes (Vickery et al., 1988; Bloor et al., 1992; Thurmon et al., 1994; Hellebrekers & Sap, 1997; Ko et al., 2000; Kuusela et al., 2000, 2001), sugerindo que a ação de vasoconstrição periférica dos alfa-2 agonistas se verifica durante a anestesia de isoflurano e propofol, onde fica preservada. Thurmon et al., 1994, dizem que uma infusão venosa contínua de propofol (vasodilatador) parece aliviar a vasoconstrição induzida pela dexmedetomidina.
14 1.6.4. Efeitos respiratórios
Após a administração de dexmedetomidina ou medetomidina IV ou IM, a frequência respiratória diminui com mínimos efeitos sobre os valores gasosos sanguíneos (Vainio, 1989; Schmeling et al., 1991; Venugopalan et al., 1994; Kramer et al., 1996). Nguyen et al., 1992, descobriram também que a doses baixas de dexmedetomidna a ventilação diminui, mas a doses acima dos 20 μg/kg o CO2 expirado diminui e o O2 expirado aumenta, quando comparado com
valores base em animais acordados. Alguns autores sugerem que este efeito pode ser relacionado com o recetor alfa-1 agonista. Contudo, mostrou-se que dexmedetomidina IV de uma forma dose-dependente reduz a resposta à hipercapnia (Nguyen et al., 1992; Sabbe et al., 1994).
Alguns autores mostraram também que uma combinação de dexmedetomidina IV em infusão com isoflurano causa uma menor depressão respiratória que apenas uma anestesia só com isoflurano, à mesma profundidade anestésica (Bloor et al., 1989, citado por Kuusela, 2004).
1.6.5. Efeitos nas hormonas do stress
Dexmedetomidina IV reduz o nível de catecolaminas em circulação em cães (Schmeling et al., 1991; Bloor et al., 1992b; Flacke et al., 1993; Roekaerts et al., 1996, 1997; Willigers et al., 2003).
Foi também reportado que uma dose muito elevada deste fármaco faz com que haja libertação de catecolaminas a partir do coração em cães (Flacke et al., 1992).
Após toracotomia, os níveis de catecolaminas foram menores em cães que receberam medetomidina IM que nos que receberam buprenorfina (Vainio & Ojala, 1994).
Doses clínicas de medetomidina IM não revelaram influência nos níveis de cortisol em cães (Ambrisko & Hikasa, 2002) mas houve um atraso na resposta do cortisol induzida pela OVH (Benson et al., 2000; Ko et al., 2000).
Em cadelas submetidas a OVH os níveis de catecolaminas e cortisol foram menores em premedicação com medetomidina IM que com acepromazina. Contudo, a concentração de beta-endorfina não diferiu entre os grupos pré-medicados (Väisänen et al., 2002, citado por kuusela, 2004).
Já Willigers et al., 2003 mostrou que em cães sob cirurgia torácica (induzida isquémia miocárdica), uma infusão de dexmedetomidina de 0,6 µg/kg/h não teve efeito nos níveis de cortisol plasmático.
15
Lamont et al., 2012, estudando duas CRI de medetomidina durante 8 horas (Med1 com uma dose de ataque de 2μg/kg e infusão de 1μg/kg/h e Med2 com uma dose de ataque de 4μg/kg e infusão de 2μg/kg/h), chegaram à conclusão que ambas as doses diminuíram os níveis de norepinefrina. No entanto foram menores em Med2, embora sem diferenças muito significativas. Em relação a epinefrina, cortisol, glucose ou insulina não se notaram alterações significativas.
1.6.6. Efeitos no sistema renal
Os alfa-2 agonistas induzem diurese nos animais, no entanto o mecanismo pode variar consoante a espécie. Em estudos realizados com clonidina verificou-se que há uma diminuição da libertação de ADH em cães anestesiados (Maze & traquilli, 1991). Já Junior, 2003 verificou que em cães sob anestesia geral a dexmedetomidina causa diurese, não associado com quaisquer alterações hemodinâmicas, mas associada a uma redução dos níveis plasmáticos de vasopressina.
1.6.7. Efeitos no sistema gastrointestinal
O fluxo salivar é reduzido com os alfa-2 agonistas devido à ativação a nível vagal que inibe a libertação de ácido gástrico através das células parietais. Estes fármacos reduzem também a motilidade gástrica e do intestino delgado, inibindo a secreção de iões e água no intestino grosso. Está reportado também que a clonidina foi usada com sucesso no tratamento de diarreias aquosas (Maze & tranquilli, 1991).
1.6.8. Ação antinociceptiva dos fármacos alfa-2 agonistas
Os alfa-2 agonistas têm uma ação antinocicetiva potente em estudos experimentais e clínicos em animais (5μg/kg + 0,3 μg/kg/h, em CRI de clonidina diminui as necessidades de morfina no período pós-operatório) (Maze& Tranquilli, 1991; Pertovaara, 1993). Contudo, o seu uso para sedação de uma forma corrente limita o seu uso para uma ação analgésica, mas sabe-se na mesma que se for usado como pré-anestésico a sua ação antinocicetiva contribuirá para uma analgesia intraoperatória (Murrel, J. et al., 2005).
Há dados que confirmam que existe um sinergismo entre os alfa-2 agonistas e os opióides (Ossipov et al., 1990). Já Valtolina, C., 2009 refere que uma CRI de dexmedetomidina é tão efetiva como uma CRI de morfina para produzir analgesia no período pós-operatório.
Há estudos que comprovam que há uma forte ligação aos recetores alfa-2 na substância gelatinosa e nas colunas intermediolaterais da espinal medula e a proporção dos alfa-2 estão
16
localizados nos terminais aferentes primários (Unnerstall et al., 1984; Yaksh, 1985), sugerindo uma ação espinal direta dos alfa-2 agonistas. Estes são do tipo alfa-2A (Uhlén & Wikberg, 1991).
Contudo, devido à sua localização muito difusa, a estimulação dos recetores alfa-2 pode suprimir sinais nocicetivos em vários pontos: inibindo a libertação do neurotransmissor pelas fibras aferentes primarias até aos neurónios de segunda ordem; afetando a modulação dos sinais nociceptivos nos neurónios pré e pós-sinápticos, ocorrendo de forma segmentada no corno dorsal; influenciando os sistemas modeladores descendentes do tronco cerebral; alterando a modulação ascendente dos sinais nocicetivos do diencéfalo e áreas límbicas.
Alguns estudos demonstraram que o facto de este fármaco ter também um efeito sedativo complica as conclusões acerca do seu efeito nocicetivo (Pertovaara, 1993).
1.6.8.1. Mecanismo de ação dos α-2 agonistas na analgesia
Os alfa-2 agonistas produzem analgesia, pelo menos em parte por um mecanismo espinhal (Xu et al., 2000). Outros estudos, em ratinhos, (Hamalainen & Pertovaara, 1995) mostraram que a dexmedetomidina suprime o estímulo das fibras C no corno dorsal da medula espinhal, sugerindo que a inibição seletiva do estímulo nócico ocorre nos terminais aferentes pré-sináticos. Isto foi também confirmado através do trabalho de outros autores que a seguir se mencionam: Belcher et al., 1978; Fleetwood-Walter et al., 1985; Sullivan et al., 1992. Apesar do que anteriormente citei, há evidências anatómicas que suportam uma contribuição inibitória (Carlton et al., 1991), estando também comprovado que a ativação dos recetores alfa-2 diminui a atividade espontânea nos neurónios nocicetivos do corno dorsal.
O LC é reconhecido como um local importante de ação dos alfa-2 agonistas, induzindo sedação (Williams et al., 1985) e o seu papel na antinocicepção tem sido investigado. Guo et al., 1996 comprovaram a existência de antinocicepção em roedores a doses em que não havia concentrações detetáveis na medula epinhal, sendo posteriormente revertidos por antagonistas alfa-2. Isto sugere que a estimulação dos recetores alfa-2 no LC causa antinocicepção cuja ativação é na medula espinhal.
17
Por outro lado, sabe-se que a dexmedetomidina provoca inibição do locus coeruleus. Há uma diminuição da noradrenalina e libertação de norepinefrina que ativa os recetores espinhais e produz antinocicepção (Murrel, J. et al., 2005).
Uma via neuro-anatómica da dexmedetomidina que induz depressão da atividade do LC, faz com que aumente a concentração de norepinefrina na espinhal medula, o que ativa os recetores alfa-2, como sugeriu Guo et al., 1996.
Alguns destes investigadores anteriores sugeriram que a supressão da dor ocorre pelo aumento da concentração da norepinefrina no LC e noutras zonas dos neurónios descendentes noradrenérgicos.
1.7. A dor neuropática e os alfa-2 agonistas
Os alfa-2 agonistas podem atenuar ou até mesmo reverter a alodinia e são um complemento para a dor neuropática. A dor neuropática é de difícil tratamento e os alfa-2 podem ter potencial para tratar a dor opióide-resistente (Murrel, J. et al., 2005).
Lervik, Haga et al., 2012 realizaram um estudo experimental que confirma que sob condições clínicas, a dexmedetomidina pode reduzir o risco do desenvolvimento de dor crónica na fase pós-operatória.
1.8. Infusão venosa contínua de dexmedetomidina (CRI)
Há estudos que referem que as doses de dexmedetomidina dadas na pré-anestesia devem ser reavaliadas após 60 minutos e a dose deve ser repetida, daí que uma infusão contínua de dexmedetomidina potencialmente manterá os níveis de fármaco adequados no plasma e não será necessário haver esse re-doseamento (Uilenreef et al., 2008).
Está também indicado que uma CRI de dexmedetomidina é um bom complemento ao isoflurano na manutenção de uma anestesia de um canídeo ASA I-II. Os dados evidenciam uma boa perfusão tecidular e requisitos de isoflurano menores, bem como uma suave e rápida recuperação após reversão com atipamezole (Uilenreef, J. et al, 2008).
No entanto, a dose ótima para uma CRI de dexmedetomidina, tanto para uma boa estabilidade hemodinâmica como para uma perfusão tecidular adequada ainda não está bem determinada para cães (Uilenreef. J. et al., 2008).
18
Há também a hipótese que a administração de dexmedetomidina em CRI reduz a necessidade de isoflurano de forma dose-dependente durante a anestesia cirúrgica (Uilenreef, 2008).
Há também alguns estudos que referem que uma CRI de dexmedetomidina de 1 μg/kg/h, com uma dose de ataque de 5μg/kg IM produzem os resultados mais favoráveis (Roux, 2010; Campos, J. 2010).
Entende-se assim, que uma CRI, é necessária para manter tanto uma boa estabilidade hemodinâmica (quantidade adequada de alfa-2 agonistas no plasma), como para manter um efeito anti-nocicetivo adequado (Uilenreef et al., 2008).
Devem ser asseguradas concentrações ideais do fármaco no plasma e não regimes de administração intermitente, pois as concentrações iniciais no plasma excederão a quantidade necessária, seguida de uma queda das suas concentrações no resto da cirurgia. Isto evita possíveis efeitos adversos por excesso de dosagem inicial administrado pelo bólus inicial e permite manter uma concentração ideal do fármaco no plasma o resto da cirurgia. Assim são evitados os efeitos hemodinâmicos mais indesejáveis (Urquhart, 2000).
Segundo um estudo, uma CRI de dexmedetomidina ≥ 0,5 μg/kg/min tem um potencial de uso em anestesia em cães porque reduz a concentração alvéolar mínima (CAM) de isoflurano. Segundo o mesmo, a diminuição da frequência cardíaca é dose-dependente mas só se verificaram bradicárdias (< 60 batimentos/min) a 3 μg/kg/h em infusões de 5-6 horas. Estas infusões não devem ser administradas a animais com baixa perfusão tecidular (ex: lactato plasmático superior a 2,5 mmol/L). Contudo, as CRI de dexmedetomidina têm o potencial para uso em cães saudáveis, sob procedimentos cirúrgicos. Em cães sob anestesia com isoflurano em CRI de dexmedetomidina entre 1 a 3 μg/kg/h não foram mostradas evidências do aumento do metabolismo anaeróbio, bem como concentrações plasmáticas de lactato. Assim, uma CRI pode ser aconselhada para procedimentos cirúrgicos rotineiros (Neto, 2009).
19
2. Revisão Bi
b
liográfica sobre Dor
2.1. Introdução
Nos tempos mais antigos não foi dada a meritória importância à dor (Flecknell, 1994 citado por Vedpathak, 2009). Nas sociedades mais antigas era defendido que a dor representava uma invasão do corpo por parte de espíritos e era considerada uma punição por parte dos deuses (Campos, J., 2010).
No século VI a.C., Acméon, considerado o “avô da medicina”, foi o primeiro a reconhecer o cérebro como o centro de todas as sensações (Filho, 2007).
Mais recentemente, Descartes começou por defender que se tratava de um processo apenas mecânico e a transmissão da dor ocorria através de um canal que se iniciava na pele e terminava no cérebro (DeLeo, 2006; Pinto, 2007).
Atualmente o conceito de dor é diferente. A transmissão e a perceção da dor é um conjunto de mecanismos mais complexos (Mogil et al., 1997; Muir, 2008b). Tem-se tornado uma das maiores áreas de interesse científico, assumindo um papel de grande relevância. É considerada como o 5º sinal vital desde 2001. Esta crescente importância tem vindo a cativar interesse para estudos e pesquisas nos diferentes campos da neurofisiologia, procurando esclarecer quais os mecanismos fisiopatológicos associados a ela (Wetmore, 2006; Miilis, 2006; Hellyer et al., 2007; Rollin, 2008; Dyson, 2008, citado por Azevedo, P., 2009).
Um dos marcos mais importantes no estudo da dor foi protagonizado por Melzack e Wall, 1965, com a publicação da “Teoria do Controlo do Portão” e por Perl, 1971 e Prodacci, 1969, com a “Teoria da Especificidade”.
A teoria do controlo do portão defende que a dor é um fenómeno neurofisiológico em que a sensação dolorosa é transmitida por um estímulo e sustenta que o pensamento, as experiências passadas e as emoções também influenciam a perceção e a resposta à dor. Estabelece, assim, uma envolvência da mente e do corpo na experiência da dor.
Já a teoria da especificidade sustenta que a dor tem apenas uma componente reativa e descreve a transmissão dos impulsos dolorosos através de fibras especiais até aos centros cerebrais específicos (Almeida & Almeida, 2006; Nascimento, 2010).
20
A dor tem um caráter subjetivo, o que torna a sua avaliação e quantificação uma etapa delicada e difícil. Em Medicina Veterinária a avaliação da dor torna-se ainda mais complicada e é um ponto chave para o médico veterinário pois pode constituir-se um fracasso ou um êxito a nível terapêutico (Hansen, 2003).
A dor produzida aumenta os níveis de stress (o que provoca uma supressão da imunidade) e a taxa catabólica, atrasando no período peri-operatório a cicatrização dos tecidos intervencionados e a consequente recuperação do doente (Beilin et al., 2003; Millis, 2006; Paul-Murphy, 2007).
É, por isto, necessário um conhecimento de estratégias para um melhor maneio das síndromes de dor, logo terá que haver, segundo Muir, 2008b, um conhecimento das vias neuronais envolvidas no processamento do estímulo nocicetivo, uma boa apreciação dos estímulos despoletantes iniciais, conhecimento da resposta do sistema nervoso a repetidos estímulos nocicetivos e conhecimento das consequências sistémicas da dor.
2.2. Definição e conceitos de dor
“A dor nos animais é uma experiência sensorial e emocional adversa (perceção) que desencadeia ações motoras de proteção, resultando num estímulo negativo aprendido e que pode modificar o comportamento social das várias espécies”( Kitchell, 1987).
Atualmente aceita-se a definição proposta pela Associação Internacional para o Estudo da Dor (AIED), que a define como uma experiência sensorial e emocional desagradável associada a uma potencial ou real lesão tecidular (Viñuela-Fernandez et al., 2002).
A dor é uma emoção subjetiva que pode ser experienciada mesmo na ausência de um estímulo nócico externo e que pode ser reforçada ou abolida por um larga quantidade de experiências, incluindo medo, memória e stress emocional (Seymour, C. et al., 2007).
Contudo, há autores que preferem outras definições, consoante o propósito dos seus estudos. Molony and Kent, 1997 definem a dor como uma experiência sensorial e emocional representando os danos causados ao animal ou ameaça para com os seus tecidos (citado por Stillwel, 2009). Já Broom and Fraser, 2007 preferem não descrever a dor nos termos próprios (“in terms”) mas como um sentimento e uma sensação aversiva associada a um potencial ou atual dano dos tecidos.
21
A incapacidade de comunicar, que é o caso dos animais, não nega que o indivíduo possa estar perante uma experiência dolorosa. Esta realidade é muito importante em medicina veterinária. Assim, a dor pode ser expressa de formas muito diferentes e torna-se necessário recorrer a uma terapia analgésica adequada (Benedito-Castellote, 1995; Beilin et al., 2003; Gaynor, 2008; Molony & Kent, 1997, citado por Azevedo, 2009).
Há alguns conceitos relacionados com os estímulos dolorosos e que passo a destacar:
Analgesia é uma ausência da sensação dolorosa na presença de um estímulo que normalmente é
doloroso (Ettinger, et al., 2010); Anestesia é uma ausência de todas as modalidades sensoriais no corpo ou em partes do corpo (Ettinger, et al., 2010); Hiperestesia é um aumento da sensibilidade ao estímulo, excluindo os sentidos especiais (Ettinger, et al., 2010). É utilizado para designar uma resposta desagradável a um estímulo nócico (kitchell, 1987); dificuldade do animal em realmente perceber a dor. É uma reação comportamental indicando que o estímulo é desagradável e é considerado um estímulo nocicetivo. O uso mais comum é descrito como uma resposta do animal à manipulação que causa uma reação adversa num local mas não noutros (Lorenz et al., 2004); Hiperalgesia é uma resposta aumentada ao estímulo que é normalmente doloroso. Os recetores estimulados respondem a um baixo limiar e de forma mais vigorosa;
Hiperpatia denota uma resposta desagradável e dolorosa a um estímulo nócico, especialmente
se repetido e é caracterizado por um atraso (Lorenz et al., 2004); Alodinia é dor resultante de um estímulo não nócico numa pele normal. Muitas vezes avaliam-se reações dolorosas de outras estruturas, pelo que este termo não é muito utilizado. (Lorenz et al., 2004).
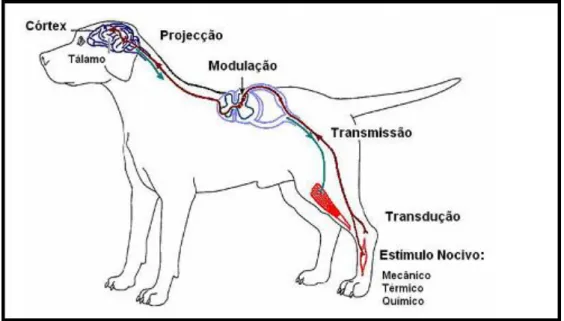
2.3. Conceito de nociceção
A Nociceção é uma atividade aferente inconsciente produzida no sistema nervoso periférico e central por um estímulo com potencial para danificar os tecidos (Stilwell, 2009).
A resposta física a um estímulo capaz de lesar os tecidos, como por exemplo o estímulo cirúrgico, é um conceito mais restrito e objetivo que se designa por nociceção (Pinto, 2007).
A nociceção compreende os processos de transdução, transmissão e modulação a nível central de sinais gerados por estímulos externos que resultam na perceção consciente da dor (Thurman et al., 1999; Traquilli et al., 2004, citado por Campos, J., 2010).
A dor é uma perceção e não uma entidade quantificável. É incorreto referir: estímulo doloroso; recetores de dor; vias de dor; fibras nervosas. É mais correto referir estímulo nócico (injurioso). Assim diz-se estímulo nócico, nocicetores, vias nocicetivas etc. (Lorenz et al., 2004).
22 2.4. Classificação da dor
A classificação da dor é muito variável de autor para autor. Há várias abordagens à sua classificação. Dado isto, passo a destacar algumas classificações encontradas na bibliografia porque considero que todas se podem complementar, ajudando numa classificação mais completa e objetiva.
Segundo (Wolf, 2004), a dor é uma entidade sensorial em que existem vários tipos, classificados como: nocicetiva, inflamatória, neuropática e funcional.
A dor pode ser classificada em dor fisiológica, patológica, aguda, crónica, visceral e neuropática (Azevedo, 2009).
Segundo (Campos, 2010) a dor pode ser classificada quanto à sua origem, quanto à sua
neurofisiologia e quanto ao seu período de duração.
Quanto à sua Origem
Dor fisiológica (nociceptiva)
Dor patológica
Quanto à Neurofisiologia
Dor Nociceptiva
Dor Somática Dor Visceral
Dor não Nociceptiva
Dor Neuropática Dor Psicogénica
Quanto ao período de duração
Dor aguda
Dor crónica Tabela 1 – Classificação da dor (Adaptado de Campos, 2010)
23
2.4.1. Dor Inflamatória
Quando ocorrem danos tecidulares, há uma mudança na maneira como o sistema nervoso central e periférico processa o estímulo nócico (e não nócico) daí resultante. O sistema sensorial nocicetivo não é um “sistema rígido de fios” mas é um sistema inerentemente plástico, capaz de mudar a sua sensibilidade consoante um estímulo intenso ou repetido. A seguir ao dano dos tecidos ou inflamação a sensibilidade de uma região lesada fica reforçada. De seguida, um estímulo normal inócuo é percebido como doloroso para prevenir o uso ou o contacto dos tecidos lesados e promover a cura. Isto é a dor inflamatória (Seymour, C. et al., 2007).
A dor inflamatória é uma dor que, segundo normais circunstâncias, transporta a dor aguda pós-operatória até à zona “curada”, representando assim um potencial benefício adaptativo de resposta ao dano daquele tecido. Isto é reproduzido dentro dos minutos seguintes ao trauma dos tecidos e em geral a sua extensão, intensidade e duração estão diretamente relacionados com a sua severidade. As mudanças no sistema nocicetivo são geralmente reversíveis e a sensibilidade normal do sistema pode ser restaurado quando o tecido se reabilita completamente. Contudo, se o estímulo nócico for severo ou o foco de inflamação persistir, então a dor também vai persistir. Isto é a experiência da dor de animais com doenças inflamatórias crónicas como arterites, otites, gengivites, dermatites e dores lombares (Seymour, C. et al., 2007).
2.4.2. Dor fisiológica ou nocicetiva e dor patológica
Segundo Cole et al., 2006,a dor fisiológica ou nocicetiva é aquela que resulta do estímulo nocicetivo que pode ser calor, frio ou pressão e ocorre diariamente, sendo bem localizada e transitória. Relativamente à dor patológica, esta ocorre devido à persistência dos estímulos nocivos por um processo inflamatório tecidular ou por lesão nervosa, causando desconforto e sensibilidade exagerada (Gogny, 2006; Klaumann, 2008; citado por Campos, 2010).
2.4.3. Dor somática e dor visceral
A dor somática tem origem em estruturas como a pele, tecido subcutâneo ou muscular. É uma dor variável e localizada, conforme a lesão. Já na dor visceral os mecanismos responsáveis são os mesmos que para a dor inflamatória e sabe-se que os órgãos ocos têm na sua musculatura lisa mecanorecetores, com fibras nocicetivas viscerais, A, que são sensíveis a diversos estímulos, tais como pressão aplicada sobre o peritoneu, distensão e contração orgânica, pressões
24
intraluminias e processos inflamatórios (Kraychete & Guimarães, 2003) (citado por Campos, 2010).
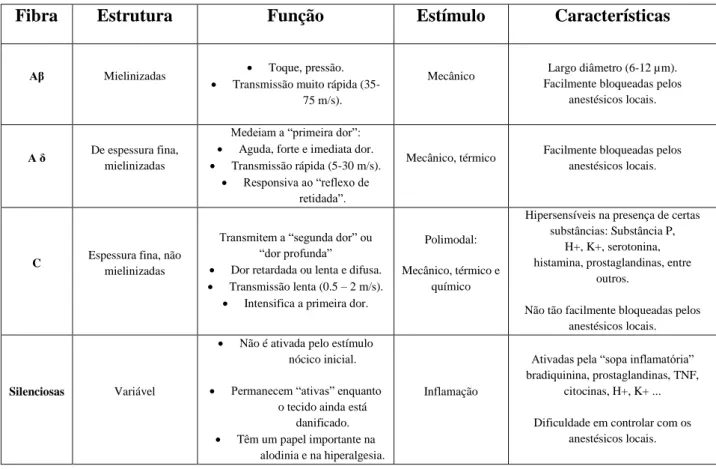
2.5. Tipos de fibras dos nocicetores
Fibra Estrutura Função Estímulo Características
Aβ Mielinizadas Toque, pressão. Transmissão muito rápida
(35-75 m/s).
Mecânico Largo diâmetro (6-12 µm). Facilmente bloqueadas pelos
anestésicos locais.
A δ De espessura fina,
mielinizadas
Medeiam a “primeira dor”:
Aguda, forte e imediata dor.
Transmissão rápida (5-30 m/s).
Responsiva ao “reflexo de retidada”.
Mecânico, térmico Facilmente bloqueadas pelos anestésicos locais.
C Espessura fina, não
mielinizadas
Transmitem a “segunda dor” ou “dor profunda”
Dor retardada ou lenta e difusa.
Transmissão lenta (0.5 – 2 m/s).
Intensifica a primeira dor.
Polimodal: Mecânico, térmico e
químico
Hipersensíveis na presença de certas substâncias: Substância P,
H+, K+, serotonina, histamina, prostaglandinas, entre
outros.
Não tão facilmente bloqueadas pelos anestésicos locais.
Silenciosas Variável
Não é ativada pelo estímulo nócico inicial.
Permanecem “ativas” enquanto o tecido ainda está
danificado.
Têm um papel importante na alodinia e na hiperalgesia.
Inflamação
Ativadas pela “sopa inflamatória” bradiquinina, prostaglandinas, TNF,
citocinas, H+, K+ ... Dificuldade em controlar com os
anestésicos locais.
As fibras C não mielinizadas são ativadas por um intenso estímulo mecânico, químico e térmico e são relativamente lentas na transmissão, contribuindo com uma sensação de dor tipo queimadura.
Já as fibras A conduzem os impulsos de dez a 60 vezes mais rápido, contribuindo para uma resposta de dor aguda tipo estocada.
Há também uma população de fibras chamada de nocicetores silenciosos que se tornam ativos durante a inflamação ou dano dos tecidos.
O estímulo para ativar as fibras C tem que ser forte e está comprovado que existe um relacionamento direto entre intensidade do estímulo e resposta do recetor. Em condições normais quanto maior o estímulo provocado maior será a sua intensidade e mais vigorosa será a resposta