DEPARTAMENTO DE FITOTECNIA
A maturação fenólica em uvas tintas.
Comparação de metodologias
Pedro Tiago Relvas Correia
Orientação: Professora Doutora Maria João Cabrita
Mestrado em Viticultura e Enologia
Dissertação
Évora, 2014
DEPARTAMENTO DE FITOTECNIA
A maturação fenólica em uvas tintas.
Comparação de metodologias
Pedro Tiago Relvas Correia
Orientação: Professora Doutora Maria João Cabrita
Mestrado em Viticultura e Enologia
Dissertação
Évora, 2014
I | P á g i n a RESUMO
A maturação fenólica em uvas tintas é uma importante ferramenta de ajuda na decisão de vindima. Com o presente trabalho pretende-se estudar uma nova metodologia de avaliação de parâmetros relacionados com a maturação fenólica das uvas tintas, em comparação com metodologias mais habituais.
Neste contexto a maturação fenólica de uvas foi avaliada através de espectrofotometria de refletância difusa e através dos métodos de bancada e dos métodos baseados em espectrofotometria de infra vermelhos com transformada de Fourier (FTIR).
Os parâmetros de cor obtidos através das 3 metodologias serão comparados por forma a se tentar compreender as vantagens e desvantagens da metodologia de refletância difusa, que é uma nova metodologia para a qual se carece de informação.
Palavras-chave: maturação fenólica; espectrofotometria de refletância difusa;
II | P á g i n a
Thephenolic ripenessingrapes.Comparison of methodologies
ABSTRACT
The phenolic ripeness in grapes is an important tool to aid in the decision to harvest. The present work aims to study a new methodology for evaluation of parameters related to the phenolic ripeness of grapes, compared to more usual methods.
In this contextthe phenolic ripening of grapeswas assessed by diffuse reflectance spectroscopyand counter-methods and methods based on infra-red spectroscopy Fourier transform(FTIR).
Thecolor parametersobtained from thethreemethodsare comparedin order totry to understandthe advantages anddisadvantages of the diffuse reflectancemethod, which is a new methodologyfor which itneeds information.
III | P á g i n a
"O Vinho é uma prova constante de que Deus nos ama e deseja ver-nos felizes” (Benjamim Franklin)
Dedico esta dissertação aos meus pais, à minha esposa e à memória do meu avô Francisco Relvas, "Mestre Patarata".
IV | P á g i n a AGRADECIMENTOS
Chegado o final do trabalho não poderia de deixar agradecer a colaboração e disponibilidade de todas as pessoas sem as quais, de uma maneira ou de outra, a sua realização seria impossível. Por isso quero expressar a minha gratidão a todos, nomeadamente:
À Professora Doutora Maria João Cabrita, minha orientadora, pela sua disponibilidade, apoio, ajuda, simpatia e amizade que sempre demonstrou.
A todos os docentes do Mestrado em Viticultura e Enologia, que se empenharam e dedicaram a transmitir conhecimentos, de modo a construir a minha formação.
À minha família, principalmente à minha esposa e aos meus pais, um obrigado muito especial. Pelo carinho, amor, amizade, encorajamento e dedicação que me demonstraram ao longo destes anos.
Aos meus colegas de trabalho da CARMIM e colegas de mestrado pelo constante encorajamento e apoio na realização da componente prática deste trabalho.
A todos os que de uma forma ou de outra contribuíram para a realização deste trabalho.
V | P á g i n a ACRÓNIMOS
ABS – absorvância.
AT – Antocianinas potenciais ou totais. EA – extratibilidade das antocianinas.
FTIR – espectrofotometria de Infra Vermelhos com Transformada de Fourier. IPT – Índice de polifenóis totais.
MP – contribuição dos taninos provenientes das grainhas. N – nuance.
Nm – nanómetros. QP – qualidade fenólica. R – refletância.
VI | P á g i n a ÍNDICE Resumo ... I Abstract ... II Agradecimentos ... IV Acrónimos ... V Índice ... VI Lista de Tabelas ... VIII Lista de Figuras ... VIII
Capitulo 1 | Introdução ... 13
1.1. Introdução ... 14
1.2. Objetivos e síntese da metodologia de trabalho ... 16
1.3. Contribuição Científica ... 17
1.4. Organização e Estrutura da tese ... 17
Capitulo 2 | revisão do conhecimento ... 18
2.1. Compostos Fenólicos ... 19
2.1.1. Compostos de natureza não flavonóide ... 21
2.1.2. Compostos de natureza flavonóide ... 23
2.1.2.1. Antocianinas ... 25
2.2. A maturação da uva ... 27
2.2.1 Evolução dos Compostos Fenólicos ... 29
2.3. Métodos de Análise ... 31
2.3.1. Metodologia clássica ... 32
2.3.2. FTIR - Espectrofotometria de infra vermelhos com transformada de Fourier ... 34
2.3.3 Refletância difusa ... 36
2.3.3.1. Equipamento MT00 (Maselli Misure) ... 38
Capitulo 3 | Metodologia e resultados ... 43
3.1. Introdução ... 44
3.2. Colheita de amostras e metodologias ... 44
VII | P á g i n a
3.2.1.1. Análise de bancada ... 45
3.2.1.2. Análise por FTIR ... 48
3.2.1.3. Análise por refletância difusa ... 48
3.2.2. Análises gerais ... 50
3.2.2.1. Açucares ... 50
3.2.2.2. pH ... 51
3.2.2.3. Acidez total ... 51
3.3 Resultados ... 52
3.3.1 Características das uvas em análise ... 52
3.3.2 Determinação de antocianinas totais ... 53
3.3.3 Determinação de antocianinas extraíveis ... 55
3.3.4 Determinação do Índice de Polifenóis Totais - IPT ... 58
3.3.5 Determinação da Extratibilidade das Antocianinas - EA (%) ... 59
3.3.6 Determinação da contribuição dos taninos das grainhas - MP (%) ... 60
3.3.7 Maturação fenólica pela metodologia de refletância difusa ... 61
Capitulo 4 | Discussão, Conclusão e Recomendações ... 63
4.1. Considerações Finais ... 64
4.2. Conclusões ... 65
4.3. Perspetivas futuras ... 66
Capitulo 5 | bibliografia ... 67
VIII | P á g i n a LISTA DE TABELAS
Tabela 1 – Características dos vários modelos do MT00 (Raccagni, 2011). ... 41
Tabela 2 – Valores de máximo, mínimo, média e desvio padrão de álcool provável, acidez total e pH, do universo de amostras em estudo. ... 52
Tabela 3 – Valores de máximo, mínimo, média, desvio padrão e fator de correlação de todos os parâmetros analisados pela metodologia de refletância difusa (equipamento Maselli MT02), do universo de amostras em estudo. ... 61
LISTA DE FIGURAS Figura 1 – Influência da estrutura dos compostos fenólicos na diversidade das suas características organoléticas: 1. Procianidinas pouco polimerizadas; 2. Procianidinas oligoméricas; 3. Procianidinas polimerizadas; 4. Antocianinas; 5. Taninos dos engaços (Glories, 1994, não publicado). ... 19
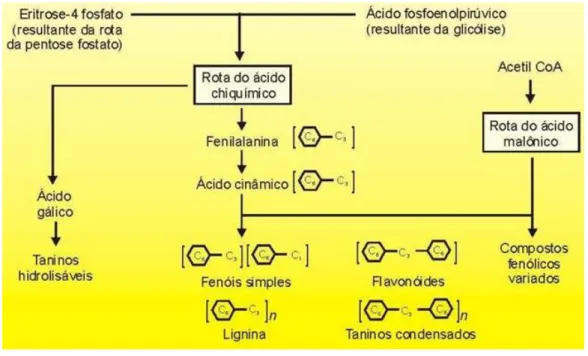
Figura 2 – Processo de síntese de compostos fenólicos derivado do ácido shiquímico (Castro, 2014). ... 20
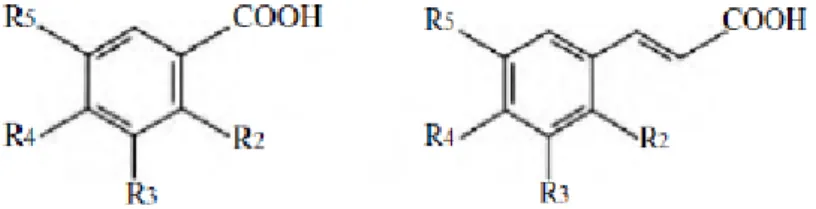
Figura 3 – Estrutura química do ácido benzóico e do ácido cinâmico (Cabrita, 2004). ... 22
Figura 4 – Formulas gerais dos flavonóis (Cabrita et al., 2003). ... 24
Figura 5 – Estrutura dos 3-flavanóis (Cabrita et al., 2003). ... 24
Figura 6 – Estrutura e classificação das Antocianinas (Jakson, 2008). ... 26
Figura 7 – Fases de crescimento do bago e acumulação de compostos (Magalhães, 2008; adaptado de Fregoni, 1999). ... 28
Figura 8 – Esquema da transmissão da luz por uma amostra (Raccagni, 2011). . 36
Figura 9 – Refletância difusa pela passagem da luz por uma amostra (Maselli, 2014). ... 37
Figura 10 – Equipamento MT00 da Maselli Misure (Maselli, 2014). ... 39
Figura 11 – Gamas de comprimentos de onda analisadas pelo MT00 (Raccagni, 2011). ... 39
Figura 12 – Exemplo de visualização de uma curva de maturação de uma parcela, com os parâmetros: índice de polifenóis total (IPT) e as antocianinas totais (AT) (http://www.maselli.com, 2014). ... 41
IX | P á g i n a
Figura 13 – Espectrofotómetro Perkin Elmer, modelo Lambda 25 (foto de Pedro
Correia, 2013). ... 46
Figura 14 – Equipamento Winescan FT120 (foto de Pedro Correia, 2013) ... 48
Figura 15 – Equipamento MT00 (Masselli, 2014)... 49
Figura 16 – Equipamento MT 00 com o triturador (Maselli, 2014). ... 50
Figura 17 – Gráfico de valores de antocianinas totais obtidos pela metodologia de bancada método Glories (1990) e pela metodologia de refletância difusa (equipamento Maselli MT02), em mg/L... 53
Figura 18 – Gráfico de correlação entre valores de antocianinas totais obtidos pela metodologia de bancada Glories (1990) e pela metodologia de refletância difusa (equipamento Maselli MT02), em mg/L... 54
Figura 19 – Gráfico de valores de antocianinas extraíveis obtidos pela metodologia de bancada pelo método de Glories (1990) e pela metodologia de refletância difusa (equipamento Maselli MT02), em mg/L... 55
Figura 20 – Gráfico de correlação entre valores de antocianinas extraíveis obtidos pela metodologia de bancada (Glories, 1990) e pela metodologia de refletância difusa (equipamento Maselli MT02), em mg/L. ... 56
Figura 21 – Gráfico de correlação entre valores de antocianinas extraíveis obtidos pela metodologia FTIR e pela metodologia de refletância difusa (equipamento Maselli MT02), em mg/L. ... 56
Figura 22 – Gráfico de correlação entre valores de antocianinas extraíveis obtidos pela metodologia FTIR e pela metodologia de bancada pelo método de Glories (1990), em mg/L. ... 57
Figura 23 – Gráfico de correlação entre valores de Índice de Polifenóis Totais obtidos pela metodologia de bancada (Glories, 1990) e pela metodologia de refletância difusa (equipamento Maselli MT02). ... 58
Figura 24 – Gráfico de correlação entre valores de Índice de Polifenóis Totais obtidos pela metodologia FTIR e pela metodologia de refletância difusa (equipamento Maselli MT02). ... 58
Figura 25 – Gráfico de correlação entre valores de Extratibilidade das Antocianinas obtidos pela metodologia de bancada pelo método de Glories (1990) e pela metodologia de refletância difusa (equipamento Maselli MT02), em percentagem. ... 59
X | P á g i n a
Figura 26 – Gráfico de valores de MP (%) - contribuição dos taninos das grainhas,
13 | P á g i n a CAPITULO 1 | INTRODUÇÃO
1.1.INTRODUÇÃO
1.2.OBJETIVOS E SÍNTESE DA METODOLOGIA DE TRABALHO
1.3.CONTRIBUIÇÃO CIENTÍFICA
14 | P á g i n a
1.1. Introdução
Já foi detetada a ocorrência de mais de 8000 compostos fenólicos em plantas (Dreosti, 2000), sendo estes, os seus metabolitos secundários mais abundantes. Este vasto e complexo grupo faz parte dos constituintes de muitas variedades de vegetais, frutas e produtos industrializados como o chocolate, o chá e o vinho. Os compostos fenólicos possuem grande importância no mundo da enologia, pois a qualidade do vinho deriva, direta ou indiretamente, da quantidade e estrutura destes compostos, pois contribuem para o seu sabor e aroma (Mamede, 2005). São eles os responsáveis pela cor, corpo e adstringência dos vinhos e são os grandes responsáveis pelas diferenças entre uvas ou vinhos tintos e brancos, pela presença ou ausência de antocianinas. Assim, os compostos fenólicos revestem-se de fundamental importância nas características dos vinhos (Cabrita, et al., 2003).
A quantidade destes compostos nos vinhos varia de acordo com alguns fatores, como: clima, natureza do solo, variedade da uva, maturação da uva, maceração da uva, temperatura de fermentação, pH, dióxido de enxofre e etanol (Teissedre, 1995).
O processo de maturação das uvas inclui um conjunto de reações físicas e bioquímicas, que começa no pintor e acaba com a uva madura, ou seja, quando esta atinge o potencial máximo de cada componente, para ser sujeita a transformações enológicas ou consumo (Palacios, 1986; González-Sanjosé, 1991). As transformações que ocorrem nas uvas durante a maturação não ocorrem simultaneamente. De forma geral podemos distinguir vários estados diferentes de ótimos de maturação que não costumam coincidir no tempo, como; maturação fisiológica, aquando da germinação; industrial, quando a uva atinge maior peso e concentração em açúcar sem decréscimo dos ácidos; e tecnológica, quando atinge as características ótimas para o seu destino final tendo em conta o tipo de vinho que se deseja produzir (Robredo, 1991; Perez-Magariño, 2006).
A maturação fenólica compreende não somente a concentração total de fenóis, mas também a sua estrutura e a sua capacidade de serem extraídos das uvas durante o processo de elaboração do vinho (Ribereau-Gayon et al., 2006), podendo ser estimada através do potencial fenólico da uva.
15 | P á g i n a
Teoricamente, sobre condições de vinificação comparáveis, por exemplo, uvas com alto teor de antocianinas deveriam produzir vinhos com mais cor, mas nem sempre se verifica o resultado esperado. Este facto é explicado pela variação do potencial de extração ou extratibilidade dos compostos fenólicos, que variam de acordo com as condições de amadurecimento das uvas e potencial genético das diferentes castas. Dessa forma, a maturação fenólica corresponde à combinação entre um alto potencial de pigmentação aliado a uma boa capacidade de libertar esses compostos nos vinhos (Ribereau-Gayon et al., 2006).
Assim, na produção de vinhos tintos é necessário ter em conta a maturação fenólica das uvas, através da determinação da concentração de compostos fenólicos, bem como a sua extratibilidade durante a vinificação (Segade, 2008), já que são estes compostos que conferem ao vinho atributos sensoriais como a estrutura, acidez, adstringência e cor (Escribano-Bailon, 2001), o que permite ao enólogo explorar o máximo potencial da uva.
A maturação tecnológica, aromática e fenólica são variáveis independentes e todas devem ser tidas em conta para chegar a uma conclusão sobre o melhor momento para vindimar, conseguindo assim, a maior qualidade possível do vinho a produzir (Ribereau-Gayon et al., 2006).
16 | P á g i n a
1.2. Objetivos e síntese da metodologia de trabalho
O trabalho apresentado nesta dissertação pretende dar um contributo na comparação de metodologias de avaliação de parâmetros relacionados com a maturação fenólica das uvas tintas, ferramenta determinante na ajuda à decisão de vindima.
Pretende-se, neste contexto de maturação fenólica das uvas, avaliar a quantidade de antocianinas totais e extraíveis, o índice de polifenóis totais, a tonalidade e intensidade da cor das uvas, com recurso a uma nova metodologia, a espectrofotometria de refletância difusa, e pelos tradicionais métodos de bancada e métodos baseados em espectrofotometria de infra vermelhos com transformada de Fourier (FTIR).
Os parâmetros de cor obtidos através das 3 metodologias serão comparados por forma a se tentar compreender as vantagens e desvantagens da metodologia de refletância difusa, que é uma nova metodologia para a qual se carece de informação.
Assim, foram analisadas e caracterizadas mais de 100 amostras de uva durante a campanha de vindima do ano 2012, entre os dias 11 de Setembro e 26 de Setembro. As amostras foram colhidas dos reboques de uva entregues pelos associados da CARMIM - Cooperativa Agrícola de Reguengos de Monsaraz, imediatamente antes da descarga nos tegões, tendo-se privilegiado a heterogeneidade entre amostras, no sentido de obter um largo espectro de estados de maturação fenólica das uvas e consequente, maior robustez aquando da comparação dos parâmetros analisados pelas três metodologias.
Para além, da análise aos compostos fenólicos das uvas pelas diferentes metodologias, todas as amostras foram caracterizadas quanto a álcool provável, pH e acidez total.
No âmbito deste trabalho não foi possível analisar os compostos de cor presentes nos vinhos resultantes das uvas analisadas, contudo, seria muito interessante compará-los com o valores obtidos na avaliação fenólica da uva, de forma equacionar o potencial fenólico dos vinhos à vindima, pela análise à uva e segundo determinada metodologia de vinificação.
17 | P á g i n a
1.3. Contribuição Científica
A principal contribuição deste estudo centra-se na avaliação da metodologia de refletância difusa, para análise dos compostos fenólicos ao longo da maturação da uva, pela comparação com os tradicionais métodos de bancada e métodos baseados em espectrofotometria de infra vermelhos com transformada de Fourier (FTIR).
Esta metodologia apresenta um elevado potencial no apoio à tomada de decisão de vindima pelo enólogo, pois permite a caracterização fenólica de uma amostragem de uva de forma expedita e rápida.
1.4. Organização e Estrutura da tese
Feita a caracterização do tema em estudo, no presente capítulo, esta dissertação é composta por mais três capítulos. No segundo capítulo é efetuado um enquadramento teórico sobre os compostos fenólicos, a maturação fenólica das uvas, e sobres as metodologias para determinação dos compostos fenólicos, para elucidar o leitor menos familiarizado com estas temáticas. No terceiro capítulo apresentam-se as metodologias aplicadas neste estudo, pela descrição das diferentes técnicas de análise dos compostos fenólicos das uvas e análise de bancada de outros parâmetros analíticos das uvas, como sendo, teor em açúcar, acidez total e pH.
Os resultados obtidos pelas diversas metodologias e análises são também apresentados neste capítulo, embora sejam apenas discutidos no capítulo seguinte (capítulo quatro).
Finalmente, no capítulo quatro tecem-se algumas considerações sobre os métodos utilizados e os resultados obtidos, bem como se apresentam algumas recomendações para trabalhos futuros, com vista ao aperfeiçoamento da metodologia aqui aplicada.
18 | P á g i n a CAPITULO 2 | REVISÃO DO CONHECIMENTO
2.1.COMPOSTOS FENÓLICOS
2.1.1.COMPOSTOS DE NATUREZA NÃO FLAVONÓIDE
2.1.2.COMPOSTOS DE NATUREZA FLAVONÓIDE
2.1.2.1.ANTOCIANINAS
2.2.A MATURAÇÃO DA UVA
2.2.1.EVOLUÇÃO DOS COMPOSTOS FENÓLICOS
2.3.MÉTODOS DE ANÁLISE
2.3.1.METODOLOGIA CLÁSSICA
2.3.2.FTIR
2.3.3.REFLETÂNCIA DIFUSA
19 | P á g i n a
2.1. Compostos Fenólicos
Os compostos fenólicos possuem uma grande importância em enologia devido ao papel que desempenham, direta ou indiretamente, sobre a qualidade dos vinhos (Flanzy, 2000). São substâncias que possuem um papel determinante na bioquímica da planta, com funções variadas desde a cor das flores e frutos, até à impregnação de lenhina das paredes pecto-celulósicas. Em viticultura a sua importância é capital, não apenas devido ao papel sobre a coloração dos frutos, mas sobretudo pelas particularidades gustativas que conferem ao mosto e vinho (Champagnol, 1984), como representado na figura 1.
Figura 1 – Influência da estrutura dos compostos fenólicos na diversidade das suas características organoléticas: 1. Procianidinas pouco polimerizadas; 2. Procianidinas oligoméricas; 3. Procianidinas polimerizadas; 4. Antocianinas; 5. Taninos dos engaços (Glories, 1994, não publicado).
Do ponto de vista fisiológico, os compostos fenólicos são produtos do metabolismo secundário das plantas, caracterizados por conter um grupo fenol num anel aromático, que embora possuam grupos álcool, não exibem as suas propriedades (Taiz & Zeiger, 2004; Jackson, 2008).
A síntese destes compostos em Vitis vinífera, tem origem principalmente, na via do ácido shiquímico ou em biossíntese mista (Figura 2) (Conde et al., 2007).
20 | P á g i n a
Figura 2 – Processo de síntese de compostos fenólicos derivado do ácido shiquímico (Castro, 2014).
Segundo Deloire et al. (1998), a videira produz os polifenóis como defesa a situações adversas ou ao stresse, como quando a planta é submetida ao ataque de agentes patogénicos, ou a um stresse abiótico (deficit hídrico, radiação ultravioleta).
Os compostos fenólicos são encontrados, principalmente, nas camadas internas da película e da grainha, enquanto que na polpa, a sua concentração é muito baixa, no entanto estes valores dependem muito da casta e dos fatores ambientais (Perez-Magariño, 2006). Estes compostos existem em estruturas insolúveis como vacúolos das células das plantas, em vesículas de lipoproteínas, ou adsorvidos ou unidos a polissacáridos nos vasos fibrovasculares, o que complica a sua extração (Corrales, 2008).
Os polifenóis presentes nas uvas e nos vinhos podem subdividir-se em dois grandes grupos, os não flavonóides e flavonóides. Os primeiros são caracterizados por se apresentarem sob a forma de ácidos (Jackson, 2008), sendo os mais comuns nas uvas, os ácidos fenólicos, cinâmicos, benzóicos, e outros derivados fenólicos como os estilbenos (Macheix, 1990). No caso dos flavonóides as classes mais abundantes são as flavanas, os flavanóis e as antocianinas, sendo que estas últimas, como referido, apenas estão presentes nas uvas e vinhos tintos (Corrales, 2009).
21 | P á g i n a
Os compostos fenólicos distribuem-se de modo desigual pelas diversas partes do fruto, sendo que nas grainhas existem flavanóis e ácido gálico; na polpa, ácidos hidroxicinamil tartáricos; nos vasos fibrovasculares, flavanóis e ácidos fenólicos do tipo benzoico e na película, todos os anteriores e ainda flavonóis e antocianinas (Cabrita, et al., 2003).
A sua concentração aumenta continuamente desde o início do desenvolvimento da uva, contudo, o maior aumento verifica-se no início do desenvolvimento dos bagos, sendo que a acumulação durante a maturação é mais lenta (Pinto, 2002).
Várias são as enzimas que participam em reações metabólicas e influem na síntese de compostos fenólicos, como a fenilalanina-amoníaco-liase e a chalcona sintetase. A primeira localiza-se nas células epidérmicas do bago de uva e nas grainhas, apresenta um máximo de atividade na fase de crescimento herbáceo do bago, decrescendo a sua atividade até ao pintor, sendo que ao longo da maturação presenta uma atividade muito baixa (Ribéreau-Gayon et al, 2006). Nas castas tintas a atividade desta enzima aumenta de novo no pintor e existe uma forte relação entre a sua atividade e a intensidade da cor dos mostos.
2.1.1. Compostos de natureza não flavonóide
Como referido, os compostos não flavonóides compreendem os ácidos fenólicos, cinâmicos, benzóicos, e outros derivados fenólicos como os estilbenos.
Estes compostos, no que refere às suas estruturas químicas, segundo Melo & Guerra (2002), são classificados da seguinte forma:
os derivados das estruturas químicas C6-C1, específicas dos ácidos hidroxi
benzóico, gálico e elágico;
os derivados das estruturas químicas C6-C3, específicas dos ácidos cafeico e
p-cumárico; ou então dos ácidos hidroxicinamil tartáricos como o ácido fertárico e coutárico;
os derivados das estruturas químicas C6-C2-C6, específicas do
trans-resveratrol, cis-resveratrol e trans-resveratrol-glucosídio.
Os compostos não flavonóides encontram-se em baixas concentrações nas uvas e nos vinhos, com exceção dos ácidos fenólicos (hidroxicinâmico e benzoico), que
22 | P á g i n a
representam a terceira classe de compostos fenólicos mais abundantes nas uvas, depois de taninos e antocianinas (Kennedy et al., 2006).
A uva e o vinho contêm ácidos benzóicos e cinâmicos, sendo que a concentração nos vinhos tintos é de 100 a 200 mg/L. Os ácidos fenólicos são constituídos por apenas um anel benzénico na molécula, são incolores em solução hidroalcoólica, mas podem tornar-se amarelos depois da oxidação (Ribéreau-Gayon et al., 2003). Representados na Figura 3, estes ácidos estão presentes nos vacúolos das células da pelicula e da polpa, sob a forma de ésteres tartáricos.
Figura 3 – Estrutura química do ácido benzóico e do ácido cinâmico (Cabrita, 2004).
O ácido hidroxicinâmico e seus derivados como p-cumárico, caféico, ferrúlico e sinápico são originados do metabolismo da fenilalanina ou tirosina (Riceevans et
al., 1996), geralmente, estes ácidos encontram-se esterificados.
Os ácidos hidroxicinâmicos, ainda que não exerçam qualquer influência no gosto dos vinhos, estão envolvidos no processo de aparecimento de fenóis voláteis e consequentes alterações aromáticas, nomeadamente, nos aromas primários desenvolvidos durante a maturação das uvas (Garcia et al., 2003).
Os ácidos derivados do ácido benzóico sofrem substituições nas posições meta e para, dando origem, por exemplo, ao ácido gálico. Alguns vinhos que sofrem envelhecimento em barrica apresentam altos teores de ácido gálico.
Os compostos não flavonóides são os principais compostos fenólicos dos vinhos brancos. Estes compostos jogam um papel importante nas oxidações que conduzem ao acastanhamento dos mostos e dos vinhos (Singleton, 1987).
Os estilbenos, apesar de se apresentarem em quantidades mínimas nos vinhos, têm grande importância devido aos benefícios que trazem a saúde humana. Destaca-se neste grupo, o resveratrol, por ser o principal estilbeno produzido nas uvas (Conde et al., 2007), concentrando-se na pelicula dos bagos, e sintetizado principalmente em reposta ao ataque de patogénios e ao stresse abiótico.
23 | P á g i n a
A atividade antioxidante dos não-flavonóides está relacionada com a posição dos grupos hidróxilo e também com a proximidade do grupo -CO2H com o grupo fenil.
Quanto mais próximo esse grupo estiver do grupo fenil maior será a capacidade antioxidante do grupo hidróxilo na posição meta (Mamede et al., 2005).
2.1.2. Compostos de natureza flavonóide
Os flavonóides, dividem-se em flavonóis, flavanóis e antocianinas, e são compostos polifenólicos que apresentam estrutura química de 15 átomos de carbono, ou seja, 2 anéis de benzeno (anéis A e B) ligados por um grupo pirano (anel C), cuja representação da fórmula é C6-C3-C6 (Herrmann, 1976 cit. por
Mamede, 2004).
Esta classe de compostos pode ser dividida em famílias, as quais se distinguem pelo grau de oxidação do anel central (Cabrita et al., 2003).
A estrutura química dos flavonóides favorece a sua ação antioxidante. Os hidrogénios dos grupos hidroxilo adjacentes, localizados em várias posições dos anéis A, B e C, as duplas ligações dos anéis benzénicos e a dupla ligação da função carbonilo (-C=O) de algumas moléculas de flavonóides, fornecem a estes compostos, uma alta atividade antioxidante (Rice-Evans et al., 1996).
Os compostos fenólicos são encontrados, principalmente, nas camadas internas da película e da grainha, sendo que na polpa as suas concentrações são muito baixas, no entanto estes valores dependem muito da casta e dos fatores ambientais (Perez-Magariño, 2006).
Nas uvas, os flavonoides são sintetizados no reticulo endoplasmático e de seguida são deslocados e armazenados nos vacúolos das células produtoras e em vesículas de lipoproteínas, o que complica a sua extração (Corrales, 2008).
Os principais flavonóis da uva são a quercetina, o campferol e a miricetina (Figura 4), sendo que estes compostos são caracterizados pela presença de uma insaturação no anel heterocíclico e um grupo hidroxilo na posição 3 (Mattivi et al., 2006). A síntese de flavonóis ocorre na pelicula do bago, praticamente durante todo o crescimento do bago. Embora seja uma família minoritária nas uvas, os flavonóis têm um papel importante na evolução da cor dos vinhos tintos através de
24 | P á g i n a
processos de co-pigmentação com as antocianinas (Ribéreau-Gayon et al., 2006) (Cabrita et al., 2003).
Figura 4 – Formulas gerais dos flavonóis (Cabrita et al., 2003).
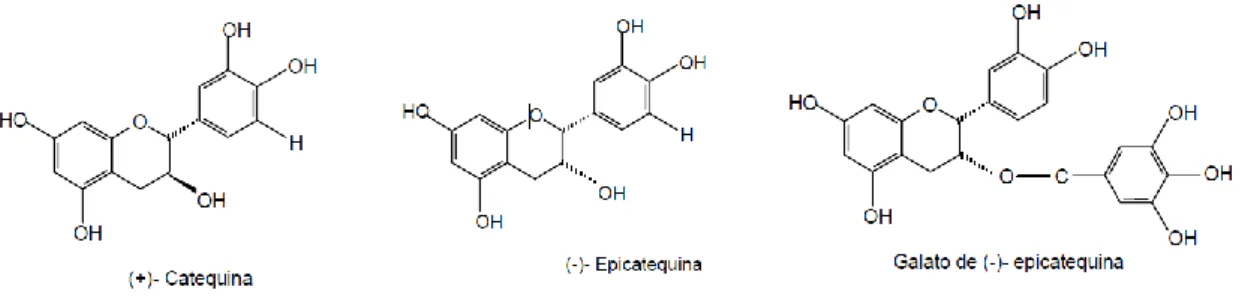
Os flavanóis presentes nas uvas são representados principalmente por 3-flavanóis e taninos ou proantocianidinas. Os primeiros caracterizam-se por possuir um anel heterocíclico saturado, sendo estes os monómeros responsáveis pelo sabor amargo dos vinhos. As suas formas mais encontradas nas uvas e nos vinhos são a (+)-catequinas, (-)-epicatequinas (Figura 5) (Su et al., 1969).
Figura 5 – Estrutura dos 3-flavanóis (Cabrita et al., 2003).
Os taninos podem ser divididos em dois grandes grupos, os taninos hidrolisáveis e os taninos condensados.
Os taninos hidrolisáveis não existem naturalmente na uva, assim são adicionados ao vinho, quer seja por contato com materiais vegetais, como a madeira de carvalho das barricas; quer por adição de produtos enológicos com taninos comerciais (Ferreira, 2006 cit. por Tomaz, 2013).
Os taninos condensados são responsáveis pelas características organolépticas das uvas e vinhos, como resultado das suas propriedades tânicas, que dependem da sua estrutura e do seu grau de polimerização (Freitas, 1998).
25 | P á g i n a
Os taninos condensados estão presentes em todas as partes sólidas do cacho (peliculas, grainhas e engaços) e solubilizam-se no vinho durante a maceração. O seu teor no vinho tinto depende da variedade e das condições de vinificação, variando de 1 a 4 g/L (Ribéreau-Gayon et al., 2003).
Os taninos, também denominados de proantocianidinas são compostos que libertam antocianidinas quando aquecidas em meio fortemente ácido e alcoólico, mediante a rutura das ligações entre as unidades monoméricas. Consoante se liberte cianidina ou delfinidina, estas moléculas recebem o nome de procianidinas ou prodelfinidinas. As primeiras são polímeros de catequina e epicatequina e as segundas são constituídas por galocatequinas e epigalocatequinas (Cabrita et al., 2003).
As proantocianidinas são assim, polímeros de moléculas de 3-flavanóis, e consoante o número de vezes que esta unidade se repete, assim as proantocianidinas podem ser dímeras, trímeras, oligoméricas ou polímeros.
Estes compostos são extraídos das peliculas, grainhas e dos engaços das uvas e conferem a adstringência aos vinhos, daí a existência de teores mais elevados nos vinhos tintos que nos vinhos brancos, pois a maceração das partes sólidas aquando da fermentação dos vinhos tintos, permite a extração destes compostos para o mosto.
Os teores de proantocianidinas nas uvas, como os restantes compostos fenólicos, variam com o tipo de solo, o ano de colheita, de casta para casta, as condições climatéricas, a forma de condução das cepas.
2.1.2.1. Antocianinas
O termo antocianina é de origem grega (anthos, uma flor, e kyanos, azul escuro). Depois da clorofila, as antocianinas são o mais importante grupo de pigmentos de origem vegetal (Harborne et al., 1988).
As funções desempenhadas pelas antocianinas nas plantas são variadas: antioxidantes, proteção à ação da luz, mecanismo de defesa e função biológica. A estrutura química básica das antocianinas é baseada numa estrutura policíclica de quinze carbonos, representada na Figura 6 (López et al., 2000).
26 | P á g i n a
Figura 6 – Estrutura e classificação das Antocianidinas (adaptado de Jakson, 2008).
As antocianinas estão entre os mais importantes flavonoides das uvas tintas. São responsáveis pela cor de vinhos tintos e estão localizadas nas paredes espessas de células hipodérmicas das peliculas dos bagos de uva (Conde et al., 2007). A sua estrutura difere dos restantes flavonoides por ser complementada por uma ou mais moléculas de glucose. Estruturalmente são glucósidos de polihidroxi ou polimetoxi dos sais de flavilium (2-fenil-benzopirilo). Elas diferenciam-se pelo número de grupos hidroxi (oxidrilo) e o grau de metilação destes grupos presentes no anel lateral, o número e a natureza dos açúcares ligados à molécula, e o número e natureza das cadeias alifáticas ou aromáticas esterificadas com os açúcares (Guerra, 1997 cit. por Cabrita et al., 2003).
As antocianinas na forma de heterósidos (antocianinas), são muito mais estáveis do que na forma aglicona (antocianidinas).
As antocianinas do género Vitis são a cianidina, a delfinidina, a peonidina, a petunidina e a malvidina. As suas quantidades relativas variam com a casta, mas a malvidina é sempre maioritária.
A malvidina é a molécula dominante em todas as variedades, representando de 50 a 80% do total na uva madura. Das antocianinas restantes, temos 5 a 10% de cianidina, 10 a 20% de delfinidina, 15 a 25% de petunidina e 15 a 30% de paeonidina (Guerra, 1998).
OH
27 | P á g i n a
A cor das antocianinas varia com as condições do meio e com as suas estruturas químicas, variando do rosa ao azul, com o aumento dos grupos hidroxilo e o efeito inverso observa-se quando se substituem estes grupos por grupos metoxi.
Em soluções aquosas, as antocianinas apresentam diferentes estruturas em função do pH. De modo geral, um meio extremamente ácido (pH entre 1 e 2), as antocianinas apresentam coloração intensamente vermelhada, devido ao predomínio da forma catiónica flavílica (AH+). Para um meio com pH maior que 2, é observado um equilíbrio entre o catião flavílico e uma estrutura conhecida como pseudobase cabinol (B).com o aumento do pH, as antocianinas perdem a cor até ser tornarem praticamente incolores em pH cerca de 6 (Março, 2008).
2.2. A maturação da uva
O conceito de maturação depende não só do grau ou estado de acumulação dos compostos químicos da uva e do volume do bago, mas também dos objetivos a dar à produção: uva de mesa, uva-passa, ou uva para vinho, e, dentre estes, quais os tipos e níveis de características qualitativas.
Segundo Magalhães (2008), podem considerar-se três definições de maturação. A maturação fisiológica, que corresponde à maturação completa da grainha e sua capacidade germinativa posterior; a maturação industrial, traduzida pelo valor máximo da relação entre açucares acumulados no bago e a acidez total; e a maturação tecnológica, que diz respeito ao momento ótimo de vindima, em função do destino pretendido, pelo que nem sempre corresponde à fisiológica ou à industrial.
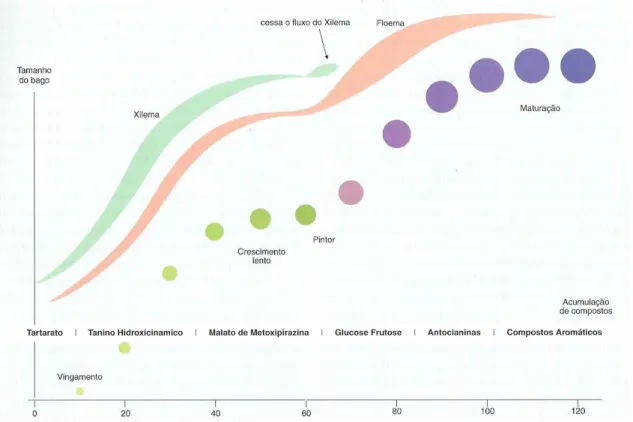
O crescimento do bago, processa-se, desde o vingamento à maturação. O bago apresenta uma curva de crescimento sigmoidal dupla (aumento do peso, do volume e do diâmetro), a que corresponde duas fases (fase I e III) separadas por uma fase de paragem ou de desenvolvimento muito lento (fase II ou fase lag) (Dokoozlian, 2000).
Na primeira fase (fase I), que decorre entre o vingamento e o pintor, o bago apresenta elevada dureza, cor verde devido à presença de clorofila e o seu crescimento deve-se à divisão e expansão celular. Durante esta fase, dá-se o desenvolvimento das sementes e a síntese de ácidos orgânicos e ficam definidos o
28 | P á g i n a
número de células e a capacidade de distensão das suas paredes e, consequentemente, a dimensão potencial do bago e a produção à vindima (Lissarrague et al., 2007). Designada também de fase herbácea, tem uma duração de cerca de 5 a 6 semanas, em função das características das castas, do seu grau de precocidade e valores de temperatura, o que para as nossas condições, corresponde ao período compreendido entre meados de julho a inícios de agosto (Reynier, 1986).
Na segunda fase de crescimento (fase III), que se inicia com o pintor, o bago perde rigidez, perde clorofila e, no caso de castas tintas, inicia a pigmentação da película. Durante esta fase dá-se a acumulação de açúcares, dos componentes da cor e dos aromas, a concentração em ácidos orgânicos decresce e o seu crescimento é apenas resultante do alargamento celular.
Na figura 7 estão representadas as fases de crescimento do bago ao longo do ciclo de maturação.
Figura 7 – Fases de crescimento do bago e acumulação de compostos (Magalhães, 2008; adaptado de Fregoni, 1999).
29 | P á g i n a
2.2.1 Evolução dos Compostos Fenólicos
A síntese das antocianinas começa no pintor e vão-se acumulando ao longo da maturação da uva (Perez-Magarino, 2004). No pintor as antocianinas aparecem sob a forma de monoglucosido e respetivos esteres, principalmente com o ácido acético, ácido cafeico e ácido p-cumárico, e a esta acumulação deve-se o aparecimento da cor tinta nas uvas (Kelebek, 2006).
A evolução do conteúdo antociânico é caracterizada por 3 fases (Ribéreau-Gayon
et al, 2006): na primeira fase o nível de antocianinas apresenta um ligeiro
aumento, na segunda fase um aumento de antocianinas e na terceira fase em que se observa uma estabilização seguida de decréscimo até ao fim da maturação tecnológica.
A taxa de acumulação de antocianinas tem sido relacionado com várias condições agro-ambientais, tais como, a cultivar, o clima, as condições do solo, condições de rega e praticas culturais, no entanto pode ocorrer um decréscimo destas mesmo antes da vindima e/ou durante a sobrematuração (Río Segade, 2008).
A temperatura tem demonstrado ter um papel direto e importante na formação dos compostos fenólicos, nomeadamente, das antocianinas (Huglin & Schneider, 1998).
Em zonas frias e de fraca insolação (latitudes e/ou altitudes elevadas), é menor a concentração de antocianinas, sendo aquelas geralmente desfavoráveis à produção de vinhos tintos de grande qualidade. Por outro lado, temperaturas elevadas, até 35º C, e grandes amplitudes térmicas diurnas (dias quentes, noites frias) são favoráveis à síntese de antocianinas, originando vinhos com mais cor (Magalhães, 2008).
Enquanto temperaturas baixas (14 - 9º C dia e noite, respetivamente) não conduzem a grandes concentrações de antocianinas (Combe, 1987), temperaturas a partir de 30º C também tem como efeito a diminuição da síntese de antocianinas (Tarara et al., 2008), podendo mesmo chegar a ser uma inibição completa e irreversível quando se atingem temperaturas muito elevadas.
Existem estudos que defendem que em climas quentes, o bago pode chegar a temperaturas demasiado altas que inibem a formação de antocianinas e portanto reduz a cor da uva (Downey et al., 2006).
30 | P á g i n a
A radiação solar é o fator que mais influencia a biossíntese e acumulação de antocianinas (Mazza & Miniati, 1993). Segundo este autor, a redução da exposição da videira a radiação solar provoca uma diminuição do nível de antocianinas nos bagos. Confirma Reynier (1986) quando cita Glories(1676) que refere que as temperaturas elevadas exercem um efeito negativo sobre a coloração dos bagos, contudo, pelo contrário, a iluminação direta dos cachos é favorável.
Vários estudos foram efetuados com o objetivo de avaliar a influência do stress hídrico na acumulação de compostos fenólicos. Matthews e Anderson (1988) registaram maior concentração de polifenóis totais e antocianinas totais nos bagos da casta “Cabernet Franc” em plantas sujeitas a rega deficitária ao longo de todo o ciclo e em plantas na qual a rega foi interrompida antes ou depois do pintor do que nas plantas mantidas em conforto hídrico durante todo o ciclo.
Refere Magalhães (2008) que práticas culturais que conduzam a um vigor excessivo são desfavoráveis à síntese de antocianinas, pois os fotoassimilados dirigem-se preferencialmente para a síntese proteica, em detrimento da dos açucares. Assim, solos profundos e ricos, excesso de adubação azotada e mal localizada no ciclo vegetativo, rega abundante no período de maturação, o excesso de folhagem que dificulta a penetração da luz no interior da copa, são fatores que não abonam na síntese de antocianinas.
Confirma Ojeda et al. (2002) quando refere que a acumulação de antocianinas nos bagos é determinada por fatores climáticos, nomeadamente, a temperatura e a radiação, pelas características do solo, pela disponibilidade em azoto e pelas operações de maneio da sebe, com sejam o sistema de condução e a desfolha. De forma geral, ao longo da maturação, na grainha, o teor de taninos extraíveis vai diminuindo, tornando o mosto menos herbáceo e adstringente, enquanto na pelicula aumentam os polifenóis.
A intensidade corante depende não só do teor em antocianinas e do grau da sua extratibilidade, mas também dos taninos e pH do mosto. Também a extração das antocianinas é devida, em parte, à quantidade de moléculas biossintetizadas nas células peliculares (associadas às características do "terroir"), mas sobretudo ao estado de degradação das células à maturação, sob ação enzimática (característica da casta) (Gaulejac et al., 1998).
A difusão dos constituintes fenólicos para o mosto em fermentação depende da solubilidade e localização destes no bago da uva. Esta difusão é igualmente
31 | P á g i n a
afetada por diversos fatores incluindo a temperatura, teor em etanol e dióxido de enxofre. As antocianinas localizadas nas películas e polpa de variedades tintureiras, são extraídas rapidamente, atingindo a sua concentração máxima após alguns dias e diminui lentamente enquanto a extração dos taninos continua (Cheynier, 2003).
A análise da maturação fenólica é baseada na evolução dos compostos fenólicos presentes nas peliculas e nas grainhas da uva. Considera-se que a uva está madura quando a extratibilidade dos taninos das sementes diminui, a concentração das antocianinas e taninos da pelicula aumenta e a degradação das paredes celulares da pelicula facilita a extração destes compostos (Glories, 1991; Guerra, 2002).
O acompanhamento da maturação fenólica é útil para determinar a melhor época de colheita das uvas tintas, para testar a adaptação das variedades às diferentes regiões de cultivo e para adaptar as condições de vinificação à uva produzida, visando a elaboração de vinhos de qualidade.
2.3. Métodos de Análise
O momento ótimo de colheita da uva para vinificação depende de vários fatores, tradicionalmente, analisam-se o teor de açúcar, o pH e acidez total, para determinar a data de começo da vindima, o conjunto destes parâmetros caracterizam a maturação tecnológica da uva. Contudo, para além dos referidos, existem mais parâmetros qualitativos que são determinantes para a produção de vinhos de alto padrão de qualidade, como sendo o teor de compostos fenólicos, caracterizando estes, a maturação fenólica da uva.
O acompanhamento da maturação fenólica das uvas e o conhecimento dos teores de compostos fenólicos são elementos essenciais para a gestão da vindima, pois permitem apontar a data ótima de colheita da uva, e na adega, definir protocolos de vinificação diferenciados, de forma de adequar a tecnologia de vinificação (Gonzáles-Sanjosé et al., 1991), como sendo, a duração de macerações, a intensidade e a frequência de remontagens, as temperaturas de maceração e de fermentação, etc.; tendo em vista um determinado perfil de vinho ( González-Neves et al., 2007).
32 | P á g i n a
Vários são os métodos de avaliação do conteúdo das uvas em compostos fenólicos que têm sido sugeridos por diversos autores, sendo utilizados para determinar o teor de antocianinas e taninos, de forma a estimar o potencial enológico das uvas.
Este trabalho realizou-se no contexto da comparação de três metodologias de avaliação da maturação fenólica de uvas, os quais se introduzem nos pontos seguintes.
2.3.1. Metodologia clássica
De acordo com Bautista-Órtin (2005), várias metodologias foram desenvolvidas na tentativa de estimar a maturação fenólica das uvas, sendo que o método mais utilizado é o desenvolvido por Glories (1990) e descrito por Saint-Cricq et al. (1998), também referido por Ribéreau-Gayon et al. (2006).
Esta metodologia sugere uma comparação entre os extratos obtidos após um processo de maceração dos bagos de uva triturados, em duas soluções: uma com valor de pH de 1,0 e outra com pH de 3,2. Tratam-se de soluções aquosas acidificadas, a pH 1 (HCI N / 10) e pH 3,2 (solução de ácido tartárico a 5g / l neutralizado).
O princípio deste método consiste em extrair, rapidamente, as antocianinas das peliculas dos bagos de uva, gentilmente em primeiro lugar e, em seguida, sob condições mais extremas. A acidez é utilizada como um vetor, para facilitar a extração.
É recomendado um procedimento de trituração grosseira das uvas, e o preparado resultante deve ser diluído pela metade, com ambas as soluções, uma com valor de pH de 1,0 e outra com pH de 3,2. O esmagamento das grainhas, também contribui para a extração parcial dos seus taninos.
A partir das duas macerações das uvas inteiras trituradas, realizadas durante 4 horas, após filtração, pode ser determinado o teor de polifenóis com base na medição da absorvância a 280 nm (IPT) da amostra a pH 3,2, como descrito por Ribéreau-Gayon et al. (2006), enquanto que as antocianinas podem ser quantificadas aplicando o método da descoloração pelo ião bissulfito, também descrito por Ribéreau-Gayon et al. (2006).
33 | P á g i n a
O meio ácido, pH 1, promove o rompimento da membrana celular (próteo-fosfolipídica) quebrando as ligações com as proteínas e, consequentemente, libertando o conteúdo dos vacúolos. Todas as antocianinas são, então, extraídas e solubilizadas na solução a pH 1.
A diluição das uvas trituradas com a solução a pH 3,2, promove uma extração de antocianinas que é, aproximadamente, comparável à que se realiza no processo de vinificação clássica de vinho tinto, em cubas de fermentação. Se a membrana celular não for porosa, as antocianinas são extraídas em pequena quantidade, contudo, se esta é quebrada por enzimas, então os pigmentos são libertados dos vacúolos e a extração tende a aproximar-se dos níveis descritos no caso anterior. A diferença entre o teor de antocianinas nos dois extratos obtidos é uma indicação do estado de fragilidade das membranas das células das películas e, consequentemente, do seu estado de maturação, sendo que a fragmentação parcial das grainhas permite uma maior extração dos taninos.
A concentração de antocianinas é dada pela seguinte formula:
Sendo , a diferença entre as Abs 520 nm das duas amostras (com e sem descoloração pelo ião bissulfito), para percurso ótico de 10 mm.
Ribéreau-Gayon et al. (2006) destaca o facto de que as antocianinas e os taninos são extraídos da pelicula sobre as mesmas condições, e que se um extrato com elevado conteúdo de antocianinas possui também, um elevado conteúdo em taninos, então as antocianinas podem ser consideradas como indicadores dos taninos nas peliculas.
Outros parâmetros podem ser calculados após o conhecimento do teor de polifenóis e de antocianinas de uma amostra, como o cálculo da extratibilidade das antocianinas (1) e a contribuição dos taninos provenientes das grainhas (2) (Ribéreau-Gayon et al., 2006).
34 | P á g i n a
Onde A pH 1,0 e A pH 3,2 representam o teor em antocianinas totais dos respetivos extratos, a pH 1,0 e a pH 3,2, expresso em mg/L.
Ribéreau-Gayon et al. (2006) refere que é conhecido que o valor de Abs. 280 para os extratos da pelicula está correlacionado com a concentração de antocianinas por uma relação aproximada de Abs. 280 = A pH 3,2 x 40, sendo A pH 3,2 expresso em g/l. Assim, quanto maior o valor de MP, maior será a contribuição dos taninos das grainhas e maior o risco que estes compostos transmitam um efeito negativo ao sabor do vinho.
Os métodos para quantificação das antocianinas encontram- se bem elucidados na literatura. Uma maneira de se expressar os resultados da determinação de antocianinas é em termos da quantidade absoluta total de antocianinas presentes num extrato particular, estimando, dessa maneira, o teor de antocianina.
A grande maioria dos flavonóides absorvem luz na zona do espectro entre 350 e 380nm de comprimento de onda, enquanto que as antocianinas são capazes de absorver a luz, na zona do visível, compreendida entre os comprimentos de onda 496 e 550nm (Brouillard, 1982). Essa característica particular permite a quantificação das antocianinas por métodos espectrofotométricos em medições simples de absorvância em comprimentos de onda adequados (Wrolstad, 1976). De acordo com González-Neves et al. (2003), a análise do potencial fenólico das uvas, de acordo com a metodologia descrita acima, pode ser uma excelente ferramenta para melhorar a gestão do processo de vinificação.
2.3.2. FTIR - Espectrofotometria de infra vermelhos com transformada de Fourier
As espectroscopias no infravermelho próximo (NIR) e médio (MIR) são técnicas de relevância cada vez maior em controlo de qualidade de processos e produtos industriais (Blanco et al., 1998). Estas técnicas permitem a caracterização
35 | P á g i n a
qualitativa e quantitativa de amostras de materiais em processamento através do espectro de absorção nesta região do infravermelho.
Estes espectros possuem informação relacionada com a composição química e com as propriedades físicas da amostra, como a granulometria e a viscosidade (Blanco et al., 1998).
A espectrometria de infravermelho por transformada de Fourier (FTIR) em enologia, deve ser baseada em calibrações analíticas específicas estabelecidas através da quantificação dos parâmetros a analisar, por métodos físico-químicos usuais. A calibração global desenvolvida para a análise de vinhos permite bons resultados para todos os parâmetros, conferindo alto grau de confiança à metodologia FTIR (Moreira et al., 2002).
Estes mesmos autores referem que a metodologia de análise por FTIR não constitui um processo de análise absoluto. O valor analítico do parâmetro a determinar é obtido pela aplicação de um algoritmo em que são compensadas as contribuições de interferentes relativamente ao valor que adviria da avaliação direta das absorvâncias nos diversos comprimentos de onda.
O controlo da qualidade dos resultados é assegurado pela utilização da solução “zero” e de uma solução de equalização.
Esta tecnologia é uma forma eficiente de fazer medições espectrometricas usando luz infravermelha. Esta abordagem, ao contrário de métodos monocromáticos ou dispersivos, é vantajosa quanto à produtividade, à precisão e ao multíplex necessários para as aplicações do usuário final.
Um interferómetro típico divide a luz infravermelha de uma fonte espectral em dois feixes, refletindo um feixe num espelho fixo e outro num espelho móvel. O espelho em movimento introduz um atraso de tempo que provoca uma mistura de interferências construtivas e destrutivas na recombinação dos feixes. A verificação deste sinal versus a posição do espelho produz um interferograma que pode ser convertido num espectro utilizando a transformada de Fourier.
A transformada de Fourier é utilizada como um método matemático para a criação, em serie, da curva de expansão (interferograma). A transformada consiste na soma de senos e co-senos das distintas frequências óticas que compõem a radiação. Com a ajuda de um programa de computador, estes cálculos complexos, são calculados de forma rápida e exata.
36 | P á g i n a
Moreira et al. (2002), defendem que esta metodologia de análise está particularmente destinada às situações em que o prazo de resposta é crítico e a utilização de métodos oficiais não se torna imperativa. Defendem ainda a metodologia FTIR, ao nível da simplicidade de operação, da elevada cadência e dos baixos custos de análise e manutenção.
Rousseau et al. (2002), referem que as condições de armazenagem e de espera das amostras de uva para análise FTIR, podem provocar uma modificação dos parâmetros a analisar, particularmente nos indicadores de cor.
A metodologia FTIR é aprovada e apontada com grande fiabilidade por Dubernet (2000).
2.3.3 Refletância difusa
Os métodos de refletância (R) podem ser usados em amostras que são difíceis de analisar por métodos de transmitância.
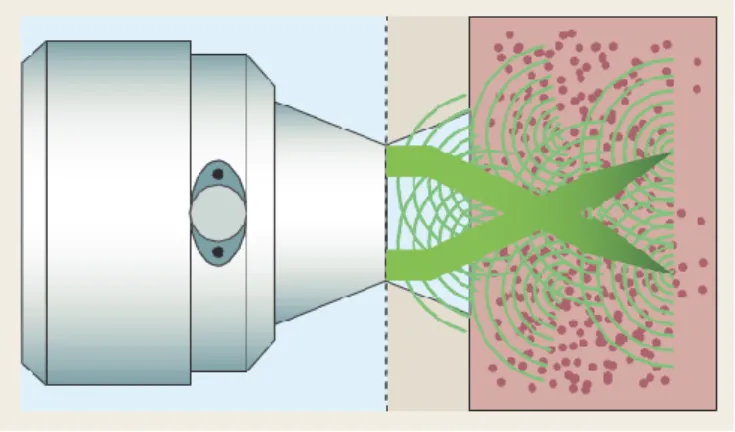
Uma importante diferença entre a transmissão e a refletância dá-se devido ao diferente caminho ótico percorrido pela luz. Enquanto que na transmissão o caminho ótico é constante para todo número de onda, na refletância, o caminho pode ser variável, como elucidam abaixo as figuras 8 e 9.
Por exemplo, as bandas fracas no espectro por transmissão aparecerão mais fortes na refletância.
Figura 8 – Esquema da transmissão da luz por uma amostra (Raccagni, 2011).
Os métodos de refletância podem ser divididos em duas categorias: a refletância interna, que envolve uma célula de refletância total atenuada em contacto com a amostra, e a refletância externa que envolve um feixe de luz refletido diretamente
37 | P á g i n a
da superfície da amostra. Na refletância externa, a radiação, quando incide na amostra, pode ser refletida sob a forma de refletância especular ou difusa. A refletância é fortemente afetada pelas características físicas da amostra, tais como a granulometria e o grau de homogeneidade, assim como a forma e características superficiais das partículas, que influenciam de forma sistemática o espectro em toda a sua gama de comprimentos de onda (Osborne, 1993).
Figura 9 – Refletância difusa pela passagem da luz por uma amostra (Maselli, 2014).
A refletância especular ocorre quando o ângulo da radiação refletida iguala o respetivo ângulo de incidência. A intensidade da luz refletida depende do ângulo de incidência, do índice de refração do cristal, das características da superfície e das propriedades de absorção da amostra.
A reflexão especular é de maior intensidade na região onde a amostra apresenta forte absorção e neste caso pode ocorrer severas distorções no espectro obtido (Ferrão, 2001).
A refletância difusa ocorre quando a luz incide na superfície de um material e é parcialmente refletida e transmitida em todas as direções (Figura 9).
A refletância difusa mede a razão entre a intensidade da luz refletida a partir da amostra, ou seja, a porção de radiação que penetra na superfície da amostra e não é absorvida, mas refletida, e a intensidade da luz incidente.
O caminho percorrido pela luz pode ser considerado aleatório devido a múltiplas reflexões, algumas das quais após percorrer o interior de partículas que constituem a amostra.
É recomendado que as dimensões das partículas das amostras sejam reduzidas, de modo a reduzir a quantidade de luz refletida em modo especular.
38 | P á g i n a
Nesta técnica, quando a radiação penetra na amostra, pode ser refletida da superfície de uma partícula ou ser transmitida através desta. A radiação refletida da superfície é tipicamente perdida. A radiação que passa através da partícula pode ser refletida na próxima partícula ou transmitida através desta. Este efeito de transmissão-reflexão pode ocorrer várias vezes na amostra. Assim, a radiação incidente é dispersa em todas as direções num largo ângulo. Por último, a energia da radiação dispersa é recebida num espelho esférico e reunida no detetor (Santos, 2007).
A interpretação de qualquer espectro é, essencialmente, um exercício de descoberta e entendimento de como interage a radiação eletromagnética com o material, a fim de se descobrirem informações ou propriedades relacionadas com a composição dos seus constituintes (Ferrão, 2001).
Esta tecnologia permite recolher informação mais completa sobre líquidos opacos com partículas em suspensão, tais como o mosto de uva triturado.
2.3.3.1. Equipamento MT00 (Maselli Misure)
Tendo por base a tecnologia de refletância difusa, a empresa Maselli Misure, desenvolveu o equipamento MT00, para análise de compostos fenólicos.
O componente de refletância difusa corresponde à luz que penetra no interior da amostra. Ela sofre absorção molecular e processos de refração, difração e de reflexão múltipla, resultando na dispersão em todas as direções, incluindo o seu retorno para o detetor de reflexão.
Este equipamento, por uma medição ótica, traduz a evolução da maturação fenólica diretamente a partir do sumo de uvas esmagadas, mosto.
As análises são feitas a partir de uma amostra de bagos de uva triturados por um misturador, fornecido junto com o equipamento, sendo que não necessitam de reagente químico e não há tempo de maceração.
O MT00 é um dispositivo dedicado aos laboratórios de enologia, pois, rapidamente, avalia as antocianinas, índice de polifenóis totais (IPT), a extratibilidade desses parâmetros da uva (determinação dos mesmos parâmetros que o método de Glories) e qualidade fenólica.
39 | P á g i n a
O espectrofotómetro para refletância difusa MT00 utiliza como fonte de luz os LED de comprimentos de onda específicos, selecionados por meio de filtros de interferência.
Figura 10 – Equipamento MT00 da Maselli Misure (Maselli, 2014).
Ao efetuar uma medição de refletância e turbidez combinadas, o software do MT pode calcular a densidade ótica nos comprimentos de onda de 280-420-520-880 nm, como abaixo elucidado na figura 11.
Figura 11 – Gamas de comprimentos de onda analisadas pelo MT00 (Raccagni, 2011).
Os valores do espectro de refletância difusa são extrapolados para todos os comprimentos de onda e interpretados para calcular os seguintes índices de maturação fenólica:
00 00
40 | P á g i n a
1. Antocianinas potenciais ou totais (AT): representam a quantidade total de antocianinas extraíveis (medido em laboratório a pH = 1.0), sendo que sua a quantidade varia muito, dependendo das castas;
2. Índice de polifenóis totais (IPT): representa o conjunto de compostos polifenóis presentes, medidos a um comprimento de onda de 280 nm;
3. Nuance ou tonalidade (N): é a relação entre o componente clássico amarelo (Abs 420) e o componente vermelho (Abs 520). É um índice de maturidade das uvas tintas. Se estamos na presença de uma amostra de uvas saudáveis e não muito maduro, o índice de maturidade vai mostrar um valor muito alto (cerca de 1). Por outro lado, se estamos na presença de uma amostra de uvas maduras e saudáveis, o índice de maturidade pode ser inferior a 0,4;
4. Extratibilidade de antocianinas (EA): indica a potencialidade de extração das antocianinas durante o processo de vinificação, a qual depende da maturação das uvas, quanto mais maduras estão as uvas, mais a sua pelicula enfraquece; e da casta, pois existem castas que possuem a pelicula dos bagos bastante frágil.
5. Contribuição de taninos provenientes das grainhas (MP%): contribuição dos taninos das grainhas em conteúdo fenólico do bago; o valor de MP depende da casta, as condições de maturação e do número de grainhas por bago;
6. Qualidade Fenólica (QP): O índice QP foi concebido para ser sensível à componente de cor dos polifenóis e estabilidade da cor do vinho resultante. Esta é a medida de compostos fenólicos da uva orientados para a intensidade corante do vinho final.
Aquando da criação do MT00, a empresa Maselli Misure criou vários modelos deste equipamento, para que o mesmo se adapta-se às necessidades específicas de cada adega. A tabela 1 apresenta os parâmetros analisados por cada um dos modelos do equipamento MT00, bem como, as unidades de medição para esses parâmetros, os intervalos de medição, valores típicos de gama de medição, e a
41 | P á g i n a
significância esperada dos valores em medição quando comparados com análises de bancada.
Tabela 1 – Características dos vários modelos do MT00 (Raccagni, 2011).
Na figura 12 por ver-se um exemplo de visualização de uma curva de maturação produzida pelo MT00, neste caso, os parâmetros visualizados são o índice de polifenóis total (IPT) e as antocianinas totais (AT).
Figura 12 – Exemplo de visualização de uma curva de maturação de uma parcela, com os parâmetros:
42 | P á g i n a
O equipamento MT00 permite a determinação rápida e precisa do perfil fenólico das uvas, assim, fornece ao enólogo, informação que pode ser utilizada em diferentes fases do processo enológico, como, no acompanhamento da evolução da maturação fenólica, pela determinação do tempo ótimo de colheita e criação de curvas de maturação; na otimização das operações culturais, pela identificação das parcelas com elevado potencial de polifenóis (zonagem) e no acompanhamento da eficácia de determinadas intervenções na vinha; na seleção de uvas durante a colheita, utilizando tecnologias de vinificação diferenciadas, dependendo da qualidade fenólica; e na criação de um banco de dados para criação de históricos por parcelas e por campanha.
Em suma, o MT00 permite ao enólogo uma serie de vantagens, pela forma expedita e rigorosa com que fornece valores de compostos fenólicos da uvas. A empresa Maselli Misure aponta as seguintes mais valias deste equipamento: a análise é realizada diretamente nas uvas trituradas; existe bastante facilidade de uso, mesmo por pessoal não treinado; o método de análise é simples e rápido; não será necessário qualquer outra análise a compostos fenólicos, pois o equipamento abrange todos os parâmetros mais importantes, em maioria equivalentes aos determinados pelo método de Glories (1990); é um método não reativo; o interface de usuário é bastante intuitivo e abrangente, permitindo a apresentação gráfica de dados e criação de uma base de dados abrangente com todas as informações da campanha; custo mínimo por análise.
43 | P á g i n a CAPITULO 3 | METODOLOGIA E RESULTADOS
3.1.INTRODUÇÃO
3.2. COLHEITA DE AMOSTRAS E METODOLOGIAS
3.2.1.ANÁLISE AOS COMPOSTOS FENÓLICOS
3.2.1.1.ANÁLISE DE BANCADA
3.2.1.2.ANÁLISE POR FTIR
3.2.1.3.ANÁLISE POR REFLETÂNCIA DIFUSA
3.2.2.ANÁLISES GERAIS
3.2.2.1.AÇUCARES
3.2.2.2. PH
3.2.2.3. ACIDEZ TOTAL
44 | P á g i n a
3.1. Introdução
As grandes adegas elaboram os seus vinhos a partir de um vasto número de parcelas de vinhas, por vezes em condições de produção bastante distintas e em diferentes regiões, o que origina uma gama extensiva de qualidade de uvas.
Em particular, nas adegas cooperativas, este facto é agravado devido ao elevado número de associados, às diferentes formas de condução das suas parcelas de vinha e à heterogeneidade das condições edafoclimáticas, que contribuem para um elevado grau de variabilidade qualitativa da uva na chegada à adega.
Assim, torna-se indispensável uma criteriosa seleção qualitativa da uva à chegada à adega, de forma a encaminhar os reboques de uva para descarregar em lugares distintos de acordo a aptidão da uva e perfil de vinho pretendido.
Se é verdade que alguns parâmetros qualitativos da uva são de medição rápida e direta, como sendo o teor em açúcar, a acidez, o pH, etc., o mesmo não se verifica para a avaliação dos compostos fenólicos, sendo que estes permitem ao enólogo explorar o máximo potencial da uva, pois a sua concentração e extratibilidade durante a vinificação, conferem ao vinho atributos sensoriais como a estrutura, corpo e adstringência.
Este estudo realizado na CARMIM - Cooperativa Agrícola de Reguengos de Monsaraz, situada em Reguengos de Monsaraz - Alentejo, pretende, como referido, a comparação de metodologias para caracterização fenólica de uma amostra de uva, nomeadamente, entre as metodologias mais clássicas e a metodologia de refletância difusa, sobre a qual se carece de informação, mas que apresenta um elevado potencial, dada a forma expedita e rápida com que pode ser realizada e obtidos dados.
3.2. Colheita de amostras e metodologias
Para a realização deste ensaio foram colhidas 100 amostras de uva tinta durante a campanha de vindima do ano 2012, entre os dias 11 de Setembro e 26 de Setembro. As amostras foram colhidas, diretamente, dos reboques de uva entregues pelos associados da CARMIM, e imediatamente antes da descarga nos tegões.
45 | P á g i n a
Nas amostras colhidas, privilegiou-se a heterogeneidade de amostragem, no sentido de obter um largo espectro de estados de maturação fenólica das uvas e consequente, maior robustez aquando da comparação dos parâmetros analisados pelas três metodologias.
As amostras de uva foram colhidas em baldes de 20 litros e contemplaram vários cachos de uva, os quais foram desengaçados para recipientes e misturados todos os bagos de cada amostra.
Da totalidade de bagos obtidos por amostra, é retirada, aleatoriamente, a quantidade necessária para a realização das análises aos compostos fenólicos das uvas pelas diferentes metodologias, e análises ao álcool provável, ao pH e à acidez total (tabela em anexo).
3.2.1. Análise aos compostos fenólicos
Para a análise dos compostos fenólicos foram utilizadas as três metodologias, afim de correlacionar os valores obtidos.
Segue uma descrição de cada uma das metodologia utilizadas no decorrer do estudo.
3.2.1.1. Análise de bancada
As análises de bancada para determinação de compostos fenólicos seguiram a metodologia segundo Glories (1990).
A metodologia consiste em recolher 200 bagos de uvas da amostra, sendo estes triturados inteiros com a ajuda de uma trituradora.
Após triturados os bagos, são retirados 50 g e adicionado o mesmo volume de HCl N/10 (solução aquosa a pH 1,0).
São retirados mais 50 g do triturado e adicionado o mesmo volume de solução tampão pH 3,2.
Ambas as preparações, pH 1,0 e pH 3,2, são realizadas em duplicado para avaliação da repetibilidade e conferir consistência ao ensaio.