Universidade de Trás-os-Montes e Alto Douro
Reprodução de Equinos
Maneio Reprodutivo das Éguas Geriátricas
Dissertação de Mestrado Integrado em Medicina Veterinária
Sofia Manuela Mota da Silva
Orientador: Doutor Miguel Nuno Pinheiro Quaresma
Universidade de Trás-os-Montes e Alto Douro
Reprodução de Equinos
Maneio Reprodutivo das Éguas Geriátricas
Dissertação de Mestrado Integrado em Medicina Veterinária
Sofia Manuela Mota da Silva
Orientador: Doutor Miguel Nuno Pinheiro Quaresma
DECLARAÇÃO
NOME: SOFIA MANUELA MOTA DA SILVA
C.C.: 13863456
TELEMÓVEL: 914263666
CORREIO ELECTRÓNICO: SOFIASILVAMV@GMAIL.COM
DESIGNAÇÃO DO MESTRADO: MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA: REPRODUÇÃO EQUINA: MANEIO REPRODUTIVO DAS ÉGUAS GERIÁTRICAS ORIENTADOR: DOUTOR MIGUEL NUNO PINHEIRO QUARESMA
ANO DE CONCLUSÃO: 2017
DECLARO QUE ESTA DISSERTAÇÃO DE MESTRADO É RESULTADO DA MINHA PESQUISA E TRABALHO PESSOAL E DAS ORIENTAÇOES DO MEU SUPERVISOR. O SEU CONTEUDO É ORIGINAL E TODAS AS FONTES CONSULTADAS ESTÃO DEVIDAMENTE MENCIONADAS NO TEXTO, E NA BIBLIOGRAFIA FINAL. DECLARO AINDA QUE ESTE TRABALHO NÃO FOI APRESENTADO EM NENHUMA OUTRA INSTITUIÇÃO PARA OBTENÇÃO DE QUALQUER GRAU ACADÉMICO.
VILA REAL, ABRIL DE 2017. SOFIA MANUELA MOTA DA SILVA
“As éguas não leem livros.” Ana Luísa Costa
AGRADECIMENTOS
À Universidade de Trás-os-Montes e Alto Douro, a todos os professores, técnicos, auxiliares e demais funcionários, o meu obrigada.
Ao Doutor Miguel Nuno Pinheiro Quaresma, por ter aceitado ser meu orientador e por toda a ajuda na construção desta dissertação, transmissão de conhecimentos, paciência e horas de dedicação.
À Dra. Ana Luísa Costa, por todas chamadas de atenção, por todos os conhecimentos transmitidos ao longo do estágio e por todas as vezes que exigiu mais de mim.
Ao Nuno Oliveira, pela responsabilidade que me deu.
Ao Dr. Gonzalo Marañon, ao Yago, à Ana, à Olga e à restante equipa do Horsepital S.L., por me terem recebido, pelos conhecimentos transmitidos e por me darem apoio quando eu mais precisei, e especialmente ao Dr. William Manley por me ter mostrado o caminho a seguir.
À Dra. Madalena Roquete, à monitora Ana Casquilho, ao Engº. Francisco e à restante equipa da Fundação Alter Real, por me terem recebido, pelos conhecimentos transmitidos e pela oportunidade de participação em diversos eventos ao longo do estágio.
À Helen Burgess e restante equipa, por me terem dado a enorme oportunidade de estagiar no Haras de la Gesse, e aos meus companheiros Berny, Bruno, Célia, Diogo, João, Pedro, Poucachinho e Vitória, por disfarçarem as minhas saudades de casa.
À Aninha Costa, pelos momentos de diversão ao longo destes anos, mas principalmente pela ajuda na superação dos momentos menos bons.
Às minhas amigas Carla, Lara, Mara, Joana, Raquel, Luísa, e seus respetivos apêndices, por serem a família que eu escolhi.
Ao Bruno por sempre me carregar às costas mesmo quando lhe faltam as forças. Aos cavalos Malcontent, Norval du Blondel e Calu, por terem sido as maiores paixões da minha vida e os responsáveis por este sonho.
Aos meus pais, por tornarem esta aventura possível…
RESUMO
A indústria equina mundial não sobrevive sem um maneio reprodutivo eficaz e eficiente dos cavalos, o que torna o médico veterinário numa peça fundamental na reprodução equina. O cavalo vê frequentemente a sua componente reprodutiva adiada para estágios mais tardios da sua vida devido à predileção pela performance desportiva. Além disso, é muito frequente serem apresentados à reprodução animais subférteis e bastante expostos aos efeitos do envelhecimento, o que dificulta bastante o trabalho do médico veterinário. A reprodução de éguas geriátricas está a tornar-se numa prática cada vez mais comum, devido aos avanços na medicina da reprodução. Por esse facto, torna-se importante compreender os efeitos do envelhecimento nas éguas e saber como contornar esses efeitos.
O objetivo deste trabalho foi efetuar um estudo restrospectivo, comparando diferentes parâmetros relacionados com a fertilidade em éguas de grupos etários diferentes. Para tal, foram utilizados dois grupos de éguas, cada um com sete animais, e revistos 923 registos. O primeiro grupo era constituído por éguas jovens (grupo 1) e o segundo grupo por éguas velhas (grupo 2). O estudo foi divido em 3 componentes que englobaram: o acompanhamento reprodutivo das éguas na componente prática do estágio; uma pesquisa bibliográfica aprofundada do tema; e um estudo retrospetivo dos casos observados.
Verificou-se que os dois grupos de éguas ovularam pela primeira vez na mesma altura do ano. Existiu uma tendência para um maior número de ovulações duplas em éguas do grupo 2 (p=0,061). O intervalo interovulatório nas éguas do grupo 1 foi de 16,8 dias e nas éguas do grupo 2 foi de 21,4 dias (p = 0,206). A incidência de folículos anovulatórios foi de 0% no grupo 1, e 3,9% no grupo 2. A incidência da morte embrionária precoce foi de 0% no grupo 1 e de 17,4% no Grupo 2 (p = 0,251). A incidência da presença de líquido intrauterino foi significativamente maior no grupo 2 (46,1%), do que no grupo 1 (25,8%) (p < 0,001). A taxa de sucesso de recolha de embriões foi maior no grupo 1 (p = 0,272). Foram necessários em média 3,9 ciclos reprodutivos para se obter um poldro de uma égua velha, comparando com 2,4 ciclos reprodutivos para as éguas mais jovens.
A partir destes resultados podemos concluir que embora a reprodução de éguas mais velhas seja um desafio, com o tratamento correto e um maneio adequado, é possível alcançar o sucesso, embora com uma clara tendência a este ser menor que nas éguas jovens.
Palavras-chave: ciclo reprodutivo, endometrite, égua, geriátrica, maneio, transferência de embriões.
ABSTRACT
The world equine industry does not survive without an effective and efficient reproductive management of horses, which makes the veterinarian a key player in equine breeding. The horse often sees its reproductive component being delayed for later stages of its life due to the predilection for the sporting performance. In addition, sub-fertile animals are frequently exposed to reproduction and are often exposed to the effects of aging, which makes the veterinarian's work very difficult. Reproduction of geriatric mares is becoming an increasingly common practice due to advances in reproductive medicine. It is therefore important to understand the effects of aging on mares and how to circumvent these effects.
The goal of this work was to carry out a restrospective study that compares different parameters related to fertility in mares. For this, two groups of mares were used, each with seven animals, and 923 were reviewed and registered. The first group consisted of young mares (group 1) and the second group was composed of old mares (group 2). The study was divided in 3 components that included: the reproductive follow up of the mares in the practical component of the internship; a bibliographical research of the theme; and a retrospective study of the observed cases.
It was found that both groups of mares ovulated for the first time at the same time of the year. There was a tendency to observe a higher number of double ovulations on the mares of group 2 (p = 0.061). The interovulatory interval on the mares of group 1 was 16.8 days, and on the mares of group 2 was 21.4 days (p = 0.206). The incidence of anovulatory follicles was 0% on group 1 and 3.9% on group 2. The incidence of early embryonic death was 0% on group 1 and 17.4% on group 2 (p = 0.251). The incidence of intrauterine fluid was significantly higher on group 2 (46.1%) than on group 1 (25.8%) (p <0.001). The success rate of embryo collection was higher on group 1 (p = 0.272). It took an average of 3.9 reproductive cycles to obtain a foal from an older mare, compared to 2.4 reproductive cycles from the younger mares.
From these results we can conclude that although the reproduction of older mares is a challenge, with the correct treatment and adequate management, it is possible to achieve success, although with a clear tendency for worse results than in young mares.
ÍNDICE GERAL
I. NOTA PRÉVIA ... 1
II. REVISÃO BIBLIOGRÁFICA ... 5
1. Introdução ... 5 2. Anatomia ... 6 3. Fisiologia ... 7 3.1. Ciclo Reprodutivo ... 7 3.2. Influência Hormonal... 8 3.3. Sazonalidade... 9 3.4. Comportamento Reprodutivo ...11
3.5. Mudanças uterinas durante o ciclo éstrico ...12
3.6. Reconhecimento materno da gestação ...13
3. A Égua Geriátrica ...14
4.1. Doenças mais frequentes em éguas velhas ...15
4.2. Estratégias para melhorar a eficiência reprodutiva ...23
4.3. Tratamento da égua com fluido uterino ...28
4.4. O uso de técnicas reprodutivas assistidas ...33
III. OBJECTIVOS DO ESTUDO ...37
IV. MATERIAL E MÉTODOS ...39
1. Amostra ...39 2. Dados Epidemiológicos………..………40 3. Maneio do Efectivo ...40 4. Metodologia de Análise………...41 5. Análise estatística ...42 6. Parâmetros registados ...42 7. Limitações do Estudo...43 V. RESULTADOS E DISCUSSÃO...45 VI. CONCLUSÕES ...57
VII. REFERÊNCIAS BIBLIOGRÁFICAS ...59
LISTA DE FIGURAS, GRÁFICOS, QUADROS E TABELAS
Figura 1 – (A) Vista Dorsal e (B) Vista Lateral do trato reprodutivo da égua ... 6
Figura 2 - Níveis hormonais e correspondente atividade ovárica ao longo do ciclo éstrico ... 9
Figura 3 - Sazonalidade das éguas ao longo do ano ...10
Figura 4 – (A) Aspecto ecográfico do útero durante o estro (pregas endometriais). (B) Aspecto ecográfico do útero durante o diestro ...13
Figura 5 - Ultrassonografia de um folículo com múltiplas partículas ecogénicas no lúmen folicular ...17
Figura 6 – (A) Fluído uterino de Grau II; (B)Fluído uterino de Grau III ...29
Figura 7: Tipo de ovulação observada no Grupo 1 e no Grupo 2. ...48
Quadro 1. Casuística registada durante o estágio curricular. ... 2
Quadro 2 – Dosagens e considerações sobre os antibióticos de utilização mais frequente em terapia de endometrite. ...31
Quadro 3 – Dosagens e considerações sobre os antifúngicos de utilização mais frequente em terapia de endometrite. ...32
Quadro 4 - Indicação, preparação e protocolo de terapias alternativas para endometrite uterina ...33
Gráfico 1- Percentagem dos problemas observados no estágio curricular. ... 3
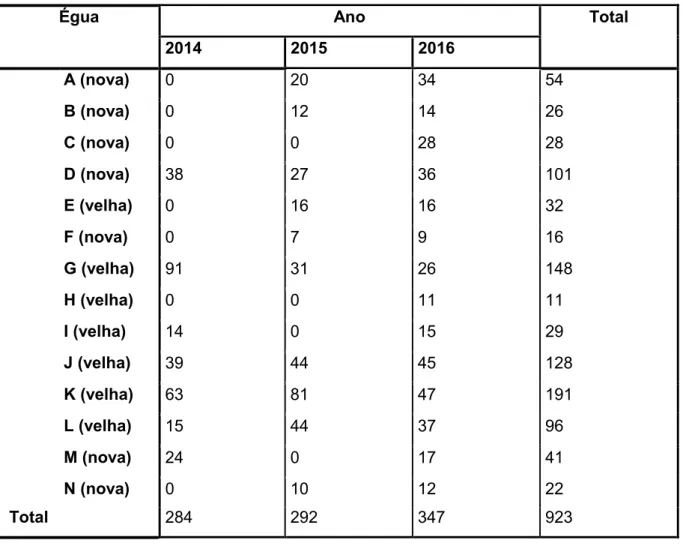
Tabela 1: Resumo das amostras recolhidas por égua/ano. ...45
Tabela 2: Momento da primeira ovulação por grupo de éguas/ano. ...46
Tabela 3: Comparação do intervalo interovulatório entre éguas novas e velhas. ...48
Tabela 4: Incidência da Morte Embrionária Precoce nos dois grupos de éguas...50
LISTA DE SIGLAS E ABREVIATURAS AA – Anglo-árabe AB - antibiótico AF – antifúngico CC – Condição Corporal cm – centímetro CL - corpo lúteo DMSO – dimetilsulfóxido Escherichia coli – E. coli
eCG - gonadotrofina coriónica equina FSH - hormona folículo-estimulante gr – gramas
GnRH - hormona libertadora de gonadotrofina hCG – Gonadotrofina Coriónica Humana HDLG – Haras de la Gesse H2O2 – peróxido de hidrogénio IA – inseminação artificial IM – intramuscular IV – endovenosa IU - intrauterino L – litro LH - hormona luteinizante LR - Lactato de Ringer
MEP - Morte Embrionária Precoce mg - miligramas
ml – mililitro
NAC - N-acetilcisteína PSA – Puro-Sangue Àrabe PGE - Prostaglandina E Pgf2α – Prostaglandina F2α
PSL – Puro-sangue Lusitano
PR-HDLG - Pôle Reproduction do Haras de la Gesse RAO - Obstrução Recorrente das Vias Aéreas Inferiores SC - subcutânea
TE - transferência de embriões UI - unidades internacionais µg - microlitro
I. NOTA PRÉVIA
A etapa final do curso de Mestrado Integrado em Medicina Veterinária inclui a realização de um estágio curricular e a elaboração de uma monografia baseada nas atividades presenciadas. O meu estágio curricular teve a duração de nove meses e duas semanas, sendo realizado em 4 entidades distintas. Os objetivos gerais do estágio foram a aquisição de um conhecimento integrado e prático da realidade da clínica de equinos, aprendizagem e treino de técnicas de diagnóstico, tratamento, capacidade de emissão de prognóstico de evolução da doença; domínio da comunicação adequada entre médico e cliente, desenvolvimento da capacidade de trabalho em equipa, assim como um estudo e aquisição de conhecimento mais aprofundado em Reprodução Equina.
A primeira parte do estágio foi realizada na Coudelaria Quinta Oliveira Lusitano Stud Farm, localizada na Póvoa de Varzim (Portugal), tendo início a 1 de Junho de 2015 e término a 28 de Agosto de 2015. As principais atividades desenvolvidas consistiram na reprodução de equinos, destacando-se: o controlo reprodutivo por ecografia transrectal (avaliando-se a presença de folículos no ovário e o seu tamanho, ecogenicidade uterina, presença de fluído endometrial, previsão do momento da ovulação e momento de inseminação) e palpação rectal (verificação da tonicidade uterina e avaliação da competência cervical), o diagnóstico de gestação e o maneio do garanhão.
A segunda parte do estágio foi realizada no Horsepital S.L., localizado em Madrid (Espanha), tendo inicio a 1 de Setembro de 2015 e término a 1 de Dezembro de 2015. As principais atividades desenvolvidas e acompanhadas consistiram sobretudo na medicina desportiva, de onde se destacaram os exames de claudicação (com recurso a testes de esforço, raio-X e ecografia), a utilização da cintigrafia no diagnóstico de claudicações e infiltrações intra-articulares; e cirurgia de equinos, de onde se destacaram as cólicas cirúrgicas, ablação a laser do palato mole, neurectomia do nervo digital palmar, artroscopias, remoção de fragmentos ósseos e castrações de cavalos criptorquídeos com recurso a laparoscopia.
A terceira parte do estágio foi realizada na Fundação Alter Real, localizada em Alter do Chão (Portugal), tendo início a 14 de Fevereiro de 2016 e término a 6 de Março de 2016. As principais atividades desenvolvidas e acompanhadas consistiram sobretudo na reprodução de equinos, de onde se destacaram: o controlo reprodutivo por ecografia transrectal e palpação rectal, o diagnóstico de gestação, colheita de sémen, inseminação artificial (utilizando sémen fresco e refrigerado) e transferência de embriões.
A última parte do estágio curricular ocorreu na Pôle Reproduction do Haras de la Gesse, localizado em Boulogne-sur-Gesse, Toulouse, França. Este estágio teve início no dia
25 de Março de 2016 e término no dia 16 de Junho de 2016. As principais atividades desenvolvidas consistiram sobretudo na reprodução de equinos, destacando-se: o controlo reprodutivo de éguas dadoras e éguas recetoras, diagnóstico de gestação, colheita de sémen, inseminação artificial (utilizando sémen fresco, refrigerado ou congelado), transferência de embriões e auxílio nos partos. O tema desenvolvido na presente tese surgiu aquando do acompanhamento reprodutivo de éguas mais velhas, que apresentam vários obstáculos para atingir o sucesso reprodutivo.
A casuística dos casos observados durante o estágio curricular encontra-se descrita no Quadro 1.
Quadro 1. Casuística registada durante o estágio curricular. Casuística Nº de
Ocorrências
Nº de Ocorrências
Cirurgia Total = 36 Dermatologia Total = 14
Ablação do Palato Mole 5 Hipersensibilidade a culicoídes
2
Artroscopia 3 Lacerações várias 4
Castração 7 Dermatofitose 8
Cólica Cirúrgica 9 Oftalmologia Total = 3
Herniorrafia 1 Úlcera da Córnea 3
Laparoscopia 4 Reprodutivo Total = 2619
Lavagem Articular 2 AB intrauterinos 92
Neurectomia do n. Digital Palmar 2 Colheita de Sémen 49 Remoção de fragmentos ósseos 3 Cultura 13
Digestivo Total = 47 Diagnóstico de Gestação 87
Cólicas Médicas 25 Exame Reprodutivo 2021
Dentística 18 Exantema Coital 5
Úlceras Gástricas 4 Flushing para Transferência de Embrião
54
Locomotor Total = 95 Inoculação de embrião na
Receptora
22
Abcesso Subsolar 10 Inseminação Artificial 93
Cintigrafia 7 Lavagem Uterina 118
Claudicação 44 Monta Natural 47
Infiltração 31 Parto Assistido 17
Laminite 3 Parto Distócico 1
Neonatologia Total = 11 Outros Total = 221
Artrite Séptica 1 Desparasitação 144
Falha de Imunização 2 Eutanásia 5
Impactação do Mecónio 1 Exame em Ato de Compra 12 Infeção por Rodococcus equi 3 Identificação Animal 7
O maior número de casos observados foram os relacionados com problemas reprodutivos, seguidos de problemas locomotores, digestivos, cirúrgicos, casos de neonatologia, dermatologia e oftalmologia (Gráfico 1). Além destes, houve outros casos que não se enquadram em nenhuma categoria específica, como foi o caso das desparasitações, eutanásias, exames em ato de compra, identificação animal e vacinações.
Gráfico 1- Percentagem dos problemas observados no estágio curricular.
O maneio reprodutivo da égua geriátrica foi o tema que se considerou ser mais interessante de desenvolver na presente tese, dado o número de casos observados, e o facto de ser um problema cada vez mais frequente e de grande importância para os criadores de cavalos. Pretendeu-se assim desenvolver os conhecimentos sobre as doenças que mais afetam as éguas geriátricas, os seus sinais clínicos, tratamento e prevenção.
. Cirurgia 1,2% Dermatologia 0,26% Digestivo 1,5% Locomotor 3,13% Neonatologia 0,24% Oftalmologia 0,01% Outros 7,27% Reprodutivo 86,2%
II. REVISÃO BIBLIOGRÁFICA 1. Introdução
A indústria equina mundial é uma importante fonte geradora de valor económico acrescentado e empregos. Esta indústria não sobrevive sem um maneio reprodutivo eficaz e eficiente, daí a sua importância na produção de equinos (Tezza & Dittrich 2006).
Os equinos apresentam um baixo índice de fertilidade e são pouco prolíficos. Isto porque a reprodução apenas se inicia aos 3 anos de idade, a gestação têm uma duração de 11 meses, e há apenas um produto por gestação, sendo relativamente comum a ocorrência de mortes embrionárias precoces ou abortos. Em parte, a dificuldade de obter uma gestação e de a levar a termo, deve-se à pouca ou nenhuma seleção para fertilidade na espécie, visto que normalmente apenas os animais vencedores de competições são selecionados para a reprodução, mesmo que sejam subférteis (Paradis 2002).
Idealmente, uma égua deveria entrar à reprodução a partir dos 3 anos de idade, sendo saudável, ter um aparelho reprodutor funcional e boa conformação da vulva, bom instinto maternal, boa genética e boa morfologia (Samper 2008). Acontece que éguas com um bom desempenho competitivo, não são colocadas à reprodução até ao término das suas carreiras. Apesar de nunca terem levado uma gestação a termo, são expostas igualmente aos efeitos do envelhecimento, como a degeneração glandular e a fibrose uterina (Pycock 2006).
Há também o caso das éguas geriátricas, progenitoras de produtos excecionais, que o proprietário insiste em continuar a reproduzir, mesmo que este se revele um já trabalho quase impossível. Isto porque estes animais apresentam um pobre desempenho reprodutivo, relacionado com vários fatores de envelhecimento tais como mudanças no funcionamento ovárico, estado do útero, conformação perineal, fraca condição corporal, e outros fatores como ciclos éstricos longos, corpos lúteos persistentes, folículos anovulatórios e estros silenciosos (Madill 2002).
O maneio da égua geriátrica é desafiante e pode ser ao mesmo tempo frustrante. Será função do médico veterinário fazer o correto controlo reprodutivo destes animais, escolher o melhor momento para a beneficiação e tentar corrigir eventuais defeitos de conformação, de modo a proporcionar as melhores condições possíveis para que ocorra a fecundação, e posteriormente uma gestação a termo (Madill 2011). O tratamento dos animais deve ser individual e de acordo com o seu valor monetário. O médico veterinário deverá dominar as áreas de anatomia e fisiologia, e deve ser capacitado para trabalhar com técnicas avançadas como a ultrassonografia, inseminação artificial e transferência de embriões (Tezza & Dittrich 2006).
2. Anatomia
O conhecimento da anatomia e fisiologia reprodutivas da égua é dos fatores mais importantes para se conseguir um bom maneio reprodutivo, visto que ajuda a alcançar o sucesso reprodutivo, minimizando perdas económicas para o criador (Samper 2009). O trato reprodutivo da égua estende-se desde a posição dos ovários, ventralmente à 4º ou 5º vértebra lombar e, caudalmente, através da cavidade pélvica, até à vulva (Habel 1953) (figura 1A e 1B). A funcionalidade destes órgãos está dependente das hormonas neuroendócrinas, produzidas e secretadas pelo hipotálamo e hipófise (Brinsko & Blanchard 2011; Samper 2009).
Os ovários têm uma posição anatómica variável, pois o mesovário permite um elevado grau de movimento passivo. O ovário esquerdo situa-se caudalmente ao ovário direito e mais perto do rim ipsilateral (Ginther 1979). Estes órgãos apresentam, nos equídeos, uma depressão proeminente, denominada de fossa ovulatória, no bordo côncavo ventral. O bordo convexo dorsal está incorporado no mesovário. O tamanho dos ovários varia entre os 7 e 8 cm, dependendo da fase do ciclo reprodutivo e da atividade folicular. O ovário é maior em éguas mais jovens, e tende a ficar mais fibroso à medida que a égua envelhece. (Kainer 2011). A égua, como qualquer outra fêmea equídea, é distinta de outras espécies pois as suas camadas ováricas estão invertidas, ou seja, a zona medular é superficial e a zona cortical, que contem os folículos (parênquima), é interna. O parênquima apenas atinge a superfície do ovário na fossa da ovulação, consequentemente, pequenos folículos e corpos lúteos podem ser vistos ecograficamente mas não conseguem ser detetados à palpação. Apenas folículos grandes e salientes podem ser sentidos à palpação do ovário (Miro 2012).
A
B
Figura 1 – (A) Vista Dorsal e (B) Vista Lateral do trato reprodutivo da égua (adaptado de Evans et al. 2002).
Cada oviduto consiste num infundíbulo que se expande desde os extremos dos cornos uterinos até à fossa da ovulação. Divide-se em ampola, que cobre a fossa da ovulação, e istmo, que termina numa papila na extremidade do corno uterino (Dyce et al. 2009). Os cornos uterinos, que estão localizados na cavidade abdominal. Tem uma configuração em “V” com o mesométrio localizado dorsalmente. Divergem acentuadamente a partir do ligamento intercornual e têm cerca de 20 a 25 cm, sendo assimétricos em éguas recém-paridas. O útero, que tem cerca de 20 cm em éguas não gestantes, torna-se contínuo caudalmente e termina na cérvix, que se situa cranialmente na cavidade pélvica (Kainer 2011). A cérvix possuí uma parede muito espessa e é atravessada pelo canal cervical, que se estende desde o orifício interno do útero até ao orifício externo localizado na vagina. A vulva deve ter uma posição vertical sem nenhum desvio na sua orientação vertical, e os lábios vulvares devem coaptar completamente, não permitindo a entrada de ar na vagina (Ginther 1979).
3. Fisiologia
3.1. Ciclo Reprodutivo
A égua é um animal poliéstrico sazonal, apresentando mais de um ciclo éstrico dentro de um período do ano específico, com um intervalo interovulatório de 20 a 22 dias ( Samper, 2008, Brinsko & Blanchard, 2011). A sua atividade reprodutiva é regulada principalmente pelo fotoperíodo, mas também por fatores nutricionais e climáticos. A atividade ovárica e o crescimento folicular ocorrem em resposta ao aumento diário da luminosidade (Macêdo et al. 2014). Em condições naturais, as éguas ficam gestantes num dos dois primeiros ciclos após o parto. Como a gestação dura, em média, cerca de 11 meses, as éguas tendem a parir cada 12 meses. A vantagem da época reprodutiva começar na Primavera torna-se clara: os poldros nascem quando as condições ambientais são favoráveis (Crowell-Davis 2007).
O ciclo éstrico é definido como a sequência de alterações anatómicas e endócrinas que preparam a égua para a ovulação e posterior gestação. Este pode ser dividido em estro (fase folicular) que dura cerca de 5 a 7 dias, e diestro (fase lútea) que dura em média 15 dias. O intervalo interovulatório é maior na Primavera e vai ficando mais curto entre Junho e Setembro (Samper 2008).
No início do estro, sob a influência da hormona folículo-estimulante (FSH), ocorre a maturação de um ou mais folículos. Estes folículos pré-ovulatórios começam a secretar estrogénios, sendo estes os responsáveis pela égua manifestar os sinais de cio (Macêdo et al. 2014). A ovulação irá ocorrer no terço final do estro e normalmente apenas um folículo dominante (folículo de maior tamanho) ovula. Apesar de neste período a recetividade sexual
ser geralmente marcada, algumas éguas não apresentam sinais de cio, sendo neste caso fundamentais os exames ecográficos para a deteção do estro. O estro silencioso ocorre mais frequentemente no cio do poldro, entre o quinto e o décimo quinto dia após o parto, e em éguas que estão em posições hierarquicamente inferiores (Romano et al. 1998).
Após a ovulação, ocorre a formação do corpo lúteo (CL) e inicia-se o período de diestro, onde há um declínio acentuado dos estrogénios, contrabalançados pelo aumento dos níveis sanguíneos de progesterona produzida pelo CL. Nesta fase a égua não mostra sinais de cio. Caso ocorra a fecundação e reconhecimento materno da gestação, a vida do CL prolonga-se. Caso contrário, o corpo lúteo sofre luteólise devido à influência da prostaglandina F2α (PgF2α) produzida no útero por volta do dia 15 do ciclo (Samper 2009).
3.2. Influência Hormonal
O controlo endócrino do ciclo éstrico é feito pelo eixo hipotalâmico-hipofisário-gonadal, que por sua vez é controlado principalmente pelo fotoperíodo. Existem, no entanto, outros fatores com influência no ciclo reprodutivo como a nutrição, temperatura, ambiente, condição corporal, idade e raça do animal. A atividade reprodutiva sazonal é estimulada por dias longos. Existe uma relação inversamente proporcional entre as horas de luminosidade e a produção de melatonina. Quanto maior a produção de melatonina, maior o efeito inibidor na produção da hormona libertadora de gonadotrofina (GnRH) (Palmer & Guillaume 1992).
Os dias longos provocam uma diminuição da produção da melatonina e aumento da produção de GnRH por mecanismos de retroação. O aumento das concentrações de GnRH provoca um efeito estimulante na produção de duas hormonas provenientes da hipófise anterior: hormona folículo-estimulante (FSH), cuja função é a de promover o crescimento dos folículos e controlar a síntese de estrogénios; e hormona luteinizante (LH), cuja principal função é a de estimular a maturação do folículo dominante, e secundariamente promover a formação e manutenção do corpo lúteo (Palmer & Guillaume 1992).
A libertação de FSH é bifásica: ocorre nos dias 9 a 12 do ciclo éstrico e 2 dias antes da ovulação. O pico próximo da ovulação ocorre quando o estradiol produzido pelo folículo dominante diminui. Isto permite a maturação do folículo pré-ovulatório e o arranque do desenvolvimento de novos folículos (Ginther et al. 2004). O folículo pré-ovulatório é sensível ao estímulo ovulatório desempenhado pelo padrão de libertação da LH e esta atinge o pico de concentração dois dias após a ovulação. Depois da ovulação é formado o CL produtor de progesterona que inibe a libertação de LH. A concentração plasmática de progesterona aumenta rapidamente em 24 a 48h após a ovulação, atingindo um valor máximo entre os dias
4 a 7 do ciclo éstrico, e mantendo-se elevada até aos dias 14 a 15 do ciclo, na égua não gestante. Se não ocorrer a fecundação, no final do diestro observa-se a produção de PgF2α
pelo endométrio, que posteriormente induz a luteólise. A partir dos dias 15 a 16 há um declínio dos níveis de progesterona, que baixam para níveis inferiores a 1ng/ml (Macêdo et al. 2014). A esquematização das alterações hormonais ao longo do ciclo éstrico pode ser vista na figura 2.
De um modo geral as éguas entram em cio entre o dia 15 a 16 do ciclo éstrico, quando a PgF2α produzida no endométrio induz a luteólise do CL. Aproximadamente 2 dias antes do final do estro ocorre a ovulação e há formação CL, que apenas responde à prostaglandina exógena quando está maduro, ou seja, 5 dias após a ovulação (Macêdo et al. 2014).
3.3. Sazonalidade
Diferentes espécies animais desenvolveram estratégias de reprodução sazonal de modo a assegurar que a sua descendência nasça numa altura específica do ano, em que as condições ambientais são mais favoráveis. Na égua, o ritmo circanual reprodutivo endógeno é regulado principalmente por mudanças no fotoperíodo, que visa sincronizar o ritmo endógeno com as estações do ano. O número de horas de luz são traduzidas num sinal endócrino na glândula pineal, que secreta melatonina durante as horas de escuridão. Os dias curtos estão associados a uma diminuição da secreção de gonadotrofinas e, consequentemente, a uma diminuição da atividade folicular. O mecanismo que regula a reduzida secreção de gonadotrofina, e presumivelmente a secreção reduzida de GnRH Figura 2 - Níveis hormonais e correspondente atividade ovárica ao longo do ciclo éstrico (adaptado de Taylor-MacAllister & Freeman 2007).
durante o período de anestro, não é ainda completamente compreendido no caso das éguas. Estudos recentes sugerem que o período de anestro pode ser o resultado direto de uma inibição induzida por falta de estímulos: dias curtos, clima adverso e má nutrição. A presença de estímulos como dias longos, condições climáticas e nutricionais favoráveis, a presença do garanhão; vai estimular a secreção de gonadotrofinas e GnRH durante a época reprodutiva (Nagy et al. 2000).
A época reprodutiva tem início na Primavera. Este facto está associado ao aumento das horas de luz, temperatura e disponibilidade de alimento. A época reprodutiva ocorre de Abril a Setembro no Hemisfério Norte (Hughes & Stabenfeldt 1975), sendo que de Fevereiro a Abril se dá a transição de Primavera, e de Setembro a Novembro se dá a transição de Outono. Nas fases de transição as éguas apresentam ciclos éstricos irregulares com elevada incidência de folículos dominantes em regressão. Nos meses de Dezembro a Fevereiro a égua encontra-se em anestro sazonal, embora algumas éguas ciclem durante todo o ano (Cuervo-Arango et al. 2009). O anestro entende-se como uma falha na exibição do estro por um longo período de tempo, acompanhado por um período anovulatório, onde os ovários se tornam mais pequenos e inativos devido a estímulo gonadotrófico insuficiente (Thompson 2011). A sazonalidade das éguas ao longo do ano está descrita na figura 3.
Várias associações de criadores estabeleceram que o dia de nascimento de todos os poldros é o dia 1 de Janeiro no Hemisfério Norte, e que a época de reprodução oficial se verifica de Fevereiro a Junho, o que resulta na mesma idade oficial para todos os poldros nascidos na mesma época (Ginther 1979). Surgiu assim uma pressão económica nos criadores e veterinários, para que estes consigam reproduzir as éguas o mais cedo possível no ano, de modo a obter vantagem sob poldros nascidos mais tarde (Langlois & Blouin 1996).
Um estudo de 10 anos feito por Guerin e Wang (1994) mostra que existe uma diferença significativa entre os anos e a altura em que ocorre a primeira ovulação. Os autores concluíram que o início da atividade reprodutiva também está relacionada com as temperaturas ambientais máximas e mínimas. As temperaturas máximas e mínimas nas Figura 3 - Sazonalidade das éguas ao longo do ano (adaptado de Taylor-MacAllister & Freeman 2007).
semanas imediatamente antes da primeira ovulação eram similares em todos os anos do estudo. Dados de campo sugerem que a transição de Primavera é retardada devido ao tempo frio (Nagy et al. 2000).
O efeito da nutrição e condição corporal também está descrita por diversos autores. Um estudo feito por Niekerk e Heerden (1972) demonstrou que éguas que recebem alimento suplementar sob a forma de concentrado, ovulam mais rapidamente após o anestro de Inverno, do que as éguas que não recebem suplementação. O período anovulatório também é mais curto em éguas que aumentam o seu peso no início da Primavera (Ginther 1974). Segundo Henneke (1984) o espaço de tempo até que ocorra a primeira ovulação é significativamente maior em éguas com uma condição corporal menor que 5 (numa escala de 1 a 9) comparando com éguas com uma condição corporal superior a 5.
3.4. Comportamento Reprodutivo
As poldras tem geralmente o seu primeiro estro no segundo ano de vida, mas em condições naturais é pouco usual ficarem gestantes antes dos 3 anos de idade (Noakes 2009). O comportamento de cio caracteriza-se pelo aumento do interesse no garanhão. A égua volta os posteriores para o garanhão, exibindo uma postura característica de pélvis rebaixada. Esta postura é acompanhada de um desvio lateral da cauda e exposição da região perianal, com uma eversão rítmica do clítoris e libertação frequente de pequenas quantidades de urina com um odor característico. A micção frequente vai provocar uma reação olfatória no garanhão, traduzida pelo sinal de Flehmen (Crowell-Davis 2007; Mills & Nankervis 1999).
As éguas em cio exibem um perfil facial caracterizado por relaxamento dos músculos da face, orelhas caídas para os lados e cabeça baixa. Em contraste, as éguas em diestro não mostram interesse pelo garanhão, relincham agressivamente e podem dar coices caso este se aproxime. A sua face expressa agressividade, caracterizada por tensão dos músculos faciais, orelhas voltadas para trás e podem morder (Crowell-Davis 2007). Este comportamento não deve ser confundido com o período de anestro, onde há igual desinteresse pelo garanhão, mas a égua encontra-se num estado fisiológico diferente (Mills & Nankervis 1999).
Em contraste com outras espécies, as éguas mostram comportamento de cio logo no seu primeiro ciclo éstrico, assim como no seu primeiro ciclo logo após o anestro sazonal e depois do parto (cio do poldro). Na égua pós-parto, esta característica facilita a sua beneficiação no cio do poldro (Crowell-Davis 2007).
Existem éguas que não mostram sinais de estro, tendo o chamado “estro silencioso”. É frequente em éguas novas virgens, éguas com poldros recém-nascidos ou nas éguas que
se encontram no fundo da hierarquia, caso vivam “a campo”. Contudo, até uma égua que geralmente apresente sinais de cio pode ser afetada. Nestes casos, recorre-se ao uso de ecografias para confirmar o estro e prever o momento da ovulação (Miro 2012).
3.5. Mudanças uterinas durante o ciclo éstrico
Ao longo do ciclo éstrico, o útero, vagina e endométrio passam por uma série de mudanças devido aos diferentes ambientes endócrinos, que são facilmente distinguidas com o auxílio de um exame clínico (Nagy et al. 2000). Estas mudanças são reguladas pela interação do estrogénio e da progesterona com os seus recetores no endométrio, e a sua expressão é muito influenciada pela fase do ciclo éstrico. Durante o estro, devido às altas concentrações de estrogénios, há um engrossamento da parede uterina, com formação de edema. Dá-se também o relaxamento da cérvix, que se acentua até ao final do estro, e nota-se perda de tonicidade do útero e vagina. Há também um aumento da vascularização, ativação e proliferação das glândulas endometriais. Estas mudanças anatómicas estão relacionadas com a atividade folicular e com as mudanças de comportamento observadas durante o estro (Lieux 1970).
O edema uterino pode estar associado a pequenas acumulações de fluídos no lúmen uterino (Tunón et al. 1995). À ecografia transrectal, o edema uterino é facilmente distinguível pois na égua forma-se uma imagem típica de “roda de carroça”, onde os “aros da roda” são formados pelas pregas endometriais. Estas pregas tem diferentes ecotexturas, sendo as áreas anecogénicas as porções edematosas, e as áreas ecogénicas o tecido denso central (Aurich 2011) (figura 4A). O edema vai-se tornando cada vez mais pronunciado ao longo do estro e começa a diminuir em média 48h antes da ovulação. A ecotextura das pregas endometriais pode variar do grau 0 (não há evidência ecográfica de pregas endometriais) ao grau III (pregas endometriais proeminentes). O grau IV refere-se a um edema de origem patológica associado a endometrite (Carnevale & Olsen 2011).
Já durante o diestro, onde dominam as altas concentrações de progesterona, a espessura da parede uterina e a atividade glandular diminuem. Há um aumento do tónus uterino e dá-se o encerramento da cérvix (Kainer 2011). A ecotextura uterina deverá, nesta fase do ciclo, ser homogénea e não deve haver edema presente (Tunón et al. 1995) (figura 4B).
3.6. Reconhecimento materno da gestação
Quando um ovócito é fertilizado, o embrião passa pela junção útero-tubárica e chega ao útero entre 144 e 168 horas após a ovulação (Battut et al. 2010). Na égua, apenas os oócitos fertilizados dão entrada no útero, sendo que os restantes ficam alojados na mucosa do oviduto onde degeneram ao longo de meses (Flood et al. 1979). Isto deve-se ao facto de o oócito fertilizado começar a secretar prostaglandina E (PGE) quando atinge o estádio de mórula (a partir do dia 5 após a ovulação). A PGE têm um efeito relaxante nos músculos da parede tubárica, auxiliando na progressão do oócito e permitindo a sua entrada no útero 24 horas depois do início da produção de PGE, já no estado de mórula tardia ou blastocisto inicial (Weber 1991).
Após a chegada ao útero, o embrião movimenta-se continuamente ao longo do lúmen uterino devido a contrações peristálticas do miométrio, até que se fixa e implanta ao dia 17 na base de um dos cornos uterinos (Allen 2000). A mobilidade que se verifica até ao dia 17 serve para assegurar que o sinal luteostático do reconhecimento materno da gestação alcance todo o endométrio uterino. O reconhecimento materno da gestação é fundamental para evitar a luteólise do CL primário e, consequentemente para manter a gestação (Brinsko & Blanchard 2011).
Figura 4 – (A) Aspecto ecográfico do útero durante o estro (pregas endometriais). (B) Aspecto ecográfico do útero durante o diestro (adaptado de Evans et al. 2002).
No dia 21 após a ovulação, o embrião torna-se visível ecograficamente, pode distinguir-se o batimento cardíaco e começa a formação da corioalantóide, que eventualmente se vai tornar na placenta definitiva (Allen 2000). A formação das taças endometriais começa a partir do dia 25; ao dia 35 estas invadem o estroma endometrial e tornam-se visíveis ao dia 40, altura em que se tornam glândulas funcionais produtoras de gonadotrofina coriónica equina (eCG). A secreção de eCG estimula o desenvolvimento folicular e consequente acumulação de CL secundários, havendo uma elevação exponencial sérica de progesterona. As taças endometriais atingem o seu tamanho e produtividade máxima aos dias 60 a 70 de gestação, altura em que começam a degenerar até aos dias 100-120 de gestação (Clegg et al. 1954). Nesta altura a placenta do tipo microcotilédone já está suficientemente desenvolvida para produzir a concentração de progesterona necessária para manter a gestação. Uma placenta microcotiledonária extensa e completamente funcional anexada a um endométrio saudável e funcional é um pré-requisito essencial para uma gestação normal na égua. O poldro nasce ao dia 336 a 340 após a ovulação (Allen 2000).
4. A Égua Geriátrica
Existem várias razões para reproduzir uma égua velha: pode ser devido à sua performance, valor elevado dos seus poldros, obtenção de produtos de éguas de competição aposentadas ou simplesmente devido a fatores sentimentais (Madill 2002). O envelhecimento é um processo fisiológico e não deve ser encarado como doença, embora possa predispor a mudanças que levam à doença. A senescência começa após o animal atingir o seu pico de função fisiológica (Paradis 2002). Como as mudanças fisiológicas progridem a um nível individual, não existe uma idade definida para um cavalo ser considerado geriátrico. No entanto, na comunidade equestre, um cavalo é considerado geriátrico ao início dos 20 anos de idade (Madill 2011).
A fertilidade permanece elevada até aos 12-15 anos de idade, altura que começa a diminuir lentamente até aos 25 anos de idade, quando a taxa de partos por época reprodutiva é geralmente nula (Badi et al. 1981; Vanderwall et al. 1989; Madill 2011). Um estudo realizado por Hearn et al. (1993) em PSI, mostrou que as éguas com idades compreendidas entre os 15 e 26 anos tinham aproximadamente metade da probabilidade (0,56) de estarem gestantes aos 14 e 20 dias após a ovulação, quando comparadas com as éguas mais jovens. São precisos, em média, 4,6 ciclos reprodutivos para se obter um poldro de uma égua velha, comparando com os 2 ciclos necessários para as éguas mais jovens (Vanderwall et al. 1989).
De um modo geral, a fertilidade diminui com a idade na maioria dos mamíferos pois o número de folículos presentes no ovário ao nascimento é limitado. Este número diminuí à medida que o animal passa pelos ciclos éstricos, mas também por atresia dos folículos, o que resulta num declínio do número de ovócitos com a idade. No entanto, a redução da fertilidade ocorre antes que este número atinja um nível crítico (Armstrong 2001).
As éguas mais velhas são menos férteis, requerem um maneio mais intensivo e uma maior intervenção veterinária do que as éguas mais novas. As razões para tal podem ser a entrada tardia na época reprodutiva, aumento do tempo do ciclo éstrico, resposta reduzida ou deficiente a drogas indutoras da ovulação, fraca qualidade dos folículos, maior incidência de infeções uterinas, endometrite persistente induzida pós inseminação ou monta natural, mudanças degenerativas do endométrio e aumento das perdas embrionárias (Madill 2002). Além dos problemas reprodutivos relacionados com a idade, estes animais apresentam maior incidência de problemas gastrointestinais, músculo-esqueléticos, respiratórios e endocrinológicos, o que afetam indiretamente a sua performance reprodutiva (Paradis 2002).
4.1. Doenças mais frequentes em éguas velhas 4.1.1. Alteração do ciclo éstrico
O ciclo éstrico é mais prolongado nas éguas mais velhas, podendo existir um aumento de 4,3 dias em relação às éguas mais novas (Vanderwall et al. 1989; Carnevale et al. 1993). O prolongamento do ciclo éstrico deve-se à maior duração da fase folicular, que provavelmente está associada ao menor diâmetro dos folículos presentes na altura da luteólise em éguas mais velhas. O intervalo da fase lútea é igual em éguas novas e éguas velhas (Carnevale et al. 1993). Quando comparadas com éguas novas, a onda folicular que promove o crescimento dos folículos, ocorre mais tarde nas éguas mais velhas. Também se desenvolvem menos folículos (Ginther et al. 1993). A média de crescimento do folículo dominante é significativamente menor em éguas mais velhas, que é cerca de 2,2mm por dia, em contraste com 3,2mm por dia que se verifica em éguas mais jovens (Carnevale et al. 1993). Quando ciclam, as éguas mais velhas tem tendência a entrar mais tarde na época reprodutiva. As éguas com mais de 19 anos tem a primeira ovulação 2 semanas mais tarde que éguas com menos de 13 anos de idade (Vanderwall & Woods 1990; Wesson & Ginther 1981).
A atividade ovárica pode cessar em algumas éguas mais velhas, enquanto outras continuam a ciclar mesmo tendo mais de 20 anos de idade (Vanderwall & Woods 1990; Wesson & Ginther 1981). Um estudo realizado por Vanderwall & Woods (1990) mostrou que
37% das éguas com mais de 24 anos não ovularam durante a época reprodutiva. Num outro estudo realizado por Carnevale et al. (1994) verificou-se que apenas 50% das éguas com mais de 20 anos apresentavam ciclos regulares durante a época reprodutiva, e 19% não ovularam.
4.1.2. Falha na ovulação
Em alguns casos, ocorre a falha de ovulação de folículos dominantes. Esta falha pode ter uma explicação fisiológica ou patológica. A falha na ovulação fisiológica ocorre nos períodos de transição de Primavera ou Outono e em algumas éguas pós-parto, devido à baixa atividade ovárica associada a esses períodos (McCue & Squires 2002). A falha patológica ocorre em aproximadamente 8,2% dos ciclos éstricos durante a época reprodutiva, e resultam num longo intervalo interovulatório. As causas podem ser estimulação hormonal insuficiente (McKinnon 1997), produção insuficiente de estrogénio do folículo dominante (Pierson 1993), ou hemorragia no lúmen do folículo pré-ovulatório (Ginther 1979). A incidência de folículos anovulatórios aumenta com a idade e é uma causa de redução de fertilidade em éguas mais velhas (Carnevale & Griffin 1993).
A incidência da falha da ovulação em éguas com mais de 16 anos é de 13,1%, cerca de 3 vezes maior que os 4,4% descritos em éguas dos 6 aos 10 anos. O intervalo interovulatório das éguas afetadas é de 38,5 dias e 43,5% das éguas que apresentam um folículo anovulatório voltam a reincidir na mesma época reprodutiva, podendo-se perder vários ciclos (McCue & Squires 2002).
A primeira indicação ecográfica de um folículo anovulatório é a deteção de partículas ecogénicas no fluído folicular, quando o folículo ainda está tenso (figura 5). A maioria destes folículos contêm sangue e são designados de folículos anovulatórios hemorrágicos. O fluído hemorrágico folicular forma uma massa gelatinosa, que ecograficamente tem uma aparência granular. O “Colour Doppler” ajuda na identificação de folículos anovulatórios, já que 85,7% luteinizam e formam uma parede lútea grossa e altamente vascularizada (Ginther & Utt 2004). O tratamento com prostaglandina induz a luteólise e o retorno ao estro. Os restantes 14,3% de folículos anovulatórios não luteinizam e são estruturas pouco vascularizadas, onde o tratamento com prostaglandina não tem efeito (McCue & Squires 2002).
Figura 5 - Ultrassonografia de um folículo com múltiplas partículas ecogénicas no lúmen folicular (adaptado de McCue & McKinnon 2011).
4.1.3. Síndrome “Old Maiden Mare” (égua velha nulípara)
É comum que éguas com carreiras desportivas nunca fiquem prenhas até que sejam aposentadas, altura em que há um crescente interesse em obter poldros destas mesmas éguas. O maneio reprodutivo destas éguas é uma tarefa difícil, pois são mais suscetíveis a endometrites pós-cobrição/inseminação artificial (IA). É por isso importante reconhece-las para que seja instituído um maneio adequado e haja sensibilização dos proprietários para este problema, pois muitos assumem que a fertilidade das éguas nulíparas velhas é igual à de éguas jovens (Pycock 2006).
Muitas éguas nulíparas velhas possuem características reprodutivas comuns que se assemelham a uma síndrome. Biópsias endometriais revelam mudanças glandulares degenerativas e fibrose (endometrose), que são uma inevitável consequência do envelhecimento, apesar de nunca terem estado prenhas (Ricketts & Alonso 1991). Frequentemente possuem o cérvix anormalmente fechado não se observando o seu normal relaxamento durante o estro. Também apresentam degeneração vascular endometrial (LeBlanc 2003). Como resultado, são éguas que tendem a acumular fluido no lúmen uterino, pois não o conseguem drenar corretamente (Pycock 1993). Em muitos casos este fluído não apresenta crescimento bacteriano nem há presença de células inflamatórias. Caso a égua seja inseminada, há uma maior acumulação de fluido no lúmen uterino devido à pobre drenagem linfática, e baixa contração miométrica em conjunto com um cérvix não relaxado. O volume de fluidos acumulados é variável e pode ir de alguns mililitros até um litro em casos
extremos. Apesar disso, geralmente as éguas afetadas que ficam gestantes, não tem dificuldade em dilatar o cérvix aquando o parto (LeBlanc 1991).
O diagnóstico é difícil pois muitas éguas não mostram sinais de inflamação antes da cobrição ou IA. Uma história de inseminações repetidas com acumulação de fluído será o melhor indicador. O exame ecográfico é útil em detetar éguas com deficiências na normal limpeza uterina. A presença de fluido livre intraluminal antes da cobrição ou IA sugere uma maior suscetibilidade a endometrite persistente (Pycock & Newcombe 1996). A presença de fluido no lúmen uterino durante o diestro é um indicador de inflamação uterina e está associado à subfertilidade, devido à morte embrionária precoce e um encurtamento da fase lútea (Newcombe 1997).
Quanto ao tratamento, o objetivo passa por auxiliar o útero na limpeza física dos produtos inflamatórios que se formam normalmente após a monta natural ou IA (Pycock 1994). A administração de ocitocina é o método ideal de tratamento, pois é uma técnica não invasiva e frequentemente fornece a total eliminação do fluído acumulado, por promover a drenagem uterina (Allen 1991). A lavagem uterina com Lactato de Ringer (LR) também pode ajudar na evacuação mecânica do conteúdo uterino, e deve ser feita antes da cobrição/IA e idealmente 4 a 6 horas após a cobrição/IA (Knutti et al. 2000). Como o sémen congelado provoca, por norma, reações inflamatórias endometriais mais acentuadas que o sémen fresco, o seu uso deve ser evitado nestes animais (Kotilainen et al. 1994).
4.1.4. Endometrite
Uma defesa imunológica deficiente do trato reprodutivo pode provocar subfertilidade ou esterilidade, temporária ou permanente. A manutenção de um ambiente uterino saudável está dependente de barreiras físicas, um sistema imunológico eficiente e um sistema linfático competente (Hafez & Hafez 2003). A idade das éguas, juntamente com os problemas ginecológicos e obstétricos, são fatores conhecidos por causarem diminuição da competência dos mecanismos naturais de defesa uterina, gerando maior suscetibilidade à endometrite. A endometrite pode ser classificada em endometrite persistente pós-cobrição/IA ou aguda, endometrite crónica, e endometrite crónica degenerativa ou endometrose (Hurtgen 2006). As éguas geriátricas tem maior risco de sofrer destas 3 últimas condições.
Endometrite Persistente Pós-cobrição/IA ou Aguda
A inflamação uterina após cobrição/IA está descrita em várias espécies domésticas (England et al. 2013). Os espermatozoides e, potencialmente, as bactérias introduzidas no
útero durante o coito ou IA estimulam uma resposta imune dominada por um rápido influxo de neutrófilos polimorfonucleares para o lúmen uterino (Rozeboom & Troedsson 1999). Este influxo ativa várias vias inflamatórias e promove a acumulação de fluído no útero (Woodward et al. 2013). No entanto, esta inflamação é passageira e resolvida num curto período de tempo (1 a 2 dias) em éguas saudáveis (Katila 1995).
O influxo de neutrófilos polimorfonucleares é uma reação fisiológica normal que visa eliminar o excesso de espermatozoides e possíveis bactérias presentes no útero, tendo um papel essencial na fertilidade. Contudo, se existir uma causa subjacente que resulta na persistência da endometrite pós-coital/inseminação por um longo período de tempo (falha na limpeza uterina), a inflamação transforma-se numa patologia clínica e requer o tratamento adequado (Troedsson 2014).
Existe um aumento significativo da incidência e severidade de acumulação de fluído no lúmen uterino em éguas mais velhas. Os fatores predisponentes são: útero largo e descaído, incompetência cervical, drenagem linfática deficiente e diminuição das contrações do miométrio (Pycock 2009). A inflamação persistente vai induzir a luteólise prematura e tem efeitos deletérios no embrião assim que este chega ao útero, o que reduz potencialmente a fertilidade (Troedsson 1999).
Endometrite Crónica
À medida que a idade e o número de partos aumentam, ocorrem mudanças anatómicas que podem tornar uma égua subfértil. Estas mudanças incluem a fraca coaptação dos lábios vulvares, que ocorre em éguas mais velhas ou em éguas de baixa condição corporal; o enfraquecimento da musculatura abdominal com expansão do abdómen, que leva a um afundamento do trato intestinal com deslocação do ânus cranialmente e, consequência do afundamento do trato digestivo, os ligamentos suspensórios entre o reto e o trato reprodutivo arrastam a vagina e o vestíbulo cranialmente, resultando numa fenda vulvar mais horizontal e de eficácia reduzida em manter o selo vestibular (Pascoe 1978). Estas alterações anatómicas predispõe a égua geriátrica a pneumovagina, contaminação bacteriana do trato reprodutivo cranial e a urovagina, aumentando o risco de infeção uterina e diminuindo a taxa de fertilidade (Pouret 1982).
A endometrite crónica é encontrada frequentemente em éguas com mais de 12 anos, multíparas e com má conformação perineal. Também ocorre em éguas suscetíveis a endometrite persistente pós-cobrição/IA, éguas com incompetência cervical e em éguas dadoras de embriões (LeBlanc 2008). Ao contrário da endometrite aguda, em que há acumulação de neutrófilos, a endometrite crónica caracteriza-se pela afluência de linfócitos para o estroma endometrial (Vanderwall 2008). O tratamento adequado requer lavagens
uterinas, aplicação de antibióticos intrauterinos e eventualmente reparação de efeitos anatómicos (LeBlanc 2008).
Endometrite Crónica Degenerativa/ Endometrose
Com o aumento da idade da égua, independentemente se alguma vez esteve gestante ou não, o endométrio sofre alterações degenerativas. Estas são progressivas e estão associadas ao normal processo de envelhecimento e aos efeitos hormonais cíclicos. No entanto, a estimulação continuada por parte de certos agentes, como sémen e microrganismos, aceleram a progressão da endometrose. Geralmente, éguas até aos 9 anos não apresentam alterações, éguas até aos 13 anos apresentam alterações moderadas, e éguas com 15 anos ou mais possuem alterações moderadas a graves (Ricketts 2008).
A endometrose é diagnosticada pela observação após biopsia uterina de degeneração glandular e dilatação glandular cística, observadas sob a forma de “ninhos” celulares rodeados por lâminas de tecido fibroso (Inoue et al. 2000). Pode observar-se também fibrose periglandular e, menos frequentemente, fibrose difusa. A observação de fibrose difusa é indicadora de mau prognóstico (McCue 2008). Estas mudanças contribuem para a morte embrionária precoce e morte fetal. A sua natureza progressiva mostra que éguas de 17 anos de idade, ou mais velhas, são mais propensas de estarem afetadas por esta patologia (Ricketts & Alonso 1991).
Também se observam alterações escleróticas, que estão associadas a repetitivas perdas de gestação em éguas idosas (Immegart 2007). Pressupõe-se que a diminuição da vascularização endometrial comprometa a contratilidade uterina, a resposta inflamatória após cobrição/IA e o desenvolvimento fetal. Ao contrário do que ocorre no útero com endometrite, em que a morte do embrião ocorre provavelmente devido à libertação de substâncias citotóxicas pelos leucócitos, no útero fibrótico a morte embrionária ocorre devido à deficiência no suporte trófico (Heuer et al. 1993). As éguas que apresentam um elevado grau de fibrose podem ficar gestantes, mas tem uma enorme probabilidade de perder a gestação ou de manter uma gestação prolongada com dismaturidade fetal. É uma patologia muito comum em éguas que iniciam a sua vida reprodutiva numa idade avançada, e que devido às alterações endometriais excessivamente marcadas para a sua idade, tornam muito difícil alcançar com sucesso uma gestação (Schoon & Klug 1999).
Segundo Samper (2008), estas alterações endometriais não se verificam em éguas idosas com partos anuais desde os 4 anos de idade, pois estas apresentam alterações degenerativas em menor grau às consideradas normais para a sua idade. Esta diferença deve-se provavelmente à interrupção da circulação de estrogénios devido à gestação, que
tem um efeito protetor na integridade endometrial. Ou seja, o maneio reprodutivo deve visar também que se evite o descanso reprodutivo prolongado (Samper 2008).
4.1.5. Morte Embrionária Precoce
A morte embrionária precoce (MEP) refere-se às perdas de gestação que ocorrem até ao dia 40 após a fertilização, antes da transição da fase embrionária para a fase fetal (Woods et al. 1987). A incidência da MEP é de 5-15%, contudo em éguas com mais de 18 anos de idade, esta incidência aumenta para 20-30% (McDowell et al. 1992). A maioria das perdas ocorre nos primeiros dias após a fertilização. Estas perdas devem-se a problemas frequentemente encontrados em éguas geriátricas, tais como: envelhecimento dos folículos, anormalidades oocitárias, falha na fertilização, ambiente anormal do oviduto e atrasos no desenvolvimento do embrião. As restantes perdas são devidas à falha da produção de progesterona primária, à prostaglandina produzida no útero com endometrite que irá provocar a luteólise, ou, quando é o caso, em éguas que apresentam um elevado grau de fibrose uterina, pois não existe um suporte trófico suficiente para manter a gestação.(Brinsko et al. 1995).
À ecografia antes do dia 21 após a ovulação, a MEP diagnostica-se pelo desaparecimento repentino da vesícula embrionária entre controlos ecográficos. Após o dia 21, o embrião já está mais desenvolvido e os sinais de MEP tornam-se mais evidentes: forma irregular da vesícula embrionária (até ao dia 20 após a ovulação a vesícula embrionária tem normalmente uma forma irregular), mobilidade prolongada da vesícula (após o dia 16), presença de edema endometrial, vesícula mais pequena que o normal, perda do batimento cardíaco, aumento da ecogenicidade do fluído embrionário e desenvolvimento anormal das membranas embrionárias (Morris & Allen 2002).
A MEP deve ser diagnosticada o mais cedo possível para que se possa beneficiar a égua novamente, se a perda de gestação ocorreu cedo o suficiente na época reprodutiva. A deteção precoce é possível com a realização de exames ecográficos transretais a cada 10 dias entre os dias 14 e 40 de gestação. Caso se detetem sinais de morte iminente, a única opção de tratamento existente é a administração de progesterona exógena para “tentar salvar” o conceptus. Caso se queira eliminar o conceptus para cruzar a égua novamente, esta eliminação deve ocorrer antes do dia 35 de gestação, de modo a evitar o desenvolvimento das taças endometriais que se começam a formar e a produzir eCG a partir dessa altura. O término da gestação antes que as taças endometriais se tornem funcionais é de extrema importância pois após este período de tempo, muitas éguas não voltam à atividade cíclica
normal durante essa época, exibindo frequentemente anestros prolongados e estros anovulatórios (Vanderwall 2011).
4.1.6. Deficiências em Progesterona
Alguns dos fatores que levam à morte embrionária são endócrinos e podem estar relacionados com a baixa produção de progesterona, por insuficiência lútea primária ou por luteólise induzida por alterações endometriais. Segundo McCue & McKinnon (2011) a insuficiência lútea primária dá origem à diminuição da produção de progesterona pelo CL primário e a falha do reconhecimento materno da gestação parece ser a maior causa de insuficiência lútea. Segundo Pinto (2011), as baixas concentrações de progesterona (<2ng/mL) estão associadas à morte embrionária precoce na égua. No entanto, esta patologia é incomum, e na maior parte dos casos é provável que ocorra associada a processos inflamatórios uterinos (que provocam a libertação precoce de prostaglandina e provocam a luteólise do CL).
Não existe evidência significativa de que a falha na produção de progesterona seja uma causa comum de perda embrionária, assim como também não se pode afirmar que este seja um problema com maior incidência em éguas em idade avançada. Assim, é recomendada a suplementação de 0,044mg/kg de progesterona exógena (altrenogest, Regumate ®), por via oral, todos os dias, quando a égua tem um histórico de repetidas perdas de gestação, após serem descartadas outras patologias, como a endometrite (Vanderwall 2011). Nesta categoria também se incluem as éguas com vesículas embrionárias de tamanho normal, mas com baixo tónus uterino, e éguas que apresentam edema uterino no dia do diagnóstico de gestação (Madill 2011).
Em éguas gestantes, a placenta começa a produzir progesterona entre os dias 80 e 100 de gestação; depois do dia 100 produz progesterona em quantidade suficiente para manter a gestação. O que significa que entre os dias 100 e 120 a suplementação exógena de progesterona deve ser descontinuada gradualmente, pois não existe uma necessidade fisiológica em administrar progesterona exógena após esse período (Vanderwall 2011).
4.2. Estratégias para melhorar a eficiência reprodutiva
Numa tentativa de melhorar o sucesso reprodutivo das éguas problemáticas, tem sido estudadas ao longo dos anos várias técnicas e tratamentos hormonais, que quando utilizados em conjunto, podem aumentar a eficiência reprodutiva destes animais (Squires 2008). - Escolha do garanhão e tipo de sémen
A fertilidade de um garanhão, ou a taxa de fertilidade do seu sémen fresco, refrigerado ou congelado são determinantes na taxa de gestação da égua. Este aspeto é muito importante quando se trata da reprodução de éguas velhas subférteis, que quando cruzadas com um garanhão subfértil, quase sempre é garantido um fraco resultado. Idealmente deve sempre ser escolhido o garanhão com a maior taxa de gestação por ciclo. Esta escolha frequentemente não acontece pois estas informações raramente são fornecidas e o proprietário seleciona o garanhão que mais lhe interessa, tendo em conta o seu potencial genético e não a sua taxa de fertilização (Allen et al. 2007).
O sémen fresco, geralmente, têm taxas de gestação por ciclo superiores ao sémen refrigerado, e este por sua vez, têm taxas de gestação superiores ao sémen congelado (Jasko et al. 1993; Loomis 2001). Na prática, com um bom maneio reprodutivo, atingem-se bons resultados com todos os tipos de sémen em éguas férteis, e portanto o veterinário irá trabalhar com o tipo de sémen escolhido pelo proprietário. No entanto, o uso de sémen congelado em éguas geriátricas com história de infertilidade não é aconselhado, especialmente em éguas cuja infertilidade está relacionada com problemas crónicos devido à endometrite pós-cobrição/IA persistente. Isto porque a combinação da relativa baixa taxa de fertilização do sémen congelado com a subfertilidade de uma égua geriátrica, piora as probabilidade de fertilização. Além disso, foi demonstrado que o sémen congelado provoca uma maior reação inflamatória, exacerbando o problema numa égua já suscetível à endometrite pós-cobrição/IA persistente. Como por norma a IA se faz pós-ovulação a janela de tratamento da endometrite pós-IA é reduzida (Madill 2011).
- Manipulação Hormonal
A manipulação do ciclo éstrico tem várias vantagens e as suas aplicações são muito variadas. É possível induzir ciclos ovulatórios em éguas que estavam em anestro para que tenham produtos mais cedo no ano, induzir a ovulação para uma melhor gestão reprodutiva,
assim como se pode eliminar os sinais de cio indesejáveis nas éguas em competição (Aurich 2011). É importante referir que a manipulação farmacológica do ciclo éstrico aumenta a incidência de gestações gemelares (Veronesi et al. 2003).
Indução do Estro
Numa égua em diestro, ou fase lútea, o estro pode ser induzido com uma injeção intramuscular de Pgf2α ou seus análogos, induzindo a lise do CL. Este tratamento só é geralmente eficaz a partir do dia 5 após a ovulação, quando o CL está maduro. Espera-se que a égua inicie uma nova fase éstrica 3 a 4 dias após o tratamento e que ovule entre 8 a 12 dias após o mesmo. O número de dias para que ocorra a ovulação depende do estado de desenvolvimento do folículo dominante na altura da administração da Pgf2α. Quando existe um folículo pré-ovulatório no final da maturação, a ovulação pode ocorrer 48h após a administração da Pgf2α. Caso exista um folículo de pequenas dimensões ou em atresia a ovulação ocorre mais tarde (Douglas & Ginther 1975; Aurich 2011). Está descrito que em 10% das éguas, a administração intramuscular de prostaglandina provoca alguns efeitos colaterais incluindo sudorese, desconforto abdominal e diarreia. Estes efeitos podem surgir 20 minutos após a administração mas não colocam em risco a vida do animal (Staempfli 2011).
As prostaglandinas sintéticas mais utilizadas na sincronização de cios são o dinoprost e o cloprostenol (Estrumate ®), sendo que a primeira é uma prostaglandina natural e a segunda é uma prostaglandina sintética análoga. A dose recomendada de dinoprost é de 9 µg/kg (5 – 10 mg por égua), e a de cloprostenol é de 0,55 µg/kg (250 µg por égua) (Bradecamp 2011).
Supressão do Estro
O estro pode ser suprimido com a administração oral diária de altrenogest (sintético da progesterona, Regumate ®). Contudo, a ovulação nem sempre é inibida. O tratamento com altrenogest também pode ser usado para adiar a ovulação durante um ou dois dias sem afetar a fertilidade. Não foram detetados efeitos secundários mesmo em casos de tratamentos prolongados com altrenogest (Squires 2008; Shideler et al. 1983).
Indução da Ovulação
Para uma correta indução da ovulação deve-se em primeiro lugar confirmar a presença de um folículo pré-ovulatório e a presença de edema uterino. De seguida pode optar-se pela administração de hCG (gonadotrofina coriónica humana) ou deslorelina (análogo da GnRH) (Squires 2008). A administração IM ou endovenosa (IV) de 1500 UI a 5000 UI de hCG, em éguas que apresentam comportamento de cio e um folículo igual ou superior a 35 mm, induz