Universidade de Trás-os-Montes e Alto Douro
Caracterização Física e Química da Água para Consumo Humano: Uma
Abordagem Didática
Dissertação de Mestrado em
Ensino de Física e de Química no 3º Ciclo do Ensino Básico e no Ensino Secundário
Maria Alexandra Pereira Dias Pinheiro
Orientador: Prof. Doutor José Paulo Cerdeira Cleto Cravino
Coorientador: Prof. Doutor José Alcides Silvestre Peres
Universidade de Trás-os-Montes e Alto Douro
Caracterização Física e Química da Água para Consumo Humano: Uma
Abordagem Didática
Dissertação de Mestrado em
Ensino de Física e de Química no 3º Ciclo do Ensino Básico e no Ensino Secundário
Maria Alexandra Pereira Dias Pinheiro
Orientador: Prof. Doutor José Paulo Cerdeira Cleto Cravino
Coorientador: Prof. Doutor José Alcides Silvestre Peres
Composição do Júri:
Doutora Cristina Maria Correia Marques
Doutor José Paulo Cerdeira Cleto Cravino
Doutor Paulo Fernando da Conceição Santos
CARACTERIZAÇÃO FÍSICA E QUÍMICA DA
ÁGUA PARA CONSUMO HUMANO: UMA
ABORDAGEM DIDÁTICA
Relatório de Estágio de Mestrado apresentado à Universidade de Trás-os-Montes e Alto Douro para cumprimento dos requisitos necessários à obtenção de grau de Mestre em Ensino de Física e de Química no 3º Ciclo do Ensino Básico e no Ensino Secundário sob a orientação científica do Prof. Doutor José Paulo Cerdeira Cleto Cravino e do Prof. Doutor José Alcides Silvestre Peres
MARIA ALEXANDRA PEREIRA DIAS PINHEIRO
Vila Real, 2013
Agradecimentos
À professor Ana Edite Cunha pela confiança que depositou em mim, pelo olhar crítico, sempre construtivo e entusiasmante com que orientou o estágio e, de certa forma, com que acompanhou este trabalho.
Ao professor Cravino pelo entusiasmo, pela sua forma de estar na profissão e pelos desafios propostos que me permitiram percorrer caminhos de grande aprendizagem e chegar ao fim desta etapa sem nunca perder o ânimo.
Ao professor José Alcides Peres pelo estímulo, incentivo e confiança que sempre demonstrou em mim e no meu trabalho.
Ao Rui, colega de mestrado e de estágio, pela companhia durante as viagens e pela forma simples, mas sábia, de trabalhar em grupo.
À minha irmã e aos meus pais pelo amor incondicional, pela ajuda permanente que torna a minha vida mais simples e bonita e por tomarem conta da minha família quando estou ausente.
Ao Rui, o meu marido, companheiro das horas boas e das horas e más, pela paciência nos momentos difíceis e por tornar a minha vida tão rica e preenchida. E à Francisca, a nossa filha, que resolve todos os meus problemas quando me vê e me dá um sorriso de orelha a orelha.
Resumo
No 11º ano de escolaridade, na disciplina de Física e Química A, a água é utilizada como contexto para o estudo de muitos conceitos físicos e químicos. Deste recurso natural que pode ter variadas utilizações, o programa da disciplina salienta o seu uso para consumo humano.
Assim, a comparação dos parâmetros legais a considerar na análise de águas para consumo humano com os parâmetros estudados no 11º ano de escolaridade, especialmente ao nível do trabalho experimental desenvolvido, permitiu propor dois protocolos experimentais que introduziram o estudo de dois parâmetros: a alcalinidade e o teor em cloretos.
Os protocolos experimentais foram testados com alunos da Escola Secundária de S. Pedro em Vila Real, cujo contributo foi fundamental para que se concluísse que os recursos físicos da escola, o tempo disponível e os saberes disponíveis dos alunos mostram que os protocolos propostos são exequíveis.
Palavras – Chave: Física; Química; Ensino Secundário; trabalho experimental; água;
Abstract
In grade 11 (students aged 16-17 years old), in Physics and Chemistry A, water is used as a context for studying many physical and chemical concepts. From the different uses that this natural resource may have, the curriculum emphasizes its use for human consumption.
Thus, the comparison between the legal parameters to consider in the analysis of water for human consumption and the parameters studied in grade 11, especially considering the experimental work developed, has led to the proposal of two experimental protocols which introduce the study of two parameters: alkalinity and content of chloride.
The experimental protocols have been tested with students of S. Pedro High School, whose contribution was essential to conclude that the resources in the school lab, the time available, and the knowledge that students already have, shows that the protocols proposed are feasible.
Keywords: Physics; Chemistry; Secondary school; experimental work; water, alkalinity;
Índice Geral
Página
1. Introdução 11
2. Visão Geral do Programa das Disciplina de Física e Química A ao longo
do Ensino Secundário
15
2.1. Visão Geral do Programa de Química do 11º ano de
Escolaridade
17
2.2. A Água no Programa de Química do 11º ano de Escolaridade 23
2.3. Proposta de Alteração das Atividades Laboratoriais a
Desenvolver na Segunda Unidade de Química do 11º ano de Escolaridade: Da Atmosfera ao Oceano
25
3. Parâmetros de Qualidade de uma Água para Consumo Humano 28
3.1. Alcalinidade 30
3.1.1. Método de Determinação Experimental da Alcalinidade
de uma Água
34
3.2. Cloretos 36
3.2.1. Método de Determinação Experimental do Teor em
Cloretos de uma Água
37
4. Proposta de Inclusão da Determinação da Alcalinidade de uma Água
para Consumo Humano no Atual Programa de Química do 11º Ano
41
4.1. O Atual Programa 41
4.2. Proposta de Alteração 44
5. Proposta de Inclusão da Determinação do Teor em Cloretos de uma
Água para Consumo Humano no Atual Programa de Química do 11º Ano
46
5.1. O Atual Programa 46
6. Execução das Atividades Laboratoriais Propostas 50
6.1. Exploração da Proposta de Alteração da Atividade Laboratorial
2.1 – Alcalinidade de uma Água para Consumo Humano
51
6.2. Exploração da Proposta de Alteração da Atividade Laboratorial
2.5 – Determinação do Teor numa Água para Consumo Humano pelo Método de Mohr
57
7. Conclusão 61
8. Bibliografia 66
Índice de Tabelas
Página Tabela 2.1 – Carga horária da disciplina de Física e Química A ao longo do
ensino secundário
15
Tabela 2.2 - Linhas gerais do programa de Física e Química do 11º ano de
escolaridade
16
Tabela 2.3 - Distribuição dos tempos letivos pelos capítulos da Química e
da Física na disciplina de Física e Química do 11º ano de escolaridade
16
Tabela 2.4 - Linhas gerais do programa de Química do 11º ano de
escolaridade
18
Tabela 2.5 –Objetos de aprendizagem das duas unidades de Química no
11º ano de escolaridade
19
Tabela 2.6 – Atividades laboratoriais de Química do 11º ano de
escolaridade de caráter obrigatório
20
Tabela 2.7 – Objetos de ensino das atividades laboratoriais de Química do
11º ano de escolaridade de carácter obrigatório
22
Tabela 2.8 – Parâmetros físico-químicos de uma àgua avaliados em cada
actividade laboratorial
24
Tabela 2.9 – Sugestão das atividades laboratoriais a desenvolver na
segunda unidade de Química do 11º ano de escolaridade
25
Tabela 3.1 –Parâmetros de qualidade de uma água 29
Tabela 3.2 – Contribuição para a alcalinidade por parte de diferentes
espécies
33
Tabela 3.3 – Relação entre o pH e os iões presentes na água 35
Tabela 3.4 – Concentração de cloretos em diferentes tipos de água 36
Tabela 3.5 – Solubilidade dos sais de prata 38
Tabela 3.6 – Concentrações em equilíbrio dos iões prata e cromato 39
Tabela 4.1 – Indicadores de ácido-base e respectivas zonas de viragem 42
Tabela 4.2 – Valores de Kwa diferentes temperaturas 43
Química do 11º ano de escolaridade para a atividade laboratorial 2.1
Tabela 4.4 – Proposta de procedimento experimental a adotar na
atividade laboratorial 2.1
44
Tabela 5.1 – Procedimento experimental sugerido pelo Programa de
Química do 11º ano de escolaridade para a atividade laboratorial 2.5
48
Tabela 5.2 – Proposta de procedimento experimental a adotar na
atividade laboratorial 2.5
49
Tabela 6.1 – Material e reagentes necessários à realização da proposta de
atividade laboratorial 2.1
53
Tabela 6.2 – Cor de amostras de água na presença de indicadores de pH 53
Tabela 6.3 – Medição do pH de águas com o indicador universal 54
Tabela 6.4 – Medição do pH de águas e comparação com o valor indicado
no rótulo
54
Tabela 6.5 – Variação do pH de uma água com a temperatura 55
Tabela 6.6 – Volume de titulante gasto e valores de pH obtidos na
titulação potenciométrica
56
Tabela 6.7 – Material e reagentes necessários à realização da proposta de
atividade laboratorial 2.5
58
Tabela 6.8 – Solubilidade de sais em três solventes 59
Tabela 6.9 – Variação da solubilidade de KNO3 em água com a temperatura
Índice de Figuras
Página Figura 3.1 – Relação água total, água potencialmente utilizada e água
potável
28
Figura3.2 – pH de uma água em função da composição em CO2 (aq), HCO3- (aq) e CO32- (aq)
32
Figura3.3 – Evolução típica do pH durante a adição de uma solução de
H2SO4 numa titulação potenciométrica
34
Figura 6.1 – Medidor de pH com sensor de temperatura 52
Figura 6.2 – Indicador universal 54
Figura 6.3 – Curva de titulação de uma água para consumo humano com
H2SO4
57
Lista de abreviaturas e símbolos
AL – actividade laboratorial;
COT – carbono orgânico total;
CBO – carência bioquímica de oxigénio;
1. Introdução
Ao longo dos últimos anos tem-se notado uma disparidade crescente entre a educação nas nossas escolas e as necessidades e os interesses dos alunos. A mudança tecnológica acelerada e a globalização do mercado exigem indivíduos com educação abrangente em diversas áreas, que demonstrem flexibilidade, capacidade de comunicação e uma capacidade de aprender ao longo da vida. Estas competências não se coadunam com um ensino em que as ciências são apresentadas de forma compartimentada, com conteúdos desligados da realidade e sem uma verdadeira dimensão global e integrada.
A Ciência transformou não só o ambiente natural, mas também o modo como pensamos sobre nós próprios e sobre o mundo que habitamos. Os processos que utiliza, baseados em evidência e raciocínio, a resolução de problemas, o trabalho experimental ou o projeto, em que a argumentação e a comunicação são situações inerentes – são um valioso contributo para o desenvolvimento do indivíduo. Garcia (cit. por Bastos 2006:15)diz mesmo que “desde o século XIX que a ciência e a tecnologia estão cada vez mais entrosadas, institucionalizadas e organizadas socialmente.”
Interligando diferentes áreas do saber, foram produzidos, numa espantosa variedade, artefactos e produtos – desde motores eléctricos a antibióticos, de satélites artificiais a clones – que transformaram o nosso estilo de vida, quando comparado com o das gerações anteriores. Os jovens têm de aprender a relacionar-se com a natureza diferente deste conhecimento. O papel da Ciência no nosso dia-a-dia exige uma população com conhecimento e compreensão suficientes para entender e seguir debates sobre temas científicos e tecnológicos e envolver-se em questões que estes temas colocam, quer para eles como indivíduos quer para a sociedade como um todo.
De facto, parece consensual que políticos, professores, educadores, alunos, investigadores e a opinião pública em geral, reconheçam o papel fundamental da ciência no dia a dia dos cidadãos. A este respeito, Bastos (2006:15), afirma que
“Políticas sobre a ciência e a tecnologia determinam um maciço investimento em ciência, que se estende desde a escola secundária até aos centros de pesquisa, desde as universidades até às empresas.” E, porque os alunos não adquirem o conhecimento científico simplesmente pela vivência de situações quotidianas, têm sido introduzidas profundas alterações nos currículos escolares dos alunos. A este propósito Fernandes (2002:12) afirma que “As questões curriculares têm estado, nestes últimos tempos, na ordem do dia, ocupando um lugar central nos debates sobre a educação.”
As Ciências Físico-Químicas não ficaram à margem destas mudanças e, desde 2003, que o currículo escolar dos alunos sofreu profundas alterações que aumentaram consideravelmente a carga horária da disciplina para alunos e professores. Em 2012, foram introduzidas novas alterações mas, curiosamente, não foi alterada a carga horária destinada ao trabalho laboratorial dos alunos, talvez porque, como referem Carvalho e colegas (2012:30) na sua obra sobre o ensino experimental das ciências direccionada para professores de Física e Química, “A experiência é uma importante componente dos processos utilizados em ciência.”
O ensino das Ciências Físico-Químicas inicia-se no 7º ano de escolaridade e corresponde a uma preparação inicial a ser aprofundada no Ensino Secundário. E é justamente no ensino secundário, nomeadamente no 10º e 11º ano de escolaridade, que o tempo dedicado ao estudo da disciplina de Física e Química é extremamente relevante quando comparado com o tempo dedicado às outras disciplinas. De facto, à disciplina de Física e Química são atribuídas mais horas de trabalho do que a praticamente todas as outras disciplinas. Aliás, em número de horas letivas, surge apenas a disciplina de Biologia com tantas horas como a de Física e Química. A todas as outras disciplinas é atribuída uma carga horária inferior.
Tal facto justifica-se pela importância que é atribuída ao trabalho laboratorial porque, tal como referiram Martins e colegas (2003:2), as atividades de laboratório são vias para alcançar aprendizagens específicas. Os mesmos autores acrescentam ainda que “…os saberes implícitos nos objetivos de aprendizagem listados no programa podem e devem ser trabalhados em atividades de laboratório.”
No que respeita à disciplina de Física e Química no ensino secundário, o programa inclui atividades laboratoriais obrigatórias sendo que, no 11º ano de escolaridade, a água é um dos contextos utilizados para o desenvolvimento de grande parte das actividades laboratoriais de Química.
A água é um elemento fundamental na sobrevivência de praticamente todas as espécies uma vez que está presente em importantes reações, como as trocas gasosas no sangue ou a dissolução de sais na água indispensável ao crescimento das plantas. Este é, aliás, o motivo pelo qual os autores entendem que a água é o contexto ideal para o aprofundamento de muitos conceitos químicos importantes.
O programa oficial do Ministério da Educação para a disciplina de Física e Química A do 11º ano de escolaridade atribui especial importância às águas para consumo humano pelo que este estudo pretende:
I. Investigar qual a importância atribuída à água como recurso natural à luz das orientações curriculares emanadas do ministério da educação;
II. Comparar os principais parâmetros legais a considerar na análise de águas de consumo com os parâmetros estudados no 11º ano de escolaridade;
III. Averiguar sobre a tipologia de trabalho laboratorial desenvolvida nas escolas ao longo do 11º ano de escolaridade para abordar esta temática;
IV. Sugerir protocolos de trabalho laboratorial a desenvolver nas aulas de Física e Química em função dos parâmetros a estudar.
Assim, partir-se-á de uma análise geral do Programa de Física e Química A do 11º ano de escolaridade para depois se aprofundar a unidade que à água diz respeito, em termos de objetivos a cumprir, atividades laboratoriais obrigatórias e tempo que lhes está destinado. Esta análise permitirá compreender a importância do papel atribuído à água e aferir sobre o tipo de trabalho laboratorial utilizado para explorar o assunto.
Finalmente pretende-se que, do exposto, resulte uma proposta de trabalho que, com a incrementação de possíveis alterações ao nível do trabalho laboratorial, permita aproximar os objetivos do programa, mais concretamente no que respeita às
características físico-químicos de uma água para consumo humano, com o trabalho
2. Visão Geral do Programa das Disciplina de Física e Química A ao longo
do Ensino Secundário
Com a atual reorganização curricular, a disciplina de Física e Química A no ensino secundário inicia-se no 10º ano e termina no 11º ano de escolaridade.
Tanto no 10º, como no 11º ano de escolaridade, as aulas estão organizadas em blocos de 90 minutos ou tempos letivos de 45 minutos, mediante decisão tomada por cada escola. Aos alunos é imputada uma carga horária semanal de 7 tempos letivos (7 x 45 minutos), sendo que 3 destes tempos letivos devem obedecer a uma planificação de aula de carácter essencialmente prático, com a turma dividida. Assim, a disciplina está dividida pelos dois anos como mostra a tabela 2.1.
Tabela 2.1 – Carga horária da disciplina de Física e Química A ao longo do ensino secundário.
Tempos Letivos
Aluno Professor
Teóricos Teórico-Práticos Teóricos Teórico-Práticos
10º Ano 4 3 4 6
11º Ano 4 3 4 6
Não é fácil a gestão do tempo para a lecionação dos conteúdos da disciplina de Física e Química A porque, de acordo com Martins e colegas (2003):
não se trata de transmitir conhecimento, mas de criar situações que permitam aos alunos compreender e construir esse conhecimento;
cada aluno tem o seu próprio ritmo de aprendizagem;
é necessário ter em conta as conceções alternativas dos alunos;
é necessário privilegiar a avaliação formativa.
Mas, admitindo que um ano corresponde em média a 32 semanas de aulas, o aluno, tem ao longo do ensino secundário para trabalhar a disciplina:
Distribuídos por dois grandes grupos: o de Física e o de Química.
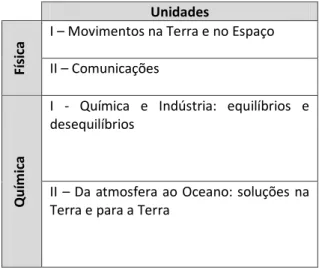
Desta forma, no 11º ano de escolaridade os alunos têm ao seu dispor cerca de 224 tempos letivos para trabalhar o programa que obedece ao disposto na tabela2.2.
Tabela 2.2 - Linhas gerais do programa de Física e Química do 11º ano de escolaridade.
Unidades
Fí
si
ca
I – Movimentos na Terra e no Espaço II – Comunicações
Q
u
ím
ica
I - Química e Indústria: equilíbrios e desequilíbrios
II – Da atmosfera ao Oceano: soluções na Terra e para a Terra
Recorrendo às orientações emanadas do Ministério da Educação, a distribuição da carga horária pelos capítulos da Física e da Química surge ilustrada natabela2.3.
Tabela2.3 - Distribuição dos tempos letivos pelos capítulos da Química e da Física na disciplina
de Física e Química do 11º ano de escolaridade.
Tempos Letivos
Unidades Física Química
Movimentos na Terra e no Espaço 36 Comunicações 36 Química e Indústria: equilíbrios e desequilíbrios 32 Da atmosfera ao Oceano: soluções na Terra e para a Terra
54
Os restantes tempos letivos devem ser geridos pelo professor mediante as necessidades reconhecidas em cada turma.
2.1. Visão Geral do Programa de Química do 11º ano de Escolaridade
Citando Martins e colegas (2003:3), “A componente de Química do 11º ano de escolaridade procura constituir-se como um caminho para que os alunos possam alcançar um modo de interpretação do mundo que os rodeia naquilo que o constitui hoje, no quanto se afasta do passado e de possíveis cenários de evolução futura”.
O programa do 11º ano está organizado em duas unidades centradas em temáticas diferentes já referidas na tabela2.2.
Na primeira unidade, Química e Indústria: equilíbrios e desequilíbrios, salienta-se a importância da Indústria Química na sociedade atual e aproveita-salienta-se a síntesalienta-se do amoníaco para introduzir importantes conceitos para se compreender a Química.
Esta primeira unidade assenta no princípio referido por Martins e colegas (2003:4) quando afirmam que “Na atualidade, a importância do equilíbrio químico se reflete particularmente na produção industrial”. E, de facto, o estudo das variáveis que influenciam as reações químicas como forma de otimizar os processos à escala industrial é a meta desta unidade.
Assim, o documento oficial do programa de Química do 11º ano de escolaridade, começa por apontar a indústria do amoníaco como um exemplo primordial de produção industrial. A este propósito Martins e colegas (2003:4) referem que “A alimentação da população mundial em crescimento necessita de grandes quantidades de fertilizantes em grande escala e de baixo custo, sendo que muitos destes se podem obter a partir do amoníaco”.
Desta forma, o amoníaco como matéria prima é o ponto de partida para o estudo dos subtemas desta unidade. E, citando novamente Martins e colegas (2003:7), este ponto de partida abre caminho ao estudo das variáveis chave de que depende qualquer processo industrial que envolva reações químicas.
Na segunda unidade, Da Atmosfera ao Oceano: soluções na Terra e para a
Terra, a partir dos sistemas aquosos naturais e da sua composição, apresentam-se
facetas da Química das soluções, incluindo o estudo das reacções ácido-base, de precipitação e de oxidação-redução.
A segunda unidade assenta no facto de cerca de 70% da superfície do planeta estar coberta por uma preciosa camada de água. Mas, o documento oficial do programa relembra que a água não preenche só o nosso planeta. E, a este respeito, Simões e colegas (2008) afirmam que são vários os organismos da Terra que têm, na sua constituição, uma grande percentagem de água. Os autores citam como exemplos:
“- 60% do peso de uma árvore é água;
- O Homem e a maioria dos animais possuem cerca de 65% de água;
- Até a medusa, capaz de libertar um veneno narcotizante que pode provocar a morte, tem 90% de água.”
Assim, dada a sua importância, a água e as soluções aquosas naturais, são um excelente contexto para a abordagem e aprofundamento de muitos conceitos químicos.
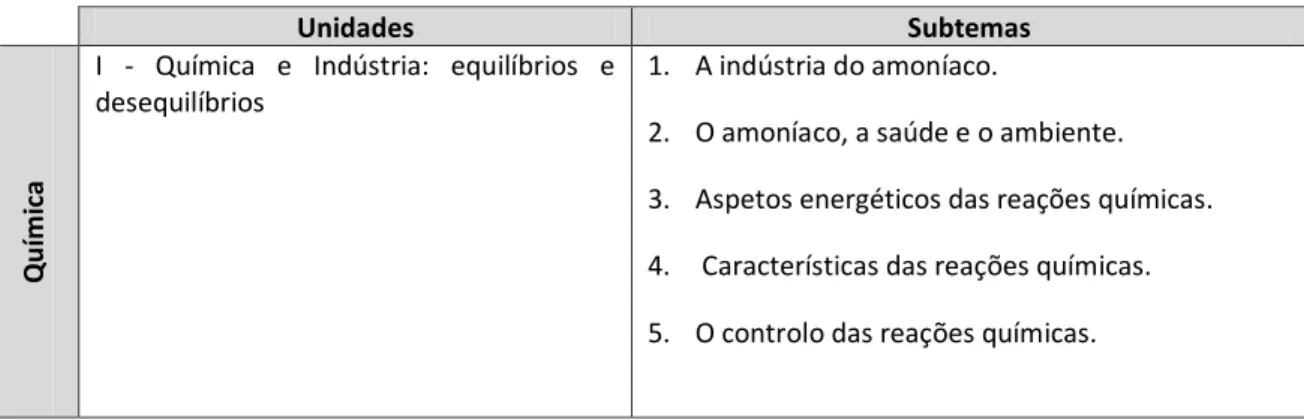
Para abordar estas duas unidades, o programa aponta o estudo dos subtemas enunciados na tabela2.4.
Tabela 2.4 - Linhas gerais do programa de Química do 11º ano de escolaridade.
Unidades Subtemas
Q
u
ím
ica
I - Química e Indústria: equilíbrios e desequilíbrios
1. A indústria do amoníaco.
2. O amoníaco, a saúde e o ambiente. 3. Aspetos energéticos das reações químicas. 4. Características das reações químicas. 5. O controlo das reações químicas.
II – Da atmosfera ao Oceano: soluções na Terra e para a Terra
1. A água na Terra: Abundante ou escassa? 2. Água da chuva, água destilada e água pura; 3. Água potável;
4. Acidez e basicidade das águas; 5. Chuva ácida;
6. Reações de oxidação-redução;
7. Solubilidade e reações de precipitação; 8. Mineralização e desmineralização das águas.
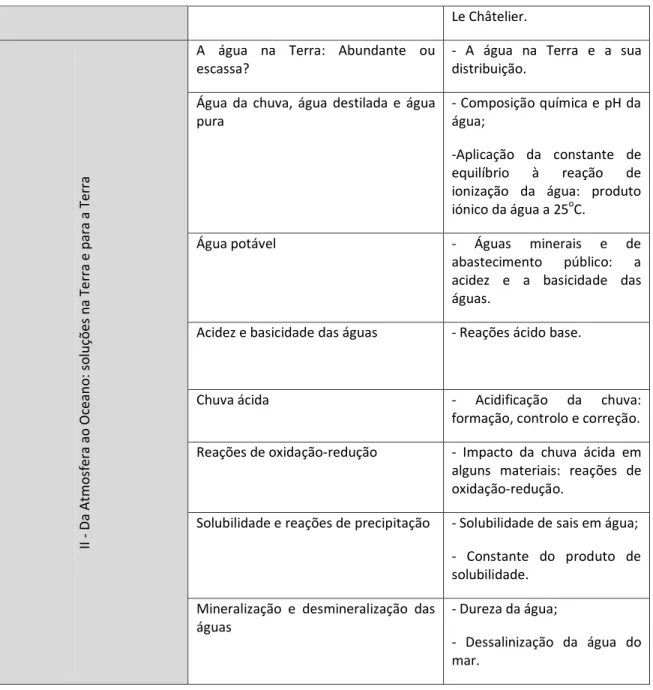
O programa oficial é ainda mais específico e aponta os objetos de estudo dentro de cada subtema, resumidos na tabela2.5.
Tabela 2.5 –Objetos de aprendizagem das duas unidades de Química no 11º ano de
escolaridade.
Unidade Subtema Objetos de estudo
I – Q u ími ca e In d ú st ri a: eq u ilí b ri o s e d es eq u ilí b ri o s
A indústria do amoníaco - Aspetos quantitativos das
reações químicas;
- Quantidade de substância; - Rendimento de uma reação química;
- Grau de pureza dos
componentes de uma mistura reacional.
O amoníaco, a saúde e o ambiente - Segurança na manipulação
do amoníaco. Aspetos energéticos das reações
químicas
- Variação de entalpia de reação.
Características das reações químicas - Reversibilidade das reações
químicas;
- Constante de equilíbrio; - Quociente de reação.
O controlo das reações químicas - Fatores que influenciam a
evolução do sistema reacional:
concentração, pressão,
Le Châtelier. II - D a At mo sf er a ao Oc ea n o : s o lu çõ es n a Te rr a e p ar a a Ter ra
A água na Terra: Abundante ou escassa?
- A água na Terra e a sua distribuição.
Água da chuva, água destilada e água pura
- Composição química e pH da água;
-Aplicação da constante de
equilíbrio à reação de
ionização da água: produto
iónico da água a 25oC.
Água potável - Águas minerais e de
abastecimento público: a
acidez e a basicidade das águas.
Acidez e basicidade das águas - Reações ácido base.
Chuva ácida - Acidificação da chuva:
formação, controlo e correção.
Reações de oxidação-redução - Impacto da chuva ácida em
alguns materiais: reações de oxidação-redução.
Solubilidade e reações de precipitação - Solubilidade de sais em água;
- Constante do produto de solubilidade.
Mineralização e desmineralização das águas
- Dureza da água;
- Dessalinização da água do mar.
Para atingir os objetivos de estudo descritos na tabela2.5, são ainda indicadas as atividades laboratoriais da tabela2.6 como obrigatórias.
Tabela 2.6 –Atividades laboratoriais de Química do 11º ano de escolaridade de caráter
obrigatório.
Unidade Subtema Atividade Laboratorial
Q u ími ca e In d ú st ri a: u ilí b ri o s e eq u ilí b ri o
s A indústria do amoníaco AL 1.1. - Amoníaco e
compostos de amónio em materiais de uso comum
Aspetos energéticos das reações químicas
Características das reações químicas AL 1.2. - Síntese do sulfato de
tetraaminocobre (II) mono-hidratado
O controlo das reações químicas AL 1.3. - Efeitos da
temperatura e da concentração no equilíbrio de uma reacção II - D a At mo sf er a ao Oc ea n o : so lu çõ es n a Te rr a e p ar a a Ter ra
A água na Terra: Abundante ou escassa?
Água da chuva, água destilada e água pura
AL 2.1. -Ácido ou base: uma
classificação de alguns
materiais Água potável
Acidez e basicidade das águas AL 2.2. - Neutralização: uma
reação ácido-base
Chuva ácida AL 2.3. - Chuva "normal" e
chuva ácida
Reações de oxidação-redução AL 2.4. - Série eletroquímica: o
caso dos materiais;
Solubilidade e reações de precipitação AL 2.5. - Solubilidade: solutos e
solventes; Mineralização e desmineralização das
águas
AL 2.6. - Dureza da água e problemas de lavagem;
A importância atribuída ao trabalho experimental é tal que as atividades laboratoriais têm caráter obrigatório e são realizadas com a turma dividida como apontado na tabela 2.1. A este respeito, Lopes (2004) afirma que “o trabalho experimental é uma ocasião privilegiada para construir e desenvolver conceitos, pois ao mesmo tempo que mobiliza conceitos será necessário reformular alguns, enriquecer e eventualmente aprender outros.”
A tabela 2.6, para além de constituir um resumo das atividades laboratoriais obrigatórias, revela a coerência existente no desenrolar das diferentes atividades. E, de facto, a sugestão feita no programa oficial mostra um seguimento facilitador da aprendizagem de conceitos dentro de cada unidade.
Mas é relevante conhecer os objetivos de cada atividade laboratorial para melhor se perceber a ligação entre as diferentes actividades.
Tabela 2.7 –Objetos de ensino das atividades laboratoriais de Química do 11º ano de
escolaridade de carácter obrigatório.
Unidade Atividade Laboratorial Objetos de ensino
I – Q u ími ca e In d ú st ri a: eq u ilí b ri o s e d es eq u ilí b ri o s AL 1.1 - Amoníaco e compostos de amónio em materiais de uso comum
-Identificação laboratorial da presença de amoníaco e de compostos de amónio.
AL 1.2 - Síntese do sulfato de tetraaminocobre (II) mono-hidratado
- O amoníaco como matéria-prima;
- Síntese de um sal usando
como matéria-prima o
amoníaco.
AL 1.3 - Efeitos da temperatura
e da concentração no
equilíbrio de uma reação
- Efeitos da variação da
temperatura e da
concentração num equilíbrio homogéneo em fase líquida.
II – D a At mo sf er a ao Oc ea n o : So lu çõ es d a Te rr a e p ar a a Ter ra
AL 2.1 -Ácido ou base: uma
classificação de alguns materiais - Avaliação qualitativa ou quantitativa de acidez, basicidade e de neutralidade de soluções aquosas; - Apreciação do efeito da temperatura no pH de uma solução. AL 2.2 - Neutralização: uma reacção ácido-base - Acidificação natural e
artificial de águas provocada pelo dióxido enxofre;
- Efeitos das chuvas ácidas em materiais;
- Força relativa de ácidos e concentração das soluções respectivas. AL 2.3 - Chuva "normal" e chuva ácida - Neutralização: reacções ácido-base; - Indicadores ácido-base; - Titulação;
- Curvas de titulação de ácido forte - base forte.
AL 2.4 - Série electroquímica: o caso dos materiais;
- Série eletroquímica
qualitativa;
- Proteção de metais por metais.
- Solubilidade em água: substâncias muito e pouco solúveis;
- Factores que interferem na solubilidade de um soluto num solvente;
- Influência da temperatura na solubilidade de um soluto num solvente.
AL 2.6 - Dureza da água e problemas de lavagem;
- Dureza da água: origem,
consequências a nível
doméstico e amaciamento.
2.2. A Água no Programa de Química do 11º ano de Escolaridade
Uma análise atenta às tabelas 2.3 e 2.5 permite tirar três conclusões importantes:
é à segunda unidade de Química que é atribuída maior carga horária;
a água é um elemento chave no estudo dos conceitos inerentes à segunda unidade;
as águas para consumo humano são separadas de outras possíveis utilizações.
Estas conclusões são ainda justificadas pelos autores do programa de Física e Química A do 11º ano de escolaridade (Martins e colegas, 2003), quando referem que “Na segunda unidade de Química se pretende desenvolver a compreensão dos alunos sobre sistemas aquosos naturais, distinguir águas próprias para consumo de outras…”. Os mesmos autores sublinham também que, para que esta interpretação possa ser alcançada, “desenvolvem-se conceitos do domínio do ácido-base e da solubilidade, nos quais o conceito de equilíbrio químico surge com conceito subsidiário.”. Note-se que os autores acrescentam ainda que “uma abordagem simples de oxidação-redução também está prevista.”
Em suma, as afirmações dos autores do programa e uma análise à tabela 2.6, permite afirmar que após o estudo das características físico-químicas de uma água para consumo humano, é abordado o equilíbrio ácido-base, de solubilidade e de
oxidação-redução. Assim, neste momento, urge uma questão: Como se relacionam as
características físico-químicas de uma água para consumo humano com os conceitos de química previstos no programa?
A resposta do programa oficial da disciplina a esta questão foi já dada na tabela 2.7, com o incremento de atividades laboratoriais que prevêem a utilização de soluções aquosas para dar cumprimento aos seus objetos de ensino e aprendizagem. A tabela 2.8 simplifica esta resposta.
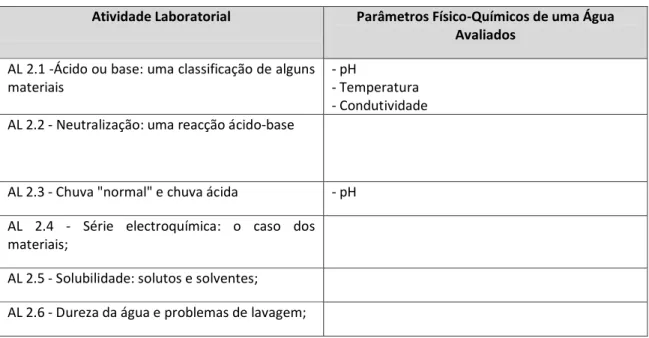
Tabela 2.8 –Parâmetros físico-químicos de uma água avaliados em cada actividade laboratorial.
Atividade Laboratorial Parâmetros Físico-Químicos de uma Água Avaliados
AL 2.1 -Ácido ou base: uma classificação de alguns materiais
- pH
- Temperatura - Condutividade AL 2.2 - Neutralização: uma reacção ácido-base
AL 2.3 - Chuva "normal" e chuva ácida - pH
AL 2.4 - Série electroquímica: o caso dos materiais;
AL 2.5 - Solubilidade: solutos e solventes; AL 2.6 - Dureza da água e problemas de lavagem;
A tabela 2.8 revela que apenas em duas atividades laboratoriais é feita uma avaliação de parâmetros físico-químicos de uma água que a permitem classificar quanto ao seu uso. De facto, em todas as outras atividades propostas, o programa não se mostra preocupado em obter resultados passíveis de classificação.
Na atividade 2.2 a água está presente porque são utilizadas soluções aquosas de ácidos e bases mas, na verdade, o objetivo desta atividade é apenas a realização de uma titulação ácido-base. O mesmo se passa com a atividade 2.4 que tem como objetivo principal realizar reações de oxidação-redução em soluções aquosas. Já a atividade laboratorial 2.5 prevê o estudo da água como solvente e a atividade 2.6 as
2.3. Proposta de Alteração das Atividades Laboratoriais a Desenvolver na Segunda Unidade de Química do 11º ano de Escolaridade: Da Atmosfera ao Oceano
A tabela 2.7 confirma mais uma vez o que relembraram Martins e colegas (2003:3): “o programa está dividido em duas temáticas diferentes”. Isto não significa que as duas unidades possam existir separadamente porque, na verdade, não podem. A este respeito os mesmos autores afirmam também que “o conceito de equilíbrio químico estudado na primeira unidade é muito importante para a compreensão de muitos fenómenos em áreas de ácido-base, oxidação-redução e solubilidade estudadas na segunda unidade”.
Ora, como na segunda unidade, o estudo dos conceitos químicos é feito utilizando a água como pretexto, e se pretende apresentar uma proposta de trabalho que permita uma abordagem mais aprofundada acerca das características
físico-químicas de uma água para consumo humano, sugere-se uma alteração à tabela 2.7,
nomeadamente na segunda unidade, com a substituição dos trabalhos experimentais 2.1 e 2.5 de tal modo que, para além de se dar cumprimento às exigências do programa, se dê um sentido de complementaridade ao que deve ser um todo: o contexto do estudo e o objectivo de estudo.
Obviamente que são muitos os parâmetros de análise obrigatórios numa água para consumo humano que, mesmo com esta alteração, continuarão à margem do programa, mas, considerando os conhecimentos prévios dos alunos, esta é uma alteração possível que, pensa-se, enriquecerá o programa e não alterará o seu esqueleto em termos de objectivos a serem cumpridos.
Tabela 2.9 –Sugestão das atividades laboratoriais a desenvolver na segunda unidade de
Química do 11º ano de escolaridade.
Unidade Atividade Laboratorial Objetos de ensino
II – D a At mo sf er a ao Oc ea n o : S o lu çõ es d a Ter ra e p ar a a Ter ra AL 2.1. – Alcalinidade de uma água para consumo humano
- Avaliação qualitativa ou quantitativa de acidez, basicidade e de neutralidade de soluções aquosas; - Apreciação do efeito da temperatura no pH de uma solução;
- Verificação da alcalinidade de uma água por adição de uma solução de ácido sulfúrico.
AL 2.2. - Neutralização: uma reacção ácido-base
- Acidificação natural e
artificial de águas provocada pelo dióxido enxofre;
- Efeitos das chuvas ácidas em materiais;
- Força relativa de ácidos e concentração das soluções respectivas. AL 2.3. - Chuva "normal" e chuva ácida - Neutralização: reacções ácido-base; - Indicadores ácido-base; - Titulação;
- Curvas de titulação de ácido forte - base forte.
AL 2.4. - Série electroquímica: o caso dos materiais;
- Série eletroquímica
qualitativa;
- Proteção de metais por metais.
AL 2.5. –Determinação do teor em cloretos numa água para consumo humano
- Solução saturada e não saturada de sais em água;
- Solubilidade em água:
substâncias muito e pouco solúveis;
- Factores que interferem na solubilidade de um soluto num solvente;
- Influência da temperatura na solubilidade de um soluto num solvente.
- Determinação do teor em cloretos pelo Método de Mohr.
AL 2.6. - Dureza da água e problemas de lavagem;
- Dureza da água: origem,
consequências a nível
Uma das alterações surge na atividade laboratorial 2.1 com a determinação da
alcalinidade de uma água para consumo humano. Outra alteração surge na actividade
laboratorial 2.5 com a determinação do teor em cloretos recorrendo ao Método de
Mohr.
Repare-se que não foram retirados nem substituídos objetos de ensino das atividades laboratoriais, foram apenas incluídos novos objetos que, pensa-se, resultarão numa alteração positiva e passível de ser efetuada com facilidade, uma vez que os reagentes e equipamento necessário para a sua realização fazem parte do material básico de qualquer laboratório de Química e que o tempo requerido para a concretização das novas atividades laboratoriais é coincidente com o tempo que lhes estava destinado.
Por sua vez, os saberes disponíveis dos alunos também permitem esta alteração, uma vez que, previamente às atividades laboratoriais, foram abordadas as características físico-químicas de uma água para consumo humano, logo os parâmetros alcalinidade e teor em cloretos. Por outro lado, antes da realização da atividade laboratorial 2.1 o programa prevê que sejam relembrados os conceitos de pH, ácido, base e introduzido o estudo da variação do pH mediante diferentes condições. Do mesmo modo, antes da atividade laboratorial 2.5, já foram trabalhadas as volumetrias e está previsto o estudo das reações de precipitação.
3. Parâmetros de Qualidade de uma Água para Consumo Humano
Segundo o artigo 2.º do Decreto-Lei n.º 236/98, de 1 de Agosto, são definidas, em função dos seus usos principais, as seguintes categorias de águas: consumo
humano, suporte da vida aquícola, balneares e de rega.
Uma água para consumo humano ou água potável é aquela que pode ser consumida pelo Homem, sem perigo para a sua saúde. Apesar de vivermos num planeta “azul” já que a maior parte da sua superfície está coberta por uma camada de água, de acordo com Simões (2008) só 2,5% é potencialmente utilizável para consumo humano. Simões (2008:51) acrescenta ainda que, dessa quantidade,“…1,76% está na forma de gelo ou glaciares e que os restantes 0,74% que representam a parte disponível se podem encontrar sob a forma de humidade do solo, vapor de água, nos lagos e rios e nas águas subterrâneas.” O autor utiliza o modelo comparativo da figura 3.1 para ilustrar esta relação.
Figura 3.1 – Relação água total, água potencialmente utilizada e água potável. (Simões,
2008:52)
No entanto, a água disponível está mal repartida pelo Mundo e, devido à ação do Homem, encontra-se muitas vezes contaminada ou poluída.
Atualmente é o Decreto-Lei n.º 306/2007, de 27 de Agosto, que estabelece o regime de qualidade de uma água para consumo humano e nele pode ler-se que,
radiológicos, sendo que os mais representativos da qualidade de uma água se encontram resumidos na tabela 3.1.
Tabela 3.1 – Parâmetros de qualidade de uma água.
Parâmetros Físicos Organoléticos - Sabor - Cheiro - Cor
Físicos (propriamente ditos)
- Turvação - Condutividade - Temperatura - Salinidade Químicos pH Dureza Alcalinidade CO2 livre Cloretos Matéria orgânica Sulfatos Nitritos Nitratos
CBO (oxigénio dissolvido)
CQO (oxidabilidade) COT Fe2+ Mn2+ Cloro residual Azoto amoniacal Teor em cálcio Biológicos N.º total de germes Coliformes totais Coliformes fecais Estreptococos fecais Staphylococosaureus
Radiológicos Medição das radiações α e β com contador Geiger
A água potável que respeita a legislação portuguesa (e comunitária) é geralmente segura para beber, porque sofre um tratamento adequado, de acordo com a sua qualidade na origem, e são regularmente realizadas análises à sua qualidade, de acordo com a legislação em vigor, de modo a verificar e garantir que a água que sai da torneira é própria para consumo.
O artigo 9º do Decreto-Lei n.º 306/2007, de 27 de Agosto, estabelece que é da responsabilidade das entidades gestoras em cada município assegurarem um tratamento adequado da água destinada a consumo humano. Nesse sentido, o mesmo Decreto-Lei obriga à realização de análises regulares em laboratórios certificados e à divulgação pública trimestral dos resultados.
No entanto, a par destas análises, as entidades gestoras têm de fazer um controlo de rotina a determinados parâmetros que variam consoante o tratamento aplicado à água, por forma a ajustar dosagens de reagentes. Na verdade, as análises de rotina pretendem, de acordo com o Decreto-Lei n.º 306/2007, de 27 de Agosto, assegurar um controlo organoléptico da água que seja agradável ao consumidor e garantir uma qualidade microbiológica adequada à saúde humana.
Como a alcalinidade é um parâmetro que afeta a quantidade de produtos químicos que é necessário adicionar para coagulação, amaciamento e controlo da corrosão de sistemas de distribuição, a sua análise é de extrema importância. Por sua vez, como o teor em cloretos altera consideravelmente o sabor da água, este é um parâmetro que deve preocupar as entidades gestoras dos sistemas de abastecimento de água, já que o sabor como característica organolética é detetado pelo consumidor final.
3.1. Alcalinidade
Citando Simões (2008:86) “A alcalinidade de uma solução é uma medida da sua
capacidade-tampão e é uma propriedade que está associada à resistência da solução a
variações de pH, por adição de pequenas quantidades de ácidos ou bases.” Nesse sentido, o autor acrescenta ainda que as soluções tampão são constituídas, habitualmente, por um ácido ou uma base fracos e um sal da partícula conjugada, como por exemplo H2CO3/HCO3-, HCO3-/CO32-, NH4+/NH3.
adição de um qualquer ácido e que se traduz no facto do valor do pH não sofrer grandes alterações durante essa adição.”
Para Peixoto (2008:6) “Do ponto de vista sanitário a alcalinidade não tem sentido relevante, mesmo para valores elevados.” No entanto, o autor acrescenta que as águas de elevada alcalinidade são desagradáveis ao paladar e que a associação com um pH elevado, excesso de dureza e de sólidos dissolvidos, no conjunto, é que são prejudiciais. É por isso que nos processos de tratamento de água a alcalinidade tem grande importância sobretudo quando estão envolvidas operações como a coagulação química ou o amaciamento.
Simões e colegas (2008:86) consideram que “Nas águas de superfície, a alcalinidade é sobretudo devida à presença de iões carbonato, hidrogenocarbonato ou
bicarbonato e hidróxido, podendo ainda ter o contributo de iões borato, fosfato, etc.”.
Esta opinião é partilhada por Martins (2004) que, considerando a contribuição principal dos iões carbonato, hidrogenocarbonato e hidróxido, em comparação com o contributo menor dos outros iões, refere que a alcalinidade pode ser definida de uma forma mais simples recorrendo à equação 3.1:
[ ] [ ] [ ] [ ][ ]
A equação 3.1 pode ser sintetizada a partir da equação química 3.2 que apresenta uma relação do número de iões H+ com que a base pode reagir.
H2O(l) + CO2(g) [H2CO3(aq)] HCO3-(aq) + H+(aq) 2 H+(aq) + CO32-(aq)[ ]
A este propósito Peres (2009:39) acrescenta ainda que: “Normalmente a concentração de iões H3O+ é tão pequena que pode ser desprezada se a água tiver um pH básico e que para valores de pH inferiores a 9,4 a concentração de iões OH- é também relativamente pequena quando comparada com as de carbonato e hidrogenocarbonato pelo que pode não ser contabilizada.”
Já os iões hidrogenocarbonato assumem um papel fundamental porque são formados em quantidades consideráveis pela dissolução do dióxido de carbono em água como esquematizado na equação química 3.2. Estes iões são anfotéricos como revelam as equações químicas 3.3. e 3.4.
[eq. 3.3] [eq. 3.4]
Em termos genéricos, a figura 3.2 apresenta os diferentes valores de pH de uma água em função da composição em CO2(aq), HCO3-(aq) e CO32-(aq).
Figura3.2– pH de uma água em função da composição em CO2(aq), HCO3-(aq) e CO32-(aq).
(Simões,2008:86)
A figura 3.2 está na base da definição apresentada por Simões (2008) onde o autor afirma que:
- águas com pH ≤ 6 têm capacidade-tampão muito baixa, sendo o CO2 a forma dominante de carbono inorgânico;
- águas com pH da ordem de 8.0 – 8.5 são muito resistentes a variações de pH, sendo a partícula dominante HCO3-.
- águas com pH > 11 raramente se encontram em águas naturais, mas nesse caso a forma predominante de carbono inorgânico é CO32-.
hidrogenocarbonato presente. Quanto maior for, maior será a alcalinidade e, consequentemente, maior será a resistência às variações de pH.”
Usualmente distinguem-se dois tipos de alcalinidade: alcalinidade total (T) e
alcalinidade simples ou à fenolftaleína (P). A alcalinidade simples corresponde ao
teor em iões carbonato e hidróxido. A alcalinidade total indica o teor em carbonato, hidróxido e hidrogenocarbonato.
A proveniência e natureza dos iões que contribuem para a alcalinidade deixam antever uma relação direta entre as formas de alcalinidade presentes e o valor do pH da água: o hidróxido resulta da dissociação duma base forte e os carbonatos e bicarbonatos da dissociação do ácido carbónico que é um ácido fraco. A este respeito, Peres (2009:40) apresenta a classificação da tabela 3.2.
Tabela 3.2 – Contribuição para a alcalinidade por parte de diferentes espécies. (Peres,2009:40)
pH Alcalinidade devida a…
>9,4 Carbonatos e hidróxidos
8,3 – 9,4 Hidrogenocarbonatos e carbonatos
4,4 – 8,3 Hidrogenocarbonatos
Peixoto (2008:6) afirma que “… a natureza básica das substâncias causadoras de alcalinidade proporciona a sua avaliação através da neutralização por adição de um ácido forte.” Já Peres (2009:41) refere que “A alcalinidade é medida volumetricamente por titulação com H2SO4 N e é expressa em mg CaCO3/L”
Saliente-se que a alcalinidade é, tal como a dureza, expressa em mg CaCO3/L, ou seja, ppm de CaCO3,porque existe uma relação entre a alcalinidade total e a dureza total na mesma amostra de água. Esta relação prende-se com o facto da dureza em carbonatos incluir todos os sais de baixa solubilidade como os carbonatos e bicarbonatos de cálcio e magnésio.
3.1.1. Método de Determinação Experimental da Alcalinidade de uma Água
Citando Peixoto (2006:6), “A determinação da alcalinidade pode ser feita volumetricamente ou potenciometricamente, por titulação com uma solução aferida dum ácido forte.” Mas, o autor, à semelhança de Peres (2009) e Simões (2008) realça também que o método potenciométrico dá determinações mais precisas visto que não é afetado pela cor, turvação das soluções ou pelos erros visuais do operador. Assim, Peres (2009) apresenta a figura 3.3 característica da evolução típica do pH durante a adição de uma solução de H2SO4 numa titulação potenciométrica.
Figura3.3 – Evolução típica do pH durante a adição de uma solução de H2SO4 numa titulação
Recorrendo à figura 3.3 pode deduzir-se a tabela 3.3.
Tabela 3.3 – Relação entre o pH e os iões presentes na água.
pH Iões presentes
>8,3 Hidróxido e carbonato
<8,3 Hidrogenocarbonato
E atendendo à tabela 3.3 e à definição de alcalinidade simples e total, pode dizer-se que para valores de pH superiores a 8,3 é determinada a alcalinidade à fenolftaleína e neste caso Peres (2009:41) sugere que a amostra seja “titulada com um ácido padrão até um pH de 8,3 onde a fenolftaleína mudará de uma cor rosa para incolor.” O primeiro ponto de inflexão da figura 3.3 corresponde à primeira fase da titulação; o volume de titulante gasto inclui a alcalinidade devida aos hidróxidos e aos carbonatos denominando-se por isso alcalinidade à fenolftaleína e exprime-se de acordo com a equação 3.5.
( ) ( ) ( )
[eq. 3.5]
Já para valores de pH inferiores a 8,3 APHA (2009) sugere o alaranjado de metilo como indicador e como titulante o ácido até um pH de 4,3.O segundo ponto de inflexão da figura 3.3 corresponde à conversão do ião hidrogenocarbonato em ácido carbónico, e o volume de titulante gasto corresponde a um valor de alcalinidade dito total traduzido pela equação 3.6.
( ) ( )
( )
3.2. Cloretos
Os cloretos são encontrados em quase todas as águas naturais e podem provir de infiltrações de águas marinhas, dejetos humanos, percolação através de terrenos salgados, efluentes de indústrias extrativas de papel, minas de potássio e indústria petrolífera entre outros.
Simões e colegas (2008) referem que as secreções humanas são a fonte de cloretos mais comum a considerar porque o cloreto de sódio é uma substância comum na dieta humana. Clesceri (1989) afirma mesmo que o teor de cloretos das águas residuais é, regra geral, superior ao das águas de consumo que as originaram.
Quando presente na água, o anião cloreto, acelera os processos de corrosão nas tubagens e altera o sabor da água.
O ião Cl- forma, de um modo geral, sais muito solúveis e encontra-se em quase todos os tipos de águas com concentrações que variam amplamente. Peres (2009) apresenta a classificação da tabela 3.4.
Tabela 3.4 – Concentração de cloretos em diferentes tipos de água.
Tipo de Água Concentração em mg Cl-/L
Águas doces 10 – 250 (não sendo raro encontrar valores
superiores)
Águas residuais domésticas 500 – 10 000 (na ordem das centenas ou milhares
de mg/L)
Água do mar Na ordem de 20 000 mg Cl-/L
A classificação da tabela 3.4 sugerida por Peres (2009),é também adotada por Simões e colegas (2008) que acrescentam que nas águas doces para valores superiores a 300 mg Cl-/L a água tem um sabor salgado. O Decreto-Lei n.º 306/2007, de 27 de Agosto estabelece que o valor máximo recomendado de cloretos numa água para consumo humano é de 250 mg/L.
de montanha e mais elevado em zonas baixas e nas águas em regiões próximas do litoral. Este é o motivo porque Peres (2009:16) refere que “As águas subterrâneas em áreas adjacentes ao oceano estão em equilíbrio hidrostático com a água do mar, logo uma captação excessiva de águas subterrâneas produz uma diferença hidrostática a favor da água do mar fazendo com que esta se introduza na área da água doce.”
Na água para consumo humano, o gosto salgado conferido pela presença de cloreto varia dependendo da composição química da água. A este propósito Peixoto (2008) refere que o gosto salgado pode ser mais perceptível em águas contendo 250 mg de Cl-/L com o sódio presente como o catião mais presente, do que em águas contendo 1000 mg Cl-/L com o cálcio e magnésio como catiões predominantes.
A concentração em cloretos na água é, assim, importante para se determinar a qualidade de uma água para consumo humano.
3.2.1. Método de Determinação Experimental do Teor em Cloretos de uma Água
O teor de cloretos numa água determina-se recorrendo aos métodos
argentométricos, sendo que os mais utilizados são o método de Mohr, o método de
Charpentier-Volhard e o método de Fajans. No entanto, o método de Mohr é o mais utilizado em contexto escolar, em laboratórios de análise de águas certificados e defendido por autores como Mendes e colegas (2004), Peres (2009), Simões e colegas (2008) e Skoog e colegas (1992).
O método de Mohr consiste numa volumetria de precipitação dos iões cloreto com uma solução padrão de AgNO3. O ião cloreto reage com o catião prata de acordo com a equação química 3.7 originado um composto de baixa solubilidade.
Ag+(aq) + Cl-(aq) AgCl(s)(pp branco)[eq. 3.7]
O indicador usado é uma solução de cromato de potássio que origina um precipitado vermelho-tijolo de Ag2CrO4como traduzido pela equação química 3.8.
2 Ag+(aq) + CrO42-(aq) Ag2CrO4(s)(pp vermelho-tijolo)[eq. 3.8]
Nesta volumetria verifica-se, em primeiro lugar, a precipitação do AgCl, que forma um precipitado branco. Quando a concentração dos iões cloreto se aproxima do fim ocorre a formação de um precipitado cor de tijolo que indica o ponto final da titulação. O precipitado cor de tijolo só ocorre se houver um excesso de AgNO3.
Para que a determinação do ponto final seja correta é necessário que o AgCl precipite quantitativamente antes da formação do precipitado do cromato de prata. É por isso que Peres (2009:18) diz que “…a concentração de indicador é crítica e tem de ser ponderada.” Para tal é necessário conhecer o produto de solubilidade dos equilíbrios de solubilidade que, para um composto genérico representado na equação química 3.9, segue a equação 3.10.
( ) ⇔ ( ) ( )[eq. 3.9] [ ( )] [ ( )] [eq. 3.10]
A expressão 3.10 obedece à definição de Corrêa (2012:189) onde o autor define que “a constante produto de solubilidade de um sal é igual ao produto das concentrações dos iões que origina, quando está em equilíbrio com a fase sólida, cada uma delas elevada a uma potência igual ao respectivo coeficiente estequiométrico da equação de dissolução”. Esta definição vai de encontro às definições apresentadas por Barros e colegas (2008) e Skoog e colegas (1992).
Assim, conhecendo os valores dos produtos de solubilidade dos sais, é possível obter os valores das respectivas solubilidades em água. Do mesmo modo, conhecida a solubilidade de um sal em água, pode calcular-se o seu produto de solubilidade (Ks). A solubilidade dos sais de prata é apresentada na tabela 3.5.
Tabela 3.5 – Solubilidade dos sais de prata. (Peres, 2009:18)
Sal
Solubilidade (25oC)
Ks (25oC)
mg.L-1 mol.L-1
A tabela 3.5 revela que o valor do produto de solubilidade para o cromato é inferior ao do cloreto mas que para a solubilidade a situação é inversa, pelo que se a concentração do indicador for escolhida de forma adequada precipita primeiro o ião cloreto. Para tal, no ponto de equivalência, as concentrações nos diferentes iões têm de ser tais que verifiquem simultaneamente os valores das duas constantes do produto de solubilidade como sugerido na tabela 3.6.
Tabela 3.6 – Concentrações em equilíbrio dos iões prata e cromato.
Produto de solubilidade Concentração em equilíbrio
[ ] [ ] [ ]
[ ] [ ] [ ]
A tabela 3.6 permite concluir que se a concentração do indicador for igual ou superior a 6,1x10-3 mol/L, precipita primeiro o AgCl e logo que exista excesso de Ag+ forma-se um precipitado corado de Ag2CrO4. Por esse motivo, Clesceri (1989) aconselha uma concentração de indicador igual a 4x10-3 mol/L.
Outro aspeto que influencia a aplicação e sucesso do método de Mohr é o pH do
meio reaccional que, Mendes (2004) sugere que deva situar-se entre 6,5 e 9,0. O autor
considera que o meio deve ser ligeiramente básico ou neutro porque em meio ácido o anião cromato é solúvel formando o anião dicromato como exemplifica a equação química 3.11.
[eq. 3.11]
Como o dicromato de prata é consideravelmente mais solúvel que o cromato de prata, a reação indicadora em meio ácido ou não ocorrerá ou necessitará de uma maior quantidade de prata, falseando o resultado da análise. Assim, em meio ácido, Peres (2009:20) sugere que o acerto de pH se faça com carbonato de cálcio por ser “um sólido inerte e insolúvel.”
Já em meio fortemente básico pode ocorrer competitivamente a precipitação do AgOH de acordo com a equação química 3.12.
( )[eq. 3.12]
Neste caso, Mendes (2004) sugere que a acidificação se faça com ácido acético cujo excesso é, depois, neutralizado com o excesso de carbonato de cálcio.
Finalmente, Mendes (2004) e Simões e colegas (2008) aconselham a que titulação se realize à temperatura ambiente porque a solubilidade dos precipitados envolvidos aumenta com o aumento desta. Sugerem também a realização de um ensaio em branco feito na ausência de iões cloreto, uma vez que é necessária a formação de uma certa quantidade de cromato de prata para se detetar a sua cor, pelo que o ponto de equivalência é ultrapassado.
A concentração de cloretos é dada pela equação 3.13.
[ ] ( )
4.
Proposta de Inclusão da Determinação da Alcalinidade de uma Água para Consumo Humano no Atual Programa de Química do 11º AnoA alcalinidade não é uma característica físico-química avaliada nos trabalhos práticos obrigatórios a desenvolver ao longo do 11º ano de escolaridade (tabela 2.8). No entanto, como referido na tabela 3.1, é um parâmetro de análise obrigatória quando se pretende testar a qualidade de uma água para consumo humano. Por este motivo sugere-se a substituição da tabela 2.7 pela tabela 2.9, nomeadamente no que se refere à atividade laboratorial 2.1.
4.1. O Atual Programa
Tal como enunciado na tabela 2.7, o atual programa prevê a classificação de águas e de outras soluções aquosas em ácidas, neutras ou alcalinas sugerindo a utilização de um processo de avaliação qualitativa (usando indicadores em solução ou em papel) ou um processo de avaliação quantitativa (usando medidores eletrónicos de pH).
De facto, a composição química de uma água pode ser muito diversa, dependendo de vários fatores como a natureza de sais e gases dissolvidos, a formação geológica do solo que atravessa e o tipo de poluição a que a água está sujeita.
Barros (2008:22), refere que “Em geral, as águas naturais têm um pH compreendido entre 4,0 e 9,0.” O mesmo autor acrescenta que em regiões de solo granítico e basáltico a água geralmente tem pH menor do que 7, e que em regiões de solo calcário o pH é superior a 7.
O pH de uma água é um parâmetro importante, uma vez que pode condicionar a sua utilização e, de acordo com o Decreto-Lei n.º 306/2007, de 27 de Agosto, nas águas para consumo humano, o pH deve estar compreendido entre 6,5 e 9, inclusive.
De acordo com as orientações do Programa de Química para o 11º ano, a avaliação qualitativa do pH pode ser feita observando a cor de soluções de indicadores
de ácido-base. Uma forma prática de utilização desses indicadores consiste em impregná-los em papéis que mudam de cor conforme o pH da solução em que são mergulhados. A tabela 4.1 indica as zonas de viragem de alguns indicadores de ácido-base.
Tabela 4.1 – Indicadores de ácido-base e respectivas zonas de viragem. (Barros, 2008:24)
Indicador Zona de Viragem Mudança do Cor
Azul de timol* 1,2 – 2,8 Vermelho – Amarelo
Alaranjado de metilo 3,1 – 4,4 Vermelho – Amarelo
Verde de bromocresol 3,8 – 5,4 Amarelo – Azul
Vermelho de metilo 4,2 – 6,0 Vermelho – Amarelo
Tornesol 5,0 – 8,0 Vermelho – Azul
Azul de bromotimol 6,0 – 7,6 Amarelo – Azul
Azul de timol* 8,0 – 9,6 Amarelo – Azul
Fenolftaleína 8,2 – 9,8 Incolor – Rosa
*Indicador com duas zonas de viragem
A avaliação quantitativa faz-se utilizando aparelhos medidores de pH. Estes dispositivos têm um elétrodo sensível ao pH (em geral um elétrodo de vidro), um elétrodo de referência e um sensor de temperatura.
O sensor de temperatura é importante porque o valor da constante de auto-ionização da água, kW, aumenta com a temperatura, ou seja, com o aumento da temperatura o equilíbrio desloca-se para a direita, o que significa que o pH de uma solução diminui (H3O+ aumenta) quando a temperatura aumenta, de acordo com a equação 4.1.
( ) ( ) ( ) [ ] Na tabela 4.2 são apresentados valores de Kwa diferentes temperaturas.
Tabela 4.2 – Valores de Kwa diferentes temperaturas. (Barros, 2008:24)
Temperatura (oC) 0 10 20 25 40
Kw 1,5 x 10-15 3,0 x 10-15 6,8 x 10-15 1,0 x 10-14 3,0 x 10-14
pH(solução neutra) 7,41 7,26 7,08 7,00 6,76
Este efeito da temperatura no pH é tido em conta nos instrumentos de medição de pH, que possuem dispositivos manuais ou automáticos de correcção do pH em função da temperatura a que as medições são efetuadas.
O procedimento experimental sugerido pelo Programa de Química de 11º, para que sejam cumpridos os objetivos de ensino enunciados na tabela 2.7 para a atividade 2.1, obedece ao descrito na tabela 4.3.
Tabela 4.3 – Procedimento experimental sugerido pelo Programa de Química do 11º ano de
escolaridade para a atividade laboratorial 2.1.
Procedimento Experimental Parte I – Avaliação qualitativa, usando
indicadores de ácido base em solução e em papel
1 – Selecionar diferentes indicadores existentes no laboratório (fenolftaleína, azul de bromotimol, vermelho de metilo, alaranjado de metilo, ou outros);
2 – Com uma pipeta graduada colocar cerca de 3mL de cada amostra de água num tubo de ensaio;
3- Adicionar 2-3 gotas de um dos indicadores em cada amostra de água e agitar, levemente;
4 - Observar e registar a cor adquirida;
5 - Proceder de igual modo para os restantes indicadores; 6 – Colocar novamente cerca de 3 mL de cada amostra de água num tubo de ensaio;
7 – Mergulhar uma tira de papel de indicador universal em cada tubo de ensaio e registar o valor de pH.
Parte II – Avaliação quantitativa: medição do
valor de pH
1 – Efetuar a calibração do eléctrodo de medição de pH, seguindo as instruções do aparelho;
2 – Num gobelé de 100 mL, colocar cerca de 50 mL de amostra de água;
3 – Introduzir uma barra magnética no gobelé e colocar em cima de um agitador magnético;