Luis Tiago da Costa e Maia
Disfunção Imunológica e Linfomagénese: ilacções a
partir das associações descritas
2010/2011
Junho, 2011
Luis Tiago da Costa e Maia
Disfunção Imunológica e Linfomagénese: ilacções a
partir das associações descritas
Mestrado Integrado em Medicina
Área: Biopatologia
Trabalho efectuado sob a Orientação de:
Prof.ª Drª Maria Clara Correia Sambade
Junho, 2011
Arquivos de Medicina
ÍNDICE
• TÍTULO, AUTORES, CONTACTOS 2
• RESUMO 3
• ABSTRACT 5
• INTRODUÇÃO 7
• AUTO-IMUNIDADE E LINFOMAGÉNESE 10
Factores de Susceptibilidade Comuns 11
Mecanismos de linfomagénese derivados da Patogénese das Doenças Auto-Imunes 14
Papel da Intervenção Farmacológica 21
• IMUNO-DEFICIÊNCIA E LINFOMAGÉNESE 23
Perda de Vigilância Imunológica 24
Desregulação da Latência/Replicação Vírica 25
Estimulação Crónica de Células B 29
Papel dos Macrófagos 30
Papel de Citocinas 31
• CONCLUSÕES 33
• REFERÊNCIAS BIBLIOGRÁFICAS 35
• ILUSTRAÇÕES 55
Desregulação Imunológica e Linfomagénese: ilacções a partir das associações descritas
Maria Clara Correia Sambade*, Luis Tiago Costa Maia**
*Professora Associada convidada da Faculdade de Medicina da Universidade do Porto.
**Aluno do 6º ano da Faculdade de Medicina da Universidade do Porto
Contactos
Telefone: 00351 917974730; endereço postal: Rua da Caldeira nº 8, 3810-223 Aveiro, Portugal; endereço electrónico: tiagomaia_21@hotmail.com
Agradecimentos
Agradeço à Professora Doutora Clara Sambade pela dedicação extrema, que excedeu o mero profissionalismo, e pela gestão sábia do poder de crítica e de incentivo,
durante o percurso deste trabalho. Agradeço-lhe também a cultura de exigência que me imprimiu e que considero ter contribuido fortemente para o meu crescimento intelectual e, consequentemente, para as minhas competências futuras. A
oportunidade e amizade que me foram concedidas permanecerão como uma das memórias centrais da minha passagem pela Faculdade de Medicina do Porto.
RESUMO
Um número crescente de situações de disfunção imunológica — auto-imunidade e imunodeficiência — tem vindo a ser associado a desenvolvimento de linfomas. A investigação recente sobre situações de disfunção imunológica tem fornecido dados sobre a patogenia dessas doenças que podem ter implicações no risco de
transformação neoplásica de populações linfóides. Por outro lado, as alterações recentes das estratégias terapêuticas podem modificar o contexto patogénico e interferirem com a linfomagénese.
Neste trabalho propomo-nos a rever a evidência relativa à epidemiologia e à patogenia de doenças auto-imunes e de situações de imunodeficiência, no sentido de tentar identificar elos eventualmente subjacentes à associação a linfomas. Procedemos à revisão da literatura sobre as patologias auto-imunes mais comuns – Síndrome de Sjögren, Artrite Reumatóide e Lúpus Eritematoso Sistémico – e sobre a
Imunodeficiência Adquirida por infecção pelo HIV.
Da revisão efectuada podemos concluir que estados crónicos de estimulação linfocitária B e de elevação de citocinas anti-apoptóticas são aspectos comuns aos dois grupos de disfunção imunológica considerados e são mecanismos propiciadores de linfomagénese. Nas doenças auto-imunes, a relevância de factores de
susceptibilidade individual e da formação de centros germinativos ectópicos no desenvolvimento de linfomas não está ainda esclarecida e, de momento, não há evidência de que as terapêuticas biológicas tenham consequências no risco de
linfomagénese. Na imunodeficiência, a perda de eficácia da vigilância imunológica, ao desenvolvimento tumoral e ao controlo de infecções víricas, e a disfunção de
linfomagénese e a HAART diminuiu, acentuada mas selectivamente, o risco de linfomas.
Palavras-Chave: Doenças auto-imunes; Imunodeficiência; Linfomas; Estimulação crónica B; Citocinas anti-apoptóticas; Vigilância imunológica
ABSTRACT
An increasing number of conditions characterized by immune dysfunction, from auto-immune diseases to immunodeficiencies, has been associated with development of lymphomas. Recent data on the pathogenesis of some of those conditions may eventually contribute to elucidate the risk of neoplastic transformation of lymphoid populations. In addition, new therapeutic approaches may also have impact on lymphomagenesis.
We reviewed the evidence so far gathered on the epidemiology and pathogenesis of auto-immune diseases and immunodeficiencies aiming to identify possible links between the two groups of immune dysfunction and lymphoma development. For that purpose we have chosen the more common auto-immune diseases – Sjögren´s Syndrome, Rheumatoid Arthritis and Systemic Lupus Erythematosus – and the Immune Deficiency due to HIV infection.
Based on published data, we conclude that chronic B cell stimulation and increase of anti-apoptotic cytokines are mechanism common to both groups of immune dysfunction under analysis that can be considered lymphomagenic. In auto-immune diseases, the relevance of individual susceptibility factors as well as the role of ectopic germinal centres in lymphoma development is not yet clear. In immunodeficiency, the loss of immune surveillance, to neoplastic development and to viral latency/replication control, and the dysfunction of HIV infected macrophages are additional mechanisms favouring lymphoagenesis. In this condition, the HAART therapy has decreased, significantly but selectively, the risk of lymphoma.
Key-words: Auto-immune diseases; Immunodeficiency; Lymphomas; Chronic B cell stimulation; Anti-apoptotic cytokines; Immune surveillance.
INTRODUÇÃO
A desregulação imunológica é um conceito que engloba situações fisiopatológicas distintas decorrentes de perturbações da homeostasia do sistema imune,
sistematizáveis em 3 grupos: auto-imunidade, manifestada em respostas efectoras contra antigénios próprios, atopia que corresponde a uma resposta individual a moléculas exógenas de patogenicidade restrita e imunodeficiência, traduzida por um défice geral ou selectivo da resposta imune. As situações de auto-imunidade
englobam patologias específicas de órgão e auto-imunidade sistémica (1). Nas imunodeficiências distinguem-se situações congénitas e adquiridas (1)
A associação de certas formas de auto-imunidade e de estados de imunodeficiência ao desenvolvimento de linfomas é há muito conhecida. São exemplos clássicos os linfomas que ocorrem em portadores de Síndroma de Sjögren (2) ou Tiroidite de Hashimoto (3) e os linfomas que surgem em doentes transplantados (4)ou infectados por HIV (5). No entanto, estudos epidemiológicos mais recentes têm vindo a aumentar o espectro das associações descritas (6,7). No âmbito da associação entre disfunção imunológica e desenvolvimento de linfomas, a atopia tem sido menos estudada e os resultados publicados são contraditórios (8).
A prevalência de patologia auto-imune está estimada entre 5,3% e 9,4% (9). Nos estudos publicados (6,7), o risco global de desenvolvimento de linfomas varia entre 1 e 6,5x para os Linfomas Não-Hodgkin (NHL) e 1 e 3,5x para o Linfoma de Hodgkin (HL) estando relatadas associações inversas excepcionais cuja natureza não é conhecida. No entanto, a magnitude de associação entre patologia auto-imune e linfomagénese é função da patologia específica e do sexo do doente (maior penetrância no sexo masculino) (6,7). Relativamente aos subtipos de linfomas observados nas associações, dois factos genéricos tornam-se evidentes. O primeiro é que se
observam, maioritariamente, três subtipos de neoplasias linfóides: o Linfoma B difuso de células grandes (DLBCL), o Linfoma de células marginais de tipo MALT (MALT L) e o Linfoma T periférico (pTL). O segundo aspecto a ressalvar é o facto de uma mesma patologia auto-imune se associar a vários subtipos de linfoma (6,7).
Por outro lado, a imunodeficiência comporta um risco de desenvolvimento de linfoma até 80x superior ao da população geral (10,11), em relação directa com o grau de imunossupressão (12). É possível definir as seguintes características gerais para os linfomas associados às várias formas de imunodeficiência: a maioria é DLBCL, têm uma elevada frequência de apresentação extra-nodal e de associação à infecção por EBV, e têm tendência para serem precocemente agressivos (13,14). Relativamente às situações de imunodeficiência primária, os estudos de associação a linfomas são muito escassos o que provavelmente resulta da raridade daquelas doenças e da sua mortalidade precoce na ausência de transplantação eficaz.
Apesar dos subtipos de linfomas representados nas associações com estados de disfunção imunológica serem subtipos observados na população geral, a frequência relativa dos vários subtipos de linfoma no contexto de auto-imunidade e
imunodeficiência, bem como algumas das suas características, são distintas da população geral, sugerindo que a disfunção imunológica possa incluir mecanismos próprios ou adicionais de linfomagénese.
Tendo em conta os factos acima mencionados, o objectivo deste trabalho consiste na revisão de dados da literatura que permita actualizar o estado actual do conhecimento, em particular no que se refere aos mecanismos subjacentes à agregação entre
situações de disfunção imunológica e desenvolvimento de linfomas. Para tal foram seleccionados três tipos de patologia auto-imune — Síndroma de Sjogren (SS), Artrite Reumatóide (AR) e Lúpus Eritematoso Disseminado (LES) — e a Síndroma de
frequência da patologia em causa, a consistência da associação a linfomas, a disponibilidade actual de estudos e a diversidade de mecanismos gerais que essas escolhas poderiam fornecer no seu todo. Deste ponto de partida, propomo-nos rever e discutir os dados epidemiológicos e os mecanismos patogénicos dos diferentes
quadros de desregulação imunológica procurando identificar pontos de convergência que possam contribuir para a linfomagénese.
AUTOIMUNIDADE E LINFOMAGÉNESE
O LES, a AR e a SS são exemplos de patologias auto-imunes consistentemente associadas ao desenvolvimento de linfomas (6,7). Cada entidade corresponde, porém, a um conjunto de variantes clínicas distintas no que diz respeito aos locais atingidos e à magnitude de inflamação sistémica (15-17). Esta variabilidade implica dificuldades na estimativa do risco de desenvolvimento de linfomas associado a estas situações. Tal é exemplificado num estudo desta associação em contexto de SS que, por selecção preferencial de variantes patológicas mais graves, obteve um risco 20x superior ao descrito em estudos mais recentes (2,7).
Uma dificuldade adicional deriva da relativa raridade de algumas patologias auto-imunes, o que dificulta a obtenção de dados estatisticamente sólidos. Se a AR é comum, com uma prevalência de 1%, já o LES e a SS são patologias raras (0,0238% e 0,0144%, respectivamente) (18). Manifestações de algumas das situações auto-imunes referidas podem co-existir pelo que os estudos sobre risco de desenvolvimento de linfomas deveriam considerar apenas as formas primárias das doenças (9,18). Apesar dos constrangimentos mencionados, o risco aumentado de desenvolvimento de linfomas em doentes portadores de patologia auto-imune é considerado um dado adquirido, nomeadamente para o LES, AR e SS. A Fig. 1ilustra a associação global em cada uma destas patologias auto-imunes e evidencia a heterogeneidade do tipo de linfomas associados a cada uma das patologias em causa (6,7).
Dos dados coligidos na Fig. 1 torna-se claro que a SS primária é a doença auto-imune mais fortemente associada a linfomas, comportando um risco global 1,9x superior ao observado na população normal mas com uma associação particularmente forte ao subtipo linfoma MALT. Por outro lado, a AR é dos poucos exemplos deste grupo de
doenças em que foi encontrada uma associação significativa a linfomas foliculares (FL). O subtipo DLBCL é o único associado aos três tipos de patologia.
Na prossecução do nosso objectivo, a revisão da literatura de forma a evidenciar eventuais mecanismos subjacentes à associação entre doenças auto-imunes e desenvolvimento de linfomas, os dados disponíveis serão discutidos com a seguinte estruturação: I – a identificação de factores de susceptibilidade comuns aos dois tipos de situação; II – a clarificação da patogenia da doença imunológica e do eventual papel dos seus factores patológicos no desenvolvimento de linfomas; III – o
esclarecimento do papel de medidas terapêuticas no desenvolvimento de linfomas.
I – Natureza da associação: uma questão de factores de susceptibilidade individual ou ambientais partilhados?
A identificação de factores de susceptibilidade individual para o desenvolvimento de patologia auto-imune iniciaram-se com o estudo dos haplótipos HLA, tendo em conta a descrição de agregação familiar para algumas doenças auto-imunes (9,18), e
estenderam-se posteriormente a estudos de variações genéticas individuais, quer em doentes com patologias auto-imunes quer em doentes com linfomas, através de metodologias progressivamente mais sofisticadas (Fig. 2).
O haplótipo HLA-DRB1 constitui um factor de risco para cada uma das doenças auto-imunes em análise bem como para o desenvolvimento de linfomas. Por outro lado, o haplótipo HLA-DQA1 constitui um factor de risco para a AR e SS e um factor de risco para o desenvolvimento de linfomas, nomeadamente FL, o que poderá estar
subjacente à referida associação entre AR e aquele tipo particular de linfoma. No entanto, não existem dados publicados sobre a genotipagem HLA nos doentes portadores de patologia auto-imune que desenvolveram linfomas pelo que o
significado da partilha dos genótipos referidos, enquanto factor de risco linfomagénico, não está esclarecido.
Polimorfismos de várias citocinas, em particular das IL-2, IL-10 e IL-21, bem como do TNFα, do CD40 e de reguladores directos ou indirectos da apoptose como o CD95 (FAS) e o NF-kB, têm sido apontados como factores de risco para o desenvolvimento de doenças auto-imunes. De notar que várias destas citocinas bem como os referidos reguladores da apoptose constituem também factores de risco para o desenvolvimento de linfomas. De novo, estes factos apontam para a possibilidade dos polimorfismos referidos poderem participar na associação entre doenças auto-imunes e linfomas. No entanto, não estão ainda disponíveis dados sobre a caracterização dos genes
mencionados nos doentes portadores de qualquer uma das patologias auto-imunes que desenvolveram linfomas.
Uma forma de tentar inferir o eventual papel dos polimorfismos referidos na
patogénese de doenças auto-imunes e linfomas é considerar os dados obtidos em modelos experimentais, mediante manipulação génica, cujo fenótipo inclui
manifestações auto-imunes ou neoplasias linfóides. Sem pretensões de revisão exaustiva, é particularmente interessante atender a dois tipos de situações: a sobre-expressão de CD40-L e a abolição da sinalização pró-apoptótica da via FAS/FAS-L.
Num modelo de ratinhos transgénicos para o CD40-L observou-se desenvolvimento de linfomas na ausência de sinais de patologia auto-imune (43). Num outro modelo de transgénicos para o CD40-L, no qual a estirpe de ratinhos era diferente, desenvolveu-se patologia auto-imune sistémica desenvolveu-semelhante ao LES mas não desenvolveu-se obdesenvolveu-servaram linfomas (44). Os resultados, aparentemente contraditórios, são interessantes na medida em que apontam para a relevância do background genético no qual ocorrem alterações da via de sinalização do CD40/CD40-L. É tentador especular que, na
interacção genético-ambiental adequada, polimorfismos que activem a via do CD-40 possam estar subjacentes ao risco de agregação entre auto-imunidade e linfomas.
Os modelos animais com mutações inactivantes de FAS (ratinhos lpr) ou de FAS-L (ratinhos gld), resistentes à apoptose desencadeada pela interacção FAS/FAS-L, apresentam quadros de linfoproliferação acentuada e desenvolvimento de patologia auto-imune semelhante ao LES na qual o atingimento renal causa a morte precoce dos animais (45). O facto de nestes modelos não ter sido observado desenvolvimento de linfomas pode resultar da curta expectativa de vida dos animais. Contudo, neste contexto salienta-se uma situação excepcional: os raros casos familiares de mutações germinativas de FAS (ou outros genes da sua via de sinalização como o FAS-L ou a Caspase 10) (46). Estes doentes apresentam linfoproliferação generalizada e
fenómenos auto-imunes (penetrância de 70%), fenótipo que designa a patologia: Síndrome Linfoproliferativa Auto-Imune. Nesta doença o risco de desenvolvimento linfoma em relação à população geral é de 51x para os NHL e em 14x para o HL (47). A maioria dos subtipos de NHL observados nesses doentes – DLBCL, FL, MALTL e TL – são os subtipos mais frequentemente observados em associação a patologias auto-imunes.
Dos dados resumidamente expostos poder-se-á concluir que a caracterização detalhada de alguns dos genes citados, particularmente de genes envolvidos na estimulação linfóide e de genes envolvidos na regulação da apoptose, nos doentes portadores de patologia auto-imune que desenvolvam linfomas poderá contribuir para clarificar a relação entre os dois tipos de patologia.
Por outro lado, a possibilidade de infecções víricas poderem constituir elementos desencadeadores de resposta imunológica que possibilite o desenvolvimento de patologia auto-imune é uma hipótese frequentemente admitida (42). A ubiquidade do EBV e algumas das suas propriedades patogénicas, como a possibilidade de infecção
latente, justifica que vários estudos tenham explorado um eventual papel da infecção por este vírus nas doenças auto-imunes em discussão. Também a infecção por EBV tem sido associada a alguns tipos de linfomas, em doentes imunodeficientes mas também em doentes imunocompetentes (41).
As evidências disponíveis sugestivas de alterações da situação de infecção por EBV em doentes com LES, AR e SS estão resumidas na Fig. 3 (42). Grande parte das alterações observadas podem resultar da desregulação imunológica própria das situações auto-imunes, não constituindo argumentos decisivos de um papel
patogénico da infecção. Por exemplo, no LES e na AR, foi documentada a existência de hipofunção T-CD8+ no combate a células infectados pelo EBV (42). Por outro lado, os estudos que analisaram a presença de EBV nos linfomas desenvolvidos em
doentes portadores de AR ou de LES forneceram resultados negativos, isto é, a frequência de detecção de EBV nesses linfomas é muito baixa (48). Podemos, assim, concluir que a infecção por EBV não parece ser um contributo para a associação entre doenças auto-imunes e desenvolvimento de linfomas.
II –Natureza da associação: à procura de mecanismos de linfomagénese derivados da patogénese das doenças auto-imunes
Os mecanismos patogénicos das doenças auto-imunes potencialmente envolvidos na linfomagénese podem sistematizar-se em três tipos: estado de estimulação
imunológica crónica; formação de centros germinativos ectópicos; modificação do perfil de citocinas. O papel potencial de cada um destes mecanismos será de seguida revisto e discutido.
A estimulação imunológica crónica é uma característica essencial da patogenia das doenças auto-imunes e é um estado propiciador de desenvolvimento de linfomas, evidenciado por dados epidemiológicos, por estudo das características da população linfóide ao longo da doença e por resultados em modelos experimentais.
A epidemiologia revelou que a associação ao desenvolvimento de linfomas é partilhada por um conjunto de situações de etiologia heterogénea, como são várias formas de patologia infecciosa crónica (49,50) (e.g. H. pylori; HCV) e as várias
patologias auto-imunes (6,7), situações que têm em comum um estado de persistência antigénica. Um estudo fez uma abordagem inversa a esta questão analisando a
patologia associada em indivíduos com diagnóstico de linfoma versus diagnóstico de outras neoplasias (51). Nesta casuística observou-se um excesso de patologias auto-imunes e inflamatórias crónicas nos doentes com linfomas.
Nas células B e T, a sinalização desencadeada pelos receptores antigénios (BCR e TCR, respectivamente) envolve a activação da via do NF-kB (52,53). O NF-kB promove a transcrição de numerosos genes entre os quais se contam genes favorecedores da proliferação celular (como o c-myc e a ciclina D1) e genes
favorecedores da resistência à apoptose (como genes anti-apoptóticos da família BCL-2 e IAPs) (54). Assim, o índice proliferativo elevado aumenta a probabilidade de erros genéticos e a maior resistência à apoptose permite a sobrevida de células com alterações genéticas; a manutenção deste contexto favorece a acumulação de anomalias genéticas adicionais. Os resultados obtidos em modelos animais com activação mantida do BCR e TCR revelaram incidência aumentada de linfomas (55,56).
Importa ainda salientar que a maturação das células B nos centros germinativos inclui fenómenos de hipermutação somática e de recombinação dos genes das
genes oncossupressores e assim contribuir para a geração de clones anómalos e para o desenvolvimento de populações malignas (57). A instabilidade genómica própria do centro germinativo está subjacente à maior prevalência de linfomas B periféricos de células residentes no centro germinativo ou células em fase pós-centro germinativo relativamente a outros tipos de linfoma na população geral. A circunstância de também se observar o predomínio deste tipo de linfomas no contexto de auto-imunidade (6,7) coaduna-se com a relevância da estimulação imunológica mantida enquanto factor de risco de desenvolvimento de linfomas.
Adicionalmente, vários estudos analisaram detalhadamente as populações linfóides em patologias auto-imunes, em particular no SS primário. Os resultados obtidos evidenciaram a evolução de um estado de policlonalidade, para oligoclonalidade, e mais tarde para uma população neoplásica monoclonal (58). Esta apresentava restrição marcada do uso dos genes das porções variáveis das cadeias das
imunoglobulinas e hipermutação desses segmentos, com evidência de persistência de hipermutação, a traduzir uma resposta imunológica crónica com maturação de
afinidade e selecção clonal por determinado antigénio. O quadro descrito suporta a interpretação de que, na SS, as anomalias genéticas subjacentes à transformação neoplásica ocorrem durante as reacções do centro germinativo.
Por último, foi demonstrado que a intensidade do estado inflamatório, no SS, AR e LES, está independentemente associado a maior risco de linfomas (59-61). Tal é compatível com a interpretação atrás discutida, apesar de não permitir excluir a
participação de outros factores, como a secreção aumentada de determinados tipos de citocinas (discutida adiante em mais detalhe).
Está descrita a formação de centros germinativos ectópicos em locais de inflamação crónica de várias etiologias, infecciosa ou auto-imune, nomeadamente na SS, na AR e SLE (62-65). Estas estruturas formam-se em cerca de 20-30% dos doentes com SS ou AR e são consideradas marcadoras de maior actividade inflamatória. Na SS, a
presença destes centros germinativos tem sido associada ao desenvolvimento de linfomas e alguns autores consideram que se trata de uma condição necessária ao desenvolvimento de linfomas marginais do subtipo MALT (66,67).
A expressão de AID nos centros germinativos ectópicos da SS (62) baseia a asserção de que nessas estruturas ocorrem os fenómenos típicos do centro germinativo normal. Por outro lado, a já referida caracterização populações linfóides no contexto de SS permitem afirmar a passagem dessas populações por reacções típicas dos centros germinativos. No entanto, a associação destas estruturas ectópicas com o
desenvolvimento de linfomas é menos evidente noutras doenças, como a AR. Nesta situação formam-se centros germinativos no sinovium inflamado mas não se
desenvolvem linfomas nesse local (68). Contudo, está demonstrada a existência de proliferação oligoclonal no sinovium (65), traduzindo a presença de estímulo antigénico local sustentado com selecção clonal progressiva. O facto de os linfomas que ocorrem no contexto de AR não serem, geralmente, de tipo MALT (7,68) e se apresentarem maioritariamente com atingimento nodal e extranodal (68) sugere que factores específicos da AR, provavelmente decorrentes do micro-ambiente, possam ser desfavoráveis ao desenvolvimento local de linfomas e que estes possam desenvolver-se após circulação de populações linfóides possivelmente já (parcialmente)
transformadas.
Um aspecto que merece atenção particular na SS é a presença de populações B de transição nos tecidos inflamados que são origem da população neoplásica (69,70). Este tipo de população não está descrita no sinovium da AR, mas em modelos
do sistema imune, podem aceder ao centro germinativo, o que acarreta riscos de lesões genéticas (71).
Perfil de citocinas
Numerosas citocinas com efeitos proliferativos e anti-apoptóticos estão presentes nos territórios envolvidos por doenças auto-imunes (72); as consequências desses efeitos como risco de transformação neoplásica de células linfóides já foram discutidas anteriormente. Nesta fase resumiremos apenas alguns dados recentes relativos ao aumento de BAFF e de Flt-3L nas doenças auto-imunes e suas possíveis implicações no desenvolvimento de linfomas.
À semelhança do que acontece em vários tipos de situações inflamatórias, os níveis de BAFF estão elevados na SS, na AR e no LES, quer sistemicamente quer nos locais atingidos (73-76). No SS, os níveis de BAFF correlacionam-se com os níveis de anticorpos circulantes (73,75) e o nível de organização dos infiltrados linfóides (76) e, na SS, AR e LES, correlacionam-se com o grau de inflamação sistémica (73,75). Por último, nos modelos transgénicos de BAFF, a progressão da doença pode ser
atrasada por terapêutica antagonista desta citocina (77). Estes factos suportam uma participação patogénica dos níveis elevados de BAFF nas situações de
auto-imunidade.
Os receptores do BAFF (BAFF-R, TACI. e BCMA) são expressos selectivamente consoante a fase de maturação B (54). Os BAFF-R sinalizam através do NF-kB, por activação da via canónica e da via alterna (54). As consequências da activação do NF-kB já foram referidas, nomeadamente o papel propiciador de transformação neoplásica linfóide.
Apesar da expressão transgénica de BAFF em modelos animais não se acompanhar de linfomas, animais simultaneamente transgénicos para o BAFF e knock-out para o TNFα apresentam uma incidência considerável de linfomas (78), facto não observado nos modelos TNFα -/- (79). Por outro lado, os modelos knockout de TACI
apresentaram também incidência elevada de linfomas (54).
Pensamos ser legítimo concluir que, apesar do aumento dos níveis de BAFF, per se, não conferirem risco acrescido de linfomagénese, a coexistência de alterações noutras vias de sinalização pode resultar num contexto propiciador à ocorrência de linfomas.
Por outro lado, os níveis de BAFF estão frequentemente elevados na presença de linfomas e vários os tipos de linfoma expressam BAFF-R (80,81). Um aumento da expressão de BAFF por parte de clones malignos linfóides foi correlacionado fenótipos tumorais mais agressivos (80) e a importância da secreção parácrina de BAFF em linfomas de Hodgkin (82) e a sua secreção autócrina em casos de leucemia linfóides crónicas também já foi descrita (83). Além disso, há uma correlação dos níveis de BAFF com prognóstico desfavorável e resposta insuficiente ao tratamento (80). Estes factos sugerem que a sinalização BAFF/BAFF-R é um factor promotor de linfomas.
Flt-3 e Flt-3L
Já fizemos referência à existência de células B de transição na SS. Detalhando este aspecto particular, na SS foi descrito um padrão de células B no sangue periférico caracterizado pelo aumento das células B1 e B2 e diminuição das restantes sub-populações, e pelo aumento das células B de memória nas glândulas envolvidas pela doença (69,84). Se os mecanismos de estabelecimento de tolerância central não forem eficazes, numerosas células B de transição, poli-reactivas, podem desencadear reacções auto-imunes.
Paralelamente, nos doentes com SS e AR foi demonstrado o aumento dos níveis de Flt-3L, no soro ou nos territórios envolvidos pela doença, incluindo no sinovium na AR (69,85). Os níveis elevados de Flt-3 não se correlacionam com os níveis de citocinas da família TNF nem com os níveis de BAFF correlacionando-se, no entanto, com o risco de desenvolvimento de linfomas (69). Curiosamente, os níveis de Flt-3L
correlacionaram-se, na SS, com os níveis de células B de transição e foi demonstrado que o receptor Flt-3 era selectivamente expresso nas referidas células (69). Tendo em conta que a sinalização via Flt-3 é um mecanismo de proliferação e sobrevivência importante nas fases precoces de maturação B (86), é de salientar os resultados obtidos in vitro que documentam aumento da proliferação e da sobrevivência de células B de doentes com SS quando tratadas com Flt-3 em condições de estimulação do BCR (69).
Em conjunto, os dados resumidos apontam para a importância das anomalias de populações B na patogenia da SS, na qual parece estabelecer-se um quadro de aumento/mobilização de células B potencialmente poli-reactivas, com alteração do perfil de células B periféricas, incluindo as células que infiltram os tecidos afectados, que persiste por mecanismos autócrinos ou parácrinos e que parece envolver sinalização pelo Flt-3
Embora estejam descritas anomalias da sinalização via Flt-3 em neoplasias hematológicas, estas incluem, essencialmente, leucemias mielóides agudas e
neoplasias linfóides de células imaturas (87). Por esta razão, e independentemente da relevância dos aspectos descritos na patogenia da SS, as alterações referidas não apontam directamente para as anomalias do Flt-3 enquanto elo entre doenças auto-imunes em geral, ou SS em particular, e o desenvolvimento de linfomas. No entanto, tendo em conta a forte associação entre SS e o linfoma MALT seria interessante analisar a via Flt-3 neste tipo particular de linfomas nos doentes com SS.
III – Natureza da associação: qual o papel da intervenção farmacológica? O uso do imunossupressor metotrexato e, mais recentemente, a utilização das chamadas terapias biológicas, nomeadamente os antagonistas do TNFα, têm sido discutidos na perspectiva de aumento do risco de desenvolvimento de neoplasias linfóides.
Vários tipos de dados suportam que a terapia imunossupressora possa estar envolvida na linfomagénese: 1) o aumento de linfomas associados a EBV em doentes com AR tratados com metotrexato (88); 2) a detecção de DNA vírico monoclonal nesses tumores (89) (sugerindo infecção prévia ao processo oncogénico); 3) a reversibilidade de lesões linfoproliferativas após suspensão do tratamento, o que se verifica, a maioria das vezes, para as lesões positivas para EBV (90). A terapêutica imunossupressora das doenças auto-imunes tem sido equiparada, em termos patogénicos, às situações de pós-transplante nas quais a imunossupressão iatrogénica mediada pelo
metotrexato é factor de risco para desenvolvimento de linfomas, quase sempre associados a EBV (13). Já foi referido que existe uma elevação dos marcadores víricos plasmáticos no LES e na AR; no entanto, esses níveis não são alterados pela terapêutica destas doenças auto-imunes (91). Adicionalmente, e como já referimos, a detecção de EBV nos linfomas em doentes portadores de AR ou LES é rara. Acresce, no entanto, o facto das propriedades oxidativas do metotrexato poderem desencadear lesões no DNA (92). No seu conjunto, os dados referidos constituem o suporte para a individualização das "lesões linfoproliferativas associadas a terapêutica
imunossupressora” (41) preconizado pela OMS. De momento, não existe evidência de que a agregação entre doenças auto-imunes e linfomas resulte (significativamente) da terapêutica imunossupressora (93-95). A seu tempo, o estudo de casuísticas maiores e melhor caracterizadas poderão contribuir para validar esta questão.
No passado, alguns artigos apontaram um risco acrescido de desenvolvimento de linfoma nos doentes submetidos a terapêutica antagonista do TNFα (96). No entanto, uma crítica relevante a estes resultados consistiu na ausência de correcção estatística para a actividade inflamatória que estava a ser tratada. De facto, estudos ulteriores demonstraram que os linfomas, pelo menos no contexto de AR, se associam a níveis médios e altos de inflamação, contextos em que a terapia com antagonistas de TNFα é preferencialmente utilizada (93,94). Um outro estudo mostrou que, após o ajuste estatístico, o risco de desenvolvimento de linfomas era cerca de 10x superior ao dos doentes não tratados (96) mas estes resultados não foram reproduzidos em estudos ulteriores (95). De momento, não existe evidência de que a terapêutica biológica de doenças auto-imunes acarrete risco acrescido de desenvolvimento de linfomas. No entanto, os resultados obtidos em modelos animais com ausência de TNFα em contexto de sobre-expressão de BAFF (78) que documentaram o desenvolvimento de linfomas merecem atenção particular e justificam a realização de mais estudos, com
follow-up mais longo dos doentes tratados, para clarificar a relação entre a utilização
terapêutica de antagonistas de TNFα e o desenvolvimento de linfomas. Outro aspecto da questão será avaliar se a terapêutica anti-TNFα poderá acompanhar-se de
diminuição de desenvolvimento de linfomas, tendo em conta que polimorfismos activadores do TNFα estão associados a maior risco de linfoma (24) enquanto modelos knockout de TNFα não documentam ocorrência de linfomas, mesmo em modelos deficientes em p53 (79).
IMUNODEFICIÊNCIA E LINFOMAGÉNESE
A Imunodeficiência Adquirida por infecção pelo vírus HIV é uma situação muito prevalente e está desde há muito inequivocamente associada ao desenvolvimento de linfomas. Actualmente, essa associação não pode deixar de ser abordada em dois registos temporais: uma era pré-tratamento anti-retroviral que cumpre a história natural da infecção e do respectivo declínio imunitário, na qual o risco global de
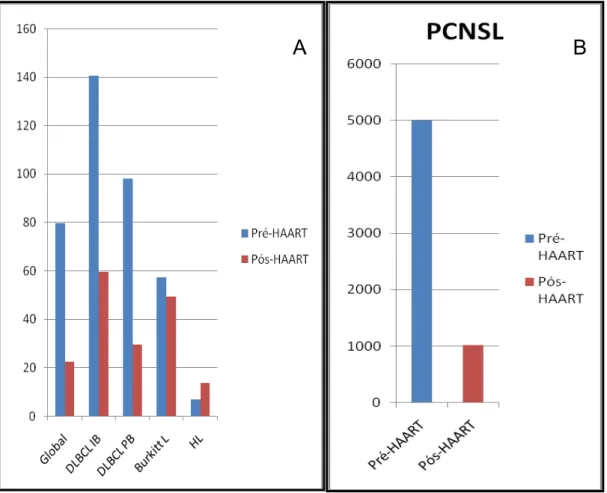
desenvolvimento de linfomas era de 80x o risco da população normal, e uma era pós-tratamento em que o risco global de desenvolvimento de linfomas diminuiu
significativamente, para cerca de 20x o risco da população não infectada (10) (Fig. 4). O risco linfomagénico que a infecção por HIV acarreta é largamente superior ao risco associado às doenças auto-imunes previamente discutidas, mesmo após a introdução da terapêutica (HAART). Contudo, é de notar que a diminuição global pós-HAART decorreu, essencialmente, à custa da diminuição do Linfoma Primário do Sistema Nervoso Central (PCNSL) e do DLBCL. Curiosamente, a diminuição de risco de desenvolvimento de LB foi apenas marginal e o risco de LH parece ter aumentado na sequência da terapêutica.
Apesar das conquistas resultantes da terapia anti-retrovírica, os doentes de HIV continuam a ter um risco de desenvolverem alguns tipos de linfoma cerca de 60x superior ao da população geral (10). Adicionalmente, deve notar-se que a infecção por HIV apresenta um risco de desenvolvimento de linfoma várias vezes superior ao estado de imunossupressão iatrogénica, enquanto os dois tipos de situação têm riscos semelhantes de desenvolvimento de outras neoplasias, o que levanta a possibilidade de outros mecanismos de génese/promoção de linfomas poderem ocorrer nestes doentes.
Em conjunto, os dados epidemiológicos referidos são compatíveis com as seguintes interpretações, não mutuamente exclusivas: a) as consequências da infecção por HIV
ou os mecanismos patogénicos da doença associados ao risco de linfomagénese não são totalmente antagonizadas pela terapêutica;b) no momento da instituição da terapêutica já se geraram eventos irreversíveis que comportam risco linfomagénico; c) a imunossupresão não é o único mecanismo linfomagénico associado à infecção por HIV. Esta última hipótese é apoiada por diversos dados adicionais, tais como: os diferentes valores de risco para cada subtipo de linfoma; as associações de cada subtipo a diferentes níveis de CD4+ (97); a heterogeneidade na variação do risco para cada subtipo de linfoma após a implementação da HAART; o aumento da incidência de linfomas Hodgkin na era pós-HAART.
Diversos estudos têm tentado esclarecer quais os mecanismos conferidores de risco oncogénico geral, e linfomagénico particular, na infecção por HIV. Os diferentes mecanismos discutidos são genericamente sistematizáveis em: a) perda de vigilância imunológica; b) descontrolo das fases de latência/replicação de vírus potencialmente oncogénicos; c) estimulação crónica de populações B; d) alteração do perfil de
citocinas; e) acção promotora tumoral de macrófagos infectados por HIV. De seguida, resumiremos a participação de cada um dos mecanismos enunciados.
Perda de vigilância imunológica ao desenvolvimento neoplásico
Para além da perda progressiva das células T CD4+ (98), a patogénese da infecção por HV inclui a afecção de vários outros constituintes do sistema imunológico, no seu número e/ou função. Essas alterações incluem a perda de capacidade citolítica pelas células NK (99) e resistência à activação pelas células CD8+ (100). Cada um destes tipos celulares parece ser importante na acção imunológica contra clones aberrantes emergentes e/ou no combate a populações neoplásicas estabelecidas. Esta afirmação baseia-se em aspectos próprios de patologias em que existe um atingimento selectivo de população celulares imunes e tem suporte adicional em resultados obtidos em modelos experimentais.
Na doença de Chediak-Higashi, em que existe uma perturbação funcional no sistema imune que é selectiva para as células NK, assiste-se a uma proliferação linfocitária atípica (“linfo-histiocitose”) em 85% destes doentes (101). Consistente com o papel anti-tumoral das células NK, modelos knockout de NKG2D, um ligando fundamental à activação destas células, apresentam um fenótipo também caracterizado por
incidência aumentada de vários tipos de cancro, nomeadamente de linfomas (102).
A síndrome de DiGeorge, com aplasia ou agenesia tímica e consequente diminuição do número e da função T (CD4+, CD8+ e NKT) (103) constitui também um bom exemplo em favor da relevância da função anti-tumoral das populações T normais. Também nestes doentes se observa uma incidência aumentada de linfomas e outras neoplasias (103). Em modelos animais knockout para as moléculas JNK, perforina ou INFy, fundamentais às funções CD8+, observam-se fenótipos semelhantes à S. de DiGeorge no que se refere à ocorrência de neoplasias (104,105), salientando a importância desta população na evicção da sobrevivência de células que adquiriram algum tipo de anomalia mutacional.
Por outro lado, a importância das células CD4+ na expansão de células T citotóxicas e na cooperação com células NKT na citotoxicidade directa contra clones malignos, foi considerada crucial para a rejeição tumoral (106,107).
Em conclusão, parece indiscutível que as anomalias das diferentes populações linfóides decorrentes da infecção por HIV resultem num estado de deficiente
imunidade anti-tumoral que inclui o risco acrescido de desenvolvimento de linfomas.
Desregulação da latência/replicação vírica
Os vírus EBV e HHV8 são vírus de DNA da família dos herpes-vírus, capazes de estabelecer infecção latente no organismo humano (108). O estado de latência pode
alternar com períodos de replicação vírica, estes responsáveis pela lise celular. A percentagem de adultos portadores de EBV estima-se em 90-95% (109), enquanto a prevalência de infecção pelo HHV8 varia amplamente, entre 1% e 60%, em função da localização geográfica e de padrões comportamentais dos indivíduos (110,111). A resposta imunológica normal à infecção primária é melhor conhecida para o EBV, mas admite-se que a resposta ao HHV8 será semelhante. In vivo, os linfócitos B infectados por EBV são eliminados pelas células NK e pelos linfócitos T citotóxicos (112). Esta resposta inicial não elimina todos os linfócitos infectados, e células B de memória permanecem num estado de infecção latente caracterizado pela ausência de replicação vírica e pela expressão de um número limitado de proteínas e RNAs víricos (109,112). Contudo, o estado de latência não é um quadro homogéneo: para o EBV, a fase de latência pode corresponder a três estados distintos, descritos como fase de latência I, II e III, cada uma das quais caracterizada por um determinado conjunto de produtos víricos expressos (108). Na reactivação da infecção outras proteínas víricas passam a ser expressas e apresentadas ao sistema imune e do seu reconhecimento resulta a eliminação da célula infectada, tal como acontece durante a infecção primária (109,112). Assim, em condições fisiológicas existe uma vigilância imunológica à
reactivação da infecção vírica nas células que constituem o seu reservatório (em latência).
Na infecção por HIV, como noutros estados de imunodeficiência T, a reactivação vírica deixa de ser controlável pelo sistema imune, assistindo-se a um aumento dos
marcadores sistémicos da presença do vírus (113). A perda de capacidade de controlar a fase replicativa da infecção decorre da perda de células CD4+ e da disfunção CD8+ próprias da patogenia da infecção por HIV (112-114). Curiosamente, as células CD4+ são importantes no controle vírico não só pela interacção com células CD8+ como por propriedades citolíticas próprias em células infectadas por EBV (114); esta propriedade é uma resposta a antigénios nucleares do vírus que são de baixa
das alterações possíveis ao padrão de expressão de proteínas víricas. A
imunossupressão torna também permissiva a expressão de proteínas características da infecção latente que, em condições normais, activariam o sistema imune resultando numa resposta citotóxica à célula infectada.
As consequências biológicas da infecção vírica decorrem do tipo de proteínas expressas a partir do genoma vírico. As proteínas codificadas pelos EBV e HHV8 alteram os processos celulares quer por homologia funcional quer por interferência funcional com proteínas do hospedeiro. Entre os processos biológicos mais afectados contam-se a sinalização da via NFkB, a regulação das vias apoptóticas, a regulação da proliferação celular e a função de genes oncossupressores (116,117).
Nas fases de latência II e III da infecção por EBV é expressa a proteína vírica LMP-1, análogo funcional do CD40, que causa activação das células B pelo recrutamento da via do NF-kB (108,116). Nas fases de latência e nas fases replicativas do HHV8 é expressa a proteína v-Flip análoga da c-Flip humana, do que resulta bloqueio da via extrínseca da apoptose (108,116); adicionalmente, a interacção da v-Flip com a molécula adaptadora TRAF2 condiciona a activação do NF-kB, quer pela via canónica quer pela via alterna (108,116,117). Como já foi referido, a activação da via do NF-kB resulta no aumento da transcrição génica com consequências no aumento da
proliferação celular e na maior resistência à apoptose, situações potencialmente favorecedoras da transformação neoplásica.
Numa análise global, 60% dos linfomas que ocorrem nos doentes HIV são EBV-positivos (13). No entanto, esta prevalência não é idêntica nos vários subtipos de linfomas neste contexto. Contrastando com este dado, a presença do vírus HHV8 está restrita ao “linfoma do tipo derrame pleural” (PEL), no qual ocorre em 100% dos casos (13,117). A Fig.5 resume a prevalência de infecção por estes vírus nos diferentes subtipo neoplásicos. Estes dados sugerem um papel particular da infecção por EBV em alguns tipos de linfomas, como é o caso do HL, mas sobretudo em tipos de
linfomas particularmente raros nos imunocompetentes, como é o caso do PCNSL e do PEL (neste último caso em co-infecção por HHV8). Explicações potenciais para estes factos residem nas diferentes proteínas víricas expressas nos diferentes subtipos de neoplasias.
A proteína vírica LMP-1 é frequentemente expressa nos DLBCL, grupo que inclui o PCNSL e o PEL (118). A ausência de expressão desta proteína, por silenciamento génico, em linhas celulares derivadas de DLBCL que ocorreram em doentes
infectados por HIV causa apoptose, evidenciando o papel da LMP -1 na sobrevivência da população neoplásica (119). Adicionalmente, modelos animais transgénicos para LMP-1 desenvolvem frequentemente linfomas (120).
Nos linfomas de Burkitt dos doentes infectados por HIV, a proteína LMP-1 está ausente, sendo expressa a proteína EBNA-1 (121); foi demonstrado que a EBNA-1 pode cooperar com o c-myc, favorecendo o seu potencial oncogénico (122).Outras proteínas víricas, como o BALF1 e o BHRF1 são expressas em alguns destes linfomas(123); estas proteínas são necessárias à imortalização in vitro das células B (124) pelo que se admite a possibilidade de terem um papel protector, in vivo, ao estado pró-apoptótico induzido pela activação constitucional do c-myc.
Nos HL são expressas as proteínas virais EBNA-1, LMP-1 e LMP-2 (124).
Curiosamente, foi demonstrado que a LMP-2 favorece a sobrevivência e proliferação de células B sem um BCR funcionante, como é o caso das células de Sternberg-Reed (RS) (125). Por outro lado, nas células RS a LMP-1 causa sobre-expressão da
proteína BMI-1, proteína associada ao desenvolvimento de linfomas em modelos transgénicos (126).
Relativamente ao papel patogénico do HHV8 no PEL (e na sua variante sólida OPL) os estudos efectuados são sobreponíveis aos sumariamente descritos para o EBV. Foi demonstrada a expressão de proteínas de latência deste vírus, como a LANA, a vcyc,
a vFLIP e a vIL-6, nos clones PEL (127-129). O silenciamento experimental do vFLIP, a inibição do NF-kB, ou o silenciamento do vcyc conduzem ao aumento da apoptose nas células tumorais (130,131). Em contrapartida, modelos animais transgénicos de v-FLIP desenvolvem frequentemente linfomas (132). A formação do complexo
LANA/P53/MDM2, estabilizado pelo LANA e inactivador da P53, confere resistência à apoptose de linhas celulares de PEL infectadas pelo HHV8 (133). Por último, foi demonstrado que a proteína vIL-6, expressa em alguns PEL, constitui um factor autócrino em linhas celulares de PEL (134).
Estimulação crónica das células B
A infecção por HIV é, em si mesma, um factor de estimulação e activação dos linfócitos B mediada, essencialmente, por três mecanismos (135-137): a) na
exteriorização de partículas víricas o CD40-L é translocado para a superfície vírica do que decorre a estimulação B através do CD40; b) as partículas víricas podem ligar-se ao complemento; c) os macrófagos infectados pelo HIV produzem citocinas (IL-6, IL-10 e TNFα) que promovem a sobrevivência e a proliferação B.
De facto, vários marcadores da hiperactivação linfóide B, como a elevação dos níveis de AID, CD30, CD27 e de IL-6 e IL-10, correlacionam-se com o risco de
desenvolvimento de linfomas nos doentes infectados por HIV (138-141).
Adicionalmente, estes valores são apenas parcialmente revertidos pela terapêutica (142) o que reforça a importância da hiperestimulação B como mecanismo de risco de transformação neoplásica, como já foi discutido a propósito das doenças auto-imunes.
A análise molecular dos linfomas desenvolvidos no contexto de imunodeficiência por HIV documentou a existência, em todos os sub-tipos de NHL, de hipermutação somática aberrante, bem como translocações frequentes dos genes c-myc e Bcl-6
(nos LB e DLBCL, respectivamente) (143-145). Estes resultados salientam a
importância da passagem dos linfócitos B por reacções do centro germinativo como evento de risco linfomagénico, potenciado por um contexto de estimulação crónica que ocorre na infecção por HIV. Recentemente, foi descrito que as células CD4+ têm um papel na protecção genética, decorrente da activação processos de reparação do DNA, durante a reacção do centro germinativo (146); assim, a perda funcional CD4+ na infecção por HIV pode potenciar a geração/persistência de lesões genéticas durante as reacções do centro germinativo.
A participação dos macrófagos
Os macrófagos infectados pelo HIV constituem o seu reservatório e transcrevem proteínas víricas (e.g. Tat e Nef) capazes de modular as suas funções biológicas intrínsecas (137). Adicionalmente, proteínas virais em circulação, como a gp120, são inductoras de vias de sinalização nas células macrofágicas. A disfunção macrofágica causada pela infecção HIV, irreversível pela HAART, exprime-se na diminuição da capacidade de apresentação antigénica e de secreção de IL-12, e no aumento da produção de TNFα, IL-10 e IL-6 (137,147).
Recentemente, os macrófagos dos infiltrados inflamatórios que se observam em territórios de desenvolvimento neoplásico, chamados “tumor associated macrophages (TAMs)”, têm sido alvo de numerosos estudos. Em diferentes tipos de neoplasias malignas foi constatado que a abundância de infiltrado inflamatório se associa a prognóstico desfavorável pelo que a interpretação de que o infiltrado traduzia resposta imunológica à neoplasia foi substituída pela proposta de que o infiltrado inflamatório fornece um ambiente favorável ao desenvolvimento e progressão neoplásicos, nomeadamente através da acção dos macrófagos (148-150). Foi amplamente demonstrado que os TAMs contribuem para um maior crescimento tumoral, para a angiogénese, a invasão e a metastização (149,150). Também em alguns tipos de
linfoma, nomeadamente HL e BL, foi demonstrada a acção promotora neoplásica dos TAM, mediada pela secreção de factores anti-apoptóticos como o BAFF (151,152) e, em séries de HL e de FL (152,153), a quantidade de TAM associou-se a prognóstico desvaforável.
No que se refere ao papel dos TAMs no contexto de linfomas desenvolvidos em portadores de HIV é importante salientar que cerca de 50% desses linfomas contêm TAMs infectados por HIV e que esta situação é transversal aos vários tipos
histológicos (154). Em modelos animais, a transferência de TAMs infectados para ratinhos SCID originou linfomas agressivos nos hospedeiros, ao contrário do que se observou para macrófagos não infectados provenientes dos mesmos doentes (155). Recentemente, com recurso a técnicas imagiológicas sofisticadas, foi possível observar a formação de microtúbulos a partir de macrófagos que estabelecem comunicação com linfócitos B. Foi posteriormente demonstrado que a proteína Nef pode ser translocada dos macrófagos para linfócitos B (156) o que permite postular que factores biologicamente activos do HIV podem interferir de forma muito mais vasta do que previamente se considerava na biologia das células B, para as quais o vírus não tem tropismo. A investigação actual das propriedades da Nef e, eventualmente, de outras moléculas víricas translocadas para as célula B, por acção parácrina dos
macrófagos, na emergência e/ou promoção de clones malignos é uma área muito activa. Assim, para além de serem alvo de terapêutica de erradicação do HIV, os macrófagos podem vir a constituir um alvo terapêutico na prevenção e/ou tratamento de linfomas nestes doentes.
O papel de citocinas
Já nos referimos ao mecanismo subjacente ao aumento das citocinas IL-6, IL-10 e TNFα e ao facto dos níveis destas citocinas se correlacionarem com o risco de
desenvolvimento de linfomas nos doentes com HIV. Também já nos referimos ao papel destas citocinas na proliferação e activação das células B e às suas
consequências em termos de risco de transformação neoplásica. Assim, resta-nos mencionar, brevemente, que a expressão de outras citocinas estimuladoras da actividade B, como a CCR5, a SDF-1 (CXCL12) e a BAFF também está aumentada em doentes portadores de HIV (139,157). Em particular convém notar que, neste contexto, a BAFF actua em conjunto com a proteína Env do vírus na activação das células B com indução de reacções típicas dos centros germinativos (158). Por último, a quase sistemática co-existência de infecção por EBV permite a interacção da LMP-1 com a BAFF na estimulação B (159).
CONCLUSÕES GERAIS E PERSPECTIVAS
Procedemos à revisão da literatura sobre SS, AR e LES e sobre a Imunodeficiência Adquirida por infecção HIV com o objectivo de identificar mecanismos subjacentes ao risco de desenvolvimento de neoplasias linfóides, em cada grupo de situações de disfunção imunológica e eventualmente partilhados entre os dois grupos. Dos aspectos apresentados e discutidos podemos concluir:
I- Há evidência epidemiológica para a existência de factores de
susceptibilidade individual partilhados para o desenvolvimento de auto-imunidade e linfomas. Entre os factores descritos, os polimorfismos de várias cotocinas (IL-2, IL-10 e IL-21) de TNFα e de CD40, e de reguladores da apoptose (CD95/CD95-L e NF-kB) são particularmente interessantes podendo justificar estudos adicionais;
II- Não há evidência de que a infecção por EBV tenha um papel relevante quer na patogenia das doenças auto-imunes quer no desenvolvimento de linfomas nos doentes portadores dessas patologias;
III- A estimulação crónica de células B e a persistência de um perfil de citocinas com actividades pró-proliferativas e anti-apoptóticas constituem condições favoráveis à transformação neoplásica de populações linfóides, particularmente susceptíveis durante a fase de maturação no centro
germinativo. Estes fenómenos, presentes nas situações de auto-imunidade e na imunodeficiência por HIV, são componentes da agregação entre os estados de disfunção imunológica e o desenvolvimento de linfomas; IV- Nas situações de imunodeficiência, a perda de eficácia da vigilância
imunológica, ao desenvolvimento de populações neoplásicas e ao controlo de infecções víricas por EBV e HVV8, é um factor indiscutível de
linfomagénese. Este facto está subjacente ao maior risco de
desenvolvimento de linfomas na imunodeficiência adquirida relativamente às situações de auto-imunidade;
V- Não há actualmente evidência suficiente para implicar um papel das
medidas terapêuticas (imunossupressoras ou biológicas) na associação de situações de auto-imunidade com o desenvolvimento de linfomas. No entanto, estudos adicionais contribuirão certamente para clarificar esta questão;
VI- A terapêutica da imunodeficiência por HIV com o regime HAART reduziu drásticamente, mas selectivamente, o risco de linfomas. As bases desse efeito selectivo não são ainda conhecidas;
VII- O papel dos macrófagos, em locais cronicamente inflamados ou infectados pelo HIV, no favorecimento de um micro-ambiente propício ao
desenvolvimento neoplásico é uma evidência recente cuja exploração futura pode contribuir para reformular aspectos da linfomagénese no contexto de disfunção imunológica.
Referências Bibliográficas
1 - Kindt, Goldsby, Osborne. Kuby Immunology.6th edition. Paperback, W.H.Freeman &
Co Ltd, 2006.
2 - Kassan SS, Thomas TL, Moutsopoulos HM, Hoover R, Kimberly RP, Budman DR, et al. Increased risk of lymphoma in sicca syndrome. Ann Intern Med 1978;89:888–92. 3 - Holm L, Blomgren H, Lowhagen T. Cancer risks in patients with chronic lymphocytic thyroiditis. N Engl J Med; 1985;312:601–604.
4 - Lutterbeck PM. Post-transplantation malignancy. N Engl J Med.1969;25;281:739.
5 - Ziegler JL, Beckstead JA, Volberding PA, Abrams DI, Levine AM, Lukes RJ, et al. Non-Hodgkin's Lymphoma in 90 Homosexual Men - Relation to Generalized
Lymphadenopathy and the Acquired Immunodeficiency Syndrome. N Engl J Med 1984;311:565-70.
6 - Ansell P, Simpson J, Lightfoot T, Smith A, Kane E, Howell D, et al. Non-Hodgkin lymphoma and autoimmunity: does gender matter? Int J Cancer;2010: 000;00-000. 7 - Anderson LA, Gadalla S, Morton LM, Landgren O, Pfeiffer R, Warren JL, et al. Population-based study of autoimmune conditions and the risk of specific lymphoid malignancies. Int J Cancer. 2009 July 15;125:398-405.
8 - Vajdic CM, Falster MO, de Sanjose S, Martínez-Maza O, Becker N, Bracci PM, et al. Atopic disease and risk of non-Hodgkin lymphoma: an InterLymph pooled analysis. Cancer Res 2009;15;69:6482-9.
9 - Cooper GS, Bynum ML, Somers EC. Recent insights in the epidemiology of
autoimmune diseases: improved prevalence estimates and understanding of clustering of diseases. J Autoimmun 2009;33:197-207.
10 - Engels EA, Pfeiffer RM, Goedert JJ, Virgo P, McNeel TS, Scoppa SM,, et al. Trends in cancer risk among people with AIDS in the United States 1980-2002. AIDS 2006;20:1645-54
11 - Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunossupressed transplant recipients: a meta-analysis. Lancet 2007;370:59-67.
12 - Biggar RJ, Chatuverdi AK, Goedert JJ, Engels EA. AIDS-related cancer and severity of immunossupression in persons with AIDS. J Natl Cancer Inst 2007;99:962-72.
13 - Tran H, Nourse J, Hall S, Green M, Griffiths L, Gandhi MK. Immunodeficiency-associated lymphomas. Blood 2008;22:261-81.
14 - Gérard L, Meignin V, Galicier L, Fieschi C, Leturque N, Piketty C, et al. Characteristics of non-Hodgkin lymphoma arising in HIV-infected patients with suppressed HIV replication. AIDS 2009;13;23:2301-8.
15 - Fox RI. Sjögren´s Syndrome. Lancet 2005;366:321–31.
16 - D'Cruz DP, Khamashta MA, Hughes GR. Systemic Lupus Erithematosus. Lancet 2007;369:587-96.
17 - Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis. Lancet 2010;376:1094-108.
18 - Somers EC, Thomas SL, Smeeth L, Hall AJ. Autoimmune Diseases Co-occurring Within Individuals and Within Families: A Systematic Review. Epidemiology
2006;17:202-17.
19 - Conde L, Bracci PM, Halperin E, Skibola CF. A search for overlapping susceptibility loci between non-Hodgkin lymphoma and autoimmune diseases. Genomics 2011. doi: 10.1016/j.ygeno 2011.03.007.
20 - Flesher DL, Sun X, Behrens TW, Graham RR, Criswell LA. Recent advances in the genetics of systemic lupus erythematosus. Expert Rev Clin Immunol 2010;6:461-79.
21 - Cobb BL, Lessard CJ, Harley JB, Moser KL. Genes and Sjögren´s Syndrome. Rheum Dis North Am 2008;34:847-68.
22 - Wang SS, Nieters A. Unraveling the interactions between environmental factors and genetic polymorphisms in non-Hodgkin lymphoma risk. Expert Rev Anticancer Ther 2010;10:403-13.
23 - Wang SS, Purdue MP, Cerhan JR, Zheng T, Menashe I, Armstrong BK, et al. Common Gene Variants in the Tumor Necrosis Factor (TNF) and TNF Receptor Superfamilies and NF-kB Transcription Factors and Non-Hodgkin Lymphoma Risk. PLoS ONE 2009;4;e5360.
24 - Morton LM, Purdue MP, Zheng T, Wang SS, Armstrong B, Zhang Y, et al. Risk of Non–Hodgkin Lymphoma Associated with Germline Variation in Genes that Regulate the Cell Cycle, Apoptosis, and Lymphocyte Development. Cancer Epidemiol
Biomarkers Prev 2009;18:1259–70.
25 - Lan Q, Morton LM, Armstrong B, Hartge P, Menashe I, Zheng T, et al. Genetic variation in caspase genes and risk of non-Hodgkin lymphoma: a pooled analysis of 3 population-based case-control studies. Blood. 2009;9;114:264-7.
26 - Cerhan JR, Novak AJ, Fredericksen ZS, Wang AH, Liebow M, Call TG, et al. Risk of non-Hodgkin lymphoma in association with germline variation in complement genes. Br J Haematol 2009;145:614-23.
27 - Nieters A, Bracci PM, de Sanjosé S, Becker N, Maynadié M, Benavente Y, et al. A functional TNFRSF5 polymorphism and risk of non-Hodgkin lymphoma, a pooled analysis. Int J Cancer 2011;15;128:1481-5.
28 - Maiti AK, Kim-Howard X, Viswanathan P, Guillén L, Rojas-Villarraga A, Deshmukh H, et al. Confirmation of an association between rs6822844 at the Il2-Il21 region and multiple autoimmune diseases: evidence of a general susceptibility locus. Arthritis Rheum 2010;62:323-9.
29 - López P, Gutiérrez C, Suárez A. IL-10 and TNFalpha genotypes in SLE. J Biomed Biotechnol 2010;2010:838390.
30 - Kim K, Cho SK, Sestak A, Namjou B, Kang C, Bae SC. Interferon-gamma gene polymorphisms associated with susceptibility to systemic lupus erythematosus. Ann Rheum Dis 2010;69:1247-50.
31 - Chadha S, Miller K, Farwell L, Lightstone LB, Daly MJ, Rioux JD, et al. Haplotype structure of TNFRSF5-TNFSF5 (CD40-CD40L) and association analysis in systemic lupus erythematosus. Eur J Human Genet 2005;13:669-76.
32 - Arasteh JM, Sarvestani EK, Aflaki E, Amirghofran Z. Fas gene polymorphisms in systemic lupus erythematosus and serum levels of some apoptosis-related molecules. Immunol Invest 2010;39:27-38.
33 - Sullivan KE, Jawad AF, Piliero LM, Kim N, Luan X, Goldman D, et al. Analysis of polymorphisms affecting immune complex handling in systemic lupus erythematosus. Rheumatology 2003;42:446-52.
34 - Kelley JM, Edberg JC, Kimberly RP. Pathways: Strategies for Susceptibility Genes in SLE. Autoimmun Rev 2010;9:473–76.
35 - Ying B, Shi Y, Pan X, Song X, Huang Z, Niu Q, et al. Association of polymorphism in the human IL-10 and IL-18 genes with rheumatoid arthritis. Mol Biol Rep
36 - Plant D, Flynn E, Mbarek H, Dieudé P, Cornelis F, Arlestig L, et al. Investigation of potential non-HLA rheumatoid arthritis susceptibility loci in a European cohort
increases the evidence for nine markers. Ann Rheum Dis 2010;69:1548-53.
37 - Gregersen PK, Amos CI, Lee AT, Lu Y, Remmers EF, Kastner DL, et al. REL, encoding a member of the NF-kappaB family of transcription factors, is a newly defined risk locus for rheumatoid arthritis. Nat Genet. 2009;41:820-3.
38 - García-Lozano JR, Torres B, Fernández O, Orozco G, Alvarez-Márquez A, García A, et al. Caspase 7 influences susceptibility to rheumatoid arthritis. J Rheumatology. 2007 Aug;46:1243-7.
39 - Plenge RM, et al. TRAF1-C5 as a risk locus for rheumatoid arthritis--a genomewide study. N Engl J Med 2007;20;357:1199-209.
40 -. Baris D, Hoar Zahm S. Epidemiology of lymphomas. Curr Opin Oncol 2000;12:383–94.
41 - Swerdlow, SH, Campo, E, Harris, NL, et al. (Eds). World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues, IARC Press, Lyon 2008.
42 - Toussirot E, Roudier J. Epstein Barr virus in autoimmune diseases. Best Practice & Research Clinical Rheumatology 2008;l 22;5:883-896.
43 - Sacco MG, Ungari M, Catò EM, Villa A, Strina D, Notarangelo LD, et al. Lymphoid abnormalities in CD40 ligand transgenic mice suggest the need for tight regulation in gene therapy approaches to hyper immunoglobulin M (IgM) syndrome. Cancer Gene Therapy 2000;7:1299–306.
44 - Higuchi T, Aiba Y, Nomura T, Matsuda J, Mochida K, Suzuki M, et al. Cutting edge: Ectopic Expression of CD40 Ligand on B cells Induces Lupus-Like Auto-Immune Disease. J Exp Med 2011;3;194:615-28.
45 - Cohen, PL, and Eisenberg RA. Lpr and gld: single gene models of systemic autoimmunity and lymphoproliferative disease. Annu Rev Immunol 1991;9:243–69.
46 - Teachey DT, Seif AE, Grupp SA. Advances in the management and understanding of autoimmune lymphoproliferative syndrome (ALPS). British Journal of Haematology 2010;148:205-16.
47 - Straus SE, Jaffe ES, Puck JM, Dale JK, Elkon KB, Rösen-Wolff A, et al. The development of lymphomas in families with autoimmune lymphoproliferative syndrome with germline Fas mutations and defective lymphocyte apoptosis. Blood 2001;98:194-200.
48 - Kojima M, Itoh H, Shimizu K, Saruki N, Murayama K, Higuchi K, et al. Malignant lymphoma in patients with systemic rheumatic disease (rheumatoid arthritis, systemic lupus erythematosus, systemic sclerosis and dermatomyositis): a clinicopathologic study of 24 Japanese cases. Int J Surg Pathol. 2006;14:43-8.
49 - Suarez F, Lortholary O, Hermine O, Lecuit M. Infection-associated lymphomas derived from marginal zone B cells: a model of antigen-driven lymphoproliferation. Blood 2006;15;107:3034-44.
50 - Sagaert X, Van Cutsem E, De Hertogh G, Geboes K, Tousseyn T. Gastric MALT lymphoma: a model of chronic inflammation-induced tumor development. Nat Rev Gastroenterol. Heptol 2010;7:336-46.
51 - van de Schans SA, van Spronsen DJ, Hooijkaas H, Janssen-Heijnen ML,
Coebergh JW. Excess of autoimmune and chronic inflammatory disorders in patients with lymphoma compared with all cancer patients: a cancer registry-based analysis in the south of the Netherlands. Autoimmunity Reviews 2011;10:228-34.
52 - Weil R, Israel A. Deciphering the pathway from the TCR to NF-kappaB. Cell Death Differ 2006;13:826-33.
53 - Dal Porto JM, Gauld SB, Merrell KT, Mills D, Pugh-Bernard AE, Cambier J. B cell antigen receptor signaling 101. Molecular Immunology 2004;41:599-613.
54 - Fabienne Mackay and Pascal Schneider. Cracking the BAFF code. Nature Immunology 2009;9:491-502.
55 - Refaeli Y, Young RM, Turner BC, Duda J, Field KA, Bishop JM. The B cell Antigen Receptor and Overexpression of Myc Can cooperate in the genesis of B cell
lymphomas. PLoS Biol 2008;6:152.
56 - Serwold T, Hochedlinger K, Swindle J, Hedgpeth J, Jaenisch R, Weissman IL. T-cell receptor-driven lymphomagenesis in mice derived from a reprogrammed T T-cell. Proc Natl Acad Sci U S A2010;2;107:18939-43.
57- Pasqualucci L, Bhagat G, Jankovic M, Compagno M, Smith P, Muramatsu M, et al. AID is required for germinal center-derived lymphomagenesis. Nat Genet 2008;40:108-12.
58 - Dong L, Masaki Y, Takegami T, Jin ZX, Huang CR, Fukushima T, et al. Clonality analysis of lymphoproliferative disorders in patients with Sjögren’s syndrome. Clinical and Experimental Immunology 2007;150:279–84.
59 - Baecklund E, Ekbom A, Sparén P, Feltelius N, Klareskog L. Disease activity and risk of lymphoma in patients with rheumatoid arthritis: nested case-control study. BMJ1998;18;317:180-1.
60 - Bernatsky S, Ramsey-Goldman R, Rajan R, Boivin JF, Joseph L, Lachance S, et al. Non-Hodgkin's lymphoma in systemic lupus erythematosus. Ann Rheum Dis 2005;64:1507-9.
61 - Baimpa E, Dahabreh IJ, Voulgarelis M, Moutsopoulos HM. Hematologic Manifestations and Predictors of Lymphoma Development in Primary Sjögren`s Syndrome Clinical and Pathophysiologic Aspects. Medicine 2009;88:284-93.
62 - Le Pottier L, Devauchelle V, Fautrel A, Daridon C, Saraux A, Youinou P, et al. Ectopic Germinal Centers Are Rare in Sjögren´s syndrome salivary glands and do not exclude autoreactive b cells. J Immunol 2009;182;3540-47.
63 - Takemura S, Braun A, Crowson C, Kurtin PJ, Cofield RH, O'Fallon WM, et al. Lymphoid neogenesis in rheumatoid synovitis. J Immunol 2001;167:1072–80.
64 - Chang A, Henderson SG, Brandt D, Liu N, Guttikonda R, Hsieh C, et al. In situ B cell-mediated immune responses and tubulointerstitial inflammation in human lupus nephritis. J Immunol 2011;1;186:1849-60.
65 - Weyand CM, Seyler TM, Goronzy JJ. B cells in rheumatoid arthritis. Arthritis Res 2000;2:126-31.
66 - Christodoulou MI, Kapsogeorgou EK, Moutsopoulos HM. Characteristics of the minor salivary gland infiltrates in Sjögren's syndrome. J Autoimmun 2010;34:400-7.
67 - Bombardieri M, Barone F, Humby F, Kelly S, McGurk M, Morgan P, et al. Activation-induced cytidine deaminase expression in follicular dendritic cell networks and interfollicular large B cells supports functionality of ectopic lymphoid neogenesis in
autoimmune sialoadenitis and MALT lymphoma in Sjögren's syndrome. J Immunol 2007;1;179:4929-38.
68 - Baecklund E, Sundström C, Ekbom A, Catrina AI, Biberfeld P, Feltelius N, et al. Lymphoma Subtypes in Patients With Rheumatoid Arthritis: increased proportion of diffuse large B cell lymphoma. Arthritis and Rheumatism 2003;48;6:1543–50.
69 - Tobón GJ, Renaudineau Y, Hillion S, Cornec D, Devauchelle-Pensec V, Youinou P, et al. The Fms-like Tyrosine Kinase 3 Ligand, a Mediator of B cell survival, is also a marker of lymphoma in Primary Sjogren`s Syndrome. Arthritis and Rheumatism 2010;62;11:3447-56.
70 - Royer BD, Cazals-HatemJ, Sibilila F, Agbalika JM, Cayuela T, Sossi F, et al. Lymphomas in patients with Sjögren's syndrome are marginal zone B cell neoplasms, arise in diverse extranodal and nodal sites, and are not associated with viruses. Blood 1997;90:766–75.
71 - Zhou Z, Niu H, Zheng YY, Morel L. Autoreactive marginal zone B cells enter the follicles and interact with CD4+ T cells in lupus-prone mice. BMC Immunol
2011;20;12:7.
72 - Kunz M, Ibrahim SM. Cytokines and Cytokine Profiles in Human Autoimmune Diseases and Animal Models of Autoimmunity. Mediators of inflammation
2009;2009:979258.
73 - Vadacca M, Margiotta D, Sambataro D, Buzzulini F, Lo Vullo M, Rigon A, et al. BAFF/APRIL pathway in Sjögren syndrome and systemic lupus
erythematosus: relationship with chronic inflammation and disease activity. Reumatismo 2010;62:259-65.
74 - Gottenberg JE, Miceli-Richard C, Ducot B, Goupille P, Combe B, Mariette X, et al. Markers of B-lymphocyte activation are elevated in patients with early rheumatoid