I
Estudo da esterificação do bagaço de cana-de-açúcar com os
anidridos ftálico e trimelítico: aplicação na remoção de Co (II),
Cu (II) e Ni (II) em soluções aquosas idealmente contaminadas
II
Stela Nhandeyara do Carmo Ramos
Estudo da esterificação do bagaço de cana-de-açúcar com os
anidridos ftálico e trimelítico: aplicação na remoção de Co (II),
Cu (II) e Ni (II) em soluções aquosas idealmente contaminadas
Dissertação de mestrado apresentada ao Programa de Pós-Graduação em Engenharia Ambiental da Universidade Federal de Ouro Preto, como requisito parcial à obtenção do título de Mestre em Engenharia Ambiental.
Orientador: Leandro Vinícius Alves Gurgel
III
Catalogação: www.sisbin.ufop.br
R175e Ramos, Stela Nhandeyara do Carmo.
Estudo da esterificação do bagaco de cana-de-açúcar com os anidridos ftálico e trimelitico [manuscrito]: aplicação na remoção de Co(II), Cu(II) e Ni(II) em soluções aquosas idealmente contaminadas / Stela Nhandeyara do Carmo Ramos. - 2015.
125f.: il.: color; grafs; tabs.
Orientador: Prof. Dr. Leandro Vinicius Alves Gurgel.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Programa de Pós-Graduação em Engenharia Ambiental.
1. Cana-de-açucar - Derivados. 2. Esterificação (Quimica). 3. Adsorção. 4. Metais pesados. I. Gurgel, Leandro Vinicius Alves. II. Universidade Federal de Ouro Preto. III. Titulo.
V
Agradecimentos
Agradeço primeiramente à minha mãe, Zulmira, por estar sempre ao meu lado me apoiando e proferindo palavras de incentivo e amor.
Ao meu namorado, Nego, por conseguir me fazer sorrir mesmo nos momentos mais estressantes e cansativos.
Ao meu orientador, Leandro, por ter me dado a oportunidade de realizar este trabalho e pela constante disponibilidade e boa vontade para sanar minhas dúvidas. Obrigada também pela paciência demostrada nos momentos mais difíceis, nos quais
você geralmente dizia “está tudo bem Stela, esse processo é necessário para o seu crescimento como pesquisadora”.
Aos Professores Laurent Frédéric Gil e Tânia Márcia Sacramento Melo por terem me acolhido no laboratório com tanto carinho.
Gostaria de agradecer também aos amigos do Laboratório de Química Orgânica e Ambiental (LQOA) Bruno Ferreira, Luide Martins, Francine Almeida, Felipe Simões, Amália Xavier, Megg Elias, Fernanda Gonçalves, Ana Luísa, Luísa Tavares, Josilene com os quais dividi muito trabalho, assim como inúmeras alegrias e preocupações.
À aluna de iniciação científica Fabiane Carla que me ajudou a obter grande parte dos resultados referentes à síntese dos materiais.
VI Sumário
Lista de Figuras ... X Lista de tabelas ... XII Lista de abreviaturas ... XIII Resumo ... XIV Abstract ... XVI
1. Introdução... 1
2. Objetivos ... 3
2.1. Geral ... 3
2.2. Específicos ... 3
3. Revisão bibliográfica... 4
3.1. Metais pesados ... 4
3.1.1. Níquel (Ni2+) ... 6
3.1.1.1. Toxicidade ... 7
3.1.1.2. Tratamento ... 7
3.1.2. Cobalto (Co2+) ... 8
3.1.2.1. Toxicidade ... 8
3.1.3. Cobre (Cu2+) ... 9
3.1.3.1. Toxicidade ... 9
3.1.3.2. Tratamento ... 9
3.2. Combustíveis fósseis x biocombustíveis ... 10
3.3. Produção de cana-de-açúcar ... 11
3.4. Lignina ... 13
3.5. Hemiceluloses ... 15
3.6. Celulose ... 16
3.6.1. Estrutura supramolecular ... 18
3.7. Modificação química de celulose ... 20
3.7.1. Acetilação ... 21
3.7.2. Esterificação da celulose e lignocelulósicos com anidridos cíclicos de ácido carboxílico ... 22
3.7.2.1. Esterificação da celulose com anidridos ftálico e trimelítico ... 23
3.7.3. Carboximetilação ... 26
VII
3.8.1. Modelos empíricos ... 28
3.8.1.1. Modelo cinético de adsorção ... 28
3.8.1.1.1. Modelo cinético de pseudo primeira ordem ... 28
3.8.1.1.2. Modelo cinético de pseudo segunda ordem... 29
3.8.1.2. Modelos de isoterma para sistemas monocomponente ... 30
3.8.1.2.1. Isoterma de Langmuir ... 31
3.8.1.2.2. Isoterma de Freundlich ... 31
3.8.1.2.3. Isoterma de Sips ... 32
3.8.1.2.4. Isoterma de Redlich-Peterson (R-P) ... 32
3.8.1.3. Modelos de isoterma para sistemas multicomponente ... 34
3.8.1.3.1. Modelo competitivo de Langmuir não modificado ... 34
3.8.1.3.2. Modelo estendido de Langmuir modificado por Jain e Snoeyink .. 34
3.8.1.3.3. Modelo P-fator ... 35
3.8.1.3.4. Modelo de Langmuir estendido e modificado ... 35
4. Materiais e métodos ... 36
4.1. Materiais ... 36
4.2. Métodos ... 36
4.2.1. Síntese dos adsorventes ... 36
4.2.1.1. Destilação da piridina ... 36
4.2.1.2. Preparação do bagaço de cana-de-açúcar ... 36
4.2.1.2.1. Modificação química do bagaço de cana com anidrido ftálico ... 37
4.2.1.2.1.1. Estudo em função do tempo de reação ... 38
4.2.1.2.1.2. Estudo em função da quantidade de anidrido ... 38
4.2.1.2.1.3. Elaboração dos materiais modificados ... 38
4.2.1.2.2. Modificação química do bagaço de cana com anidrido trimelítico 38 4.2.1.2.2.1. Estudo em função do tempo de reação ... 39
4.2.1.2.2.2. ... Estudo em função da quantidade de anidrido 39 4.2.1.2.2.3. ... Elaboração dos materiais 39 4.2.2. Caracterização dos adsorventes ... 39
4.2.2.1. Ganho de massa ... 39
VIII
4.2.2.3. Análise Elementar de C, H e N (CHN) ... 40
4.2.2.4. Espectroscopia na região do infravermelho com transformada de Fourier (FTIR) ... 40
4.2.2.5. Determinação do ponto de carga zero (PCZ) ... 41
4.2.2.6. Análise termogravimétrica (TGA) ... 41
4.2.2.7. Microscopia eletrônica de varredura (MEV) ... 41
4.2.2.8. Espectroscopia de energia dispersiva de raio-X (EDX) ... 42
4.2.3. Experimentos de adsorção ... 42
4.2.3.1. Adsorção dos íons metálicos em BAF e BAT em função do tempo de contato (cinética) ... 42
4.2.3.2. Adsorção dos íons metálicos em função do pH ... 43
4.2.3.3. Isoterma de adsorção ... 43
4.2.3.3.1. Monocomponente ... 43
4.2.3.3.2. Multicomponente ... 44
4.2.4. Experimento de dessorção ... 44
4.2.5. Reuso do adsorvente após a dessorção ... 45
5. Resultados e discussão ... 46
5.1. Síntese e caracterização do BAF e BAT ... 46
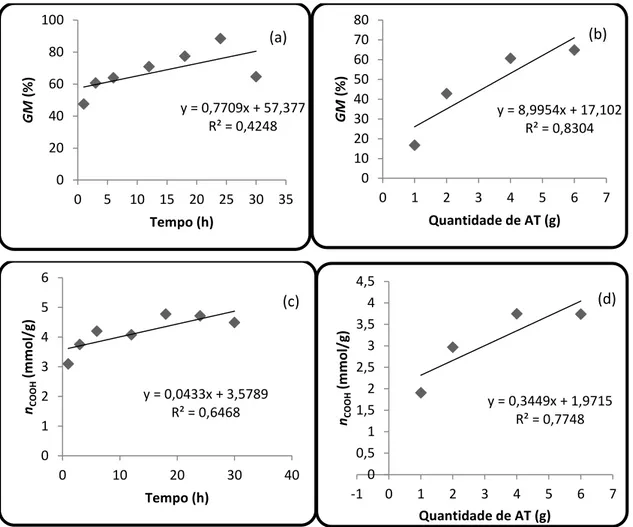
5.1.1. Percentual de ganho de massa (GM) e número de grupos ácido carboxílico introduzidos no material (nCOOH) ... 46
5.1.1.1. BAF... 46
5.1.1.2. BAT ... 49
5.1.2. Análise Elementar de C, H e N (CHN) ... 52
5.1.3. Espectroscopia na região do infravermelho com transformada de Fourier (FTIR) 52 5.1.3.1. BAF... 52
5.1.3.2. BAT ... 54
5.1.4. Determinação do ponto de carga zero (PCZ) ... 56
5.1.5. Análise termogravimétrica (TGA)... 57
5.1.6. Microscopia eletrônica de varredura (MEV) ... 59
5.1.7. Espectroscopia de energia dispersiva de raios-X (EDX) ... 61
5.2. Experimentos de adsorção ... 63
IX
5.2.2.1. BAF... 66
5.2.2.2. BAT ... 68
5.2.3. Isoterma de adsorção ... 71
5.2.3.1. Isoterma de adsorção monocomponente ... 71
5.2.3.1.1. BAF ... 71
5.2.3.1.2. BAT ... 76
5.2.3.2. Isoterma de adsorção multicomponente ... 80
5.2.3.2.1. BAF ... 81
5.2.3.2.2. BAT ... 89
5.2.4. Dessorção dos adsorventes carregados com Co2+, Cu2+ e Ni2+ ... 98
5.2.5. Re-adsorção ... 98
5.2.6. Comparação dos dados experimentais com a literatura... 99
6. Conclusão ... 100
X
Lista de Figuras
Figura 1 Principais unidades presentes na lignina. 14
Figura 2 Estrutura da lignina de faia proposta por Nimz (1974). 15
Figura 3 Estrutura molecular da celulose 16
Figura 4 Dados estruturais da cadeia de celulose (Maple et al., 1994) 17
Figura 5 Padrões mais prováveis das ligações de hidrogênio dos amorfos de celulose
18
Figura 6 Algumas distâncias referentes ao arranjo dos átomos no plano para celulose I (nativa) e para celulose II (mercerizada) relevantes para a modificação química
19
Figura 7 Procedimento de acetilação da celulose em DMAc/LiCl 22
Figura 8 Classificação de isotermas de acordo com Weber e Chakravorti
(1974) 30
Figura 9 Esquema que ilustra a síntese do BAF 47
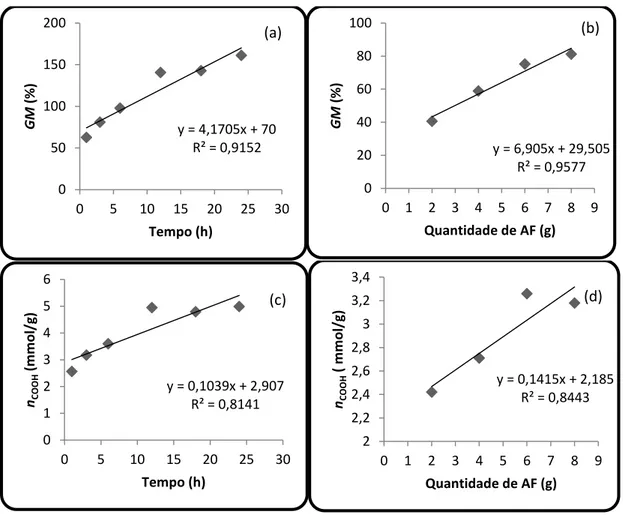
Figura 10 Gráficos que correlacionam ganho de massa, número de funções,
quantidade de anidrido ftálico e tempo de reação 49
Figura 11 Esquema que ilustra a síntese do BAT 50
Figura 12 Gráficos que correlacionam ganho de massa, número de funções, quantidade de anidrido trimelítico e tempo de reação
52
Figura 13 Espectro FTIR de BC, BAF e BAF-carregado Co2+, Cu2+ e Ni2+ 55
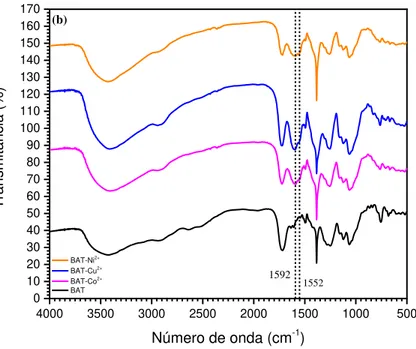
Figura 14 Espectro FTIR de BC, BAT e BAT-carregado Co2+, Cu2+ e Ni2+ 57
Figura 15 Posições das carbonilas na estrutura do anidrido trimelítico 58 Figura 16 Curvas TG e DTG da decomposição térmica do BC, BAF e BAT 60 Figura 17 MEV micrografias do BC, BAF e BAT, com ampliação de 60 e
500 vezes
62
Figura 18 Micrografias MEV-EDX do mapeamento de superfície para Co2+,
Cu2+ e Ni2+ na superfície do adsorvente BAF 63
Figura 19 Micrografias MEV-EDX do mapeamento de superfície para Co2+,
Cu2+ e Ni2+ na superfície do adsorvente BAT 64
Figura 20 Efeito do pH na adsorção de Co2+, Cu2+ e Ni2+ com BAF 65
Figura 21 Efeito do pH na adsorção de Co2+, Cu2+ e Ni2+ com BAT 66
Figura 22 Cinética de adsorção do Co2+ , Cu2+ e Ni2+ em BAF a pH 5.75 para
Co2+ e Ni2+ e 5.5 Cu2+, 0.79 mmol/L M2+, 25°C, 130 rpm e 0.2 g/L
BAF
69
Figura 23 Cinética de adsorção do Co2+ , Cu2+ e Ni2+ em BAT a pH 5.75 para
Co2+ e Ni2+ e 5.5 Cu2+, 0.79 mmol/L M2+, 25°C, 130 rpm e 0.2 g/L
BAT
72
Figura 24 Isoterma de adsorção monocomponente para adsorção de (a) Co2+,
(b) Cu2+ e (c) Ni2+ em BAF a 25°C, pH 5.75 for Co2+ e Ni2+ e 5.5
for Cu2+, 180min, 130 rpm, 0.2 g/L BAF
77
Figura 25 Isoterma de adsorção monocomponente para adsorção de (a) Co2+,
(b) Cu2+ e (c) Ni2+ em BAT a 25°C, pH 5.75 for Co2+ (180 min) e
Ni2+ (75 min) e 5.5 for Cu2+ (250 min), 130 rpm, 0.2 g/L BAT
81
Figura 26 Isoterma adsorção bicomponente de Co2+–Cu2+, Co2+–Ni2+ e Cu2+–
Ni2+ em BAF, a 25° C, 180 min, pH 5.5, 130 rpm, 0.2 g/L BAF 85
Figura 27 Gráficos de qe,est versus qe,exp dos sistemas binários de adsorção
Co–Cu, Cu–Co, Co–Ni, Ni–Co, Cu–Ni, e Ni–Cu a 25°C, 130 rpm, pH 5.5, e 0.2 g/L BAF
XI
Figura 28 Isoterma adsorção bicomponente de Co2+–Cu2+, Co2+–Ni2+ e Cu2+–
Ni2+ em BAT, a 25° C, pH 5.5, 130 rpm, 0.2 g/L BAT 92
Figura 29 Gráficos de qe,est versus qe,exp dos sistemas binários de adsorção
Co–Cu, Cu–Co, Co–Ni, Ni–Co, Cu–Ni, e Ni–Cu a 25°C, 130 rpm, pH 5.5, e 0.2 g/L BAT
XII
Lista de tabelas
Tabela 1 Capacidade máxima de adsorção de Ni2+, Co2+ e Cu2+ de materiais
lignocelulósicos modificados quimicamente. 13
Tabela 2 Faixa de GP de vários materiais celulósicos 17
Tabela 3 Cristalinidade ( x̅c ) de alguns materiais celulósicos (Fink e
Walenta, 1994). 19
Tabela 4 Alguns parâmetros que diferenciam a fisiossorção da quimiossorção. (Naja e Volesky, 2011)
27
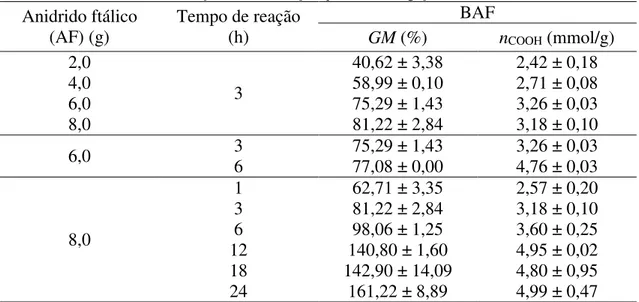
Tabela 5 Resultados da otimização da modificação química do bagaço de cana com anidrido ftálico
47
Tabela 6 Resultados da otimização da modificação química do bagaço de cana com anidrido trimelítico
51
Tabela 7 Análise elementar de C, H e N para BC, BAF e BAT 54
Tabela 8 Dados termogravimétricos para decomposição térmica do B, BAF e BAT
59
Tabela 9 Resultados da regressão não linear dos dados experimentais da adsorção dos íons metálicos em BAF(0.79 mmol/L M2+, 25°C, 130
rpm, 0.2 g/L BAF
67
Tabela 10 Resultados da regressão não linear dos dados experimentais da adsorção dos íons metálicos em BAT (0.79 mmol/L M2+, 25°C,
130 rpm, 0.2 g/L BAT)
70
Tabela 11 Resultados da modelagem da isoterma de equilíbrio de adsorção com modelos de isoterma monocomponente (25°C, 130 rpm e 0.2 g/L BAF)
74
Tabela 12 Resultados da modelagem da isoterma de equilíbrio de adsorção com modelos de isoterma monocomponente (25°C, 130 rpm e 0.2 g/L BAT)
78
Tabela 13 Resultado do modelamento das isotermas de adsorção no
equilíbrio com modelos de isoterma multicomponente (25°C, 130 rpm e 0.2 g/L BAF)
86
Tabela 14 Estimativa da capacidade máxima de adsorção estatística a partir dos dados experimentais (BAF)
87
Tabela 15 Resultado do modelamento das isotermas de adsorção no
equilíbrio com modelos de isoterma multicomponente (25°C, 130 rpm e 0.2 g/L BAT)
93
Tabela 16 Estimativa da capacidade máxima de adsorção estatística a partir dos dados experimentais (BAT)
94
Tabela 17 Comparação do Qmáx para remoção de Co2+, Cu2+ e Ni2+ por vários
adsorventes
XIII
Lista de abreviaturas
AGU Unidade de anidroglicose GP Grau de polimerização
FTIR Espectroscopia na região do infravermelho com transformada de Fourier MEV Microscopia eletrônica de varredura
TGA Análise termogravimétrica
EDX Espectrometria de energia dispersiva de raios-X
nCOOH Número de funções ácido carboxílico (mmol/g)
G.M. Ganho de massa (%)
PCZ Ponto de carga zero BC Bagaço de cana-de-açúcar
BAF Bagaço de cana modificado com anidrido ftálico BAT Bagaço de cana modificado com anidrido trimelítico
ES Detector de elétrons secundários
BSE Detector de elétrons secundários-retroespalhados FAAS Espectroscopia de absorção atômica de chamas
RL Fator de separação
Qmáx Capacidade máxima de adsorção (mmol/g)
Ce Concentração do metal no equilíbrio (mmol/L)
b Constante de Langmuir (L/mg)
R2 Coeficiente de correlação
qe Capacidade de adsorção no equilíbrio (mmol/g)
k1 Constante de velocidade de adsorção de pseudo primeira ordem
(g/mmol.min)
k2 Constante de velocidade de adsorção de pseudo segunda ordem
(g/mmol.min)
t tempo (min)
qt Capacidade de adsorção em um tempo t (mmol/g)
ΔGº Energia livre padrão de Gibbs
n Parâmetro que caracteriza a heterogeneidade do sistema de adsorção
b Constante de Sips
R-P Redlich-Peterson
NC Número de coordenação
KR Constante do modelo de R-P (L/g)
αR Constante do modelo de R-P
β Expoente do modelo de R-P
Pi Fator de capacidade
(KL,i/aL,i)mono Capacidade máxima de adsorção para o componente i no sistema
monocomponente
(KL,i/aL,i)multi Capacidade máxima de adsorção para o componente i no sistema
XIV
Resumo
A poluição da água por metais pesados está se tornando um sério problema global desde que tais metais são tóxicos, não biodegradáveis e bioacumulativos através da cadeia alimentar. O rápido desenvolvimento de algumas indústrias como de tratamento de superfícies metálicas, mineração, fertilizantes, curtumes, baterias, papel e celulose, pesticidas, eletrônicos, petroquímica, têxtil dentre outras tem contribuído para aumentar a concentração de metais tóxicos em águas residuárias, as quais são por vezes lançadas direta ou indiretamente no meio ambiente, principalmente em países em desenvolvimento.
Dentro deste contexto, o presente trabalho de dissertação estudou a preparação de novos materiais adsorventes a partir de bagaço de cana-de-açúcar, um importante resíduo agroindustrial brasileiro, via a esterificação dos grupos hidroxila contidos nos componentes do bagaço, celulose, hemiceluloses e lignina, com os anidridos ftálico e trimelítico para aplicação na remoção de metais tóxicos (Co2+, Cu2+ e Ni2+) de soluções
idealmente contaminadas. A adsorção foi estudada em função do pH da solução, tempo de contato e concentração inicial de íon metálico, sendo esse último em sistema mono- e bicomponente.
A síntese dos novos materiais, bagaço de cana modificado com anidrido ftálico (BAF) e trimelítico (BAT), foi intensivamente estudada. As condições de síntese otimizadas produziram BAF e BAT com um ganho de massa de 75 e 73,9%, respectivamente, e com número de grupos ácido carboxílico de 4,79 e 3,78 mmol/g, respectivamente. Os materiais adsorventes foram caracterizados por FTIR, análise elementar, TGA, PCZ e MEV.
A cinética de adsorção foi melhor descrita pelo modelo de pseudo segunda ordem, sendo que a constante de adsorção mostrou a seguinte ordem: k2,Ni2+ > k2,Co2+ >
k2,Cu2+ para BAF e k2,Ni2+ > k2,Cu2+ > k2,Co2+ para BAT. Quatro modelos de isotermas
mono- e multicomponente foram usados para modelar os sistemas de adsorção. O modelo de Langmuir se ajustou bem aos dados experimentais monocomponente para o BAF, enquanto os modelos de Langmuir e Sips se ajustaram bem aos dados experimentais para o BAT. Já os dados dos sistemas multicomponente para os dois adsorventes foram bem ajustados aos modelos de Langmuir estendido e modificado e P
XV
As capacidades máximas de adsorção (Qmáx,mono) obtidas a partir do modelo de
Langmuir foram de 0,561, 0,935 e 0,932 mmol/g para o BAF e 1,140, 1,197 e 1,563 mmol/g para o BAT para Co2+, Cu2+ e Ni2+, respectivamente. Os estudos competitivos
demonstraram que a capacidade de adsorção multicomponente, Qmáx,multi, foi menor do
que a monocomponente, Qmáx,mono, como um resultado da interação entre os íons
metálicos.
Já os estudos de dessorção mostraram que todos os íons metálicos podem ser totalmente dessorvidos do BAF e BAT e estes adsorventes podem ser utilizados novamente para adsorção sem perda da capacidade de adsorção.
Palavras-chaves: Bagaço de cana-de-açúcar, anidrido ftálico, anidrido trimelítico,
XVI
Abstract
Water pollution by heavy metals has become a serious global problem as such metals are toxic, non-biodegradable and bioaccumulative through the food chain. The rapid development of some industries such as surface treatment, mining, fertilizers, leather, batteries, pulp and paper, pesticide, electronics, petrochemical, textile among others has contributed to increase the concentration of toxic metals in wastewaters, which are directly or indirectly discharged into the environment, especially in developing countries.
Within this context, this dissertation evaluated the preparation of new adsorbent materials from sugarcane bagasse, an important Brazilian agro-industrial waste, through esterification of hydroxyl groups of sugarcane bagasse components as cellulose, hemicellulose, and lignin with phthalic and trimellitic anhydrides for application in the removal of toxic metals (Co2+, Cu2+, and Ni2+) from spiked aqueous
solutions. The adsorption was studied as a function of solution pH, contact time and initial concentration of metal ion, being the latter evaluated in mono- and bi-component systems.
The new carboxylated-functionalized materials (SPA and STA) were prepared
via esterification of sugarcane bagasse with phthalic and trimellitic anhydrides. The
optimized synthesis conditions yield SPA and STA with a percent weight gain of 75% and 73.9%, respectively, and number of carboxylic acid groups of 4.79 and 3.78 mmol/g, respectively. SPA and STA were also characterized by FTIR, elemental analysis, TGA, PCZ and SEM.
Adsorption kinetics followed pseudo-second-order model. Adsorption rate constant exhibited the following order k2,Ni2+ > k2,Co2+ > k2,Cu2+ for SPA and k2,Ni2+ >
k2,Cu2+ > k2,Co2+ for STA, respectively.
Four mono- and multi-component isotherm models were used to model the adsorption systems. Monocomponent experimental data for SPA adsorbent were fitted well to Langmuir model, while for STA were fitted well to Langmuir and Sips models. The multicomponent data were fitted well to modified extended Langmuir and P-factor
models.
Maximum adsorption capacities (Qmax,mono) obtained from Langmuir model
XVII
the multicomponent adsorption capacities, Qmax,multi, were smaller than monocomponent
adsorption capacities, Qmax,mono, as a result of the interaction between metal ions.
Desorption studies also demonstrated that all metal ions could be fully desorbed from SPA and STA, and therefore, these adsorbents could be recovered and reused for a new adsorption cycle.
Keywords: Sugarcane bagasse, phthalic anhydride, trimellitic anhydride, adsorption,
1
1. Introdução
A água é uma substância primordial para a existência da vida, a mesma é utilizada para o abastecimento doméstico e industrial, irrigação, lazer, dessedentação de animais, geração de energia elétrica, navegação, e é o principal constituinte do corpo humano (Von Sperling, 1996).
É a substância mais abundante encontrada na Terra, com um volume total de aproximadamente 1,3 bilhões de km3 e se encontra nos oceanos, rios, lagos, aquíferos,
geleiras polares e até no ar. Na natureza a água se encontra nos três estados: sólido, líquido e gasoso, sendo que o maior percentual de água do planeta se encontra na forma salgada e apenas 0,007% do volume total, corresponde a água doce de fácil acesso. Com relação à distribuição dos recursos hídricos pelo mundo, a agricultura é responsável pelo consumo de 70%, a indústria por 22% e as residências por apenas 8%.
Além da percentagem de água doce de fácil acesso no planeta ser muito pequena, apenas 0,007%, grande parte dos rios tem sua qualidade comprometida em decorrência de atividades humanas que lançam rejeitos sem um tratamento adequado e acabam contaminando os recursos hídricos.
Dentre os principais poluentes dos corpos d’água é importante destacar os
metais pesados. O termo metal pesado se aplica a um grupo de metais e/ou metaloides que são tóxicos ao ser humano e/ou animais e normalmente são provenientes do descarte inadequado de rejeitos no meio ambiente (Duffuz, 2002).
Os metais pesados não são degradáveis e a contaminação das águas por esses poluentes ocorre principalmente devido à agricultura, drenagem ácida de minas, o despejo de rejeitos provenientes das indústrias sem um tratamento prévio adequado e das atividades mineradoras (Kuns et al., 2002).
A fim de minimizar os níveis de poluição nos corpos d’água, vários métodos de
remoção de poluentes são utilizados, tais como troca iônica, osmose reversa, ozonização, eletrólise, precipitação química, adsorção.
2
O bagaço proveniente da cana-de-açúcar tem se mostrado bastante promissor para ser modificado quimicamente e produzir materiais com novas propriedades, inclusive a de adsorvente de poluentes em soluções aquosas. Sua capacidade de adsorção se dá porque o mesmo é constituído de celulose, hemiceluloses e lignina, que são ricos em grupos hidroxilas e grupos fenólicos que podem reagir quimicamente (Yu
et al., 2012).
Por conter vários grupos hidroxila em sua composição química, o bagaço de cana é um material que se mostra bastante promissor para ser modificado quimicamente visando a sua utilização em novas aplicações tecnológicas como, por exemplo, a adsorção de poluentes comuns em recursos hídricos. Tal modificação química visa única e exclusivamente modificar as propriedades do material com o intuito de melhorar suas propriedades como adsorvente.
3
2. Objetivos
2.1. Geral
O presente trabalho tem como objetivo o desenvolvimento de novos materiais lignocelulósicos modificados para a adsorção de metais tóxicos em solução aquosa idealmente contaminada. Para a realização deste estudo foram utilizados o bagaço de cana-de-açúcar e os anidridos ftálico e trimelítico, produzindo assim materiais funcionalizados com aplicação na adsorção de poluentes como metais.
2.2. Específicos
Estudar a modificação química do bagaço de cana-de-açúcar com anidrido ftálico e trimelítico em função do tempo de reação;
Estudar a modificação química do bagaço de cana-de-açúcar em função da concentração de anidrido ftálico e trimelítico, a fim de se obter adsorventes altamente funcionalizados;
Estudar a adsorção dos metais Cu2+, Co2+ e Ni2+ em função do tempo de contato;
Estudar a adsorção dos metais Cu2+, Co2+ e Ni2+ em função do pH;
Estudar a adsorção monocomponente dos metais Cu2+, Co2+ e Ni2+ em função da
concentração do metal em solução aquosa idealmente contaminada com o objetivo de otimizar o processo de adsorção;
4
3. Revisão bibliográfica
3.1. Metais pesados
Os metais são definidos pelas propriedades físicas do elemento no estado sólido, sendo que as propriedades gerais são alto brilho, elevada condutividade térmica e elétrica, ductilidade mecânica e maleabilidade. Eles podem ser tóxicos se reagirem com os sistemas biológicos quando se encontram na forma catiônica. Vários nomes são dados aos subconjuntos de elementos metálicos como: metais alcalinos, alcalino-terrosos, de transição e metaloides, os quais possuem características de metais e não-metais (Cassaret e Doull, 2008).
A utilização dos metais é de fundamental importância para o progresso e sucesso da civilização humana, uma vez que eles são utilizados nos processos industriais e em produtos de consumo. Além disso, alguns metais são essenciais para diversos processos biológicos. Dessa forma, a exposição humana aos metais em algum nível é inevitável. Entretanto, com o aumento da exposição, esses metais podem se tornar tóxicos para os seres humanos e animais (Casarett e Doull, 2008).
O termo “metais pesados” é associado a um grupo de metais e metaloides que
possuem um grau significativo de toxicidade para os seres humanos e/ou animais, e normalmente tais metais são provenientes de descartes inadequados de rejeitos no meio ambiente. Essa denominação se deu por causa da alta densidade do elemento em sua forma elementar, mas não há um consenso entre os cientistas sobre esse valor. Além de não existir um consenso sobre a relação entre densidade e toxicidade, o termo metal pesado é usado sem discernimento tanto para elementos quanto para seus compostos (Duffuz, 2002).
Alguns pesquisadores como Bennet e Lewis tentaram formular uma definição em função da massa molar e do número atômico dos elementos, porém os critérios não são claros e possuem várias inconsistências. Dessa forma, Duffuz (2002) sugeriu uma classificação baseada nas propriedades químicas que permita a interpretação das bases bioquímicas para a toxicidade dos metais.
5
Theophrastus de Erebus. Um dos primeiros relatos da toxicidade dos metais se deu em 370 a.C. com a descrição de cólicas abdominais em decorrência da extração de metais.
Apesar de alguns metais pesados serem de conhecimento humano há muito tempo, outros só foram descobertos recentemente, como é o exemplo do cádmio que foi reconhecido apenas em 1817, em minérios associados a carbonato de zinco (Goyer e Clarkson, 2001).
Dos 118 elementos da tabela periódica aproximadamente 30 apresentam toxicidade ao homem, sendo estes Cd, Cr, Hg, Ni, Pb, Zn, As e Be metais com maior poder de toxicidade; Co, Cu, Fe, Mg, Mo, Se e Zn metais essenciais com potencial de toxicidade; Al, Bi, Ga, Au, Li e Pt metais utilizados na terapia medicinal com potencial de toxicidade e Sb, Ba, Ge, In, Ag, Te, Ti, Sn, Tl, U e V possuem menor poder de toxicidade (Goyer e Clarkson, 2001).
Naturalmente os metais são distribuídos no meio ambiente através dos ciclos biológicos e geológicos. Sendo que no ciclo biológico ocorre a bioconcentração destes metais por animais e plantas, e consequentemente são incorporados à cadeia alimentar (Goyer e Clarkson, 2001).
Ao contrário dos contaminantes orgânicos, a maioria dos metais não sofre degradação microbiana ou química, e, portanto, as concentrações no solo persistem por um longo tempo após a sua entrada (Goyer e Clarkson, 2001).
O aumento da concentração dos metais pesados pode ocorrer como consequência de atividades antrópicas ou naturais. O intemperismo e a lixiviação são exemplos de atividades naturais que aumentam a concentração desses poluentes nos
solos e corpos d’água. Já as atividades mineradoras, rejeitos industriais, atividades
agrícolas e a queima de combustíveis fósseis são exemplos de atividades antrópicas (Alleoni et al., 2005; Guilherme et al., 2005).
Nas atividades agrícolas, para aumentar a produtividade do solo se faz necessário o incremento de insumos agrícolas no mesmo, tais como: fertilizantes, corretivos de pH e pesticidas. Entretanto estes agroquímicos contêm várias impurezas, dentre elas metais tóxicos (Núñez et al., 2006).
6
Nas atividades mineradoras envolvendo os processos de retirada de minérios de depósitos minerais são gerados resíduos sólidos estéreis e minerais sem valor comercial. Esses rejeitos na presença de ar, água e da bactéria Thiobacillus ferroxidans são
oxidados, ocasionando assim na acidificação de drenagens e dissolução de metais, acarretando na drenagem ácida de mina (DAM). A DAM pode conter os íons metálicos: As, Cd, Cu, Ni, Pb, Zn, Al, Cr, Hg, Mg e Mn, sendo que as concentrações e composição da DAM variam de acordo com as condições geológicas da região explorada (Fungaro, 2005).
Os metais tóxicos não são biodegradáveis e acarretam malefícios para os seres vivos, tais como: danos ao sistema nervoso central e mutações genéticas (Casarett e Doull, 2008).
Portanto, a recuperação destes metais se faz necessária, pois além de evitar a
contaminação dos corpos d’água e lençóis freáticos, que acarretam danos à saúde dos
seres vivos, ainda representa uma importante fonte de renda, pois metais como cobre, cobalto e níquel possuem elevado valor de mercado.
3.1.1. Níquel (Ni2+)
O níquel é um metal presente na natureza que ocorre principalmente na forma de sulfureto, óxido e minerais de silicatos. O níquel tem como principais propriedades a resistência à corrosão, boa condutividade térmica e elétrica, e por isso é muito utilizado em ligas metálicas, aços inoxidáveis, galvanoplastia e em outras aplicações (Goyer e Clarkson, 2001).
O níquel pode ser encontrado em baixos níveis no ar atmosférico em decorrência da combustão de combustíveis fósseis, lamas e resíduos de incineração (Goyer e Clarkson, 2001).
A exposição humana a esse metal se dá por inalação, ingestão e contato dérmico, sendo que a alimentação é a principal fonte de exposição para a maioria da população. A Agência de Proteção Ambiental dos Estados Unidos (EPA) estima que a ingestão diária de níquel em adultos é de 100 a 300 µg (Goyer e Clarkson, 2001).
7
sanguínea. Já a exposição cutânea pode acarretar em dermatites (Goyer e Clarkson, 2001).
A eliminação do níquel pelo organismo é expressa em função do tempo de meia-vida, ou seja, é o tempo que o corpo precisa para excretar metade da concentração acumulada. Dessa forma, o tempo de meia-vida do sulfato de níquel varia entre 1 a 3 dias, e mais de 100 dias para o óxido de níquel, por exemplo (Benson et al., 1987;
Dunnick, 1989).
3.1.1.1. Toxicidade
O níquel carbonil [Ni(CO)4] é um composto formado em decorrência do refino
do níquel e é extremamente tóxico, e muitos casos de toxicidade aguda já foram relatados. Os primeiros sintomas são dor de cabeça, náuseas, vômitos, dor epigástrica ou no peito, seguido de tosse, hiperpnéia, cianose, problemas gastrointestinais e fraqueza. Além desses, pode haver ainda leucocitose e os casos mais graves evoluem para pneumonia, insuficiência respiratória e até edema cerebral e morte (Casarett e Doull, 2008). O níquel carbonil é absorvido rapidamente pelo pulmão, entra nos glóbulos vermelhos e posteriormente é convertido em níquel bivalente e CO.
Toxicidade aguda do níquel bivalente foi observada em trabalhadores da galvanoplastia que beberam água contaminada com NiSO4 e NiCl2. Os sintomas
prontamente desenvolvidos foram vômito, diarreia, tontura, dor de cabeça, tosse e falta de ar (Bastarache, 2012).
3.1.1.2. Tratamento
8 3.1.2. Cobalto (Co2+)
O cobalto é um metal raro produzido como subproduto do refino de outros metais, como cobre. Seus sais são utilizados como catalisadores, na secagem de tintas e na produção de diversos pigmentos. Já sob a forma de cobalamina, o cobalto é um componente essencial para a produção de vitamina B12, sendo essa necessária para a produção dos glóbulos vermelhos nos seres humanos e na prevenção da anemia perniciosa (Goyer e Clarkson, 2001).
A absorção dos sais de cobalto se dá logo após a ingestão oral e principalmente quando o indivíduo está em jejum. Entretanto, o aumento dos níveis de ingestão de cobalto geralmente não acarreta na acumulação do mesmo no organismo. Isso porque cerca de 95% dos sais ingeridos são excretados através da urina e das fezes, mas existem ainda as rotas secundárias, como o suor e amamentação, que são responsáveis pela eliminação de mais uma parcela do cobalto (Goyer e Clarkson, 2001).
3.1.2.1. Toxicidade
A inalação de poeira contendo cobalto na concentração entre 0.002-0.01 mg/m3
pode causar irritação das vias respiratórias, já concentrações mais elevadas podem acarretar em pneumoconiose, forma progressiva de fibrose pulmonar intersticial. A exposição cutânea pode ainda gerar dermatite alérgica (Casarett e Doull, 2008).
Dados evidenciam que a exposição humana ao cobalto não provoca câncer. Entretanto, a inalação de sulfato de cobalto por roedores, provoca tumor pulmonar, inclusive carcinoma. Já a inalação de outros compostos de cobalto pode levar ao desenvolvimento de sarcoma local também em roedores (Casarett e Doull, 2008).
9 3.1.3. Cobre (Cu2+)
O cobre é um componente das células vivas e está presente abundantemente na natureza, além de ser um elemento nutricional essencial encontrado em alimentos e bebidas. A absorção gastrointestinal do cobre é regulada pelos mecanismos homeostáticos, enquanto a excreção é feita pela bile.
A deficiência desse metal em humanos é rara e se dá principalmente em recém-nascidos com pouco peso e em crianças malnutridas após o nascimento. A carência do cobre no organismo resulta em anemia micrifitica e hipocrômica e susceptibilidade a infecções.
3.1.3.1. Toxicidade
Os efeitos adversos à saúde em decorrência da ingestão excessiva de cobre são problemas gastrointestinais. Casos de náuseas, vômitos e dor abdominais se deram após a ingestão de sulfato de cobre em bebidas com concentração superior a 3 mg/L de Cu. A ingestão de grandes quantidades de sal de cobre pode ocasionar necrose hepática e até morte (Casarett e Doull, 2008).
Além disso, a acumulação excessiva desse metal nos rins, fígado, cérebro e córnea podem ocasionar distúrbios desses órgãos e a doença de Wilson. Pacientes com a doença de Wilson tem a excreção biliar de cobre comprometida e esse quadro só é revertido mediante um transplante de fígado (Goyer e Clarkson, 2001).
Entretanto, estudos epidemiológicos não indicaram relação entre a exposição ao cobre e câncer (Casarett e Doull, 2008).
3.1.3.2. Tratamento
O tratamento clínico se dá por quelação do cobre com penicilamina,
trien[trietilenotetramina∙2HCl], acetato de zinco e tetratiomolibdato. Segundo Casarett e
10
3.2. Combustíveis fósseis x biocombustíveis
A sociedade tem utilizado como umas das principais fontes energéticas os derivados do petróleo, tais como: gasolina e óleo diesel. Um inconveniente dessa fonte energética é que a mesma não é de fonte renovável, ou seja, a intensa extração do petróleo vai ocasionar em escassez do mesmo. Dessa forma será cada vez mais difícil encontrar essa matéria prima e os poços serão cada vez mais difíceis de serem explorados, e com isso serão necessárias tecnologias mais eficazes e consequentemente maiores serão os custos para a sua extração. Fato este que acarretará no aumento do preço dos derivados do petróleo (Figueira, 2007).
Além do aumento do preço para os consumidores, a queima dos combustíveis fósseis libera gases danosos para o meio ambiente, como o dióxido de carbono (CO2) e
metano (CH4) que intensificam o efeito estufa no planeta.
O efeito estufa é um processo natural que mantém a temperatura da Terra praticamente constante e possibilita assim a vida humana na mesma. O sol emite radiação sobre o planeta com comprimento de onda na região do infravermelho e ultravioleta, da qual uma parcela dessa energia é refletida pela atmosfera terrestre e o restante é absorvida pela superfície da terra e pelo ar. Ainda no que se refere à energia absorvida pela terra, uma parcela desta é irradiada de volta para o espaço, enquanto o restante fica retida na superfície do planeta na forma de infravermelho térmico. É esse fenômeno que mantém a temperatura da superfície do planeta em aproximadamente 15°C (Onça, 2013).
Entretanto, os gases que potencializam o efeito estufa formam uma camada que bloqueia a dissipação da energia que é refletida pela superfície, aumentando assim a temperatura do planeta. Este aquecimento tem causado o derretimento de geleiras nas regiões polares, elevando assim o nível dos mares e consequentemente provocando o alagamento de ilhas e regiões litorâneas. Além disso, tufões, furacões e enchentes provavelmente ocorrerão com mais intensidade (Onça, 2013).
Mediante esse quadro de aumento do preço dos combustíveis e das mudanças climáticas, se faz necessário o aprimoramento e desenvolvimento de produtos que substituam os derivados do petróleo utilizando matérias primas renováveis (Cunha e Gandini, 2010).
11
70. Mais precisamente, em de novembro de 1975, foi criado o Programa Nacional do Álcool ou Proálcool, pelo decreto nº 76.593, que tinha o objetivo de estimular a produção de álcool oriundo da cana-de-açúcar ou outra matéria-prima, visando a substituição da gasolina. Isso porque a primeira crise do petróleo se deu em 1973, quando o peço do barril subiu de US$ 3,88 para US$ 12,55 em apenas um ano (aumento de 223,5%) e o Brasil importava cerca de 80% do petróleo consumido (Távora, 2011).
Em 1977, começa a ser adicionado 4,5% de álcool anidro na gasolina para aumentar a octanagem, além de evitar a corrosão nos motores. O álcool com tal finalidade substituiu completamente o chumbo tetraetila (Pb(C2H5)4), visto que esse
composto libera partículas de chumbo no ar que são tóxicas para o ser humano e animais (Távora, 2011).
No ano de 2003 o setor sucroalcooleiro foi impulsionado pela criação dos carros flex, ou seja, veículos que operam com qualquer porcentagem de etanol na mistura combustível. Além disso, o preço do etanol teve uma redução de aproximadamente 70% e para complementar houve aumento do preço internacional do petróleo. Mediante esse cenário, o álcool tornou-se um biocombustível competitivo em relação à gasolina, tanto no mercado interno, quanto no externo (Távora, 2011).
3.3. Produção de cana-de-açúcar
A cana-de-açúcar é uma matéria prima com capacidade grande energética, entretanto alguns pesquisadores defendem que apesar desta fonte ser renovável e ter o ciclo de carbono fechado, ou seja, o CO2 emitido na queima é capturado no processo de
fotossíntese pela planta, essa alternativa não é viável, pois o mesmo não acontece com o ciclo do nitrogênio. Durante os processos de nitrificação e desnitrificação, bem como a utilização de fertilizantes nitrogenados, acontece a liberação do precursor do óxido nitroso. Este óxido é um gás estufa 296 vezes mais potente que o CO2 (Crutzen et al.,
2008).
12
O Brasil tem grande potencial para produzir biocombustíveis e alguns fatores que contribuem para tal fato são: localização na região tropical, regime pluviométrico adequado, grande incidência solar, além de ter enormes reservas de terra (Laviola et al.,
2011).
O Brasil é o maior produtor de cana-de-açúcar do mundo, seguido pela Índia, Tailândia e Austrália (UNICA, 2011). De acordo com o IBGE a região Norte-Nordeste é responsável por 15% da produção total dessa matéria prima, enquanto a região Centro-Sul representa 85%. Dentre os estados produtores, São Paulo é o maior produtor sendo responsável por 60% da safra nacional (Laviola et al., 2011).
Na safra brasileira de 2012/2013 foram esmagadas mais de 588 milhões de toneladas de cana, com geração de aproximadamente 182 milhões de toneladas de bagaço de cana. Já na safra 2013/2014 houve um aumento de 12% em relação à safra 2012/2013, produzindo assim 658,8 milhões de toneladas de cana, com geração de 204 milhões de toneladas de bagaço (CONAB, 2014).
O Brasil aumentou cerca de 330 mil hectares de área cultivada de cana na temporada 2013/2014, o que corresponde a um aumento de 3,8% em relação à 2012/2013. Houve um acréscimo de 5,1% (375,1 mil hectares) na área da região centro-sul e um decréscimo de 4,3% (48,6 mil hectares) na área da região norte/nordeste. Esse aumento se deu em decorrência da expansão de novas áreas de plantio das indústrias em funcionamento (CONAB, 2014).
Além disso, o crescimento da indústria sucroalcooleira no Brasil também se deve aos investimentos em pesquisa agrícola e biotecnia, o que acarreta no desenvolvimento de cepas mais resistentes a bactérias, doenças e parasitas, e que possuem capacidade de responder a diversos ambientes. Além de desenvolverem cepas com maior capacidade de acumulação de açúcar (sacarose), e consequentemente maior conteúdo energético (Rocha et al., 2015).
A cana-de-açúcar é constituída de três frações, que são: caldo, palhada e ponteiras e bagaço. O caldo é utilizado para a fermentação alcóolica da sacarose para a produção do etanol de primeira geração, e parte da palhada e ponteiras são deixadas no campo para o controle de ervas daninhas e fertilização do solo, e parte do bagaço é utilizado na cogeração de vapor para produção de energia mecânica e eletricidade nas usinas sucroalcooleiras (Laviola et al., 2011).
cana-13
de-açúcar após extração do caldo, rico em sacarose, que é utilizado para produção de etanol ou açúcar, e ele juntamente com a palha, correspondem a 35% do peso total da cana. O bagaço é constituído por celulose, hemiceluloses, lignina, extrativos e sais minerais. Em média, esse resíduo é composto por 42,3% de celulose, 25,1% de hemiceluloses (na forma de pentosanas), 3,7% de grupos acetila (incorporados às hemiceluloses), 24,7% de lignina e 3,5% de cinzas (compostos inorgânicos) (Rocha, 2015).
Devido à presença das três macromoléculas (celulose, lignina e hemiceluloses), o bagaço de cana é rico em grupos hidroxilas primários, secundários e fenólicos, e esses podem ser modificados quimicamente para produzir materiais adsorventes com novas propriedades (Yu et al., 2012). O mesmo pode acontecer com outros materiais
lignocelulósicos que possuem essas três macromoléculas. Dentre as novas propriedades, esse trabalho destaca a capacidade de adsorver metais pesados presentes em águas residuais e efluentes. A Tabela 1 a seguir apresenta algumas modificações químicas, juntamente com a capacidade de adsorção para os íons metálicos.
Tabela 1 –Capacidade máxima de adsorção de Ni2+, Co2+ e Cu2+ de materiais lignocelulósicos
modificados quimicamente.
Adsorvente
Capacidade máxima de adsorção, Qmáx
(mg/g) Referência
Ni2+ Co2+ Cu2+
Quitosana + ácido oxálico
dihidratado 52 - 75 Boddu et al., 2008
Celulose + etilenodiamina 63 112 - Silva Filho et al., 2006
Bagaço de cana (B) +
anidrido succínico - 113 - Silva et al., 2013
B mercerizado + dianidrido etilenodiaminatetraacético
- - 92 Karnitz et al., 2009
3.4. Lignina
14
anos, com o desenvolvimento do grupo de plantas vasculares. Além da lignina, todas as plantas vasculares possuem outros polissacarídeos como celulose, hemiceluloses e extrativos (Belgacem e Gandini, 2008).
HC CH CH2OH
OH
HC CH CH2OH
H3CO
OH
HC CH CH2OH
H3CO
OH OCH3
Álcool sinapílico Álcool coniferílico
Álcool p-cumarílico
OH H3CO
OH H3CO
OH OCH3
p-hidroxifenila guaiacila siringila
Figura 1– Principais unidades presentes na lignina.
A lignina é uma macromolécula tridimensional, cuja função é conferir impermeabilidade, rigidez e resistência a ataques microbiológicos e mecânicos aos tecidos vegetais. É uma das macromoléculas mais abundantes na natureza, e assim como diversos componentes da biomassa vegetal, é formada através do processo de fotossíntese. A produção anual de lignina está na faixa entre 6-36× 108 toneladas
(Belgacem e Gandini, 2008).
As ligninas são formadas através da polimerização de monolignóis, sendo que os três álcoois precursores da lignina são: coniferílico, cumarílico e sinapílico (Figura 1). As estruturas das ligninas diferem de uma espécie vegetal para outra, dependendo se os núcleos aromáticos são do tipo p-hidroxifenila (H), guaiacila (G) e siringila (S)
15
Figura 2 – Estrutura da lignina de faia proposta por Nimz (1974).
3.5. Hemiceluloses
As hemiceluloses são polissacarídeos heterogêneos não cristalinos, abundantes em palhas e cereais, podendo representar cerca de um quarto a um terço da constituição das plantas, sendo que a quantidade varia de acordo com a espécie vegetal. Proporcionam rigidez às paredes celulares em tecidos lignificados e são os componentes mais complexos da parede celular de gramíneas e cereais, que formam ligações de hidrogênio com a celulose, ligações covalentes com a lignina (principalmente ligações
éter α-benzil) e ligações éster com unidades acetil e ácidos hidroxicinâmicos (Sun, 2010).
São macromoléculas ramificadas que possuem baixa massa molar e grau de polimerização (GP) entre 80–200. Seus constituintes são ácido urônico e diferentes açúcares do tipo pentosanas e hexosanas cujas formas gerais são (C5H8O4)n e
(C6H10O5)n, respectivamente, com proporções e substituintes diferentes. Os principais
açúcares são xilose, L-arabinose, glucose, galactose, manose, ácido D-glicurônico, ácido 4-O-metil-D-glucurônico, ácido D-galacturônico, e em menor extensão L-ramnose, L-fucose (Sun, 2010).
16
(ligações α-1,5 em unidades L-arabionose) e galactanas (ligações β-1,3 em unidades D-galactose) (Belgacem e Gandini, 2008).
3.6. Celulose
A celulose é o biopolímero mais abundante da natureza (Gandini e Belgacem 2008) com produção anual estimada em cerca de 1,5 × 1012 toneladas. Considerando-se
a aplicabilidade de materiais naturais que possam melhorar a vida, a celulose é o mais atrativo. Não só porque é o biopolimero mais disponível na natureza, mas também porque pode ser extraída a partir de algas e das células de plantas vegetais como as superiores e as gramíneas (Melo et al., 2010).
A Figura 3 mostra a estrutura molecular da celulose que é constituída por unidades de D-anidroglicopiranose (AGU) que estão unidas através de ligações
glicosídicas do tipo β(1→4). Considerando a celobiose como unidade repetitiva, a
celulose é um homopolímero isostático do dímero celobiose, no qual cada unidade AGU possui hidroxilas no carbono dois (C-2) e no carbono três (C-3), conhecidas como secundárias, e no carbono seis (C-6), conhecida como primária, que podem participar de inúmeras reações (Klemm et al., 2005).
HO O HO OH O OH O HO OH OH O O 1 4 5 HO OH 6 2 3 OH OH HO OH H OH O O Terminação redutora Terminação não redutora
Unidade de anidroglucose, AGU n = valor de GP
Celobiose: unidade repetitiva da celulose
Figura 3- Estrutura molecular da celulose
Os grupos hidroxilas que se encontram nas extremidades da cadeia possuem comportamentos diferentes. A hidroxila em C-4 tem terminação com propriedade não-redutora, enquanto o carbono do grupo aldeído C-1 tem terminação redutora (Klemm et al., 2005).
17
valor médio da quantidade de AGUs que a constitui. O GP depende da origem e do pré-tratamento ao qual o biopolímero foi submetido conforme mostrado na Tabela 2.
Tabela 2- Faixa de GP de vários materiais celulósicos
Material Faixa de GP
Algodão nativo Até 12000
Línteres de algodão desengordurados e branqueados 800-1800 Pó de celulose (hidrólise parcial e desintegração mecânica) 100-250
Filamentos e fibras de celulose 250-500
Polpa de madeira 600-1200
Fonte: Klemm et al., 2005, p. 12.
A celulose apresenta uma considerável inércia química e física, mas em condições adequadas a mesma pode ser modificada. Sendo que a maior parte das modificações ocorre nas hidroxilas primárias, C-6, seguidamente das hidroxilas secundárias em C-2 e C-3 (Melo et al., 2010). Normalmente, a hidroxila secundária é
uma base mais forte que a primária, logo a reação deveria acontecer primeiramente na hidroxilas secundárias. Porém, na celulose, as hidroxilas secundárias são mais impedidas estericamente e dessa forma a reação acontece primeiramente nas hidroxilas primárias (Klemm, 2005).
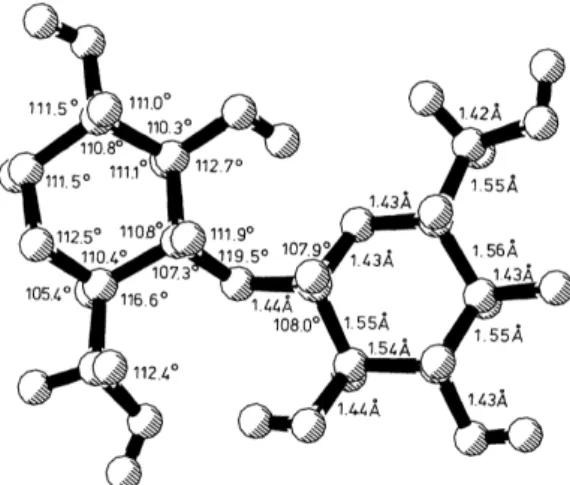
Na celulose, os ângulos de ligação, o comprimento da ligação glicosídica e os ângulos de torção determinam a conformação do esqueleto da cadeia, conforme mostrado na Figura 4.
Figura 4 –Dados estruturais da cadeia de celulose (Maple et al., 1994)
18
3.6.1. Estrutura supramolecular
As cadeias de celulose tendem a se agruparem em estruturas muito ordenadas por causa da sua conformação espacial e constituição química. Essa tendência a se agruparem de forma ordenada é explicada pela rede de ligações de hidrogênio que são formadas, que consiste tanto de ligações intra- quanto intermoleculares, como pode ser observado na Figura 5. Dentre as ligações de hidrogênio intermoleculares, a ligação entre o O-3 e o O-6 normalmente é considerada como a mais relevante para celulose I do ponto de vista químico. São as ligações de hidrogênio que conferem coesão entre as cadeias da celulose, que são de extrema importância para as reações em fase heterogênea (Klemm et al., 2005).
Figura 5 – Padrões mais prováveis das ligações de hidrogênio dos amorfos de celulose I.
Kroon-Batenburg et al., 1986.
Fonte: Klemm et al., 2005, p. 33.
A organização das macromoléculas nas fibras de celulose não se dá de forma uniforme ao longo de toda estrutura. Dessa forma existem regiões pouco ordenadas, bem como regiões muito organizadas e cristalinas. Tendo como base as evidências experimentais disponíveis atualmente, é adequado interpretar a estrutura supramolecular da celulose como um modelo de duas fases, composto por regiões pouco ordenadas, denominadas amorfas, e regiões altamente ordenadas, ditas cristalinas. Dessa forma, a pequena quantidade de matéria com estado intermediário de organização é negligenciada (Klemm et al., 2005).
19
difração de raios-X. O grau de cristalinidade de diversas amostras de celulose abrange uma vasta gama e é dependente da origem e do pré-tratamento aplicado à amostra, como pode ser observado na Tabela 3 (Klemm et al., 2005).
Tabela 3 - Cristalinidade ( x̅c ) de alguns materiais celulósicos (Fink e Walenta, 1994).
Amostra Comentário x̅c (%)
Línter de algodão (limpo e branqueado) Amostra de várias origens 56 - 63 Polpa de dissolução sulfito Amostra de várias origens 50 - 56
Polpa sulfato Pré-hidrolisada 46
Filme de celulose regenerada Amostra de várias origens 40 - 45
Viscose rayon Amostra de várias origens 27 - 40
Fonte: Klemm (2005), p. 16.
A celulose é um polímero que possui 4 polimorfos, sendo estes conhecidos como celulose I, II, II e IV. Dentre os polimorfos, a celulose I é a única encontrada na natureza na sua forma nativa e a Figura 6 mostra alguns dados cristalográficos da deste polimorfo.
Figura 6 – Algumas distâncias referentes ao arranjo dos átomos no plano para celulose I
(nativa) relevantes para a modificação química (Krässig, 1993). Notações da distribuição dos átomos no plano de acordo com Meyer, Mark e Misch.
Fonte: Klemm et al., 2005, p. 36.
A celulose I possui a conformação do C-6 (grupo CH2OH) disposta na posição
trans-gauche (tg) em relação às ligações O5-C5 e C4-C5 (Klemm et al., 2005). A
estrutura cristalina da celulose nativa (celulose I) pode ser descrita por uma célula unitária monoclínica, com o grupo espacial P-21, que contém duas cadeias de celulose
20
concluíram que a celulose I é constituída de duas formas cristalinas diferentes, que são Iα e Iβ (Wada et al., 2004).
Estudos de difração de raios-X e difração de elétrons revelaram que a estrutura cristalina da celulose Iα e Iβ é descrita por uma célula unitária triclínica e monoclínica, respectivamente.
3.7. Modificação química de celulose
De acordo com Cunha e Gandini (2010), a celulose possui em sua estrutura supramolecular tanto regiões amorfas quanto cristalinas, sendo que normalmente o grau de cristalinidade está crompreendido entre 40 e 60%, dependendo do pré-tratamento e da origem da amostra. A reatividade da celulose está relacionada à sua morfologia, uma vez que os grupos hidroxilas localizados nas regiões amorfas são mais acessíveis, consequentemente essa região é mais reativa. Já aqueles presentes nas regiões cristalinas são mais compactos e menos acessíveis, o que acarreta em menor reatividade.
A celulose é utilizada principalmente nas indústrias têxteis, papel, papelão, embalagens, em materiais compósitos, dentre outras e seu aspecto mais inovador está relacionado ao aumento de atividades que utilizam recursos renováveis em detrimento aos fósseis.
A esterificação da celulose foi o primeiro tipo de modificação química conhecida deste biopolímero e sua relevância nunca se perdeu. Cerca de 150 anos atrás ésteres de celulose eram utilizados como fonte de plástico, antes do advento da petroquímica (Cunha e Gandini, 2010).
Os ésteres de celulose são atrativos para os laboratórios e indústrias por duas razões. Primeiro porque a celulose é pouco solúvel em solventes comuns e se decompõe antes de sofrer fusão. A conversão do biopolímero em seus ésteres proporciona materiais que podem ser usados de várias formas, como filmes ou membranas para revestimento ou em aplicações onde seletividade é necessária em meios permeáveis. Segundo porque suas propriedades físicas podem ser modificadas por derivatização. Além desses aspectos, os ésteres são bastante atrativos, pois são biodegradáveis, de fontes renováveis, não tóxicos e recicláveis (Edgar et al., 2001).
21
modificações químicas e seus derivados podem ser usados na forma de fibras, filmes, invólucros para alimentos, membranas, esponjas, dentre outros (Sun, 2010).
A utilização da celulose com a finalidade de produzir derivados é benéfica, pois diminui o consumo de recursos fósseis de fontes não renováveis, protegendo assim o meio ambiente. Devido à disponibilidade de três hidroxilas em cada unidade AGU e o caráter polimérico da celulose, várias modificações químicas podem ser efetuadas, tais como esterificações com anidridos cíclicos e acíclicos, carboximetilação, dentre outras que são possíveis e que serão abordadas nas seções subsequentes (Sun, 2010).
3.7.1. Acetilação
A acetilação da celulose com anidrido acético ou cloreto de acetila é bem conhecida, sendo que o acetato de celulose é um derivado comercialmente importante. Suas propriedades são resistência, baixo custo, brilho, transparência, estética favorável, e dessa forma, são muito utilizados na indústria têxtil. Suas fibras também são utilizadas em filtros de cigarros com o objetivo de adsorver vapores e acumular alguns componentes da fumaça, e como transportador para negativos fotográficos, microfilmes, fita de áudio e filmes cinematográficos (Sun, 2010).
Atualmente, vários métodos de acetilação de celulose estão sendo desenvolvidos. Industrialmente o acetato de celulose é produzido através da reação de celulose com excesso de anidrido acético, utilizando ácido sulfúrico ou perclórico como catalizador (Sun, 2010).
Os pesquisadores Biswas et al., (2006) realizaram a acetilação a partir da
reação de resíduos agrícolas com excesso de anidrido acético, em presença de ácido sulfúrico, seguido de hidrólise com ácido diluído em temperatura moderada para remoção das hemiceluloses. Os resultados indicaram um aumento de 0,5, 1,8 e 13,5% em massa, na taxa de conversão para palha de trigo, fibra de milho e casca de arroz sem tratamento, respectivamente, após o pré-tratamento. Logo, o pré-tratamento utilizado para hidrolisar as hemiceluloses também foi útil para aumentar o ganho de massa do acetato de celulose (Sun, 2010).
22
temperatura e a proporção molar entre os reagentes de derivatização da celulose. Em segundo lugar, a introdução dos grupos substituintes é feita com regularidade ao longo da estrutura da celulose. Por último, as propriedades físico-químicas dos produtos obtidos são controladas mais facilmente do que aquelas preparadas em condições heterogêneas (Sun, 2010).
A acetilação da celulose em fase homogênea necessita de três passos, que são: ativação da celulose, dissolução da mesma e reação com o agente de derivatização. Para tais passos acontecerem é necessário o tratamento com solventes, como água, metanol e
N,N-dimetilacetamida (DMAc), por destilação parcial e aquecimento da celulose sob
pressão reduzida. Por fim a reação com um agente de acetilação pode acontecer mediante a presença de um catalisador ou não. El Seoud et al., (2000) acetilaram
línteres de celulose de algodão, sisal e bagaço de cana em fase homogênea sob condições de DMAc/LiCl (Figura 7) da seguinte forma: a celulose e o LiCl foram aquecidos a 110°C sob pressão reduzida, a seguir a celulose foi dissolvida em DMAc/LiCl a 155°C por uma 1 h e arrefecida até 60°C. Por fim, ao polímero já solubilizado foi adicionado um agente de acetilação e mantido a 60°C por 18 h. Os pontos positivos citados sobre esse procedimento foram alta reprodutibilidade do GS, pouca degradação da celulose e recuperação da DMAc e do ácido acético (Sun, 2010).
Dissolução Acetilação
Celulose (2 g)
Solução de celulose
Derivado de celulose
*5 g LiCl *60°C por 1 h
*110°C por 0,5 h, sob 2
mmHg *agente de acetilação
*60 mL DMAc *60°C por 18 h
*150°C por 1 h
Figura 7 – Procedimento de acetilação da celulose em DMAc/LiCl.
Fonte: Sun, 2010, p. 157.
3.7.2. Esterificação da celulose e lignocelulósicos com anidridos cíclicos de ácido carboxílico
23
a utilização de hidrogéis superabsorventes biodegradáveis tem sido muito estudada nos últimos anos (Sun, 2010).
A acilação da celulose com anidridos cíclicos de ácido carboxílico gera derivados de celulose que possuem um ou mais grupos ácido carboxílico em sua estrutura, e com isso os derivados podem ser utilizados no tratamento de águas residuárias, já que são capazes de adsorver íons metálicos em solução aquosa (Sun, 2010).
Liu et al., (2007) realizaram a succinilação da celulose do bagaço de cana em
líquido iônico sem a presença de catalisador. Os resultados obtidos indicaram que o grau de substituição foi relativamente baixo, GSmáx = 0,53 e houve degradação da
celulose durante o processo. Já a reação de celulose com anidrido ftálico indicou que houve a produção de monoéster celulósico e a análise por CP/MAS 13C RMN indicou
que houve reações nas hidroxilas nas posições C-6, C-3 e C-2.
Já Chadlia et al., (2010) modificaram a Posidonia, uma planta aquática, com os
anidridos maleico e ftálico usando tripropilamina como catalisador e na ausência de solvente. Estes pesquisadores observaram que o número de funções ácidas introduzidas no material aumentou com o aumento da quantidade de anidrido, do tempo reacional e com o aumento da temperatura de 100ºC para 130ºC. O nCOOH variou de 1,5 a 5,7 mmol/
g e de 0,45 a 3,3 mmol/g para os anidridos maleico e ftálico, respectivamente.
A succinilação do bagaço de cana foi realizada por Gurgel et al., (2008). Eles
reagiram o bagaço de cana (5 g) com anidrido succínico (15 g), na presença de piridina (50 mL) sob refluxo, durante 24 h. Transcorrido o tempo necessário, o sólido foi filtrado e lavado com ácido acético em cloreto de metileno (1 mol/L), etanol, água destilada, solução de ácido clorídrico (0,01 mol/L) e acetona. Por fim o material foi seco em estufa a 80°C durante 1 h. O ganho de massa obtido foi de 89,6%, enquanto o número de funções ácidas introduzidas foi 5,6 mmol/g.
3.7.2.1. Esterificação da celulose com anidridos ftálico e trimelítico
A esterificação da celulose com os anidridos ftálico (AF) e trimelítico (AT) pode se dar através da reação da celulose com AF ou AT, utilizando solventes polares e um catalizador, como por exemplo, dimetilsulfóxido (DMSO), N,N-dimetilacetamida
24
(TEA) como catalisadores, mediante aquecimento (Melo et al., 2010; Gun Ko et al.,
2010; Liu et al., 2007; Kurita et al., 2002; Matuana et al., 2001).
Liu et al. (2007) realizaram a acilação de celulose ao solubilizarem a celulose
isolada do bagaço de cana (0,405 g) em cloreto de 1-butil-3-metilimidazólio ([C4min]Cl) (10 mL), mediante aquecimento de 100° C por 12 h.
À solução de celulose em líquido iônico foi adicionado o anidrido ftálico (0,74-3,7 g) sob atmosfera de N2, e o sistema foi aquecido em diferentes temperaturas
(85-105°C) e tempos de 20-120 min. A celulose modificada foi precipitada em etanol e o sólido foi separado por filtração, lavado com etanol a fim de eliminar excessos não reagidos de líquido iônico e anidrido. O material modificado foi seco sob vácuo a 50°C durante 16 h.
Os pesquisadores relataram que o grau de substituição (GS) da celulose variou entre 0,12 e 2,54, e o número de funções ácidas (nCOOH) introduzidas na celulose variou
entre 0,67 e 4,72 mmol/g. O aumento do nCOOH se deu com o aumento da temperatura
até 100°C, com o aumento da razão molar anidrido ftálico/celulose e com o aumento do tempo reacional.
A ftalação do bagaço de cana também foi feita por Liu et al. (2006). Eles
suspenderam o bagaço de cana (5 g) em piridina anidra (50 mL) a 30°C sob incidência de radiação ultrassom durante tempos determinados (10-40 min). À suspensão foi adicionado o anidrido ftálico (2,5-7,5 g) e o sistema foi agitado e aquecido (80-115°C) durante certo tempo (30-150 min). A reação foi interrompida após o tempo necessário e arrefecida até temperatura ambiente. O sólido foi filtrado e lavado com solução de ácido clorídrico 0,1 mol/L, água destilada e metanol para remover excesso de anidrido ftálico e piridina. O material foi seco sob vácuo a 50°C por 15 h.
Os ganhos de massa obtidos variaram entre 6,1 e 39,1% e foi observado que o efeito positivo na ftalação do bagaço de cana se dava com a incidência da radiação ultrassom, com o aumento do tempo reacional e da quantidade de anidrido ftálico. Além disso, os pesquisadores observaram que em temperaturas superiores a 100°C ocorreu degradação do material.
Já Gun Ko et al. (2010) obtiveram o ftalato de celulose a partir da reação de