FORMAÇÃO DE INIBIDORES BOWMAN BIRK DURANTE A
GERMINAÇÃO DE Macrotyloma axillare
Catalogação: sisbin@sisbin.ufop.br
C421F CÉSAR, JORGINO JULIO.
Formação de inibidores bowman birk durante a germinação de macrotyloma axillare. [manuscrito] / Jorgino Julio Cesar. – 2006.
xix, 96f.: il., color; graf., tabs.
Orientador: Prof. Dr. Milton Hércules Guerra de Andrade. Área de concentração: Bioquímica estrutural e fisiológica.
Dissertação (Mestrado) – Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de pesquisas em ciências Biológicas.
DEPARTAMENTO DE CIÊNCIAS BIOLÓGICAS NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
FORMAÇÃO DE INIBIDORES BOWMAN BIRK DURANTE A
GERMINAÇÃO DE Macrotyloma axillare
AUTOR: JORGINO JULIO CESAR
ORIENTADOR: Prof. Dr. Milton Hércules Guerra de Andrade
Dissertação submetida ao programa de
Pós-Graduação do Núcleo de Pesquisas em Ciências
Biológicas da Universidade Federal de Ouro
Preto, como parte integrante dos requisitos para
obtenção do título de Mestre em Ciências
Biológicas, área de concentração: Bioquímica
Estrutural e Fisiológica.
+
,$
- "
$ #
.
-$
#
/ # $,
-
.
"
-$
0
- " # $# 1
# ,
.
" # $# #
" . "$1
-,$
1 #
#2 3
A Deus, nosso pai Eterno, criador e
mantenedor dos céus e da terra, a Ele, pois
toda a Glória e Louvor!!! Quem tem me
ajudado até aqui em todos os âmbitos de
minha vida. A Deus o meu reconhecimento,
pois sem Ele não estaria onde estou hoje.
# $ (
. $
$
" 8$ $ !/
. % #9
# .
*
0
* ":
# $ #$
,
9
#
#;
#$
"
9
#
#
# # $
(
$
$ <; 2
$
,
9
9= . 9
#
# #
. 9
" . #
#
"
*
* ":
;
>$ . 9
"
* =
9 #
$
9
* ":
2
#
>$
#;. 8 >$
8$
!/
9/
<
. 9
"
* .
9
#
<;
>$ /
,
"
.
# /# 9
>$
/
# /#
$# % #9 9
# #.
# #$
#
"
*
9
* #
2
? "
>$
9
#
#&
; 9
>$ "
>$
9
! -$
$#
$
.
9
8 /
( *
8 , ! *
2
#
9 "
- ! -$
9
# " *
" #
$
" <; "
& "
#
$
= . #$
,
9
<;
"
. 9
"
2 (
>$
9
-* 9
9
# # #
9
" : " .
9
9 "-"
*
$ "
.
#9
#
$#
* 2
# $ >$
# , 8 /
9
<;
"
# #. 9
9 " : " . 9
#9
#
#9
1$
9
$
9
$,
@ 2
)
!
"
9
(
2
2
A/ "$
$
. #$
,
9
<;
"
. 9
#
9
#
$
"
= "
"
.
# /# 9
" <;
" " $ ;
<; 2
"
,
#;
"
& " 6
"
$ /
0
"
$ &9
*
0
%
< *
0 !/
8 /
!
0
C
0 8 / D
0
0
-$
"
0
,
#0
$"
E
F #
9 "
9
1$
$
"
%9
* 9
/ #
9
%9 #
2
# 9 "
/" " 8 / A
>$
, 9
#9
. 9
9
<;
*
#
#9
1$
/ "
9
>$ "&*
# #
"
<;
"
.
# =
* * #
9 >$
222
,
# ,
"
$ /
9
$,
@ .
"
1$
#
<;
, # <;
.
,
9
"
$
"
2
G #
>$
# , H-
* . >$
#9
#9
,
$ <;
#
#
$#
,
# , B
,
9
"
* .
" #9
#
< 2 C ":
#9
#
$ $# #
# , 2
>$
#
/ 9 *
BBB
,
# ,
D
! $ .
I
" " 9
" #9
# .
#
9
# #
"
<; 2
"
,
#
. 9 "
$
" 9
$#
9 $"
"
$# # $
=
$
% "$<;
9
%9 #
.
#
>$ "
$
# # , 2
1
# $
"
" :# " 2
9
'(
. #
9 "
J>$
>$ "
#
# "
$ *
#
. ,
<
$,
@
9 "
2
G !
9
#
.
# # .
. 9
#9
.
*
" <;
#
*
$
= #
9
$ "
$
2 (
>$
>$
"
# 9
" 1$
>$
;
"
#
,
" #
.
#
"
>$
$
#
# /#
;
"
9
#9
# #
# #=
# $ "
<; 2
#
Diferentes frações de inibidores do tipo Bowmam-Birk foram isolados de sementes e cotilédones germinados por 120h da Macrotyloma axillare. Foram realizadas extrações em meio ácido com e sem a etapa de tratamento térmico. Os extratos foram fracionados por precipitação etanólica (fração 60-80%), cromatografia de troca catiônica (
S-sepharose), cromatografia de troca aniônica (Q-sepharose) e fase reversa (HPLC).
Proteomic analysis of Macroyiloma axillare Bowman-Birk inhibitors reveals the presence of only two species of 8 kDa with little variations on mass and charge which correspond to different proportions of amination of Glu and Asp residues present in molecules. The 120h-germinated cotyledons present several isoforms resulting from proteolytic processing which present a higher inhibitory activity. Limited proteolysis results in negative charge decrease, thus reducing the size in 1 kDa. These results differ from those described for Dolichos biflorus, a plant of the same genus, due to the complex composition in different types of inhibitors. General enzymatic
INDICE
1. Introdução ...2
1.1 Bowman Birk - Descrição geral ...2
1.2 Propriedades físico-químicas dos BBI...2
1.3 Métodos de purificação...3
1.4 Resíduos de aminoácidos envolvidos na interação com as enzimas proteolíticas ..3
1.5 Mecanismo de ação dos inibidores Bowman Birk ...5
1.6 Funções na planta ...6
1.6.1 Papel dos inibidores de protease na defesa contra insetos predadores ...7
1.6.2 A síntese de inibidores de protease é estimulada por injúrias na planta ...8
1.7 Proteólise do inibidor do tipo Bowman-Birk durante a germinação...9
1.7 Perfil do BBI de Dolichos biflorus durante a germinação e desenvolvimento da semente ...10
1.8 Formação de Inibidores do tipo Bowman-Birk durante a germinação de Dolichos biflorus...11
1.9 Proteases estocadas e o processo de mobilização de proteínas armazenadas durante a germinação...11
1.9.1. Síntese das enzimas proteolíticas...12
1.9.2 Vários tipos de enzimas proteolíticas são encontradas em sementes e cotilédones de diversas plantas ...12
1.10 Proteases envolvidas na maturação de sementes...13
1.11 A leguminosa Macrotyloma axillare...14
1.11.1. Inibidores da Macrotyloma axillare...15
2. Justificativa e objetivos...18
2.1 Justificativa...18
2.2 Objetivos Gerais ...18
2.3 Objetivos específicos ...18
3. Materiais e Metodologias...21
3.1. Determinação das Atividades Inibitórias ...22
3.1.1.Ensaio de inibição sobre a Tripsina Bovina ...22
3.2.1. Obtenção das Sementes da Macrotyloma axillare ...23
3.2.2. Obtenção dos cotilédones da Macrotyloma axillare ...23
3.2.3. Preparo do Extrato Bruto...24
3.2.4. Precipitação por Tratamento Térmico do EB 20%...24
3.2.5. Precipitação por Etanol a Frio ...24
3.2.6. Cromatografia de Troca Iônica em Q-Sepharose ...25
3.2.7. Dessalinização ...25
3.2.8. Cromatografia de Troca Iônica em S-Sepharose ...25
3.2.9. Cromatografia de fase reversa em cromatógrafo líquido de alta Efiviência - HPLC ...26
3.3 Caracterização do inibidor ...27
3.3.1. Determinação da Massa Molecular por Espectrometria de Massa ...27
3.3.2. Tabela de Purificação...27
3.4 Pesquisa e caracterização parcial de enzimas proteolíticas no extrato bruto de sementes e cotilédones...28
Foram utilizados os seguintes tipos de extratos a 20% p/v, extraídos por 12h a 4ºC com e sem tratamento térmico a 85ºC por 30 min. ...28
3.4.1.Extração em salina e glicina-HCl 0,1M pH 2,5 usando semente e cotilédone ...28
3.4.2.Ensaio de atividade com DL-BApNA e azocaseína. ...29
4. Resultados ...32
4.1 Purificação das Frações de inibidores BBI de sementes da Macrotyloma axillare ...32
4.1.1. Inibidores da Semente Tratada Termicamente ...32
4.1.2. Inibidores da semente não tratada termicamente...36
4.2. Purificação das Frações de inibidores dos cotilédones de Macrotyloma axillare 42 4.2.1. Inibidores do Cotilédone do Broto Tratado Termicamente...42
4.2.2. Inibidores do Cotilédone do Broto Não Tratado Termicamente ...50
4.3. Quadros gerais de purificação...61
65
4.4.2. Espectros de Massa de Isoformas do Cotilédone não Tratado
Termicamente...66
4.5 Pesquisa de protease na semente e cotilédone de Macrotyloma axillare...67
4.5.1. Condição de extração em salina 0,15 M - SEMENTE ...67
4.5.2. Condição de extração em salina 0,15 M - COTILÉDONE...68
4.5.3. Condição de extração em glicina HCl pH 2,5 – SEMENTE e COTILÉDONE ...68
4.5.5. Condição de extração em salina – Tratamento térmico ...69
5. Discussão ...71
6. Conclusões e Perspectivas ...78
K. Referências Bibliográficas ...80
BBI Inibidor Bowman Birk
HGI-I Dolichos biflorus inhibitor – Tipo I
HGGI-I Horsegram germininated inhibitor – Tipo I
MBI Mung Bean inhibitor
CPR`s Papain-like cisteíno protease
BSA Soroalbumina Bovina
DL-BApNA cloridrato de N-α
-benzoil-DL-arginil-p-nitroanilida
DMSO Dimetilsulfóxido
EB Extrato Bruto
TT Tratamento Térmico
NT Não Tratado Termicamente
EB TT Extrato Bruto Tratado Termicamente
EI Complexo enzima-inibidor
HPLC Cromatografia líquida de alta eficiência
IP Inibidor de proteinase
L-BTpNA cloridrato de N-α-benzoil-L-tirosil-p-nitroanilida
TCA 10% Ácido tricloroacético a 10% p/v
TFA Ácido trifluoracético
tris-HCl Tris-hidroximetil-aminometano
PMSF Fenilmetanosulfonil fluoreto
1,10 Fenantrolina Orto-fenantrolina
TLCK Tosil lisil clorometil cetona TPCK Tosil fenilalanil clorometil cetona
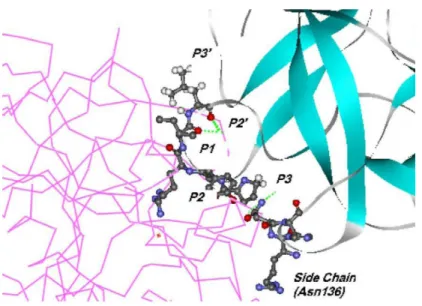
Figura 1: Esquema representativo da interação entre tripsina (domínios identificados em magenta e verde) e um inibidor Bowman-Birk (representado em modelo de
bastões e bolas),segundo(Sattar e cols., (2004)....4
Figura 2: Regulação do desenvolvimento de cisteíno proteases (CPR) e sua mobilização durante germinação da semente e crescimento do embrião em ervilhaca (Vicia sativa L.). A quantidade das enzimas foi detectada por ensaio de
immunoblot e está representada pela barra escura. (+) indica a presença da
enzima no embrião central e cotilédone. baseado em Muntz e cols., (2001)...13
Figura 3: Macrotyloma axillare; à esquerda, foto da planta adulta e à direita , foto das sementes (FAO - FOOD AND AGRICULTURE ORGANIZATION OF THE
UNITED NATIONS, 2003)...14
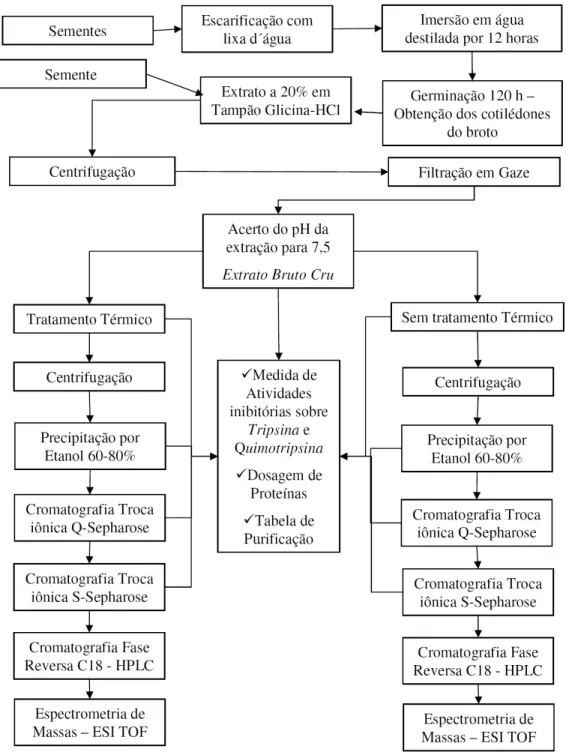
Figura 4: Fluxograma representativo das etapas de purificação dos inibidores BBI de
sementes e cotilédones da Macrotyloma axillare...21
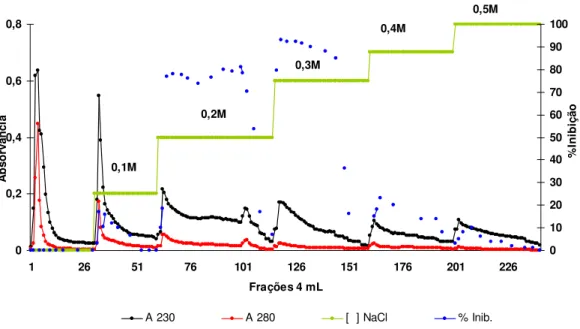
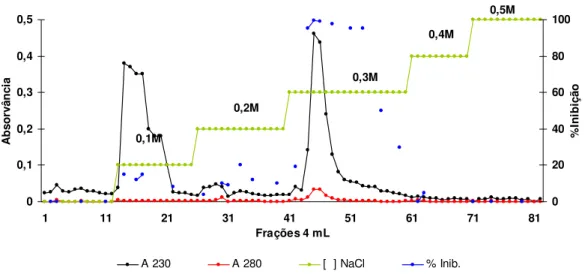
Figura 5: Perfil cromatográfico de Troca Aniônica em Q-Sepharose-(Pharmacia LKB Biotechnology) da fração TT 60-80 proveniente das sementes com tratamento térmico . Coluna cromatográfica de dimensões de 6,0cm x 1,5cm equilibrada em
tampão NH4HCO3 0,01M pH 8,5; fluxo cromatográfico de 1ml/min....32
Figura 6: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração Q2 TT- semente tratada termicamente.Coluna
cromatográfica com dimensões de 6,0 cm x 1,5 cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....33
Figura 7: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração S-Sepharose pH 3,0 da fração Q3 TT semente tratada
termicamente.Coluna cromatográfica com dimensões de 6,0 cm x 1,5 cm
equilibrada em tampão acetato de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....34 Figura 8: Perfil cromatográfico em HPLC da amostra Q2S4 TT. Coluna cromatográfica
utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu® (octadecil silano
utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu® (octadecil silano
– C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de 1ml/min....35
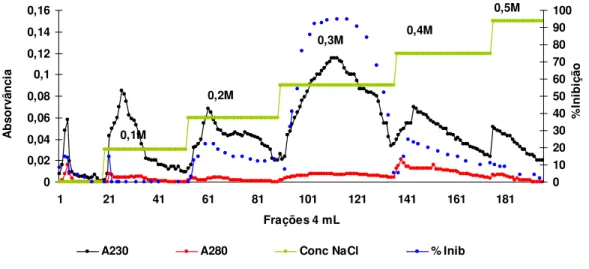
Figura 10: Perfil cromatográfico de Troca Aniônica em Q-Sepharose-(Pharmacia LKB Biotechnology) da fração NT 60-80 proveniente das sementes sem tratamento térmico . Coluna cromatográfica de dimensões de 6,0cm x 1,5cm equilibrada em
tampão NH4HCO3 0,01M pH 8,5; fluxo cromatográfico de 1ml/min....36
Figura 11: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração S-Sepharose pH 3,0 da fração Q3 – semente não tratada
termicamente.Coluna cromatográfica com dimensões de 6,0 cm x 1,5 cm
equilibrada em tampão acetato de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....37 Figura 12: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração Q4 – semente não tratada termicamente.Coluna
cromatográfica com dimensões de 6,0 cm x 1,5 cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....38
Figura 13: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração Q5 – semente não tratada termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....39
Figura 14: Perfil cromatográfico em HPLC da amostra Q3S3NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....40 Figura 15: Perfil cromatográfico em HPLC da amostra Q 4S2NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....41 Figura 16: Perfil cromatográfico em HPLC da amostra Q4S3NT. Coluna cromatográfica
utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu® (octadecil silano
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
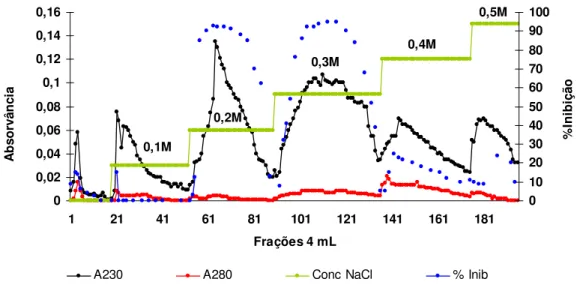
1ml/min....42 Figura 18: Perfil cromatográfico de Troca Aniônica em Q-Sepharose-(Pharmacia LKB
Biotechnology) da fraçãoTT 60-80 proveniente dos cotilédones do broto com tratamento térmico. Coluna cromatográfica de dimensões de 6,0cm x 1,5cm
equilibrada em tampão NH4HCO3 0,01M pH 8,5; fluxo cromatográfico de
1ml/min....43 Figura 19: Perfil cromatográfico de Troca Catiônica em S-Sepharose pH 3,0
(Pharmacia LKB Biotechnology) da fração BQ0TT . Coluna cromatográfica de
dimensões de 6,0cm x 1,5cm equilibrada em tampão NH4HCO3 0,01M pH 8,5;
fluxo cromatográfico de 1ml/min....44
Figura 20: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração BQ1 – cotilédone tratado termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....45
Figura 21: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração BQ2 – cotilédone tratado termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....46
Figura 22: Perfil cromatográfico em HPLC da amostra BQ0S2TT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....47 Figura 23: Perfil cromatográfico em HPLC da amostra BQ0S3TT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....47 Figura 24: Perfil cromatográfico em HPLC da amostra BQ1S1TT. Coluna
1ml/min....48 Figura 25: Perfil cromatográfico em HPLC da amostra BQ1S2TT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....48 Figura 26: Perfil cromatográfico em HPLC da amostra BQ1S3TT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....49 Figura 27: Perfil cromatográfico em HPLC da amostra BQ2S2TT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....49 Figura 28: Perfil cromatográfico em HPLC da amostra BQ2S3TT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
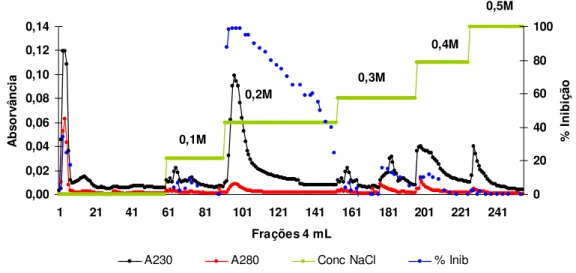
1ml/min....50 Figura 29: Perfil cromatográfico de Troca Aniônica em Q-Sepharose (Pharmacia LKB
Biotechnology) da fração NT 60-80 proveniente dos cotilédones do broto, sem
tratamento térmico.Coluna cromatográfica com dimensões de 6,0 cm x 1,5 cm
equilibrada em tampão NH4HCO3 0,01M pH 8,5; fluxo a 1ml/min....51
Figura 30: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração BQ0NT– cotilédone não tratado termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....52
Figura 31: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração BQ1NT– cotilédone não tratado termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....53
Figura 32: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....54 Figura 33: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração BQ4NT– cotilédone não tratado termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....55
Figura 34: Perfil cromatográfico de Troca Catiônica em S-Sepharose (Pharmacia LKB
Biotechnology) da fração BQ5NT– cotilédone não tratado termicamente. Coluna
cromatográfica com dimensões de 6,0cm x 1,5cm equilibrada em tampão acetato
de amônio 0,05M pH 3,0; fluxo cromatográfico de 1ml/min....56
Figura 35: Perfil cromatográfico em HPLC da amostra BQ0S2NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....57 Figura 36: Perfil cromatográfico em HPLC da amostra BQ0S3NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....57 Figura 37: Perfil cromatográfico em HPLC da amostra BQ1S2NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....58 Figura 38: Perfil cromatográfico em HPLC da amostra BQ1S3NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....58 Figura 39: Perfil cromatográfico em HPLC da amostra BQ3S2NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....59 Figura 40: Perfil cromatográfico em HPLC da amostra BQ3S3NT. Coluna
1ml/min....59 Figura 41: Perfil cromatográfico em HPLC da amostra BQ4S2NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....60 Figura 42: Perfil cromatográfico em HPLC da amostra BQ5S2NT. Coluna
cromatográfica utilizada SHIM-PACK CLC-ODS (M) 228 17873-92 -.Shimadzu®
(octadecil silano – C18) de 25cm de comprimento, partículas de 5 µµµµm, fluxo de
1ml/min....60 Figura 43: Espectrograma da amostra Q4S2 NT2-2.Tempo de retenção na fase reversa
= 5,52 minutos (pico 2)...65
Figura 44: Espectrograma da amostra BQ1S3 NT1-2. Tempo de retenção na fase
reversa = 7,157 minutos...66
Figura 45: Expansão do eixo das massas de 1440 a 1470 Da do espectrograma
anterior (BQ1S3 NT1-2)...66
Figura 46: Curva padrão dosagem de proteína pelo método de Lowry...89 Figura 47: Espectrograma da amostra Q3S3 NT1-1.Tempo de retenção na fase reversa
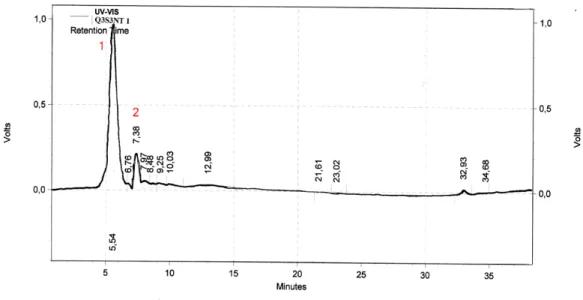
= 5,54 minutos (pico 1)...90
Figura 48: Espectrograma da amostra Q4S3 NT1-1.Tempo de retenção na fase reversa = 7,39 minutos...90 Figura 49: Espectrograma da amostra Q4S3 NT1-4. Tempo de retenção na fase reversa
= 11,12 minutos...91 Figura 50: Espectrograma da amostra Q5S2 NT1-3. Tempo de retenção na fase reversa
= 9,81 minutos...91 Figura 51: Espectrograma da amostra BQ0S2 NT1-1.Tempo de retenção na fase
reversa = 7,398 minutos...92
Figura 52: Espectrograma da amostra BQ0S2 NT1-2.Tempo de retenção na fase
reversa = 9,24 minutos...92
Figura 53: Espectrograma da amostra BQ0S3 NT1-1.Tempo de retenção na fase
reversa = 11,32 minutos...93 Figura 55: Espectrograma da amostra BQ1S3 NT1-3. Tempo de retenção na fase
reversa = 10,425 minutos...94
Figura 56: Espectrograma da amostra BQ3S2 NT1-1. Tempo de retenção na fase
reversa = 7,405 minutos...94
Figura 57: Espectrograma da amostra BQ3S2 NT1-2. Tempo de retenção na fase
reversa = 10,672 minutos...95
Figura 58:Espectrograma da amostra BQ3S3 NT1-3. Tempo de retenção na fase
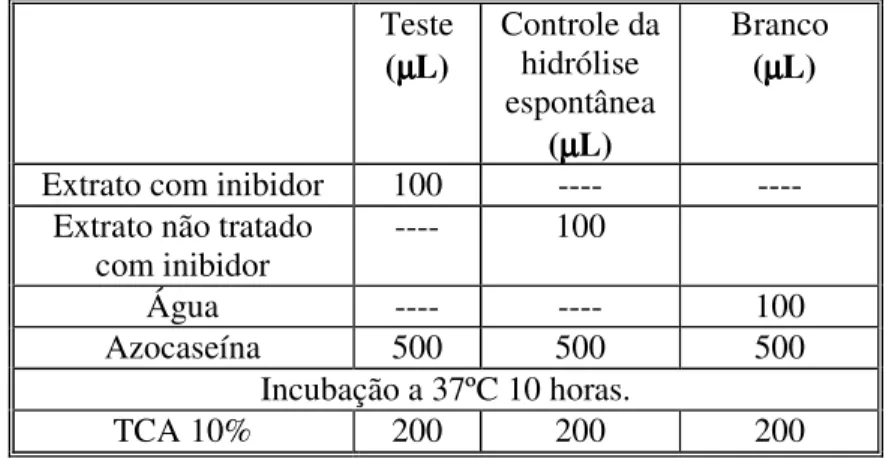
Tabela 1: Protocolo do ensaio de reação dos extratos protéicos com os respectivos
inibidores de proteases....29
Tabela 2: Volume ( em µµµµL ) dos reagentes a serem utilizados no ensaio de atividade
da protease da Macrotyloma axillare sobre a Azocaseína....30
Tabela 3:Tabela de purificação – semente não tratada termicamente – Inibição da
hidrólise do DL – BApNA pela Tripsina...61
Tabela 4: Tabela de purificação – semente não tratada termicamente – Inibição da
hidrólise do L – BTpNA pela Quimotripsina...61
Tabela 5:Tabela de purificação – cotilédone não tratado termicamente – Inibição da
hidrólise do DL – BApNA pela tripsina...62
Tabela 6: Tabela de purificação – cotilédone não tratada termicamente – Inibição da
hidrólise do L – BTpNA pela Quimotripsina...62
Tabela 7: Tabela de purificação – semente tratada termicamente – Inibição da hidrólise
do DL – BApNA pela tripsina...63
Tabela 8: Tabela de purificação – semente tratada termicamente – Inibição da hidrólise
do L – BTpNA pela Quimotripsina...63
Tabela 9: Tabela de purificação – cotilédone tratada termicamente – Inibição da
hidrólise do DL – BApNA pela tripsina...64
Tabela 10: Tabela de purificação – cotilédone tratada termicamente – Inibição da
hidrólise do L – BTpNA pela quimotripsina...64
Tabela 11: Incubação do extrato de semente de M. axillare extração em salina, sem tratamento térmico, com vários tipos de inibidores de protease . Substrato usado = BAPNA...67 Tabela 12: Incubação do extrato de semente de M. axillare extração em salina, sem
tratamento térmico, com vários tipos de inibidores de protease . Substrato usado = Azocaseina...67 Tabela 13: Incubação do extrato de cotilédones de M. axillare extração em salina, sem
tratamento térmico com vários inibidores de protease . Substrato usado = BAPNA
tratamento térmico, com vários tipos de inibidores de protease . Substrato usado = Azocaseína...68 Tabela 15: Comparação entre a seqüência N-terminal dos inibidores de Dolichos
biflorus presentes na semente e cotilédones do broto, segundo Sreerama,( 2002)74
Tabela 16: Tabela de homologia entre os inibidores DE-3 e DE-4 da Macrotyloma axillare e HGI-III da Dolichos biflorus a partir do alinhamento das pontes
dissulfeto...74 Tabela 17: Relação entre as massas moleculares encontradas EIMS e as massas
teóricas obtidas pela remoção de aminoácidos dos inibidores DE-3 e DE-4 de Joubert e cols. 1979, e aumentos de massa molecular proveniente da hidrólise de
1.
I
NTRODUÇÃO1.1 Bowman Birk - Descrição geral
As plantas contêm uma variedade de inibidores de serino proteases que podem ser divididos em 16 classes (Ryan, 1990). Entretanto, quatro classes são mais conhecidas: os inibidores de tripsina do tipo Kunitz de soja; os inibidores de Bowman Birk e os inibidores do tipo I e II, presentes na batata. Os Inibidores Bowman Birk (BBI) foram isolados e caracterizados pela primeira vez em sementes de soja (Bowman, 1946; Birk e cols., 1963) sendo, posteriormente, identificados em outras leguminosas (Norioka & Ikenaka, 1983) e gramíneas (Odanie cols., 1986).
Os BBI possuem em sua estrutura dois domínios ativos que podem agir de forma independente, pois em sua estrutura existem duas regiões distintas que inibem, de forma reversível, as enzimas semelhantes à tripsina e quimotripsina, sendo por essa razão, conhecidos como “inibidores de dupla-cabeça”. Tais domínios estruturais estão colocados simetricamente em lados opostos, onde as duas “cabeças” estão localizadas disponibilizando os sítios de ligação (Gariani e cols., 1999). Essas moléculas, geralmente possuem massa molecular que varia de 6 a 9 KDa e freqüentemente apresentam sete ligações dissulfeto altamente conservadas.
O papel fisiológico dos BBI foi associado a três principais funções: regulação da atividade de proteínas endógenas;
reserva de aminoácidos sulfurados ;
defesa contra ataques de patógenos e insetos. Nesse caso os BBI parecem atuar inibindo a atividade proteolítica das enzimas digestivas desses organismos, retardando o desenvolvimento e a reprodução (Tanaka e cols., 1996; Pompermayer e cols., 2001; Tiffin & Gaut, 2001).
regulação de proteólise na semente
1.2 Propriedades físico-químicas dos BBI
hidrogênio. Assim sua estrutura tridimensional apresenta-se muito estável, garantindo a sua atividade mesmo em condições desfavoráveis (Osmane cols., 2002).
Estudos de avaliação da resistência de inibidores de leguminosas frente a diferentes valores de pH têm sido alvo de várias investigações que demonstraram uma perda maior de atividade inibitória em meio alcalino, provavelmente devido à destruição das ligações dissulfeto que são responsáveis pela manutenção da estrutura tridimensional nativa (Friedman, 1984; Obara & Watanabe, 1971).
O conhecimento da estabilidade frente a variações de temperatura e de pH desses inibidores constitui uma importante ferramenta nos processos de purificação dos BBI. A redução do conteúdo protéico de extratos brutos por desnaturação térmica de outras proteínas diminui a complexidade desses extratos e facilita a obtenção e o isolamento dos inibidores de proteases, uma vez que esses tratamentos alteram pouco a atividade do inibidor, mas muda a sua distribuição na amostra. O tratamento térmico suprime a atividade de frações com maior quantidade de carga (Oliveira & Andrade, 2004).
1.3 Métodos de purificação
O extrato total aquoso de proteínas de sementes pode conter peroxidases, que são constituintes protéicos importantes de sementes (Gillikin & Graham, 1991). Para contornar esse problema é comum utilizar a extração com etanol 60%v/v seguida de precipitação com acetona gelada (Werner & Wemmer, 1991). Tendo em vista a presença de fosfolipídios, os pós de semente são desengordurados em Soxhlet com fases azeotrópicas de etanol absoluto e hexanoou simplesmente etanol a 95% (Sessa & Wolf, 2001). Os extratos, tratados com os procedimentos citados acima, são submetidos aos diversos procedimentos cromatográficos. A troca iônica e filtração molecular têm sido empregadas com maior freqüência.
é denominado P1 e aqueles que se situarem à montante da carbonila envolvida na hidrólise serão numerados gradativamente, P2, P3, e assim sucessivamente; e os aminoácidos que se situarem à jusante daquele serão numerados da seguinte forma: P1’, P2’ e assim sucessivamente. Os sítios de interação da enzima em posições correspondentes aos aminoácidos do peptídeo que se acomodam no sítio catalítico são denominados S1, S2, S1’, S2’, conforme figura 1.
Figura 1: Esquema representativo da interação entre tripsina (domínios identificados em magenta e verde) e um inibidor Bowman-Birk (representado em modelo de bastões e bolas),segundo(Sattar e cols.,
(2004).
Embora as análises das seqüências das alças de inibição revelem que essas sejam extremamente conservadas (McBride e cols., 1998; Odani & Ikenaka, 1973) os BBI apresentam variações pontuais muito importantes que podem modificar suas especificidades; sendo as posições mais relevantes os resíduos que se encontram em P1 e P2'. Na natureza ocorrem inibidores que tipicamente tem os seguintes resíduos em P1 que determinam a especificidade primária para as enzimas: leucina e fenilalanina (α -quimotripsina), alanina (elastase pancreática), arginina ou lisina (tripsina). Variações na posição P2’ resultam em diferenças na estabilidade do inibidor quanto à sua velocidade de hidrólise (Gariani & Leatherbarrow, 1997).
desta posição na interação com a enzima. A presença em P2’ do aminoácido isoleucina resulta em um valor baixo da constante de inibição, da mesma maneira as substituições por outros aminoácidos com cadeia lateral alifática melhoram bastante a potência inibitória. Aminoácidos carregados positivamente como arginina e lisina são bem tolerados e produzem constantes relativamente baixas; já as substituições com cadeias laterais dotadas de cargas negativas resultam em inibidores pobres, o resíduo de glutamato, por exemplo, praticamente não possui atividade inibitória, apresentando um valor de constante de inibição superior à ordem de 1 mM (Garianie cols., 1999).
O aminoácido serina em P1’ é altamente conservado, mas em peptídeos sintéticos a substituição por alanina apresentou uma boa tolerância, demonstrando que este resíduo não é essencial para a integridade da alça reativa (Brauer & Leatherbarrow, 2003).
1.5 Mecanismo de ação dos inibidores Bowman Birk
Esses inibidores são proteínas semelhantes aos substratos protéicos de elevada afinidade, os quais inibem fortemente a atividade catalítica de enzimas proteolíticas. Os BBI se encaixam tão bem nos sítios enzimáticos, que proíbem as mudanças de conformação necessárias à catálise, gerando um complexo típico EI (enzima-inibidor) com uma barreira energética desfavorável à hidrólise, sendo assim muito estável (Longstaffe cols., 1990; R.Read, 1986).
1.6 Funções na planta
Na fisiologia da planta os inibidores atuam como reguladores de proteólise na semente, além de serem considerados como proteínas de estoque, principalmente de aminoácidos sulfurados (Ryan, 1973). Esses inibidores têm também a função de atuarem como compostos de defesa contra pestes por ação direta, inibindo proteases dos possíveis predadores (Lawrence & Koundal, 2002).
A interação prolongada com proteases na semente pode provocar a quebra de pequenos peptídeos que vão gerar isoformas em quantidades e atividades diferentes. Durante o processo de germinação ocorrem mudanças na composição de isoformas existentes na semente, provavelmente, em decorrência a proteólises que resultam em pequenas modificações da composição de aminoácidos (Kumar e cols., 2002). Modificações ocorridas em determinadas isoformas e a não alteração de outras, sugere que as diversas estruturas, inibidores e proteases, tenham papéis diferentes na planta (Kumare cols., 2002).
Os inibidores de proteases comumente encontrados em plantas das famílias
Solanaceae e Fabaceae aparecem como constituintes protéicos em diferentes fases da
vida vegetal, sendo que é na semente onde aparecem os mais elevados níveis dessas moléculas. Durante o estágio de maturação da semente, os vegetais acumulam um grande número de proteínas de estoque, sendo que as de maior quantidade são as glicininas e as β-conglicininas (Tange cols., 1993).
Os níveis finais das várias proteínas que aparecem na semente dependem da transcrição, tradução e da renovação dessas proteínas. Para alguns peptídeos, esse processo pode exibir variações cronológicas durante a maturação das sementes, variações essas que podem ser importantes para o esclarecimento das funções fisiológicas dos inibidores na planta. Algumas isoformas de inibidores estão presentes principalmente em determinada fase do desenvolvimento da planta, como semente ou broto (Gatehousee cols., 1986; Meinkee cols., 1981; Asghar & Demason, 1990).
demonstraram que os inibidores do tipo Kunitz aparecem mais cedo na região abaxial e persistem durante todo o processo de maturação da semente.
O aparecimento de novas formas de inibidor durante o processo de germinação concomitante ao desaparecimento de formas provenientes da semente madura, a constatação de inibidores com atividades inibitórias e mobilidades eletroforéticas semelhantes sugeriram que as novas formas são resultantes de processamentos proteolíticos a partir do inibidor da semente. Análises da seqüência de aminoácidos de várias formas de algumas espécies vegetais demonstram a existência de uma grande homologia, com pequenas diferenças encontradas principalmente nas regiões amino e carboxi terminais, sugerindo modificações por ação de proteases específicas (Sreerama & Gowda, 1998).
1.6.1 Papel dos inibidores de protease na defesa contra insetos predadores
Devido ao ataque de insetos fitófagos a plantas, estas são capazes de sintetizar uma grande quantidade de moléculas para defendê-las contra o ataque de tais predadores e os inibidores de proteases são considerados as moléculas mais importantes para tal função biológica (Falcoe cols., 2001)
Apesar de não serem as proteínas mais abundantes, os inibidores de proteases são de grande importância no controle e desenvolvimento do embrião (Tang e cols., 1993). Quando expresso em plantas transgênicas, os inibidores de proteases tem demonstrado proteção a tais plantas contra o ataque de insetos predadores das famílias
Coleoptera e Lepdoptera (Jouanin e cols., 1998). Um exemplo interessante é a
clonagem de genes que codificam o inibidor de Glycine max do tipo Bowman-Birk
(SBBI) e do inibidor do tipo Kunitz (SKTI) na cana de açúcar (Saccharum officinarum
L.). Tal clonagem conferiu à cana-de-açúcar transgênica resistência contra o inseto
Diatraea saccharalis (Fabricius), um dos seus maiores predadores, o qual é responsável
por grandes perdaseconômicas nas plantações de cana de açúcar (Falco & Silva-Filho, 2003)
max mostraram serem tóxicos para larvas do besouro Tribolium confusum (Lawrence & Koundal, 2002). Sabe-se que hoje existem vários tipos de inibidores de protease ativos contra várias espécies de insetos, seja pela comprovação de ensaios in vitro entre o inibidor de protease e a respectiva protease do intestino do inseto, ou através de ensaios
in vivo onde os insetos são alimentados com dietas artificiais contendo o inibidor de
protease em estudo, neste caso verificando-se morte ou diminuição na taxa de crescimento do respectivo inseto (Kobayashie cols., 1998)
Os inibidores de protease apresentam um amplo espectro de atividade, incluindo a supressão do desenvolvimento de nematódeos patogênicos como Globodera
tabaccum, além de causar a inibição da germinação de esporos e até o crescimento de
micélio de fungos fitopatogênicos como Alternaria alternata e Trichoderma reesei.
(Dunaevskiie cols., 1997).
1.6.2 A síntese de inibidores de protease é estimulada por injúrias na planta
As folhas normalmente contêm baixos níveis de inibidores de proteases, mas quando sofrem determinada tipo de injúria, aumentam o seu teor (Green & Ryan, 1972). Em plantas jovens a concentração de inibidores de proteases aumenta pouco com o primeiro ferimento, mas se elevam substancialmente o teor dessa proteína com as injúrias subseqüentes o que corrobora com a hipótese do aumento da síntese de inibidores de proteases em diversos locais da planta por injúrias sucessivas (Pearce e cols., 1993). Em plantas jovens, que são mais vulneráveis, o investimento desses recursos de defesa após poucos ataques é intenso, mas em uma planta madura, tal resposta freqüentemente é menor (Wolfson & Murdock, 1990). Entretanto, injúrias diárias em plantas maduras de tabaco e batata resultam em um rápido aumento dos níveis de inibidor de tripsina somente nas folhas feridas, sugerindo que algumas plantas após a maturidade perdem a capacidade de propagar a síntese de inibidores de proteases em toda planta, mas conservam a defesa local (Wolfson & Murdock, 1990).
moléculas ativas; assim, é freqüente a ocorrência de inibidores com atividades inibitórias simultâneas sobre proteases e amilases em uma mesma molécula. Nesse caso mesmo havendo poucas moléculas do referido inibidor, este se porta como uma molécula multifuncional, possuindo a capacidade de inibir mais de um tipo de enzima (Jongsma & Bolter, 1997).
1.7 Proteólise do inibidor do tipo Bowman-Birk durante a germinação
As sementes dicotiledôneas geralmente contêm grande quantidade de reserva de nutrientes, tipicamente (mas não exclusivamente) nos cotilédones. Sementes de leguminosas são notáveis pela alta quantidade de inibidores de proteases (Laskowski & Kato, 1980). Durante a germinação e crescimento da semente essas reservas são mobilizadas em prol do crescimento da planta, servindo como precursores de metabólitos.
Alguns estudos demonstram que durante o processo de germinação ocorre o desaparecimento de formas de inibidores típicos das sementes, além do aparecimento de outras isoformas nos cotilédones. Por exemplo, observa-se o desaparecimento do inibidor de tripsina do tipo Bowman-Birk BBSTI-E em Glycine max e vários outros inibidores Bowman-Birk presentes nesta planta durante o crescimento da semente. Concomitante ao desaparecimento do inibidor de tripsina característico da semente (BBSTI-E) ocorre o aparecimento de um novo tipo de inibidor Bowman-Birk no cotilédone, BBSTI-D. O novo inibidor Bowman-Birk que surge em Glycine max
BBSTI-D é um produto oriundo de proteólise de BBSTI-E, a qual ocorre durante a germinação da semente. Tal proteólise resulta na remoção do dipeptídeo carboxi terminal Glu70-Asn71 na molécula de BBSTI-E. O inibidor BBSTI-D é derivado de BBSTI-E e não é um novo produto formado por um gene distinto (via síntese de novo) (Lorensene cols., 1981; Wilson & Chen, 1983).
Como observado para o inibidor de Glycine max (L.), o inibidor de tripsina
Bowman-Birk de mung bean (Vigna radiata) também sofre hidrólises durante o
1.7 Perfil do BBI de Dolichos biflorus durante a germinaçãoe desenvolvimento da
semente
Sabe-se que as sementes de leguminosas contem vários inibidores de serino protease, e exaustiva investigação tem apontado a presença principalmente de duas classes: os inibidores de Kunitz e os Inibidores de Bowman-Birk. Infelizmente faltam informações consistentes, relacionadas com o papel fisiológico de tais inibidores nas plantas (Godbolee cols., 1994).
Vários estudos demonstram que ocorre o aparecimento de isoformas de inibidores de serino protease com alteração da mobilidade eletroforética no cotilédone, por outro lado ocorre o desaparecimento de algumas formas presentes apenas nas sementes não germinadas (Pusztai, 1972; Wilson, 1988)
Quatro tipos de isoinibidores (isoformas de um mesmo inibidor) do tipo Bowman-Birk foram isolados e purificados a partir da semente não germinada de
Dolichos biflorus: HGI-I, HGI-II, HGI-III e HGI-IV. Foram observadas mudanças no
perfil eletroforético, em PAGE nativo, de inibidores quando se compara semente germinada e não germinada. Durante a germinação verifica-se o aparecimento de três novas isoformas, com mobilidades eletroforéticas reduzidas (Sreerama & Gowda, 1997).
Estudos do metabolismo de inibidores de protease de leguminosas durante a germinação e desenvolvimento do embrião têm sido dificultados pela multiplicidade de isoformas encontrados nessas plantas (Odani & Ikenaka, 1977; Domoneye cols., 1995). Observa-se a existência de quatro isoinibidores na semente de Dolichos biflorus não germinada e que estes quatro isoinibidores desaparecem, mas ocorre o aparecimento de novas espécies de inibidores com mobilidade eletroforética diminuída, quando analizados pela eletroforese nativa em gel de poliacrilamida (Native PAGE). A mobilidade eletroforética retardada destes novos inibidores formados durante a germinação reflete uma diminuição no teor de carga líquida negativa destes peptídeos (Sreeramae cols., 1997).
Dolichos biflorus contem grandes quantidades de resíduos de ácido aspártico e ácido glutâmico e a perda destes resíduos leva uma diminuição da carga líquida negativa da proteína, diminuição esta refletida em uma menor migração na Native PAGE (Prakashe cols., 1996).
1.8 Formação de Inibidores do tipo Bowman-Birk durante a germinação de Dolichos
biflorus
Três novos tipos de BBI’s (HGGI-I, II e III) aparecem nos cotilédones de
Dolichos biflorus depois de 120 horas de germinação da semente. Estes inibidores
diferem uns dos outros e também dos inibidores encontrados na semente não germinada pela composição de aminoácidos, pelo tamanho e também pela carga. A análise da seqüência amino-terminal desses inibidores indica que eles são derivados dos isoinibidores da semente não germinada por uma proteólise limitada (modificação pós traducional) e não pela via de síntese de novo. Tais inibidores diferem uns dos outros pela sua seqüência amino-terminal, por exemplo: HGGI-II é idêntico ao HGGI-I exceto pela perda de um simples resíduo amino-terminal de ácido aspártico. Tais eventos proteolíticos parecem ser catalisados por uma endoproteinase que é específica para o lado amino-terminal de resíduos ácidos da cadeia polipeptídica. (Kumare cols., 2002).
Durante a germinação de Dolichos biflorus, os BBI’s presentes nas sementes não germinadas modificam-se rapidamente durante a germinação e ocorre concomitantemente o aparecimento de novas espécies com potência inibitória modificada. Observa-se que os novos inibidores formados durante o processo de germinação apresentam uma atividade específica para tripsina cerca de cinco vezes maior quando comparada com a atividade específica dos inibidores da semente não germinada (Sreeramae cols., 1997; Kumare cols., 2002).
1.9 Proteases estocadas e o processo de mobilização de proteínas armazenadas
durante a germinação
Endopeptidases e carboxipeptidases são proteases presentes em sementes dormentes, mas toda a compreensão do papel dessas enzimas ainda constituem objeto de estudo. Em algumas plantas foi demonstrado que endopeptidases e carboxipeptidases estão envolvidas na degradação e mobilização de proteínas estocadas durante a germinação (Madisone cols., 1981; Muntze cols., 2001).
1.9.1. Síntese das enzimas proteolíticas
Precursores inativos de enzimas proteolíticas são sintetizados no retículo endoplasmático rugoso, local de onde eles são transportados por um sistema de endomembranas para compartimentos ligados à membrana; onde ocorrem devidas ativações das enzimas e proteólise limitada (Shutov & Vaintraub, 1987).
Proteínas de estoque não são acumuladas e mobilizadas apenas a partir dos tecidos de estoque, mas também a partir de órgãos axiais como a radícula e o broto. A mobilização de proteínas de estoque não começa em todas as regiões do embrião simultaneamente, mas sim em locais específicos (Smith, 1981).
1.9.2 Vários tipos de enzimas proteolíticas são encontradas em sementes e cotilédones de diversas plantas
Endo e exopeptidases estão presentes em sementes e cotilédones de plantas como, por exemplo: a presença de cisteíno-protease tipo papaína encontrada em cotilédones de pepino (Hara & Matsubara, 1980)e a família de proteases com especificidade para Asn (asparagina) no sítio de clivagem (legumaínas) (Hara-Nishimura, 1998). Proteases do tipo legumaína de Phaseolus vulgaris (feijão) também participam de processos de proteólise em cotilédones depois do início do processo de germinação (Bewley, 1997; Senyuke cols., 1998).
1.10 Proteases envolvidas na maturação de sementes
No início da germinação as enzimas proteolíticas tornam-se ativas para iniciar a quebra, ou seja, a mobilização de proteínas estocadas. Antes do início da germinação as proteases são mantidas em uma forma inativa, prevenindo assim uma quebra prematura das proteínas dentro das células (Ishii, 1994).
Em sementes de ervilhaca (Vicia sativa L.), cisteíno proteases tipo papaína (CPR`s) são responsáveis pela mobilização de proteína estocada. Foram analisados quatro membros da família de proteases tipo papaína e dois membros da família tipo legumaína cisteíno-protease. Conforme a Figura 2, observamos que ocorre o surgimento e/ou desaparecimento de determinados tipos de protease quando analisamos o embrião e os cotilédones, em função do tempo. Alguns tipos como, por exemplo, protB aparecem tanto no embrião quanto nos cotilédones após o início da germinação (Müntz, 1998).
Os respectivos RNAm que codificam todos as seis proteases são traduzidos em pré-pro-polipeptídeos que, em contato com determinadas enzimas sintetizam o peptídeo sinal e um propeptídeo. Os precursores das cisteíno proteases entram em vias secretórias e sofrem processamento pós-traducional via proteólise limitada. Algumas hipóteses alternativas que levam a ativação/inativação de enzimas proteolícas são (Okamoto & Minamikawa, 1998; Okamoto & Minamikawa, 1999):
Compartimentalização diferencial seguida pela fusão de uma enzima com o pro-protease, contida em outro compartimento celular;
Associação/dissociação de um dado inibidor (I) com a protease; Mudança de pH e mudança na concentração de íons.
1.11 A leguminosa Macrotyloma axillare
Essa planta é usada na pecuária e na agricultura como forrageira e adubação verde. A Macrotyloma axillare é uma leguminosa rasteira, contorcida, constituída de caules pilosos e com folhas verdes brilhantes trifoliadas. Suas flores são amarelo - esverdeadas e as vagens pilosas são ligeiramente reclinadas, contendo de 7 a 8 sementes por vagem. A M. axillare é uma planta de origem africana, com abundante distribuição na África Tropical e cresce vigorosamente no verão (United States Department of Agriculture - Plants Database, 2003).
Classificação Sistemática da Macrotyloma axillare
• Sinonímia: Dolichos axillaris (E. Meyer); Clitoria vividiflora (Boulton);
• Nomes Comuns: Archer (Austrália), Grama de cavalo perene (Perenial horsegram);
• Informações Taxonômicas (United States Department of Agriculture - Plants
Database, 2003):
o Reino: Plantae - Plantas
o Sub-Reino: Tracheobionta - Traqueófita (plantas vasculares) o Superdivisão: Spermatophyta - Plantas com sementes o Divisão:Magnoliophyta - Plantas com Flores
o Classe:Magnoliopsida - Dicotiledôneas o Sub-classe: Rosidae
o Ordem: Fabales
o Família:Fabaceae - Família das ervilhas o Gênero: Macrotyloma (Wight & Arnott) Verdc.
o Espécie: Macrotyloma axillare (E. Meyer) Verdc. – “horsegram”
1.11.1. Inibidores da Macrotyloma axillare
Em um trabalho desenvolvido por (Joubert e cols., 1979), foram encontradas duas isoformas do tipo Bowman Birk. As moléculas foram denominadas DE-3 e DE-4; sendo que o sequenciamento demonstrou alta homologia pelo alinhamento das ligações dissulfeto com outros inibidores da mesma classe já conhecidos.
Os trabalhos de Jourbert demonstraram que a isoforma DE-3 da Macrotyloma
axillare continha sítios reativos para tripsina e quimotripsina, constituídos dos resíduos
Lys26-Ser27 e Phe53-Ser54, respectivamente, enquanto que a isoforma DE-4, apresenta Lys26-Ser27 e Leu53-Ser54, idênticos ao da soja de acordo com (Odani & Ikenaka, 1972).
2.
J
USTIFICATIVA E OBJETIVOS2.1 Justificativa
Inibidores do tipo Bowman Birk são encontrados em diversas plantas, entretanto, apesar de vários estudos, o papel fisiológico dessas moléculas é ainda obscuro. Sampaio e cols., (1996) e Pompermayere cols., (2001) sugeriram que os BBI´s seriam proteínas estoque de aminoácidos sulfurados, entretanto nos cotilédones a manutenção da atividade inibitória e o aparecimento de isoformas mais ativas com massas moleculares reduzidas sugerem o envolvimento desses inibidores em outros mecanismos, como a proteção da planta nos estágios iniciais de desenvolvimento.
No processo de germinação, a degradação dos inibidores gera intermediários com atividades e características físico-químicas diferenciadas, possivelmente, pela remoção de resíduos carregados nas extremidades N e C-terminais pela ação de proteases específicas em proteólise limitada (Maddene cols., 1985). Além disso, formas intermediárias da proteólise limitada dos BBIs podem exercer um importante papel fisiológico na transição semente/broto da planta.
Sendo a Macrotyloma axillare, planta forrageira de farto crescimento em climas tropicais e um modelo de leguminosa para o estudo da fisiologia da germinação, o presente trabalho desenvolve estudos dos inibidores do tipo BBI presentes na semente e cotilédone dessa planta com os seguintes objetivos:
2.2 Objetivos Gerais
Estudar as isoformas de inibidores do tipo Bowman-birk presentes na semente e em cotilédones da Macrotyloma axillare; vislumbrando acompanhar modificações na composição de inibidores durante o processo de germinação da semente.
2.3 Objetivos específicos
A. Estabelecer método que permita o isolamento dos inibidores na semente e no cotilédone, preservando-se da melhor forma possível a estrutura original;
C. Estudar condições que minimizem o efeito da degradação proteolítica durante o processamento das amostras;
D. Estudar as modificações ocorridas no padrão de isoformas durante o processo de germinação;
E. Verificar se o processo de tratamento térmico constitui-se uma etapa imprescindível no processo de purificação do BBI, ou se este leva alguma modificação no padrão dos BBI`s ;
F. Quais modificações ocorrem com os perfis do inibidor quando a amostra é processada com e sem o tratamento térmico;
3.
M
ATERIAIS EM
ETODOLOGIASO isolamento e purificação das isoformas dos inibidores foi obtido segundo o esquema abaixo:
3.1. Determinação das Atividades Inibitórias
3.1.1.Ensaio de inibição sobre a Tripsina Bovina
A determinação da atividade tripsínica foi feita segundo Erlangere cols., (1961). O substrato usado foi o cloridrato de N-α-benzoil-DL-arginil-p-nitroanilida (DL-BApNA), que foi preparado dissolvendo-se 196mg do composto em 5mL de dimetilsulfóxido (DMSO) para obter concentração final de 9 x 10-2 M. Esta solução foi mantida no congelador como solução estoque e diluída 100 vezes no momento do uso com tris-hidroximetil-aminometano (tris-HCl) 0,1M contendo CaCl2 20mM pH 8,1 para a concentração de 9 x 10-4M.
O tubo “teste” (inibição da atividade tripsínica) foi constituído dos seguintes reagentes: DL-BApNA (9x10-2) 1000µL, Tripsina 100µL a uma concentração de
0,05mg/mL e 20µL das frações de purificação do inibidor, previamente diluídas em
tampão NH4HCO3 0,01M pH8,5.
O tubo “branco” foi constituído de 1000µL de substrato (DL-BApNA) e 120µL de água.
O tubo “controle” (referência da atividade Tripsínica) continha 1000µL de substrato (DL-BApNA); 100µL de enzima e 20µL de água.
Os tubos de reação foram homogeneizados e incubados em banho-maria a 37ºC por 20min. Após esse tempo, adicionaram-se 250µL de ácido acético 60%v/v para paralisar a reação e posteriormente quantificar a atividade enzimática pela medida da absorvância em 410nm.
Os dados obtidos com essas atividades inibitórias foram usados para a construção das tabelas de purificação.
O cálculo da percentagem de inibição foi feito tendo como base a absorvância do tubo controle da atividade enzimática que corresponde a 100% da atividade da enzima, ou seja, 0% de atividade inibitória. Para tal cálculo utilizou-se a seguinte equação matemática:
3.1.2.Ensaio de inibição sobre a Quimotripsina Bovina
A determinação da atividade quimotripsínica foi feita de acordo com (Erlangere cols., 1961). O substrato usado foi o cloridrato de N-α-benzoil-L-tirosil-p-nitroanilida (L-BTpNA) que foi preparado dissolvendo-se 182mg do composto em 5mL de DMSO para obter 9 x 10-2M. Esta solução foi mantida no congelador como solução estoque e diluída no momento do uso com tris-HCl 0,1M contendo CaCl2 20mM pH 8,1 e DMSO na proporção de 80% e 20% respectivamente, para a concentração de 9x10-4M.
O tubo “teste” (atividade de inibição da quimotripsina) foi constituído pelos seguintes reagentes: L-BTpNA 1000µL, Quimotripsina 100µL a uma concentração de 0,05mg/mL e 20µL das frações de purificação do inibidor, previamente diluídas em tampão NH4HCO3 0,01M pH 8,5.
O tubo “branco” foi constituído por 1000µL de substrato e 120µL de água,
enquanto que o tubo “controle” da atividade enzimática foi constituído de 1000µL de
substrato, 100µL de enzima e 20µL de água.
Os tubos de reação foram homogeneizados e incubados em banho-maria a 37ºC por 40min. Após esse tempo, adicionaram-se 250µL de ácido acético 60%v/v para
paralisar a reação e posteriormente quantificar a atividade enzimática pela medida da absorvância a 410nm.
3.2. Isolamento e Purificação do inibidor
3.2.1. Obtenção das Sementes da Macrotyloma axillare
As sementes da M. axillare foram adquiridas pela empresa Matsuda Sementes
Ltda localizada na cidade de Álvares Machado, estado de São Paulo.
Esse cultivar foi obtido do cruzamento artificial de dois cultivares comerciais da
Macrotyloma: Archer (Austrália) e Guatá (Indonésia), assim o nome da semente híbrida
desse cruzamento foi denominado Java.
3.2.2. Obtenção dos cotilédones da Macrotyloma axillare
penetração da água e deixar as sementes túrgidas para promover a quebra da dormência de maneira homogênea. As sementes escarificadas foram imersas em água destilada por um período de 12h, peneiradas e colocadas sobre papel de filtro (Whatman nº1) a temperatura ambiente e acompanhadas por 120 horas, mantendo-se adequadamente a umidade com pulverizações periódicas de água.
3.2.3. Preparo do Extrato Bruto
A extração protéica das sementes moídas ou cotilédones triturados foi realizada segundo metodologia proposta por Kumare cols., (2002). Desse modo, o extrato bruto foi preparado a partir de uma suspensão a 20% p/v em glicina HCl 0,1M pH 2,5 e deixada em repouso por 12 horas a 4°C e com agitação. Após o período de extração, a suspensão foi filtrada em gaze e o filtrado submetido à centrifugação a 4724g por 30 minutos a 4°C para remoção de fibras insolúveis presentes. Após a centrifugação o pH do extrato bruto é acertado para 7,5 usando hidróxido de amônio (NH4OH) concentrado. Esse extrato foi denominado Extrato Bruto a 20 % p/v (EB 20%).
3.2.4. Precipitação por Tratamento Térmico do EB 20%
Após acertar o pH para 7,5 o EB foi submetido a um processo de tratamento térmico, no qual a amostra é aquecida a 85ºC por 30 minutos. Vale ressaltar que o EB é rapidamente aquecido, de forma que em menos de um minuto sua temperatura varia de 4ºC para 85ºC, tendo assim um choque térmico.
Decorrido esse tempo de incubação a suspensão foi resfriada em banho de gelo e submetida a uma nova centrifugação a 4724g por 30 minutos a 4°C para remoção das proteínas precipitadas pelo calor. O sobrenadante foi então denominado Extrato Bruto Tratado Termicamente (EB TT). Para a fração de inibidor obtida sem o tratamento térmico, desconsiderar esta etapa.
3.2.5. Precipitação por Etanol a Frio
etanol, a suspensão era mantida em banho de gelo sob repouso por 15min. e centrifugada a 4°C por 30min. a 4724g.
Os volumes de etanol necessários para a precipitação de cada fração foram calculados segundo a equação (Scopes, 1987):
2 1 2
100
) (
1000 )
(
C C C ml
V
− −
= ; onde:
V é numericamente igual ao volume de etanol a ser adicionado a uma solução líquida pronta contendo C1%v/v para que a concentração se torne C2%v/v; para um litro
de solução inicial.
Os precipitados obtidos foram ressolubilizados em tampão NH4HCO3 0,01M pH 8,5, em seguida novamente centrifugados para remoção de proteínas insolúveis.
3.2.6. Cromatografia de Troca Iônica em Q-Sepharose
A fração 60-80% precipitada por etanol (EB 60-80%) foi aplicada em uma coluna cromatográfica com dimensões de 6,0 cm x 1,5 cm contendo resina trocadora com carga positiva (Q-Sepharose - Pharmacia LKB Biotechnology) equilibrada em tampão NH4HCO3 0,01M pH 8,5. Procedeu-se a eluição com o tampão de equilíbrio para remoção do material não ligado e posteriormente com NaCl dissolvido no mesmo tampão para obter os seguintes intervalos isocráticos 0,1; 0,2; 0,3; 0,4; 0,5 e 1,0 M. O fluxo cromatográfico foi mantido em 1mL/min, coletando-se frações de 4mL. A eluição de proteínas foi monitorada pela medida das absorvâncias em 280 e 230nm.
3.2.7. Dessalinização
Após a cromatografia de troca iônica em Q-Sepharose, aquelas frações eluidas em cada gradiente de sal e que apresentavam atividade sobre a inibição da tripsina bovina foram reunidas em um pool e dessalinizados utilizando-se coluna de exclusão molecular contendo Sephadex G25 Pharmacia (> 5KDa) com dimensões de 18cm x
3,5cm.
3.2.8. Cromatografia de Troca Iônica em S-Sepharose
Aquelas frações com atividades inibitórias provenientes da cromatografia em
1,5 cm contendo resina trocadora com carga negativa (S-Sepharose - Pharmacia LKB
Biotechnology) equilibrada em tampão acetato de amônio 0,05M, pH 3,0. Procedeu-se a
eluição com o tampão de equilíbrio para remoção do material não ligado e posteriormente com NaCl dissolvido no mesmo tampão para obter os seguintes intervalos isocráticos 0,1; 0,2; 0,3; 0,4; 0,5 e 1,0 M. O fluxo cromatográfico foi mantido em 1mL/min e coletado frações de 4mL. A eluição de proteínas foi monitorada através da leitura das absorvância em 280 e 230nm e a atividade inibitória pela porcentagem de inibição da hidrólise do DL-BApNA pela tripsina bovina.
3.2.9. Cromatografia de fase reversa em cromatógrafo líquido de alta Efiviência - HPLC
A coluna cromatográfica usada foi a SHIM-PACK CLC-ODS (M) 228 17873-92 (octadecil silano – C18) de 250mm de comprimento por 4,6mm, tamanho das partículas de 5 µm, da Shimadzu®, equilibrada com a mistura de 70% da solução A (0,1% TFA) e 30% da solução B (ACN 80% + 0,1% TFA) de maneira que a porcentagem inicial de acetonitrila (ACN) fosse de 24%. As amostras foram preparadas a 4mg/mL e uma alíquota de 25µl foi aplicada na coluna a um fluxo de 1mL/min., sendo que a eluição
seguiu as seguintes etapas:
1- Nos 5 minutos iniciais a fase móvel era constituída apenas pela solução de equilíbrio: 70% da solução A (0,1% TFA) + 30% da solução B (ACN 80% + 0,1% TFA) de maneira que a porcentagem inicial de acetonitrila (ACN) fosse de 24%;
2- Entre o tempo 5:01 minutos e 20:00 minutos, a porcentagem da fase B foi aumentada gradativamente de forma linear até atingir 50%, ou seja, 40% de ACN;
3- Entre o tempo 20:01 minutos e 30:00 minutos, a concentração da fase B atinge 100%, ou seja, 80% de ACN, e nesse ponto, interrompe-se o fracionamento das amostras;
4- Entre o tempo 30:01 minutos e 35:00 minutos a concentração da fase B foi mantida constante (80% de ACN) para limpeza da coluna;