UNIVERSIDADE CATÓLICA DE BRASÍLIA
PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA
PROGRAMA DE PÓS-GRADUAÇÃO STRICTU SENSU
MESTRADO EM CIÊNCIAS GENÔMICAS E BIOTECNOLOGIA
EXPRESSÃO DIFERENCIAL DE miRNAs EM LINFÓCITOS T
DE INDIVÍDUOS TRANSPLANTADOS RENAIS
Brasília - DF
2013
Pró-Reitoria de Pós-Graduação e Pesquisa
Programa de Pós-Graduação
Strictu Sensu
Mestrado em Ciências Genômicas e Biotecnologia
EXPRESSÃO DIFERENCIAL DE miRNAs
EM LINFÓCITOS T
DE INDIVÍDUOS TRANSPLANTADOS RENAIS
Autor: Laureane Ribeiro Pavanelli
Orientadora: Dr.ª Rosângela Vieira de Andrade
Coorientador: Dr. Marcelo de Macedo Brígido
LAUREANE RIBEIRO PAVANELLI
EXPRESSÃO DIFERENCIAL DE miRNAs EM LINFÓCITOS T DE INDIVÍDUOS TRANSPLANTADOS RENAIS
Dissertação apresentada ao Programa de Pós-Graduação Strictu Sensu em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito para obtenção do título de Mestre em Ciências Genômicas e Biotecnologia.
Orientador: Dr.ª Rosângela Vieira de Andrade
Coorientador: Dr. Marcelo de Macedo Brígido
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
25/07/2013
P337e Pavanelli, Laureane Ribeiro.
Expressão diferencial de miRNAs em linfócitos T de indivíduos transplantados renais. / Laureane Ribeiro Pavanelli – 2013.
92f. ; il.: 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2013.
Orientação: Dr.ª Rosângela Vieira de Andrade Coorientação: Dr. Marcelo de Macedo Brígido
AGRADECIMENTO
É com muita satisfação que expresso aqui o mais profundo agradecimento a todas as pessoas que direta ou indiretamente tornaram possível a realização desta dissertação. Agradeço, portanto:
À minha família, parentes e queridos agregados. Em especial, mãezinha Therezinha, paizão Altamiro, irmão Rumenigh e cunhada Karine, por terem proporcionado as condições necessárias para os meus estudos e por serem o meu lar, e ainda, pelo amor, carinho, afago e aconchego.
À minha amiga Nina Jardim, que além de muito querida e amada, foi o elo entre o meu desejo de fazer o mestrado e a Universidade Católica de Brasília – UCB.
À minha orientadora Rosângela Vieira que me recebeu no seu grupo de braços abertos e me guiou por toda a trajetória de elaboração deste trabalho.
A todos os professores da Pós-Graduação da UCB que foram essenciais para o meu crescimento intelectual e por despertar em mim o desejo por novos conhecimentos.
Aos professores da Universidade de Brasília – UnB, Marcelo Brígido, meu coorientador, e Andrea Maranhão, minha cocoorientadora, por toda a ajuda, considerações, ideias, bolsa de estudo e colaboração. A todo o pessoal da bioinformática da UnB que sempre foram solícitos, em especial, Tainá Raiol e professora Maria Emília.
Especialmente à Isabel Garcia, minha parceira, companheira, amiga, cúpida, por toda a ajuda e por ter dividido comigo muito mais que amostras, mas muitas alegrias, todas as angústias, desesperos e quartos de hotéis. Sem você eu não teria conseguido.
A todos os amigos e amigas de longa data e aos que fiz através do mestrado por me proporcionarem momentos maravilhosos de alegria, distração e cumplicidade. Não vou citar nomes porque certamente vou me esquecer de alguém, mas prometo expressar minha gratidão dia-a-dia a cada um.
“In my view, all that is necessary for faith is the belief that by doing our best we shall succeed in our aims: the improvement of mankind.”
RESUMO
Pavanelli, L. R. Expressão Diferencial de miRNAs em Linfócitos T de Indivíduos Transplantados Renais. 93f. 2013. Mestrado em Ciências Genômicas e Biotecnologia, Universidade Católica de Brasília, Brasília, 2013.
O transplante tornou-se uma terapia para vários casos de falência de órgão a partir do desenvolvimento de novas técnicas cirúrgicas associadas a potentes terapias imunossupressoras. No entanto, a rejeição pós-transplantes ou falência do enxerto, ainda é um fator limitante para esse tipo de intervenção. A rejeição resulta, basicamente, a partir da interação de linfócitos T com células apresentadoras de antígenos, do reconhecimento desses antígenos estranhos pelos receptores dos linfócitos T e pela estimulação de sinalização acessória. Ao longo das últimas décadas, o conhecimento mais detalhado desses mecanismos moleculares associados ao reconhecimento do enxerto pelos linfócitos T, possibilitou o desenvolvimento de várias abordagens e terapias como, por exemplo, o bloqueio de coestimulação e a depleção de linfócitos T alorreativos. Sabe-se ainda, que uma parcela dos pacientes transplantados desenvolve espontaneamente um estado de tolerância operacional que garante a sobrevida do enxerto. Esta é uma condição rara, observada em indivíduos transplantados renais e de fígado e geralmente apresentada por indivíduos que suspenderam o uso dos medicamentos imunossupressores por conta própria devido aos inúmeros efeitos colaterais e fatores de risco associados ao uso dessas drogas. A indução desse estado de tolerância, e consequentemente, manutenção dessa tolerância sem o uso de drogas imunossupressoras e sem rejeição, são os maiores desafios do transplante. Assim, a busca por potenciais biomarcadores para a rejeição ou para a aceitação do enxerto faz-se cada vez mais necessária. Neste contexto, o presente estudo tem como principal objetivo identificar miRNAs diferencialmente expressos em linfócitos T humanos de pacientes com função estável ao enxerto, com rejeição crônica, com tolerância operacional e em indivíduos saudáveis, uma vez que mais pesquisas são necessárias para uma compreensão profunda da função dos miRNAs na fisiopatologia renal e nos estados de tolerância operacional. Para tal, foram selecionados 7 miRNAs (miR-1-1, miR-16, miR-31, miR-126, miR-133a, miR-196b, miR-328) e analisados em 15 indivíduos transplantados renais (em estado de tolerância operacional n=5, com função do enxerto estável n=5 e com rejeição crônica ao enxerto n=5) e em 5 indivíduos saudáveis doadores dos órgãos. Apenas o miR-31 teve expressão diferencial significativa nos linfócitos T de indivíduos transplantados em relação a indivíduos não transplantados (p< 0,05). Contudo, a identificação e análise da expressão deste miRNA, pode ser uma ferramenta importante para a identificação de um biomarcador promissor, além de promover o melhor entendimento dos mecanismos envolvidos no estado de tolerância operacional. Esse conhecimento pode futuramente, identificar pacientes, os quais poderão se beneficiar com a diminuição ou retirada do uso de drogas imunossupressoras, proporcionar o entendimento das vias imunorregulatórias envolvidas nesse estado de tolerância ao enxerto e subsidiar o desenvolvimento de novas terapias e/ou validar moléculas que poderão ser utilizadas como biofármacos.
ABSTRACT
Transplantation has become a therapy for multiple organ failure cases from the development of new surgical techniques associated with potent immunosuppressive therapies. However, post-transplant rejection or graft failure still a limiting factor for this type of intervention. The rejection arises primarily from the interaction of T cells with antigen-presenting cells, the recognition of foreign antigens by T lymphocyte receptors and signaling by stimulating accessory. Over the last few decades, detailed knowledge of these molecular mechanisms involved in the recognition of the graft by T lymphocytes has enabled the development of several approaches and therapies such as the blocking of costimulation of T cells and alloreactive depletion. It is known that some transplanted patients spontaneously develop an operational state of tolerance that ensures survival of the graft. This is a rare condition seen in kidney and liver transplanted patients and generally made by individuals who discontinued the use of immunosuppressive drugs on their own due to the numerous side effects and risk factors associated with the use of these drugs. Induce this operational state of tolerance, and consequently, maintenance of tolerance without the use of immunosuppressive drugs and without rejection, are the biggest challenges of the transplant. Thus, the search for potential biomarkers for rejection or acceptance of the graft becomes increasingly necessary. In this context, the present study has as main objective to identify miRNAs differentially expressed in human T lymphocytes from patients with graft function, with chronic rejection, with operational tolerance and healthy subjects, whereas more research is needed for a deep understanding of the role of miRNAs in renal pathophysiology and in the operational tolerance. For this purpose, 7 miRNAs (1-1, 16, 31, 126, 133a, 196b, miR-328) were selected and analyzed in 15 transplanted kidney patients (with operational tolerance n = 5, stable graft function n = 5 and chronic graft rejection n = 5) and 5 healthy donor organs. Only miR-31 had significant differential expression in T lymphocytes in transplanted patients compared to non-transplant (p <0.05). However, the identification and analysis of the expression of miRNA may be an important tool for the identification of a promising biomarker, and to promote a better understanding of the mechanisms involved in the operational state of tolerance. This knowledge may eventually identify patients who may benefit from the reduction or withdrawal of immunosuppressive drugs, lead to understanding of the immunoregulatory pathways involved in this state of tolerance to the graft and subsidize the development of new therapies and / or validate molecules that may be used as biopharmaceuticals.
LISTA DE FIGURAS
Figura 1. Estrutura gênica do HLA. Classe I (HLA-A, B e C), classe II (HLA-DR, DQ e DP) e classe III (proteínas do complemento, HSP e TNF). Os genes TAP, LMP e HLA-DM codificam proteínas que não são expressas nas superfícies celulares. ... 19
Figura 2. Biogênese e função de miRNA. ... 35
Figura 3. Caracterização da população de linfócitos T por citometria de fluxo. Os linfócitos foram colocados em uma região com base no tamanho e granulosidade (FSC e SSC) (A) e linfócitos T CD3+-PE (B). ... 55
Figura 4. Análise da qualidade do RNA extraído: Gel de agarose 1,2%, com visíveis subunidades 28S e 18S, indicando a integridade do material. Marcador (M), Amostras (Ltx 10 – Ltx 43). ... 56
Figura 5. Mapeamento das reads no gene CD28, localizado no cromossomo humano 21. Em cada isoforma, as linhas mais grossas representam éxons e as mais finas, regiões de íntrons. A visualização foi feita no UCSC Genome Browser. ... 71
LISTA DE GRÁFICOS
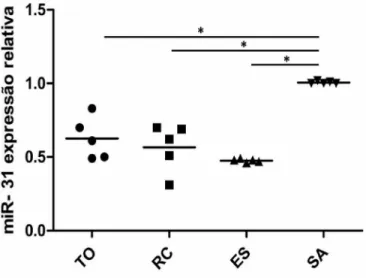
Gráfico 1. Expressão do miR-31 em linfócitos T de indivíduos transplantados renais e não transplantados. Pacientes com tolerância operacional (TO), pacientes com rejeição crônica (RC), pacientes estáveis (ES) e indivíduos saudáveis (SA). *representa a expressão es estatisticamente significativa dos indivíduos saudáveis em relação aos transplantados renais. ... 60
Gráfico 2. Expressão do miR-1-1 em linfócitos T de indivíduos transplantados renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 62
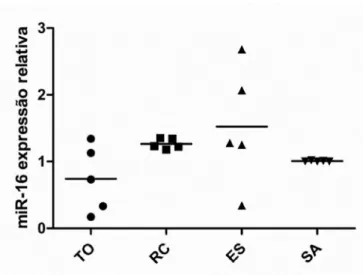
Gráfico 3. Expressão do miR-16 em linfócitos T de indivíduos transplantados renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 63
Gráfico 4. Expressão do miR-126 em linfócitos T de indivíduos transplantados renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 64
Gráfico 5. Expressão do miR-133a em linfócitos T de indivíduos transplantados renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 65
Gráfico 6. Expressão do miR-196b em linfócitos T de indivíduos transplantados renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 67
Gráfico 7. Expressão do miR-328 em linfócitos T de indivíduos transplantados renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 68
Gráfico 9. Gráfico boxplot das qualidades das sequências obtidas depois da retirada dos adaptadores e das sequências com qualidade <20, segundo a escala PHRED. Eixo X: posição nas reads em pb. Eixo Y: escala de qualidade PHRED. ... 70
LISTA DE TABELAS
Tabela 1. Dados clínicos dos sujeitos selecionados. ... 52
Tabela 2. Quantidade de células totais, de linfócitos T e de RNA obtido dos linfócitos T, após separação imuno-magnética de células dos grupos: tolerante operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ... 57
Tabela 3. Valores de fold change dos miR-126 e miR-133a nos indivíduos do matching 1. Os valores pertencentes ao paciente estável caracteriza um outlier. .... 58
Tabela 4. Número de reads antes e depois da retirada dos adaptadores e das sequências de baixa qualidade. ... 69
Tabela 5. Dados demográficos e clínicos dos indivíduos em estado de tolerância operaciomal...89
Tabela 6. Dados demográficos e clínicos dos indivíduos em estado de rejeição crônica...90
Tabela 7. Dados demográficos e clínicos dos indivíduos com função estável do enxerto tomando doses habituais de imunossupressores...91
LISTA DE SIGLAS
APCs, antigen-presenting cells
ATG, globulina antitimócita
BCR, B cell receptor
BSA, bovine serum albumin
CD, cluster of differentiation
cDNA, DNA complementar
Cq, Quantification Cicle
CsA, ciclosporina
cTECs, thymic cortical epithelial cells
CTLA, Cytotoxic T lymphocyte antigen
DGCR8, DiGeorge Syndrome critical region 8
DNA, ácido desoxirribonucleico
dNTPS, desoxirribonucleotídeos fosfatados
EDTA, ethylenediamine tetraacetic acid
ES, estáveis
FACS, fluorescence-activated cell sorting
FOXP3, forkhead box protein P3
FSC, Side Scatter
gDNA, DNA genômico
HLA, Human Leukocyte Antigens
HSP, heat shock protein
IL, interleucina
INF, interferon
MHC, major histocompatibility complex
MIP-1α, macrophage inflammatory protein
miRNA, microRNA
mRNA, RNA mensageiro
PBMC, peripheral blood mononuclear cells
PBS, phosphate buffered saline
PCR, polymerase chain reaction
pri-miRNA, microRNA primário
qPCR, quantitative polymerase chain reaction
RAG, recombination-activating gene
RANTES, regulated upon activation, normal T cell expressed and secreted
RC, rejeição crônica
RISC, RNA-induced silencing complex
RNA, ácido ribonucleico
rRNA, RNA ribosomal
SA, saudáveis
SFB, soro fetal bovino
SSC, Forward Scatter
STAT, signal transducers and activators of transcription
TCR, T cell receptor
Th, T helper cell
TO, tolerância operacional
SUMÁRIO
1. INTRODUÇÃO ... 17
1.1 Aspectos gerais do transplante renal ... 17
1.2 Mecanismos imunológicos ligados à rejeição de transplantes ... 20
1.3 Mecanismos imunológicos ligados à tolerância ao transplante ... 23
1.4 Mecanismos de indução de tolerância ao transplante ... 26
1.5 Tolerância operacional ... 28
1.6 miRNAs ... 34
1.7 miRNAs COMO BIOMARCADORES da tolerância operacional ... 37
1.8 Transcritoma, Rna-seq e bioinformática ... 38
2. OBJETIVOS ... 42
2.1 Objetivo geral ... 42
2.2 Objetivos específicos ... 42
3. DELINEAMENTO EXPERIMENTAL ... 43
4. MATERIAL E MÉTODOS ... 44
4.1 Sujeitos de pesquisa ... 44
4.2 Obtenção de células mononucleares de sangue periférico ... 45
4.3 Congelamento de células ... 45
4.4 Separação das células para obtenção dos linfócitos T ... 46
4.5 Citometria de fluxo ... 46
4.6 Extração de RNA ... 47
4.7 Quantificação e qualificação do RNA ... 48
4.8 Tratamento com DNase ... 48
4.9 Síntese de cDNA e qPCR... 48
4.11 Sequenciamento de alto desempenho ... 49
4.12 Análise computacional dos dados ... 50
5. RESULTADOS E DISCUSSÃO ... 51
5.1 Sujeitos da pesquisa ... 51
5.2 Eficiência e pureza da separação de linfócitos T ... 54
5.3 Qualidade e quantidade de RNA ... 55
5.4 Perfil de expressão de miRNAs em linfócitos T de transplantados renais .. 57
5.4.1 Perfil de expressão do miR-31 ... 59
5.4.2 Perfil de expressão do miR-1-1 ... 61
5.4.3 Perfil de expressão do miR-16 ... 62
5.4.4 Perfil de expressão do miR-126 ... 64
5.4.5 Perfil de expressão do miR-133a ... 65
5.4.6 Perfil de expressão do miR-196b ... 65
5.4.7 Perfil de expressão do miR-328 ... 67
5.5 Sequenciamento de alto desempenho ... 68
6. CONCLUSÃO E PERSPECTIVAS ... 74
REFERÊNCIAS ... 75
ANEXO A - APROVAÇÃO DO PROJETO PELO COMITÊ DE ÉTICA. ... 84
ANEXO B - TERMO DE CONSENTIMENTO LIVRE ESCLARECIDO E APROVAÇÃO DO PROJETO PELO COMITÊ DE ÉTICA... 85
1. INTRODUÇÃO
1.1 ASPECTOS GERAIS DO TRANSPLANTE RENAL
O transplante de órgãos e células hematopoiéticas surgiu como uma solução para várias patologias. O primeiro transplante de órgão sólido bem sucedido em humanos foi realizado no ano de 1954, em Boston, por Joseph Edward Murray, que depois de várias tentativas frustradas transplantou um rim entre gêmeos idênticos e posteriormente ganhou prêmio Nobel pelo desenvolvimento de técnicas de transplante de órgãos (GARCIA et al., 2012).
Peter Medawar e Thomas Gibson foram os primeiros a fazer associação entre o transplante e o sistema imunológico durante a Segunda Guerra Mundial, através de experimentos que envolviam enxerto de pele em vítimas de queimaduras. Nesses experimentos, através de biópsias seriadas, eles observaram que enxertos do próprio indivíduo eram aceitos (auto-enxertos), enxertos de outros indivíduos eram rejeitados (aloenxertos) e que um segundo aloenxerto igual ao primeiro era rejeitado de forma acelerada, sugerindo que a destruição do tecido do próprio doador ocorria por imunização passiva e ainda que esse processo de rejeição é sistêmico e não local (SIMPSON, 2004).
A resposta imunológica contra o enxerto tem sido atribuída ao reconhecimento de antígenos do órgão transplantado, apresentados aos linfócitos T no contexto de antígenos leucocitários humanos HLA (Human Leukocyte Antigens), as quais, por sua vez, dirigem uma enorme variedade de respostas celulares e humorais, causando dano tecidual e rejeição do enxerto. Esse tipo de resposta é mediada pela porção adaptativa do sistema imune (AYALA-GARCÍA et al., 2013). Corroborando com essa teoria, estudos realizados em camundongos demonstraram que os animais desprovidos de linfócitos T não rejeitam o enxerto (COELHO; RAMOS; FILHO, 2007).
com o mesmo agente infectante. Em contrapartida, a resposta imune adquirida envolve a ativação e proliferação de células especializadas, linfócitos B e T, e das moléculas solúveis por eles produzidas. É específica, capaz de reconhecer uma grande diversidade de antígenos, de se tornar mais eficiente após cada encontro sucessivo com o antígeno, de especialização de resposta, autolimitação e tolerância a componentes do próprio organismo (DELVES; ROITT, 2000; CRUVINEL et al., 2010).
Apesar dos linfócitos T serem as principais células envolvidas nos processos de rejeição ao transplante, as células apresentadoras de antígenos APCs (antigen-presenting cells) desempenham papel fundamental em sua ativação, funcionando como uma ponte entre o sistema imune inato e o adaptativo. APCs são especializadas na captura e apresentação de antígenos aos linfócitos por expressarem em sua membrana plasmática antígenos associados às moléculas do complexo histocompatibilidade principal MHC (major histocompatibility complex). O conceito de imunohistocompatibilidade surgiu na década de 30, a partir dos trabalhos de Peter Gorer. Consequentemente, surgiu um forte estímulo em busca dos conhecimentos em imunogenética levando à definição do MHC que em humanos são chamados de antígenos leucocitários humanos (HLA) (AMOS, 1986).
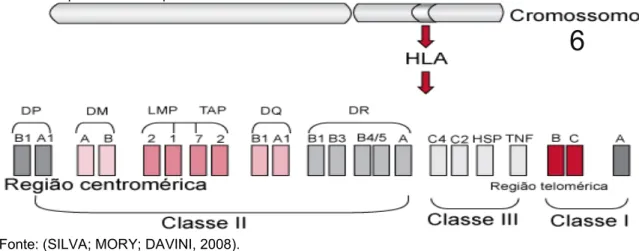
O sistema HLA, descrito por Jean Dausset et al. em 1954 (RAPAPORT et al., 1965) é um complexo gênico altamente polimórfico que contém mais de 1.000 alelos diferentes presentes no cromossomo 6 (Figura 1). As moléculas do HLA associadas a antígenos são exibidas na membrana plasmática de células dendríticas, os linfócitos T por sua vez reconhecem esses antígenos através de seus receptores de membrana. Moléculas de HLA-A, B e C correspondem ao MHC de classe I e apresentam peptídeos endógenos, expressos em todas as moléculas nucleadas do organismo, aos linfócitos T CD8+. Moléculas de HLA-DP, DQ e DR correspondem ao
Figura 1. Estrutura gênica do HLA. Classe I (HLA-A, B e C), classe II (HLA-DR, DQ e DP) e classe III (proteínas do complemento, HSP e TNF). Os genes TAP, LMP e HLA-DM codificam proteínas que não são expressas nas superfícies celulares.
Fonte: (SILVA; MORY; DAVINI, 2008).
O processo de apresentação de antígenos aos linfócitos T é extremamente importante para a sua seleção e maturação no timo. As células pré-T entram no córtex tímico pelas artérias e durante o processo de seleção e maturação migram em direção à medula, de onde saem para a circulação. Para que ocorra a maturação o linfócito T precisa expressar tanto um receptor TCR (T cell receptor) funcional, quanto co-receptores CD4 e/ou CD8 (ABBAS; LICHTMAN; PILLAI, 2007).
O TCR é expresso na membrana dos linfócitos T em associação com um complexo denominado CD3, composto por cinco diferentes proteínas da família das imunoglobulinas, responsável pelo reconhecimento do complexo peptídeo-molécula de MHC, e o CD3, pela sinalização celular subsequente. A grande diversidade de repertório dos linfócitos T maduros é gerada pelo processo de recombinação somática do TCR na qual um dado gene V, entre os diversos possíveis, liga-se a um dado gene J ou combinação DJ. A recombinação entre os diferentes segmentos é mediada por enzimas expressas apenas durante a fase de maturação dos linfócitos (STUTMAN, 1978).
Existem diversos subtipos de linfócitos T efetores e reguladores. Dentre os efetores destacam-se os auxiliares (Th1, Th2 e Th17) e os citotóxicos (T CD8). Já dentre os reguladores os linfócitos T são divididos em subpopulações especializadas. Linfócitos T regulatórios (TREG), subpopulação de linfócitos T CD4+,
foram inicialmente descritos como derivados do timo (SEDDON; MASON, 2000). Entretanto, outras descobertas apontaram que estas células também podem ser geradas na periferia (WALDMANN; COBBOLD, 2001). Os linfócitos TREG foram
originalmente identificados em camundongos e logo após em seres humanos. Eles normalmente constituem uma pequena fração dos linfócitos T CD4+ circulantes no
humano adulto e são comumente identificados pela expressão de IL2Rα (CD25) bem como de FOXP3. Como o próprio nome sugere, são células com papel de regulação e estão ligadas a manutenção da autotolerância imunológica e no controle das respostas autoimunes. Existe ainda outra subpopulação de linfócitos (NKT e LTγδ) que atuam ora como efetoras, ora como reguladoras, representando assim populações muito heterogêneas do ponto de vista funcional. Desse modo, há grande interesse no estudo dos subtipos celulares com função regulatórias e de sua potencial aplicação em tratamentos no âmbito de transplantes e de doenças autoimunes. (PAPIERNIK et al., 1998; STEPHENS et al., 2001).
1.2 MECANISMOS IMUNOLÓGICOS LIGADOS À REJEIÇÃO DE TRANSPLANTES
No transplante, quanto maiores são as diferenças imunohistoquímicas entre dois organismos, maior será a reação imunológica contra o transplante. Assim, é essencial determinar as diferenças entre o HLA de um potencial doador e do receptor antes do transplante. Mas mesmo depois de determinada a histocompatibilidade por meio de testes in vitro, quando um indivíduo recebe um órgão transplantado, seu sistema imunológico é ativado, culminando ou não em resposta inflamatória contra o transplante. Existem diversas formas de reconhecimento dos transplantes pelo sistema imunológico, as chamadas vias de alorreconhecimento, do Grego állos que significa reconhecimento do outro, essas vias se dividem em direta, indireta e semi-direta (CORNELL; SMITH; COLVIN, 2008).
transplantado e células do parênquima do órgão, podem ainda expressar moléculas de HLA, gerando alorreconhecimento direto (JIANG; HERRERA; LECHLER, 2004).
A via indireta é o modo convencional de apresentação de antígenos pelo sistema imune e se dá pela mesma forma de apresentação de antígenos derivados de patógenos. Moléculas do sistema HLA do receptor apresentam peptídeos, derivados dos antígenos do doador, que foram processados nas APCs, aos linfócitos T CD4+. As vias diretas e indiretas podem acontecer simultaneamente em um
indivíduo transplantado (CÔTÉ; ROGERS; LECHLER, 2001).
E por último, a via semi-direta, ocorre devida à capacidade das APCs de transferir moléculas da sua superfície celular para outras células. Estudos mostraram que células dendríticas apresentadoras de antígenos, adquiriram essas moléculas de HLA de outras células dendríticas ou de células endoteliais e foram capazes de apresentá-las de forma eficiente para linfócitos T alorreativos. Essa via cria uma ligação entre as diretas e indiretas, já que as APCs podem adquirir moléculas de HLA intactas de células do doador e a mostrá-las aos linfócitos T pela via direta, e essas mesmas APCs podem apresentar peptídeos, gerados por fagocitose, e apresentá-los pela via indireta aos linfócitos T CD4+ (JIANG; HERRERA; LECHLER, 2004).
Na rejeição aguda mediada por linfócitos T ocorre a infiltração de células mononucleadas no interstício, seguida por inflamação dos túbulos e por vezes do endotélio das artérias renais. Dentre as células mononucleares presentes em maior frequência estão os linfócitos T CD4+ e T CD8+. Além da perforina e granzina,
grânulos dos linfócitos T citotóxicos, e o FasL, um importante efetor do sistema imune. Outras citocinas e quimiocinas também expressas na rejeição aguda são: IFN-ϒ, TNF-α e β, RANTES (regulated upon activation, normal Tcell expressed and secreted) um quimiotático para linfócitos T, eosinófilos e basófilos, MIP-1α (macrophage inflammatory protein) um quimiotático para leucócitos polimorfonucleados. Os pacientes com esse quadro clínico desenvolvem uma elevação abrupta da creatina sérica, retenção de líquidos, febre e até mesmo perda do enxerto (CORNELL; SMITH; COLVIN, 2008).
A rejeição aguda mediada por anticorpos, geralmente ocorre em pacientes com exposição prévia a aloantígenos, como aqueles que fizeram transfusões de sangue, transplantes anteriores, gravidez, entre outros. Os anticorpos são direcionados principalmente para antígenos do sistema HLA e para moléculas de MHC expressas nas células endoteliais. Os anticorpos nesse caso atacam regiões diferentes das atingidas pelos linfócitos T, regiões chamadas de peritubulares e capilares glomerulares. A rejeição mediada por anticorpos costuma ter um prognóstico pior do que a rejeição mediada por linfócitos T, necessitando, portanto, de terapias diferenciadas. É caracterizada por evidência morfológica de agressão aguda e por presença de fragmentos de C4d que também é utilizado como marcador diagnóstico na biópsia renal. C4d é um fragmento de C4b, um produto de ativação da via clássica do complemento. Caracteriza-se também pela ativação das vias da cascata de coagulação que juntamente com o complemento, recrutam células inflamatórias (COLVIN, 2007).
que estão relacionados à progressão da rejeição crônica são: disparidades de antígenos HLA entre o doador e o receptor, sensibilização pré-transplante do receptor dirigido a antígenos HLA, episódios anteriores de rejeição aguda, injúria do órgão transplantado causada pelo tempo de isquemia e reperfusão pré e/ou durante a cirurgia e imunossupressão inadequada. A injúria do aloenxerto causada por isquemia e reperfusão resulta em dano tecidual com consequente resposta inflamatória e aumento da expressão de moléculas como: HSP (heat shock protein), moléculas de adesão, citocinas e quimiocinas, que sinalizam a resposta imune inflamatória (JOOSTEN et al., 2005).
Como forma de prevenir a rejeição ao enxerto, vários agentes imunossupressores poderosos foram desenvolvidos, tais como a ciclosporina, um peptídeo cíclico natural que inibe ativação de linfócitos T iniciada por antígenos específicos, que bloqueia a atividade da calcineurina, uma fosfatase cálcio-dependente integrante de uma via que induz a expressão de múltiplos genes, incluindo o fator de crescimento de linfócitos T, a IL2; o tacrolimus, um antibiótico macrolídeo é outro exemplo de imunossupressor que também inibe a atividade da calcineurina e é ainda mais potente que a ciclosporina no tratamento da rejeição aguda a transplantes; o azatioprina e o sirolimus que agem como antiproliferativos dos leucócitos; o micofenolato mofetil derivado do ácido micofenólico, mais seletivo que a azatiopina e que inibe proliferação de linfócitos B e T; a rampamicina, outro antibiótico macrolídeo que tem poderoso efeito inibitório sobre a sinalização dos receptores da IL2 e sobre o ciclo celular de linfócitos T ativados por antígenos; anticorpos monoclonais que foram desenvolvidos para alvejar moléculas específicas em linfócitos T, incluindo moléculas de alta afinidade ao receptor de IL2 que são expressas em linfócitos T ativados; os glicocorticóides que bloqueiam a transcrição dos genes de citocinas em linfócitos, células apresentadoras de antígenos e em outras células imunológicas, entre outros (YU; CARPENTER; ANASETTI, 2001; MAGEE; PASCUAL, 2004).
1.3 MECANISMOS IMUNOLÓGICOS LIGADOS À TOLERÂNCIA AO TRANSPLANTE
próprios, mas capazes de reconhecer antígenos estranhos ao organismo. A tolerância é classificada em dois tipos, a central quando os linfócitos são selecionados ainda nos órgãos linfóides primários (timo para linfócitos T e medula óssea para linfócitos B), e periférica quando selecionados posteriormente nos órgãos linfóides secundários (baço e linfonodos) e tecidos linfóides secundários associados a mucosas MALT (mucosa-associated lymphoid tissue) (SAKAGUCHI, 2010).
Durante a maturação dessas células, os receptores dos linfócitos são produzidos pela geração de uma enorme quantidade de rearranjos gênicos, TCR (T cell receptor) e BCR (B cell receptor), são receptores de linfócitos T e B, respectivamente. Os genes que codificam esses receptores são montados a partir de fragmentos variáveis e constantes mediados pelas proteínas RAG (recombination-activating gene), sendo assim, partindo de um pequeno número de genes, um grande repertório de receptores é formado, maximizando a diversidade de receptores através da introdução de sequências variáveis no sítio de recombinação e regulando o desenvolvimento de linfócitos individuais capazes de reconhecer um ou um pequeno número de peptídeos (MEDZHITOV, 2007).
Apenas uma minoria de linfócitos T é capaz de reconhecer, tanto moléculas do MHC próprias do organismo, quanto antígenos estranhos. Muitos linfócitos imaturos duplamente positivos (T CD4+CD8+), não são capazes de reconhecer
moléculas de MHC próprias, portanto entram em apoptose. Aqueles linfócitos que expressam TCRs capazes de interagir tanto com antígenos próprios, quanto estranhos, são selecionados positivamente no cTECs (thymic cortical epithelial cells), mas se essas células apresentarem alta afinidade por antígenos próprios, elas serão eliminadas posteriormente pela indução de apoptose ao interagirem com células dendríticas e macrófagos na medula tímica (seleção negativa). Células selecionadas podem migrar em direção aos tecidos linfóides periféricos continuando sua maturação a partir da interação com moléculas MHC de classe I ou II, determinando assim a maturação em linfócitos T CD8+ ou T CD4+ respectivamente
(ABBAS; JANEWAY, 2000; DELVES; ROITT, 2000).
Mesmo assim, fisiologicamente existe um grande número de linfócitos T autorreativos maduros na periferia (COHEN; QUINTANA; MIMRAN, 2004; COHEN, 2007). Estes linfócitos T autorreativos, normalmente não são ativadas e não induzem autoimunidade, mostrando que existem outros mecanismos de regulação na periferia que são capazes de manter o estado de tolerância ao próprio, esses mecanismos envolvem deleção e apoptose, anergia e regulação ou supressão (AYLA-GARCÍA et al., 2013).
Linfócitos T imunorregulatórios (TREG), como o próprio nome sugere, são
células capazes de suprimir respostas imunes exacerbadas que podem prejudicar o organismo, além de estabelecer imunidade contra o que não é próprio, tais como os órgãos transplantados. Para tanto, não é nenhuma surpresa que essas células são estritamente controladas. Linfócitos T se ligam a qualquer antígeno que entre em contato com os seus TCRs, mas para que essas células sejam ativadas, gerando proliferação e diferenciação, é necessário um segundo estímulo que é mediado pelo sistema imune inato e pelas APCs (ABBAS; JANEWAY, 2000). Uma melhor definição de TREG se dá pela expressão do principal regulador da transcrição no
desenvolvimento de TREG, FOXP3, que confere ao linfócito T CD4+ não regulatório
tanto uma função reguladora, quanto um fenótipo regulador. Células que expressam FOXP3 com atividade regulatória exibem uma variedade de marcadores de superfície celular incluindo: CD25, CTLA4, CD103, CD134, CD62L, GITR, GARP, CD39, CD73, TGF-β ligado à superfície, CD127lo e produzem as citocinas anti-inflamatórias TGF-β, IFN-γ, IL9, and IL10 (YEH et al., 2013).
Os principais linfócitos T com função imunorregulatória são: linfócitos TREG
(CD4+CD25+), que expressam o fator de transcrição FOXP3 (forkhead box protein
P3) e a cadeia α (alfa) do receptor de IL2 (CD25); linfócitos TR1, que se diferenciam
de linfócitos T CD4+ naive na presença de IL10 e regulam outros linfócitos T; e os
linfócitos Th3 (T helper 3), capazes de impedir reações autoimunes mediante produção de TGF-β (MESQUITA et al., 2010). Linfócitos TREG, que expressam o fator
celular tornou-se o foco central de estudos que envolvem a tentativa da manutenção desse estado (SAKAGUCHI; WING; YAMAGUCHI, 2009).
Linfócitos TREG podem ser de duas categorias: CD4+CD25+ naturais ou
induzidos. Os naturais se desenvolvem normalmente no processo de maturação de linfócitos T no timo e no sangue periférico e estão sempre em vigilância normal contra antígenos próprios evitando respostas autoimunes em potencial. Os induzidos adquirem atividade supressora a partir de sucessivas ativações e sob condições de estimulação únicas (SAKAGUCHI; WING; YAMAGUCHI, 2009).
Vários outros mecanismos de regulação, modulação e tolerâncias já foram descritos. Entre eles, um estudo mostrou que camundongos com deficiência de CD28, um receptor coestimulatório indispensável para ativação dos linfócitos TREG
CD4+CD25+FOXP3+, desenvolvem severas doenças autoimunes (TAI et al., 2005). Outro estudo demonstrou que o CTLA-4 (Cytotoxic T lymphocyte antigen), está associado à supressão de linfócitos T ativados, controlando negativamente os linfócitos TREG (CHIKUMA; BLUESTONE, 2003). Zheng et al. (2006) reportaram
ainda que a estimulação in vitro de linfócitos T CD4 naive na presença de TGF-β leva a um aumento na expressão de FOXP3, juntamente com a conversão para o fenótipo regulador, a expressão do perfil de citocinas associadas com TREGCD4+CD25+ e aquisição de atividade supressora.
1.4 MECANISMOS DE INDUÇÃO DE TOLERÂNCIA AO TRANSPLANTE
A aceitação de um transplante pelo organismo é um processo longo que demanda várias combinações de drogas imunossupressoras. Esse tratamento traz risco a saúde e a qualidade de vida dos transplantados, tais como, infecções oportunistas e vários efeitos colaterais. Em modelos animais mecanismos são estudados na tentativa de indução da tolerância, dentre eles destacam-se: indução do quimerismo linfo-hematopoiético misto, o uso de agentes bloqueadores de coestimulação e o uso de agentes depletadores de linfócitos T (KEAN et al., 2006).
Esse modelo mieloablativo implica riscos excessivos de toxicidade. Estudos mais refinados desenvolveram um protocolo que inclui ciclofosfamida, irradiação tímica e globulina antitimócita (ATG) com ciclosporina (CsA) e obtiveram sucesso com 2 pacientes que receberam transplante renal de doadores HLA compatíveis e que foram retirados de todos os regimes imunossupressores. Esses e outros exemplos que envolvem várias combinações de medicamentos e irradiações pré-transplante devem ser cuidadosamente estudados, já que o estado de tolerância não depende apenas de reconhecimento direto pelos linfócitos T, mas também de vários outros mecanismos supracitados (MATTHEWS; RAMOS; BLUESTONE, 2003).
Linfócitos T necessitam de uma gama de agentes coestimulatórios para sua ativação completa. O uso de agentes bloqueadores de coestimulação, como o próprio nome sugere, tem a finalidade de bloquear essas moléculas na superfície celular para induzir anergia aos linfócitos T, utilizando antagonistas das vias de sinalização. Técnicas que utilizam esses princípios têm grande potencial, já que envolvem protocolos que não implicam toxicidade. Mas o grande desafio é bloquear as diversas vias de sinalização dos linfócitos T, simultaneamente. Os estudos mais promissores demonstraram efeito sinérgico a partir da combinação de bloqueio de CD28 e CD154, com ou sem a adição da técnica de quimerismo linfo-hematopoiético. Outra técnica que obteve sucesso em modelo animal é a combinação do quimerismo linfo-hematopoiético, com CTLA4lg e com anti-CD154, isso reduz a necessidade de terapia de radiação, reduzindo portanto, a toxicidade do quimerismo linfo-hematopoiético originalmente descrito (MATTHEWS; RAMOS; BLUESTONE, 2003; ANSARI; SAYEGH, 2004).
cruzamento final de dados para compreensão das vias imunorregulatórias no transplante renal, como um todo.
É notório que linfócitos TREG e suas vias estão intimamente ligadas à
manutenção da tolerância, suprimindo a imunidade por vários mecanismos distintos. O estudo dessas interações é promissor como alvo de terapia clínica, mas um grande desafio é saber se mecanismos supressivos observados in vitro podem ser transferidos para situações in vivo, mesmo observando o microambiente em diferentes órgãos do corpo (WING; FEHÉRVÁRI; SAKAGUCHI, 2006).
1.5 TOLERÂNCIA OPERACIONAL
A tolerância operacional é uma situação clínica definida por estabilização da função do órgão transplantado sem nenhum indicativo de rejeição crônica e ausência de qualquer droga imunossupressora, usualmente por mais de 1 ano. Tolerância operacional “espontânea” já foi descrita em pacientes com transplante renal e hepático. Tais pacientes oferecem uma oportunidade única de estudo das condições biológicas e clínicas associadas à tolerância. Um processo de “quase” tolerância operacional caracterizado por função estável do órgão em pacientes com baixas doses de drogas imunossupressoras (monoterapia), também é alvo de estudos (ROUSSEY-KESLER et al., 2006).
Como a tolerância operacional parece estar ligada à deleção clonal, à anergia, ou à uma regulação ativa. Estudos que envolvem seleção e ativação em sangue periférico de indivíduos que realizaram transplante são os mais realizados. A partir desses estudos, já foi possível caracterizar que os transplantados operacionalmente tolerantes têm alterações em linfócitos T clonais no sangue periférico e que esses linfócitos são principalmente T CD8+ com ausência de acúmulos de transcrição de citocinas. Esses estudos buscam ainda usar essas descobertas como marcadores, que poderiam ajudar a identificar indivíduos tolerantes em potencial (BROUARD et al., 2005; ROUSSEY-KESLER et al., 2006).
Brouard et al. (2007) analisaram células mononucleares do sangue periférico de 17 pacientes tolerantes operacionais, juntamente com outros grupos clínicos. As análises por microarranjo identificaram um conjunto de 49 genes que estavam diferencialmente expressos no grupo de tolerantes operacionais. Em seguida, os 49 genes foram validados por qPCR e 33 deles tiveram acurácia comprovada. Quando esses 33 genes foram testados em sangue periférico de pacientes com função estável ao enxerto, 1 de 12 pacientes estáveis com terapia tripla de imunossupressão e 5 de 10 pacientes estáveis com monoterapia de baixa dosagem, compartilharam o perfil dos tolerantes, sugerindo que é possível selecionar tolerantes operacionais em potencial dentre os pacientes estáveis ao enxerto.
Foi ainda observado que em pacientes com transplante de fígados os casos de tolerantes operacionais é mais comum, chegando a 20% dos pacientes. Martínez-Llordella et al. (2008) analisaram múltiplos parâmetros, incluindo expressão gênica com microarranjo em sangue periférico de 16 pacientes tolerantes operacionais. Os genes encontrados incluíam receptores de linfócitos T e células NK. Curiosamente, o conjunto de genes encontrados em sangue periférico dos transplantados de fígado, pouco se relacionava com os conjuntos gênicos encontrados na tolerância operacional de pacientes transplantados renais. Isso pode ter ocorridos pelas próprias diferenças dos dois tipos de transplante ou pelas variações técnicas devido ao pequeno número amostral.
base para futuros ensaios que poderão ser usado no diagnóstico de tolerância, a fim de adaptar melhor a terapia imunossupressora. Mas é importante pensar que outras variáveis podem desenvolver um papel importante no desenvolvimento do estado de tolerância. Não se pode contar só com o perfil genético dos indivíduos transplantados para determinar se eles podem interromper a terapia imunossupressora. Portanto, deve-se associar o transcritoma, com o “imunoma” e com o “clinicoma” na tentativa de predizer com precisão os possíveis tolerantes operacionais (BRAZA; SOULILLOU; BROUARD, 2012).
Desde o final dos anos 90, Coelho et al. (1999), pertencentes a este grupo de estudo, também publicavam artigos com dados importantes que buscavam elucidar os caminhos de rejeição e aceitação do enxerto pelas células do sistema imunológico utilizando indivíduos transplantados renais, um dos primeiros trabalhos mostrou evidências de que a via de alorreconhecimento indireta estava presente no sangue periférico de transplantados renais com longo tempo de transplante independentemente de quadros de rejeição ao enxerto.
Em 2001, dando continuidade a esse trabalho, Spadafora-Ferreira et al. publicaram dois artigos que avaliavam a resposta indireta à alopeptídeos contra HLA-DR em pacientes renais transplantados, pré-transplantados e pós-transplantados em períodos diversos, bem como em indivíduos saudáveis, através da caracterização do repertório de linfócitos T envolvidos no alorreconhecimento indireto pela avaliação da proliferação e produção de citocinas por essas células. O conjunto de dados desses dois estudos demonstrou que os linfócitos T da via de alorreconhecimento indireta, contradizendo outros estudos, não possuíam papel inflamatório e sim regulador, surgindo assim à hipótese de que a ativação do repertório de linfócitos T regulatórios na via indireta de alorreconhecimento pode induzir um processo ativo de tolerância.
linfócitos T autorreativos. A detecção de resposta proliferativa exclusivamente no grupo pós-transplantados sugeriu ainda uma alteração significante no repertório de linfócitos T autorreativos. Mas ainda era preciso esclarecer se essas populações de linfócitos autorreativos suprimiam a alorreatividade e a inflamação, assim com descrito para linfócitos T HSP-reativos em artrite reumatoide e artrite experimental ou se contribuía para a agressão ao enxerto como reportado na autorreatividade anti-miosina nos pós-transplantados de modelo murino.
Contudo, o grupo decidiu seguir o que sugeria o estudo de artrite reumatoide, avaliando, portanto, a dinâmica da resposta proliferativa e a produção de citocina induzida por HSP60 e HSP70 (heat shock protein), com a finalidade de caracterizar funcionalmente o repertório de linfócitos T anti-HSP no contexto do transplante renal humano. Para tal, as células mononucleadas do sangue periférico de 36 indivíduos renais transplantados foram analisadas em vários períodos pós-transplante. E verificou-se que a produção de interleucina-4 (IL4) induzida por HSP60 estava associada com a ausência de rejeição imunológica ao enxerto (GRANJA et al., 2004).
Esse dado foi melhor analisado e no mesmo ano (2004) outro artigo foi publicado, o objetivo dele era de avaliar a produção de citocinas contra peptídeos autólogos da HSP60 oriundos de diferentes regiões da proteína em pacientes renais transplantados em dois momentos pós-transplante, já que dados anteriores sugeriram que havia predominância de um repertório de linfócitos T autorreativos pró-inflamatórios no início do pós-transplante (<6 meses) e algum fator regulador em indivíduos com mais tempo de transplante (>1 ano). O conjunto de resultados encontrados sugeriu uma predominância de autorreatividade no repertório de linfócitos T regulatórios anti-HSP, no período mais longo do pós-transplante, que predominantemente reconhecem peptídeos das regiões intermediárias e C-terminal da HSP60, esses dados estavam de acordo com o observado no modelo de artrite reumatoide experimental (CALDAS et al., 2004).
e se esse padrão estava associado com o reconhecimento de diferentes regiões da molécula de HSP60. Outra pergunta do estudo era se em grupos de pacientes clinicamente distintos (pacientes estáveis após longo tempo de transplante versus pacientes com rejeição crônica ao enxerto) havia diferentes populações reativas a HSP. E por fim, foi investigado se os linfócitos que infiltravam o enxerto eram capazes de reconhecer a proteína HSP própria e qual era o perfil de citocinas induzidas por essa proteína. Como conclusão foi observado que, nas células mononucleadas avaliadas, houve uma predominância da interleucina 10 (IL10) sendo produzidas por indução da HSP60 durante o período tardio do pós-transplante, principalmente em resposta a peptídeos das regiões intermediárias e C-terminal da HSP60, foi relatado ainda que pacientes com rejeição crônica apresentaram reatividade para HSP60 com maior produção de IL10 em relação aos pacientes estáveis a longo prazo, sendo assim foi sugerido que apesar de ter atividade pró-inflamatória a autorreatividade para HSP60 no transplante provavelmente exercia um papel regulador (CALDAS et al., 2006).
Para um maior respaldo das informações até então descritas, foi avaliada a proliferação de linfócitos T e a produção de citocinas induzidas por diferentes regiões de HSP60 recombinante em três linhagens de camundongos, BALB/c(H-2d),
C57BL/6(H-2b) e C3H/HePas(H-2k). A partir disso, foi verificado que resposta
proliferativa foi encontrada predominantemente em camundongos C57BL/6(H-2b), e
alternativa complementar futura ou como uma imunoterapia para controlar a rejeição (LUNA et al., 2007).
Em seguida foi necessário caracterizar os linfócitos T regulatórios das vias direta e indireta de alorreconhecimento utilizando células mononucleadas de sangue periférico de indivíduos transplantados renais. Este trabalho também foi desenvolvido por Spadafora-Ferreira et al. (2007) e visava definir se os linfócitos TREG participavam ou não da via indireta de alorreconhecimento, a partir da expressão de FOXP3, além de avaliar o repertório de linfócitos T na via de alorreconhecimento direta, dado que havia sido descrito por vários autores. Em resumo, foi encontrado um conjunto funcional de linfócitos T dessa via reativos para antígenos HLA-DR de doadores, dependentes de IL10 e IL4, sugerindo atividade regulatória. Foi realizada ainda, a caracterização de linfócitos T CD4+CD25+FOXP3+ que suprimiam a proliferação de outra população de linfócitos T do mesmo paciente tanto na via direta como indireta, mostrando que a via indireta do alorreconhecimento também está envolvida nos mecanismos regulatórios inerentes a manutenção do enxerto.
O grupo ainda descreveu a manutenção de linfócitos T CD4+CD25+FOXP3+ no sangue periférico pode ser relevante para o processo de tolerância operacional, além de outras vias, como a STAT6 (STAT, signal transducers and activators of transcription) que foi descrita como um inibidor do FOXP3 e que em tolerante operacional teve um perfil de sinalização alterado com a fosforilação reduzida de STAT6 em monócitos, sugerindo que a via IL4/STAT6 pode participar do processo de tolerância imunológica. Esse estudo foi realizado a partir da análise diferencial de sangue periférico de indivíduos transplantados renais com rejeição crônica, estáveis e no estado de tolerância operacional e ainda no controle saudável. (VIEIRA et al., 2010). Utilizando o mesmo grupo de pacientes, outro estudo quantificou o perfil de expressão gênica de um conjunto de moléculas predominantemente inflamatórias e imunorregulatórias (FOXP3, GATA3, IL10, TGFB1, TGFBR1/TBX21, TNF e IFNG) e verificou que foi possível discriminar os tolerantes operacionais dos demais indivíduos pela expressão significativa do gene GATA3 (VIEIRA et al., 2011).
comparação com indivíduos saudáveis. Seguindo a hipótese de que o repertório de linfócitos B, inclusive linfócitos B regulatórios também participam dos processos de tolerância ao enxerto. Foi descoberto com esse estudo que nos indivíduos tolerantes operacionais o repertório de linfócitos B se assemelhava com o repertório do grupo de indivíduos saudáveis, mostrando uma preservação quantitativa, números normais de linfócitos B totais, naive, de memória e regulatório. Com capacidade conservada para ativar CD40/STAT3 (via de sinalização dos linfócitos B regulatórios). Enquanto, os indivíduos com rejeição crônica apresentaram redução do número de linfócitos B e diminuição significativa na ativação de linfócitos B regulatórios (SILVA et al., 2011). A descoberta de biomarcadores para a tolerância operacional busca contribuir para a seleção de agentes imunossupressores, ajustes de dosagens e pode ainda contribuir para a seleção de pacientes que possam ser tolerantes operacionais em potencial e que se beneficiariam com a retirada da terapia imunossupressora.
Um biomarcador ideal tem que possuir sensibilidade e especificidade próximas de 100%, ser de baixo custo e de simples execução e acessibilidade, e deve, em última análise, impactar na mortalidade associada à doença. Os biomarcadores detectados em sangue, urina ou fezes são especialmente interessantes pela facilidade de obtenção dos espécimes, facilidade de repetição das amostras e mínimo desconforto para os pacientes o garante sua aderência no caso destes biomarcadores serem utilizados em rastreamento. Neste contexto, os pequenos RNAs (miRNAs) constituem hoje ferramentas valiosas para o diagnóstico e prognóstico de várias doenças renais.
1.6 miRNAs
Os conhecimentos a respeito da biogênese e regulação dos miRNAs foram expandidos nos último anos. Atualmente sabe-se que a biogênese é realizada em um processo complexo que envolve várias proteínas, dentre elas duas endonucleases RNase III, Dicer and Drosha. MiRNAs são codificados por DNA genômico e comumente transcrito pela RNA polimerase II, que gera um transcrito primário (pri-miRNA) que formam estruturas em grampo, contendo o miRNA maduro como parte de uma haste com pareamento de dupla fita imperfeito conectado por um pequeno loop terminal. Os pri-miRNAs são processados pelas proteínas nucleares DROSHA e seu cofator DGCR8 (DiGeorge Syndrome critical region 8), resultando na formação de uma molécula em forma de grampo com 70-100pb chamada de miRNA precursor ou pré-miRNA, que é exportado para o citoplasma pela exportina-5. No citoplasma a estrutura em forma de grampo é clivada pela endonuclease DICER, formando duas moléculas de fita dupla de 21-23 nucleotídeos. Depois da separação das duas fitas, uma delas (miRNA maduro) é transferida para uma proteína ARGONAUTA (Ago) localizada no complexo de silenciamento induzido por RNA (RISC, RNA-induced silencing complex), que está envolvido na supressão da expressão gênica por conduzir miRNAs a determinados mRNAs alvos, enquanto geralmente a outra fita é degradada (Figura 2) (CARTHEW; SONTHEIMER, 2009).
Figura 2. Biogênese e função de miRNA.
Sabe-se que os miRNAs geralmente são sintetizados a partir de genes específicos de miRNA ou de determinadas regiões gênicas que não estão associadas à produção de proteínas (RODRIGUEZ et al., 2004). DNA que codifica para miRNAs pode ser encontrado em regiões de íntrons, bem como em regiões intergênicas (INUI; MARTELLO; PICCOLO, 2010). O processo de maturação dos miRNAs envolve uma complexa via metabólica que se inicia no núcleo e se estende até o citoplasma celular (AMBROS, 2004) Os miRNAs exercem suas funções regulatórias da expressão gênica ligando-se à região 3’ não traduzida (UTR), sequência codificadora ou 5’UTR de RNAs mensageiros (mRNA) alvos levando à degradação ou inibição da sua tradução, sendo assim miRNAs são usualmente reguladores negativos da expressão gênica. Cada miRNA é capaz de regular centenas de mRNAs de um tipo celular e um mRNA pode ser regulados por múltiplos miRNAs (VOLINIA et al., 2010), e ainda estima-se que metade do transcritoma humano está sob regulação de miRNA, incorporando essa via de regulação pós-transcricional dentro de quase todos os processos biológicos (CHANDRASEKARAN, et al. 2012; RAISCH, 2013). Os miRNAs são responsáveis por regular a expressão de cerca de 5.300 genes, ou seja, cerca de 30% de todos os genes humanos (LEWIS; BURGE; BARTEL, 2005).
Progressos recentes na pesquisa de miRNAs mostraram boas oportunidades para o entendimento de doenças renais e para a identificação de novos biomarcadores diagnósticos. O potencial de utilização de miRNAs já foi demonstrado para câncer em humanos, além de prover melhor acurácia, na classificação de tumor, quando comparada com a análise de mRNAs (LU et al., 2005). Existem algumas vantagens para análise de miRNAs sobre mRNAs tais como, maior estabilidade em tecidos e fluidos biológicos, incluindo soro; e natural proteção contra RNases endógenas por serem pequenos e talvez por ficarem internalizados dentro dos exossomos (MITCHELL et al., 2008).
Avanços na tecnologia hoje permitem detecção de miRNAs com grande sensibilidade e especificidade. Originalmente, análise de RNA por blot fornecia informações quantitativas e qualitativas sobre as várias formas de um miRNA a partir de uma amostra de RNA total. Mas assim como houve aumento nos números de miRNAs registrados no miRBase, a tecnologia de microarranjo foi adaptada para buscar milhares de miRNAs de uma mesma amostra. A técnica de PCR em Tempo Real também foi adaptada para prover análises quantitativas sobre os níveis de miRNAs. Através dessa técnica é possível gerar grandes quantidades de informações utilizando uma pequena quantidade de amostra, permitindo análise de pequenas biópsias, volume limitado de fluido biológico e até de material fixado em parafina (LI et al., 2010).
1.7 miRNAs COMO BIOMARCADORES DA TOLERÂNCIA OPERACIONAL
O transplante renal surgiu como um ótimo tratamento para pacientes com doenças renais em estágio terminal. No entanto, para o aumento na sobrevida de transplantados e a diminuição na morbidade e mortalidade causadas pelos efeitos colaterais associados ao uso de drogas imunossupressoras, alguns desafios devem ser transpostos. Ultrapassar esses obstáculos requer a descoberta e validação de biomarcadores que permitam o reconhecimento precoce de qualquer reposta imunológica contra o órgão transplantado e melhor entendimento dos processos de rejeição para o desenvolvimento de terapias mais diretas e a identificação de pacientes que podem ter suas terapias imunossupressoras diminuídas ou até retiradas. Como os eventos moleculares precedem o desenvolvimento da resposta imunológica contra o órgão transplantado, eles fornecem uma oportunidade ideal para detectar essa resposta antes que um dano significativo ocorra. É possível detectar algumas alterações por biópsia, mas a habilidade de detectar um sinal em uma amostra não invasiva tais como, sangue periférico e urina, traz benefícios e permite um monitoramento prático dos pacientes (CHOWDHURY; HERNANDEZ-FUENTES, 2013).
transplantados renais (SUI et al., 2008; ANGLICHEAU et al., 2009; SCIAN et al., 2011).
No contexto de biomarcadores não invasivos, Danger e et al. (2012) investigaram a modulação de miRNAs em células mononucleadas de sangue periférico de 9 pacientes com tolerância operacional comparada a 10 pacientes com função estável do enxerto sob terapia imunossupressora clássica. A expressão de 381 miRNAs foi mensurada e um total de 266 desses miRNAs estavam expressos com ciclo de quantificação (Cq) menor que 35 em pelo menos metade das amostras de cada grupo. Baseado no teste estatístico de Mann-Whitney entre os dois grupos foram escolhidos oito miRNAs que mostravam claramente a diferença de expressão entre o grupo de tolerantes operacionais e o grupo de estáveis, sendo 4 miRNAs muito expressos (miR-450b-5p, miR-142-3p, miR-876-3p, e miR-106b) e 4 miRNAs pouco expressos (miR-508-3p, miR-148b, miR-324-5p, e miR-98). Outras análises comparativas com indivíduos saudáveis foram realizadas até que o miR-142-3p fosse escolhido como o mais específico dentre os oito miRNAs. Foi verificado, então, sua expressão em subpopulações de leucócitos e foram encontradas as maiores expressões desse miRNA comparadas com os estáveis nos linfócitos B totais, purificados a partir de sangue periférico de tolerantes operacionais. Por fim, os prováveis alvos desse miRNA foram avaliados e foi encontrado que em linfócitos B provenientes de tolerantes operacionais a expressão de TGF-β1, que tem papel fundamental na resposta inflamatória, estava aumentada em comparação com estáveis. Utilizando ferramentas de bioinformática foi possível inclusive predizer a implicação do miR-142-3p na via do TGF-β. Este estudo atualmente é o único que mostrou um provável biomarcador da tolerância operacional utilizando indivíduos com o mesmo contexto clínico que os pacientes deste estudo.
1.8 TRANSCRITOMA, RNA-SEQ E BIOINFORMÁTICA
também para a compreensão de doenças e do desenvolvimento. Os principais focos da análise de transcritomas são: catalogar todos os tipos de transcrição, incluindo mRNAs, RNAs não-codificadores e miRNAs; determinar a estrutura transcricional de genes, como os seus sítios de início 5’ e fim 3’, padrões de splicing e outros modificadores pós-transcricionais; e quantificar os níveis de expressão da mudança de cada transcrição durante o desenvolvimento e sob condições diferentes (WANG; GERSTEIN; SNYDER, 2009).
A análise do transcritoma constitui uma excelente ferramenta para estudar a expressão diferencial dos genes. Geralmente essa análise é feita de forma grosseira resultando em sequências curtas que são utilizadas como marcadores ou etiquetas e demonstram a atividade transcricional daquela dada região do genoma. Essa limitação estava ligada ao método de sequenciamento de Sanger, que demandava bibliotecas de cDNA e um grande número de sequenciamentos para acumular dados representativos de EST, porém com advento de técnicas de sequenciamento de última geração como o pirosequenciamento e o PCR em ponte, criou-se um novo paradigma operacional. Com essas novas técnicas, múltiplos sequenciamentos são feitos em paralelo a um custo que representa uma fração daquele realizado com a tecnologia de Sanger (TORRES et al., 2008; WANG; GERSTEIN; SNYDER, 2009).
Para se realizar um RNA-Seq, em geral, uma população de RNA (total ou fracionada) é convertida em uma biblioteca de fragmentos de cDNA com adaptadores ligados a uma ou as duas pontas dessa pequena sequência. Cada molécula, com ou sem amplificação, é sequênciada em uma plataforma de alto rendimento para obter sequências curtas de uma extremidade (single-end sequencing) ou de ambas extremidades (pair-end sequencing). As reads são tipicamente de 30-400 pb, dependendo da plataforma de sequenciamento utilizada. Ao final do sequenciamento todas as reads são alinhadas a um genoma referência ou transcritos de referência ou montado sem um genoma de referência, podendo assim indicar tanto a estrutura transcricional, quanto o nível de expressão de cada gene (WANG; GERSTEIN; SNYDER, 2009).
técnica de arranjo Affymetrix, utilizando uma mesma amostra de RNA de rim e de fígado. O estudo mostrou que o sequenciamento Illumina tem alta reprodutibilidade, com pouca variação técnica, além de ser possível realizar o sequenciamento de cada amostra de RNA uma única vez utilizando uma única canaleta para isso. O sequenciamento Illumina também permite análises adicionais, tais como, detecção de baixos níveis de expressão gênica, variantes de splicing alternativo e novos transcritos (MARIONI et al., 2008).
Com o aprimoramento das técnicas de sequenciamento, surgiram novos desafios para a bioinformártica, tais como, o desenvolvimento de métodos eficientes para armazenar, recuperar e processar grandes quantidades de dados, que devem ser suficientes para reduzir erros e para remover sequências de baixa qualidade. De forma geral, uma vez que reads de alta qualidade foram obtidas, a primeira tarefa é mapear as reads a partir de um genoma de referência ou montá-las em contigs alinhando a sequência genômica para revelar as estruturas de transcrição. A partir disso são utilizados softwares que permitem a visualização desse alinhamento e a confecção de gráficos gerados a partir do tipo de elemento transcricional que se deseja. Um desafio para o futuro é desenvolver métodos computacionalmente simples para identificar novos eventos de splicing que ocorrem entre duas sequências distantes ou entre éxons de dois genes (WANG; GERSTEIN; SNYDER, 2009).
pós-transplantes ou falência do enxerto, devido à resposta do receptor, ainda é um fator limitante para esse tipo de intervenção.
2. OBJETIVOS
2.1 OBJETIVO GERAL
Identificar miRNAs diferencialmente expressos em linfócitos T humanos de pacientes estáveis, com rejeição crônica, tolerante operacional e indivíduos saudáveis.
2.2 OBJETIVOS ESPECÍFICOS
a. Analisar os dados clínicos dos sujeitos da pesquisa;
b. Analisar a expressão de miRNAs por meio de qPCR na busca de potenciais biomarcadores para a tolerância operacional;
3. DELINEAMENTO EXPERIMENTAL
Sujeitos da pesquisa (n=20):
Tolerantes operacionais (n=5);
Rejeição crônica (n=5);
Estáveis (n=5);
Saudáveis (n=5).
Separação das células para
obtenção dos linfócitos T, após
seleção dos grupos
Citometria de fluxo
Extração de RNA
Quantificação e qualificação do
RNA
Síntese de cDNA de miRNAs
4. MATERIAL E MÉTODOS
4.1 SUJEITOS DE PESQUISA
Os indivíduos do presente estudo provêm do projeto maior coordenado pela Dr.ª Verônica Coelho (INCOR) e foi devidamente aprovado pela Comissão de ética para análise de projetos de pesquisa do HCFMUSP (Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo) e da FMUSP (Faculdade de Medicina da Universidade de São Paulo) (CAPPesp no 1097/05, vide anexo A). As
informações clínicas dos pacientes transplantados renais foram obtidas no prontuário eletrônico do Serviço de Transplante Renal do HCFMUSP e no serviço de transplante renal do Hospital São Lucas da PUC-RS com auxílio dos colaboradores clínicos do projeto. Os indivíduos saudáveis são doadores de pacientes transplantados renais no HCFMUSP. Todos os participantes deste projeto assinaram o termo de consentimento livre e esclarecido, aprovado pela comissão de ética da instituição (anexo A e B). Foram analisados três grupos de pacientes transplantados renais e um grupo de indivíduos saudáveis e não transplantados, separadamente. Cada grupo clínico é composto por 5 indivíduos. Os grupos foram dispostos pelas seguintes características:
A - Grupo Tolerante Operacional: Indivíduos estáveis com longo tempo de transplante (> 1 ano de transplante), sem uso de drogas imunossupressoras há pelo menos 1 ano.
B - Grupo Rejeição Crônica: Indivíduos com longo tempo de transplante (> 1 ano de transplante) com rejeição crônica (diagnóstico por biópsia seguindo os critérios histopatológicos de classificação do rim transplantado - Banff 1997 e 2005 (SOLEZ et al., 2007).
C - Grupo Estável: Indivíduos estáveis com longo tempo de transplante (> 1 ano de transplante) sem uso de drogas imunossupressoras há pelo menos 6 meses, ou com baixas doses de imunossupressores, seja monoterapia ou terapia com 2 drogas.
4.2 OBTENÇÃO DE CÉLULAS MONONUCLEARES DE SANGUE PERIFÉRICO
As células mononucleares foram isoladas a partir do sangue de indivíduos adultos sadios e indivíduos transplantados, obtido por punção venosa em tubos contendo anticoagulante, EDTA ou heparina. As amostras de sangue coletadas foram diluídas 1:2 em solução salina isotônica e separadas em gradiente de Ficoll-Hypaque (densidade 1.077g/L, Ficoll: Pharmacia Biotech, Sweden e Ficoll-Hypaque: Urografina 370, Schering, Brasil). Após a centrifugação a 600xg por 25 min, as células mononucleares (PBMC, peripheral blood mononuclear cells) foram coletadas, ressuspensas com salina e centrifugadas a 600xg por 10 min. Após a centrifugação, o sedimento celular foi lavado duas vezes. Nessas lavagens as células foram ressuspensas em meio RPMI 1640 (Roswell Park Memorial Institute Medium, Gibco-BRL, Grand Island, NY, EUA) suplementado com 2mM L-Glutamina (Gibco BRL, Grand Island, NY, EUA), 10mM Hepes (Gibco BRL, Grand Island, NY, EUA), 0,1ng/mL de Perflacin (Rhodia, SP-Brasil), 1mM de Piruvato de Sódio (Gibco BRL, Grand Island, NY, EUA) e centrifugadas novamente a 600xg, por 8 min. As células foram ressuspendidas em 10mL de meio RPMI 1640 e centrifugadas a 400xg, por 8 min, para a remoção de plaquetas. As células foram ressuspensas em 3mL de meio RPMI 1640 acrescido de 10% de soro fetal bovino inativado (SFB) (Imunoquímica, RJ, Brasil). A concentração e viabilidade celular foram determinadas por contagem em câmara de Neubauer utilizando-se o corante vital Azul de Tripan (MCB Manufacturing Chemists Inc., Cincinnati, OH, EUA).
4.3 CONGELAMENTO DE CÉLULAS
As suspensões de células mononucleares foram centrifugadas a 600xg por 8 min e ressuspensas (5 a 20x106 células/mL) em solução de congelamento contendo