UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISA EM CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Participação da angiotensina II central na regulação
da ingestão de sacarose
Milede Hanner Saraiva Paes
Ouro Preto
UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISA EM CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
Participação da angiotensina II central na regulação
da ingestão de sacarose
Autora: Milede Hanner Saraiva Paes
Orientador: Profa. Dra. Lisandra Brandino de Oliveira
Dissertação apresentada ao programa de Pós Graduação do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para obtenção do título de Mestre em Ciências Biológicas, Área de concentração: Bioquímica Metabólica e Fisiológica.
Ouro Preto
IV
V “Cem vezes todos os dias lembro a mim mesmo
que minha vida interior e exterior depende dos trabalhos de outros homens, vivos ou mortos, e que devo esforçar-me a fim de devolver na
mesma moeda que recebi”.
VI
VII Agradecimentos
A minha orientadora, Profa. Dra. Lisandra Brandino de Oliveira, pela oportunidade, amizade e excelente orientação. Por todos os conselhos e ensinamentos que me conduziram neste grande avanço em minha carreira científica e por ser, para mim, um exemplo de pessoa e de profissional em quem pretendo me espelhar;
Ao Prof. Dr. Leonardo Máximo Cardoso pelo apoio e pelos ensinamentos científicos que tanto contribuíram no desenvolvimento deste trabalho;
A Profa. Dra. Andreia Carvalho Alzamora do Laboratório de Hipertensão e ao Prof. Dr. Robson Santos do departamento de Fisiologia da UFMG pelo auxílio técnico sem o qual não seria possível realizar este trabalho;
Ao Prof. Dr. Cândido Celso Coimbra e ao Prof. Dr. Mauro César Isoldi por aceitarem compor a banca contribuindo para o enriquecimento do meu trabalho;
Aos amigos do Laboratório de Fisiologia Endócrina e Cardiovascular: Bruna, João Lucas, Hellen, Marcone, Renato, por tornarem os dias de laboratório mais divertidos sem deixar faltar ajuda quando precisei, especialmente a Giovana pela amizade e apoio e a Paula pela solicitude com que sempre me ajudou;
As amigas Carol, Marcelle, Pollyana, Vitória, pelo apoio de sempre e por tornarem melhores os meus dias em Ouro Preto e especialmente a Larissa, amiga também na profissão, por me incentivar e ajudar a vencer os obstáculos;
VIII
Resumo
A angiotensina II (Ang II) é um peptídeo que atua sobre o comportamento ingestivo reduzindo a ingestão de alimento e aumentando a ingestão de água e sódio, além de modular a resposta ao sabor salgado. Entretanto pouco se sabe sobre os possíveis efeitos da Ang II na regulação da ingestão de sacarose. Assim o objetivo deste estudo foi investigar a ação central de angiotensina II na regulação da ingestão de solução de sacarose 2%. Para tanto, ratos Wistar machos adultos foram anestesiados e uma cânula de aço inoxidável foi implantada no encéfalo direcionada ao ventrículo lateral para microinjeção de drogas. Três protocolos foram realizados, o primeiro (com grupos de animais habituados e não habituados a ingerirem sacarose) foi utilizado para verificar o efeito da injeção central de diferentes doses de Ang II (0,1; 0,4 e
0,8nmol/μL) sobre a ingestão de sacarose 2%. O segundo e terceiro protocolos foram
realizados com animais não habituados a ingerirem sacarose. Assim, no segundo protocolo os animais foram tratados com antagonistas dos receptores AT1 (losartana:
50nmol/ μL) e AT2 (PD123319: 30nmol/μL) para verificar o papel destes receptores
na ingestão de sacarose induzida por Ang II central. O terceiro protocolo foi realizado para verificar a ingestão de sacarose 2% após a privação hídrica (situação fisiológica na qual há aumento endógeno de angiotensina II), no qual os animais passaram por privação hídrica de 24 horas seguida por 2 horas de reidratação para então serem ofertadas simultaneamente água e sacarose 2% ou água, sacarose 2% e salina 1,8%. Os resultados foram expressos com média ± erro padrão da média. Para as análises estatísticas foi utilizado teste t parareado ou não pareado ou testes análise de
variância (ANOVA) de duas vias seguida por pós teste Fisher’s LSD considerando as
variáveis tempo e tratamento, sendo diferenças significativas quando p < 0,05. Um aumento na ingestão de sacarose 2% foi observado para os animais tratados com Ang II independente da dose utilizada ou habituação à ingestão de sacarose. Essa resposta demonstrou ser mediada por ambos os receptores, AT1 e AT2, uma vez que
a dose utilizada de losartana (50 nmol/μL) inibiu completamente o efeito de Ang II
sobre a ingestão de água e de sacarose (PBS + Ang II: água 1,0 ± 0,4/120min; sacarose 2% 15,0 ± 2,0/120min versus losartana + Ang II: água 0,02 ± 0,02/120min; sacarose 2% 2,1 ± 1,0/120min) e a dose utilizada de PD123319 (30 nmol/μL) aboliu o
IX
X
Abstract
It´s known that angiotensin II (Ang II) is a peptide that acts on the ingestive behavior reducing food intake and increasing water and sodium intake, besides modulate the response to the salty taste. However little is known about the possible effects of Ang II in the regulation of sucrose intake. So this study investigated the effects of central angiotensin II on 2% sucrose solution intake. Therefore, adult male Wistar rats were anesthetized and a stainless steel cannula was implanted in the animal's brain, directed to the lateral ventricle (LV), for drug microinjection. Three protocols were applied, the first (with trained, accustomed, or not trained, no accustomed, animals to intake sucrose) was used to evaluate the effects of central injection of Ang II in different
doses (0.1, 0.4 and 0.8 nmol/μL) on 2% sucrose intake. The second and third protocols
were performed with animals no accustomed to intake sucrose. So in the second
protocol, the animals were treated with AT1 (losartan 50 nmol/μL) and AT2 (PD123319
30 nmol/μL) receptor antagonists, verifying the role of these receptors in sucrose intake
induced by central Ang II. Lastly, the third protocol was performed to verify 2% sucrose intake after water deprivation (physiological situation in which endogenous angiotensin II is increased) in which the rats were water deprived for 24 hours followed by 2 hours of rehydration and then water and 2% sucrose or water, 2% sucrose and 1.8% sodium solution were simultaneously offered. The results were expressed as mean ± standard error of the mean. For statistical analysis it was used t-test paired or unpaired or two-way repeated measures ANOVA followed by Fisher's LSD post-test, considering as variables time and treatment, with significant differences at p <0.05. An increase in 2% sucrose intake was observed for animals treated with Ang II independent of the dose used or if the animal were accustomed or not to intake sucrose. This effect was shown to be mediated by both receptors, AT1 and AT2. The dose of losartan (50
nmol/μL) inhibited the effect of Ang II on water and sucrose intake (PBS + Ang II: water 1,0 ± 0,4/120min; sucrose 2% 15,0 ± 2,0/120min versus losartan + Ang II: water 0,02 ± 0,02/120min; sucrose 2% 2,1 ± 1,0/120min) and the dose of PD123319 (30 nmol/μL)
XI
XII
Lista de Figuras
Figura 1: Principais fatores que influenciam no controle neural do apetite e da regulação do balanço energético. ... 2
Figura 2: Grupos experimentais. ... 9 Figura 3: Protocolo para determinação do efeito central de angiotensina II realizado em ratos habituados ou não à ingestão de sacarose. ... 13
Figura 4: Protocolo para determinação da participação do receptor AT1 na ingestão de sacarose decorrente da administração central de angiotensina II em ratos não habituados. ... 14
Figura 5: Protocolo para determinação da participação do receptor AT2 na ingestão de sacarose decorrente da administração central de angiotensina II em ratos não habituados. ... 14
Figura 6: Protocolo experimental realizado com o grupo AS para a determinação do efeito de privação hídrica sobre a ingestão de solução de sacarose 2%. ... 15
Figura 7: Protocolo experimental realizado com o grupo ASS para a determinação do efeito de privação hídrica sobre a ingestão de solução de sacarose 2% e NaCl 1,8%. ... 16
Figura 8: Fotomicrografia a fresco de corte histológico transversal de encéfalo de rato ... 18
Figura 9: Ingestão cumulativa de água e sacarose 2% pelo grupo habituado após a
microinjeção de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. ... 19
Figura 10: Volume total (água + sacarose 2%) cumulativo ingerido pelo grupo
habituado após a microinjeção de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. ... 19
Figura 11: Ingestão cumulativa de água e sacarose 2 % pelo grupo não habituado
após a microinjeção de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. ... 21
Figura 12: Volume total cumulativo (água + sacarose 2%) ingerido pelo grupo não
habituado após a microinjeção no VL de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. ... 21
Figura 13: Diferença entre a ingestão cumulativa de água pelos grupos habituados e não habituados após microinjeção no VL de PBS, Ang II 0,1nmol/μL, Ang II 0,4
nmol/μL ou Ang II 0,8nmol/μL ao final de 120 minutos de experimento. ... 23
Figura 14: Diferença entre a ingestão cumulativa de sacarose 2% pelos grupos habituados e não habituados após microinjeção no VL de PBS, Ang II 0,1nmol/μL, Ang
XIII Figura 15: Comparação entre o volume total (água + sacarose 2%) cumulativo ingerido pelo grupo habituado e pelo grupo não habituado após microinjeção no VL de PBS, Ang II 0,1nmol/μL, Ang II 0,4 nmol/μL ou Ang II 0,8nmol/μL ao final de 120
minutos de experimento. ... 24
Figura 16:Δ da ingestão cumulativa de água nos grupos habituados e não habituados
após microinjeção no VL de Ang II 0,1nmol/μL, Ang II 0,4 nmol/μL ou Ang II 0,8nmol/μL
ao final de 120 minutos de experimento. ... 25
Figura 17: Δ da ingestão cumulativa de sacarose 2% nos grupos habituados e não
habituados após microinjeção no VL de Ang II 0,1nmol/μL, Ang II 0,4 nmol/μL ou Ang
II 0,8nmol/μL ao final de 120 minutos de experimento. ... 25
Figura 18: Δ do volume total cumulativo ingerido pelos grupos habituados e não habituados após microinjeção no VL de Ang II 0,1nmol/μL, Ang II 0,4 nmol/μL ou Ang
II 0,8nmol/μL ao final de 120 minutos de experimento. ... 26
Figura 19: Ingestão cumulativa de água e sacarose 2% após a microinjeção no VL de
PBS ou losartana 50nmol/μL seguida da microinjeção dePBS ou Ang II 0,4nmol/μL .
... 27
Figura 20: Volume total (água + sacarose 2%) cumulativo ingerido após a
microinjeção no VL de PBS ou losartana 50nmol/μL seguida da microinjeção de PBS
ou Ang II 0,4nmol/μL. ... 27
Figura 21: Porcentagem (%) correspondente à ingestão total (mL, água + sacarose 2%) induzida pela microinjeção no VL de Ang II 0,4nmol/μL quando associada ao prévio tratamento com losartana 50nmol/μL em relação à ingestão promovida pela
associação PBS + Ang II (considerada como 100%). ... 28
Figura 22: Ingestão cumulativa de água e sacarose 2% após a microinjeção no VL de PBS ou PD123319 30nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL
.. ... 29
Figura 23: Volume total (água + sacarose 2%) cumulativo ingerido após a
microinjeção no VL de PBS ou PD123319 30nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL. ... 30
Figura 24: Porcentagem (%) correspondente à ingestão total (mL, água + sacarose
2%) induzida pela microinjeção no VL de Ang II 0,4nmol/μL quando associada ao prévio tratamento com PD123319 30nmol/μL em relação à ingestão promovida pela
associação PBS + Ang II (considerada como 100%). ... 30
XIV
sacarose 2% (120 a 240 minutos), em ratos privados ou não (controle) de água e sacarose 2% por 24 h.. ... 32
Figura 26: Volume total (água + sacarose 2%) cumulativo ingerido após a colocação dos bebedouros de água e de sacarose (120 a 240 minutos), em ratos privados ou não (controle) de água e sacarose 2% por 24 h.. ... 32
Figura 27: Ingestão cumulativa de água na fase de reidratação (0 a 120 minutos do experimento) e de água, sacarose 2% e salina 1,8% após o oferecimento concomitante de sacarose 2% e salina 1,8% (120 a 240 minutos), em ratos privados ou não (controle) de água, sacarose 2% e salina 1,8% por 24 h.. ... 34
Figura 28: Volume total (água + sacarose 2% + NaCl 1,8%) cumulativo ingerido após a colocação do bebedouro de sacarose e NaCl 1,8% (120 a 240 minutos) em ratos previamente privados de água, sacarose 2% e salina 1,8% (24 h) ou não (controle). ... 35
Figura 29: Comparação entre o volume (mL) ingerido de salina (NaCl 1,8%) e sacarose (2%) após a privação hídrica de 24h e a fase de reidratação.. ... 35
XV Lista de Tabelas
Tabela 1: Ingestão de água (mL) e sacarose 2% (mL) pelo grupo habituado em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min), ao longo dos 120 minutos de medida de ingestão, após a microinjeção no
VL de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. ... 20 Tabela 2: Ingestão de água (mL) e sacarose 2% (mL) pelo grupo não habituado em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min) ao longo dos 120 minutos de medida de ingestão, após a microinjeção no
VL de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. ... 22
Tabela 3: Ingestão de água (mL) e sacarose 2% (mL) em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min) ao longo dos 120 minutos de medida de ingestão após a microinjeção no VL de PBS ou losartana (Los)
50nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL. ... 28
Tabela 4: Ingestão de água (mL) e sacarose 2% (mL) em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min) ao longo dos 120 minutos de medida de ingestão após a microinjeção no VL de PBS ou PD123319 (PD)
30nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL. ... 30
XVI Lista de Abreviaturas
SNC: Sistema nervoso central
NPV: Núcleo paraventricular
NSO: Núcleo supraótico
NVM: Núcleo ventromedial
NDM: Núcleo dorso medial
CVD: Complexo vagal dorsal
NTS: Núcleo do trato solitário
AP: Área postrema
OCVs: Órgãos cicunventriculares
OSF: Órgão subfornical
OVLT: Órgão vasculoso da lâmina terminal
CG: Córtex gustativo
CART: transcrito relacionado à cocaína e à anfetamina
Ang II: Angiotensina II
SRA: Sistema renina angiotensina
ECA 1: Enzima conversora de angiotensina 1
AT1: Receptor de Angiotensina tipo 1
AT2: Receptor de Angiotensina tipo 2
CCA: Centro de ciência animal
CEUA: Comitê de ética em uso animal
XVII
1. Introdução ... 1
1.1. Comportamentos ingestivos ... 1
1.2. Angiotensina II ... 4
2. Objetivos ... 8
2.1 Geral ... 8
2.2 Específicos ... 8
3 Materiais e Métodos ... 9
3.1 Modelo Animal ... 9
3.2 Drogas e Soluções ... 10
3.3 Cirurgia encefálica (Estereotaxia) ... 11
3.4 Microinjeções intracerebroventriculares ... 11
3.5 Protocolos experimentais ... 11
3.6 Análise histológica ... 16
3.7 Apresentação dos resultados e análise dos dados ... 16
4 Resultados ... 18
4.1 Análise Histológica ... 18
4.2 Efeito central de angiotensina II (Ang II) na ingestão de sacarose em ratos habituados e não habituados ... 18
4.3 Efeitos da administração do antagonista de receptores AT1 (losartana) e AT2 (PD123319) na ingestão de sacarose 2% induzida por angiotensina II central ... 26
4.4 Efeito de privação hídrica de 24 horas na ingestão de sacarose 2%. ... 31
5 Discussão ... 38
1 1. Introdução
1.1. Comportamentos ingestivos
A ingestão de água, sódio e de alimentos são comportamentos motivados que participam de mecanismos homeostáticos do organismo e são fundamentais para a sobrevivência (Lent, 2010). Os comportamentos motivados são originados a partir de um impulso interno (motivação) que leva a ajustes corporais e comportamentais. A sede é um exemplo de motivação que reflete uma necessidade corporal em busca de homeostasia, ou preservação do meio interno, e que resulta na ingestão de água que é um comportamento motivado.
Os comportamentos ingestivos, bem como os demais comportamentos, são regulados pelo sistema nervoso central (SNC) em resposta a estímulos internos e ambientais (Lent, 2008; Mccaughey, 2008; Lent, 2010). O hipotálamo é considerado como um centro de controle e possui estruturas que são responsáveis por regular os comportamentos consumatórios de sede e fome, dentre elas destacam-se o núcleo paraventricular (NPV), o núcleo supraótico (NSO), núcleo ventromedial (NVM), núcleo dorso medial (NDM), núcleo arqueado e a área hipotalâmica lateral (Lent, 2008; Magni
et al., 2009; Lent, 2010). O complexo vagal dorsal (CVD) (que compreende o núcleo
dorsal do vago, o núcleo do trato solitário (NTS) e a área postrema (AP)) juntamente aos demais órgãos circunventriculares (OCVs, que possuem barreira hematoencefálica incompleta), em especial o órgão subfornical (OSF) e o órgão vasculoso da lâmina terminal (OVLT), promovem uma ligação entre os sinais periféricos e o hipotálamo, que processa as informações sob a influência de estruturas córtico-límbicas, e envia projeções para o tronco encefálico, que por sua vez coordena as ações dos sistemas oromotor e locomotor que resultará na ingestão ou rejeição (Lent, 2008; Magni et al., 2009; Lent, 2010).
Segundo Norgren et al (2003) os comportamentos motivados ingestivos podem ser
influenciados pelo sistema gustativo por meio das respostas hedônicas imediatas, que são refletidas pelas preferências e aversões, por meio de aprendizado e também por processos de privação, que podem alterar as preferências e aversões.
2
relação entre a busca de prazer e o comportamento pode ser observada pela influência exercida pelo sabor no comportamento de ingestão (Mccaughey, 2008).
Em humanos a ingestão decorrente da busca pelo prazer tem superado o controle homeostático, sendo relacionada à crescente prevalência de obesidade e doenças relacionadas, podendo ser observadas preferências por alimentos de alto valor calórico, ricos em açúcares e gordura (Levine et al., 2003a; Lowe et al., 2007; Lundy,
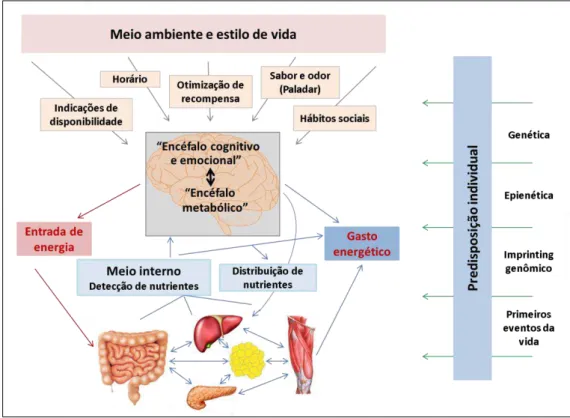
2008; Berthoud, 2011). Apesar de a etiologia da obesidade ser complexa e envolver fatores genéticos, metabólicos e comportamentais, de modo geral, ela resulta de um desequilíbrio energético de longo prazo (Lundy, 2008). Como pode ser observado na Figura 1, muitos fatores estão relacionados ao consumo excessivo de alimentos, que por vezes ocorre mesmo na ausência de fome e presença de grande reserva de gordura, envolvendo fatores cognitivos, emocionais e de recompensa que possuem vias neurais paralelas aos mecanismos de dependência (Berthoud, 2011). Esse fato foi demonstrado por Colantuoni et al (2002) que aponta evidências de que o consumo
excessivo de açúcar causa dependência com sinais de abstinência similar à morfina e nicotina.
3
Sinais gerados por estruturas córtico-límbicas, relativos a processamento de informações de recompensa, sensoriais e cognitivas, podem influenciar, no hipotálamo, processos relevantes para a regulação do metabolismo energético (Berthoud, 2011). Gorduras e açúcares, particularmente os açucares, podem afetar sistemas centrais de recompensa, aumentando a ingestão de alimentos (Levine et al.,
2003a; b; Mccaughey, 2008).
A ingestão de açúcares (sabor doce) estimula respostas neurais e comportamentais distintas das evocadas por outros compostos (sabores salgado, azedo, amargo e umami), o que leva praticamente todos os mamíferos a responderem aos açucares pelo sabor (Mccaughey, 2008). Em paralelo aos mecanismos que controlam os comportamentos ingestivos, as informações gustativas periféricas são direcionadas inicialmente ao núcleo do trato solitário (NTS), seguido por projeções para o núcleo parabraquial (NPB) na ponte e tálamo (o subnúcleo mediano ventral posterior), e, em seguida, para o córtex insular agranular, onde as respostas neurais dentro de cada núcleo irá fornecer uma estreita correspondência com a qualidade do sabor. Além disso, outras áreas do encéfalo, tais como amígdala, núcleo accumbens, hipotálamo lateral e córtex orbitofrontal, mudam sua taxa de ativação após a estimulação do paladar por sabor doce (Mccaughey, 2008; Mungarndee et al., 2008) A avaliação da
expressão de proteína C-fos após a ingestão de sacarose em comparação a ingestão de água, revela maior ativação em neurônios no NTS, NPB, tálamo gustatório, no córtex gustativo (GC), no núcleo do leito da estria terminal, no núcleo central da amígdala, e em parte do núcleo accumbens (Mungarndee et al., 2008).
4
receberam o SR141716, que é um bloqueador do receptor CB1 (receptor canabinóide específico do SNC), apresentaram redução na ingestão de sacarose, o que sugere que canabinóides endógenos possam modular a ingestão de sacarose (Arnone et al.,
1997; Yoshida, T. et al., 2012). De modo oposto, insulina e leptina, sinais
neuroendócrinos que regulam a homeostase da energia no SNC, desempenhando papel anorexígeno, desempenham também um papel de modulação do sistema de recompensa, reduzindo a ingestão de sacarose (Kawai et al., 2000; Figlewicz et al.,
2001; Figlewicz et al., 2006; Figlewicz et al., 2008; Shigemura et al., 2013). Este fato
pode ser observado através do estudo de Figlewicz et al (2006) que verificaram que a injeção central de insulina e leptina reduzem a resposta de desempenho motivado para ingestão de sacarose 5%. Observaram ainda, que ratos alimentados com uma dieta rica em gordura durante 5 semanas eram resistentes aos efeitos centrais (intracerebroventricular, icv) de insulina ou leptina na redução da ingestão de sacarose. Outro fator que regula a homeostase de energia é o transcrito relacionado à cocaína e à anfetamina (CART), que é um neuropeptídio anorexígeno produzido pelo SNC com expressão modulada pelo estado nutricional. Assim como leptina e insulina, quando injetado no sistema ventricular suprime a ingestão de alimento e a ingestão de sacarose (Zheng et al., 2001).
Como pode-se observar várias substâncias endógenas parecem estar envolvidas na regulação, não apenas da ingestão de alimento, quanto de sacarose (sabor doce). Um importante peptídeo que se sabe estar envolvido na regulação dos comportamentos motivados, como sede, apetite ao sódio e ingestão de alimento é a angiotensina II (Rowland et al., 1992; Fitzsimons, 1998; Luca et al., 2002; Porter et al., 2003; Porter
et al., 2004; Formenti et al., 2011; Wright et al., 2011; Yamamoto et al., 2011;
Nakano-Tateno et al., 2012);
1.2. Angiotensina II
1.2.1. Aspectos gerais
5
plasmática, do volume sanguíneo ou da pressão arterial desencadeiam o processo que dá origem a Ang II, que através da circulação sanguínea alcança diversos tecidos onde atua principalmente por meio dos receptores AT1 e AT2 (Fitzsimons, 1998; Berne et al., 2004; De Kloet et al., 2010). Os receptores AT1 e AT2 pertencem à família
de receptores acoplados a proteína G e quando ligados a Ang II produzem sinais que levam a ações que geralmente são opostas, um exemplo disso é que Ang II ligada a AT1 promove vasoconstrição e quando ligada ao receptor AT2 promove vasodilatação (Fyhrquist et al., 2008; Wright et al., 2011). Ang II circulante é amplamente conhecida
por seu papel na regulação do balanço hidroeletrolítico e função cardiovascular, uma vez que atua diretamente nas arteríolas promovendo vasoconstrição; no lobo posterior da glândula hipófise estimulando a secreção de vasopressina; nos rins, diretamente no túbulo renal aumentando excreção de potássio e a reabsorção de sódio (consequentemente aumentando a retenção de água); e no córtex da glândula renal estimulando a liberação de aldosterona, que por sua vez também atua na excreção de potássio e reabsorção de sódio (Fitzsimons, 1998; Berne et al., 2004; Fyhrquist et al., 2008; De Kloet et al., 2010).
Além da Ang II circulante, existem vários tecidos e até mesmo dentro de algumas células (intracelular) onde ocorre a produção e atuação da Ang II, bem como de outros componentes do SRA (SRA local), o que permite considerar sua atuação como endócrina, parácrina e autócrina. No encéfalo, componentes do SRA local medeiam uma grande variedade de atividades neurobiológicas que ainda estão sendo estudadas, como por exemplo, apoptose e regeneração neuronal, respostas de aprendizagem e memória, secreção de vasopressina, e ingestão alimentar e de sal e água (Fyhrquist et al., 2008; Wright et al., 2011). Contudo, Ang II circulante também
atua no encéfalo por meio de sua ligação a receptores presentes nos órgãos circunventriculares (OCVs), que são regiões encefálicas livres de barreira hematoencefálica, o que permite ao encéfalo detectar sinais ou alterações na composição do sangue e responder a essas alterações por meio de ajustes neurais ou neuroendócrinos (Fitzsimons, 1998; Luca et al., 2014).
1.2.2. Angiotensina II e comportamentos ingestivos
6
(Fitzsimons 1979, Lind and Kim Johnson 1982; Avrith and Fitzsi-mons, 1980; Fitzsimons 1998). Desde então, vários estudos vem sendo desenvolvidos e seu efeito sobre a ingestão, bem como os mecanismos pelos quais angiotensina II modula os comportamentos ingestivos vem sendo esclarecidos.
Os OCVs como o órgão vasculoso da lâmina terminal (OVLT), órgão subfornicial (OSF) e a área postrema (AP) são ricos em receptores de Ang II, e medeiam a ação desse peptídeo no controle da ingestão de água e sódio (Formenti et al., 2011; Wright et al., 2011; Luca et al., 2014).
Quando injetada centralmente, Ang II estimula a ingestão de água e esse efeito é abolido quando losartana (antagonista de receptores AT1) é administrada, mostrando que este efeito seria mediado por meio da ligação de Ang II principalmente nos receptores AT1, encontrados nos OCVs (Fitzsimons, 1998; Wright et al., 2011).
Quando PD123319 (antagonista do receptor AT2) é administrado centralmente também inibe o efeito de Ang II central sobre a ingestão de água, porém para isso é necessária uma concentração maior que a concentração de losartana utilizada para gerar o mesmo efeito (Rowland et al., 1992).
Em relação à ingestão de sódio, microinjeções centrais de Ang II em diferentes doses estimula a ingestão de soluções de sódio independente da ingestão de água e da natriurese induzida por Ang II, revelando que este peptídeo induz o apetite ao sódio (Formenti et al., 2011). Outra situação onde se pode notar que Ang II induz ao apetite
ao sódio é com a realização do protocolo de privação hídrica de 24 horas seguido de reidratação com água por duas horas, pois essa reidratação corrige totalmente a osmolalidade, mas mantém as concentrações de angiotensina II, que induz o apetite ao sódio (Luca et al., 2002). Os antagonistas dos receptores AT1 e AT2 (losartana e
PD123319) centralmente reduzem a ingestão de solução hipertônica de NaCl induzida por privação hídrica ou depleção de sódio (Sato et al., 1996). Ang II também é capaz
de gerar mudanças na sensibilidade gustativa ao sódio e aumentar a preferência ao mesmo, tornando mais palatáveis algumas concentrações de salina que normalmente seriam consideradas aversivas (Fitzsimons, 1998; Shigemura et al., 2013; Shigemura,
7
Além de modular os comportamentos relativos à ingestão de água e sódio (controle hidrossalino), Ang II tem efeito sobre a ingestão de alimentos. Yoshida et al (2012)
demonstraram que a administração sistêmica ou icv de Ang II reduz a expressão dos neuropeptídios orexígenos (NPY e orexina) gerando efeitos de redução do apetite. Além disso, infusões icv crônicas de Ang II também tem efeito anorexígeno em ratos, sendo esse efeito abolido quando antagonistas dos receptores AT2 foram utilizados e reduzido quando antagonistas dos receptores AT1 foram utilizados (Porter et al., 2003;
Porter et al., 2004; Nakano-Tateno et al., 2012).
Estudos demonstraram ainda que camundongos knockout para receptores AT1 apresentaram um aumento na sua ingestão alimentar, indicando seu provável papel no efeito inibitório de Ang II sobre a ingestão de alimentos (Yamamoto et al., 2011).
Todavia, pouco se sabe sobre o papel da Ang II na regulação da ingestão de sacarose. Estudos recentes têm demonstrado que a Ang II está relacionada a alguns aspectos da preferência por sabor doce. Em roedores, a administração periférica de Ang II gerou aumento da resposta do nervo corda do tímpano quando sacarose e glicose e os adoçantes sacarina e SC45647 foram oferecidas, sendo o efeito da sacarose mais significativo e abolido após administração de um antagonista do receptor AT1 (CV11974) de angiotensina II. Além disso, a administração de CV11974 reduziu também o número de lambidas para as soluções de sacarose com baixas concentrações quando a produção de Ang II endógena foi estimulada por protocolo de privação hídrica (Shigemura et al., 2013; Shigemura, 2015).
8 2. Objetivos
2.1 Geral
Investigar a ação central de angiotensina II na regulação da ingestão de solução de sacarose 2%.
2.2 Específicos
Avaliar o efeito da injeção central (ventrículo lateral - VL) de diferentes doses de angiotensina II sobre a ingestão de sacarose 2% em ratos habituados e não habituados a ingerir sacarose;
Verificar se a habituação altera o comportamento de ingestão de sacarose 2% induzida por injeção central de angiotensina II;
Avaliar a participação dos receptores AT1 e AT2 na ingestão de sacarose induzida por injeção central de angiotensina II;
9 3 Materiais e Métodos
3.1 Modelo Animal
Neste estudo foram utilizados ratos Wistar machos, adultos (aproximadamente 12 semanas) e com peso entre 280 e 320g, provenientes do Centro de Ciência Animal (CCA) da Universidade Federal de Ouro Preto. Os ratos foram mantidos com ração e água ad libitum, ciclo claro-escuro de 12h e temperatura média de 23°C, até a
realização dos protocolos experimentais. Os animais foram divididos em três conjuntos experimentais conforme mostrado na Figura 2. Todos os procedimentos foram realizados de acordo com aprovação prévia do Comitê de Ética em Uso Animal (CEUA) da Universidade Federal de Ouro Preto, sob protocolo nº 2015/31.
10 3.2 Drogas e Soluções
3.2.1 Drogas utilizadas nos procedimentos cirúrgicos
Anestésico: solução de cetamina + xilazina (2,5 mL de Xilazina 2% (p/v) adicionado a 10 mL de cetamina 10% (p/v)). A dose utilizada foi 80mg/kg de cetamina e 7mg/kg de xilazina em um volume de 0,1mL/100g de animal, por via intraperitoneal.
Anti-inflamatório: cetoprofeno 2mg/Kg em 0,1mL por animal por via intramuscular.
Antibiótico: pentabiótico veterinário 0,1mL/300g de animal (Penicilina 4.800UI/kg, Estreptomicina 2mg/kg de diidroestreptomicina 2mg/kg) por via subcutânea.
3.2.2 Drogas utilizadas nas injeções intracerebroventr iculares
Veículo - PBS (Salina tamponada com fosfato): solução de NaCl, Na2HPO4.H2O e NaH2PO4.H2O diluídos em água ultrapurificada (Milli-Q), com pH ajustado a 7,2, esterilizada por autoclavação durante 30 minutos e mantida à temperatura ambiente para uso.
Angiotensina II (Sigma®): foi diluída nas concentrações 0,1; 0,4 e 0,8nmol/μL, distribuídas em aliquotas de 10 μL e armazenadas a -5°C até o momento do uso.
Losartana potássica (Gemini®): foi diluído na concentração 50nmol/μL, distribuído em aliquotas de 10 μL e armazenadas a -5°C até o momento do uso.
PD123319 (Sigma®): foi diluído na concentração 30nmol/μL, distribuídas em aliquotas de 10 μL e armazenadas a -5°C até o momento do uso.
As doses foram estabelecidas com base em experimentos já realizados anteriormente no laboratório como parte de outros projetos de pesquisa (Marchi, 2014).
3.2.3. Drogas utilizadas na eutanásia
Anestésico: Tiopental sódico (60 mg/kg – volume de injeção: 0,1 mL para cada 100 g de peso corporal).
11 3.3 Cirurgia encefálica (Estereotaxia)
A cirurgia consistiu no implante de uma cânula guia no encéfalo dos animais, direcionada ao ventrículo lateral (VL). Para tanto, os animais foram anestesiados com injeção intraperitoneal de solução de cetamina (80mg/kg) e xilazina (7mg/kg) e adaptados a um aparelho estereotáxico Stoelting®. Dois parafusos de aço inoxidável foram implantados no osso craniano a fim de dar estabilidade ao implante após o fim da cirurgia. Os pontos de referência bregma e lambda foram alinhados para nivelar a cabeça dos ratos. O ponto de introdução da cânula guia foi determinado utilizando o bregma como referência e seguindo as coordenadas: 0,8 mm antero-posterior, 1,7 mm mediana à lateral direita e 2,7 mm dorso-ventricular (abaixo da dura mater). No local, um orifício de aproximadamente 0,8 mm foi feito no osso craniano por meio de trepanação para inserção da cânula guia. O corte cirúrgico foi fechado com resina acrílica odontológica, fixando a cânula guia com o auxílio dos parafusos previamente implantados. Após a resina estar seca, a cânula guia foi obstruída com um mandril de aço inoxidável até o momento dos experimentos. Os animais receberam uma dose de anti-inflamatório intramuscular e antibiótico subcutâneo e passaram por cinco dias de recuperação com livre acesso a água e alimento e a outras soluções conforme o protocolo realizado.
3.4 Microinjeções intracerebroventriculares
Para as microinjeções intracerebroventriculares realizadas como parte dos protocolos experimentais, utilizou-se seringa Hamilton (10μL) conectada com tubo de polietileno
PE-10 de aproximadamente 25cm a uma agulha injetora de 12mm, que foi introduzida no encéfalo através da cânula guia (10mm) implantada pela estereotaxia. Para tanto o animal foi imobilizado, o mandril foi retirado e a agulha injetora foi introduzida, sendo microinjetado o volume de 1μL por aplicação, conforme o protocolo utilizado. Após a microinjeção a agulha injetora foi retirada e o mandril foi novamente colocado para evitar a obstrução da cânula guia.
3.5 Protocolos experimentais
12
Dois grupos de animais passaram por este protocolo. Em todos foi realizada a estereotaxia para o implante de cânula guia direcionada ao VL e posteriormente foram colocados em gaiolas individuais onde passaram por período de adaptação e recuperação, de no mínimo cinco dias, antes da realização do experimento. O primeiro grupo, chamado de habituados (H), durante a adaptação teve livre acesso ao alimento e água, e duas horas por dia, sempre das 14:00 as 16:00h, a ração e a água foram retiradas e foi ofertado um bebedouro graduado contendo solução de sacarose 2% e um bebedouro graduado contendo água, esse processo se repetiu até que houvesse estabilidade (em torno de 10 dias) na quantidade de sacarose ingerida.
O segundo grupo, chamado de não habituados (NH), durante o período de recuperação pós-cirúrgico, teve livre acesso ao alimento e a dois bebedouros, o primeiro contendo água e o segundo solução de sacarose 2%. Após os dias de adaptação/recuperação, o experimento foi realizado (às 14:00h) de forma similar para os dois grupos.
Para tanto, a água e a ração (e a solução de sacarose no grupo não habituado) foram retiradas e os animais receberam injeção central (VL) de PBS ou Ang II nas
concentrações 0,1; 0,4 ou 0,8nmol/μL. Após 15 minutos, água e sacarose 2% foram
oferecidas ao animal, sendo a ingestão das mesmas mensuradas nos tempos de 15, 30, 60, 90 e 120 minutos (Figura 3). Ao final das 2 horas, os animais receberam ração e água (e sacarose, grupo não habituado) ad libitum. Cada grupo de ratos foi
submetido a quatro tratamentos: PBS; Ang II 0,1; Ang II 0,4; Ang II 0, 8nmol/μL. Em
13
Figura 3: Protocolo para determinação do efeito central de angiotensina II realizado em ratos habituados ou não à ingestão de sacarose. *Sacarose retirada no grupo não habituado.
3.5.2 Protocolo II - Estudo do efeito da associação entre angiotensina II e os antagonistas dos receptores AT1 e AT2 sobre a ingestão de sacarose 2%
Dois grupos de animais não habituados a ingerirem sacarose passaram por este experimento. Um grupo recebeu injeções icv do antagonista do receptor AT1
(losartana 50nmol/μL) e o outro do antagonista do receptor AT2 (PD123319
30nmol/μL). Todos os animais passaram pela estereotaxia para o implante de cânula
guia direcionada ao VL e posteriormente foram colocados em gaiolas individuais onde passaram por período de adaptação/recuperação de no mínimo cinco dias, no qual receberam livre acesso a ração, água e solução de sacarose 2%. Para a realização do experimento, água, sacarose e ração foram retiradas, em seguida, os animais receberam injeção central (VL) de PBS ou antagonista correspondente ao grupo (losartana ou PD 123319) e após 15 min receberam injeção central (VL) de PBS ou
angiotensina II 0,4 nmol/μL. Novamente, após 15 minutos, água e sacarose 2% foram
oferecidas ao animal, e a ingestão foi mensurada nos tempos de 15, 30, 60, 90 e 120 min (Figuras 6 e 7). Ao final dos 120 min, os animais receberam ração, água e sacarose ad libitum. Cada grupo de ratos foi submetido a 4 tratamentos: PBS + PBS;
14
experimento e outro. Encerrado o protocolo, os animais foram perfundidos com formalina 10% e os encéfalos foram retirados para posterior análise histológica do posicionamento das cânulas guia.
Figura 4: Protocolo para determinação da participação do receptor AT1 na ingestão de sacarose decorrente da administração central de angiotensina II em ratos não habituados.
Figura 5: Protocolo para determinação da participação do receptor AT2 na ingestão de sacarose decorrente da administração central de angiotensina II em ratos não habituados.
3.5.3 Protocolo III - Estudo do efeito da privação hídrica de 24 horas seguida de reidratação na ingestão de sacarose 2%
15
bebedouros, o primeiro contendo água e o segundo solução de sacarose 2%. O segundo grupo, chamado ASS (água/sacarose/salina hipertônica-1,8%), durante a adaptação teve livre acesso ao alimento e a três bebedouros, contendo água, solução de sacarose 2% e solução de NaCl 1,8%. Os bebedouros foram colocadas lado a lado. Ao fim do período de adaptação, os animais tiveram todos os bebedouros retirados permanecendo com livre acesso apenas ao alimento durante 24 horas (privação hídrica de 24 horas). Após este período, a ração foi removida e foi oferecido aos animais um bebedouro graduado contendo água, durante 120 minutos (período de reidratação). A ingestão foi mensurada nos tempos 15, 30, 60, 90 e 120 minutos. Aos 120 minutos, além de manter o bebedouro de água, foi oferecido aos animais do grupo AS um bebedouro graduado contendo solução de sacarose 2% e aos animais do grupo ASS dois bebedouros graduados contendo solução de sacarose 2% e salina 1,8%. Os bebedouros foram colocados na ordem que utilizados durante a adaptação, e permaneceram durante mais 120 minutos (totalizando 240 minutos). A ingestão de água e das soluções de sacarose e salina colocadas (conforme o grupo) foram mensuradas nos tempos 135, 150, 180, 210 e 240 minutos (Figuras 6 e 7). Ao final das 4 horas de período experimental, foram retirados os bebedouros graduados e retornadas a ração e os bebedouros convencionais de água, sacarose e salina (de acordo com o grupo). Para a determinação do controle para este experimento, os mesmos procedimentos (240 minutos) foram realizados no mesmo horário, sem que a privação hídrica acontecesse previamente a ele.
16
Figura 7: Protocolo experimental realizado com o grupo ASS para a determinação do efeito de privação hídrica sobre a ingestão de solução de sacarose 2% e NaCl 1,8%.
3.6 Análise histológica
Ao final dos protocolos experimentais I e II, 1 µL de azul de Evans foi injetado através da cânula guia a fim de marcar o local onde foram injetadas as drogas. Os ratos foram profundamente anestesiados com injeção intraperitoneal de tiopental sódico (60 mg/kg – volume de injeção: 0,1 mL para cada 100 g de peso corporal) e uma abertura torácica foi realizada para a exposição do coração que então foi perfundido com 20 mL de formalina 10% tamponada com fosfato 0,1M. Uma abertura no crânio dos animais foi realizada para remoção do encéfalo que foi fixado em formalina 10% tamponada com fosfato 0,1M por, no mínimo, 24 horas. Após esse período, cortes transversais (50 µm de espessura) foram feitos nos pontos de injeção com auxílio de um criostato e em seguida montados sobre lâminas de vidro previamente gelatinizadas. Os cortes foram, então, visualizados a fresco sob lupa (aumento aproximado de 5 vezes) para confirmação da microinjeção no ventrículo lateral. Apenas animais cujo sítio de injeção foi confirmado no VL foram computados na análise dos dados.
3.7 Apresentação dos resultados e análise dos dados
17
sua confecção. Teste t pareado ou não pareado foi utilizado para comparar a ingestão cumulativa ao final dos experimentos em grupos distintos. Análise de variância
18 4 Resultados
4.1 Análise Histológica
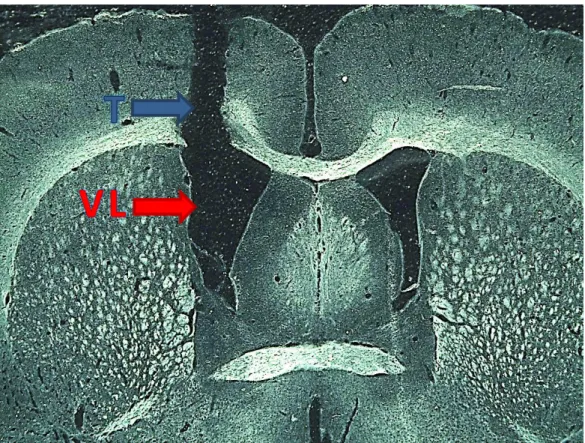
A Figura 8 mostra corte histológico do encéfalo de um rato demonstrando a trajetória (T) da cânula guia e o ventrículo lateral (VL), ponto onde foram realizadas as microinjeções.
Figura 8: Fotomicrografia a fresco de corte histológico transversal de encéfalo de rato indicando pela seta vermelha o ventrículo lateral (VL) e a pela seta azul a trajetória (T) da cânula guia.
4.2 Efeito central de angiotensina II (Ang II) na ingestão de sacarose em ratos habituados e não habituados
4.2.1 Efeito central de Ang II na ingestão de água e sacarose em ratos habituados
19
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0 5 1 0 1 5 2 0 2 5
A : Á g u a
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0 5 1 0 1 5 2 0 2 5
P B S
A n g II 0 ,1 n m o l/L A n g II 0 ,4 n m o l/L A n g II 0 ,8 n m o l/L
* * * * *
* * * * *
* * * *
*
B : S a c a r o s e 2 %
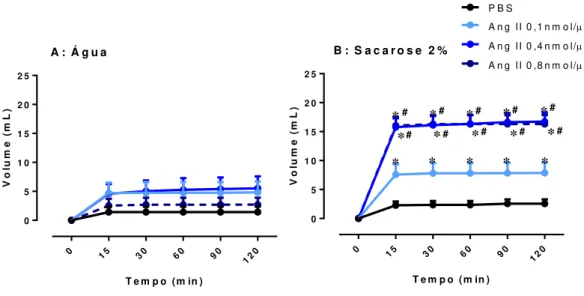
Figura 9: Ingestão cumulativa de água (A) e sacarose 2% (B) pelo grupo habituado após a microinjeção
de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. N=8. *Diferente do grupo controle (PBS).
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0 5 1 0 1 5 2 0 2 5
P B S
A n g II 0 ,1 n m o l/L A n g II 0 ,4 n m o l/L A n g II 0 ,8 n m o l/L
* * * * *
* * * * *
* * * *
*
V o lu m e to ta l
Figura 10: Volume total (água + sacarose 2%) cumulativo ingerido pelo grupo habituado após a
microinjeção de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. N=8. *Diferente do grupo controle (PBS).
Quando analisada por períodos, também não houve diferenças na ingestão de água e notou-se que a ingestão de sacarose estimulada pela angiotensina II se concentrou nos primeiros minutos após a oferta [P<0,05], não sendo diferente do grupo controle
após 60 minutos, independente da dose. As doses de 0,4 e 0,8nmol/μL produziram um efeito similar e maior que a dose de 0,1nmol/μL sobre a ingestão de sacarose nos
primeiros 15 minutos, entretanto a partir de 30 minutos a ingestão foi igual a do grupo
controle. Em relação a dose de 0,1nmol/μL, a ingestão foi superior ao controle nos
20
Tabela 1: Ingestão de água (mL) e sacarose 2% (mL) pelo grupo habituado em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min), ao longo dos 120 minutos de medida de ingestão, após a microinjeção no VL de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL.
Tratamento
Tempo (minutos)
0-15 15-30 30-60 60-90 90-120
Á
gu
a
PBS 0,3 ± 0,1 0,0 ± 0,0 0,1 ± 0,1 0,0 ± 0,0 0,0 ± 0,0
Ang II 0,1nmol/μL 1,8 ± 1,5 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Ang II 0,4nmol/μL 0,7 ± 0,7 0,1 ± 0,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Ang II 0,8nmol/μL 1,2 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
S
aca
rose
PBS 6,7 ± 1,9 0,2 ± 0,2 0,0 ± 0,0 0,1 ± 0,1 0,5 ± 0,5
Ang II 0,1nmol/μL 13,7 ± 1,8* 2,9 ± 2,7* 0,1 ± 0,0 0,0 ± 0,0 0,2 ± 0,1
Ang II 0,4nmol/μL 16,9 ± 1,8*# 0,7 ± 0,5 0,1 ± 0,1 0,4 ± 0,4 0,0 ± 0,0
Ang II 0,8nmol/μL 17,2 ± 1,6*# 0,5 ± 0,2 0,0 ± 0,0 0,0 ± 0,0 0,8 ± 0,7
N=8. *Diferente do grupo controle (PBS). #Diferente de Ang II 0, 1 nmol/μL.
4.2.2 Efeito central de Ang II na ingestão de água e sacarose em ratos não habituados
Assim como os animais habituados, a ingestão de água pelo grupo de animais não habituados não foi diferente entre o controle e nenhuma das doses de angiotensina II utilizadas [p>0,05] (Figura 11 A). Porém a intensidade da ingestão cumulativa de sacarose diferiu de acordo com as doses de Ang II utilizadas, apresentando maior efeito para as maiores doses [P<0,05] (Figura 11 B). Em relação ao volume total cumulativo ingerido, a ingestão também foi maior quando os animais receberam as doses de 0,4 e 0,8nmol/μL, do que quando receberam a dose de 0,1nmol/μL, mas as
21
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0 1 20 0 5 1 0 1 5 2 0 2 5
A : Á g u a
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0 1 20
0 5 1 0 1 5 2 0 2 5
P B S
A n g II 0 ,1 n m o l/L A n g II 0 ,4 n m o l/L A n g II 0 ,8 n m o l/L
* * * * * * * * * * * * * * *
B : S a c a r o s e 2 %
# # # # # # # # # #
Figura 11: Ingestão cumulativa de água (A) e sacarose 2 % (B) pelo grupo não habituado após a microinjeção de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. N=8. *Diferente do grupo controle (PBS).
#Diferente de Ang II 0, 1 nmol/μL.
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0
5 1 0 1 5 2 0
2 5 P B S
A n g II 0 ,1 n m o l/L
A n g II 0 ,4 n m o l/L
A n g II 0 ,8 n m o l/L
* * * * * * * * * * * * * * * # # # # # # # # # #
V o lu m e to ta l
Figura 12: Volume total cumulativo (água + sacarose 2%) ingerido pelo grupo não habituado após a microinjeção no VL de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL. N=8. *Diferente do grupo controle (PBS).
#Diferente de Ang II 0, 1 nmol/μL.
22
Tabela 2: Ingestão de água (mL) e sacarose 2% (mL) pelo grupo não habituado em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min) ao longo dos 120 minutos de medida de ingestão, após a microinjeção no VL de PBS ou Ang II 0,1; 0,4 e 0,8 nmol/μL.
Tratamento
Tempo (minutos)
15 30 60 90 120
Á
gu
a
PBS 1,4 ± 1,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Ang II 0,1nmol/μL 6,7 ± 2,0 0,1 ± 0,1 0,0 ± 0,0 0,0 ± 0,0 0,1 ± 0,0
Ang II 0,4nmol/μL 4,6 ± 1,9 0,7 ± 0,3 0,4 ± 0,3 0,2 ± 0,2 0,2 ± 0,1
Ang II 0,8nmol/μL 2,4 ± 1,2 0,3 ± 0,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
S
aca
rose
PBS 2,5 ± 0,8 0,1 ± 0,1 0,2 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Ang II 0,1nmol/μL 5,5 ± 1,0* 0,3 ± 0,2 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Ang II 0,4nmol/μL 17,2 ± 1,6*# 0,5 ± 0,1 0,4 ± 0,2 0,4 ± 0,3 0,1 ± 0,1
Ang II 0,8nmol/μL 14,9 ± 1,5*# 0,3 ± 0,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
N=8. *Diferente do grupo controle (PBS). #Diferente de Ang II 0, 1 nmol/μL.
4.2.3 Comparação entre a ingestão cumulativa de água e sacarose induzidas por angiotensina II nos grupos habituados e não habituados após 120 minutos de experimento
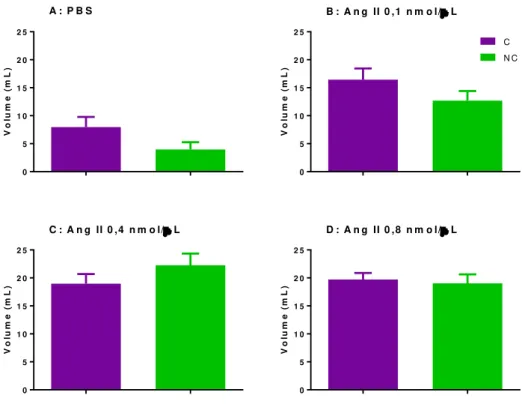
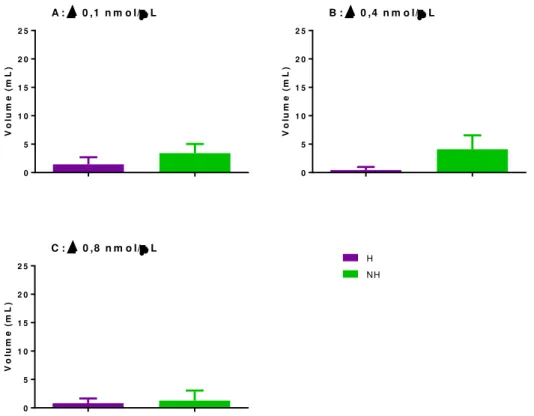
Ao final dos 120 minutos de experimento, não houve diferença entre a quantidade de água ingerida entre os grupos habituado e não habituado à ingestão de sacarose [p>0,05] (Figura 13 A, B, C e D).
Entretanto, a ingestão de sacarose 2% pelo grupo controle (PBS) foi superior no grupo habituado [p<0,05] (Figura 14 A) tendo ocorrido o mesmo quando a menor dose de
Ang II (0,1nmol/μL) foi injetada [p<0,05] (Figura 14 B). Entretanto, para as maiores
23 V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
A : P B S
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5 H NH
B : A n g II 0 ,1 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
C : A n g II 0 ,4 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
D : A n g II 0 ,8 n m o l/L
Figura 13: Diferença entre a ingestão cumulativa de água pelos grupos habituados (H) e não habituados (NH) após microinjeção no VL de A: PBS; B: Ang II 0,1nmol/μL; C: Ang II 0,4 nmol/μL. D: Ang II
0,8nmol/μL ao final de 120 minutos de experimento. N=8.
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
A : P B S
* V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5 H NH B : A n g II 0 ,1 n m o l/L
* V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
C : A n g II 0 ,4 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
D : A n g II 0 ,8 n m o l/L
Figura 14: Diferença entre a ingestão cumulativa de sacarose 2% pelos grupos habituados (H) e não
habituados (NH) após microinjeção no VL de A: PBS; B: Ang II 0,1nmol/μL; C: Ang II 0,4 nmol/μL. D:
24
Não houve diferença entre os grupos habituado e não habituado para o volume total ingerido em 120 minutos de experimento [p >0,05] (Figura 15 A, B, C e D).
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
A : P B S
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5 C N C B : A n g II 0 ,1 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
C : A n g II 0 ,4 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
D : A n g II 0 ,8 n m o l/L
Figura 15: Comparação entre o volume total (água + sacarose 2%) cumulativo ingerido pelo grupo habituado (H) e pelo grupo não habituado (NH) após microinjeção no VL de A: PBS; B: Ang II
0,1nmol/μL; C: Ang II 0,4 nmol/μL. D: Ang II 0,8nmol/μL ao final de 120 minutos de experimento. N=8.
25 V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
A : 0 ,1 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
B : 0 ,4 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0
2 5 H
NH C : 0 ,8 n m o l/L
Figura 16: Δ da ingestão cumulativa de água nos grupos habituados (H) e não habituados (NH) após
microinjeção no VL de A: Ang II 0,1nmol/μL; B: Ang II 0,4 nmol/μL; C: Ang II 0,8nmol/μL ao final de
120 minutos de experimento. N=8.
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
A : 0 ,1 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
B : 0 ,4 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0
2 5 H
NH
C : 0 ,8 n m o l/L
Figura 17: Δ da ingestão cumulativa de sacarose 2% nos grupos habituados (H) e não habituados (NH)
26 V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
A : 0 ,1 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0 2 5
B : 0 ,4 n m o l/L
V o lu m e ( m L ) 0 5 1 0 1 5 2 0
2 5 H
NH
C : 0 ,8 n m o l/L
Figura 18: Δ do volume total cumulativo ingerido pelos grupos habituados (H) e não habituados (NH)
após microinjeção no VL de A: Ang II 0,1nmol/μL; B: Ang II 0,4 nmol/μL;C: Ang II 0,8nmol/μL ao final
de 120 minutos de experimento. N=8
4.3 Efeitos da administração do antagonista de receptores AT1 (losartana) e AT2 (PD123319) na ingestão de sacarose 2% induzida por angiotensina II central
4.3.1 Antagonista do receptor AT1
O bloqueio do receptor AT1 por meio da microinjeção de losartana 50nmol/μL aboliu
27
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0 1 20
0 1 2 3 4 5 * * * * *
A : Á g u a
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0 5 1 0 1 5 2 0 2 5
P B S + P B S P B S + A n g II
lo s a rta n a + P B S lo s a rta n a + A n g II
* * * * *
B : S a c a r o s e 2 %
Figura 19: Ingestão cumulativa de água (A) e sacarose 2% (B) após a microinjeção no VL de PBS ou
losartana 50nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL . N=5. *Diferente do grupo
controle (PBS + PBS).
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0
5 1 0 1 5 2 0
2 5 P B S + P B S
P B S + A n g II
lo s a rta n a + P B S lo s a rta n a + A n g II
* * * * *
V o lu m e to ta l
28
V o lu m e (m L )
0 5 1 0 1 5 2 0
lo s a rta n a + A n g II P B S + A n g II
1 0 0 %
8 ,4 %
Figura 21: Porcentagem (%) correspondente à ingestão total (mL, água + sacarose 2%) induzida pela microinjeção no VL de Ang II 0,4nmol/μL quando associada ao prévio tratamento com losartana
50nmol/μL em relação à ingestão promovida pela associação PBS + Ang II (considerada como 100%).
n=5.
Quando avaliada por períodos, losartana aboliu o efeito de Ang II para a ingestão de água [p<0,05] e reduziu a ingestão de sacarose [p<0,05] no tempo 15 (Tabela 3). Nos demais tempos não foram observadas diferenças entre os tratamentos para a ingestão de água e de sacarose (Tabela 3).
Tabela 3: Ingestão de água (mL) e sacarose 2% (mL) em intervalos de 15 ou 30 min (períodos/intervalos: 0 a 15; 15 a 30; 30 a 60; 60 a 90; 90 a 120 min) ao longo dos 120 minutos de medida de ingestão após a microinjeção no VL de PBS ou losartana (Los) 50nmol/μL seguida da
microinjeção de PBS ou Ang II 0,4nmol/μL.
Tratamento
Tempo (minutos)
15 30 60 90 120
Á
gu
a
PBS + PBS 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
PBS + Ang II 1,0 ± 0,4* 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 Los + Ang II 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Los + PBS 0,3 ± 0,2 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
S
aca
rose
PBS + PBS 0,0 ± 0,0 0,6 ± 0,6 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
PBS + Ang II 14,9 ± 2,0* 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Los + Ang II 1,9 ± 1,1*# 0,5 ± 0,5 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
Los + PBS 1,2 ± 1,2 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
29
4.3.2 Antagonista do receptor AT2
O bloqueio do receptor AT2 por meio da microinjeção de PD 123319 30nmol/μL (PD) associado a Ang II aumentou a ingestão cumulativa de água em relação aos demais tratamentos [p<0,05] e aboliu a ingestão cumulativa de sacarose [p<0,05] (Figura 22 A e B). Em relação ao volume total cumulativo ingerido, PD 123319 reduziu o efeito de Ang II sobre a ingestão [p<0,05] (Figura 23), sendo uma redução de 53,3% (Figura 24).
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0 5 1 0 1 5 2 0 2 5 * * * * *
A : Á g u a
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0
1 20 0 5 1 0 1 5 2 0 2 5
P B S + P B S P B S + A n g II
P D + P B S P D + A n g II
* * * * *
B : S a c a r o s e 2 %
Figura 22: Ingestão cumulativa de água (A) e sacarose 2% (B) após a microinjeção no VL de PBS ou
PD123319 (PD) 30nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL . N=5. *Diferente do
30
T e m p o (m in )
V
o
lu
m
e
(
m
L
)
0 1 5 3 0 6 0 9 0
1 20 0
5 1 0 1 5 2 0 2 5
P B S + P B S P B S + A n g II
P D + P B S P D + A n g II
*
* *
* *
* *
* *
*
# # # # #
V o lu m e to ta l
Figura 23: Volume total (água + sacarose 2%) cumulativo ingerido após a microinjeção no VL de PBS
ou PD123319 (PD) 30nmol/μL seguida da microinjeção de PBS ou Ang II 0,4nmol/μL . N=5. *Diferente
do grupo controle (PBS + PBS). #Diferente de PBS + Ang II.
V o lu m e (m L )
0 5 1 0 1 5 2 0 2 5
1 0 0 %
4 6 ,7 %
P D + A n g II P B S + A n g II
Figura 24: Porcentagem (%) correspondente à ingestão total (mL, água + sacarose 2%) induzida pela microinjeção no VL de Ang II 0,4nmol/μL quando associada ao prévio tratamento com PD123319 (PD)
30nmol/μL em relação à ingestão promovida pela associação PBS + Ang II (considerada como 100%).
n=5.
Quando avaliada por períodos, PD 123319 (PD) associado a Ang II aumentou a ingestão de água [p<0,05] e reduziu a ingestão de sacarose [p<0,05] no tempo 15, não sendo diferente nos demais tempos (Tabela 4).
31
medida de ingestão após a microinjeção no VL de PBS ou PD123319 (PD) 30nmol/μL seguida da
microinjeção de PBS ou Ang II 0,4nmol/μL.
Tratamento
Tempo (minutos)
15 30 60 90 120
Á
gu
a
PBS + PBS 0,2 ± 0,2 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
PBS + Ang II 0,6 ± 0,3 1,2 ± 1,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
PD + Ang II 4,2 ± 1,4* 0,1 ± 0,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 PD + PBS 0,1 ± 0,1 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
S
aca
rose
PBS + PBS 1,3 ± 0,8 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
PBS + Ang II 14,8 ± 4,0* 0,7 ± 0,4 0,5 ± 0,5 0,0 ± 0,0 1,6 ± 1,2
PD + Ang II 5,4 ± 0,9*# 0,5 ± 0,5 0,0 ± 0,0 0,0 ± 0,0 0,1 ± 0,1
PD + PBS 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0 0,0 ± 0,0
N=5. *Diferente do grupo controle (PBS + PBS). #Diferente de PBS + Ang II.
4.4 Efeito de privação hídrica de 24 horas na ingestão de sacarose 2%.
4.4.1 Ingestão de água e sacarose pelo grupo AS (água/sacarose) após o protocolo de privação hídrica/reidratação
32
T e m p o (m in )
V o lu m e ( m L )
0 1 5 3 0 6 0 9 0 1 20
0 5 1 0 1 5 2 0 2 5 * * * * *
A : Á g u a 0 -1 2 0 m in
T e m p o (m in )
V o lu m e ( m L )
1 20 1 3 5
1 50 1 80 2 10 2 40
0 .0 0 .2 0 .4 0 .6 0 .8 1 .0 * * * *
B : Á g u a 1 2 0 -2 4 0 m in
T e m p o (m in )
V o lu m e ( m L )
1 20 1 35 1 50 1 80 2 10 2 40
0 5 1 0 1 5 2 0 2 5
P riv a d o s C o n tro le
* * * *
*
C : S a c a r o s e 2 % 1 2 0 -2 4 0 m in
Figura 25: Ingestão cumulativa de A: água na fase de reidratação (0 a 120 minutos de experimento); e de água (B) e sacarose (C) após o oferecimento concomitante de água e sacarose 2% (120 a 240 minutos), em ratos privados ou não (controle) de água e sacarose 2% por 24 h. N=20. *Diferente do controle.
T e m p o (m in )
V o lu m e ( m L )
1 20 1 35 1 50 1 80 2 10 2 40
0 5 1 0 1 5 2 0 2 5
P riv a ç ã o C o n tro le
* * * *
*
V o lu m e to ta l