Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761
Otimização das condições de extração para compostos bioativos em
barbatimão (Stryphnodendron Adstringens (Mart.) Coville) usando
metodologia de superfície de resposta
Optimization of extraction conditions for bioactive compounds in
barbatimão (Stryphnodendron Adstringens (Mart.) Coville) using the
response surface method
DOI:10.34117/bjdv6n5-079
Recebimento dos originais: 25/04/2020 Aceitação para publicação: 06/05/2020
Kauyse Matos Nascimento
Doutoranda do programa de pós-graduação em Engenharia de Alimentos da Universidade Federal do Paraná
Instituição: Universidade Federal do Paraná
Endereço: Avenida Francisco Heráclito dos Santos, 100 – Centro Politécnico, Curitiba – Pr, Brasil
E-mail: kauysematos@gmail.com
Luciana Alves da Silva
Doutoranda do programa de pós-graduação em Ciência de Alimentos da Universidade Estadual de Maringá
Instituição: Universidade Estadual de Maringá
Endereço: Avenida Colombo, 5790 – Jardim Universitário, Maringá – Pr, Brasil E-mail: luciana.alves.engali@gmail.com
Jessica Basso Cavalheiro
Graduada em Engenheira de Alimentos pela Universidade Estadual de Maringá Instituição: Universidade Estadual de Maringá
Endereço: Avenida Colombo, 5790 – Jardim Universitário, Maringá – Pr, Brasil E-mail: jbcjessicabasso@hotmail.com
Grasiele Scaramal Madrona
Pós-Doutora em Engenharia Química pela Universidade Federal de Uberlândia Instituição: Universidade Estadual de Maringá
Endereço: Avenida Colombo, 5790 – Jardim Universitário, Maringá – Pr, Brasil E-mail: gsmadrona@uem.br
Mônica Regina da Silva Scapim
Doutora em Ciência de Alimentos pela Universidade Estadual de Londrina Instituição: Universidade Estadual de Maringá
Endereço: Avenida Colombo, 5790 – Jardim Universitário, Maringá – Pr, Brasil E-mail: jprsgrss@yahoo.com.br
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761
Rita de Cássia Bergamasco
Doutora em Engenharia Química pela Universidade Estadual de Maringá Instituição: Universidade Estadual de Maringá
Endereço: Avenida Colombo, 5790 – Jardim Universitário, Maringá – Pr, Brasil E-mail: rcbergamasco@uem.br
RESUMO
O objetivo deste trabalho foi otimizar as condições de extração de compostos bioativos de cascas de barbatimão. Dois níveis e três variáveis foram aplicados a um planejamento fatorial
23. As variáveis independentes foram temperatura de extração (30-50 ° C), pH da solução
(7-11) e granulometria da amostra (0,250-0,841 mm), enquanto as variáveis resposta foram o teor de polifenóis totais, taninos condensados e a atividade antioxidante. Os resultados experimentais foram ajustados a um modelo polinomial linear de primeira ordem. A análise de variância foi utilizada para determinar as condições ótimas para o teor máximo de polifenóis totais, taninos condensados e atividade antioxidante. As condições otimizadas foi com temperatura de extração de 48 ° C, pH da solução 7 e a granulometria da amostra de 0,841 mm. Nessas condições, os valores máximos previstos foram 12,76 g de ácido gálico equivalente/ 100g de casca para polifenóis totais, 27,91 g de catequina equivalente/ 100g de casca para taninos condensados, e 0,439 g de trolox equivalente/ 100g de casca para atividade antioxidante. O extrato obtido experimentalmente apresentou-se próximo dos valores previstos, promovendo uma extração de compostos com altos teores de compostos fenólicos e capacidade antioxidante.
Palavras-chave: polifenóis totais, taninos condensados, atividade antioxidante, planejamento
experimental.
ABSTRACT
The objective of this study was to optimize the conditions for extracting bioactive compounds
from barbatimão barks. Two levels and three variables were applied to a factorial design 23.
The independent variables were extraction temperature (30-50 °C), solution pH (7-11) and sample size (0.250-0.841 mm), while the variables the answer was the content of total polyphenols, condensed tannins and antioxidant activity. Experimental results were fitted to a first order linear polynomial model. Analysis of variance was used to determine the optimal conditions for the maximum content of total polyphenols, condensed tannins and antioxidant activity. Optimized conditions were with extraction temperature of 48 °C, pH of solution 7 and sample size of 0.841 mm. Under these conditions, the maximum values predicted were 12.76 g of gallic acid equivalent / 100 g of bark for total polyphenols, 27.91 g of catechin equivalent / 100 g of bark for condensed tannins, and 0.439 g of equivalent trolox / 100 g of bark for antioxidant activity. The extract obtained experimentally was close to the predicted values, promoting an extraction of compounds with high levels of phenolic compounds and antioxidant capacity.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761
1 INTRODUÇÃO
Stryphnodendron adstringens, conhecida como barbatimão, é uma espécie de planta
pertencente à família Fabaceae, muito utilizada na medicina popular brasileira. Estudos biológicos e farmacológicos de extratos de barbatimão são conhecidos devido à ação antibacteriana, antinflamatória e antioxidante. Estas propriedades são atribuídas principalmente a grande quantidadede compostos fenólicos que a espécie possui em suas folhas e cascas, em destaque os taninos condensados (COSTA et al., 2013; SOUSA et al., 2014).
Taninos são ingredientes naturais de composição fenólica, produzidos pelo metabolismo secundário das plantas contra o ataque de insetos e microrganismos. Quimicamente, os compostos fenólicos são definidos como substâncias que possuem anel aromático com uma ou mais hidroxilas substituintes, incluindo seus grupos funcionais (LEE et al., 2005).
A aplicabilidade dos compostos bioativos do barbatimão está no curtimento de couro e peles, indústrias de tintas de escrever, assim como na indústria farmacêutica, devido as suas atividades farmacológicas (JACOBSON et al., 2005; NASCIMENTO et al. 2013).
Presença de compostos fenólicos em alguns sistemas, como de alimentos, medicamentos e cosméticos, pode promover atividade antioxidante através do sequestro de espécies radicais de oxigênio, a modulação da atividade de algumas enzimas específicas, bem como seu potencial como agente antibiótico, antialergênico, antiinflamatório e antimicrobiano. Tais substâncias têm demonstrado alto potencial antioxidante, podendo ser usadas como conservantes naturais para alimentos (FONTANA, et al, 2013; GOMEZ-ESTACA et al., 2014).
Antioxidantes sintéticos são normalmente utilizados como conservantes alimentícios, na indústria de alimentos. No entanto, a segurança desses aditivos vem sendo questionada por estudos que sugerem seus possíveis efeitos mutagênicos e cancerígenos, estimulando a busca de fontes de antioxidantes naturais (ANDRADE et al., 2015).
A maioria dos antioxidantes naturais é obtida de plantas ricas em compostos fenólicos, sendo que as técnicas de extração destes ganharam mais atenção nos últimos anos (WU et al., 2017). Entre as várias técnicas modernas utilizadas para extração de compostos fenólicos, está a extração assistida de ultrassom. Esta é uma técnica considerada simples, econômica e eficiente pela capacidade de perturbar a parede celular, reduzir o tamanho das partículas e aumentar a transferência de massa através da membrana celular (HOSSAINET al., 2012). Entretanto, dependendo da natureza da matriz da amostra e das propriedades químicas dos
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 compostos fenólicos, vários fatores podem interferir na extração de compostos antioxidantes, como tempo, temperatura, pH da solução, solvente, dentre outros (KHODDAMI et al., 2013). O planejamento fatorial é uma ferramenta útil para otimização no processo de extração de compostos fenólicos, podendo fornecer informações sobre a influência de variáveis na resposta desejada, permitindo uma avaliação eficiente das variáveis ao serem analisadas simultaneamente e assim reduzindo o número de experimentos (ANDRADE et al., 2015).
Devido às atividades biológicas notáveis, principalmente por sua atividade antioxidante, este estudo teve como objetivo otimizar o processo de extração de compostos bioativos de cascas de barbatimão.
2 MATERIAIS E MÉTODOS
As análises foram realizadas no laboratório de análises físico-químicas de alimentos da Universidade Estadual de Maringá, localizada no município de Maringá, no Paraná, Brasil.
Foram obtidas cascas secas de barbatimão (lote n0 0302/100J-25K - Nutricrok Alimentos
Ltda–Epp) no comércio local de Maringá-PR. O material vegetal foi moído com auxilio de liquidificador industrial, fracionado em três diferentes crivos de malha (20, 42 e 60 mesh) e armazenado ao abrigo de luz e umidade.
A extração dos compostos bioativos foi obtida em uma concentração de 4 mg/mL (casca/solvente), utilizando amostras com diferentes granulometrias (0,250, 0,355 e 0,841 mm), em solução hidroalcoólica (50%), com pH corrigido (7, 9 e 11). O processo foi realizado em banho ultrassônico, com temperatura mantida a 30, 40 e 50 ° C. A solução obtida foi centrifugada por 10 min, a 4000 rpm, e o sobrenadante submetido a determinação de polifenóis totais, taninos condensados e atividade antioxidante.
O teor de polifenóis totais foi determinado pelo método de Folin-Ciocalteu, conforme Singleton e colaboradores (1965), com modificações. Foi realizado por meio de espectrofotometria, utilizando curva de calibração com solução padrão de ácido gálico (0 – 900mg/L). Em tubos de ensaio, foram transferidas alíquotas de 125 µL de extrato e adicionado 125 µL de reagente de Folin-Ciocalteu e 2250µL de solução de carbonato de sódio aquoso saturado. Os tubos foram agitados e mantidos ao abrigo de luz por 30 minutos, e em seguida medido a absorbância num comprimento de onda de 725 nm. O teor de polifenóis totais foi calculado e expresso em g de ácido gálico equivalente / 100 g de casca. Todas as medições foram realizadas em triplicata.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 Os taninos condensados foram determinados pelo ensaio de vanilina-HCl, conforme Bilibio et al. (2015), com modificações. Foi realizada por meio de espectrofotometria, utilizando curva de calibração com solução padrão de catequina (0 – 300mg/L). Foi adicionado 1 ml de extrato obtido em um tubo de ensaio, e em seguida, acrescentado de 2,5 ml de solução de vanilina (1% em metanol), e 2,5 ml de HCl (9M, em metanol). A solução foi incubada durante 20 min a 30 °C, e a absorbância foi medida num comprimento de onda de 500 nm. O conteúdo de taninos condensados foi calculado e expresso em g de catequina / 100 g de casca. Todas as medições foram realizadas em triplicata.
A capacidade antioxidante foi determinada nos extratos pelo método do radical DPPH, conforme Souza et al. (2009), com modificações. Foi realizada por meio de espectrofotometria, utilizando curva de calibração com solução padrão de trolox (0 – 900 mg/L). Em tubos de ensaio, tranferiu-se 1 ml de extrato obtido e adicionado 2,5 ml de solução DPPH (0,004%, em metanol). A solução foi agitada e mantida sobre abrigo de luz durante 30 minutos, a temperatura ambiente. A absorbância foi medida num comprimento de onda de 517 nm. A capacidade antioxidante foi expressa em g de trolox equivalentes/ 100 g de casca. Todas as medições foram realizadas em triplicata.
Um planejamento fatorial 23, com três fatores e dois níveis, foi usado para otimizar e
avaliar os efeitos principais e efeitos de interação das variáveis do processo. Os fatores avaliados no planejamento e seus respectivos níveis, em valores usados na extração, são apresentados na Tabela 1.
TABELA 1: Fatores avaliados no planejamento e seus respectivos níveis.
Fatores Baixo Central Alto
Temperatura (oC) -1 (30) 0 (40) 1 (50)
pH -1 (7) 0 (9) 1 (11)
Granulometria (mm) -1 (0,250) 0 (0,355) 1 (0,841)
A metodologia de superfície de resposta foi aplicada aos dados experimentais utilizando o software Statistica 8.0 (Stasoft). O planejamento fatorial incluiu oito pontos fatoriais e três repetições do ponto central. As variáveis resposta foram teor de polifenóis totais (PT), taninos condensados (TC) e atividade antioxidante (AA). Estes valores foram relacionados com as variáveis codificadas por um polinômio de primeira ordem usando a Eq. (1)
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761
Y= β0 + β1X1 + β2X2 + β3X3+ β12 X1 X2+ β13 X1 X3+ β23 X2 X3 + ε (01)
Os coeficientes do modelo polinomial foram representados por b0 (termo constante), β1,
β2 e β3 (efeitos lineares) e β12, β13 e β23 (efeitos de interação). Os termos significativos no
modelo foram encontrados pela análise de variância (ANOVA) para cada resposta.
Depois de gerar as equações de regressão polinomial, relacionando as respostas às variáveis independentes estudadas, o procedimento de otimização foi realizado para obter o nível ótimo para os três fatores. A técnica de otimização numérica foi utilizada para encontrar uma condição única e simultânea que possa obter as melhores respostas para o estudo realizado. A extração de compostos bioativos mais adequada foi considerada com um ponto ótimo que resultasse em um extrato com elevado teor de polifenóis totais, teor de taninos condensados e atividade antioxidante. A adequação dos modelos de superfície de resposta para prever os valores de resposta ótima foi verificada através da comparação dos valores experimentais e previstos pelo modelo.
3 RESULTADOS E DISCUSSÕES
As combinações feitas pelo planejamento fatorial e seus respectivos valores na obtenção do teor de polifenóis totais, taninos condensados e atividade antioxidante são apresentadas na tabela 2. Os resultados das variáveis respostas foram expressos como média±desvio padrão.
TABELA 2: Valores codificados das variáveis independentes e valores médios das respostas de teor de
polifenóis totais (PT), teor de taninos condensados (TC) e atividade antioxidante (AA).
Ensaios X1 X2 X3 PT TC AA 1 -1 -1 -1 11,115 ± 1,059 28,896 ± 3,030 0,447 ± 0,001 2 +1 -1 -1 9,260 ± 0,443 33,765 ± 2,164 0,411 ± 0,005 3 -1 +1 -1 10,557 ± 0,931 23,674 ± 1,789 0,461 ± 0,002 4 +1 +1 -1 10,409 ± 1,300 35,052 ± 0,903 0,423 ± 0,002 5 -1 -1 +1 9,391 ± 0,624 22,841 ± 0,620 0,478 ± 0,000 6 +1 -1 +1 13,118 ± 2,292 29,199 ± 0,918 0,433 ± 0,003 7 -1 +1 +1 10,770 ± 1,082 27,937 ± 0,616 0,444 ± 0,005 8 +1 +1 +1 12,166 ± 0,581 28,038 ± 0,747 0,426 ± 0,004 9 0 0 0 11,805 ± 0,968 31,974 ± 0,703 0,432 ± 0,002 10 0 0 0 12,757 ± 1,194 32,100 ±3,789 0,437 ± 0,002 11 0 0 0 12,642 ± 0,280 28,846 ± 1,254 0,435 ± 0,000
PT: g de ácido gálico equivalente/ 100g de casca; TC: g de catequina equivalente/ 100g de casca; AA: g de trolox equivalente/ 100g de casca.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 Conforme as condições estabelecidas, os valores obtidos (Tabela 2) variaram entre 9,260 a 13,118g de ácido gálico equivalente/100g de casca para teor de polifenóis totais, o teor de taninos condensados variou de 22,841 a 35,052 g de catequina equivalente/100g de casca e a atividade antioxidante variou de 0,411 a 0,478g de trolox equivalente/100g de casca.
Na Tabelas 3, são apresentados os coeficientes de regressão e o valores de F calculados. O teste usual que verifica a significância da regressão ajustada envolve o cálculo do valor de F, comparando o valor calculado com o valor tabelado. Se o valor de F calculado for superior ao valor F tabelado, o modelo obtido apresenta regressão com um nível de significância α
(Lima Junior et al., 2013). Para as três variáveis respostas (Tabela 3), os valores de Fcalculado
foram maiores do que os valores Ftabelado, indicando que os parâmetros foram significativos ao
nível de 5% de significância.
Tabela 3. Coeficientes de regressão para as variáveis significativas no processo de extração.
Coeficiente Polifenóis Totais Taninos Condensados Atividade Antioxidante β0 11,271 29,302 0,439 β1 0,779 2,838 -0,017 β2 0,254 0,000 -0,002 β3 1,026 -1,671 0,005 β12 -0,156 0,031 0,003 β13 1,781 -1,223 0,001 β23 -0,041 0,983 -0,009 Fcalculado 9,206 12,301 24,757
A tabela 4 apresenta a análise de variância para as variáveis sobre a resposta, respectivamente.
TABELA 4. Análise de variância das variáveis (ANOVA) sobre a resposta.
Variáveis
independentes Polifenóis Totais
Taninos Condensados
Atividade Antioxidante
SS p-valor SS p-valor SS p-valor
Fatores Temperatura (1) 3,650 0,0926 193,333 < 0,0001* 0,007 < 0,0001* pH (2) 0,389 0,5729 0,000 1,0000 0,000 0,0080* Granulometria(3) 6,319 0,0301* 67,046 0,0004* 0,001 < 0,0001* Interações 1 e 2 0,146 0,7292 0,024 0,9382 0,000 <0,0001*
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761
1 e 3 19,043 0,0005* 35,932 0,0056* 0,000 0,0637
2 e 3 0,010 0,9273 23,234 0,0222* 0,002 < 0,0001*
SS – soma dos quadrados; * p-valor < 0,05, difere significativamente.
A ANOVA mostrou que apenas a granulometria da amostra exerceu influência sobre o teor de polifenóis totais, ao nível de significância de 5% (p <0,05) (Tabela 4), apresentando maior efeito no teor comparado com as demais variáveis independentes. De acordo com o coeficiente de regressão (Tabela 3), este efeito foi positivo, ou seja, quanto maior a granulometria, maior o teor obtido. Mesmo efeito foi observado para as demais variáveis, ou seja, quanto maior temperatura e pH, maior o teor de polifenóis totais.
Ao analisar as interações, observou-se que apenas a interação temperatura e granulometria (1 e 3) foi estatisticamente significativa, sendo a interação temperatura e pH (1 e 2) e pH e granulometria (2 e 3) não exercendo diferença significativa.
O teor de polifenóis totais, com temperatura de extração e pH da solução, mantendo a granulometria de 0.355 mm, é apresentado na figura 1a, e pode-se observar que o maior teor de polifenóis totais obtido foi em elevadas temperaturas, independente do pH da solução. Este aumento em temperaturas mais elevadas ocorre devido o aumento da solubilidade do soluto no solvente e do coeficiente de difusão, favorecendo o maior rendimento de compostos fenólicos na extração (SPIGNO et al., 2007)
FIGURA 1. Curvas de contorno para o efeito do pH da solução e temperatura de extração (a) (granulometria =
0,355 mm), e granulometria da amostra e temperatura de extração (b) (pH = 9) sobre polifenóis totais.
> 11,75 < 11,75 < 11,5 < 11,25 < 11 < 10,75 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Temperatura (0C) -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 pH (a)
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 > 13 < 13 < 12 < 11 < 10 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Temperatura (0C) -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Gr anulome tr ia (mm ) (b)
Na figura 1b, também observa-se teor elevado de polifenóis em altas temperaturas, utilizando amostras de maior granulometria. Conforme a literatura, em relação a tamanhos de partícula, quanto menor, maior a área superficial disponível para a transferência de massa e, então, maior o rendimento de extração (SPGINO et al., 2007). Uma justificativa dos resultados do presente estudo, seria uma possível aglomeração com partículas menores, interferindo na extração de compostos fenólicos.
O maior teor obtido de compostos fenólicos foi encontrado no nível máximo de
temperatura de extração (500C) e de maior granulometria (0,841 mm), e no nível mínimo de
pH da solução (7).
Bilibio et al. (2015), utilizando amostras de barbatimão obtidas por peneira de 20 mesh (0,841 mm), estudou individualmente variáveis (pH, temperatura de extração, solvente e concentração) que influenciaria na obtenção de polifenóis totais em extrato de barbatimão. Quanto a temperatura utilizada na extração, o presente estudo obteve resultados semelhantes ao de Bilibio, no qual maiores valores de polifenóis totais foram encontrados em elevadas
temperaturas (50 e 75oC). Quando avaliado o pH da solução, diferentemente ao presente
estudo, Bilibio obteve menor valor em seus estudos ao utilizar pH 7, comparado ao demais (pH: 3,5 e 10,5).
Deng et al. (2011), afirmam que as condições do processo de extração dos compostos têm forte influência nos resultados obtidos, de modo que também a temperatura é um fator de grande importância. Neste estudo a temperatura de extração não apresentou diferença significativa devido ser em uma faixa pequena, porém observou diferença na interação
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 granulometria e temperatura de extração (1 e 3), uma vez que a maior temperatura auxiliou na difusão dos compostos, apresentando diferença significativa.
Quanto ao teor de taninos condensados, observando os p-valor (Tabela 4), verificou-se que as variáveis temperatura de extração e granulometria da amostra exerceram influência significativa ao nível de significância de 5% (p <0,05). Além disso, através da soma dos quadrados, pode-se observar que a temperatura de extração teve maior efeito em relação as demais variáveis independentes. Ao analisar os coeficientes de regressão (Tabela 3), notou-se que a variável temperatura de extração exerceu efeito positivo e a granulometria da amostra efeito negativo, ou seja, quanto maior a temperatura de extração e menor a granulometria, maior teor de taninos condensados obtido.
O pH da solução foi a única variável independente que não exerceu influência significativa no teor de taninos condensados (Tabela 4). O coeficiente de regressão apresentado na Tabela 3 mostra que esse efeito foi positivo, ou seja, quanto maior o pH, maior o teor de taninos obtido.
Quanto as interações (Tabela 4), observou-se que temperatura de extração e granulometria da amostra (1e 3), e pH da solução e granulometria da amostra (2 e 3) exerceram influência significativa no teor de taninos. Sendo assim, apenas a interação temperatura de extração e pH da solução (1 e 2) não apresentaram diferença significativa ao nível de significância de 5% (p <0,05).
Na figura 2a, pode-se observar que quanto menor pH e granulometria, obtêm-se um
maior teor de taninos condensados, em temperatura de 40 0C. Na figura 2b, pode-se verificar
que amostras com menor granulometria e em altas temperaturas de extração, obtém-se maior teor de taninos condensados.
Como mencionado anteriormente, altas temperaturas de extração favorecem a liberação dos compostos bioativos das cascas, pois há uma maior abertura das células e, consequentemente maior difusão do solvente na casca. Já a menor granulometria, a própria literatura relata que quanto maior a área de contato da partícula com o solvente, maior a extração (SPGINO et al., 2007). Este comportamento não foi visto no resultado para polifenóis, podendo ser devido a metodologia de Folin ser mais generalizada, não mostrando devidamente a qualidade e quantidade dos constituintes do extrato (KUJALA et al., 2000).
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 FIGURA 2. Curvas de contorno para o efeito da granulometria da amostra e pH da solução temperatura de
extração (a) (temperatura = 40 0C ), e granulometria da amostra e temperatura de extração (b) (pH = 9) sobre
taninos condensados. > 32 < 32 < 31 < 30 < 29 < 28 < 27 < 26 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 pH -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 G ra nul ome tr ia ( mm) (a) > 36 < 36 < 34 < 32 < 30 < 28 < 26 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Temperatura (0C) -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Gr anulome tr ia (mm ) (b)
Dentro do intervalo de estudo pré-estabelecido, o maior teor de taninos condensados foi
encontrado no nível máximo de temperatura de extração (50oC) e níveis médios de pH da
solução (9) e granulometria da amostra (0,355 mm).
O presente estudo obteve resultados semelhantes aos encontrados por Couto et al. (1999) e Sousa et al. (2014), onde obtiveram maiores teores de taninos condensados ao utilizar
temperaturas elevadas no processo de extração (50 – 90oC), demonstrando assim que a
extração de taninos é fortemente influenciada pela temperatura.
Quanto a atividade antioxidante, verificou-se que as três variáveis exercem influência ao nível de significância de 5% (p <0,05) (Tabela 4). De acordo com os coeficientes de regressão (Tabela 3), as variáveis temperatura de extração e pH da solução exerceram efeito
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 negativo, ou seja, quanto menor a temperatura de extração e pH da solução, maior será a atividade antioxidante. Em contraste a granulometria apresentou efeito positivo, ou seja, quanto maior a granulometria, maior a atividade antioxidante.
Quanto as interações (Tabela 4), observou-se que as interações temperatura de extração e pH da solução (1 e 2), e pH da solução e granulometria (2 e 3) exerceram diferença significativa na atividade antioxidante. Sendo assim, apenas a interação temperatura de extração e granulometria (1 e 3) não apresentaram diferença significativa ao nível de significância de 5% (p <0,05).
Conforme a literatura, alguns compostos fenólicos possuem atividade antioxidante, podendo sofrer oxidação em pH alcalino. Um exemplo é o ácido ascórbico, sendo que estudos demonstram que são facilmente oxidados em meio alcalino, como também em combinação de temperatura elevada (LEE & KADER, 2000). Este comportamento pode ser visto no presente estudo, onde o pH da solução influenciou fortemente na atividade antioxidante, como também a combinação de pH da solução e temperatura.
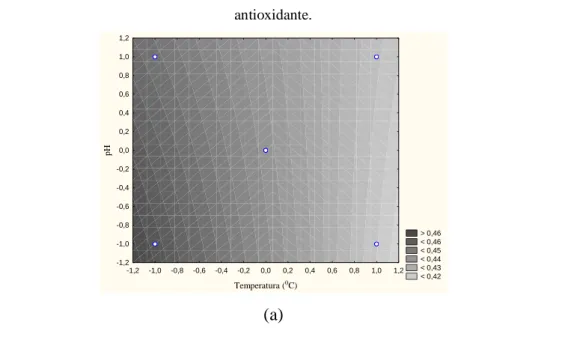
Na figura 3a, pode-se observar que independente do valor de pH da solução, a maior atividade antioxidante é obtida em menor temperatura de extração, para uma granulometria da amostra de 0,355 mm. Na figura 3b, pode-se observar que quanto maior a granulometria e
menor o pH da solução, maior foi a atividade antioxidante, para temperatura de 40 0C.
FIGURA 3. Curvas de contorno para o efeito do pH da solução e temperatura de extração (a) (granulometria =
0,355mm), e pH da solução e granulometria da amostra (b) (temperatura = 40 0C), sobre atividade
antioxidante. > 0,46 < 0,46 < 0,45 < 0,44 < 0,43 < 0,42 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Temperatura (0C) -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 pH (a)
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 > 0,45 < 0,45 < 0,44 < 0,43 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Granulometria (mm) -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 pH (b)
Dentro do intervalo de estudo pré-estabelecido a maior atividade antioxidante foi
encontrada nos níveis mínimos de temperatura de extração (30oC), pH da solução (7) e maior
granulometria (0,841 mm).
Resultados semelhantes para obtenção de um extrato com melhor atividade antioxidante foram determinados por Bilibio et al. (2015). Ao considerar que altas temperaturas podem promover perdas e diminuir a atividade antioxidantede extratos ricos em polifenóis, Bilibio e seus colaboradores tomaram como base os resultados obtidos em seus estudos e determinaram que o extrato mais adequado seria utilizando em solução com pH 7 e temperatura de extração de 25 ° C, para amostras com granulometria de 0,841 mm.
Na otimização do processo de extração, as condições ótimas numéricas indicaram que o extrato com elevado teor de polifenóis totais, atividade antioxidantes pelo método do radical DPPH e teor de taninos condensados foi obtido por extração a 48 ° C, com amostra de 0,841 mm e pH 7 de solução. Devido as condições propostas para a melhor obtenção de extrato apresentar semelhança ao ensaio 2 do planejamento experimental (Tabela 2 temperatura:
500C; pH: 7; granulometria: 0,841mm), os valores obtidos do planejamento foram utilizados
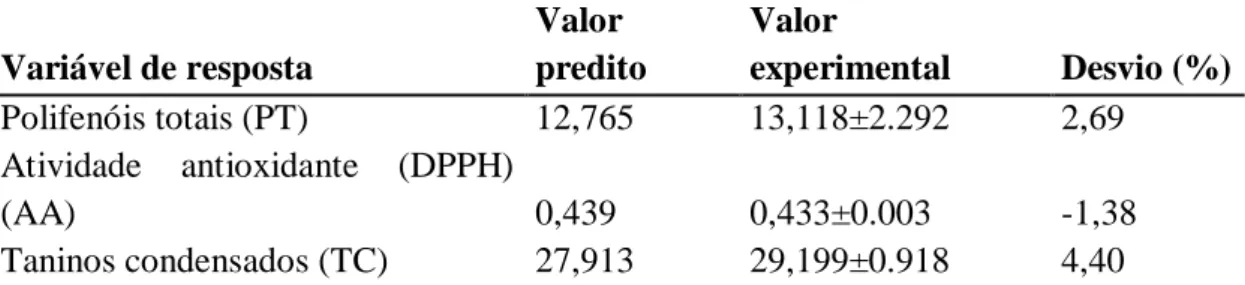
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 TABELA 5. Resultados teóricos preditos e experimentais obtidos nas condições de ponto ótimo de processo.
Variável de resposta Valor predito Valor experimental Desvio (%) Polifenóis totais (PT) 12,765 13,118±2.292 2,69 Atividade antioxidante (DPPH) (AA) 0,439 0,433±0.003 -1,38 Taninos condensados (TC) 27,913 29,199±0.918 4,40
PT: g de ácido gálico equivalente/ 100 g de casca; AA: g de trolox equivalente/ 100 g de casca; TC: g de catequina equivalente/ 100 g de casca
Os valores experimentais ficaram próximos aos valores preditos com desvio < 5% (Tabela 5). Além disso, pode-se destacar que a variável taninos condensados apresentou um pequeno aumento ao valor experimental, comparado com o valor predito. Este aumento esta
relacionado a temperatura de 2 0C a mais que o valor otimizado, demonstrando que esta
variável é fortemente influenciada pela temperatura.
Os valores de polifenóis em percentual correspondem a 22,56%. Resultados semelhantes foram obitidos na literatura. Bilibio et al. (2015) obtiveram um teor aproximado de 22% de
polifenóis totais para uma extração com alta temperatura (800C), ph de solução 7 e solvente
etanol 50%. Sousa et al. (2014) encontraram 22% de polifenóis utilizando concentração de sólidos de 4 mg/L em solução hidroalcoolica 50%, com tempo de extração com 30 min.
Quanto aos valores de taninos condensados correspondem a 50.22%. O presente estudo apresentou valores superiores ao reportados pela literatura. Couto et al. (1999) obteram 6,5%
de taninos condensados em extração aquosa utilizado altas temperaturas (60 e 90oC). O maior
percentual obtido pelo presente estudo pode ser atribuído pelo diferença do tempo se extração (4horas) como também pela solvente utilizado, visto que os taninos condensados pertence aos compostos fenólicos, estes podendo ser degradados por determinados fatores. Além disso, outro fator que pode ser atribuído é o solvente utilizado, uma vez que Li et al., (2006) afirmam que a mistura de solventes é mais eficaz na recuperação de compostos antioxidantes do que o uso de solventes individuais.
Poucos são os estudos para a extração de compostos de barbatimão, e independente das
diferenças verificou-se que a obtenção de extratos em temperatura de 50oC, pH 7 e utilizando
amostras de granulometria 0,841 mm, promoveu em boa extração de compostos com altos teores de compostos fenólicos, taninos condensados e com capacidade antioxidante.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761
4 CONCLUSÃO
A temperatura de extração apresenta maior efeito quanto ao teor de taninos condensados e atividade antioxidante. A granulometria da amostra apresenta influencia significativa para as três variáveis respostas. Maior teor de polifenóis totais, taninos condensados e atividade antioxidante são alcançados com temperatura de extração de 48 °C, com pH de solução 7 e amostras com granulometria de 0,841 mm.
AGRADECIMENTOS
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal Superior (CAPES) pela assistência financeira.
REFERÊNCIAS
ANDRADE, R. A. M. S.; MACIEL, M. I. S.; SANTOS, A. M. P.; MELO, E. A. Optimization of the extraction process of polyphenols from cashew apple agro-industrial residues. Food Science and Technoloy, v. 35, p. 354-360, 2015.
BILIBIO, D.; ZANOTTO-FILHO, A.; SIMÕES-PIRES, A.; CARNIEL, N.; MOREIRA, J. C. F.; PRIAMO, W. L. Potential of Total Polyphenols from Barbatimão against Different Reactive Oxygen/Nitrogen Species. Indian Journal of Advances in Chemical Science, v. 3, p. 260-267, 2015.
COSTA, D. F. G.; FRANCA, J. R.; RIBEIRO, T. G.; et al. Development and characterization of polymeric nanoparticles as Barbatimão ( Stryphnodendron obovatum ) standardized fraction carrier. , v. 2013, n. January, p. 89–92, 2013.
COUTO, L. C.; FORTIN, Y.; DOUCET, J.; et al. Efeito da temperature de extração no
rendimento e no teor de taninos condensados da casaca de barbatimão
(Stryphnodendronadstringens (Mart.) Coville. R.árv.. Viçosa-MG, v. 23, p. 333-339, 1999. DENG, Q.; PENNER, M. H.; ZHAO, Y. Chemical composition of dietary fiber and polyphenols of wine grape pomace skins and development of wine grape (cv. Merlot) pomace extract based films. Food Research International.p. 2712-2720, 2011.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 FONTANA, A. R., ANTONIOLLI, A., BOTTINI, R. Grape pomace as a sustainable source of bioactive compounds: extraction, characterization, and biotechnological applications of phenolics.Journal of Agricultural and Food Chemistry, v. 61, p. 8987−9003, 2013.
GOMEZ-ESTACA, J. LÓPEZ-DE-DICASTILHO, C.; HERNÁNDEZ-MUÑOZ, P.; et al. Advances in antioxidant active food packaging. Trends in Food Science & Technology, v. 35, p. 42-51, 2014.
HOSSAIN, M. B.; BRUNTON, N. P.; PATRAS, A.; TIWARI, B.; O'DONNELL, C. P.; MARTIN-DIANA, A. B. BARRY-RYAN, C. Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanummajorana L.) using response surface methodology. UltrasonSonochemistry, v. 19, p. 582–590, 2012.
JACOBSON, T. K. B.; GARCIA, J.; SANTOS, S. C.; DUARTE, J. B.; et al. Influencia de fatores edáficos na produção de fenóis totais e taninos de duas espécies de barbatimão(Stryphnodendron sp.). PesquisaAgropecuária Tropical, p.163-169, 2005.
KHODDMI, A.; WILKES, M. A.; ROBERTS, T. H. Techniques for analysis of plant phenolic compounds.Molecules, v. 18, p.2328–2375, 2013.
LEE, S. K., & KADER, A. A. Preharvest and postharvest factors influencing vitamin C content of horticultural crops. Postharvest biology and technology, V. 20, P. 207-220, 2000.
LEE, S. J.; UMANO, K.; SHIBAMOTO, T. LEE, K.G. Identification of volatile components in basil (Ocimumbasilicum L.) and thyme leaves (Thymus vulgaris L.) and their antioxidant properties.Food Chemistry, v. 91, p. 131-137, 2005.
LI, Y.; GUO, C.; YANG, J.; WEI, J.; XU, J.; CHENG, S. Evaluation of antioxidant properties of pomegranate peel extract in comparison with pomegranate pulp extract. Food Chemistry, Barking, v. 96, p. 254–260, 2006.
NASCIMENTO, A. M.; GUEDES, P. T.; CASTILHO, R. O.; VIANNA-SOARES, C. D. Stryphnodendron adstringens (Mart.) Coville (Fabaceae) proanthocyanidinsquantitationby RP-HPLC. Brazilian Journal of Pharmaceutical Sciences. v. 49, p. 549-558, 2013.
SINGLETON, V. L.; ROSSI, Joseph A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American journal of Enology and Viticulture, v. 16, p. 144-158, 1965.
SIPGNO, G.; TRAMELLI, L.; FAVERRI, D. M. Effects of extraction time, temperature and solvent on concentration and antioxidant activity of grape marc phenolics. Journal of Food Engineering, v. 81, p. 200–208, 2007.
Braz. J. of Develop.,Curitiba, v. 6, n.5, p.24882-24898 may. 2020. ISSN 2525-8761 SOUSA, J. N.; PEDROSO, N. B.; BORGES, L. L.;OLIVEIRA, G. A. R.; PAULA, J. R.; CONCEIÇÃO, E. C. Optimization of Ultrasound-assisted extraction of polyphenols, tannins and epigallocatechingallate from barks of Stryphnodendron adstringens (Mart,) Coville bark extracts.Pharmacognosy Magazine. v. 10, p. 318-323, 2014.
SOUZA, C. O.; SILVA, L. T.; SILVA, J. R.; LÓPEZ, J.; VEIGA-SANTOS, P.; DRUZIAN, J. I. Mango and acerola pulps as antioxidantadditives in cassava starchbio-basedfilm. Journal agriculture food chemistry, v.1, n.1, 2011.
SOUZA, T. M.; SEVERI, J. A.; SILVA, V. Y. A. et al. Bioprospecção de atividade antioxidante e antimicrobiana da casca de Stryphnodendronadstringens(Mart.) Coville (Leguminosae-Mimosoidae).Revista de Ciências Farmacêuticas Básica e Aplicada, v. 28, n. 2, p. 221-226, 2009.
WU, X.; XUE, J.; FAN, E. Plant Phenolics Extraction from FlosChrysanthemi: Response Surface MethodologyBased Optimization and the Correlation BetweenExtracts and Free Radical Scavenging ActivityYanfang. Journal of Food Science.v. 82, p. 2726-2733, 2017.