Empresa Brasileira de Pesquisa Agropecuária–Amazônia Oriental Universidade Federal Rural da Amazônia
Programa de pós-graduação em ciência animal
Michel Yoshio Almeida Miyasaki
Comparação entre o TRIS, Lactose/TRIS, Ringer-Lactato e Leite Desnatado como diluidores na criopreservação do sêmen bubalino.
Michel Yoshio Almeida Miyasaki
Comparação entre o TRIS, Lactose/TRIS, Ringer-Lactato e Leite Desnatado como diluidores na criopreservação do sêmen bubalino.
Dissertação apresentada para obtenção do grau de Mestre em Ciência Animal. Programa de Pós-graduação em Ciência Animal. Núcleo de Ciências Agrárias e Desenvolvimento Rural Universidade Federal do Pará. Empresa Brasileira de Pesquisa Agropecuária - Amazônia Oriental. Universidade Federal Rural da Amazônia.
Área de concentração: Produção Animal. Orientador: Prof. Dr. William Gomes Vale
Dados Internacionais de Catalogação na Publicação (CIP) –
Biblioteca Núcleo de Ciências Agrárias e Desenvolvimento Rural / UFPA, Belém-PA
Miyasaki, Michel Yoshio Almeida
Comparação entre o TRIS, Lactose/TRIS, Ringer-Lactato e Leite Desnatado como diluidores na criopreservação do sêmen bubalino / Michel Yoshio Almeida Miyasaki: orientador, William Gomes Vale, Belém, PA, 2011.
Dissertação (mestrado) – Universidade Federal do Pará, Núcleo de Ciências Agrárias e Desenvolvimento Rural, Programa de Pós-Graduação em Ciência Animal, 2011.
1. Búfalo. 2. Búfalo - Reprodução. 3. Criopreservação de órgãos, tecidos, etc.. 4. Sêmen. I. Título.
Michel Yoshio Almeida Miyasaki
COMPARAÇÃO ENTRE O TRIS, LACTOSE/TRIS, RINGER-LACTATO E LEITE DESNATADO COMO DILUIDORES NA CRIOPRESERVAÇÃO DO
SÊMEN BUBALINO.
Dissertação apresentada para obtenção do grau de Mestre em Ciência Animal. Programa de Pós-graduação em Ciência Animal. Núcleo de Ciências Agrárias e Desenvolvimento Rural Universidade Federal do Pará. Empresa Brasileira de Pesquisa Agropecuária - Amazônia Oriental. Universidade Federal Rural da Amazônia.
Área de concentração: Produção Animal.
Data: Belém-PA: 29 de fevereiro de 2012
Banca Examinadora:
___________________________________ Prof. Dr. William Gomes Vale
Universidade Federal do Oeste do Pará Orientador e Presidente
___________________________________ Prof. Dr. Haroldo Francisco Lobato Ribeiro Universidade Federal Rural da Amazônia Examinador Titular
___________________________________ Prof. Dr. Luiz Fernando de Souza
Rodrigues
A Deus e minha família, em especial, Katia Almeida (Mãe) e
AGRADECIMENTOS
À Deus a fonte do meu viver, sua graça maravilhosa, sua força, e seu querer em minha vida, confiando em mim tornando-me capaz desta missão, da qual saio fortalecida em meu espírito, em função do caráter desafiador e disciplinador da árdua e trabalhosa tarefa de conclusão desta obra acadêmica;
Agradeço a minha querida família. Aos meus pais (Takio e Kátia), Keilinha e ao meu grande exemplo, vó Lindalva Almeida, por seu amor, ajuda e compreensão! Meus irmãos Marcelo Takio, Marcos Seichy, Jéssica Akemy, Gabriel e cunhada Edilene Miyasaki. São tudo em minha vida! Os amo e agradeço, pois esta etapa é vencida com o apoio de vocês!
Ao Prof. William Gomes Vale, meu orientador, pela orientação, apoio, conselhos, pelos valiosos ensinamentos e principalmente pela amizade e agradável convívio durante essa caminhada. E ao co-orientador Dr. Haroldo Francisco Lobato Ribeiro, por estar sempre pronto a nos ajudar em momentos de maiores dificuldades;
À Fazenda Pacú (Dona Marlene, Ronaldo França, Mario França e família) pela disponibilização dos animais, espaço físico e grande amizade. Aos funcionários da Fazenda Pacú (Shimba, Cláudia, “Tchula”, Ismael e demais...), pelo dia-a-dia, pelo auxílio constante e disposição para a realização deste trabalho. Ao estagiário e amigo Mario Uribe, pela contribuição direta na realização do experimento com grande colaboração durante as etapas de colheita e criopreservação do sêmen;
Ao Dr. Humberto Hamad (UFOPA), pelo grande apoio nas análises estatísticas dos dados deste experimento;
Ao Laboratório de pesquisa em caprinos e ovinos (CPCOP/UFRA-Belém), na pessoa do prof. Dr. Luiz Fernando de Souza Rodrigues, por disponibilizar espaço e equipamentos para a leitura de materiais do experimento e por compor parte da banca examinadora de defesa desta tese;
À Universidade Federal do Pará, Universidade Federal Rural da Amazônia e à Embrapa Amazônia Oriental, que através do Curso de Pós-graduação em Ciência Animal me proporcionou grande crescimento profissional;
Aos grandes amigos Fábio André Campos e Marcela Videira, primeiramente pela amizade, pela sua grande ajuda, apoio e incentivo durante toda minha jornada. E aos demais: Kelly Gonçalves, Carla Carvalho, Renata Bastos, Samuel Vidal, Larissa Seixas, Daniel Santos, Andréia Silva, Jonathan Palmer, Tamiris Sousa, Adriel Arruda e Neto Rodrigues pela grande amizade e companheirismos;
A todos que diretamente ou indiretamente contribuíram para a realização desse trabalho, mas que, injustamente, por um lapso de memória não foram citados;
RESUMO
O objetivo do experimento foi testar a eficácia de diferentes diluidores, a base de Ringer-Lactato, Leite Desnatado, TRIS (hidroxi-methil-amino-methan) e Lactose/TRIS, na criopreservação de sêmen bubalino. Foram utilizados três machos bubalinos da raça Murrah em plena atividade sexual. O sêmen foi colhido por vagina artificial totalizando 71 ejaculados. Após a colheita, cada amostra foi submetida às análises qualitativas e quantitativas do sêmen. Os ejaculados foram fracionados e diluídos nos quatro diluidores. O sêmen diluído foi envasado em palhetas de 0,25ml e submetidos a um tempo de equilíbrio de até quatro horas a 5ºC, com posterior congelação em nitrogênio líquido. As amostras identificadas foram descongeladas em banho maria à temperatura de 40°C por 30 segundos e seqüencialmente avaliadas quanto a motilidade, vigor, lesão de acrossoma, e percentual de patologias espermáticas. As amostras também foram submetidas ao teste de termo-resistência, permanecendo incubadas à temperatura de 40°C durante 30 segundos, 3-5 minutos, 30 minutos, 1 hora, 2 horas e 3 horas, onde foram avaliadas quanto a motilidade e o vigor espermático. As características físico-químicas, após análise do sêmen in natura, encontraram-se dentro dos valores preconizados para a espécie bubalina e satisfatórios para o processo de congelação. Após descongelação do sêmen, observou redução numérica estatística (p<0,05) na motilidade espermática, sendo que no sêmen in natura se observou 86,67±6,17% reduzindo para 70±6,92% em TRIS, 67,4±8,01% em Ringer/lactato, 67,09±9,03% em Lactose/TRIS e 59,7±9,05% em leite desnatado e ao comparar entre os quatro tratamentos apenas o Leite desnatado mostrou diferença estatística significativa (p<0,05). Após descongelação, o vigor espermático também diminuiu estatisticamente (p<0,05) nos quatro tratamentos (3,50±0,53 TRIS; 3,38±0,49 Ringer-lactato; 3,3±0,46 Lactose/TRIS e 3,25±0,44 Leite desnatado) versus (4±0,39 sêmen in natura) e ao comparar entre os tratamento, apenas entre Leite desnatado e TRIS se observou diferença estatística (p<0,05). Quanto aos defeitos maiores (4,15±1,9% sêmen in natura; 10,51±4,4% TRIS; 11,94±4,2% Ringer-Lactato; 11,88±4,8% Lactose/TRIS; 12,01±5% Leite desnatado), menores (3,81±1,2% sêmen in natura; 4,67±1,1% TRIS; 4,98±1,7% Ringer-Lactato; 4,93±2,0% Lactose/TRIS; 4,93±2,0% Leite desnatado) e totais (7,91±2,1% sêmen in natura; 15,18±4,7% TRIS; 16,92±4,8% Ringer-Lactato; 16,82±5,6% Lactose/TRIS; 17,11±5,6% Leite desnatado), após descongelação houve aumento significativo dos defeitos nos quatro tratamentos (p<0,05), e entre eles não foram observadas diferenças estatísticas entre si (p>0,05). Na fase pós-TTR, após 3 horas de incubação, a motilidade progressiva (TRIS 21,13±7,5%; Ringer-Lactato 20,78±7,4%; Lactose/TRIS 20,25±5,3%; Leite desnatado 20,12±6,6%) e vigor espermático (TRIS 2,04±0,5; Ringer-Lactato 2,07±0,5; Lactose/TRIS 2,02±0,4; Leite desnatado 2,00±0,5) não apresentaram diferença estatística entre os tratamentos (p<0,05). Quanto a intergridade do acrossoma, após a descongelação (Sêmen in natura 97,85±0,6%; TRIS 91,65±4,3%; Ringer-Lactato 90,46±4,8%; Lactose/TRIS 89,76±5,4%; Leite desnatado 90,56±5,6%), houve diminuição estatística (p<0,05) e quando se comparou tal parâmetro entre os tratamentos não foi observado diferenças estatísticas significativas entre os tratamento (p>0,05). Diante dos resultados observados é possível concluir que a congelação de sêmen de búfalo com os diluidores TRIS (Tris-hydroxy-methyl-amino-methan), Ringer-Lactato, Lactose/TRIS, e Leite desnatado mostraram satisfatória função de crioproteção na viabilidade espermática do sêmen nas diferentes etapas da criopreservação.
ABSTRACT
The objective of this experiment was to test the effectiveness of different extenders, the basis of Ringer Lactate, Skim Milk, TRIS (hydroxymethyl-amino-methil Methan) and Lactose/TRIS, the cryopreservation of buffalo semen. We used three male Murrah buffaloes in full sexual activity. The semen was collected by artificial vagina total of 71 ejaculates. After harvest, each sample was subjected to qualitative and quantitative analyzes of semen. The ejaculates were split and diluted in four extenders. The diluted semen was stored in straws of 0,25 mL and subjected to an equilibration time of up to four hours at 5°C, with subsequent freezing in liquid nitrogen. The identified samples were thawed in a water bath at a temperature of 40°C for 30 seconds and subsequently evaluated for motility, vigor, acrosome damage, and percentage of sperm pathologies. The samples were also tested with heat-resistance, while remaining incubated at 40°C for 30 seconds, 3-5 minutes, 30 minutes, 1 hour, 2 hours and 3 hours, which were evaluated for motility and spermatic . The physico-chemical, after fresh semen analysis, were within the prescribed values for buffaloes and satisfactory for the freezing process. After thawing the semen, observed numerical reduction (p<0,05) in sperm motility, with fresh semen was found 86,67±6,17% decreasing to 70±6,92% in TRIS, 67,4±8,01% in Ringer/lactate, 67,09±9,03% in Lactose/TRIS and 59,7±9,05% in skim milk and to compare between the four treatments only the skimmed milk showed a statistically significant difference (p<0,05). After thawing, spermatic vigor also decreased significantly (p<0,05) in four treatments (3,50±0,53 TRIS, 3,38±0,49 Ringer's lactate, 3,3±0,46 Lactose/TRIS and 3,25±0,44 Skim milk) versus (4±0,39 fresh semen) and when comparing between treatment, only between skimmed milk and TRIS was no statistical difference (p<0,05). As for the larger defects (4,15±1,9% fresh semen; 10,51±4,4% TRIS, 11,94±4,2% Ringer's lactate, 11,88±4,8% Lactose/TRIS; 12,01±5% skim milk), smaller (3,81±1,2% fresh semen and 4,67±1,1% TRIS, 4,98±1,7% Ringer's lactate, 4,93±2,0% Lactose/TRIS, 4,93±2,0% skimmed milk) and total (7,91±2,1% fresh semen; 15,18±4,7% TRIS, 16,92±4,8% Ringer's lactate, 16,82±5,6% Lactose/TRIS, 17,11±5,6% skimmed milk), after thawing showed a significant increase of defects in the four treatments (p<0,05), and among them were not statistically different between groups (p>0,05). In the post-TTR after 3 hours of incubation, progressive motility (21,13±7,5% TRIS; Ringer lactate 20,78±7,4%; Lactose/TRIS 20,25±5,3%; Skimmed milk 20,12±6,6%) and spermatic vigor (TRIS 2,04±0,5, Ringer Lactate 2,07±0,5, Lactose/TRIS 2,02±0,4, 2 skim milk, 2,00±0,5) showed no statistical difference between treatments (p<0,05). As for intergridade acrosome after thawing (semen in natura 97,85,±0,6%; TRIS 91,65±4,3%, Ringer-Lactate 90,46±4,8%; Lactose/TRIS 89,76±5,4%; Skimmed milk 90,56±5,6%), decreased (p<0,05) and when comparing this parameter between treatments was not observed statistically significant differences between the treatment (p>0,05). Given the observed results we conclude that the freezing of buffalo semen extenders with TRIS (Tris-hydroxy-methyl-amino-Methan), Ringer Lactate, Lactose / TRIS and skimmed milk showed satisfactory function in cryoprotection of sperm viability semen in different stages of cryopreservation.
LISTA DE ILUTRAÇÕES
Páginas
Figura 1 Organização da membrana plasmática... 21
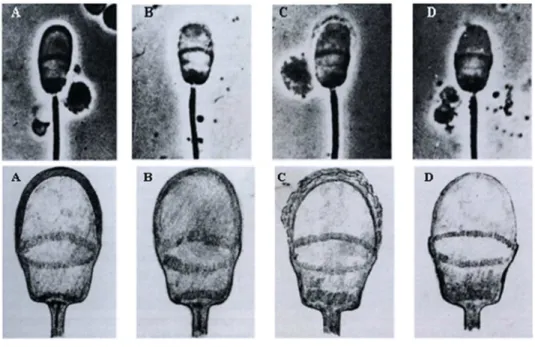
Figura 2 (A) Membrana acrossômica normal, (B) Membrana acrossômica alterada, (C) Início de desprendimento (D) Perda total da membrana acrossômica... 41
Figura 3 (A e B) Imagem de satélite e fotografia da Central de inseminação e Reprodução de Búfalos, localizado no município de Inhaúma, estado de Minas Gerais... 43
Figura 4 Exemplar bubalino utilizado no trabalho experimental... 44
Figura 5 Procedimento de colheita de sêmen bubalino pelo método da vagina artificial... 44
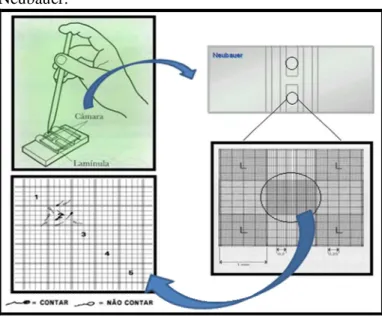
Figura 6 Câmara de Neubauer utilizada na contagem de espermatozóides e determinação da concentração espermática... 45
Figura 7 Esquema ilustrativo de como determinar a concentração espermática através do uso da câmara de Neubauer... 46
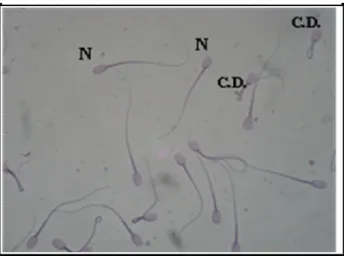
Figura 8 Imagem de microscopia óptica de espermatozóides bubalinos, corado em vermelho congo e violeta genciana, em aumento de 100x. No detalhe, espermatozóide normal (N) e espermatozóide com cauda dobrada (C.D.)... 47
Figura 9 Minitubos de 0,25 mL previamente identificados... 49
Figura 10 Envasamento manual do sêmen em Minitubos de 0,25 mL... 49
Figura 11 Desenho esquenático de uma caixa isotérmica com uma plataforma de nitrogênio líquido de 4cm de altura... 49
LISTA DE TABELAS
Páginas Tabela 1 Média ± Desvio padrão das características físico-químicas iniciais do
ejaculado (n=71) de três touros bubalinos, na fase de pré-congelação (n=71)... 52
Tabela 2 Análise comparativa da Média ± Desvio padrão da motilidade progressiva (%) de sêmen bubalino, na fase de pré-congelação (Sêmen in natura) e pós-descongelação nos diluidores TRIS (hidroxi-methil-amino-methan), Ringer-Lactato, Lactose/TRIS e Leite desnatado... 54
Tabela 3 Análise comparativa da Média ± Desvio padrão do vigor espemático (%) de sêmen bubalino, na fase de pré-congelação (Sêmen in natura) e pós-descongelação nos diluidores TRIS (hidroxi-methil-amino-methan), Ringer-Lactato, Lactose/TRIS e Leite desnatado... 56
Tabela 4 Média ± Desvio padrão dos defeitos maiores, menores e totais (%) de sêmen bubalino, na fase de pré-congelação (Sêmen in natura) em comparação com a fase pós-descongelação nos diluidores TRIS (hidroxi-methil-amino-methan), Ringer-Lactato, Lactose/TRIS e Leite desnatado... 57
Tabela 5 Média das motilidades espermáticas ± Desvio padrão (%) pós-descongelação no Teste de termorresistência em cada um dos tempos avaliados (3-5 minutos, 30 minutos, 1 hora, 2 horas e 3 horas) entre os diluidores TRIS (hidroxi-methil-amino-methan), Ringer-Lactato, Lactose/TRIS e Leite desnatado... 59
Tabela 6 Média do vigor ± Desvio padrão (%) pós-descongelação no Teste de termorresistência em cada um dos tempos avaliados (3-5 minutos, 30 minutos, 1 hora, 2 horas e 3 horas) entre os diluidores TRIS (hidroxi-methil-amino-methan), Ringer-Lactato, Lactose/TRIS e Leite desnatado... 61
Tabela 7 Média ± Desvio padrão da Integridade de acrossoma (%) de sêmen bubalino, na fase de pré-congelação (Sêmen in natura) em comparação com a fase pós-descongelação nos diluidores TRIS (hidroxi-methil-amino-methan), Ringer-Lactato, Lactose/TRIS e Leite desnatado... 61
LISTA DE ABREVIATURAS
ATP - adenosina trifosfato BSA - Albumina Sérica Bovina
C.D.- patologia espermática denominada decauda dobrada CIRB- Central de Inseminação e Reprodução de Búfalos cm3- centímetro cúbico, unidade de medida de volume cm- centímetro, unidade de medida de comprimento CH3H8O3 - fórmula molecular do glicerol
C6H12O6 - fórmula molecular da hexose C6H8O7- Fórmula molecular do ácido cítrico DNA - ácido desoxirribonucléico
DMSO- dimetilsulfoxide
FAO - Food and Agriculture Organization g - grama, unidade de medida de massa H+- íon hidrogênio
IA - inseminação artificial
IBGE - Instituto Brasileiro de Geografia e Estatística kg - quilograma, unidade de medida de massa L - litro, unidade de volume
µL - microlitro, unidade de medida de volume mg - miligrama, unidade de medida de massa mL - mililitro, unidade de medida de volume mM - milimol, unidade de medida de concentração mm3- milímetro cúbico, unidade de volume
min- minuto. Múltiplo do segundo, unidade de tempo do sistema métrico internacional.
N- espermatozóide normal pH - potencial hidrogeniônico
P- símbolo estatístico que denota grau de significância entre as variáveis estudadas PIB- Produto Interno Bruto
% - porcentagem, unidade de razão na base 100 R$- Símbolo monetário composto da moeda real
S- Latitude sul
TES-TRIS - diluidor utilizado para congelação de sêmen, principalmente em bubalinos TRIS- hidroxi-methil-amino-methan
TES- hidroxi-methil-amino-ethan TTR- teste de termorresistência
U.I.- unidade internacional, é uma unidade de medida para a quantidade de uma substância
LISTA DE SÍMBOLOS
%- porcentagem
ºC - grau Celsius, unidade de temperatura / - símbolo matemático que indica proporção
<- menor, símbolo matemático que indica valores inferiores >-maior, símbolo matemático que indica valores superiores
±- mais ou menos, símbolo utilizado entre as unidades estatísticas de média e desvio padrão
= - igual, símbolo matemático que indica igual igualdade + - mais, símbolo matemático que indica soma / positivo ° - grau
- - menos, símbolo matemático que indica menos / negativo
(-)- substância química levógira, com a característica de fazer girar o plano da luz polarizada para o sentido contrário ao das substâncias dextrógiras.
®- marca registrada
x - vezes, símbolo matemático que indica multiplicação 106-milhões
109-bilhões : - para (1:100)
SUMÁRIO
1 INTRODUÇÃO... 13
2 OBJETIVOS... 15
2.1 OBJETIVO GERAL... 15
2.2 OBJETIVOS ESPECÍFICOS... 15
3 REVISÃO DE LITERATURA... 16 3. 1 CRIOPRESERVAÇÃO DE CÉLULAS ESPERMÁTICAS... 3. 2 PRINCIPIOS DA CRIOPRESERVAÇÃO... 3. 2. 1 Diluição e envase do sêmen... 3. 2. 2 Resfriamento do sêmen... 3. 2. 3 Tempo de equilibrio do sêmen... 3. 2. 4 Congelação do sêmen... 3.2.4.1 Membrana plasmática... 3.2.4.2 Princípios da criopreservação... 3. 2. 5 Descongelação... 3.3 DILUENTES E CRIOPROTETORES PARA CONGELAÇÃO DE SÊMEN... 3.3.1 Composicão básica do meio diluente... 3.3.2 Crioprotetores... 3.3.2.1. Crioprotetores penetrantes... 3.3.2.2. Crioprotetores não penetrantes... 3.3.3 Diluidores na congelação de sêmen bubalino... 3.4 TESTE DE TERMO-RESISTÊNCIA (TTR)... 3.5 LESÃO DE ACROSSOMA ... 4 MATERIAL E MÉTODOS... 4.1 LOCAL DO EXPERIMENTO... 4.2 ANIMAIS E MEDIDAS DE MANEJO... 4.3 COLHEITAS DO SÊMEN... 4.4 AVALIAÇÃO DOS EJACULADOS... 4.4.1 Determinação das características físicas do ejaculado... 4.4.1.1 Volume, aspecto, pH seminal e concentração... 4.4.1.2 Turbilhonamento, motilidade e vigor espermático... 4.4.2 Determinação das características morfológicas dos espermatozóides...
1 INTRODUÇÃO
Segundo a Organização das Nações Unidas para Agricultura e Alimentação (FAO) o contingente populacional mundial de búfalos em 2009 foi estimado em torno de 188 milhões de cabeças (FAO, 2009), das quais mais de 80% estão localizadas na Índia, China e Paquistão (DIXIT; SIKKA, 2009).
No Brasil, a bubalinocultura se destaca, sendo que em 2009 o efetivo total de búfalos no Brasill totalizou 1.160.000 cabeças, sendo que o maior percentual efetivo desta espécie se localiza na região Norte com 62,8%. O Estado do Pará apresenta o maior contigente da região Norte, com um efetivo de 442.405 cabeças em 2008, o que corresponde a 38,57% do total nacional (VALE, 2008; IBGE, 2009), cuja criação, abate, transformação, comercialização de produtos (carne, couro, leite e derivados), turismos rural, tem contribuindo para o crescimento do agronegocio regional e para o Produto Interno Bruto (PIB) do Estado (CASTRO, 2010).
A expansão da exploração de bubalinos com aptidão leiteira no Brasil teve início a partir da década de 90, obtendo um crescimento estimado de 15% em 2009, reflexo do grande interesse pela exploração do potencial da espécie (ABCB, 2011).
Em função deste crescente interesse pela bubalinocultura, se faz premente a necessidade de aumentar as características qualitativas da espécie, já que assim o crescimento do rebanho estará associado ao controle da produtividade, possibilitando a identificação de animais que apresentem méritos genéticos, sua multiplicação e distribuição, a partir do auxílio das biotecnologias da reprodução (VALE, 1994; RODRIGUES, 2007).
O desenvolvimento de técnicas adequadas para a criopreservação de sêmen em bubalinos representa um passo importante no avanço da reprodução animal, já que possibilita um aumento na eficiência produtiva dos rebanhos, especialmente devido ao uso em maior escala de animais geneticamente superiores, que vem sendo conseguido através da aplicação de biotécnicas, cada vez mais modernas (PAPA et al., 2002).
deste em manter as funções celulares espermáticas durante o processo de congelação e descongelação.
Segundo Vale (1994, 2008), os seguintes diluidores tem sido bastante utilizados na criopreservação do sêmen bubalino: TRIS (hidroxi-methil-amino-methan), TES (Tris-hidroxi-methil-amino-ethan), Citrato-Gema, Leite-Citrato, Ácido Cítrico-Soro, Lactose, Leite desnatado, Soro de Leite e Água de Coco. Segundo Nahúm (2000), alguns destes possuem eficiência comprovada, porém de alto custo e difícil aquisição, encarecendo o processo de criopreservação, e nem sempre mostrando uma relação custo benefício favorável.
Levando em consideração as várias interações que ocorrem no processo de criopreservação de espermatozóides na espécie bubalina, esta deve ter suas técnicas aprimoradas, a partir da adoção de critérios de viabilidade espermáticas aceitáveis que sejam condizentes com os padrões normais de fertilidade (VALE, 2002).
Na última década houve maior interesse na inseminação artificial (IA), com destaque para a IA em tempo fixo e na criopreservação do sêmen na espécie bubalina. A exemplo, a solução de Ringer-Lactato já foi comprovada como bom diluidor de sêmen bubalino em experimento desenvolvido por Silva et al. (2002a), e foi constituído como alternativa econômica na criopreservação de sêmen para a espécie. Comparativamente, o custo do diluente Ringer-Lactato, é de 3 dólares/L contra 25 do TES (Tris-hidroxi-methil-amino-ethan, Laboratório Merk, Germany), representando uma redução de custo de aproximadamente 12% por dose produzida com o uso de Ringer-Lactato em comparação ao TES.
2 OBJETIVOS
2.1 OBJETIVO GERAL
Comparar diferentes diluidores no processo de criopreservação de sêmen bubalino que venham garantir adequada preservação espermática, que possam servir como alternativas mais práticas e econômicas.
2.2 OBJETIVOS ESPECÍFICOS
Avaliar turbilhonamento, motilidade, vigor espermático, pH, patologias e integridade de acrossoma de espermatozóides na fase de pré-congelação;
Avaliar os paramêtros motilidade espermática, vigor espermático, patologias e integridade de acrossoma com diluidores a base de Ringer-Lactato, Leite desnatado, TRIS (hidroxi-methil-amino-methan) e Lactose/TRIS na fase de pré-congelação;
Comparar os parâmetros motilidade, vigor espermático, patologias e integridade de acrossoma nas fases de pré-congelação e pós-congelação com diluidores a base de Ringer-Lactato, Leite desnatado, TRIS (hidroxi-methil-amino-methan) e Lactose/TRIS; Comparar motilidade e vigor espermático pelo teste de termo-resistência (TTR) do diluidor padrão TRIS (hidroxi-methil-amino-methan) aos demais diluidores: Ringer-Lactato, Leite Desnatado e Lactose/TRIS, após 30 dias do sêmen estar contido em botijão criogênico, nas etapas 3-5’, 1 hora, 2 horas e 3 horas, pós-congelação;
3 REVISÃO DE LITERATURA
3.1 CRIOPRESERVAÇÃO DE CÉLULAS ESPERMÁTICAS
As pesquisas com criopreservação de sêmen bubalino foram iniciadas na Índia, na década de 50, por Bhattacharya e Srivastava (1955). Sendo que os primeiros a obter sucessos com a congelação de sêmen bubalino foi Roy et al. (1956) e Basirov (1964) que foi o primeiro a publicar uma gestação a partir da congelação e descongelação de sêmen bubalino. Desde então, a IA foi aprovada em bubalinos, porém, permaneceu impopular em função de baixas taxas de fertilidade com sêmen descongelado (SHUKLA; MISRA, 2007). Sendo que após a realização de um seminário sobre Reprodução e IA realizado na Índia no ano de 1979, organizado pela FAO e pelo governo Sueco em Karnal, começaram a se obter resultados satisfatórios sobre as taxas de concepção, que segundo Vale (2008) estes resultados precisavam ser superiores a 65%.
No Brasil, as primeiras inseminações em bubalinos foram desenvolvidas no arquipélago do Marajó, que resultaram no nascimento de quatro bezerros no ano de 1982, pouco tempo após o início dos estudos sobre processamento tecnológico de sêmen de búfalos no Brasil, desenvolvidos por Vale e colaboradores na região amazônica (RIBEIRO et al., 1994).
A criopreservação é um método não-fisiológico, que envolve elevado grau de adaptação das células biológicas aos choques térmicos e osmóticos, durante os processos de diluição, resfriamento, congelação e descongelação (WATSON et al., 1992; HOLT 2000), tendo por objetivo preservar as células espermáticas por um longo período, já que, segundo Amman e Graham (1993), o resfriamento e a congelação do sêmen reduzem o metabolismo espermático, diminuindo desta forma a produção de catabólitos e a peroxidação de lipídeos da membrana espermática, aumentando assim a vida útil dessas células.
Geralmente, é aceito que com o processo de criopreservação haja uma redução de mais de 50% da viabilidade espermática (WATSON, 1979). Oba et al. (1993) relatam que entre 32,5 a 58,8% dos espermatozóides bubalinos tornam-se inviáveis após processo de congelação e descongelação.
Segundo Andrabi (2009), tais danos acarretam consequências cruciais a viabilidade celular e na sua capacidade fecundante. De acordo com Medeiros et al. (2002a) o sucesso da criopreservação do sêmen dependerá da manutenção do potencial fertilizante dos espermatozóides, devendo estes apresentarem integridade e funcionalidade das suas diferentes estruturas celulares
Descreveram Amann e Pickett (1987) os passos para a criopreservação do sêmen: diluição, resfriamento, congelação, armazenamento e descongelação. Segundo Yoshida (2000), a preservação das estruturas espermáticas após congelação é obtida a partir de interações entre diluidor, crioprotetor, taxas de resfriamento, congelação e descongelação, com o intuito de se minimizar os danos causados pelo choque frio, formação de cristais de gelo e desidratação celular
3.2 PRINCIPIOS DA CRIOPRESERVAÇÃO 3.2.1 Diluição e envase do sêmen
O sucesso da criopreservação de sêmen também é dependente da taxa de diluição. A “priori” este processo foi pensado para a proteção dos espermatozóides durante o resfriamento, congelação e descongelação, mas seus beneficios também proporcionaram aplicações técnicas, como possibilidades de se obter maior número de vacas inseminadas com um mesmo ejaculado (SALAMON; MAXWELL, 2000).
Segundo Vale (2008) após colheita do semên, este deve ser imediatamente pré-diluido com o diluente, misturando lentamente com o auxilio de uma pipeta, tendo o cuidado de tanto o sêmen quanto o diluente estarem a temperatura de 37°C, assim, é importante ambos estarem submergidos em banho maria à mesma temperatura.
por mL. Ao final da diluição, deve-se proceder a avaliação da motilidade e vigor, antes do envase (VALE, 2008). As Mini palhetas (0,25 mL) são geralmente as mais utilizadas devido à sua relação custo/beneficio e otimização do espaço para o armazenamento em botijões criogênicos (SANSONE et al., 2000).
Haranath et al. (1990) trabalhando com sêmen bubalino observaram em palhetas de 0,25 e 0,5 mL, motilidades pós-descongelação de 56,4±0,86 e 55,64±0,86%, respectivamente. Observaram também melhora na taxa de concepção para o sêmen envasado e congelado em mini palhetas de 52,7%, quando comparada a palhetas média de 0,5 ml com taxas de concepção de 50,4%.
3.2.2 Resfriamento do sêmen
Segundo Watson (2000), a curva de resfriamento é considerada o principal entrave no processo de criopreservação do sêmen.
Durante o processo de criopreservação, o sêmen bubalino primeiramente deve ser resfriado da temperatura corpórea à temperatura ambiente, ou seja, de aproximadamente de 38 a 20°C, antes da diluição final, que para Keith (1998) não costuma ocasionar danos aos espermatozóides, quando diluído em meio adequado.
Após a diluição, o sêmen deve ser resfriado lentamente a uma temperatura de aproximadamente 4 à 5°C, constituindo-se um período de adaptação dos espermatozóides ao metabolismo reduzido, com o objetivo de diminuir o potencial ao choque térmico (ANDRABI, 2009).
Watson (2000) cita que grandes mudanças em espermatozóides de bovinos ocorrem em um intervalo de 15 a 5°C. Segundo o autor, isto ocorre devido a fase de transição da membrana plasmática do estado líquido cristalino para o estado de gel (AMANN; PICKETT, 1987; GRAHAM, 1996; MEDEIROS, 2002a).
No estudo com sêmen de equinos as curvas de resfriamento rápida (queda maior que 1°C/mim), média (queda entre 1-0,3°C/mim) e lenta (queda menor que 0,3°C/mim) tem sido bastante descritas na literatura (JASKO, 1994).
acrossoma (GRAHAM, 1995, 1996). Alterações na fluidez e na permeabilidade da membrana plasmática também geram danos ao acrossoma pois levam à redução da atividade metabólica e ao consumo de ATP, refletindo de maneira geral na fertilidade do espermatozóide (WEITZE; PETZOLD, 1992).
Processos de resfriamento lento de sêmen bubalino também foram testados por Ramakrishnan e Ariff (1994), onde resfriaram a uma temperatura de 5°C por 45, 65 e 90 minutos, não observando diferenças significativas na motilidade pós-descongelação entre os diferentes tratamentos em que a variável era tempo.
Talevi et al. (1994) resfriando sêmen de búfalo de 28°C à 5°C, em 15 minutos e então, equilibrando a 5°C por 1 hora e 45 minutos (resfriamento rápido) ou resfriando em 1 hora e equilibrando por 1 hora (resfriamento lento), observaram que a motilidade espermática pós-descongelação foi significativamente maior no resfriamento lento quando comparado ao resfriamento rápido. Por outro lado, a taxa de resfriamento não teve efeito significativo sobre a integridade do acrossoma.
Dhami e Sahni (1994) refrigerando o sêmen de búfalos de 30 a 5°C em 60 e 120 minutos, obteve melhores resultados com 120 minutos.
Segundo Graham (1996) e Sansone et al. (2000), um processo de resfriamento lento obtendo 0,2-0,4°C/minuto seria o mais recomendado ao longo de um processo de congelação de sêmen de búfalos, minimizando assim, os efeito deletérios durante a taxa de resfriamento entre as temperaturas de 19 a 8ºC.
3.2.3 Tempo de equilibrio do sêmen
O tempo de equilíbrio é o tempo no qual o espermatozóide permanece à temperatura de 4-5°C permanecendo em contato com o crioprotetor antes da congelação (WIGGIN; ALMQUIST, 1974). Nesta fase, o crioprotetor penetra nas células espermáticas estabelecendo concentrações equilibradas intra e extracelular (SALAMON; MAXWELL, 2000). Esse tempo é necessário para que os espermatozóides interajam com os constituintes do meio (gema de ovo e crioprotetores) e esses adquiram máxima resistência aos danos causados à célula espermática pelo processo de criopreservação (BOUCHARD et al ., 1990; ENGLAND, 1993).
duas e seis horas. Já Dhami e Kodagali (1990) e Talevi et al. (1994) sugeriram que esse tempo deve compreender seis horas de equilíbrio. Por outro lado, Singh et al. (1989), Dhami e Sahni (1994) e Del Sorbo et al. (1995), sugeriram que esse tempo pode compreender entre 2 a 4 horas.
3.2.4 Congelação do sêmen 3.2.4.1 Membrana plasmática
As membranas espermáticas seguem o modelo clássico de membrana plasmática (WATSON, 1981, 1995). Desta forma, a membrana plasmática dos espermatozóides de mamíferos se apresenta organizada em domínios regionais bem delineados que diferem em composição e função (WOLFE et al., 1998). Essa integridade estrutural da membrana é determinada pela temperatura e pela solução na qual ela está banhada (COOPER, 1996; GRAHAM, 1995).
Sendo que tal membrana engloba todas as estruturas do espermatozóide, mantendo a diferenças entre o citosol e o ambiente extracelular. Sendo composta de moléculas lipídicas e protéicas, unidas principalmente por ligações não-covalentes (ALBERTS et al., 2004).
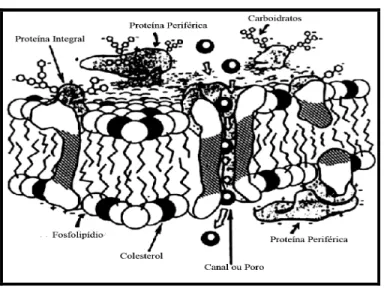
A porção extracelular das proteínas da membrana plasmática são recobertas por carboidratos que estão presentes na superfície celular, sendo, esta estrutura, conhecida como glicocálice, a qual tem a função de proteger a superfície celular, além de servir de marcador para uma grande variedade de interações celulares (Figura 1) (COOPER, 1996).
Figura 1. Organização da membrana plasmática
Fonte: (ZAFIAN, 1984).
Essa quantidade de colesterol tem grande influência sobre índices de capacitação espermática, quanto também a afetar a fertilidade e a capacidade do ejaculado em suportar o resfriamento e a congelação do sêmen (AMMAN; GRAHAM, 1993)
Essas camadas com moléculas lipídicas possuem uma extremidade hidrofílica ou polar, voltada para o meio externo e uma extremidade hidrofóbica ou apolar, voltada para o meio interno (SQUIRES et al., 1999).
A membrana plasmática dos espermatozóides não é estática, haja vista que em sua maioria todos os componentes encontram-se dispostos aleatoriamente e são livres para movimentarem-se lateralmente, visto que a membrana é fluída a temperatura ambiente, denominado estado líquido-cristalino (PARKS; GRAHAM, 1992; SQUIRES et al., 1999).
Estas membranas plasmáticas podem ser alteradas com a utilização de técnicas de preservação de sêmen. Em situações de resfriamento do sêmen ocorre uma reorientação dos lipídios, podendo afetar a estabilidade da membrana ou induzir a um rearranjo das moléculas, fase essa denominada de Hexagonal II, e assim formando pontos de fragilidade promovendo permeabilidade excessiva ou até mesmo ruptura da membrana plasmática. Sendo uma fase que pode ser transitória ou até mesmo persistir irreversivelmente mesmo após o aquecimento (PARKS; GRAHAM, 1992).
seguido de hidrólise dos fosfolipídios danificando e aumentando a permeabilidade da membrana plasmática do espermatozóide (AMANN; PICKETT, 1987).
3.2.4.2 Princípios da criopreservação
Na criopreservação, quando os espermatozóides chegam a uma temperatura de 19 a 5ºC, a membrana plasmática passa por uma fase de transição, do estado líquido cristalino para o de gel, podendo ocorrer perda de movimentos progressivos, alterações nas membranas plasmática e acrossomal, sendo o primeiro desafio para estas células, que pode ser transitório ou irreversível (PARKS; GRAHAM, 1992; WATSON, 1995).
Quando a temperatura atinge entre -5ºC e -10ºC, a água pura no meio extracelular se transforma em cristais de gelo, e como o meio intra-celular está protegida pela membrana plasmática não se congela, ficando apenas super resfriada, mesmo sendo o ponto de congelação do citoplasma celular abaixo de -1ºC. Daí a importância da integridade da membrana plasmática para impedir a entrada desse gelo na célula. E a concentração de soluto na fração descongelada aumenta, enquanto a membrana plasmática impede formação de cristais de gelo intracelular (GRAHAM, 1996).
Nesta temperaturas, a curva de congelação deve ser lenta para evitar a congelação da água intracelular e rápida o suficiente para evitar o contato da célula desidratada com o meio hiperosmótico (SQUIRES et al, 1999).
De -6°C a -15°C, a água no meio começa a cristalizar e a concentração de soluto na fração descongelada aumenta, enquanto a membrana plasmática impede formação de cristais de gelo intracelular (GRAHAM, 1996).
Como a água super resfriada no interior da célula tem maior pressão de vapor que o gelo, a célula perde água até atingir o equilíbrio. E assim, a água do interior da célula flui por osmose para o meio externo e também se congela. Os outros elementos do meio extracelular (sais, proteínas e gorduras), permanecem na porção não congelada (HOLT, 2000). Como resultado dessa desidratação, de acordo com Mazur (1990) e Meyers (2005), ocorre a concentração intracelular de soluto e diminuição do tamanho da célula
Ao passo que a temperatura diminue, mais moléculas de água se cristalizam, resultando em uma concentração maior de solutos na fração não congelada, que formarão os “canais não congelados”. O volume destes canais é importante, pois somente as células que estiverem neles irão sobreviver a criopreservação. Assim, os crioprotetores são adicionados ao meio diluidor para reduzir o ponto de congelação e proteger as estruturas espermáticas durante a congelação e descongelação (AMAN; PICKETT, 1987).
O processo de congelação se dá após o tempo de equilíbrio, onde o sêmen envasado é congelado em nitrogênio líquido. E pode ser feito quando as células alcançam a temperatura crítica (-60°C), onde os espermatozóides ficam relativamente inertes e o sêmen pode ser imerso em nitrogênio líquido, para seu armazenamento (GRAHAM, 1996).
Essa congelação em nitrogênio líquido é relativamente prática podendo ser executada a partir de uma caixa isotérmica simples, onde as palhetas ficam suspensas em posição horizontal a uma distância de 4 centímetros do nitrogênio líquido por 20 minutos, após o qual serão imersas em nitrogênio líquido a temperatura de -196°C (VALE, 2008).
3.2.5 Descongelação
O processo de descongelação é tão importante para a sobrevivência dos espermatozóides quanto a fase de congelação. Os espermatozóides que sobreviveram a congelação a -196°C ainda enfrentam o desafio de sofrerem aquecimento e descongelação, e, portanto, re-atravessar a zona de temperatura de -50 a -5°C (MARSHALL, 1984). E dependendo da curva de resfriamento (lenta, moderada e rápida) irá demandar técnicas diferentes para a descongelação (ANDRABI, 2009).
O efeito da descongelação muitas vezes irá depender se a taxa de resfriamento foi alta o suficiente para induzir a congelação intracelular, ou baixa o suficiente para produzir a desidratação celular (ANDRABI, 2009).
necessária a fim de se evitar a recristalização de qualquer gelo intracelular presente nos espermatozóides (SALAMON; MAXWELL, 2000).
Se o espermatozóide for congelado na curva lenta, a descongelação deverá ser executada de maneira lenta, já que assim haverá tempo suficiente para que o gelo extracelular descongele e a água reingresse diluindo o meio intracelular. (GRAHAM, 1996).
Já no caso de sêmen congelado em curvas moderadas de descongelação, o gelo extracelular descongelará de maneira lenta, diluindo gradativamente o soluto das frações de água não congeladas, o que permite que a água se difunda lentamente para dentro da célula, diluindo o soluto intracelular até atingir a concentração inicial (GRAHAM, 1996). Vale (2008) sugere que a descongelação para espécie bubalina deva ser feita em curvas moderadas de descongelação, em água por 30 segundos a 40°C.
Rao et al. (1986), testando duas taxas de descongelação (37°C por 30 segundos e 75°C por 9 segundos) na criopreservação de sêmen bubalino em diluidor a base de TRIS obteve melhor percentual de motilidade para o sêmen descongelado a 37°C por 30 segundos. Por sua vez, Dhami et al. (1992) testando a 40°C por 60 segundos, 60°C por 15 segundos e 80°C por 5 segundos também criopreservando sêmen bubalino com diluidor a base de TRIS, chegaram a conclusão que a descongelação a 60°C por 15 segundos produziu maior motilidade espermática em comparação a outras taxas. Anos depois, Dhami et al. (1996) testando a descongelação a 4°C por 5 minutos, 40°C por 1 minutos ou 60°C por 15 segundos, também chegaram a resultados semelhantes em que a descongelação do sêmen a 60°C por 15 segundos rendeu melhor recuperação pós-descongelação dos espermatozóides.
Baliero (1993) comparou três métodos de descongelação de sêmen de búfalos de 75°C durante 9 segundos, 40°C durante 10 segundos e 37°C durante 30 segundos, não encontrando diferença significativa na motilidade progressiva e integridade acrossômica.
3.3 DILUENTES E CRIOPROTETORES PARA CONGELAÇÃO DE SÊMEN 3.3.1 Composicão básica do meio diluente
Segundo Godim et al. (2009), a função do diluidor é manter a viabilidade das células espermáticas por alguns dias após a colheita, fornecer substratos necessários ao metabolismo dos espermatozóides, proteger o sêmen contra choque térmico, aumentar o volume do sêmen, manter o pH e inibir o crescimento bacteriano, sendo que para isso são necessários a presença de alguns componentes básicos como: fontes energéticas para o espermatozóide, estabilizador do pH no meio (LINDE-FORSBERG, 1991; ENGLAND, 1993), substâncias iônicas e não iônicas que mantenham a osmolaridade, enzimas, antibióticos e tampões como o citrato de sódio, que previnem alterações de pH à medida que se acumulam resíduos metabólicos; lipoproteínas ou material de alto peso molecular que previnam o choque frio, como a gema de ovo ou leite, glicerol e o propanediol, ou dimetilsulfoxide (DMSO) como agentes crioprotetores intracelular (VISHWANATH; SHANNON, 2000).
O TRIS constitui-se de uma substância disponível no mercado em um alto grau de pureza na forma de cristais, possuindo a propriedade de estabilizar o pH do meio diluidor, atuando como tampão bipolar em pH entre 7 e 9 (McPHAIL; GOODMAN, 1984), difundindo facilmente através de espaços intracelulares (KALLET et al., 2000), uma vez que a atividade metabólica do espermatozóide resulta na formação de íons H+, que podem levar a acidificação do meio, e assim, reduzindo a longevidade e a capacidade fertilizante da célula espermática (ENGLAND, 1993).
Conhecido também pela sua propriedade de não inibir diversos sistemas enzimáticos e habilidade de reduzir o metabolismo da frutose contribuindo para a preservação da energia das células espermáticas (SILVA, 2005).
Para o preparo dos diluentes, usualmente, realiza-se a adição de uma hexose (C6H12O6), como fonte exógena de substrato energético para o espermatozóide
(ENGLAND, 1993), e através da via glicolítica ou do ciclo de Krebs, as células espermáticas dos mamíferos obtêm energia necessária para a manutenção de sua motilidade (RIGAU et al., 2002).
Ahmad e Chaudhry (1980) investigando a lactose e a frutose em meios diluidores na criopreservação do sêmen de búfalos constaram que o diluente contendo 11% de lactose e 6% de frutose alcançaram melhores resultados quando observado motilidade pós-descongelação e sobrevivência.
O ácido cítrico (ácido 2-hidroxi-1,2,3-propanotricarboxílico - C6H8O7) é um
ácido fraco inorgânico que em temperatura ambiente, se apresenta como um pó cristalino branco, na forma anidra ou monohidratada, sendo que quando adicionada ao diluente a base de TRIS, esta na forma monohidratada (SILVA et al., 2002b).
Possui ação anti-oxidante e relevante atuação no ciclo de Krebs, importante via da respiração celular que ocorre nas mitocôndrias, e semelhante ao TRIS, contribui para a preservação da célula espermática auxiliando na manutenção do pH, quando se transforma em citrato ao doar prótons (SILVA, 2005).
3.3.2 Crioprotetores
As substâncias crioprotetoras adicionadas ao sêmen são de fundamental importância para criopreservação de quase todos os sistemas biológicos (FAHY, 1986). De acordo com Amann e Pickett (1987) estas auxiliam na preservação da integridade da membrana plasmática, que pode sofrer alterações devido às mudanças de temperatura durante o processo de congelação e descongelação. Para Sirivaidyanpong et al. (2000) preserva uma das habilidades do espermatozóide que é a reação acrossômica.
Segundo Castelo et al. (2008) as substâncias crioprotetoras podem ser classificadas penetrantes ou não penetrantes de acordo com o peso molecular e a conseqüente propriedade de atravessar ou não a membrana celular.
3.3.2.1 Crioprotetores penetrantes
Os crioprotetores penetrantes utilizados em meios diluentes para congelação de sêmen em animais domésticos são: glicerol, etilenoglicol, etanol, metanol, polietilenoglicol e o grupo das amidas: dimetilsulfóxido (DMSO), formamida, lactamida, acetamida e dimetilformamida (DE LEEUW et al., 1993, MEDEIROS et al., 2002b).
água, criando um ambiente menos nocivo para as células, já que estas ligações mudam a orientação da molécula da água nos cristais de gelo.
O glicerol (CH3H8O3), um álcool polihídrico altamente permeável, é o
crioprotetor mais empregado na congelação de sêmen nas diferentes espécies e tem sido de grande importância para o avanço na tecnologia de criopreservação de sêmen (SILVA et al., 2003), por reduzir danos mecânicos aos espermatozóide durante o processo de congelação e por prevenir os efeitos de concentração do meio extracelular (VISHWANATH; SHANNON, 2000), semelhante a outros crioprotetores penetrantes como o DMSO (NICOLAJSEN; HVIDT, 1994).
Parks e Graham (1992) sugeriram que a penetração do glicerol na célula se dá através de difusão passiva, permanecendo tanto na membrana celular quanto no citoplasma. Segundo Kundu et al. (2000), o mecanismo de proteção desta molécula se deve à capacidade de ligação dos átomos de hidrogênio dos grupos hidroxila com os átomos de oxigênio dos grupos fosfato dos fosfolipídios da membrana do espermatozóide, promovendo assim a estabilização da membrana durante o processo de criopreservação.
Segundo Lovelock e Polge (1954) e Watson (2000), como efeito crioprotetor do glicerol tem-se a impedimento da formação de cristais de gelo intracelulares, diminuição do ponto de congelação e conseqüente redução das concentrações de eletrólitos na fração não-congelada da amostra.
No entanto, o glicerol apesar de ser um bom crioprotetor espermático, pode apresentar ações deletérias sobre os espermatozóides, induzindo desnaturação de proteínas, alteração de interações da actina, indução da liberação das proteínas do seu local na membrana (FAHY et al. 1990) e efeitos contraceptivos, provavelmente, pelas alterações causadas na membrana plasmática dos espermatozóides (BECKER et al. 1977, McLAUGHLIN et al. 1992, HAMMERSTEDT; GRAHAN, 1992).
3.3.2.2 Crioprotetores não penetrantes
gelo em seu interior durante a criopreservação. Estes são representados por açúcares (glicose, lactose, xilose, frutose, rafinose, sacarose e cheeni), lipoproteínas da gema do ovo, proteínas do leite e alguns aminoácidos (SEIDEL, 1984, AMANN; PICKETT, 1987, PICKETT et al. 1987, RODRIGUES, 1992, HOLT, 2000).
O crioprotetor tem um importante papel na permeabilidade da membrana celular e manutenção do balanço eletrolítico exercidos pelos açúcares de alto peso molecular (SANSONE et al., 2000).
Kumar et al. (1994) estudando os efeitos crioprotetores de 6 açúcares (glicose, xilose, frutose, rafinose, sacarose e cheeni) em diferentes concentrações, observaram que os açúcares se comportam independente em diferentes tampões, logo, suas concentrações influenciarão sobre possíveis efeitos na motilidade espermática após descongelação. Tais açúcares criam uma pressão osmótica, provocando desidratação celular e, portanto favorecendo menor incidência de formação de gelo intracelular (AISEN et al. , 2002).
Ala Ud et al. (1981) estudando a criopreservação de sêmen bubalino com diluidores a base de Leite integral homogeneizado, Laiciphos, Lactose e Citrato, observaram que o diluidores a base de Lactose deram uma melhor proteção aos espermatozóides durante o processo criogênico.
A solução de Ringer com lactato é com freqüência utilizada na medicina humana e veterinária como fluidoterapia, possui uma composição semelhante a água de coco, que foi comprovado como bom diluidor para criopreservação de sêmen bubalino (NAHÚM, 2000). Em sua composição também possui a lactose que possui a propriedade de proteger as membranas celulares reduzindo o percentual de patologias espermáticas além de possuir semelhante osmolaridade ao plasma seminal (BALIEIRO, 1993; SILVA et al. 2002a).
O leite de vaca é um diluidor amplamente utilizado para a congelação de sêmen bubalino. Segundo Kumar et al. (1993) recomenda-se que antes do uso para a diluição, se proceda o aquecimento do leite e posterior resfriamento durante a noite em geladeira, seguida de retirada da camada de gordura e aquecimento em banho-maria por 10-12 minutos. Após o resfriamento repetido, a gordura restante deve ser removida por filtração através de lã de algodão.
densidade), as quais aderem a membrana celular durante o processo de criopreservação, preservando a membrana do espermatozóide e prevenindo a saída de fosfolipídio e colesterol da membrana espermática, através da formação de um complexo com as proteínas do plasma seminal, prevenindo a ruptura da membrana plasmática, aumentado desta forma a tolerância ao choque térmico e ao processo de congelação (HOLT et al., 1992; FARSTARD, 1996; MOUSSA et al. 2002; BERGERON et al., 2004; GONZALEZ, 2004; PRADO, 2009). Esses fosfolipídeos que compõem a fração LDL da gema de ovo também protegem o sêmen especificamente durante o processo de resfriamento a 5ºC (WILHELM et al., 1996).
As evidências dos estudos criomicroscópicos em sêmen de carneiro (JONES; MARTIN, 1973; HOLT et al., 1992; KUMAR et al., 1992) demonstram que a presença da gema de ovo no diluidor, além de contribuir na proteção da membrana plasmática contra o choque térmico estimulam as vias de sinalização do sistema enzimático na fecundação, e permitem suportar a presença em meios hiper ou hiposmóticos, por ser a gema de ovo um tampão osmótico.
Entretanto, apesar de seus efeitos benéficos, a presença da gema de ovo também pode possibilitar alguns efeitos indesejados como: a contaminação do meio diluidor, favorecendo a produção de endotoxinas capazes de prejudicar a capacidade de fecundação dos espermatozóides (BOSSEAU et al. 1998; AIRES et al., 2003; PAGL et al., 2006). Para Martin (2005) dificuldade na padronização da gema de ovo. De acordo com Wall e Foote (1999) diminuição da motilidade espermática por conter substâncias que possam inibir a atividade mitocondrial dos espermatozóides.
3.3.3 Diluidores na congelação de sêmen bubalino.
Inúmeros são os diluidores utilizados para a criopreservação de sêmen bubalino. Na criopreservação de sêmen de búfalo a composição do diluidor constitui um dos principais fatores que influenciam os resultados pós-descongelação (DHAMI et al., 1996).
73±2,11% e 82±15,55%. Às 96 horas só observaram motilidades nos diluidores leite desnatado-gema de ovo; Ácido cítrico-soro de leite e Ácido cítrico-soro de leite-glicerol 7%, com motilidades apresentando 60±1,82%; 52±4,9% e 62±17,11%, respectivamente. De acordo com os autores, em 144 horas de incubação apenas foi observado motilidade no Ácido cítrico-soro de leite de 30±14,2% e Ácido cítrico-soro de leite-glicerol 7% de 50±3,07%.
Bhosrekar e Ganguli (1976) criopreservando sêmen de oito búfalos da raça Murrah, com diluidores a base de Ácido cítrico-soro de leite, leite desnatado-gema de ovo e bicarbonato de sódio-glicose-frutose-gema de ovo observaram motilidade antes e após o armazenamento a uma temperatura de 5-7°C nos tempos 0, 96 e 144 horas. Segundo os autores, nos diluidores (Ácido cítrico-soro de leite, leite desnatado-gema de ovo e bicarbonato de sódio-glicose-frutose-gema de ovo) observaram motilidades apenas às 0 e 96 horas, com 85% e 58%; 78% e 43% e 77% e 28%, respectivamente. Os autores verificaram que apenas quando foi suplementado com frutose e um outro grupo contendo Glicerol ao diluidor Ácido cítrico-soro de leite observaram motilidade às 144 horas, com valores de 40 e 50%, respectivamente.
Avenell (1982) para preservar sêmen bubalino utilizou diluidor a base de lactose com e sem a remoção do plasma seminal. O autor observou que o sêmen diluído com motilidades pré-congelação de 60-70% mostraram motilidade de 60% e 40-50% após a descongelação a 4°C por 5 e 180 minutos, respectivamente.
Em experimento realizado por Vale et al. (1984), utilizando diluidores a base de Gema-Citrato ou Leite Desnatado, a motilidade pós-descongelação ficou próxima aos 20%, e quando a Lactose foi utilizada, a motilidade aumentou e ficou em torno de 30%. De acordo com os autores, melhores resultados foram obtidos com diluidor a base de TES-TRIS, com uma motilidade espermática de pós-descongelação sempre superior a 40% e vigor de 3%.
tempo sobre a motilidade às 0, 2, 4, 6, 8 ,10 e 12 horas, e observaram as motilidades de 44%, 44%, 42%, 37%, 34%, 7% e 4%, respectivamente.
Ahmad (1984) a partir de 18 ejaculados de três búfalos Nili-Ravi, diluiu em Lactose-fructose-gema de ovo-glicerol, testando a eficiência do tempo e a temperatura na pós-descongelação do sêmen, sendo que com 37°C por 15 segundos, observou motilidade de 40±1,43% e 75°C por 9 segundo, motilidades de 50±0,99%.
Haranath et al. (1990) diluindo sêmen de seis búfalos em TRIS-gema de ovo e glicerol, congelados em nitrogênio líquido, armazenados por 24 horas, e descongelados a 37°C por 30 segundos, observaram motilidade média em sêmen fresco de 81,8% e após descongelação em palhetas de 0,25 e 0,5 mL, motilidades de 56,4±0,86 e 55,64±0,86%, respectivamente.
Amstalden et al. (1993), obtiveram médias de motilidade espermática com sêmen in natura de 65,5±18,3% e percentual de espermatozóides vivos e de patologias espermáticas de 67,03±17,25% e 23,60±20,56%, respectivamente.
Ohashi (1993) congelando sêmen bubalino, com diluidores a base de Citrato-Leite e Lactose obteve motilidades pós-descongelação abaixo de 20% e 30%, respectivamente.
Oba et al. (1993), encontraram motilidade pós-descongelação para sêmen bubalino de 67,5±5% para o diluidor glicina-gema, 60±14,1% para TES e 41,2±17,5% para TRIS.
Baliero (1993) obteve motilidade do sêmen in natura de touros bubalino de 85,78±5,97%. E assim, testou o uso dos diluidores a base de TRIS, TES e Citrato, numa congelação com tempo de equilíbrio de sete horas. Observou motilidade pós-decongelação de 52,7%, 50,5% e 39,9%, respectivamente. Concluiu que o diluidor TES apresentava uma boa capacidade de proteção das células espermáticas contra injúrias no processo de congelação em relação a outros diluidores, e que esta proteção se deve a presença da lactose.
Misra et al. (1994) conseguiram obter em sêmen bubalino, em diluidor TRIS, motilidade pós-descongelação de 60,8%.
Barnabe et al. (1994), após congelação-descongelação do sêmen bubalino com uso de diluentes à base de TES-TRIS e TRIS-gema observaram motilidades progressiva média inicial do sêmen in natura de 75% e, após descongelação com diluidor à base de TES-TRIS, de 52,5%. Após três horas de incubação a 37ºC, a motilidade passou a ser de 40% no diluidor TES-TRIS, por outro lado o TRIS-gema, em similares condições, permaneceu entre 20 e 30%.
Dhami et al. (1996) realizaram experimento para determinar a eficácia de dois diluentes (TRIS e Leite), na criopreservação de sêmen em três búfalos da raça Murrah. Observaram que as motilidade pós-descongelação foram significativamente mais elevadas (p<0,01) após 2 horas de resfriamento em comparação à 1 hora de resfriamento (63,4% vs 59,5%). Para os autores, ambos os diluentes TRIS e Leite foram igualmente eficazes quando se comparou as motilidades pós-descongelação.
Chacur (1996) testando os tempos de equilíbrio de 1, 2, 3, e 4 horas em touros bubalino da raça Murrah, entre 5 e 12 anos de idade, não observou diferença no vigor e na motilidade espermática quando utilizou os diluentes TES, Glicina-Gema e Triladyl, como também não encontrou diferença na manutenção da integridade acrossômica para o meio TES na pós-descongelação, e assim chegando a conclusão que estes diluidores são adequados para criopreservação do sêmen bubalino. Segundo o mesmo autor, utilizando um tempo de equilíbrio de três horas reportou valores de motilidade pós-descongelação de 65,5% no TES e 61,5% no TRIS.
Nahúm (2000) congelando sêmen bubalino utilizando diluidor TES obteve 52% de motilidade pós-descongelação. Ao congelar com água de coco obteve motilidade média pós-descongelação de 46%, 7,15% de defeitos de acrossoma e 3,38% de defeitos de cauda, comprovando ser um bom diluidor para criopreservação de sêmen de búfalo.
Rasul et al. (2000) utilizaram diluidor TES-TRIS em sêmen bubalino e observaram, após a descongelação, valores de 59% de motilidade progressiva, 53,2% de integridade de acrossoma e 41,4% de integridade de membrana plasmática.
pós-descongelação a motilidade no CEBRAN II foi de 55±15,67% não significativamente diferente (p<0,2) aquela demonstrada pelo diluidor TES 57,5±10,55%, embora o vigor no diluidor TES (2,75±0,62) tenha sido superior (p<0,01) ao 2,08±0,05 no diluidor CEBRAN II.
Mota (2005) estudou o efeito de uma pré-lavagem dos espermatozóides anterior ao processo de congelação, em gradientes de Percoll. O diluidor utilizado na criopreservação do sêmen bubalino foi o diluidor TES. As médias de vigor espermático foram de 3±0,8; 2,3±1,10 e 1,3±1,40 respectivas para o sêmen a fresco, controle (diluidor TES) e tratado (pré-lavagem+diluidor TES), sendo que o sêmen a fresco não diferiu do grupo controle (p>0,05). As médias de motilidade espermática foram de 57,3±18,6% para o sêmen fresco, 20±17,30% para o controle e 17,30±25,5% para o tratado. As médias das motilidades do grupo controle e tratado não diferiram quando comparado ao sêmen a fresco (p>0,05), porém diferiram entre si (p<0,05). O sêmen teve médias respectivas para os grupos a fresco, controle e tratado, de percentuais de patologias de cauda fortemente dobrada de 23,1±30,4%; 29,2±21,5% e 17,8±23,9%, cauda dobrada de 9,8±6,6%; 7,82±13%, 5,64±4% e defeitos de peça intermediária de 9,8±6,6%; 7,82±13%, 5,64±4% (MOTA, 2005).
Siddique et al. (2006) a partir de dois touros bubalino Nili-Ravi, preservaram dezesseis amostras de sêmen em nitrogênio líquido a -196°C por 24 horas, a fim de estudarem o efeito de cinco diluidores na motilidade pós-descongelação.
Sendo que, todos os cinco diluidores continham 0,25mg de Frutose, 0,25mg de Glicose, 1mg de Lactose, 100000mg/unidade de Penicilina, 100mg/mL Streptomicina, 7mL de Glicerol, 20mL de gema de ovo e 100mL de água destilada. O que diferiam em cada diluidores era o seguinte: diluidor A (2,4mg de TRIS e 1,4mg de ácido cítrico), B (1,82mg de TRIS, 1mg de ácido cítrico e 0,52mg de citrato de sódio), C (1,21mg de TRIS, 0,67mg de ácido cítrico e 1,04mg de citrato de sódio), D (0,6mg de TRIS, 0,34mg de ácido cítrico e 1,56mg de citrato de sódio) e E (2,08mg de citrato de sódio). Os valores médios de pós-descongelação para o percentual de motilidade foram 45,9±5,2; 38,1±5,2; 50,0±6,4; 41,9±7,9 e 40,9±6,3 para os diluidores A, B, C, D e E, respectivamente (SIDDIQUE et al., 2006).
de 24 ejaculados de um total de quatro touros bubalinos. O percentual de motilidade espermática do sêmen in natura foi de 89,86±0,64%. O percentual de motilidade espermática pós-desongelação foi significativamente maior (p<0,01) em TRIS-Ácido cítrico-frutose-glicerol (71,56±1,21%) e em Universidade Cornell gema de ovo-glicerol (67,56±1,01%) que no diluidor Minnesota-gema de ovo-glicerol (39,15±2,27%) e Illinoise-temperatura variável-gema de ovo-glicerol (34,41%±3,01%). Segundo os autores, houve diferença entre os dois primeiros e entre estes dois últimos, entretanto a diferença não foi significativa (p>0,05). A porcentagem de danos acrossomas foi significativamente maior (p<0,05) em Illinoise-temperatura variável-gema de ovo-glicerol (25,41±1,55%) que em TRIS-Ácido cítrico-frutose-ovo-glicerol (14,66±1,1%) e Universidade Cornell-gema de ovo-glicerol (15,02±1,05%), porém a diferença entre o diluidor Minnesota-gema de ovo-glicerol (20,55±1,54%) e Illinoise-temperatura variável-gema de ovo-glicerol (25,41±1,55%), não foi significativa (p>0,05).
Singh et al. (2007) utilizaram espermatozóides obtidos a partir da punção do epidídimo de búfalos oriundos de matadouros. Foi feita a congelação em diluidor a base TRIS-ácido cítrico-frutose sem (Grupo I) e com heparina (Grupo II) na concentração de
80 µg/mL. A motilidade espermática, a viabilidade espermática e a integridade do
acrossoma na fase pré-congelação, no grupo I, foi de 71,7±1,14%; 83,6±0,95% e 80,2±1,08%, respectivamente, já na fase de pós-descongelação foi de 52,3±1,35%; 67,9±0,95% e 71,8±1,08%, respectivamente. No grupo II, a motilidade espermática, a viabilidade espermática e a integridade do acrossoma, na fase pré-congelação, foi de 73,2±0,98%; 83,7±1,08% e 80,2±1,11%, respectivamente e na fase de pós-congelação foi de 14,7±0,67%; 25,7±0,73% e 24,8±1,25%, respectivamente. Houve variação significativa (p<0,05) entre os tratamentos observados apenas na fase pós-descongelação.
Fatih et al. (2010) estudaram o efeito de diferentes níveis de gema de ovo (20, 15 e 10%) em diluidor a base de TRIS na qualidade de sêmen de búfalo Kundhi na pós-descongelação. Observou-se que em todos os ejaculados a cor e aspecto foram branco cremoso, apresentando volume médio, pH, turbilhonamento, concentração espermática e motilidade espermática de 2,95±0,07mL, 6,63±7,30, 3,64±0,05%, 1283,7±12,12 x106/mL e 80,05±3,79%, respectivamente. O efeito de diferentes níveis de gema de ovo nos diluentes indicou que 15% de gema de ovo resultou em aumento significativo (p<0,05) dos parâmetros pós-descongelação para motilidade e integridade de membrana plasmática. Os parâmetros motilidade e integridade de membrana plasmática para gema de ovo a 15% foram 45,71±0,61% e 31,5±0,82%, respectivamente. No entanto, segundo os autores houve diferença significativa (p<0,05) entre os tratamentos gema de ovo com 20% e 10%, sobre os parâmetros motilidade espermática e integridade de membrana plasmática na fase descongelação. A motilidade espermática pós-descongelação com 20% de gema de ovo foi de 39,83±0,64%, e integridade de membrana plasmática 23,56±0,91%. Já com 10% foram 36,89±0,62% e 18,78±0,72%, respectivamente.
Singh (2010) obteve motilidade progressiva de 48,1±1,9%, integridade de acrossoma de 17,6±1,0% e espermatozóides vivos de 61,7±1,7%, após descongelação de doses de sêmen em temperatura a 40ºC por 14 segundos, proveniente do sêmen de quatro búfalos da raça Murrah diluídos em meio à base de TRIS.
Ansari et al. (2010), congelando sêmen de 5 touros adultos Nili-Ravi (Bubalus bubalis), utilizando o diluidor TRIS-Ácido Cítrico suplementado com diferentes concentrações de glutationa exógenas (0,5mM GSH,1,0 mM GSH, 2,0 mM GSH e 3,0 mM GSH), avaliaram os parâmetros motilidade espermática, viabilidade e integridade da membrana plasmática à 0, 3 e 6 horas após a descongelação, obtiveram resultados mais favoráveis com concentrações de até 2,0 mM de GSH, com percentuais de motilidade progressiva à 0, 3 e 6 horas de 56,7%; 41,7%; 28,3% X 40%, 20%, 10% grupo controle, viabilidade espermática de 89%; 75,3%; 59,3% X 70%, 50%, 30% grupo controle e integridade da membrana plasmática de 88,7%; 70,3%; 58,7% X 70%, 50%, 30% grupo controle, às 0, 3 e 6, respectivamente.
44,6±19,9% (TES-TRIS + Pentoxifilina) e 46,9±19,0% (TES-TRIS + Vitamina C + Pentoxifilina), observando variações numéricas entre os tratamentos (p<0,05). Também observou vigor de 3,8±0,6 na fase de pré-congelação e pós-congelação de 2,4±0,6 (TES-TRIS), 2,6±0,6 (Vitamina C), 3,1±0,6 (Pentoxifilina) e 3,1±0,6 (Vitamina C + Pentoxifilina). O percentual de células com membrana íntegra na fase de pré-congelação foi de 85,4±8,3%, sendo que na fase pós-descongelação, os valores observados foram de 62,2±15,9% (TES-TRIS), 63,5±13,3% (Vitamina C), 57,9±15,7% (Pentoxifilina) e 57,6±15,9% (Vitamina C + Pentoxifilina) (p>0,05). A integridade de membrana plasmática analisada pelo teste hiposmótico (HOS) na fase pré-congelação foi de 73,1±10,5%. Na fase de pós-descongelação, os dados apresentaram variação numérica entre os tratamentos (p<0,05), com 87,0±6,8% de células com membranas íntegras para o grupo controle, 85,3±7,6% para Vitamina C, 85,8±7,0% para Pentoxifilina e 86,7±6,2% para Vitamina C + Pentoxifilina.
Akhter et al. (2010a) conseguiram observar percentual de motilidade espermática de touros bubalinos pós-descongelação de (45,3±1,1%, 45±1,4%), viabilidade espermática (66,2±1,1%, 64,4±1,3%) integridade de membrana plasmática (60,4±1,2%, 59,2±1,4%) e integridade de acrossoma (82,9±0,5%, 80,7±0,5%) em TRIS-Ácido cítrico-gema de ovo e diluidor Bioxcell®, respectivamente. Não sendo observada diferença estatística entre os tratamentos (p>0,05). Patologia de cabeça (1,2±0,1%, 1,2±0,1%), peça intermediária (0,67±0,1%, 0,87±0,1%) e cauda (11,7±0,2%, 11,6±0,3%) em TRIS-Ácido cítrico-gema de ovo e diluidor Bioxcell®, respectivamente, não sendo também observada diferença estatítica entre tratamentos (p>0,05).