Universidade Federal do Pará
Núcleo de Ciências Agrárias e Desenvolvimento Rural
Empresa Brasileira de Pesquisa Agropecuária - Amazônia Oriental Universidade Federal Rural da Amazônia
Programa de Pós-Graduação em Ciência Animal
Karol Guimarães Oliveira
ATIVAÇÃO ESPERMÁTICA E CRIOPRESERVAÇÃO DO
SÊMEN DE MACACO-PREGO (
Cebus apella
)
EM
DILUIDORES À BASE DE ÁGUA DE COCO
IN NATURA
E
TES-TRIS
Karol Guimarães Oliveira
ATIVAÇÃO ESPERMÁTICA E CRIOPRESERVAÇÃO DO
SÊMEN DE MACACO-PREGO (
Cebus apella
)
EM
DILUIDORES À BASE DE ÁGUA DE COCO
IN NATURA
E
TES-TRIS
Dissertação apresentada para obtenção do grau de Mestre em Ciência Animal. Programa de Pós-Graduação em Ciência Animal. Núcleo de Ciências Agrárias e Desenvolvimento Rural. Universidade Federal do Pará. Empresa Brasileira de Pesquisa Agropecuária – Amazônia Oriental. Universidade Federal Rural da Amazônia.
Área de concentração: Produção Animal.
Orientador Profa. Dra. Sheyla Farhayldes S. Domingues
Karol Guimarães Oliveira
ATIVAÇÃO ESPERMÁTICA E CRIOPRESERVAÇÃO DO
SÊMEN DE MACACO-PREGO (
Cebus apella
)
EM
DILUIDORES À BASE DE ÁGUA DE COCO
IN NATURA
E
TES-TRIS
Dissertação apresentada para obtenção do grau de Mestre em Ciência Animal. Programa de Pós-Graduação em Ciência Animal. Núcleo de Ciências Agrárias e Desenvolvimento Rural. Universidade Federal do Pará. Empresa Brasileira de Pesquisa Agropecuária – Amazônia Oriental. Universidade Federal Rural da Amazônia.
Área de concentração: Produção Animal.
Data da aprovação. Belém - PA: ______/_______/_______
Banca Examinadora
______________________________________ Profa. Dra. Sheyla Farhayldes S. Domingues Universidade Federal do Pará - UFPA
_______________________________________ Dr. John Patrick Kastelic
Agriculture and Agri-Food Canada, Lethbridge, Alberta, Canada
AGRADECIMENTOS
A DEUS, por permitir que eu chegasse até aqui e nunca me abandonar, dando-me força nos momentos difíceis.
À minha mãe Eleonora, por sempre pensar em nós em primeiro lugar e na nossa felicidade acima de tudo. Por me apoiar incondicionalmente, me ouvir e sempre ter uma palavra de consolo nos meus momentos de aflição. Por orar por mim e pelo seu amor.
À minha família, que mesmo longe, se faz presente com seu ilimitado apoio e incentivo. E por me fazer sentir importante a cada demonstração de carinho.
À Profa. Dra. Sheyla Farhayldes Souza Domingues pelo seu comprometimento e seriedade que muito contribuíram para a realização deste trabalho. E ainda, por estar sempre disposta a ajudar e superar qualquer obstáculo.
À Dra. Regiane Rodrigues dos Santos, pela valiosa contribuição durante o desenvolvimento do artigo dessa dissertação.
Ao Dr. José Augusto Pereira Carneiro Muniz, pelo auxílio na obtenção do material necessário para a realização desse trabalho.
Ao Prof. Dr. Otávio Mitio Ohashi e Marcela Cordeiro do Laboratório de FIV-UFPA pelos conhecimentos repassados e pela ajuda no preparo dos diluidores.
Aos amigos do Laboratório de Biologia e Medicina de Animais Silvestres da Amazônia (BIOMEDAM-UFPA). Em especial àqueles que incansavelmente me acompanharam durante a realização dos experimentos: Gustavo Sales, Danuza Leão, Stefânia Miranda, Adriel Brito, Débora Almeida.
Aos funcionários do Centro Nacional de Primatas, especialmente: Sarah Scalercio Dra. Aline Imbelone, Dra. Gilmara Abreu, D. Laura Ferro, D. Rosa, Obadias, Léo, Melânia, D. Socorro e aos técnicos Sr. Oswaldo, Sr. Viana, Sr. Alfredo pelo apoio e por estarem sempre dispostos a ajudar.
Ao Rodrigo Rodrigues, amigo e funcionário do PPGCA, pela paciência e profissionalismo.
Aos meus amigos, pelos diversos momentos de alegria e com os quais eu posso sempre contar: Nilton Jr. Rascon, Taty, Rose, Sherlem, Danyzinha, Ramon, Suzanne, Cristina, Dani, Shirley, Rayanne, Danigata, Natália e Cleber.
Aos animais experimentais, que mesmo sem saber, contribuíram de forma valiosa.
À CAPES, pela concessão da bolsa e ao CNPq pelo apoio financeiro.
À UFPA e ao Programa de Pós-Graduação em Ciência Animal.
“O Senhor é o meu pastor e nada me faltará.”
RESUMO
A espécie Cebus apella (macaco-prego) é amplamente utilizada como modelo experimental na pesquisa biomédica. Entretanto, são escassos os estudos dedicados a avaliar o sêmen desses animais, que é composto por uma fração líquida e uma coagulada de difícil manipulação e alta concentração de espermatozóides imóveis. Portanto, objetivou-se I) avaliar o efeito de duas concentrações de cafeína (6 e 10 mM/mL) diluídas em TES-TRIS e água de coco in natura (ACIN) na ativação de espermatozóides de C. apella e II) testar um protocolo de criopreservação do sêmen comparando dois diluidores (TES-TRIS e ACIN) acrescidos de gema de ovo e glicerol. O sêmen de seis animais mantidos no Centro Nacional de Primatas foi coletado por eletroejaculação, diluído na fração-A de TES-TRIS ou ACIN, e incubado a 35°C até dissolução do coágulo seminal. O tempo de liquefação foi comparado. Posteriormente foi mensurado volume, concentração, morfologia espermática e percentual de espermatozóides vivos. No experimento I as amostras foram diluídas em TES-TRIS ou ACIN acrescidos de 6 e 10 mM de cafeína após o término da motilidade durante a liquefação e mantidas a 35°C. Motilidade e vigor foram avaliados por 5 h. Para o experimento II, após liquefação, o sêmen foi diluído na fração-B (fração-A + gema de ovo e glicerol) dos diluidores, envasado, resfriado a 4°C (2 h), em seguida a -60°C (20 min), antes de ser mergulhado em nitrogênio líquido. O sêmen foi descongelado a 35°C (5 min). Os resultados foram expressos como média ± EP. O efeito dos diluidores foi comparado pelo teste t Student e ANOVA (p 0,05). O coágulo liquefez em 4,5 ± 1,7 e 2,8 ± 1,1 horas (p < 0,05) em TES-TRIS e ACIN respectivamente. O volume médio, concentração, percentual de espermatozóides normais e vivos antes de congelação foi respectivamente 0,6 ± 0,2 mL; 1.806 ± 367 x 106 espermatozóides/mL; 81,3 ± 2, e 40,1 ± 3,3 (TES-TRIS) e 30,9 ± 4 (ACIN). A duração da motilidade em TES-TRIS e ACIN foi, respectivamente, 5 ± 1,4 e 1 ± 0,5 h. A motilidade média nesse período foi 38 ± 10% (TES-TRIS) e 18 ± 9% (ACIN). Foi verificado aumento da motilidade após adição de cafeína apenas nas amostras diluídas em ACIN 6 mM (21 ± 9%) e ACIN 10 mM (22 ± 11) (p > 0,05). O percentual de espermatozóides vivos após descongelação foi 26,2% em TES-TRIS e 13,2% em ACIN (p < 0,05).Para a criopreservação de sêmen de C. apella TES-TRIS é mais indicado e pode, assim como ACIN + cafeína, ser empregado na inseminação artificial com sêmen a fresco diluído.
ABSTRACT
The species Cebus apella (capuchin monkey) is an important experimental model used in biomedical research. However, there are few reports regarding their semen, which is composed by both liquid and coagulated fractions, difficult to handle and containing a high proportion of immobile spermatozoa. Thereafter, the aims of this study were to: I) evaluate the effect of two caffeine concentrations (6 and 10 mM/mL) diluted in TES-TRIS and coconut water solution (CWS) on the activation of C. apella spermatozoa and; II) test and compare two extenders for semen cryopreservation (TES-TRIS and CWS plus egg yolk and glycerol). Semen from six males maintained at the National Primate Center was collected by electroejaculation, diluted in A-fraction of TES-TRIS or CWS, and incubated at 35 °C until coagulum liquefaction. In Experiment I, the samples were diluted in TES-TRIS or CWS plus 6 and 10 mM caffeine after stopped motility during liquefaction and maintained at 35 °C. Motility and vigor were evaluated for 5 h. In Experiment II, after liquefaction, semen was diluted in B-fraction (A-fraction + egg yolk and glycerol) of the extenders, packed, cooled to 4 °C (2 h), then to -60 °C (20 min), before being plunged into liquid nitrogen. Semen was thawed at 35 °C (5 min). The results were expressed as mean ± SEM. The seminal coagulum liquefied in 4.5 ± 1.7 and 2.8 ± 1.1 hours in TES-TRIS and CWS, respectively. Volume, concentration, percentage of normal and live sperm before freezing were, respectively, 0.6 ± 0.2 mL; 1806 ± 367 x 106 spermatozoa/mL; 81.3 ± 2, and 40.1 ± 3.3 (TES-TRIS) and 30.9 ± 4 (CWS). For TES-TRIS and CWS, the duration of sperm motility was 5 ± 1.4 and 1 ± 0.5 hours and mean motility was 38 ± 10% and 18 ± 9%, respectively. Motility increased after caffeine addition only in samples diluted in CWS 6 mM (21 ± 9%) and CWS 10 mM (22 ± 11) (p > 0.05). Post-thaw live sperm percentage was 26.2 in TES-TRIS and 13.2 in CWS (p < 0.05). For cryopreservation of semen from C. apella TES-TRIS was more appropriate than CWS. However, TES-TRIS and CWS + caffeine potentially may be useful in artificial insemination of fresh diluted semen.
SUMÁRIO
1 INTRODUÇÃO ... 10
2 OBJETIVOS ... 12
2.1 OBJETIVOS GERAIS ... ... 12 2.2 OBJETIVOS ESPECÍFICOS ... 12
3 REVISÃO DE LITERATURA ... 13
3.1 OS PRIMATAS ... 13
3.2 A ESPÉCIE Cebus apella ... 14
3.2.1 O sêmen de C. apella .... 16
3.3 O COÁGULO SEMINAL ... 17
3.4 MÉTODOS DE COLETA ... 18
3.5 CRIOPRESERVAÇÃO DE SÊMEN DE PRIMATAS ... 20
3.5.1 Meio diluidor e seus componentes ... 21
3.5.1.1 Crioprotetores ... 22
3.5.1.2 Antibióticos ... 23
3.5.1.3 TES-TRIS ... 24
3.5.1.4 Água de coco ... 24
3.6 ATIVAÇÃO ESPERMÁTICA... 25
4 LIQUEFAÇÃO DO COÁGULO SEMINAL, ATIVAÇÃO ESPERMÁTICAE CRIOPRESERVAÇÃO DO SÊMEN DE MACACO-PREGO (Cebus apella) EM ÁGUA DE COCO IN NATURA (ACIN) E TES-TRIS... 27
5 CONCLUSÃO GERAL... 44 REFERÊNCIAS... .
1. INTRODUÇÃO
A biodiversidade mundial, particularmente em regiões tropicais como o Brasil, está agora mais ameaçada do que em qualquer outro período histórico (IUCN, 2008) e sua conservação é um dos principais desafios que precisam ser atingidos para preservar a vida de animais em risco de extinção (CHEN et al., 2004).
A conservação da variabilidade genética de animais silvestres pode ser garantida com sua proteção em seus habitats naturais (in situ), pela manutenção das condições adequadas em cativeiro, em criatórios conservacionistas ou de pesquisa (ex situ), bem como pela formação de bancos de germoplasma, na qual gametas e células somáticas podem ser utilizados em programas de biotecnologia de reprodução. A conservação in situ consiste em uma das mais eficazes estratégias de conservação. Entretanto, é necessário considerar que a perda da variabilidade genética vem ocorrendo de forma acelerada, provocada principalmente pela fragmentação de habitats em decorrência de ações antrópicas como o desmatamento. Por isso, é de suma importância lançar mão de técnicas para recuperar e preservar o potencial genético de animais mesmo após a sua morte, através da conservação ex situ, que pode complementar programas de conservação in situ (DOMINGUES; CALDAS-BUSSIERE, 2006).
No Brasil, existem 26 espécies de primatas neotropicais ameaçadas de extinção (IBAMA, 1989), distribuídos nas famílias Atelidae, Pitheciidae e Cebidae. A essa última família pertence à espécie Cebus apella, que não se encontra ameaçada e é um excelente modelo experimental para o estudo da fisiologia da reprodução, como a biologia do oócito, a espermatogênese (LEÃO et al., 2008) e para o desenvolvimento de biotecnologias a serviço das espécies em extinção (DOMINGUES; CALDAS-BUSSIERE, 2006).
homens com injúria no cordão espinhal, possuindo as vantagens de ter boa aceitação clínica por não requerer cirurgia, além de permitir que até 90% do sêmen obtido permaneça com seu DNA intacto, sugerindo não ser uma técnica destrutiva para o espermatozóide (SØNKSEN; OHL, 2002).
Algumas técnicas de dissolução do coágulo seminal de C. apella foram descritas, e substâncias naturais como a água de coco in natura constituem alternativas para sua liquefação e diluição (ARAÚJO et al., 2009), além de apresentar potencial para ser empregada também na criopreservação do sêmen dessa espécie, já que proporcionou excelentes resultados para outros grupos animais (SALLES, 1989; TONIOLLI, 1989a; CRUZ, 1994; MONTEZUMA JÚNIOR; VIANA NETO; NUNES, 1994; CARDOSO et al., 2003; CARDOSO; SILVA; SILVA, 2006). Contudo, é imprescindível comparar sua atuação com a de outros diluidores cuja composição e mecanismos de ação sejam bem definidos, como o TRIS e o TES, amplamente utilizados para diversas espécies.
2. OBJETIVOS
2.1. OBJETIVOS GERAIS
• Avaliar a espécie Cebus apella como modelo experimental para outros primatas neotropicais importantes para a pesquisa biomédica e/ou ameaçados de extinção;
• Desenvolver e aprimorar a tecnologia do sêmen para a espécie Cebus apella.
2.2. OBJETIVOS ESPECÍFICOS
• Analisar as características físico-químicas dos ejaculados;
• Comparar a eficiência da liquefação do coágulo seminal em diluentes à base de TES-TRIS e ACIN;
• Investigar a influência do coágulo seminal sobre os espermatozóides inclusos nessa porção;
• Avaliar o efeito de duas concentrações de cafeína (6 e 10 mM/mL) diluídas em TES-TRIS e ACIN na ativação espermática após liquefação do coágulo seminal;
3. REVISÃO DE LITERATURA
3.1. OS PRIMATAS
Devido a sua similaridade filogenética com a espécie Homo sapiens (ABEE, 2003; WOLF et al., 2004), os primatas não-humanos se tornaram importantes modelos experimentais utilizados na pesquisa biomédica (WRIGHT; BUSH, 1977; AURICCHIO, 1995). Estes animais são geralmente os melhores ou, às vezes, os únicos modelos para estudar determinadas doenças em humanos, bem como para elaboração de estratégias de prevenção e terapias (ABEE, 2003), além de serem importantes na realização de diversas pesquisas em reprodução relacionadas à saúde humana (ABBOTT et al., 2004).
Os primatas atuais seguem a seguinte classificação taxonômica segundo Wilson e Reeder (2005):
Ordem Primates
• Subordem Strepsirrhini
o Infra-ordem Lemuriformes (lêmures) o Infra-ordem Chiromyiformes (ai-ai) o Infra-ordem Lorisiformes (lóris, gálagos)
• Subordem Haplorrhini
o Infra-ordem Tarsiiformes (társios) o Infra-ordem Simiiformes
Parvordem Platyrrhini (macacos do Novo Mundo) Parvordem Catarrhini (macacos do Velho Mundo)
3.2. A ESPÉCIE Cebus apella
Cebus apella é um platirrino pertencente à Superfamília Ceboidea, Família Cebidae, Subfamília Cebinae, Tribo Cebini e Gênero Cebus (GOODMAN, 1996), tendo ampla distribuição geográfica: Colômbia, Equador, Peru, Bolívia, Brasil, Guianas, Suriname e Venezuela (FRAGASZY et al., 2004) (Figura 1).
Eles são animais de porte médio, sendo que os machos têm o corpo 34% maior que o das fêmeas e pesam em média 2,5 kg quando alcançam a maturidade sexual, por volta dos 7 anos de idade (NAGLE; DENARI, 1983). Têm um sistema poligâmico de acasalamento e as fêmeas reproduzem-se referencialmente com o macho dominante. (EMMONS, 1990; ROWE, 1996). A gestação ocorre 1 vez ao ano e dura entre 150 e 160 dias, com uma única cria (gêmeos são raros) que nasce com cerca de 260 g. Possuem cauda semi-preênsil e
alimentam-Fig. 1:Distribuição de espécie C. apella.
se de frutos, nozes, sementes, flores, insetos, ovos e pequenos vertebrados. Vivem em bandos de 18 a 27 indivíduos (ROWE, 1996). Uma de suas características mais marcantes é a presença de tufos pretos no alto da cabeça e a coloração mais escura da pelagem dos membros e cauda (NOWAK, 1991) (Figura 2).
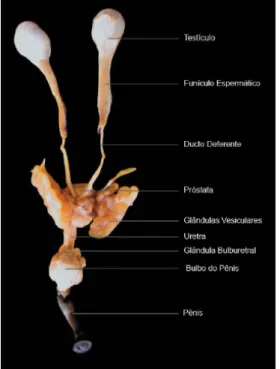
O sistema reprodutor do macho de C. apella é constituído por dois testículos, dois epidídimos, dois ductos deferentes, duas vesículas seminais, próstata, duas glândulas bulbo-uretrais (TEIXEIRA, 2005), um pênis dotado de um vestígio de osso peniano (báculo) e uma glande muito desenvolvida em formato de prego, sendo por isso conhecido vulgarmente como “macaco-prego” (NAPIER; NAPIER, 1986) (Figura 3).
Fig. 2: Exemplar macho da espécie Cebus apella. Fonte: Animal Park Zoo.
3.2.1. O sêmen de C. apella
As glândulas acessórias de C. apella têm forma e função semelhantes às encontradas em humanos. A vesícula seminal possui várias funções, dentre elas a mais importante é a produção do líquido seminal, que é rico em frutose e proteínas, e serve como transporte aos espermatozóides durante a ejaculação (TEIXEIRA, 2005).
O ejaculado dessa espécie é constituído por duas porções: a primeira é uma fração líquida, transparente e viscosa, enquanto que a segunda é mais volumosa, opaca e consistente, formando um coágulo seminal (Figura 4). Os valores máximos dos parâmetros espermáticos citados na literatura para a fração líquida são: 71% de motilidade espermática; 3,5 de vigor; pH 7,5 (PAZ, 2006); volume 1,9 ml e concentração 2,1 x 108 SPTZ/ml (ARAÚJO et al., 2009). Poucas pesquisas se propõem a estudar a fração coagulada, sendo os melhores resultados relatados por Araújo et al. (2009): volume 0,98 ml e concentração 1,6 x 109 SPTZ/ml. Entretanto, esses valores podem ser influenciados por variáveis como o período de abstinência sexual, a fração seminal analisada, o método de coleta de sêmen, o anestésico utilizado para contenção química do animal, o stress a que ele está submetido nas condições de cativeiro, dentre outras (THOMSON et al., 1992).
3.3. O COÁGULO SEMINAL
A formação do coágulo seminal deve-se à reação entre as secreções provenientes do lobo cranial da próstata e da vesícula seminal (AMBOKA; MWETHERA, 2003). O coágulo formado tende a absorver grande número de espermatozóides do ejaculado, justificando a sua alta concentração espermática em relação à fração líquida (HERNÁNDEZ-LÓPEZ; CERDA-MOLINA; MONDRAGÓN-CEBALLOS, 2008). Dixson e Anderson (2002) denominam este sêmen com aspecto gelatinoso firme de “plug copulatório”. Segundo esses autores, ele se molda no contorno da vagina da fêmea após a cópula atuando como uma barreira que impede a inseminação por outros machos, agindo como um mecanismo de seleção sexual. O coágulo pode assumir diferentes consistências conforme o tipo de acasalamento da espécie, sendo assim, em regimes monogâmicos ou poligínios, ambos em que a fêmea tem somente um parceiro sexual, o plug tende a ser menos consistente ou até mesmo ausente, em contraste com regimes poligâmicos (quando não há o estabelecimento de casais) em que atinge consistência quase sólida. O plug ou coágulo seminal também pode servir como um veículo dos espermatozóides para o interior da cérvix da fêmea, constituindo uma barreira física e química, pois apresenta pH alcalino, aumentando o índice de sobrevivência dos espermatozóides no meio ácido vaginal.
Várias espécies de primatas do Velho e Novo Mundo formam plug copulatório. Hernández-López et al. (2008), analisando o ejaculado de Ateles geoffroyi durante duas épocas do ano, verificaram aumento do volume de coágulo seminal durante as estações secas em relação às chuvosas. Há evidências de que a produção desse coágulo seja um processo que exija algum gasto energético pelo macho, pois ela é consideravelmente maior quando as fêmeas encontram-se mais receptivas ao coito (HERNÁNDEZ-LÓPEZ; CERDA-MOLINA; MONDRAGÓN-CEBALLOS, 2008). Entretanto, ainda inexistem estudos suficientes para elucidar o processo de produção do coágulo seminal entre as espécies de primatas. (DIXSON; ANDERSON, 2002).
pronase e quimotripsina para Callithrix jacchus (sagüi) (MORRELL; HODGES, 1998) ou com soluções contendo tripsina ou tripsina e hialuronidase para A. geoffroyi (macaco-aranha) embora estas enzimas afetem a motilidade e o vigor espermático, além de não desfazerem totalmente o coágulo (HERNÁNDEZ-LÓPEZ et al., 2002).
Algumas técnicas para dissolução do coágulo seminal de C. apella foram descritas. Paz et al. (2006) utilizaram meio TCM 199 acrescido das enzimas tripsina e hialuronidase e observaram que em ambos os casos houve uma redução significativa da motilidade e do vigor espermático em comparação à fração líquida de acordo com o tempo de exposição, além de não promoverem a completa dissolução do coágulo. Alguns protocolos sugerem sua dissolução sem o uso de enzimas proteolíticas, utilizando apenas solução salina a 0,9% (NAGLE; DENARI, 1983), diluidor a base de água de coco in natura (ARAÚJO et al., 2009), ou a base de água de coco em pó (OLIVEIRA et al., 2010), todos associados à fragmentação mecânica do coágulo com o uso de pipeta e incubação em banho-maria a 37 °C por 2 horas, quando se atingiu a completa dissolução do coágulo seminal.
3.4. MÉTODOS DE COLETA
O método de coleta de sêmen mais difundido há algumas décadas em primatas tem sido a eletroejaculação. Nos anos 60, a estimulação peniana direta foi um dos primeiros métodos utilizados e consiste na estimulação elétrica direta do pênis do animal contido em uma cadeira adaptada sem que haja necessidade do uso de sedativo, aplicável em espécies de pequeno porte como C. jacchus (KUEDERLING et al., 2000; SCHNEIDERS; SONKSEN; HODGES, 2004) e S. sciureus (YEOMAN et al., 1998). Os bons resultados alcançados com essa metodologia podem estar relacionados à melhor estimulação do trato reprodutivo por inteiro e diminuição das taxas de contaminação por urina, porém requer condicionamento adequado dos animais à cadeira de contenção, se limitando a espécies de pequeno tamanho corpóreo e fácil manipulação (contenção física) (VANDEVOORT, 2004).
artificial, quanto à masturbação, são métodos que requerem condicionamento do animal, uma vez que é necessário realizar o estímulo pelo animal (vagina artificial) ou permitir que ele o faça (masturbação). Ambos eliminam a necessidade de contenção química, diminuindo as interferências na qualidade do ejaculado (VALLE, 2002). A técnica de lavagem vaginal já foi testada em C. jacchus, fornecendo sêmen de boa qualidade (KUEDERLING; MORREL; NAYUDU, 1996; VALLE, 2002). A micropunção de cabeça e cauda de epidídimo é um método usualmente empregado em animais recém-mortos e já foi aplicada em M. fascicularis (MAHONY et al., 1996), P. troglodytes (YOUNG et al., 1994), Macaca fuscata (SANKAI et al, 1997) e C. jacchus (MORRELL et al., 1997).
Atualmente existem protocolos de coleta seminal por estimulação retal por sonda ou eletrodo para poucas espécies de primatas, dentre elas: Gorilla gorilla (SEAGER et al., 1982), Macaca nigra (THOMSON et al., 1992), Pan troglodytes (YOUNG; SMITHWICK; GOULD, 1995), Alouatta caraya (MORELAND et al., 2001), C. apella (BARNABE et al., 2002; ARAÚJO et al., 2007; 2009), A. geoffroyi (HERNÁNDEZ-LÓPEZ et al., 2002), Papio anubis (AMBOKA; MWETHERA, 2003) e Macaca fascicularis (LI et al., 2005b).
Uma vez que a maioria das espécies neotropicais não possui um protocolo definido de estímulos elétricos, a seqüência de estímulos utilizada para uma pode ser repetida para as outras correlatas. Na coleta seminal de S. sciureus foram alcançados bons resultados ao utilizar um intervalo de voltagem de 0,95-1,15 volts, obtendo tempo médio para ejaculação entre 2 e 3 minutos (LANG, 1967). Em A. geoffroyi foram aplicados estímulos de 1 volt e 10 mA até 7 volts e 100mA, aumentado 1 volt a cada 2 ou 3 tentativas sucessivas, além de estimulação manual do pênis (HERNÁNDEZ-LÓPEZ et al., 2002). Valle et al. (2004) utilizaram estímulos de 0 a 8 volts para A. caraya com aumentos subseqüentes de 0,5 volt a cada série de 30 estímulos que duravam cerca de 2 a 3 segundos com intervalo de 1 a 2 segundos.
otimizaram o processo de ejaculação, sendo possível obter frações de sêmen líquidas e coaguladas nos intervalos entre cada série. Em estudos que visam a coleta de sêmen por EEJ em homens com disfunções ejaculatórias, tem sido descrito que os intervalos entre as séries possibilitam o relaxamento do esfíncter uretral externo e favorecem a ejaculação em direção anterógrada com otimização do procedimento de eletroejaculação (OHL; SØNKSEN; BOLLING, 2000; SØNKSEN; OHL; WEDEMEYER, 2001; SØNKSEN; OHL, 2002). Esse protocolo é vantajoso em relação aos atualmente utilizados para a espécie por oferecer menor risco de injúrias aos indivíduos em conseqüência das baixas amperagens empregadas. Seager et al. (1982) recomendam também a lubrificação da sonda retal com gel ou pomada de vaselina com o objetivo de reduzir o risco de lesões no reto.
3.5. CRIOPRESERVAÇÃO DE SÊMEN DE PRIMATAS
O princípio dessa biotécnica é congelar o espermatozóide diminuindo reversivelmente a sua atividade metabólica, permitindo o seu armazenamento por tempo indeterminado, o que possibilita o emprego desse sêmen congelado em programas de inseminação artificial (ENGLAND, 1993). A criopreservação inclui inicialmente uma etapa de resfriamento, que consiste na redução progressiva da temperatura do sêmen diluído, baseado no princípio de que o frio é o agente mais eficaz na diminuição das atividades metabólicas dos espermatozóides, podendo ser conservado em estado líquido por várias horas com taxas de fertilidade aceitáveis, conforme observado por Mies Filho (1987).
A criopreservação de sêmen de alguns primatas não-humanos como: Cercopithecus aethiops, Erythrocebus patas, Macaca speciosa, Macaca mulatta, Pan troglodytes (ROUSSEL; AUSTIN, 1967), Papio anubis (KRAEMER; VERA CRUZ, 1969), Saimiri sciurius (DENIS et al., 1976), Macaca fascicularis (MAHONE; DUKELOW, 1978), lêmures (CLAVERT et al., 1986), Gorilla gorilla (LAMBERT et al., 1991), Macaca thibetana (CHEN et al., 1994), Callithrix jacchus (MORRELL et al., 1997) e Macaca fuscata (SANKAI et al., 1997) tem sido descrita. Contudo, somente para cinco dessas espécies foi relatado sucesso após inseminação artificial com sêmen descongelado (LI et al., 2005a).
3.5.1. Meio diluidor e seus componentes
Para o sucesso da preservação dos espermatozóides através da criopreservação, é necessário seguir uma série de passos que visam à redução dos danos causados às células e que assegurem longevidade in vitro e in vivo. O meio diluente é utilizado com o intuito de proteger os espermatozóides dos choques térmicos e osmóticos que ocorrem durante o processo (CONCANNON; BATTISTA, 1989). A existência de diferenças na composição lipídica da membrana plasmática do espermatozóide entre as espécies, raças e ainda entre indivíduos da mesma espécie, pode explicar o maior ou menor efeito protetor de um diluente aos espermatozóides de um determinado indivíduo (HOLT, 2000). A composição do diluente é de extrema importância e deve ser específica para cada espécie. Ele deve ser constituído por determinadas substâncias para ser completo e eficiente, tais como (ROTA, 1998):
- agentes crioprotetores;
- substâncias tampão para assegurar o controle do pH: TRIS, TES, ringer lactato, água de coco, citrato e fosfato de sódio;
3.5.1.1. Crioprotetores
As substâncias crioprotetoras são divididas em penetrantes e não penetrantes de acordo com o peso molecular e a conseqüente propriedade de atravessar ou não a membrana plasmática (RODRIGUES, 1992). Os crioprotetores permeáveis mais utilizados são o glicerol, etilenoglicol e dimetilsulfóxido (DMSO), essenciais para minimizar ou prevenir a formação de cristais de gelo intracelular. Os crioprotetores impermeáveis, como as lipoproteínas da gema do ovo e as proteínas do leite, por outro lado, auxiliam na estabilização da membrana plasmática durante o processo de congelação/descongelação (RODRIGUES, 1992). Os diluentes utilizados na criopreservação de sêmen de primatas não-humanos geralmente contêm gema de ovo, açúcares, glicerol ou DMSO em proporções variadas (MORREL; HODGES, 1998).
A gema de ovo é um dos protetores mais utilizados como base dos diluentes de sêmen, sendo incorporada de forma habitual na maioria dos protocolos de conservação. Ela protege contra o choque pelo frio devido à presença das frações lipoprotéicas de baixa densidade na sua composição, restaurando os fosfolipídios perdidos durante o choque térmico provocado pela mudança de temperatura que ocorre durante o resfriamento inicial do sêmen. A gema de ovo previne também a liberação da enzima hialuronidase pela célula espermática (HAMMERSTEDT; GRAHAM; NOLAN, 1990).
O glicerol (CH3H8O3) é o crioprotetor mais empregado na congelação do sêmen de
quando fora dos limites da concentração ideal para essa espécie (2,5-7%) (MORREL et al., 1997; MORREL; HODGES, 1998), intervalo que compreende a concentração adequada para Macaca mulatta, 5% (SI et al., 2004 apud SILVA, 2005b).
A concentração ideal de glicerol varia amplamente entre as diferentes espécies de primatas: 14% para Macaca speciosa, Erythrocebus patas e Cercopithecus aethiops (ROUSSEL; AUSTIN, 1967), 10% para Pan troglodytes (SADLEIR, 1966), 2.5-5% para Macaca fascicularis (CHO; HONJO, 1973), 5% para Macaca assamensis (LI; GAO; JI, 2004), 3-5% para Macaca mulatta (SI et al., 2000), 7% para Ateles paniscus e Ateles marginatus (SILVA, 2005b). Li et al. (2005a) demonstraram que os efeitos dos crioprotetores permeáveis são independentes do tipo do diluidor. Além disso, espermatozóides de diferentes espécies podem reagir de forma distinta ao glicerol.
A etapa de glicerolização tem sido realizada antes do resfriamento do sêmen de diversas espécies de primatas. Conradie, Oettle e Seier (1994) diluíram sêmen de Cercopithecus aethiops em solução com glicerol a 32 °C antes de resfriar a 5 °C, similar a Lanzendorf et al. (1992) com sêmen de Gorilla gorilla. Ejaculados de Macaca fascicularis foram diluídos 20 minutos antes de resfriar a 5 °C por 2 horas. Seier et al. (1993) compararam os efeitos do resfriamento de ejaculados de Cercopithecus aethiops a 32 °C ou 5 °C antes da adição do glicerol a mesma temperatura. Eles observaram que motilidade era maior quando a glicerolização ocorria a 32 °C, sugerindo que a permeabilidade do glicerol seja termo-dependente.
3.5.1.2. Antibióticos
3.5.1.3. TES-TRIS
O TRIS (Tris-hidroximetil-aminometano - H2NC(CH2OH)3) é uma substância
facilmente solúvel em água e disponível comercialmente em um alto grau de pureza na forma de cristais. Ele permanece estável em temperatura ambiente por diversos meses e é conhecido por não inibir diversos sistemas enzimáticos (BATES, 1962 apud SILVA, 2005a), atuando como tampão iônico bipolar com pH entre 7,0 e 9,0 (MCPHAIL; GOODMAN, 1984). Rodrigues (1997) reportou que o TRIS não apenas apresenta atividade tamponante, mas que também atua na redução do metabolismo da frutose pela célula espermática, contribuindo para a preservação de sua energia.
Diluentes contendo TRIS (hidroximetil aminometano) e TES (ácido N-Trishidroximetil-metil-2- aminometanosulfônico) já foram utilizados na criopreservação do sêmen de espécies de primatas do Velho Mundo, como Clorocebus aetiops (SEIER et al., 1993) e M. fascicularis (MAHONE; DUKELOW, 1978; TOLLNER et al., 1990; SANKAI et al., 1994; LI et al., 2005b) e do Novo Mundo, como C. jacchus (MORRELL et al.,1998), A. paniscus e A. marginatus (SILVA, 2005b).
3.5.1.4. Água de coco
A água de coco vem sendo amplamente utilizada para variados fins em diferentes tipos celulares: maturação e cultivo de oócitos e embriões bovinos (BLUME et al., 1997a, BLUME et al., 1997b); cultivo de folículos pré-antrais caprino (SILVA et al., 2000) e ovino (ANDRADE et al., 2002 apud CORDEIRO et al., 2006); diluição do sêmen de caprinos (SALLES, 1989; TONIOLLI, 1989a), suínos (TONIOLLI, 1989b), cães (MONTEZUMA JÚNIOR; VIANA NETO; NUNES, 1994; CARDOSO et al., 2003; CARDOSO; SILVA; SILVA, 2006), ovinos (CRUZ, 1994), bubalinos (VALE et al., 1999 apud CORDEIRO et al., 2006), humano (NUNES, 1998) e do primata C. apella (ARAÚJO et al., 2009). Diluidores a base de água de coco in natura (ACIN) forneceram excelentes melhorias relacionadas à motilidade e vigor espermático em caprinos, mantendo a viabilidade das amostras (NUNES, 1986). Cardoso, Silva e Silva (2004) obtiveram aproximadamente 60% de espermatozóides caninos móveis após descongelação.
Com relação à espécie C. apella, Araújo et al. (2009) demonstraram que a solução à base ACIN é eficiente na conservação da viabilidade espermática, mantendo aproximadamente 87% de espermatozóides vivos em banho-maria a 37 °C por até 7 horas após a coleta do sêmen. Ela apresentou também vantagens em relação a meios diluidores contendo enzimas proteolíticas para dissolução do coágulo, como a tripsina e a hialuronidase, que além da queda da motilidade e do vigor espermático, podem causar danos a membrana espermática impedindo o sucesso da criopreservação (HERNÁNDEZ-LÓPEZ et al., 2002; PAZ et al., 2006).
3.6. ATIVAÇÃO ESPERMÁTICA
4 LIQUEFAÇÃO DO COÁGULO SEMINAL, ATIVAÇÃO ESPERMÁTICA E CRIOPRESERVAÇÃO DO SÊMEN DE MACACO-PREGO (Cebus apella) EM ÁGUA
DE COCO IN NATURA (ACIN) E TES-TRIS
Semen coagulum liquefaction, sperm activation and cryopreservation of capuchin monkey (Cebus apella) semen in coconut water solution (CWS) and TES-TRIS
Karol G. Oliveira a,b, Stefânia A. Miranda a,b, Danuza L. Leão a,c, Adriel B. Brito a,b, Regiane R. Santos a,b,d, Sheyla F. S. Domingues a,b,c,*
a
Laboratório de Biologia e Medicina de Animais Silvestres, Universidade Federal do Pará, Belém, Pará, Brasil
b
Programa de Pós-graduação em Ciência Animal, Universidade Federal do Pará, Belém, Pará, Brasil
c
Faculdade de Medicina Veterinária, Universidade Federal do Pará, Castanhal, Pará, Brasil d
Department of Equine Sciences, Veterinary, Pharmacology, Pharmacy and Toxicology Division, Utrecht University, Utrecht, The Netherlands
*Autor para correspondência: Sheyla F. S. Domingues, DMV, PhD E-mail: shfarha@ufpa.br
Resumo
Os objetivos do presente estudo foram testar o efeito de diluidores a base de água de coco em pó (ACIN) e TES-TRIS na liquefação do coágulo seminal, na ativação espermática do sêmen fresco e na criopreservação do sêmen de macaco-prego (Cebus apella). O sêmen de seis machos adultos foi coletado através de eletroejaculação, diluído em TES-TRIS ou ACIN e incubado a 35°C até completa liquefação do coágulo seminal. No experimento I, após a liquefação, as amostras foram diluídas em TES-TRIS ou ACIN acrescidos de 6 e 10 mM/mL de cafeína. Motilidade espermática e vigor foram avaliados durante 5 horas. Para o experimento II, após liquefação, as amostras de sêmen foram diluídas em TES-TRIS (3,5% de glicerol na solução final) ou ACIN (2,5% de glicerol na solução final), criopreservado e estocado em nitrogênio líquido por 1 semana. O coágulo seminal liquefez em 4,5 ± 1,7 e 2,8 ± 1,1 horas (média ± EPM) em TES-TRIS e ACIN, respectivamente. Os espermatozóides mantiveram-se móveis em TES-TRIS e ACIN por 5,0 ± 1,4 e 1,0 ± 0,5 horas, respectivamente. A motilidade média nesse período foi 38 ± 10% (TES-TRIS) e 18 ± 9% (ACIN). Após a adição de cafeína a motilidade aumentou somente nas amostras contendo ACIN, tanto a 6 mM (21 ± 9%) quanto a 10 mM (22 ± 11%) de cafeína. O percentual de espermatozóides vivos após a congelação foi 26,2% em TES-TRIS e 13,2% em ACIN. Portanto, TES-TRIS (3,5% glicerol) foi mais apropriado que ACIN (2,5% glicerol) para a criopreservação de sêmen de C. apella. ACIN + cafeína aumentou consideravelmente a motilidade espermática, podendo ser utilizada para melhoria da técnica de inseminação artificial com sêmen fresco.
Abstract
The objectives of the present study were to test the effect of coconut water solution and TES-TRIS on the seminal coagulum liquefaction, sperm activation in fresh diluted semen, and on the cryopreservation of semen from capuchin monkeys (Cebus apella). Semen was collected from six males by electro-ejaculation, diluted in TES-TRIS or coconut water solution (CWS), and incubated at 35° C until the coagulated fraction of the semen was completely liquefied. In the Experiment I, after liquefaction, samples were diluted in TES-TRIS or CWS, plus 6 and 10 mM/mL of caffeine. Sperm motility and vigor were evaluated during 5 hours. For Experiment II, after liquefaction, semen samples were extended in TES-TRIS (3.5% glycerol in the final solution) or CWS (2.5% glycerol in the final solution), cryopreserved and stored in liquid nitrogen for 1 week. The seminal coagulum was liquefied in (mean ± SDM) 4.5 ± 1.7 and 2.8 ± 1.1 hours in TRIS and CWS, respectively. Sperm were motile in TES-TRIS and CWS for 5.0 ± 1.4 and 1.0 ± 0.5 hours, respectively. The mean motility in this period was 38 ± 22% (TES-TRIS) and 22.0 ± 16.0 (CWS). Motility increased after caffeine addition only in samples diluted in CWS containing 6 mM (22.5 ± 16.0) or 10 mM (28.0 ± 19.0) caffeine. Post-thaw live sperm percentage was 26.2% in TES-TRIS and 13.2% in CWS. For cryopreservation of semen from C. apella TES-TRIS (3.5 % glycerol) was more appropriate than CWS (2.5 % glycerol). CWS + caffeine potentially increase sperm motility and may be useful in artificial insemination of fresh diluted semen.
1. Introdução
Aquecimento global, destruição e fragmentação de habitats, introdução de espécies exóticas, assim como caça e outras pressões de exploração, têm provocado a extinção de muitas espécies animais (Fickel et al., 2007). Atualmente, todas as espécies de primatas do Novo Mundo estão listadas na Convention on International Trade in Endangered Species of Wild Fauna and Flora (CITES), mesmo que apresentem diferentes graus de vulnerabilidade. Isso estimula o desenvolvimento e aplicação de biotécnicas reprodutivas para prevenir a extinção de muitas espécies de primatas. Portanto, o simples estabelecimento de um banco de sêmen poderia ajudar a manter a diversidade genética e facilitar o desenvolvimento de outras tecnologias reprodutivas assistidas (Vidal et al., 2007).
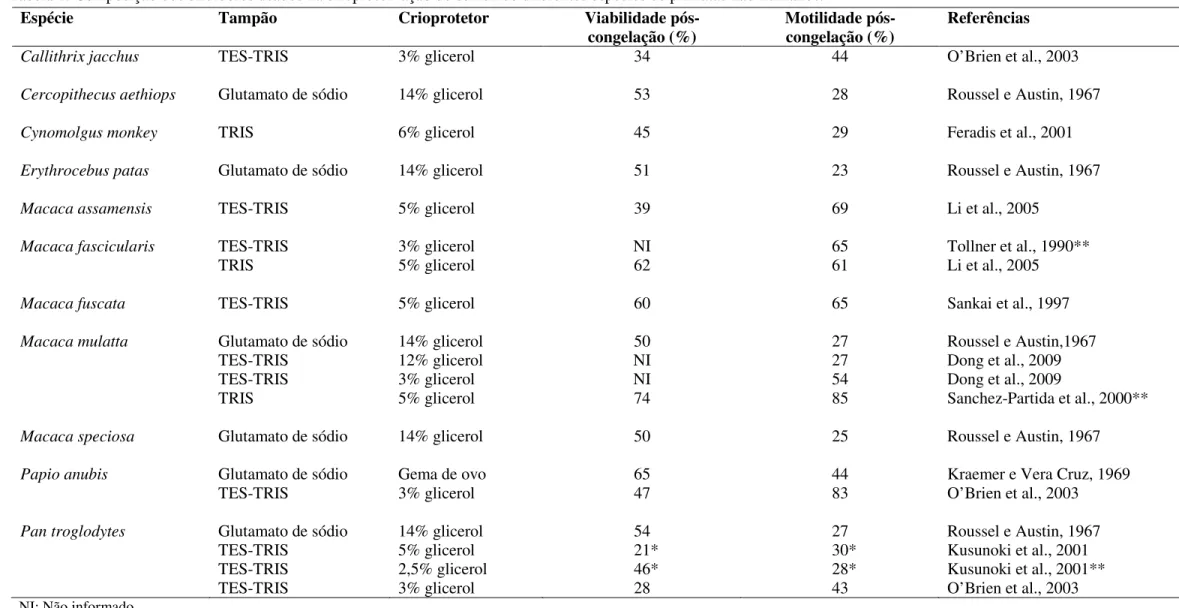
Tabela 1: Composição dos diluidores usados na criopreservação do sêmen de diferentes espécies de primatas não-humanos.
NI: Não informado.
* Valores médios calculados do epidídimo direito e esquerdo ** Nascimentos após inseminação artificial com sêmen descongelado
Espécie Tampão Crioprotetor Viabilidade
pós-congelação (%) Motilidade pós-congelação (%) Referências
Callithrix jacchus TES-TRIS 3% glicerol 34 44 O’Brien et al., 2003
Cercopithecus aethiops Glutamato de sódio 14% glicerol 53 28 Roussel e Austin, 1967
Cynomolgus monkey TRIS 6% glicerol 45 29 Feradis et al., 2001
Erythrocebus patas Glutamato de sódio 14% glicerol 51 23 Roussel e Austin, 1967
Macaca assamensis TES-TRIS 5% glicerol 39 69 Li et al., 2005
Macaca fascicularis TES-TRIS 3% glicerol NI 65 Tollner et al., 1990**
TRIS 5% glicerol 62 61 Li et al., 2005
Macaca fuscata TES-TRIS 5% glicerol 60 65 Sankai et al., 1997
Macaca mulatta Glutamato de sódio 14% glicerol 50 27 Roussel e Austin,1967
TES-TRIS 12% glicerol NI 27 Dong et al., 2009
TES-TRIS 3% glicerol NI 54 Dong et al., 2009
TRIS 5% glicerol 74 85 Sanchez-Partida et al., 2000**
Macaca speciosa Glutamato de sódio 14% glicerol 50 25 Roussel e Austin, 1967
Papio anubis Glutamato de sódio Gema de ovo 65 44 Kraemer e Vera Cruz, 1969
TES-TRIS 3% glicerol 47 83 O’Brien et al., 2003
Pan troglodytes Glutamato de sódio 14% glicerol 54 27 Roussel e Austin, 1967
TES-TRIS 5% glicerol 21* 30* Kusunoki et al., 2001
TES-TRIS 2,5% glicerol 46* 28* Kusunoki et al., 2001**
Entretanto, somente em duas (Macaca fascicularis e Macaca mulatta) dessas espécies de primatas há relatos de nascimentos após programas de inseminação artificial utilizando sêmen congelado (Tollner et al., 1990; Sanchez-Partida et al., 2000).
Os primatas do Novo Mundo têm recebido comparativamente menos atenção com relação à criopreservação do sêmen. O macaco-prego (Cebus apella) tem sido utilizado com sucesso como modelo experimental na pesquisa biomédica (Domingues et al., 2010). Porém, apesar da disponibilidade de métodos seguros e eficientes para coleta de sêmen dessa espécie neotropical (Araújo et al., 2009), nenhum protocolo de criopreservação de sêmen foi relatado.
Uma das prováveis barreiras para o sucesso da preservação do sêmen de C. apella é a formação de uma porção coagulada e consistente do ejaculado, que contém alta concentração de espermatozóides imóveis (Nagle e Denari, 1983). Por isso se tem afirmado que a diluição do coágulo seminal só é possível através da utilização de tripsina (Hernández-López et al., 2002). No entanto, a tripsina danifica severamente as células espermáticas de macaco-prego (Paz et al., 2006) que, uma vez fora do coágulo seminal, se tornam extremamente instáveis (Hernández-López et al., 2008). Além disso, diferentemente do ejaculado humano, cujo coágulo seminal liquefaz facilmente entre 5 e 20 minutos (Tauber et al., 1980), o plug seminal de macaco-prego apresenta o grau mais alto de coagulação (Barnabe et al., 2002). Por isso, é crucial otimizar o protocolo de dissolução do coágulo associado ao posterior incremento da viabilidade e motilidade espermática.
A eficiência da água de coco in natura (ACIN) na conservação do sêmen de C. apella foi relatada (Araújo et al., 2009), assim como na criopreservação do sêmen canino (Cardoso et al., 2006). Além disso, a presença do fator de crescimento ácido-3-indol-acético na ACIN é considerada um fator que promove a preservação dos espermatozóides em baixas temperaturas (Toniolli et al., 1996). A ACIN é uma substância complexa que contém enzimas e nutrientes, dentre outras substâncias, que também podem facilitar a liquefação do coágulo e a sobrevivência dos espermatozóides após a diluição e a criopreservação do sêmen. Embora seja importante salientar que a cafeína, um conhecido inibidor da fosfodiesterase, tenha sido utilizada com sucesso a várias concentrações para aumentar a motilidade espermática em outras espécies de primatas (Boatman e Bavister, 1984; Mahony et al., 1996), seus potenciais efeitos e respectivas concentrações a serem administradas em espermatozóides de C. apella após a liquefação ainda são desconhecidas.
criopreservação de sêmen para C. apella após liquefação do coágulo seminal, usando ACIN e TES-TRIS como diluidores e glicerol como crioprotetor.
2. Material e Métodos
2.1. Animais
Todos os procedimentos experimentais foram aprovados pelo Comitê de Ética em Pesquisa Animal (nº 013/2009/CEPAN/IEC/SVS/MS). Foram utilizados seis machos saudáveis e sexualmente adultos de C. apella, com idade média entre 10 e 20 anos, mantidos no Centro Nacional de Primatas (CENP). Comprimento, largura, altura, circunferência e volume dos testículos foram mensurados. O peso corporal dos animais foi aferido durante todo o período experimental. Os animais foram alocados em gaiolas individuais de 90 x 80 x 80 cm (comprimento, largura e altura, respectivamente), sob fotoperíodo natural, no CENP, Ananindeua, PA, Brasil (1º 22' 57"S, 48° 22' 52"N). O clima é tropical úmido, com temperatura anual média de 28 °C. A dieta consistia de frutas e vegetais frescos, leite e ração comercial peletizada (Foxy Junior Supreme, Curitiba, PR, Brasil). Vitaminas, minerais e ovos eram ofertados uma vez por semana, e água ad libitum.
2.2. Diluidores
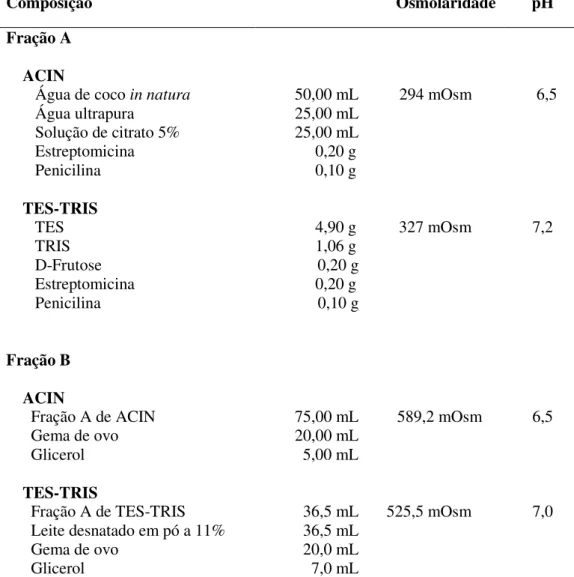
Tabela 2: Composição, osmolaridade e pH das frações A e B de TES-TRIS e ACIN.
Composição Osmolaridade pH
Fração A
ACIN
Água de coco in natura
Água ultrapura Solução de citrato 5% Estreptomicina Penicilina 50,00 mL 25,00 mL 25,00 mL 0,20 g 0,10 g
294 mOsm 6,5
TES-TRIS TES TRIS D-Frutose Estreptomicina Penicilina 4,90 g 1,06 g 0,20 g 0,20 g 0,10 g
327 mOsm 7,2
Fração B
ACIN
Fração A de ACIN
Gema de ovo Glicerol
75,00 mL 20,00 mL 5,00 mL
589,2 mOsm 6,5
TES-TRIS
Fração A de TES-TRIS
Leite desnatado em pó a 11% Gema de ovo Glicerol
36,5 mL 36,5 mL 20,0 mL
7,0 mL
525,5 mOsm 7,0
2.3. Condicionamento animal e anestesia
Um experimento piloto foi executado com seis animais para avaliar o efeito do condicionamento no tempo de ação da anestesia. O condicionamento foi conduzido por cooperação, de forma que os animais eram recompensados com uvas frescas quando permitiam a injeção do anestésico. Cada animal foi anestesiado com Cloridrato de ketamina (10 mg/Kg; IM; Vetanarcol, Konig) e Cloridrato de xilazina (1 mg/Kg; IM; Köning S.A., Avellaneda, Argentina).
2.4. Coleta de sêmen e análises preliminares
(EEJ), segundo Oliveira et al (2010). A EEJ foi realizada utilizando um eletroejaculador (Autojac-Neovet, Uberaba, Brasil) à bateria, equipado com uma probe retal bipolar (9 mm de diâmetro e 15 cm de comprimento). A probe era lubrificada e posicionada ventralmente no reto, estendendo-se a aproximadamente 5 cm do esfíncter anal para estimular a próstata. Cada sessão de estímulos consistia de seis séries, compostas por 10, 15, 20, 25, 30 e 35 estímulos elétricos (12,5 a 100 mA) com intervalos de 30 segundos entre as séries. Quando o animal não ejaculava após a sessão, não eram realizadas tentativas adicionais no mesmo dia. As coletas eram realizadas em intervalos mínimos de 15 dias. Todos os animais alcançaram ereção peniana e ejacularam pelo menos uma vez. O ejaculado era coletado em tubo de microcentrífuga (1,5 mL). Logo após a coleta, os espermatozóides eram imóveis, por isso, somente volume e aspecto seminal eram imediatamente avaliados.
2.5. Diluição I e liquefação
O ejaculado de cada animal foi dividido em duas partes iguais; cada uma foi diluída em 500 µL da fração A dos diluidores testados (TES-TRIS ou ACIN) e mantida a 35 °C. Posteriormente, o coágulo seminal em cada diluidor era mecanicamente fragmentado por meio de repetidas pipetagens a cada dez minutos, até completa liquefação, com a obtenção de um líquido viscoso. O tempo necessário para a liquefação em ambos os meios diluidores foi registrado. Concentração, Osmolaridade, morfologia, integridade de membrana, motilidade e vigor espermáticos foram avaliados após a liquefação.
2.6. Avaliação do sêmen
2.7. Delineamento experimental
Dois experimentos foram desenvolvidos neste estudo: no experimento 1, um total de cinco ejaculados (um ejaculado por macho) foi estudado para comparar a eficiência da adição de cafeína nos espermatozóides em ambos os diluidores. No experimento 2, um total de dez ejaculados de seis animais (pelo menos um ejaculado por animal) foi usado para investigar a criopreservação do sêmen usando dois diferentes diluidores (TES-TRIS e ACIN) e o glicerol como crioprotetor.
2.8. Experimento 1: Ativação espermática
Após a liquefação do coágulo na fração A de cada um dos diluidores, vigor e motilidade espermática foram avaliados. A duração da motilidade foi registrada. Quando vigor e motilidade chegavam a 0 e 0%, respectivamente, duas alíquotas de cada amostra eram retiradas e diluídas na fração A do diluidor correspondente acrescido de cafeína à concentração final de 6 ou 10 mM/mL, de acordo com Boatman e Bavister (1984) com a espécie Macaca mulatta. Motilidade e vigor espermáticos foram avaliados a cada 30 minutos durante 5 horas em microscópio invertido (Motic, British Columbia, Canada).
2.9. Experimento 2: Criopreservação do sêmen
2.10. Análise estatística
Os resultados foram expressos como média ± EPM. As diferenças entre parâmetros biométricos dos testículos direito e esquerdo e as comparações entre TES-TRIS e ACIN em todos os estágios de ambos os experimentos foram analisados pelo teste t de Student. O efeito dos diluidores no percentual de espermatozóides vivos, motilidade e vigor espermáticos foram avaliados por ANOVA, e as diferenças foram estabelecidas pelo teste de Fisher. P< 0,05 foi considerado como estatisticamente significante.
3. Resultados
Largura, altura, comprimento, circunferência e volume dos testículos foram 1,6 ± 0,1 cm, 1,5 ± 0,1 cm, 2,5 ± 0,1 cm, 6,0 ± 0,3 cm, e 2,0 ± 0,2 cm3 respectivamente, sem diferença significativa entre os testículos direitos e esquerdos. O peso corporal médio dos animais antes do período experimental foi 3,7 ± 0,5 kg, similar ao peso final (3,6 ± 0,4 kg).
O condicionamento dos animais antes da anestesia diminuiu o stress e aumentou a duração do efeito anestésico de 37,4 ± 3,6 para 52,3 ± 6,3 minutos (P<0,05). A coleta de sêmen foi bem sucedida em 19 de 21 tentativas. A ereção peniana iniciou em média na primeira série de estímulos elétricos, sendo que a ejaculação ocorria freqüentemente a partir da terceira série, após 18 minutos. As sessões de coleta duravam em média 40 minutos.
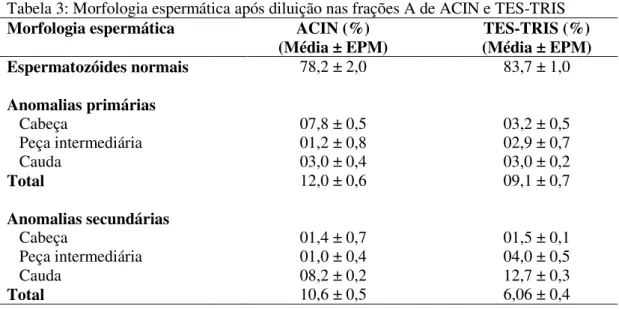
Tabela 3: Morfologia espermática após diluição nas frações A de ACIN e TES-TRIS
Morfologia espermática ACIN (%)
(Média ± EPM) (Média ± EPM) TES-TRIS (%)
Espermatozóides normais 78,2 ± 2,0 83,7 ± 1,0
Anomalias primárias
Cabeça 07,8 ± 0,5 03,2 ± 0,5
Peça intermediária 01,2 ± 0,8 02,9 ± 0,7
Cauda 03,0 ± 0,4 03,0 ± 0,2
Total 12,0 ± 0,6 09,1 ± 0,7
Anomalias secundárias
Cabeça 01,4 ± 0,7 01,5 ± 0,1
Peça intermediária 01,0 ± 0,4 04,0 ± 0,5
Cauda 08,2 ± 0,2 12,7 ± 0,3
Total 10,6 ± 0,5 6,06 ± 0,4
A motilidade foi significativamente maior (entre 10 e 70%) nas amostras diluídas na fração A de TES-TRIS que naquelas diluídas em ACIN, porém, ela não foi recuperada após a adição de cafeína em TES-TRIS (Tabela 4). Somente nas amostras diluídas em ACIN ocorreu ativação após a adição de cafeína (6 e 10 mM). A motilidade espermática observada após adição de 10 mM de cafeína foi significativamente maior que a motilidade inicial nas amostras de ACIN sem cafeína. Além disso, foi verificado aumento do percentual de amostras exibindo espermatozóides móveis durante 5 horas de avaliação. (Tabela 4).
Tabela 4: Motilidade e vigor imediatamente após liquefação do coágulo, e após exposição dos espermatozóides imóveis a ACIN e ao TES-TRIS, acrescidos de 6 ou 10 mM de cafeína.
Motilidade (%) Vigor Duração da motilidade (h)
Liquefação do coágulo
ACIN TES-TRIS
22,0 ± 16,0a
38,0 ± 22,0 b 3,0 ± 01,0 a
3,0 ± 05,0 a 1,0 ± 05,0
a
5,0 ± 01,4 b
Adição de cafeína*
ACIN 6 mM 10 mM TES-TRIS 6 mM 10 mM
22,5 ± 16,0 a 28,0 ± 19,0 a
0,0 ± 0,0 c 0,0 ± 0,0 c
2,0 ± 0,8 a 2,8 ± 1,1 a
0,0 ± 0,0 c 0,0 ± 0,0 c
3,4 ± 01,1 b 4,0 ± 01,2 b
NA NA * Cafeína foi adicionada quando a motilidade chegava a zero.
NA= não se aplica
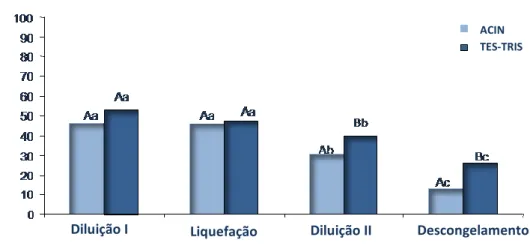
Figura 1: Percentual de espermatozóides vivos após diluição I, liquefação, diluição II e descongelamento. Letras maiúsculas diferentes (A, B) indicam diferença estatística (P < 0,05) entre diluidores em cada estágio. Letras minúsculas diferentes (a, b) indicam diferença estatística (P < 0,05) entre os estágios.
4. Discussão
No presente trabalho foi possível liquefazer o coágulo seminal usando tanto TES-TRIS quanto ACIN, sem prejudicar a viabilidade, motilidade e vigor espermáticos. Sendo mais lenta a liquefação em TES-TRIS (4,5 horas) que em ACIN (2,8 horas). Geralmente a liquefação seminal é efetuada na presença de enzimas não-específicas, como a tripsina (Nagle e Denari, 1983), para dissolver o coágulo seminal ou plug copulatório, que é composto pela
Liquefação
Diluição I Diluição II Descongelamento
semenogelina I e II (Valtonen-André et al., 2005). A água de coco contém uma variedade grande de nutrientes, incluindo vitaminas, minerais, antioxidantes, aminoácidos, fatores de crescimento e enzimas (Gopikrishna et al., 2008), que podem auxiliar a liquefazer o coágulo rapidamente a 35 °C.
Quando a liquefação foi seguida pela criopreservação, TES-TRIS, e não ACIN, foi o melhor diluidor para preservar a viabilidade espermática. Embora sua eficiência tenha sido relatada em outras espécies animais, como canina (Cardoso et al., 2006) e suína (Toniolli et al., 1996), informações relacionadas aos efeitos crioprotetores da ACIN no sêmen de primatas ainda são inexistentes. Em contraste, TES-TRIS tem sido usado na criopreservação de sêmen de outros primatas não-humanos resultando em alta taxa de sobrevivência pós-congelação (Yeoman et al., 2005) e nascimentos após IA (Morrell, 1997).
No presente estudo os melhores resultados obtidos com TES-TRIS, após criopreservação quando comparado com ACIN, pode ser explicado por três hipóteses. Primeiro, pela concentração mais alta de glicerol (3,5% em TES-TRIS e 2,5% em ACIN); segundo, a presença do leite no diluidor a base de TES-TRIS aumentou a osmolaridade da solução, o que reduziu o risco de formação de cristais de gelo intracelular; e finalmente, componentes desconhecidos na água de coco, como enzimas, podem ter sido tóxicos ou prejudiciais à célula após criopreservação.
A adição de cafeína para ativar espermatozóides tem sido eficiente em primatas não-humanos (Boatman e Bavister, 1984). Todavia, mesmo quando adicionado em ambas as concentrações ao diluidor TES-TRIS, não foi observada a recuperação da motilidade. Diferentemente, a adição de cafeína à ACIN, em ambas as concentrações resultou ma recuperação da motilidade espermática. A cafeína é conhecida por aumentar os níveis de cAMP intracelular (Cascieri et al., 1976), que pode induzir a motilidade espermática (Harayama e Miyaki, 2006). A ACIN, por sua vez, é rica em ácido 3-indol-acético (AIA), uma auxina capaz de substituir cAMP em bactérias entéricas, restaurando vias específicas (Bianco et al., 2006). Por isso, sugerimos que exista um efeito sinérgico entre a cafeína e os componentes da ACIN, envolvidos na recuperação da motilidade espermática.
glicerol assegurou melhor qualidade seminal pós-congelação que ACIN mais 2,5% de glicerol.
Referências Bibliográficas
Araújo, L.L., Oliveira, K.G., Lima, J.S., Araújo, J.B., Domingues, S.F.S., 2009. Avaliação do uso de solução à base de água de coco a 37 °C para diluição de sêmen de Cebus apella (macaco-prego) mantido em cativeiro. Ciência Animal Brasileira 10, 588-594.
Barnabe, R.C., Guimarães, M.A.B.V., Oliveira, C., Barnabe, A.H., 2002. Analysis of some normal parameters of the spermiogram of captive capuchin monkeys (Cebus apella, Linnaeus, 1758). Braz. J. Vet. Res. Anim. Sci. 39, 331-333.
Bianco, C., Imperlini, E., Calogero, R., Senatore, B., Pucci, P., Defez, R., 2006. Indole-3-acetic acid regulates the central metabolic pathways in Escherichia coli. Microbiology 152, 2421–2431.
Boatman, D.E., Bavister, B.D., 1984. Stimulation of rhesus monkey sperm capacitation by cyclic nucleotide mediators. J. Reprod. Fertil. 71, 357–366.
Cardoso, R.C.S., Silva, A.R., Silva, L.D., 2006. Comparison of two dilution rates on canine semen quality after cryopreservation in a coconut water extender. Anim. Reprod. Sci. 92, 384–391.
Cascieri, M., Amann, R.P., Hammerstedt, R.H., 1976. Adenine nucleotide changes at initiation of bull sperm motility. J. Biol. Chem. 10, 787–793
Domingues, S.F., Caldas-Bussiere, M.C., Petretski, M.D., Ohashi, O.M., Lima, J.S., Santos, R.R., Cordeiro,M.S., Gomes de Castro, P.H., 2010. Effects of follicular phase and oocyte-cumulus complexes quality on the protein profile and in vitro oocyte meiosis competence in Cebus apella. Fertil. Steril. 15, 1662–1667.
Dong, Q., Correa, L.M., VandeVoort, C.A., 2009. Rhesus monkey sperm cryopreservation with TEST-yolk extender in the absence of permeable cryoprotectant. Cryobiology 58, 20–27.
Feradis, A.H., Pawitri, D., Suatha, I.K., Amin, M.R., Yusuf, T.L., Sajuthi, D., Budiarsa, I.N., Hayes, E.S., 2001. Cryopreservation of epididymal spermatozoa collected by needle biopsy from cynomolgus monkeys (Macaca fascicularis). J. Med. Primatol. 30, 100–106.
Fickel, J., Wagener, A., Ludwig, A., 2007. Semen cryopreservation and the conservation of endangered species. Eur. J. Wildlife Res. 53, 81-89.
Gopikrishna, V., Baweja, P.S., Venkateshbabu, N., Thomas, T., Kandaswamy, D., 2008. Comparison of coconut water, propolis, HBSS, and milk on PDL cell survival. J. Endod. 34, 587–589.
Hernández-López, L., Cerezo-Parra, G., Cerda-Molina, A.L., Pérez-Bolanõs, S.C., Mondragón-Ceballos, R., 2002. Digestion by trypsin enhances assessment of sperm parameters in the black-handed spider monkey (Ateles geoffroyi). Lab. Primate Newsl. 41, 4– 6.
Hernández-López, L., Cerda-Molina, A.L., Páez-Ponce, D., Mondragón-Ceballos, R., 2008. The seminal coagulum favours passage of fast-moving sperm into the uterus in the black-handed spider monkey. Reproduction 136, 411–421.
Kraemer, D.C., Vera Cruz, N.C., 1969. Collection, gross characteristics and freezing of baboon semen. J. Reprod. Fertil. 20, 345–348.
Kusunoki, H., Daimaru, H., Minami, S., Nishimoto, S., Yamane, K., Fukumoto, Y., 2001. Birth of a Chimpanzee (Pan troglodytes) after artificial insemination with cryopreserved epididymal spermatozoa collected postmortem. Zoo. Biol. 20, 135–143.
Li, Y.H., Cai, K.J., Kovacs, A., Ji, W.Z., 2005. Effects of various extenders and permeating cryoprotectants on cryopreservation of cynomolgus monkey (Macaca fascicularis) spermatozoa. J. Androl. 26, 387–395.
Mahony, M.C., Lanzendorf, S., Gordon, K., Hodgen, G.D., 1996. Effect of caffeine and dbcAMP on zona pellucida interactions by epididymal spermatozoa of cynomolgus monkeys (Macaca fascicularis). Mol. Reprod. Dev. 43, 530-535.
Morrell, J.M., 1997. Cryopreservation of marmoset sperm (Callithrix jacchus). Cryo-letters 18, 45-54.
Nagle, C.A., Denari, J.H., 1983. The Cebus monkey (Cebus apella). In: Hearn, J.P. (Ed.), Reproduction of New World Primates. Lancaster, pp. 281–304.
O’Brien, J.K., Hollinshead, F.K., Evans, K.M., Evans, G., Maxwell, W.M., 2003. Flow cytometric sorting of frozen-thawed spermatozoa in sheep and non-human primates. Reprod. Fertil. Dev. 15, 367–375.
Oliveira, K.G., Castro, P.H., Muniz, J.A., Domingues, S.F., 2010. Semen conservation and seminal clot liquefaction of capuchin monkey (Cebus apella) in powdered coconut water extender (PCW) at different temperatures. Ciência Rural 40, 1–15.
Paz, R.C., Zacariotti, R.L., Teixeira, R.H., Guimarães, M.A., 2006. The effect of hyaluronidase and trypsin on the liquefaction of capuchin monkeys semen. Braz. J. Vet. Res. Anim. Sci. 43, 196–201.
Roussel, J.D., Austin, C.R., 1967. Preservation of primate spermatozoa by freezing. J. Reprod. Fertil. 13, 333–335.
Sankai, T., Shimizu, K., Cho, F., Yoshikawa, Y., 1997. In vitro fertilization of follicular oocytes by frozen-thawed spermatozoa in Japanese monkeys (Macaca fuscata). Lab. Anim. Sci. 47, 58–62.
Tauber, P.F., Zaneveld, L.J., Propping, D., Schumacher, G.F., 1980. A new technique to measure the liquefaction rate of human semen: the bag method. Fertil. Steril. 33, 567–570.
Tollner, T.L., VandeVoort, C.A., Overstreet, J.W., Drobnis, E.Z., 1990. Cryopreservation of spermatozoa from cynomolgus monkeys (Macaca fascicularis). J. Reprod. Fertil. 90, 347– 352.
Toniolli, R., Bussière, J., Courot, M., Magistrini, M., Combarnous, Y., 1996. Effect of indole-3-acetic acid (plant auxin) on the preservation at 15 °C of boar semen for artificial insemination. Reprod. Nutr. Dev. 36, 503–511.
Valtonen-André, C., Olsson, A.Y., Nayudu, P.L., Lundwall, A., 2005. Ejaculates from the common marmoset (Callithrix jacchus) contain semenogelin and beta-microseminoprotein but not prostate-specific antigen. Mol. Reprod. Dev. 71, 247–255.
Vidal, F.D., Luz, M.S., Pinho, T.G., Pissinatti, A., 2007. Coleta de sêmen em mico-leão-de-cara-dourada (Leontopithecus chrysomelas) (Kuhl, 1820) através da eletroejaculação Callitrichidae - primates. Rev. Bras. Ci. Vet. 14, 67-71.
5. CONCLUSÃO GERAL
O diluidor a base de ACIN pode ser usado para desfazer rapidamente o coágulo seminal de C. apella. Entretanto, a motilidade espermática é mantida por mais tempo em ACIN acrescida de cafeína e TES-TRIS. Para a criopreservação do sêmen, TES-TRIS a 3,5% de glicerol é mais indicado que ACIN a 2,5% de glicerol.
REFERÊNCIAS
ABBOTT, D.H. et al. Nonhuman Primates Contribute Unique Understanding to Anovulatory Infertility in Women. ILAR Journal, v. 45, n. 2, p. 116-131, 2004.
ABEE, C.R. Alternative New World Primate Models for Non-AIDS Research. ILAR Journal, v. 44, p. 231-235, 2003.
AMBOKA, J.N.O.; MWETHERA, P.G. Characterization of semen from olive baboons. Journal of Medical Primatology, v. 32, n. 6, p. 325-329, 2003.
ANDRADE, E.R. et al. Evaluation of saline and coconut water solutions in the preservation of ovine preantral follicles in situ. Small Ruminant Research, v. 43, p. 235-243, 2002.
ARAÚJO, L.L. et al. Avaliação do uso de solução à base de água de coco a 37 °C para diluição de sêmen de Cebus apella (macaco-prego) mantido em cativeiro. Ciência Animal Brasileira, v. 10, p. 588-594, 2009.
ARAÚJO, L. L. et al. Biometria testicular e efeito de diluidor à base de água de coco na conservação a 37 ºC de sêmen de Cebus apella (macaco-prego). In:REUNIÃO ANUAL DA SBPC,59,2007. Belém-PA. Resumos... Belém, 2007.
AURICCHIO, P. Primatas do Brasil. São Paulo: Terra Brasilis, 1995.
AURICH, J.E.; KUHNE, A.; HOPPE, H. Seminal plasma effect of milk fractions on survival of equine spermatozoa. Theriogenology, v. 46, p. 791-797, 1996.
BARNABE, R.C. et al. Analysis of some normal parameters of the spermiogram of captive capuchin monkeys (Cebus apella, Linnaeus, 1758). Brazilian Journal of Veterinary Research and Animal Science, v. 39, n. 6, p. 331-333, 2002.
BATES, R. G. Determination of pH: Theory and Practice. 2. ed. New York: John Wiley and Sons Inc., 1962, 161p.
BIANCO, C. et al. Indole-3-acetic acid regulates the central metabolic pathways in Escherichia coli. Microbiology, v.152, p. 2421–2431, 2006.
de embriões murídeos. Revista Brasileira de Reprodução Animal, v. 18, p. 97-104, 1994.
BLUME, H. et al. Avaliação da água de coco na maturação de oócitos bovinos. Revista Brasileira de Reprodução Animal, v. 21, p. 72-75, 1997a.
BLUME, H. et al. Uso da água de coco no cultivo de embriões bovinos. Revista Brasileira de Reprodução Animal, v. 21, p. 78-81, 1997b.
BOATMAN, D.E.; BAVISTER, B.D. Stimulation of rhesus monkey sperm capacitation by cyclic nucleotide mediators. Journal of Reproduction and Fertility, v.71, p. 357–366, 1984.
BUNGE, R.G. Caffeine stimulation for borderline male infertility. Fertility and Sterility, v. 51, p. 863-868, 1973.
BUSH, D.F. et al. Semen evaluation in capuchin monkeys (Cebus apella). Laboratory Animal Science, v. 25, n. 5, p. 588-593, 1975.
CARDOSO, R.C.S.; SILVA, A.R.; SILVA, L.D.M. Comparison of two dilution rates on canine semen quality after cryopreservation in a coconut water extender. Animal Reproduction Science, v. 92, p. 384-391, 2006.
CARDOSO, R. C. S.; SILVA, A.R.; SILVA, L.D.M. Use of the alternative extender powder coconut water (PCW 106®) for canine semen freezing. In: INTERNATIONAL SYMPOSIUM ON CANINE AND FELINE REPRODUCTION, 5., 2004, Embu das Artes-SP. Anais... Embu das Artes, 2004. p 96-97.
CARDOSO, R.C.S. et al. Cryopreservation of canine semen using a coconut water extender with egg yolk and three different glycerol concentrations. Theriogenology, v. 59, p. 743-751, 2003.
CASCIERI, M.; AMANN, R.P.; HAMMERSTEDT, R.H. Adenine nucleotide changes at initiation of bull sperm motility. The Journal of Biological Chemistry, v.10, p. 787–793, 1976.
CHEN, Z.J. et al. Effects of sucrose concentration on the developmental potential of human frozen-thawed oocytes at different stages of maturity. Human Reproduction, v. 19, p. 2345-2349, 2004.
CHO, F.; HONJO, S. A simplified method for collecting and preserving cynomolgus macaque semen. Japanese Journal of Medical Science and Biology. v. 26, p. 261-268, 1973.
CLAVERT, A. et al. A method for sperm cryopreservation of the lemur fulvus. Primate Reproduction, v. 14, p. 101, 1986.
CONCANNON, P. W.; BATTISTA, M. Canine semen freezing and artificial insemination. In: KIRK, R.W. (Ed.). Current Veterinary Therapy. Philadelphia: W.B. Saunders, 1989, p. 1247-1259.
CONRADIE, E.; OETTLE, E.E.; SEIER, J.V. Assessment of acrosomal integrity of vervet monkey spermatozoa after cryopreservation. Journal of Medical Primatology, v. 23, p. 315-316, 1994.
CORDEIRO, M.S. et al. The use of coconut water solution (Cocos nucifera) as a holding medium for immature bovine oocytes for in vitro embryo production. Animal Reproduction, v. 3, n. 3, p. 376-379, 2006.
CRUZ, J.F. Conservação e fertilidade do sêmen ovino mantido á temperatura de +4 ºC por um período de 48 horas diluído em frações ativas da água de coco. 1994. Dissertação (Mestrado em Produção e Reprodução de Pequenos Ruminantes) - Universidade Estadual do Ceará, 1994.
DENIS, L.T. et al. Freeze preservation of squirrel monkey sperm for use in timed fertilization studies. Fertility and Sterility, v.27, p.723-729, 1976.
DIXSON, A.F.; ANDERSON, M.J. Sexual selection, seminal coagulation and copulatory plug formation in primates. Folia Primatologica, v.73, p.63-69, 2002.
DOMINGUES, S.F.S.; CALDAS-BUSSIERE, M.C. Fisiologia e biotécnicas da reprodução desenvolvidas em fêmeas de Primatas Neotropicais importantes para a pesquisa biomédica. Revista Brasileira de Reprodução Animal, v.30, n.1/2, p. 57-71, 2006.