TÉCNICAS DE MICROSCOPIA PARA QUANTIFICAÇÃO E IDENTIFICAÇÃO
DE MICRORGANISMO
DANIELLE DA SILVA MOREIRA* ¹; ULYSSES GARCIA CASADO LINS ²
1Universidade do Grande Rio - Unigranrio, Acadêmica do Curso de Ciências Biológicas (Escola de Ciências da Saúde); 2 Universidade Federal do Rio de Janeiro, IMPG, Laboratório de Biologia de Ultraestrura de Procariotos. * dani.moreira@ymail.com Rua Professor
José de Souza Herdy,1160. CEP 25071-200, Duque de Caxias, RJ.
RESUMO
Técnicas de microscopia são fundamentais para processamentos de amostras para quantificação e identificação de bactérias, elas possuem ampla aplicação na pesquisa e apresentam vantagens devido à obtenção de resultados rápidos em relação outras técnicas de microbiologia disponíveis que dependem do crescimento de microrganismos. Neste trabalho foram utilizadas a microscopia óptica de fluorescência e eletrônica de transmissão. As bactérias utilizadas para o processamento da microscopia foram Escherichia
coli, Desulfovibrio alaskensis e Candidatus Magnetoglobus Multicelulares.
Palavras-chave: Microscopia eletrônica de transmissão, Fluorescência e Ultramicrotomia.
MICROSCOPY TECHNIQUES FOR QUANTIFICATION AND
IDENTIFICATION OF MICRO-ORGANISM
ABSTRACT
Microscopy techniques are essential for processing of samples for quantification and identification of bacteria, they have wide application in research and have advantages because of the quick wins over other techniques of microbiology available that depend on the growth of microorganisms. In this study we applied the fluorescence microscopy and transmission electron microscopy. The bacteria used to process microscopy were Escherichia coli, Desulfovibrio alaskensis and Candidatus Magnetoglobus Multicelulares.
Keywords:Transmission electron microscopy, Fluorescence and Ultramicrotomy.
INTRODUÇÃO
Microscopia óptica de fluorescência Devido à sua grande especificidade e relativa facilidade de utilização, a microscopia de fluorescência é o método de microscopia mais freqüentemente empregado em pesquisa atualmente. Com o microscópio óptico de luz equipado para microscopia de fluorescência, é possível examinar a distribuição de uma única espécie molecular em uma amostra e sob condições especiais, e até mesmo detectar moléculas fluorescentes individualmente. A microscopia de fluorescência permite a visualização de moléculas específicas que apresentam fluorescência na presença de luz de excitação ultravioleta ou radiação eletromagnética na faixa do visível de baixo comprimento de onda; emitem radiação com comprimento de onda superior à radiação incidente. A grande vantagem
desta técnica é o ganho de contraste, porém requer custo adicional com aquisição de equipamentos. Normalmente, as moléculas não-fluorescentes são marcadas com um corante fluorescente ou fluorocromo, a fim de torná-los visíveis. Exemplos destes são DAPI (4’6’-diamidino-2-fenilindol) usado para marcar diretamente o DNA nuclear ou rodamina, usada para marcar indiretamente filamentos de actina citoplasmática. O microscópio de fluorescência utiliza filtros especiais, e emprega um método especifico de iluminação para produzir imagens através da luz emitida a partir de moléculas excitadas no espécime. Os filtros são projetados para isolar dois conjuntos de comprimentos de onda. (Murphy, 2001).
Para utilizar o microscópio de fluorescência de maneira correta, o operador deve ser capaz de selecionar o fluorocromo apropriado,
filtro, e iluminação adequada para melhorar a qualidade da fluorescência.
A microscopia de fluorescência pode ser utilizada para vários tipos de estudos biológicos, como determinação da distribuição intracelular de macromoléculas, estudo da dinâmica dessas macromoléculas, mecanismos de reação de transferência de energia, determinação de concentração intracelular de íons, entre muitos outros. (Leal, 2000).
Corantes fluorescentes ou fluorocromos
Para a aplicação da técnica de microscopia de fluorescencia na maioria das vezes utilizamos o corante DAPI (4’6’-diamidino-2-fenilindol) que marcar o DNA. Quando associada a dupla-fita de DNA, o DAPI tem a sua máxima absorção no comprimento de onda de 358nm ( ultravioleta ) e seu máximo de emissão é de 461nm (azul).
Outros corantes utilizados foram o kit BaclightTM (Molecular Probes), que é um kit de viabilidade celular LIVE/DEAD® que é utilizado para fazer teste de viabilidade das amostras para observação em microscopia de fluorescencia. Esse kit utiliza uma mistura com dois marcadores: o marcador verde fluorescente SYTO® 9 (480/500nm excitação/emissão) e o marcador vermelho fluorescente iodeto de propídeo (490/638nm excitação/emissão). O SYTO 9 marca todas as bactérias presentes na amostra, viáveis e não viáveis. Por outro lado, o iodeto de propídeo penetra apenas em bactéria com a membrana celular danificada (inviáveis), causando a redução do SYTO 9 quando ambos os corantes estão presentes. Desse modo, quando há uma mistura apropriada dos dois marcadores, as bactérias que apresentam membrana celular intacta (viáveis) são marcadas em verde fluorescente, enquanto as células que apresentam danos na membrana celular (não viáveis) são marcadas em vermelho fluorescente.
Outra técnica para detecção de bactérias é a hibridização in situ fluorescente (FISH). Essa técnica é bastante eficiente para a identificação de bactérias específicas e análise da organização espacial de comunidades microbianas complexas, pois permite a observação de um grupo específico de bactérias em nível celular dentro da comunidade (Amann, Krumholz e Stahl, 1990). A técnica do FISH associada a métodos de análise digital de imagens tem se tornado uma excelente ferramenta no estabelecimento de protocolos de enumeração de microrganismos grupos-específicos em diferentes tipos de amostras (Kampfer et al., 1996, Manser et al., 2006, Bottari et al., 2006). Por ser uma técnica independente de
cultivo, permite de maneira mais adequada, a determinação do número de determinado grupo de microrganismo no ambiente, e a utilização de programas de análise de imagens permitem uma quantificação semi-automática rápida sem a introdução de erros associados ao operador. A quantificação direta de microrganismos em amostras microbianas estruturadas utilizando a abordagem do FISH associado à análise digital de imagens é dificultada, pois as células estão intimamente agregadas e a detecção de células únicas é complexo.
Nessa técnica, baseia-se no principio de que seqüências complementares dos ácidos nucléicos que se encontram em fita única têm a tendência de, sob determinadas condições, formar uma dupla hélice. Desse modo, utilizando-se ácidos nucléicos a associados a marcadores é possível estudar a distribuição, o nível da expressão de genes específicos ou as transcrições dos genes. Como o DNA encontra-se em dupla fita, é necessário primeiro abrir sua dupla hélice para que a sonda possa hibridizar.
Microscopia eletrônica de transmissão
Os microscópios eletrônicos de transmissão (MET) comerciais datam o inicio da década de 40, e desta data até os anos 1970 tivemos o período áureo da microscopia descritiva. Entretanto, hoje temos claro que a era descritiva ou puramente morfológica da microscopia eletrônica já passou. O campo da biologia celular, que esteve diretamente ligado à microscopia eletrônica desde o seu inicio, desenvolveu–se ao longo do tempo como um campo multidisciplinar que utiliza a microscopia eletrônica como uma entre muitas ferramentas. Por outro lado, esta ferramenta tem se tornado tão sofisticada, que o mundo da microscopia tornou-se praticamente independente como área de pesquisa, contribuindo significativamente para o conhecimento da ultra-estrutura, bioquímica, fisiológica e chegando à biologia molecular através da localização in situ de genes. Com o estabelecimento do microscópio eletrônico como ferramenta científica, os microbiologistas ampliaram seu potencial de percepção de detalhes estruturais, previamente limitados pelo comprimento de onda da luz visível.
No microscópio eletrônico de transmissão, a imagem é gerada por elétrons que são transmitidos através do material observado. O feixe resultante da passagem dos elétrons pela amostra contém alguns elétrons originais que não tiveram suas características alteradas e outros que, ao passar pelo espécime, tiveram alterada a
velocidade e a direção. Como os elétrons não podem ser observados diretamente, a imagem no microscópios eletrônicos de transmissão é vista através de uma tela fosforescente ou através da sensibilização de um filme ou câmera digital. O feixe gerado pelo filamento vai produzir uma imagem do material através de uma série de lentes eletromagnéticas. As lentes eletromagnéticas geram campos magnéticos que desviam a trajetória dos elétrons. Quando desviados por essas lentes eletromagnéticas, os elétrons assumem trajetórias helicoidais e vão focar a imagem de um espécime colocado antes das lentes num determinado ponto depois de atravessarem a lente. A imagem projetada pelas lentes sensibiliza uma tela fosforescente, que transforma elétrons invisíveis ao olho humano em fótons, os quais podem ser observados diretamente ou através de uma binocular. O contraste é função da natureza do espécime e dos ajustes feito no microscópio. De uma maneira geral, o contraste de um determinado material decorre dos elementos atômicos que ela possui, conseqüentemente da interação dos elétrons do feixe com estes elementos. A utilização de metais pesados junto com o material cria um contraste artificial, pois os núcleos mais pesados junto à esses elementos tendem a desviar mais os elétrons do que materiais mais leves, como os normalmente encontrados no material biológico.
As técnicas de preparo de amostras biológicas para microscopia eletrônica de transmissão como etapas básicas a fixação, desidratação, polimerização em resinas acrílicas, obtenção de cortes ao ultramicrótomo e contrastação com metais pesados, foram padronizadas após diversos trabalhos pioneiros. (Leal, 2000). Entretanto, todas estas etapas são variáveis, sendo recomendável ajuste das técnicas para cada material a ser estudado.
Fixação
A etapa de fixação é o processo através do qual se preserva o estado original de um espécime vivo, evitando-se ao máximo a introdução de “artefatos”, ou seja, estruturas previamente inexistentes formados a parti do processamento. A função do fixador é imobilizar a estrutura celular o mais próximo do estado natural e funcional da célula, paralisando o metabolismo celular. Um fixador deve criar várias ligações estáveis entre os componentes celulares e ter a capacidade de penetrar rapidamente no material em estudo. Para a observação morfológica da amostra é necessário a utilização de soluções fixadoras, que incluem um fixador e um tampão, na preparação de
amostras biológicos para MET. A fixação das amostras para o processamento da microscopia eletrônica de transmissão é em solução tampão cacodilato 0,1M pH 7,2. A solução tampão é uma solução que resite a mudanças de pH. O pH de tamponamento afinado tem faixa de pH de 6,4 a 7,4, que é a faixa fisiológica de pH. O tampão citado oferece vantagens na fixação de materiais biológicos quais sejam: resistências à contaminação por bactérias durante a estocagem das amostras (o tampão cacodilato possui arsênico inviabilizando o crescimento de microrganismos), a ausência de íons fosfato que possam interferir em estudos citoquimicos e permite adição de cálcio as soluções fixadoras. Os fixadores comumente utilizados na microscopia estão listados abaixo.
Glutaraldeído
É a substância mais utilizada como fixador em microscopia eletrônica e transmissão. Este fixador pode ser utilizado sozinho ou em mistura com outros fixadores, sendo diluído em concentrações que variam de 1- 10% em soluções tampões (por ex. cacodilato e fosfato), resultando numa melhor preservação das estruturas celulares e oferecendo um maior contraste microscópico. Entretanto, quando usado em técnicas imunológicas, este fixador pode diminuir ou eliminar o reconhecimento de proteínas por causar danos estruturais aos determinantes antigênicos (Glauert & Thornley, 1966).
Paraformaldeído
O formaldeído (CH2O) preserva menos a estrutura celular que o glutaraldeído (C5H8O2) por ser menos eficiente que estes em estabelecer ligações cruzadas, desse modo não sendo recomendável para estudos estruturais finos. Eles reagem em ligação monovalente com os grupos aminos de proteínas. É muito utilizado porque atividades enzimáticas e propriedades imunogênicas são menos prejudicadas pelo formaldeido que por outros fixadores. Pode ser utilizado em conjunto com o glutaraldeido.
Tetróxido de ósmio
O Tetroxido de ósmio (OsO4) estabiliza e constrata especialmente os fosfolipideos constituintes da membrana citoplasmáticas. Atua sobre os ácidos graxos insaturados desses fosfolipideos, sobre ácidos que tem duplas ligações e não atua sobre o acido palmítico ou o esteárico que não tem duplas ligações. Do mesmo
modo que o glutaraldeido o ósmio diminui com o tempo de fixação por se combinar com as estruturas. Por isso deve sempre haver excesso de ósmio.
Desidratação
A desidratação é uma etapa de transição que visa substituir a água presente nas amostras biológicas por um fluido miscível com as resinas de inclusão que são, em sua grande maioria, hidrofóbicas. A desidratação consiste em inúmeras lavagens em acetona ou etanol, em concentrações progressivamente aumentadas até atingir o grau absoluto. Embora pareça uma etapa banal, é durante esse processo que muitos artefatos podem ser gerados, podendo resultar na perda de detalhes da amostra que podem levar a uma interpretação errada, devido principalmente a extração de material celular.
Resina
A resina serve como um suporte secção da amostra e, assim, observação de suas estruturas internas no microscópio eletrônico de transmissão. A resina deve possuir características que facilitem a infiltração e, depois de polimerizada, deve ser possível a contrastação dos cortes e estes devem ser resistentes à incidência do feixe eletrônico do microscópio. Vários meios de inclusão são comercializados por firmas especializadas, elas são divididas em dois grupos: o das resinas epóxi e o das resinas acrílicas.
Resina Epóxi
Resina plástica de polimerização a quente. E são importantes na preparação dos cortes finos, por permitir a preservação estrutural do material e serem extremamente estáveis sob ação do feixe de elétrons. Entretanto, a natureza hidrofóbica dessas resinas afeta a preservação antigênica do material, causando diminuição dos sinais de marcação. A polimeração é feita a 60ºC por 48-72horas
Resina acrílica Unicryl TM
É derivado do metacrilato e foi desenvolvida para ser utilizada indiferentemente em microscopia de luz ou microscopia eletrônica. A resina não interage nem forma ligações cruzadas com proteínas ou ácidos nucléicos expostos na inclusão, favorecendo a detecção posterior destes componentes. Esta resina é compatível com todos os solventes normalmente
usados na desidratação. A resina pode ser polimerizada por temperatura de 50ºC à 60ºC ou por luz UV a baixa temperatura (-20ºC).
Ultramicrotomia
É uma etapa critica do processamento e seu sucesso depende de todas as etapas anteriores, de um bom ultramicrotomo, uma navalha de qualidade e do domínio do usuário, o que só pode ser atingindo com a pratica.
A espessura dos cortes é avaliada pela cor que mostram quando flutuam pela superfície da água da cuba da navalha, e que se devem à interferência entre os raios luminosos refletidos na face superior e interior. Para a ultramicrotomia pode ser utilizada navalha de diamante que são muito resistentes e duráveis, desde que não cortem materiais que contenham inclusões muito duras, porém muito caras ou navalha de vidro que são frágeis necessitando substituição freqüentemente, sua maior desvantagem.
A extremidade do bloco que contém o material deve ser aperfeiçoada como uma pirâmide, que pode ser feita à mão com uma gilete ou em equipamentos como o Piramitome da LKB. A navalha deve encontrar primeiro a base maior da pirâmide, assim o sofrerá menor pressão. O importante é que a face da pirâmide esteja bem alinhada à navalha para que ela não seja danificada. Os cortes são recolhidos em uma grade em geral de cobre, mas que pode ser de níquel ou ouro, quando houver tratamento com reagentes que reajam com cobre. As grades podem ter 2,3 ou 3,05 mm de diâmetro e convém verificar qual o tamanho correspondente para o microscópio.
Contrastação
Os elementos predominantes em amostras biológicas são o carbono, hidrogênio, oxigênio e nitrogênio, que possuem número atômico pequeno e por isso não são capazes de desviar os elétrons do feixe na formação da imagem do microscópio eletrônico de transmissão, gerando uma imagem de baixo contraste. Para intensificar o contraste na imagem observada no microscópio eletrônico, os cortes ultrafinos são incubados em soluções de sais de metais pesados que reagem com os componentes celulares. As duas substâncias mais utilizada para esse processamento são o acetato de uranila e o citrato de chumbo.
O acetato de uranila reage com vários componentes celulares, especialmente ácidos nucléicos. Pode ser empregado tanto antes da
desidratação ou diretamente sobre os cortes. As grades são colocadas em uma solução aquosa de acetato de uranila 2,5% durante 15 - 20 minutos, protegido da luz. As grades são lavadas em água destilada e colocadas em papel de filtro. A grade é incubada em um recipiente com parafilme, onde são colocadas gotas de citrato de chumbo, uma para cada grade, junto com pastilhas de hidróxido de sódio (NaOH) para diminuir a concentração de CO2, durante 2 a 5 minutos, lavando com água destilada e secando com filtro de papel. Os componentes podem variar de acordo com o objetivo de estudo.
O presente estudo teve como objetivo a familiarização de diversas técnicas de microscopia para identificação e quantificação de microrganismo e o preparo de amostras para microscopia óptica de fluorescência e eletrônica de transmissão.
METODOLOGIA
Preparo das amostras utilizadas nas técnicas descritas
Para quantificação de bactérias por DAPI e pelo kit LIVE/DEAD Baclight (Molecular Probes) foram utilizadas culturas de Escherichia coli crescidas em meio Luria-Bertani por 12 horas a 37º C. A composição do meio Meio Luria-Bertani (LB). Esse meio é feito com 10g Triptona, 5g de extrato de levedura e 10 g de NaCl para 1000 mL de água destilada. Depois que os reagentes descritos acima são solubilizados, o pH é ajustado para 7,0 com NaOH 1N, o volume ajustado para 1000 mL e o meio é então autoclavado.
A cultura de bactérias de Desulfovibrio alaskensis foi cedida pela Prof. Lucy Seldin. A água do mar e as bactérias magnetotáticas foram obtidas no laboratório do Prof. Ulysses Lins.
Microscopia de fluorescência
Na microscopia de fluorescência foram utilizadas técnicas para quantificação de bactérias utilizando o microscópio Zeiss Axioplan 2 (Carl Zeiss, Alemanha), com lâmpada de mercúrio de 100W, conjunto de filtros para DAPI, FITC e filtro 9 (480/500nm excitação/emissão) e filtro 3 (490/635nm excitação/emissão) e equipado com câmera digital (AnaliSYS GmbH, Alemanha).
Para contagem de microrganismo
aproximadamente 20-30 campos aleatórios foram adquiridos em 2 transectos perpendiculares entre si. O valor absoluto foi calculado levando em consideração a área total observada e a quantidade
de amostra, os valores são expressos em relação ao volume de amostra.
Quantificação de bactérias totais por DAPI
As amostras de bactérias foram fixadas em solução de formaldeído 4% em tampão PBS, a mesma foi filtrada em membrana de
com PBS e armazenado a -20ºC. A amostra foi observada no microscópio óptico Zeiss Axioplan 2 equipado para fluorescência. Vinte campos aleatórios da membrana foram fotografados e os microorganismos foram contados de modo semi-automático utilizando o programa ImageJ (NIH-USA).
Hibridização in situ (FISH)
Para hibridização, as amostras foram incubadas em tampão de hibridização (0,9 M NaCl; 5mM Na2EDTA; 20mM Tris-HCl [pH 7,0]; 0,1% dodecil sulfato de sódio [SDS], 5 ng de formamida). A formamida é responsável pela especificidade da hibridização; quanto maior sua concentração, maior a especificidade da FISH. Grupos de sondas específicas para eubactérias (EUBI 5´– GCT GCC TCC CGT AGG AGT – 3`, EUBII 5` – GCA GCA GCC ACC CGT AGG TGT – 3`, EUB III 5´ – GCT GCC ACC CGT AGG TGT – 3´) e bactérias redutoras de sulfato (BRS) (SRB Db 5´ – CGG CGT TGC TGC GTC AGG – 3´) foram utilizadas.
Após a incubação a 46°C por
aproximadamente 16 horas, as amostras foram lavadas em tampão de lavagem (5 mM Na2EDTA; 20mM Tris-HCl [pH 7,0]; 0,1% dodecil sulfato de sódio [SDS]; 112 mM NaCl) pré-aquecido e, logo após, lavadas gentilmente em água Milliq para a retirada do tampão de lavagem. As amostras foram coradas com DAPI (1 µg ml-1) por 5 minutos, lavada com PBS 1x, secas ao ar e montadas em lâmina com meio de montagem N-propilgalato. Seu armazenamento foi feito a -20ºC. As sondas usadas foram marcadas fluorescentemente na extremidade 5’ com Alexa 488 para BRS e Alexa 594 para eubactérias. Foi realizado também nessas amostras em tampão de hibridização com 20% de formamida.
Análise de imagens
As imagens foram adquiridas pelo microscópio de fluorescência Axioplan 2
utilizando o Software AnaliSYS (Soft Imaging System), sendo essas imagens de formato TIF com resolução 1280x1024 pixels. As células contidas nas imagens foram contabilizadas utilizando o plugin ITCN do software gratuito ImageJ (http://rsbweb.nih.gov/ij/).
No plugin ITCN alguns parâmetros numéricos podem ser mensuráveis para que uma contagem automática seja feita. Sendo assim uma contagem semi-automática foi realizada padronizando a medida de célula e de threshold. O primeiro passo é abrir a imagem através do ImageJ. Depois disso, a imagem precisa ser binarizada para que a contagem possa ser realizada. Então o plugin ITCN é aberto e a medida de célula e o threshold são definidos. O tamanho mínimo entre células foi estipulado dependendo da imagem a ser contabilizada. Um teste de aceitabilidade foi realizado para verificar a capacidade do programa em contar automaticamente as células. O valor definido de threshold utilizado foi de 0.7. O tamanho mínimo de célula padronizado foi de 9 pixels, equivalentes à 3 µm, onde a equivalência de 60 pixels representava 20 µm em cada imagem. Os
microorganismos foram contados
automaticamente utilizando o programa ImageJ. Os resultados foram expressos em número de microorganismos por ml de amostra.
Para determinar a concentração de células da amostra é necessário converter os valores de células por campo para células/ml. Para isso, os números de células contabilizados por campo são divididos pela área do campo em µm2 delimitada câmera e pelo Software AnaliSIS. Com a lente objetiva de 100x a área equivale a 5733,2 µm2.
Após a contagem, foi gerada uma figura mostrando as células contadas e uma tabela contendo o número de células e a densidade por campo. Os resultados da contabilização foram separados em forma de gráfico definindo a média dos valores e o devido erro padrão. Para a construção do gráfico o utilizou-se o programa Prisma 4.
Microscopia eletrônica de transmissão
As amostras foram fixadas em
glutaraldeído 2,5% em tampão cacodilato de sódio 0,1M em água da lagoa estéril, pH 7,2. Após a fixação a 4oC overnight, foram realizadas três lavagens de aproximadamente 15 minutos usando tampão cacodilato de sódio 0,1 M, pH 7,2. Após as lavagens, foi feita a pós-fixação, no escuro, em tetróxido de ósmio 1% em tampão cacodilato de sódio 0,1M em água da lagoa estéril por 1 hora à temperatura ambiente. Novas
lavagens usando o mesmo tampão foram realizadas e as amostras foram então desidratadas em acetona 30%, 50%, 70%, 90% e 100% (três vezes) por aproximadamente 15 minutos cada, à temperatura ambiente. Posteriormente, a etapa de impregnação com resina PolyBed 812 seguiu-se as etapas à temperatura ambiente: overnight em uma solução de acetona/resina 2:1, 8h em solução acetona/resina 1:1, overnight em solução de 1:2, 8h em resina pura. A polimerização ocorreu a 60oC em estufa por 48 a 72 horas. Os cortes ultrafinos foram feitos em um ultramicrótomo Reichert Ultracut com navalha de diamante e contrastados em uma solução aquosa de acetato de uranila 2,5% durante 20 minutos, protegido da luz e citrato de chumbo por 1 minuto e observados no microscópio FEI Morgagni em 80 KV.
RESULTADOS
DAPI
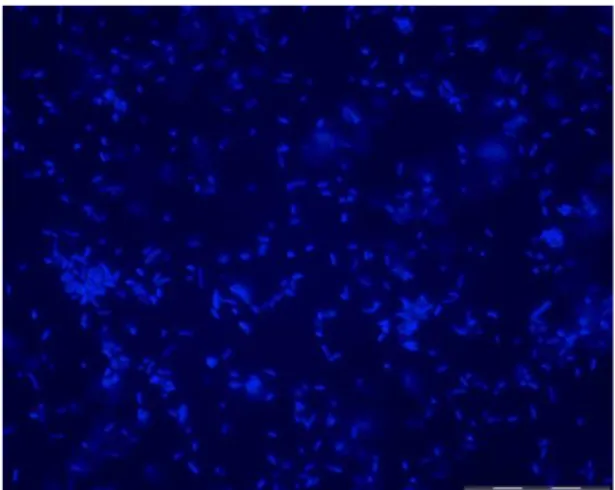
A quantificação direta realizada na amostra de Escherichia coli através do uso do corante DAPI (Figura 1) foi expressa no gráfico abaixo, mostrando a eficiência na técnica.
Figura 1 - Micrografia de fluorescência de
Escherichia coli corada com o fluorocromo DAPI. A barra de escala indica 20µm.
Gráfico 1. Quantificação de células na amostra
através do uso do fluorocromo DAPI. Contagem de células por DAPI
0 2.0×105 4.0×105 6.0×105 8.0×105 C é lu la s /m l
Teste de viabilidade
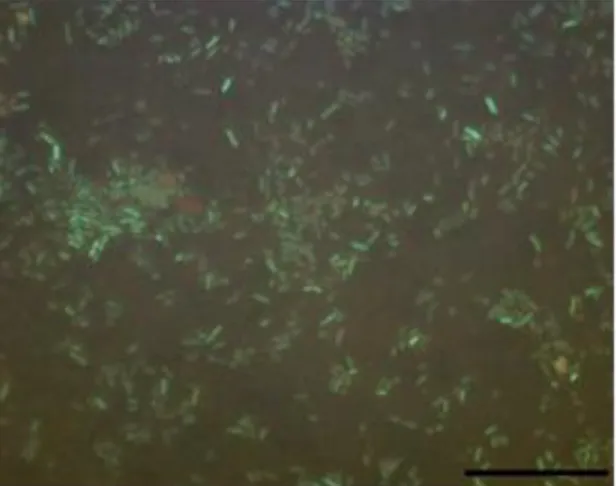
O resultado obtido através da técnica de viabilidade (Figura 2) nas amostras mostrou que o número das células viáveis é 87% ao numero total de células da amostra.
Figura 2 - Micrografia de fluorescência de
Escherichia coli corada com o kit Baclight (Molecular Probes). A barra de escala indica 20 µm.
Gráfico 2 - Quantificação de bactérias viáveis na
amostra de Escherichia coli.
Hibridização in situ (FISH)
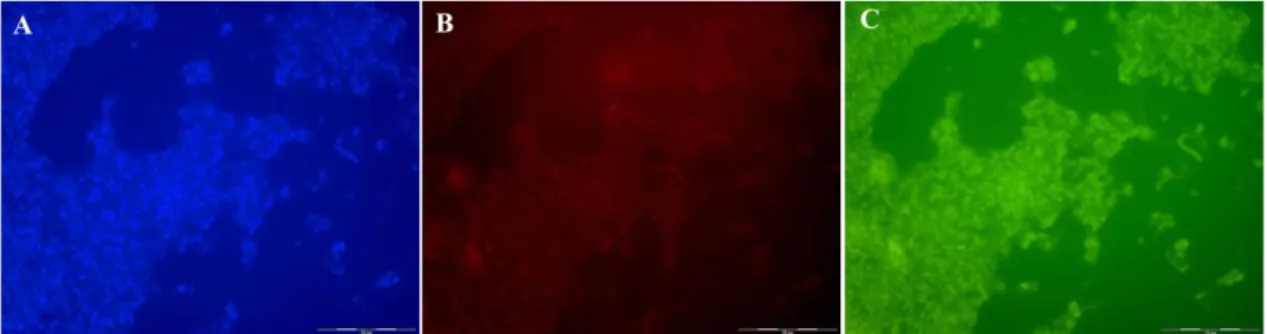
Na Hibridização in situ fluorescent foram utilizadas sondas específicas para identificação de eubactérias marcadas com Alexa 594 (Tabela 1), que emite fluorescência em vermelho, e sonda específica para identificação de bactéria redutora de sulfato marcadas com Alexa 488 (Tabela 1), que emite fluorescência em verde. Controles sem sonda foram feitos para verificar a autofluorescencia da amostra (Figura 3 e 4). Os resultados obtidos através da FISH com as amostras de Escherichia coli e Desulfovibrio
alaskensis mostraram que concentração ideal de formamida para as sondas utilizadas nesse trabalho é de 30%. Como esperado a sonda para bactéria redutora de sulfato não marca E.coli quando 20% de formamida é utilizado no tampão de hibridização (Figura 5). No entanto, note que a marcação de bactéria redutora de sulfato utilizando 20% de formamida não é muito específica, pois um bastonete grande, que não é Desulfovibrio alaskensis, está marcado, indicando que a reação está sendo inexpecífica (Figura 6). Oportunamente a cultura obtida de D. alaskensis estava contamidada por uma bactéria não redutora de sulfato, o que facilitou a determinação da melhor concentração de formamida para o uso das sondas aqui descritas. Nas amostras em que a concentração de formamida foi aumentada para 30%, a hibridização da sonda de bactéria redutora de sulfato se mostrou mais específica.
Apesar de a sonda para bactérias ter funcionado bem em 20 % de formamida, a sonda para bactéria redutora de sulfato apresentou certa inespecifidade. Como essas sondas serão utilizadas em conjunto, a melhor opção encontrada foi de aumentar a concentração de formamida para 30%, uma vez que nessa concentração todas as sondas apresentaram especificidade e eficiência na marcação (Figura 7 e 8).
Microscopia eletrônica de transmissão
O processamento das amostras para microscopia eletrônica de transmissão pode gerar inúmeros artefatos e, conseqüentemente conclusões equivocadas. Algumas características que devem ser observados na amostra como garantia de boa preparação são membranas continuas e ausências de extração no citoplasma. Durante o processamento da amostra todas as etapas são criticas para alcançar um resultado satisfatório.
Amostras mal fixadas podem levar ao aumento do volume da célula e extração de componentes citoplasmáticos. A desidratação, assim como, a infiltração mal feita da amostra também pode levar a extração de componentes celulares, bem como a existência de regiões celulares não preenchidas com resina (Figura 9).
Através da observação dos cortes das amostras foi possível observar que a membrana da célula estava contínua e que o citoplasma celular não estava extraído, o que garantia as conclusões a respeito das estruturas intracelulares observadas. No caso das bactérias magnetotáticas é possível observar a presença de organelas denominadas magnetossomos (Figura 10, setas).
Teste de viabilidade Viá veis Não -viá veis 0 50 100 150 200 250 Viáveis Não-viáveis N ú m e ro d e b a c té ri a s /m l
Essas estruturas são formadas por nanocristais magnéticos de óxido de ferro (Fe3O4) ou sulfeto de ferro (Fe3S4) envoltos por membranas lipoproteica.
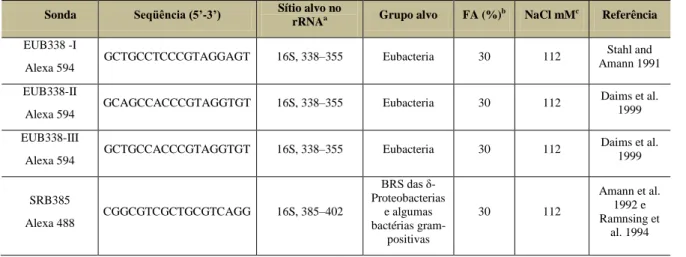
Tabela 1 - Sondas utilizadas para a técnica de Hibridização in situ fluorescent.
Sonda Seqüência (5’-3’) Sítio alvo no
rRNAa Grupo alvo FA (%)
b
NaCl mMc Referência
EUB338 -I Alexa 594
GCTGCCTCCCGTAGGAGT 16S, 338–355 Eubacteria 30 112 Stahl and Amann 1991 EUB338-II
Alexa 594 GCAGCCACCCGTAGGTGT 16S, 338–355 Eubacteria 30 112
Daims et al. 1999 EUB338-III
Alexa 594 GCTGCCACCCGTAGGTGT 16S, 338–355 Eubacteria 30 112
Daims et al. 1999 SRB385 Alexa 488 CGGCGTCGCTGCGTCAGG 16S, 385–402 BRS das δ-Proteobacterias e algumas bactérias gram-positivas 30 112 Amann et al. 1992 e Ramnsing et al. 1994 a
Posição de acordo com a numeração em E. coli b
Concentração de formamida no tampão de hibridização c
Concentração de NaCl no tampão de lavagem
Figura 3. Controle sem sonda de Desulfovibrio alaskensis, (a) marcação para bactéria redutora de sulfato, (b) sonda para bactéria.
Figura 4. Controle sem sonda de Escherichia coli, (a) marcação para bactéria redutora de sulfato, (b) sonda para bactéria.
Figura 5. FISH de amostras de Escherichia coli com formamida 20%, (a) marcação com DAPI, (b) sonda para bactéria, (c) sonda para bactéria redutora de sulfato. A barra de escala indica 20µm.
Figura 6. FISH de amostras de Desulfovibrio alaskensis com formamida 20%, (a) marcação com o fluorocromo DAPI, (b) sonda para bactéria, (c) sonda para bactéria redutora de sulfato. A barra de escala indica 20 µm.
Figura 7. FISH de amostras de Escherichia coli com formamida 30%, (a) marcação com o fluorocromo DAPI, (b) sonda para bactéria, (c) sonda para bactéria redutora de sulfato. A barra de escala indica 20
Figura 8. FISH de amostras de Desulfovibrio alaskensis com formamida 30%, (a) marcação com o fluorocromo DAPI, (b) sonda para bactéria, (c) sonda para bactéria redutora de sulfato. A barra de escala
REFERÊNCIAS BIBLIOGRÁFICAS
1. Andreasen, J.O. Etiology and Pathogenesis of traumatic dental injuries. A clinical study of 1298 cases. Scand J. Dental. Res. 1970; 78:329-42.
2. Andreasen, J.O. et AL. Texto Atlas Colorido de Traumatismo dental- editora: Artmed. 2001.
3. Antunes, K. B., Alvim, M.; Machado, T.; Abad, E. Prevalência dos traumatismos dentários em cinco anos de Projeto Trauma. 22° Reunião Anual da ABPQO. Setembro, 2005; 19:36.
4. Bastos, J. V.; Côrtes, M.I.S.; Gonçalves, A.C.P. Avulsão dental: Manejo e tratamento emergencial dos casos encaminhados à clínica de traumatismos dentários da O-UFMG. Anais do 8° Encontro de Extensão da UFMG, Belo Horizonte, outubro, 2005.
5. Bamjee, J.F.; Lownie, P.E.; Cleaton- Jones,P.E.; Lownie, M.A. Maxilofacial Injuries in a Group of South Africans under 18 yearspf age. Br J. Oral MaxilofacSurg, 1996; 34: 298-302. 6. Blinkhorn, F.A. The actiology of dento-
alveolar injuries and factors influencing attendance for emergency care adolescents in the North West of England. Endod Dent Traumatol. 2000; 16(4): 162-65.
7. Brasil. Ministério da Saúde. Cadernos de Atenção Básica, n. 17. Secretaria de Atenção à Saúde. Departamento de Atenção Básica – Brasília: Ministério da Saúde, 2006. 92 p. il.
8. Caldas Jr, A.F.; Burgos, M.E.A. A retropective study of traumatic dental injuries in a Brazilian dental trauma clinic. Dent Traumatol 2001:17(6): 250-53;
9. Carvalho, R. G. Estudo epidemiológico dos pacientes atendidos no projeto de trauma dental no período de 7 anos. 2007.
10. Côrtes, M.I.S.; Bastos, J.V. Tratamento das urgências em traumatismo dentário- São Paulo: Artes Médicas 2002; 391-408.
11. Delattre, J. P.; Resmond, R.F.; Allanche, C.; Perrin, M.; Michel, J.F.; Lê Berre, A. Dental injuries among school children ages from 6 to 15, in Rennes ( France). Endod Dental Traumatol 1994; 11(4): 186-8.
12. Gehlen, I.; Riela, A. Dinâmicas territoriais e desenvolvimento sustentável. Sociologias no.11. Porto Alegre Jan./June, 2004.
13. Hamilton, F.A.; Hill, F.J., Holloway, P.J. Na investigation of dento -alveolar trauma and its treatment in a adolescent population. Part 1: the prevalence and incidence of injuries and the stent and adequacy of treatment received. Br Dent J. 1997, 182(3): 91-95.
14. Kagul, B.; Çaglar, E.; Tamboga, I. Dental trauma in Turkish children, Istanbul. Dent Traumatol. 2003; 19:72-5. 15. Schatz,J.P.; Joho,J.P. A retrospective study of dento-alveolar injuries. Endod Dent Traumatol 1994; 10(1):11-14. 16. Sae-Lim, V.; Tan, H.H.; Yuen, K.W.
Traumatic dental injuries at the accident
and Emergency Departament of
Singuapore General Hospital. Endod Dent Traumatol. 1995; 11(1):32-6. 17. Silva, A.C.; Passeri, L.A.; Mazonetto, R.;
Moraes, M.; Moreira, W.F. Incidence of dental trauma associated with facial trauma in Brazil: A1-year evoluation. Dent Traumatol. 2004; 20: 6-11.
18. Soares, J.S.; Goldeberg, F. Endodontia: Técnicas e fundamentos. Porto Alegre. Editora: Artmed, 2002.
19. Tomito, N. E.; Bijella, V. T.; Franco, L. J. Relação entre hábitos bucais e má oclusão em pré-escolares. Rev. Saúde Pública vol.34 n.3 São Paulo June 2000. 20. Traebert, J.; Almeida, I. C. S.; Garghetti,
necessidade de tratamento e fatores predisponentes do traumatismo na dentição permanente de escolares de 11 a 13 anos de idade, Cad. Saúde
Pública vol.20 no.2 Rio de
Janeiro Mar./Apr. 2004.
21. Uji, T.; Teramoto, T. Occurrence of traumatic injuries in the oromaxillary region of children in a Japanese prefecture. Endod Dent Traumatol. 1988; 4(2): 63-9.
22. Wanderley, M. T. Como tratar dentesraumatizados ou perdidos. Traumatismo em dentes decíduos e suas repercussões para as dentições. Anais do
15° Conclave Odontológico
Internacional de Campinas ISSN 1678-1899- n.104 - Mar/Abr - 2003
23. Weine, Franklin. Tratamento
Endodôntico- 5°edição- editora: Santos. 24. Zuhal, K.J.; Semra, O.F.M.; Huseyin, K.
Traumatic injuries of the permanent incisors in children in Southern Turkey: A retrospective study. Dent Traumatol. 2005; 21:20-5
.
Recebido em / Received: 2011-01-26 Aceito em / Accepted: 2011-03-21