1. INTRODUÇÃO
A hipertensão arterial é conceituada como uma síndrome, caracterizada por valores elevados das pressões sistólica e diastólica, associados a alterações metabólicas, hormonais e a fenômenos como hipertrofia cardíaca e vascular. A prevalência da hipertensão arterial no Brasil é elevada, estimando-se que cerca de 30% da população brasileira adulta possa ser rotulada como hipertensa (VI Diretrizes Brasileiras de Hipertensão Arterial, 2010).
Apesar da mortalidade por doenças circulatórias ter apresentado uma queda no período entre 1979 a 1996, atualmente ela é causa primária de morte no Brasil (MANSUR, FAVARATO, SOUZA, AVAKIAN, ALDRIGHI, CESAR, RAMIRES, 2001). Estudos em países mais desenvolvidos demonstram que a incidência de doenças cardiovasculares está diretamente relacionada à alta prevalência de hipertensão arterial (STEGMAYR, VINOGRADOVA, MALYUTINA, PELTONEN, NIKITIN, ASPLUND, 2000).
Além de ser um importante fator de risco de morbidade e mortalidade cardiovascular, a hipertensão tem alto custo socioeconômico, sendo responsável pela maior parte dos casos de aposentadoria precoce e de absenteísmo no trabalho, decorrentes de complicações associadas como: doença cerebrovascular, doença arterial coronariana, insuficiência cardíaca, insuficiência renal crônica e doença vascular periférica (KANNEL, GORDON, SCHWARTZ, 1971; SCHMIDT, ALP, 2007).
Sabe-se que esta síndrome esta diretamente relacionada à disfunção endotelial, a qual é caracterizada pela diminuição na biodisponibilidade de fatores vasodilatadores como: o óxido nítrico e prostaciclinas, e aumento de fatores vasoconstritores como: superóxido e endotelina, todos estes produzidos e liberados pelo endotélio (GONGORA, QIN, LAUDE, KIM, MCCANN, FOLZ, DIKALOV, FUKAI, HARRISON, 2006; GALILI, VERSARI, SATTLER, OLSON, MANNHEIM, MCCONNELL, CHADE, LERMAN, LERMAN, 2007).
(peróxido de nitrito), a qual não têm função vasodilatadora e pode danificar a célula endotelial. Estes fatores estão associados à disfunção endotelial vasomotora, com prejuízos à vasodilatação e exarcebação da vasoconstrição, entre outras alterações maléficas ao funcionamento e estrutura vascular (GRAHAM, RUSH, 2004; GONGORA et al., 2006; GALILI et al., 2007).
Devido ao crescente papel do estresse oxidativo na hipertensão, diferentes estratégias terapêuticas estão sendo investigadas com o objetivo de minimizá-lo. Em modelos animais, o tratamento com antioxidantes, embora estes não atuem diretamente nas vias de produção de EROs, melhoram a função vascular e reduzem a pressão arterial por diminuírem a ação das EROs nos vasos (CHEN, TOUYZ, PARK, SCHIFFRIN, 2001).
Grande esforço também tem sido feito para atenuar a produção vascular de EROs. Dentre estes esforços estão, o bloqueio do receptor de angiotensina II (AT1) e
inibidores da enzima conversora de angiotensina (ECA), bem como inibição direta da NAD(P)H oxidase pela apocinina, os quais estão diretamente ligados a produção das EROs no vaso (GHIADONI, MAGAGNA, VERSARI, KARDASZ, HUANG, TADDEI, SALVETTI, 2003; UNGER, PATIL, 2009). Além disso, estudos com antioxidantes não enzimáticos também têm sido usados, com o mesmo propósito (MULLAN, YOUNG, FEE, MCCANCE, 2002).
Entretanto, o tratamento com antioxidantes ainda é muito controverso, pois alguns estudos clínicos têm mostrado a ineficácia deste tratamento em diminuir a mortalidade por doenças cardiovasculares e incidência de eventos cardiovasculares (VIVEKANANTHAN, PENN, SAPP, HSU, TOPOL, 2003). Do mesmo modo, as estratégias para diminuição da produção de EROs, apesar de exercerem impacto positivo nesta patologia, por outro lado , não parece ser a melhor forma de tratamento, pois sua importância na regulação biológica não só do vaso, como também em outros sistemas do organismo, pode interferir negativamente quando manipulada (HAMILTON, MILLER, AL-BENNA, BROSNAN, DRUMMOND, MCBRIDE, DOMINICZAK, 2004).
científicos e tecnológicos, surgem conceitos novos sobre a etiologia, fisiopatologia e tratamento da doença.
O treinamento físico aeróbio é amplamente indicado no tratamento não farmacológico da hipertensão (SCHMIDT, ALP, 2007). É evidenciado em animais, que o treinamento físico (TF) diminui o estresse oxidativo vascular, promove melhora da vasodilatação e, consequentemente, diminui a pressão arterial (GRAHAM, RUSH, 2004; HARRISON, WIDDER, GRUMBACH, CHEN, WEBER, SEARLES, 2006).
No entanto, apesar de estar bem definido que a atividade física pode trazer benefícios à saúde e minimizar a progressão de doenças crônico-degenerativas, dentre elas a hipertensão, os mecanismos pelos quais o TF modula os processos celulares e fisiológicos, não são completamente conhecidos. Assim, é importante salientar que a compreensão destes mecanismos pode ajudar na atuação direta no foco do problema, aumentando a expectativa de vida dos indivíduos que possuem esta patologia ou seus fatores de risco.
Apesar disso, aspectos éticos e metodológicos dificultam o avanço do conhecimento desses mecanismos em humanos, justificando a realização de estudo com animais de experimentação para uma melhor compreensão dos efeitos do TF na hipertensão. Desta forma, utilizaremos um modelo experimental de hipertensão arterial em ratos espontaneamente hipertensos (SHR), para investigar os mecanismos envolvidos na melhora da função endotelial (resposta vasodilatadora) decorrentes do TF aeróbio.
A hipótese principal deste estudo é que o TF aeróbio irá atenuar o estresse oxidativo vascular e aumentar a biodisponibilidade de NO, por diminuir a produção de EROs pela NAD(P)H oxidase e aumentar a atividade antioxidante.
2. OBJETIVO PRINCIPAL
3. OBJETIVOS ESPECÍFICOS
Avaliar, em aorta isolada de ratos SHR, os efeitos do treinamento físico da natação sobre:
A resposta vasodilatadora endotélio-dependente: agonista acetilcolina (ACh) A resposta vasodilatadora endotélio-independente: agonista nitropussiato de sódio (NPS);
O envolvimento da sintase de NO na resposta vasodilatadora endotélio-dependente: pré-incubação com inibidor da óxido nítrico sintase endotelial (eNOS) com L-NAME e agonista ACh;
O índice de biodisponibilidade de EROs (superóxido); A expressão protéica da enzima eNOS;
A expressão protéica de subunidades NOX1 e NOX4 do complexo enzimático NAD(P)H oxidase;
O índice de biodisponibilidade de NO: concentração de nitrato e nitrito.
4. REVISÃO DE LITERATURA
4.1. Hipertensão arterial
A hipertensão arterial é uma síndrome multifatorial e apesar da maioria dos seus casos ser de origem idiopática essa patologia pode ser desenvolvida a partir de etiologias diferentes, como, insuficiência renal, doença vascular aterosclerótica, obesidade, induzida por medicamentos ou drogas, síndrome da apnéia obstrutiva do sono, dentre outras causas (SCHMIDT, ALP, 2007).
Além de suas múltiplas origens vários são os fatores de risco para o desenvolvimento de hipertensão, como: diabetes, alcoolismo, idade, etnia, sexo, sedentarismo, obesidade e fatores sócios econômicos, que associada à estes fatores ou a outra patologia pode ser considerada como hipertensão secundária. Todos estes fatores contribuem, por mecanismos diferentes, para elevação da pressão arterial, e evidentemente a soma destes fatores classificam o grau da doença (CHOBANIAN, BAKRIS, BLACK, CUSHMAN, GREEN, IZZO, JONES, MATERSON, OPARIL, WRIGHT, ROCCELLA, 2003; SCHMIDT, ALP, 2007).
Estudos tanto clínicos, quanto experimentais têm mostrado, em várias etiologias da hipertensão, a distinção dos mecanismos envolvidos em cada causa, onde, além de dados clínicos com humanos, modelos com animais de experimentação que desenvolvem hipertensão espontânea ou induzida são estudados a fim de mimetizar o desenvolvimento da hipertensão arterial essencial, objetivando a compreensão das vias que desencadeiam essa patologia (OKAMOTO, AOKI, 1963; FROHLICH, 2009).
Porém, umas das alterações metabólicas que parece estar envolvida na maioria dos casos é o controle redox, ou seja, o equilíbrio entre a produção e remoção de espécies reativas de oxigênio e nitrogênio (ERNs). Esta regulação da biodisponibilidade das EROs e ERNs é de extrema importância para a manutenção da homeostase do organismo humano, onde seu estado de desequilíbrio parece desencadear alterações fisiológicas e funcionais importantes para o controle do sistema vascular, no caso da hipertensão (STOJILJKOVIC, LOPES, ZHANG, MORROW, GOODFRIEND, EGAN, 2002; SEKIGUCHI, YANAMOTO, SUNANO, 2004; TOUYZ, SCHIFFRIN, 2004).
clínicos, este fato ocorre nos vários tipos de hipertensão experimental como: as induzidas por alterações no padrão de dietas (aumento de sal ou gordura) (TOJO, ONOZATO, KOBAYASHI, GOTO, MATSUOKA, FUJITA, 2002; GALILI et al., 2007), hipertensão induzida por Angiotensina II (VIRDIS, NEVES, AMIRI, VIEL, TOUYZ, SCHIFFRIN, 2002), por mineralocorticóides (SCHAFER, WALLERATH, CLOSS, SCHMIDT, SCHWARZ, FORSTERMANN, LEHR, 2005), associado a outras patologias (diabetes, obesidade etc), pós-menopausal (FORTEPIANI, ZHANG, RACUSEN, ROBERTS, RECKELHOFF, 2003), hipertensão de origem genética (SHR), dentre outras.
O modelo SHR, por desenvolverem hipertensão de origem genética no inicio da propagação da síndrome (a partir de aproximadamente 8 semanas de vida), dá-se grande relevância ao estudo deste modelo, pois o aumento da pressão arterial é a primeira e principal alteração funcional envolvida. Outro fator importante é devido ao aumento da pressão arterial estar isolada de outras alterações metabólicas ou funcionais no inicio do desenvolvimento da síndrome mimetizando a hipertensão arterial essencial desenvolvida em humanos (OKAMOTO, AOKI, 1963). É importante salientar que as principais alterações desta patologia são na estrutura e função das artérias, onde é de grande importância o estudo dessas alterações, porém não se descartam alterações secundárias a órgãos alvo que ocorrem em fases mais avançadas da doença (CORDELLINI, NOVO, LANZA JUNIOR, 2006; LOCH, CHAN, HOEY, BROWN, 2009).
Entretanto, as alterações vasculares deste modelo ainda não são consenso na literatura, parecem que dependem da idade, tipo de leito vascular e metodologias utilizadas para acessá-lo, e todos esses aspectos podem resultar em respostas vasculares diferentes as quais serão discutidas nos próximos tópicos (BERNATOVA, CONDE, KOPINCOVA, GONZALEZ, PUZSEROVA, ARRIBAS, 2009).
4.2. Alterações no endotélio vascular
especializada na contração e relaxamento, a qual consiste no tecido muscular liso, e por fim, a camada íntima chamada de endotélio vascular (MCALLISTER, 1995).
Sabe-se desde 1980 que o endotélio é uma camada vascular unicelular que recobre a luz de todos os vasos. E devido a sua localização estratégica, entre o sangue circulante e o músculo liso, tem alta atividade metabólica e controla ativamente a homeostase cardiovascular, exercendo importante influência autócrina, parácrina e endócrina, atuando em células musculares lisas, plaquetas e leucócitos (FURCHGOTT, ZAWADZKI, 1980; GALLEY, WEBSTER, 2004).
Dentre as funções do endotélio estão, o controle da trombolise, da aderência plaquetária , do tônus vascular e consequentemente do fluxo sanguíneo, sendo assim indispensável para a homeostase de todo o organismo. Além dessas funções descritas acima, ele é uma importante barreira de passagem livre de moléculas e células, do sangue para o interstício até às células, e também uma barreira seletiva para o egresso de moléculas para a circulação (GALLEY, WEBSTER, 2004). Por exemplo, já foi descrito que as células endoteliais possuem transportadores de glicose (GLUT-1) e de aminoácidos, possuem também caveolas, as quais são invaginações da membrana responsáveis pelo transporte transcelular e regulação da atividade de uma proteína importante para o mecanismo de vasodilatação, a óxido nítrico sintáse (eNOS) (MANN, YUDILEVICH, SOBREVIA, 2003; GRATTON, BERNATCHEZ, SESSA, 2004). E, por último, possuem junções intracelulares importantes para o transporte paracelular, onde fazem a interligação das células endoteliais entre si. Todas estas funções são essenciais para a permeabilidade endotelial, auxiliando na regulação do fluxo, viscosidade do sangue, e nos processos inflamatórios (DOMEIER, SEGAL, 2007).
Devido o objetivo do presente estudo ter grande relação com a função de controle do tônus vascular, este tema será abordado com maior ênfase. Porém, não se descarta a importância e a relevância das outras funções, onde somente associadas podem manter a homeostase dos sistemas em geral.
prostaciclinas, onde, por meio desses é capaz de modular de maneira importante o fluxo sangüíneo, a coagulação e a angiogênese. Essas substâncias vasoativas denominam-se como fatores relaxantes (FRDE), constritores (FCDE) e hiperpolarizantes (FHDE) derivados do endotélio (FURCHGOTT, ZAWADZKI, 1980; FURCHGOTT, VANHOUTTE, 1989; MOMBOULI, VANHOUTTE, 1999).
Dentre os FRDE, o óxido nítrico (NO) e as prostaciclinas são liberados principalmente por estímulo da acetilcolina e bradicinina, quando liberados pelo endotélio têm ações aditivas, porém o NO tem maior representação no mecanismo de vasodilatação (MORO, RUSSEL, CELLEK, LIZASOAIN, SU, DARLEY-USMAR, RADOMSKI, MONCADA, 1996). Os FCDE são representados sobretudo pela endotelina, e espécies reativas de oxigênio em destaque, o superóxido, e são produzidas principalmente pelo estímulo da angiotensina-II aos receptores ATI no endotélio. Já os FHDE são considerados também FRDE, pois promovem a vasodilatação pelo resultado da abertura dos canais de potássio e o fechamento dos canais de cálcio (FURCHGOTT, VANHOUTTE, 1989; TOUYZ, SCHIFFRIN, 2004).
Outros estímulos como insulina, serotonina, substância P, histamina, também podem agir como vasodilatadores dependentes do endotélio e, além da angiotensina II, a noradrenalina também pode estimular a produção de endotelina, dentre outros (TOUYZ, SCHIFFRIN, 2004). O estresse de cisalhamento e de estiramento na parede do vaso também parecem favorecer a vasodilatação, porém ainda é controverso e serão discutidos posteriormente (HARRISON et al., 2006; LAUGHLIN, NEWCOMER, BENDER, 2008).
Todas estas interações entre estímulo e produção de FRDE e FCDE citadas acima estão relacionadas ao endotélio íntegro. Por outro lado, quando ocorre disfunção, as células endoteliais começam exercer efeitos diferentes ou até mesmo opostos aos de natureza fisiológica (GALLEY, WEBSTER, 2004).
Essas alterações estão ligadas diretamente às funções desempenhadas pelo endotélio, como o desequilíbrio entre a produção de substâncias vasodilatadoras e vasoconstritoras, onde componentes vasoconstritores estão aumentados em relação aos vasodilatadores, caracterizando a disfunção endotelial. Deste modo, fatores que estão envolvidos na vasodilatação, como o óxido nítrico, parece ter a sua biodisponibilidade prejudicada (LESNIEWSKI, DONATO, BEHNKE, WOODMAN, LAUGHLIN, RAY, DELP, 2008).
Humanos com hipertensão essencial (HIGASHI, SASAKI, KURISU, YOSHIMIZU, SASAKI, MATSUURA, KAJIYAMA, OSHIMA, 1999) e ratos espontaneamente hipertensos (SHR) (GRAHAM, RUSH, 2004; SEKIGUCHI, YANAMOTO, SUNANO, 2004) exibem prejuízos na vasodilatação dependente do endotélio comparados com controles normais. Essa menor vasodilatação parece ser devido, em partes, a uma disfunção endotelial, a qual esta associada em maior grau à menor biodisponibilidade de NO (GONZALES, CARTER, KANAGY, 2000). Porém, o comprometimento da função vasomotora mediada pelo endotélio pode ser resultado de uma ou três maiores determinantes da biodisponibilidade de NO como: a produção endotelial pela enzima óxido nítrico sintase endotelial (eNOS) (SCHMIDT, ALP, 2007), a sensibilidade do músculo liso ao NO (GERASSIMOU, KOTANIDOU, ZHOU, SIMOES, ROUSSOS, PAPAPETROPOULOS, 2007) e/ou desativação do NO pela interação com as espécies reativas de oxigênio (GONGORA et al., 2006).
4.3. Oxido nítrico sintases
Três isoformas distintas desta enzima têm sido identificadas, produtos de três genes diferentes, com diferente localização, regulação, propriedade catalítica e sensibilidade a inibidores. São nomeadas como: nNOS (também conhecida por tipo I, NOS-I e NOS 1) predominante em tecido neuronal; iNOS (tipo II, NOS-II, NOS-2) é induzível em várias células e tecidos tais como: macrófagos, leucócitos polimorfonucleares, endotélio, músculo liso vascular, fígado e baço; e eNOS, (tipo III, NOS-III, NOS-3), a qual foi descoberta na célula endotelial. As nNOS e eNOS são expressas de maneira constitutivas e são dependentes de cálcio (Ca2+) e a iNOS é
induzível e independente de cálcio (ALDERTON, COOPER, KNOWLES, 2001). Em humanos, além da expressão da eNOS nas células endoteliais, ela é descrita também nas células musculares lisas e músculo cardíaco, trato reprodutivo e cérebro , enquanto a nNOs é expressa em cérebro, medula espinhal, gânglios simpáticos, nervos periféricos, pâncreas e células epiteliais, mostrando sua importância pela vasta gama de funções e localizações (ALDERTON, COOPER, KNOWLES, 2001; HARRISON et al., 2006). A eNOS por ser expressa em maior quantidade nas células endoteliais será estudada com mais ênfase.
A eNOS está situada principalmente na região das cavéolas da célula endotelial, como já dito anteriormente, representando o estado inativo quando ligada à proteína calveolina, principalmente a calveolina-1, quando ocorre aumento na concentração de cálcio intracelular estimula a ligação cálcio/calmodulina e favorece a dissociação da eNOS com a calvelina e subseqüente produção de NO (GRATTON, BERNATCHEZ, SESSA, 2004).
a saída de dois fosfatos da guanosina trifosfato (GTP), aumentando os níveis de guanosina monofosfato cíclico (GMP cíclico). A ativação de proteínas quinases dependentes de GMP cíclico acarretam em redução na concentração de Ca2+ intracelular através da saída de Ca2+ da célula (sequestro para o retículo sarcoplasmático), diminuição na entrada do Ca2+ e até mesmo redução na sensibilidade de proteínas contráteis ao Ca2+. Representando o conjunto de fatores
que promovem o relaxamento dos vasos sanguíneos por mecanismos relacionados à via NO-GMP cíclico (WALSH, KARGACIN, KENDRICK-JONES, LINCOLN, 1995).
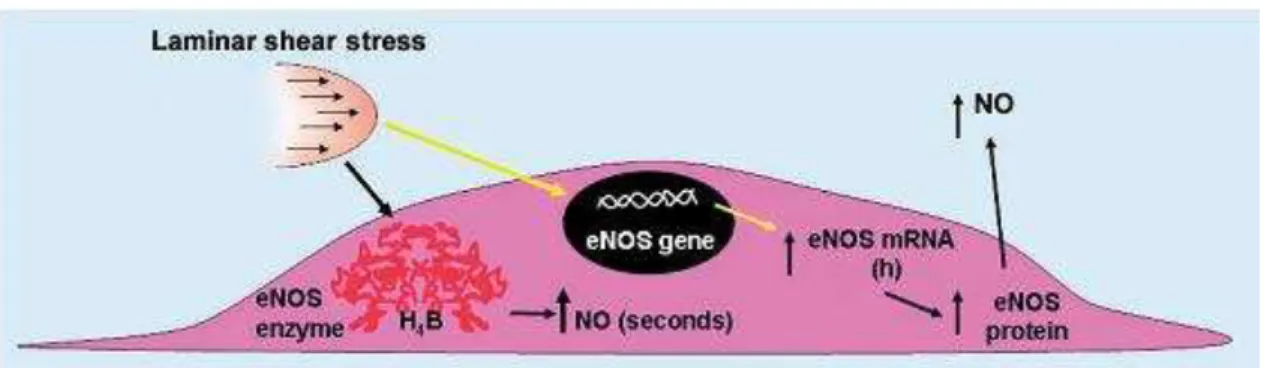
Vários estímulos contribuem para a produção de óxido nítrico no vaso, dentre eles forças hemodinâmicas podem contribuir para a produção basal de NO pela ativação da eNOS, como o shear stress (estresse de cisalhamento do sangue na parede do vaso) e o estresse circunferencial na parede do vaso, frequentemente chamado de stretch, ou seja, o efeito da pressão na parede arterial. Ainda não se sabe quais mecanismos que envolvem a produção de NO a partir destes estímulos, entretanto especula-se que seja via aumento do cálcio intracelular (FALCONE, KUO, MEININGER, 1993; AYAJIKI, KINDERMANN, HECKER, FLEMING, BUSSE, 1996; TRONC, WASSEF, ESPOSITO, HENRION, GLAGOV, TEDGUI, 1996).
A ativação da eNOS e produção de NO pelo shear stress (laminar) pode ocorrer, com o aumento agudo do shear stress, o qual a eNOS é ativada e produz NO agudamente por um aumento transiente da concentração de Ca2+ intracelular e fosforilação da eNOS, com estímulos constantes esta produção ainda é continuada mesmo quando os níveis de Ca2+ nas células endoteliais retornam ao basal. Esta
FIGURA 1 – Efeito do Shear Stress unidirecional e laminar na síntese de óxido nítrico endotelial. eNOS; óxido nítrico síntase endotelial, NO; óxido nítrico, mRNA; ácido ribonucléico mensageiro.(Adaptado de Harrison, Widder et al., 2006).
Uma outra forma de estimular a eNOS no vaso e muito usada em protocolos da reatividade vascular in vitro para testar a integridade do endotélio é a acetilcolina, pois é um vasodilatador dependente do endotélio e estimula a eNOS pelo aumento da concentração de cálcio também, e desencadeia a sequência de mecanismos descritos acima, os quais caracterizam a função da eNOS em células endoteliais íntegras (FURCHGOTT, ZAWADZKI, 1980; GONZALES, CARTER, KANAGY, 2000).
4.4. Espécies reativas de oxigênio e nitrogênio (EROs e ERNs)
O organismo sofre ação constante de EROs e ERNs geradas em processos inflamatórios, por alguma disfunção biológica ou provenientes da alimentação, agindo na manutenção dos sistemas em geral. São caracterizadas geralmente como radicais livres por sua alta reatividade biológica, pois algumas delas apresentam um ou mais elétrons não pareados no último orbital atômico ou molecular, entretanto, nem todas tem esta característica onde as tornam mais estáveis, e menos prejudiciais ao organismo (FERREIRA, MATSUBARA, 1997).
As principais EROs produzidas no vaso são : superóxido (O2·_), peróxido de
hidrogênio (H2O2), radical hidroxila (OH.) e as consideradas também ERNs,
peróxniitrito (ONOO-), NO, nitritos (NO
2-) e nitratos (NO3-) (TOUYZ, SCHIFFRIN,
2004).
provocarem danos oxidativos irreversíveis aos lipídios, proteínas e DNA. No entanto, atualmente, existem evidências de que as EROs não são apenas lesivas às células mas que apresentam papel na função celular normal, por meio da regulação de vias de sinalização que regulam a expressão gênica e a síntese protéica, entre outras funções (GRIENDLING, SORESCU, LASSEGUE, USHIO-FUKAI, 2000).
Em condições normais, as EROs produzidas não se acumulam nas células, pois são continuamente eliminadas pela ação de antioxidantes enzimáticos, como a superóxido desmutase (SOD), catalase (CAT) e glutationa peroxidase (GPx) e não enzimáticos como vitaminas C e E e peptídeos. No entanto, quando ocorre um desbalanço entre as taxas de produção e de eliminação de EROs, pode ocorrer um acúmulo de EROs nas células, o que resulta no estado de estresse oxidativo (LI, SHAH, 2004).
Por serem subprodutos do metabolismo do O2 estão envolvidas em todo
sistema biológico, tendo sua formação por meio da mitocôndria e/ou por fontes enzimáticas como: NAD(P)H oxidases, xantina oxidases, lipogenases e oxido nítrico sintases e são formadas em um processo de oxiredução com a redução univalente do oxigênio na presença de um elétron livre (e-), como um dos produtos primários, o superóxido (O2-). Este radical é capaz de reagir com outros e desencadear uma série
de reações, em uma delas ele é oxidado quando interage com o óxido nítrico produzindo ONOO-, o qual é altamente reativo e danoso quando em alta concentrações. Quando ocorre esta reação, a função vasodilatadora do NO é prejudica (LI, SHAH, 2004; GONGORA et al., 2006).
O superóxido também pode ser reduzido formando o peróxido de hidrogênio (H2O2) por meio da ação da superóxido dismutase (SOD) e por sua vez o H2O2 pode
4.5. Síntese e biodisponibilidade de NO na hipertensão arterial
Como dito anteriormente, o shear stress laminar atua no aumento da atividade e expressão da eNOS, pois é uma força de arraste unidirecional comum em vasos saudáveis. Por outro lado, vasos com a função vasomotora comprometida sendo modulado por um shear stress oscilatório, ou seja, turbilhonado, provoca efeitos deletérios ao vaso, porém estes efeitos e mecanismos de sinalização ainda não estão bem definidos na literatura e serão discutidos a seguir (LAURINDO, PEDRO MDE, BARBEIRO, PILEGGI, CARVALHO, AUGUSTO, DA LUZ, 1994; DE KEULENAER, CHAPPELL, ISHIZAKA, NEREM, ALEXANDER, GRIENDLING, 1998). Alguns estudos mostram que há um aumento na atividade e expressão da eNOS em vasos de ratos espontaneamente hipertensos e na hipertensão induzida , onde estes também demonstram aumento das espécies reativas de oxigênio no vaso . Entretanto, este fato não coincide com a biodisponibilidade aumentada de NO (DOBRIAN, DAVIES, SCHRIVER, LAUTERIO, PREWITT, 2001; GRAHAM, RUSH, 2004).
Sabe-se que a biodisponibilidade de NO não depende somente de sua produção e que depende também de sua desativação pelas EROs, especificamente o superóxido (O-2) que, no caso, parece ter uma produção aumentada nesta
patologia (ZALBA, BEAUMONT, SAN JOSE, FORTUNO, FORTUNO, ETAYO, DIEZ, 2000).
O peróxido de hidrogênio (H2O2) pode explicar em partes o aumento da
expressão da eNOS na hipertensão, pois é um importante intermediário na produção de NO em resposta ao shear stress, onde agudamente o aumento de H2O2 parece
estar associado a maior atividade da eNOS (CAI, LI, DAVIS, KANNER, HARRISON, DUDLEY, 2003). Este fato talvez seja uma forma de sinalização celular co o intuito de adaptar o fluxo às condições de equilíbrio (HARRISON et al., 2006).
Outro fato importante que também se refere à eNOS com maior atividade na hipertensão é o desacoplamento desta enzima. A falta do cofator tetrahidrobiopterina (BH4), torna a eNOS desacoplada, a qual produz superóxido ao invés de NO,
esteja com a sua atividade ou expressão aumentada não terá o óxido nítrico como produto final (MITCHELL, DORRANCE, WEBB, 2003; ZHENG, YANG, LOOKINGLAND, FINK, HESSLINGER, KAPATOS, KOVESDI, CHEN, 2003; SCHMIDT, ALP, 2007).
Por outro lado, há trabalhos que encontram a expressão ou atividade da eNOS diminuída ou sem alterações na hipertensão, alguns estudos mostram que este mecanismo de adaptação à patologia parece também estar associado ao aumento do estresse oxidativo no vaso, porém o exato mecanismo ainda não é claro, o que se sabe é que esta ligado diretamente à síntese do NO pela interrupção de sinais de transdução de receptores endoteliais, como a defosforilação ou fosforilação de sítios específicos da enzima, responsáveis pela produção de NO , sendo que estes fatores podem também depender do estágio da doença (NEWAZ, YOUSEFIPOUR, NAWAL, ADEEB, 2003; GONGORA et al., 2006).
Pesquisas realizadas com inibidores da eNOS como NAME, NMMA, L-NA, L-NAA , 7-NI e NIO, onde participam como análogos à L-arginina, competindo com o substrato na produção de NO, demonstram que a administração aguda destes inibidores causam aumento da pressão arterial de longa duração, mostrando mais uma vez a importância desta enzima e a produção de NO na hipertensão (ALDERTON, COOPER, KNOWLES, 2001).
4.6. Produção das EROs no vaso
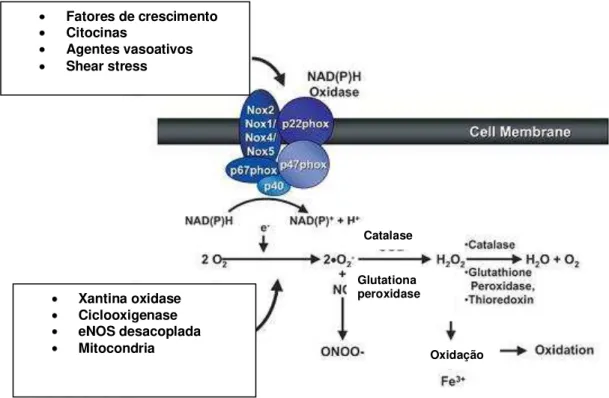
Dentre as fontes capazes de produzir EROs no vaso, estudos mostram que o complexo enzimático NAD(P)H oxidase é predominante e esta presente nas células endoteliais, adventícias e célula muscular lisa. A NAD(P)H oxidase é originalmente descrita em fagócitos, mas está claramente estabelecido que também é importante funcionalmente em não fagócitos (BABIOR, LAMBETH, NAUSEEF, 2002; LYLE, GRIENDLING, 2006).
Ela é composta por 5 subunidades, onde originalmente tem 2 subunidades localizadas na membrana plasmática (gp91phox, subunidade catalítica, e p22phox) e 3 subunidades citosólicas (p47phox, p67phox e p40phox), que em situações basais não interagem com as subunidades de membrana. Além destas, um componente adicional, a Rac, uma proteína de pequeno peso molecular. Na estimulação de um agonista, a p47phox é fosforilada, a qual interage com a p22phox facilitando a translocação da membrana, levando à atividade catalítica. (LEUSEN, VERHOEVEN, ROOS, 1996; BABIOR, LAMBETH, NAUSEEF, 2002).
Foi recentemente descoberto que a subunidade catalítica, gp91phox é mais um membro de uma família de homólogos denominados NOX. Deste modo, também são expressas nas células vasculares, NOX1, NOX4 e NOX5, além da gp91phox, conhecida como NOX2 (BANFI, MATURANA, JACONI, ARNAUDEAU, LAFORGE, SINHA, LIGETI, DEMAUREX, KRAUSE, 2000).
A NOX1 é expressa em baixos níveis nas células vasculares, e pelo contrário, a NOX4 é altamente expressa, Já a NOX5 é encontrada somente nas células vasculares de humanos. É importante ressaltar que a expressão de múltiplos homólogos desta subunidade com diferentes regulações e localizações sugerem que estas oxidases têm distintas funções (LYLE, GRIENDLING, 2006).
Como uma multisubunidade enzimática a NAD(P)H oxidase catalisa a produção de O2- por um elétron de oxigênio reduzido usando o substrato NAD(P)H
como doador do elétron: 2 O2 + NAD(P)H 2 O2- + NAD(P)H + H+ (TOUYZ,
SCHIFFRIN, 2004).
Os estímulos para a produção de O2- no vaso pela NAD(P)H oxidase podem
stress, onde a tornam uma enzima constantemente ativa, produzindo superóxido intracelular em baixas e sustentáveis concentrações (DE KEULENAER et al., 1998; LI, SHAH, 2004; LI, WHEATCROFT, FAN, KEARNEY, SHAH, 2004).
FIGURA 2 – Produção de espécies reativas de oxigênio em células vasculares. H2O:
água; O2: oxigênio; H2O2: peróxido de hidrogênio; ONOO-:
peroxinitrito; Fe: Ferro; OH. : radical hidroxila; SOD: superóxido
desmutase.(Adaptado de Touyz e Schiffrin, 2004)
4.7. Produção das EROs na hipertensão
Grande corpo de evidências na literatura demontram que a NAD(P)H oxidase está com a sua atividade aumentada em hipertensos, contribuindo para ambos, elevação da pressão arterial e disfunção endotelial sugerindo que as EROs têm um papel fisipatológico importante no desenvolvimento da hipertensão (CHEN et al., 2001; LI et al., 2004). Não só a atividade da NAD(P)H oxidase como também a expressão de suas subunidades é aumentada em ratos hipertensos, demonstrando que há um efeito crônico da hipertensão nesta enzima (ULKER, MCKEOWN, BAYRAKTUTAN, 2003).
Xantina oxidase Ciclooxigenase eNOS desacoplada Mitocondria
Fatores de crescimento Citocinas
Agentes vasoativos Shear stress
Catalase
Glutationa peroxidase
Envolvendo condições patológicas, o aumento da produção das EROs pela NAD(P)H oxidase leva à disfunção endotelial, crescimento e apoptose da célula muscular lisa, migração de monócitos e peroxidação lipídica, onde todos esses processos contribuem para o prejuízo vascular na hipertensão (TOUYZ, SCHIFFRIN, 2004).
Além da NAD(P)H oxidase, existem outras fontes de espécies reativas de oxigênio como, mitocondia, a qual libera as EROs como escape no metabilismo oxidadtivo e xantina oxidase , onde é ativada pelo processo de isquemia/reperfusão dentre outras fontes. Apesar de ocorrer produção de EROs na célula endotelial por estas fontes também a mais abundante produção no vaso é a partir da NAD(P)H oxidase (LI, SHAH, 2004)
Um dos radicais mais envolvidos na patogênese da hipertensão é o anion superóxido por estar diretamente ligado aos mecanismos de vasodilatação e vasoconstrição ao destivar o NO tirando sua ação vasodilatadora e diminuindo sua biodisponibilidade (SEKIGUCHI, YANAMOTO, SUNANO, 2004).
Estudos mostram que o ãnion superóxido esta associado a prejuízos na vasodilatação via óxido nítrico, porém a diversidade entre metodologias dificulta o entendimento de como O-2 esta atuando na hipertensão (ULKER, MCMASTER,
MCKEOWN, BAYRAKTUTAN, 2003; SEKIGUCHI, YANAMOTO, SUNANO, 2004).
4.8. Remoção das EROs no vaso (papel dos sistemas antioxidantes na HA)
As células estão constantemente produzindo EROs como parte de processos metabólicos, sendo neutralizadas por sistemas antioxidantes que são constituídos por enzimas como: catalase (CAT), superóxido dismutase (SOD), glutationa peroxidase (GPx) e numerosos antioxidantes não enzimáticos, incluindo vitaminas C, A e E , glutationa, ubiquinone e flavonóides. Para que não haja um desequilíbrio redox no vaso é importante o equilíbrio entre a produção e a remoção das EROs, com auxílio dos sistemas antioxidantes (URSO, CLARKSON, 2003).
(GSH) por meio da enzima glutationa peroxidase, onde a relação GSSG/GSH se torna também um marcador de estresse oxidativo muito usado (LI, SHAH, 2004).
Já foi demonstrado que a depleção de glutationa no vaso prejudica a vasodilatação induzida por acetilcolina, parecendo estar relacionada com a biodisponibilidade de NO (FORD, GRAHAM, DENNISS, QUADRILATERO, RUSH, 2006). Por outro lado Ulker et. al. (2003), observou um aumento nos níveis de mRNA da GPx sem aumento da sua atividade em ratos SHR associado à diminuição da vasodilatação.
Uma outra enzima participativa nos sistemas antioxidativos por eliminar H2O2
é a catalase, pois parece não estar alterada em ratos SHR, pois quando incubada antes da infusão de doses crescentes de ACh parece melhorar o relaxamento neste modelo, demonstrando que o prejuízo na vasodilatação pode ser de alguma forma associado ao H2O2 também(ULKER et al., 2003).
Apesar de esses antioxidantes fazerem parte do processo oxidativo do vaso, a enzima que está mais diretamente ligada a função motora do vaso é a SOD. A SOD é responsável pela desativação do superóxido, formando H2O2 que por sua vez
é parcialmente eliminado pela catalase e glutationa peroxidase (LI, SHAH, 2004). A SOD corresponde a uma família de enzimas com diferentes grupos protéicos em sua composição. Nos sistemas eucariontes existem três formas de SOD. A forma SOD cobre-zinco (Cu/ZnSOD) é predominante no citoplasma das células endotéliais e é regulada principalmente pelo shear stress (INOUE, RAMASAMY, FUKAI, NEREM, HARRISON, 1996). A SOD manganês (MnSOD) é mitocondrial, pode ser induzida por fatores de crescimento e a ecSOD que representa 30% a 50% do total de SOD no tecido vascular, pois é a isoforma que regula a bioatividade extracelular do NO (DIDION, RYAN, DIDION, FEGAN, SIGMUND, FARACI, 2002; LI, SHAH, 2004).
Camundongos deficientes de ecSOD têm maior indução de hipertensão por angiotensina II do que camundongos normais demonstrando o envolvimento desta enzima na função vascular (GONGORA et al., 2006).
a disfunção endotelial é provocada pelo aumento do superóxido neste estudo e não pelo prejuízo na defesa antioxodante (ULKER et al., 2003). Em contrapartida humanos com hipertensão essencial, apresentem menor capacidade antioxidante em relação aos indivíduos normotensos (RUSSO, OLIVIERI, GIRELLI, FACCINI, ZENARI, LOMBARDI, CORROCHER, 1998). Entretanto, metodologias distintas, dificultam o entendimento dos mecanismos envolvidos.
Alguns estudos mostram haver eficácia no tratamento com antioxidantes, porém existem ainda muitas controversas de como e qual realmente é a regulação antioxidante no vaso de hipertensos e consequentemente qual o melhor tratamento. A atividade e expressão destas enzimas parecem depender da idade e níveis de hipertensão, gênero, entre outras variáveis como forma de tratamento e tipos de hipertensão, todavia o sistema antioxidante não é composto somente de enzimas e também de antioxidantes não enzimaticos, em que estes parecem ter eficácia no tratamento, da disfunção endotelial (ULKER, MCKEOWN, BAYRAKTUTAN, 2003).
Contudo a regulação da atividade antioxidante depende do estado redox do vaso na hipertensão e qual mecanismo leva a estas alterações. Cada etiologia da doença tem características e mecanismos moleculares diferentes que causam adaptações distintas. A suplementação com antioxidante não enzimático, mesmo com demonstração de eficácia, ainda não é recomendada para prevenção ou tratamento da hipertensão, pois foi demonstrado em uma triagem feita com o consumo de frutas e vegetais de hipertensos que a alimentação consegue suprir estas deficiência com redução da pressão arterial (JOHN, ZIEBLAND, YUDKIN, ROE, NEIL, 2002; TOUYZ, 2004).
4.9. Exercício físico aeróbio na hipertensão
Muitas formas de tratamento estão sendo estudadas a fim de minimizar ou retardar os efeitos deletérios da hipertensão arterial, mas ainda não é bem estabelecido qual realmente seria o melhor tratamento (GHIADONI et al., 2003). Para isso, é necessário um melhor entendimento dos mecanismos e alterações causados por tratamentos e situações diferenciados.
Dentre os diferentes tratamentos, o treinamento físico aeróbio parece ter efeitos positivos, onde estudos clínicos já têm mostrado esta resposta positiva do exercício não só em hipertensos, mas também envolvendo outras patologias que trazem prejuízos ao sistema cardiovascular, como diabetes e hipercolesterolemia (JEN, CHAN, CHEN, 2002b; GREEN, MAIORANA, O'DRISCOLL, TAYLOR, 2004).
Em humanos a resposta pressórica após uma sessão de exercício é diminuída em relação pressão arterial basal de indivíduos saudáveis, caracterizando a hipotensão pós-exercício (FORJAZ, MATSUDAIRA, RODRIGUES, NUNES, NEGRAO, 1998). O mesmo acontece em hipertensos, sendo de grande importância para estes indivíduos, pois sabe-se que este fato traz menor sobrecarga cardíaca e renal, já que estes indivíduos podem desenvolver patologias decorrente das sobrecargas de pressão e metabólica constantes à estes órgãos (FORJAZ, TINUCCI, ORTEGA, SANTAELLA, MION, NEGRAO, 2000)
Talvez esta resposta pressórica diminuída seja decorrente de mecanismos como maior sensibilidade aos estímulos vasodilatadores após uma sessão de exercício (JEN, CHAN, CHEN, 2002a). Parece que uma única sessão de exercício aeróbio pode aumentar a vasodilatação possivelmente por aumentar a liberação de NO em aorta de ratos saudáveis, além de atenuar a vasoconstrição (BECHARA, TANAKA, SANTOS, JORDAO, SOUSA, BARTHOLOMEU, RAMIRES, 2008).
Entretanto há dúvidas se essa melhora é devido há produção aumentada de NO pela maior atividade da eNOS ou por outros mecanismos intrínsecos do vaso, como sensibillidade ao NO ou até mesmo ação de outras vias que participam da vasodilatação (GREEN et al., 2004). Sabe-se que o estresse de cisalhamento agudo na parede do vaso pode causar aumento das EROs no vaso e no exercício agudo ocorre aumento do estresse de cilhamento pelo aumento da demanda energética, a qual necessita de aumento do debito cardíaco , desta forma podemos descartar a possíbilidade da diminuição da interação do superóxido com o óxido nítrico após uma sessão aguda de exercício. (LAURINDO et al., 1994).
A resposta aguda ao exercício aeróbio na hipertensão tem grande importancia, porém não tem implicações diretas ao tratamento, por apresentar alterações transitórias. Por outro lado, parece que a soma de várias sessões de exercício e estímulos subseqüentes, onde caracteriza o treinamento físico, causam adaptações mais duradouras e diferenciadas, diminuindo ainda mais a sobrecarga aos órgãos alvo (DELP, LAUGHLIN, 1997; LEE, KIM, KIM, CHO, JOO, LEE, LEE, PARK, JEON, 2009).
Desta forma, após um período de treinamento físico aeróbio de intensidade moderada em humanos, ocorre melhora na vasodilatação em sujeitos saudáveis e individuos com hipertensão essencial, onde essa resposta em hipertensos é associada à queda dos níveis de pressão arterial (HIGASHI et al., 1999). Também parece melhorar o relaxamento vascular induzido por ACh em ratos hipertensos e paralelamente aumentar a biodisponibilidade de óxido nítrico (GRAHAM, RUSH, 2004).
Um dos motivos pelo qual o exercício aumenta a vasodilatação na hipertensão é o estímulo do shear stress (HARTMANNSGRUBER, HEYKEN, KACIK, KAISTHA, GRGIC, HARTENECK, LIEDTKE, HOYER, KOHLER, 2007). Pelo aumento da necessidade energética durante o exercício, há um aumento do fluxo sanguíneo e conseqüentemente do débito cardíaco fazendo com que este aumento do fluxo ative receptores endoteliais na parede do vaso aumentando a concentração de cálcio, assim proporcionando síntese de óxido nítrico pela ação da eNOS via cálcio dependente, como já citado (JEN, CHAN, CHEN, 2002a).
Por outro lado, já foi demonstrado que o aumento do fluxo, ou seja, o aumento do shear stress também aumenta a produção de espécies reativas de oxigênio pela ativação da NAD(P)H oxidase no vaso como já citado, mas parece que a soma de varias sessões agudas provocam adaptações como, aumento nos fatores de transcrição e expressão das eNOS, promovendo equilíbrio do estado redox do vaso do rato hipertenso, como forma de regulação deste meio (LAURINDO et al., 1994; DE KEULENAER et al., 1998).
Outro fator importante a respeito do shear stress é de qual é a sua natureza, se oscilatório ou laminar, podendo causar adaptações diferentes. O estímulo do shear stress laminar, ocorre no momento do exercício com períodos de recuperação proporcionando a adaptação do vaso após a sessão, contraditório é o shear stress oscilatório que é constante em hipertensos, pois parece ocorrer pela obstrução do vaso causada por aumento na vasoconstrição, sem períodos de adaptação, desta forma causando efeitos deletérios (HARRISON et al., 2006).
As adaptações que causam a diminuição da pressão arterial em resposta ao treinamento físico em hipetensos podem estar relacionadas não só com os controle das células endoteliais quando se observa os seus mecanismos de controle nos sistemas orgânicos em geral. Pesquisas desenvolvidas com humanos desmontram que o sistema nervoso simpático também é responsável por esta queda na pressõ arterial (RONDON, LATERZA, DE MATOS, TROMBETTA, BRAGA, ROVEDA, ALVES, KRIEGER, NEGRAO, 2006). Porém ao se tratar de um estudo in vitro com vasos isolados, não podemos descartar estas outras evidências.
realmente o aumento da biodisponibilidade de óxido nítrico com o treinamento físico e se esse aumento é devido a maior produção de NO. melhor capacidade antioxidante ou menor produção de EROs no vaso. Entretanto, estas resposta são influenciadas e podem variar com o período de treinamento e intensidade do exercício.
5. MATERIAIS E MÉTODOS
5.1. Amostragem
Foram estudados 20 ratos machos Wistar (WKY) e 20 ratos espontaneamente hipertensos (SHR), um modelo genético caracterizado por altos valores de pressão arterial (OKAMOTO, AOKI, 1963). Os ratos foram mantidos em caixas plásticas (3 ratos por caixa) em uma sala com temperatura controlada (22°C), com ciclo claro/escuro invertido de 12:12h. O peso inicial dos ratos foi de 250 a 300 g.
5.2. Desenho experimental
Inicialmente, todos os ratos foram submetidos individualmente ao teste de esforço máximo em esteira rolante para determinação do consumo de oxigênio pico (VO2pico) e tolerância ao esforço. Em dias separados foi determinada a pressão
arterial diastólica (PAD), sistólica (PAS) e média (PAM) e freqüência cardíaca (FC) de repouso, pelo método de pletismografia da artéria caudal.
Após o período de treinamento físico (TF) foi realizado novamente o teste de esforço máximo, a determinação da pressão arterial (PAD, PAS e PAM) e freqüência cardíaca de repouso.
Após 48hs da última sessão de treino, os ratos foram sacrificados para retirada dos tecidos, onde dois anéis da aorta torácica de cada rato foram utilizados imediatamente para o protocolo de reatividade vascular e os anéis restantes congelados para posteriores análises bioquímicas. O esquema experimental esta representado na figura abaixo.
5.3. Sequência experimental
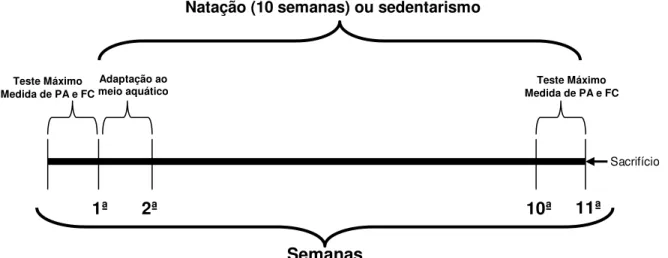
A Figura 3 ilustra a sequência dos procedimentos experimentais.
FIGURA 3 - Esquema experimental. PA: pressão arterial; FC: freqüência cardíaca.
1ª 2ª 10ª 11ª
Semanas
Natação (10 semanas) ou sedentarismo
Teste Máximo Medida de PA e FC
Sacrifício
Adaptação ao meio aquático Teste Máximo
5.4. Protocolos experimentais
5.4.1. Determinação do consumo de oxigênio de pico (VO2pico)
Todos os ratos foram submetidos a um teste de esforço máximo em esteira rolante, utilizando-se um protocolo com incremento progressivo de carga de 3m/min a cada 3 min, até a exaustão, adaptado de Brooks e White (1978), para a determinação das variáveis: VO2pico, velocidade máxima e tempo e distância
percorrida.
No protocolo de consumo de oxigênio, os ratos correram na esteira dentro de uma caixa metabólica, que serve como câmara de mistura dos gases expirados. O fluxo de ar dentro da caixa é unidirecional e mantido em 3.500 mL/min por bomba de vácuo. Amostras de ar foram retiradas e analisadas para determinação das frações de O2 e CO2.
Os valores de VO2 e VCO2 foram calculados pela fórmula (BROOKS, WHITE,
1978):
Onde:
VO2 = ml.g-¹.min-1
Fluxo de ar = 3.500 mL/min
FiO2 = fração de oxigênio inspirada (ar ambiente)
FeO2 = fração de oxigênio expirada (caixa de mistura)
Peso corporal = g
5.4.2. Protocolo de medida da pressão arterial caudal
A pressão arterial foi aferida pelo método não invasivo de pletismografia da artéria caudal (registro indireto da pressão), onde os ratos foram colocados individualmente em caixa de acrílico e mantidos sob restrição de movimentos, a temperatura dentro da caixa de acrílico foi aumentada com o intuito de aumentar a temperatura corporal do animal e promover vasodilatação da artéria caudal. O registro da pressão arterial de cauda foi realizado por meio da colocação de manguito de borracha na região proximal da cauda e ligado ao esfigmomanômetro para insuflar e desinsuflar gradualmente o manguito entre 0 e 250/300 mmHg.
Numa porção mais distal da cauda foi acoplado um transdutor pneumático para detecção dos sinais de passagem da onda de pulso de pressão arterial e registrado no sistema AT/CODAS (DataQ Instruments, Inc., Ohio, USA), com freqüência de amostragem de 1000 Hz.
A pressão arterial de cauda equivale à pressão do manguito em que o pulso de pressão desaparece ou reaparece, quando a pressão exercida sobre a cauda tornar-se ligeiramente menor que o valor da pressão intra-arterial, desobstruindo o fluxo sangüíneo na artéria caudal é permitido a detecção do pulso da pressão arterial sistólica . A pressão arterial diastólica foi considerada o menor valor do pulso de PA detectado. A freqüência cardíaca foi calculada a partir do intervalo de tempo de cada pulso de pressão arterial detectado pelo transdutor sem a oclusão da passagem do fluxo sangüíneo na cauda. Foram realizadas, para cada animal, cinco medidas de pressão arterial de cauda e freqüência cardíaca em repouso, sendo desprezadas a primeira e a última medidas e calculada a média aritmética entre os valores restantes.
5.4.3. Protocolo de treinamento físico aeróbico
aeróbico moderado (MEDEIROS, OLIVEIRA, GIANOLLA, CASARINI, NEGRAO, BRUM, 2004).
Inicialmente, todos os ratos foram adaptados ao ambiente aquático, 5 vezes por uma semana sem carga acoplada à cauda, onde a duração das sessões foram de 30, 40, 50, 60 e 60 respectivamente, desta forma já caracterizando o início do treinamento. Em seguida, foi iniciado o incremento de carga progressivo até 3% do peso corporal amarrada à cauda do animal. Os ratos foram pesados semanalmente para o ajuste da carga de treino.
5.4.4. Remoção e preparação da aorta
Após um período de 48 h da última sessão de treino, ou sedentarismo, os ratos foram sacrificados com alta dose de anestésico (pentobarbital). Com intuito de minimizar fatores de influência externos, foram sacrificados um rato de cada grupo no mesmo dia de experimento.
A aorta torácica foi imediatamente retirada e dissecada em uma placa de petri contendo tampão Krebs-Henseleit (em mM: NaCl=115; KCl=4,7; MgSO4=1,2; KH2PO4=1,5; NaHCO3=25; CaCl2 =2,5; glicose=11,1 e pH=7,4) para a remoção dos tecidos conectivo e adiposo, e cortada em 6 segmentos de 5 mm de comprimento.
5.4.5. Estudo da reatividade vascular
Com a finalidade de se mensurar in vitro as respostas de tensão isométrica desenvolvida pelos anéis aórticos frente aos agonistas utilizados no protocolo, estes foram suspensos, através de um par de ganchos de aço inoxidável, em uma cuba de vidro para órgão isolado contendo 14 ml de solução Krebs-Henseleit (descrito anteriormente), mantidos a 37ºC e aerados com uma mistura gasosa de 95% O2 e 5% CO2 (carbogênio).
Um gancho foi fixado na parte inferior da cuba enquanto o outro gancho foi conectado a um transdutor de sinal isométrico (BIOPAC, EUA), acoplado a um computador para o registro da tensão isométrica desenvolvida pelo vaso.
Os anéis aórticos foram submetidos a uma tensão de repouso inicial de 2 gramas, e mantidos nesta tensão durante 70 minutos para que ocorra a estabilização decorrente do manuseio. Durante o período de estabilização foi feita a troca da solução Krebs 3 vezes . A 1ª e a 2ª a cada 20 minutos, com a finalidade de remover eventuais metabólitos liberados no meio, após 40 minutos de estabilização, na 3ª troca da solução de Krebs, um anel de cada rato foi pré-incubado com N-nitro-L-arginina metil-éster (L-NAME, 10-4M), um análogo ao substrato da eNOS, a L-arginina, durante 30 minutos.
Após período de incubação de 30 minutos foram realizadas as curvas concentração-efeito cumulativas ao agente vasodilatador dependente do endotélio, acetilcolina (ACh; 10-10 a 10-4 M) tanto nos anéis com L-NAME quanto nos anéis sem
o inibidor, sendo pareados.
5.4.6. Variáveis avaliadas na reatividade vascular
Para cada curva concentração-efeito foi avaliado, através da análise de regressão não-linear para curvas sigmóides (GraphPad Prism Software, San Diego, CA), o efeito máximo (Emax) frente aos agonistas vasodilatadores (responsividade), bem como a concentração molar dos agonistas que gera um efeito igual a 50% da resposta máxima vasodilatadora (EC50) (sensibilidade).
5.4.7. Homogeneização e concentração de proteína
Os anéis aórticos congelados para análises bioquímicas foram inicialmente incubados em tampão e diluição específicos para cada experimento descrito abaixo; temperatura 4ºC; pH 7,4, e então homogeneizado com pestilo sobre nitrogênio líquido. O homogenato foi centrifugado a 12.000 G em temperatura de 4ºC, durante 15 minutos. Uma parte do sobrenadante foi separada para a análise da concentração de proteína pela técnica “Bradford”, utilizando-se a albumina bovina como padrão (BRADFORD, 1976).
5.4.8. Quantificação de nitrato e nitrito vascular
de homogenatos totais de artérias (10 ul) foram analisadas. Os valores medidos de nitrato e nitrato foram corrigidos pela quantidade total de proteínas dos homogenatos (método Bradford).
5.4.9. Expressão da enzima óxido nítrico sintase endotelial e subunidades da NADPH oxidase (Western Blotting)
As aortas dos ratos foram inicialmente homogeneizadas em tampão RIPA contendo Tris-Base (20 mM), NaCl (137mM), NP-40 (1%) e Glicerol (10%). O homogenato foi centrifugado por 10 minutos à 4°C com 12000 rpm. Alíquotas do homogeneizado, de 30 g de proteína, foram diluídas em tampão de amostra contendo Tris-HCL ph 6.8 240mM, azul de bromofenol 0,02%, glicerol 40%, βmercaptoetanol 200mM e SDS 0,8%. As amostras e um padrão de bandas de pesos moleculares conhecidos (Kaleidoscope, Bio-Rad, EUA) foram aplicadas ao gel de eletroforese de poliacrilamida com SDS-PAGE 12% (Dodecilsulfato de Sódio) e submetidas à corrente elétrica contínua por 120 minutos para separação eletroforética das proteínas, o qual consiste na migração de moléculas com carga, numa solução, decorrente da aplicação de um campo elétrico no aparelho para minigel (Mini Protean).
específicos para reconhecer os anticorpos primários, sendo os mesmos conjugados com peroxidase. Após novas lavagens, a membrana foi então revelada por método quimioluminescente, (peroxidase-H2O2-luminol), utilizando-se para tal fim o kit ECL (Amersham-Pharmacia, Grã-Bretanha). Após 1 minuto de reação, em seguida a membrana foi exposta ao filme radiográfico e revelada manualmente. A expressão protéica foi determinada densitometricamente através de um software de imagem (Scion Image), pelo número de pixels de cada imagem. O mesmo procedimento foi feito simultaneamente com o anti GAPDH (Mouse polyclonal Santa Cruz Biotechnology, 1:1000) para verificar a expressão da mesma, como proteína controle, não modificável com treinamento físico e tipo de patologia estudada.
5.4.10. Medidas de espécies reativas de oxigênio- Dihidroetídio (DHE)
Primeiramente, um anel aórtico de cada animal foi emblocado em gel de congelamento (OCT) e isopentano para, posteriormente, realizar cortes (6 a 8 cortes) de 30 µm em criostato.
Após os cortes, as lâminas foram lavadas cuidadosamente com PBS e incubadas com dihidroetídeo (DHE , 3 µM) por 20 minutos a 37 ºC em ambiente úmido e protegido de luminosidade. Após o período de incubação, as lâminas foram lavadas com PBS pH 7,4 novamente e a análise foi feita em microscópio de fluorescência confocal (modelo Axiovert 200M, Zeiss, Alemanha) com objetiva de 10x , conforme método adaptado (MILLER, GUTTERMAN, RIOS, HEISTAD, DAVIDSON, 1998).
Os derivados de oxidação da DHE geram uma coloração avermelhada, sendo proporcional à produção de espécies reativas de oxigênio, especificamente o superóxido.
A analise quantitativa das imagens foi feita por meio do programa Leica Qwin Plus, por meio da média da fluorecência emitida (µm2) de 4 a 5 aneis de cada animal.
6. ANALISES ESTATÍSTICAS
Os dados foram submetidos à análise estatística utilizando-se o programa GraphPad Prism (v. 4.00, San Diego, CA). As variáveis dependentes: massa corporal, pressão arterial (PAD, PAS e PAM) e frequencia cardíaca, VO2pico, tempo
de tolerância ao esforço, distancia percorrida, velocidade máximar e respostas vasomotoras (Emax e EC50), dados bioquímicos aórticos (expressões enzimáticas, concentrações de nitrato e nitrito e de EROs) foram submetidas a ANOVA 2 caminhos (sd x tr) e (WISTAR X SHR) e Post Hoc de Duncan. O nível crítico de significância estatística será de 5% (P<0,05). Os dados fora apresentados como média e erro padrão da média.
7. RESULTADOS
Inicialmente, serão apresentadas as características dos grupos constituídos na fase pré-treinamento físico: pressão arterial e freqüência cardíaca em repouso, massa corporal, capacidade aeróbica e tolerância ao esforço. Em seguida, serão apresentados os efeitos do protocolo de 10 semanas de treinamento físico aeróbio em natação sobre estas características, bem como sobre as respostas vasomotoras
in vitro e os parâmetros bioquímicos em aorta torácica dos ratos SHR e WKY.
7.1. Características pré-treinamento físico aeróbio em natação
7.1.1. Pressão arterial e freqüência cardíaca de repouso
PAS PAD PAM 0
50 100 150
200 WKYsd
WKYtr SHRsd SHRtr
*
*
*
#
# #
P
A
(m
m
H
g)
FIGURA 4 - Pressão arterial sistólica (PAS), pressão arterial diastólica (PAD) e pressão arterial média (PAM) dos grupos SHR sedentário (SHRsd, n=7), SHR treinado (SHRtr, n=7), WKY sedentário (WKYsd, n=7) e WKY treinado (WKYtr, n=6) na fase pré-treinamento físico. Valores expressos como média ± erro padrão. *p< 0,001 SHR vs WKY.
WKYsd WKYtr SHRsd SHRtr
0 50 100 150 200 250 300 350 400 450
F
C
(
ba
t/
m
in
)
7.1.2 Massa Corporal, capacidade aeróbica e tolerância ao esforço
Na fase pré-treinamento, a massa corporal, a velocidade máxima, a distância total e o VO2 pico foram semelhantes entre os grupos estudados (Tabela 1).
TABELA 1 - Massa corporal, distância total e VO2pico dos grupos SHR sedentário
(SHRsd, n=7), SHR treinado (SHRtr, n=7), WKY sedentário (WKYsd, n=7) e WKY treinado (WKYtr, n=6) na fase pré-treinamento físico. Valores expressos como média ± erro padrão.
7.2. Características pós-treinamento físico aeróbio de natação
7.2.1 Massa corporal e gordura intraperitonial
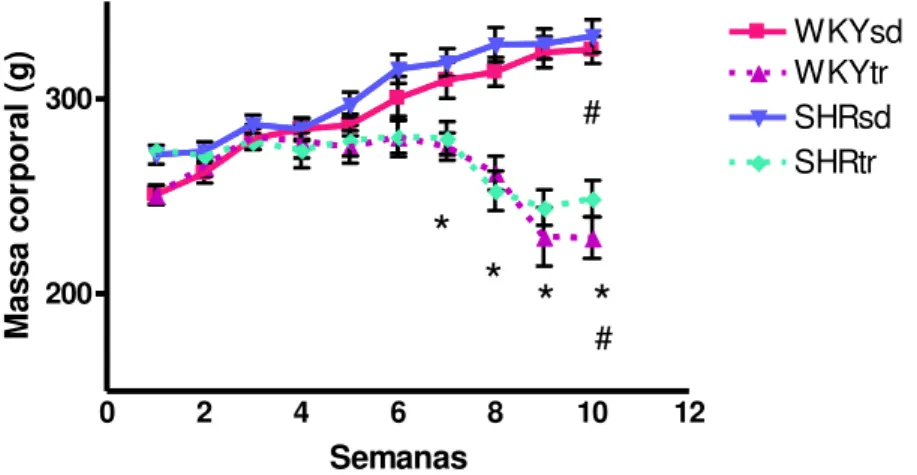
Como visto anteriormente, todos os grupos iniciaram o protocolo com a massa corporal semelhante (Tabela 1). No entanto, a massa corporal aumentou gradativamente nos grupos sedentários e, no final dos experimentos, foi significativamente maior em ambos os SHRsd e WKYsd comparados com seus respectivos grupos na fase pré-TF. Por outro lado, o protocolo de TF de natação diminuiu significativamente a massa corporal dos ratos. A partir da 7ª semana de TF, a massa corporal dos grupos SHRtr e WKYtr foi significativamente menor comparados aos grupos SHRsd e WKYsd, respectivamente (Figura 6).
Em relação à gordura intraperitonial dos ratos após o período de treinamento físico, pode-se observar menor conteúdo (corrigido pela massa corporal dos ratos) nos ratos dos grupos SHRtr e WKYtr em relação aos seus respectivos sedentários.
WKYsd WKYtr SHRsd SHRtr
Massa corporal (g)
50,88±4,85 250,73±5,03 271.45±4,86 273,91±3,79 Distância total (m)
475.45±17,40 467.30±22,08 508.02±27,79 478.43±10,35 VO2 pico (ml.kg-1./min-1)
Além disso, os ratos SHR apresentaram menor conteúdo de gordura intraperitoneal em relação aos WKY (Figura 7).
0 2 4 6 8 10 12
200 300 WKYsd WKYtr SHRsd SHRtr
*
* *
*
# # Semanas M as sa c o rp o ra l (g )FIGURA 6 - Evolução da massa corporal durante 10 semanas de treinamento físico em natação dos grupos SHRsd (n=7), SHRtr (n=7), WKYsd (n=7) e WKYtr (n=6). *p<0,005 tr vs. sd e #p<0,05 pré-TF vs. pós-TF. Dados expressos como média ± erro padrão
WKY SHR 0 10 20 sd tr
*
*
# Go rd u ra I n tr ap er it o n ia l (m g /g )7.2.2. Freqüência cardíaca e pressão arterial de repouso
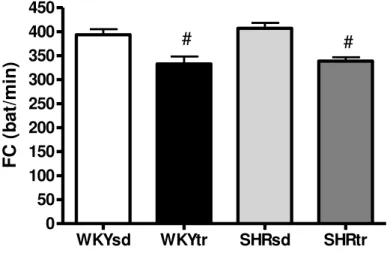
A freqüência cardíaca de repouso foi semelhante entre os grupos SHRsd e WKYsd. O treinamento físico de natação diminuiu significativamente a freqüência cardíaca em ambos os grupos WKYtr e SHRtr em relação aos grupos WKYsd e SHRsd (Figura 8).
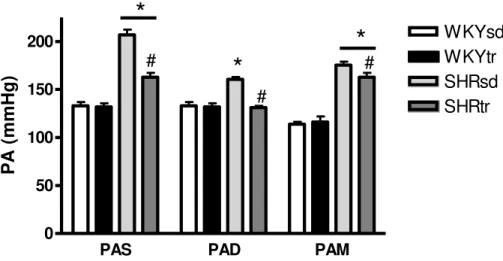
O treinamento físico de natação diminuiu significativamente a PAS, PAD e PAM no grupo SHRtr comparado ao grupo SHRsd. Entretanto, apenas a PAD do grupo SHRtr diminuiu foi normalizada (valores do WKY). Deste modo, a PAS e PAD do grupo SHRtr permaneceram significativamente maiores comparado aos grupos WKYsd e WKYtr. Além disso, o TF não modificou a PAS, PAD e PAM do grupo WKYtr comparado ao grupo WKYsd (Figura 9).
WKYsd WKYtr SHRsd SHRtr
0 50 100 150 200 250 300 350 400 450
# #
F
C
(
b
at
/m
in
)
PAS PAD PAM 0
50 100 150
200 WKYsd
WKYtr SHRsd SHRtr
*
*
*
#
# #
P
A
(m
m
Hg
)
FIGURA 9 - Pressão arterial sistólica (PAS), diastólica (PAD) e média (PAM) dos grupos SHRsd (n=7), SHRtr (n=7), WKYsd (n=7) e WKYtr (n=6) pós-treinamento físico. Dados expressos como média ± erro padrão, *p<0,05 SHR vs WKY , #p<0,05 tr vs sd.
7.2.3. Capacidade funcional e tolerância ao esforço no teste em esteira rolante
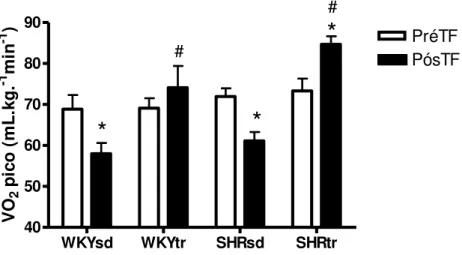
Na fase pré-TF, o VO2 pico (teste em esteira) foi semelhante entre os grupos
estudados. No entanto, na fase pós-TF, o VO2 pico diminuiu significativamente em
ambos os grupos sedentários (SHRsd e WKYsd) comparados com os grupos SHRsd e WKYsd, respectivamente, na fase pré-TF. Por outro lado, o treinamento físico de natação aumentou significativamente o VO2 pico no grupo SHRtr comparado ao
grupo SHRtr na fase pré-TF. (Figura 10).
WKYsd WKYtr SHRsd SHRtr 40 50 60 70 80 90 PréTF PósTF
*
*
*
# # VO 2 p ic o ( m L .k g . -1 m in -1 )FIGURA 10 - Consumo de oxigênio pico (VO2 pico) pré e pós o período de 10
semanas de treinamento físico dos ratos SHRsd , SHRtr , WKYsd e WKYtr. Dados expressos como média ± erro padrão *p< 0,05 vs. pré-TF e #p< 0,05 vs.sd.
WKYsd WKYtr SHRsd SHRtr 0 500 1000 1500 PréTF PósTF
*
*
*
*
# #$ D is tâ n ci a P er co rr id a (m )FIGURA 11 - Distância percorrida dos grupos SHRsd (n=7), SHRtr (n=7), WKYsd (n=7) e WKYtr (n=6) pós-treinamento físico. Dados expressos como média ± erro padrão *p<0,05 vs. pré-TF, #p<0,05 vs. sd e $p<0,05 vs. WKYtr.
7.3 Reatividade Vascular
máximo no grupo WKYtr comparado ao grupo WKYsd. Por outro lado, o treinamento físico de natação aumentou significativamente o relaxamento máximo à ACh no grupo SHRtr comparado ao grupo SHRsd. Deste modo, a relaxamento máximo à ACh não foi significativamente diferente entre o grupo SHRtr comparado aos grupos WKYsd e WKYtr (figura 12).
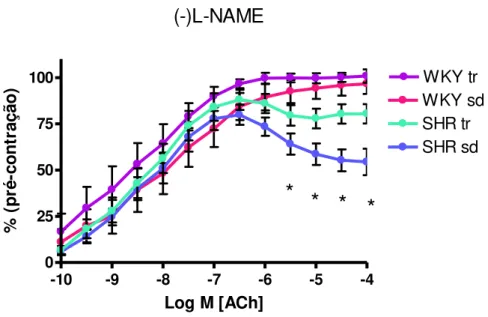
A figura 13 demonstra a curva concentração-efeito à dose crescente de ACh. Assim, pode-se observar que, em doses elevadas de ACh, o grupo SHRsd apresentou um resposta paradoxal de vasoconstrição à ACh e, portanto, em altas doses, obteve uma menor resposta vasodilatadora comparado aos grupos SHRtr, WKYsd e WKYtr. Cabe destacar, que o treinamento fisico foi eficiente em proporcionar um relaxamento à ACh significativamente maior em aortas do grupo SHRtr comparado ao grupo SHRsd.
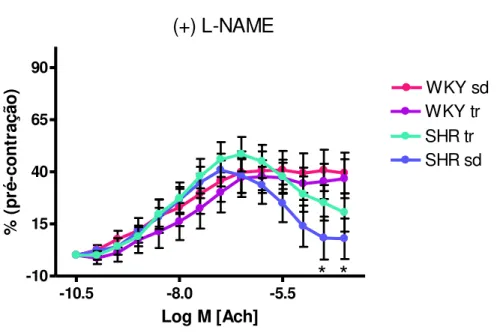
A figura 14 demonstra a curva concentração-efeito à doses crescentes de ACh, em anéis aórticos previamente incubados com L-NAME (inibidor da eNOS). Pode-se observar, que não houve diferença na resposta vasodilatadora entre os grupos em relação à resposta máxima de relaxamento. Entretanto, a diferença no relaxamento em doses altas de ACh permaneceu no grupo SHRsd vs SHRtr, WKYsd e WKYtr. O SHRtr esta igual ao WKYtr e WKYsd após a incubação com L-NAME.
A curva de relaxamento ao vasodilatador independente do endotélio, NPS, não apresentou diferença entre os grupos (Figura 15).
Emax
WKY SHR 0 25 50 75 100 125 sd Tr*
% ( p ré -c o n tr aç ão )FIGURA 12 - Resposta vasodilatadora máxima à acetilcolina em anéis aóticos (pré-contração com NE 10-7) dos grupos SHRsd (n=7), SHRtr (n=7), WKYsd (n=7) e WKYtr (n=6) pós-treinamento físico. Dados expressos com média ± erro padrão, *p<0,05 vs. WKY.
-10 -9 -8 -7 -6 -5 -4
0 25 50 75 100 WKY sd WKY tr SHR sd SHR tr
* * *
*
(-)L-NAMELog M [ACh]
% ( p ré -c o n tr aç ão )
FIGURA 13 - Curva concentração-efeito à acetilcolina (ACh, 10-10 á 10-4 M) em anéis
FIGURA 14 - Curva concentração-efeito à acetilcolina (ACh, 10-10 á 10-4 M) em anéis aórticos pré-incubados (30 min) com L-NAME dos grupos SHRsd (n=7), SHRtr (n=7), WKYsd (n=7) e WKYtr (n=6) pós-treinamento físico. Dados expressos com média ± erro padrão , *p<0,05 vs.WKY.
-12.5 -10.0 -7.5 -5.0 -2.5 -25 0 25 50 75 100 125 WKY sd WKY tr SHR sd SHR tr NPS (Emax) NPS(LogM) % ( p ré -c o n tr aç ão )
FIGURA 15 - Curva concentração-efeito ao nitropussiato de sódio (NPS, 10-11 á 10-4 M) em anéis aórticos em anéis aórticos dos grupos SHRsd (n=7), SHRtr (n=7), WKYsd (n=7) e WKYtr (n=6) pós-treinamento físico. Dados expressos como média ± erro padrão.
-10.5 -8.0 -5.5
-10 15 40 65 90 WKY sd WKY tr SHR sd SHR tr
* *
(+) L-NAME
Log M [Ach]
EMAX c/L-NAME s/L-NAME 0 25 50 75 100 WKY WKY SHR SHR * (a) % ( p ré -c o n tr a ç ã o )
Curva de Relaxamento
-10 -8 -6 -4
0 50 100 150 WKYsd SHRsd
}
}
** com L-NAME sem L-NAME (b)
Log M [ACh]
% ( p ré -c o n tr aç ão )
FIGURA 16 - Resposta vasodilatadora máxima à acetilcolina (a) e curva de relaxamento á ACh (b) em anéis aóticos pré-contraídos com noradrenalina (NE 10-7) , SHRsd (n=7) e WKYsd (n=7) com e sem pré-incubação de L-NAME. Dados expressos como média ± erro padrão, *p<0,05 vs. WKYsd sem L-NAME.
7.4 Expressões protéicas da eNOS, NOX1 e NOX4
O conteúdo protéico da enzima eNOS foi significativamente maior no grupo SHRsd comparado aos grupos WKYsd e WKYtr . O treinamento físico de natação diminuiu significativamente a conteúdo de eNOS no grupo SHRtr comparado aos grupos SHRsd, embora este conteúdo ainda permaneceu maior comparado ao grupo WKY sd e WKYtr (Figura 17).
WKY SHR 0 100 200 300 sd tr
*
E xp res são P ro téi ca eN O S -A orta (% d o c o n tr o le )FIGURA 17 - Expressão protéica da óxido nítrico sintáse endotelial (eNOS) em aorta dos grupos SHRsd (n=4), SHRtr (n=4), WKYsd (n=4) e WKYtr (n=4) pós-treinamento físico. Dados expressos como média ± erro padrão, porcentagem do grupo controle (WKYsd). *p<0,05 vs.WKYsd, WKYtr. WKY SHR 0 50 100 150 200 SD TR (a) NOX1 E xp re ss ão P ro té ic a N O X 1-Ao rt a (% d o c o n tr o le ) WKY SHR 0 100 200 300 400 SD TR * # NOX4 E xp re ss ão P ro té ic a N O X 4-Ao rt a (% d o co nt ro le ) (b)