Análise de parâmetros séricos para a
caracterização da resposta sistémica à
regeneração óssea local num modelo
experimental de osteoporose
DISSERTAÇÃO DE MESTRADO EM BIOLOGIA CLINICA LABORATORIAL
TÂNIA ALEXANDRA CARDOSO CERDEIRA
Orientador: Professor Doutor Bruno Colaço Co-orientador: Professor Doutor Pedro Gomes
Análise de parâmetros séricos para a
caracterização da resposta sistémica à
regeneração óssea local num modelo
experimental de osteoporose
MESTRADO EM BIOLOGIA CLINICA LABORATORIAL
DISSERTAÇÃO DE MESTRADO APRESENTADO POR:
TÂNIA ALEXANDRA CARDOSO CERDEIRA
Orientador Cientifico:
Professor Doutor Bruno Colaço
Universidade de Trás-os-Montes e Alto Douro, UTAD Co-orientador Científico:
Professor Doutor Pedro Gomes
Faculdade de Medicina Dentária da Universidade do Porto, FMDUP
Composição do Júri:
iii
Dissertação de mestrado em Biologia Clinica Laboratorial, submetida à Universidade de Trás-os-Montes e Alto Douro, para o cumprimento dos requisitos necessários à obtenção de grau de Mestre em Biologia Clinica Laboratorial, elaborado sob a orientação do Professor Doutor Bruno Colaço e Professor Doutor Pedro Gomes.
iv
Ao meu pai, dedico este trabalho, pois é ele a minha inspiração, para continuar a realizar os meus
v
Não poderia terminar a presente dissertação de mestrado sem prestar reconhecimento a todas as pessoas e instituições que me ensinaram, ajudaram e acompanharam ao longo da realização deste trabalho. Assim sendo, expresso os meus sinceros agradecimentos:
À Universidade de Trás-os-Montes e Alto Douro, na pessoa do seu Magnífico Reitor, Professor Doutor Carlos Alberto Sequeira, manifesto o meu reconhecimento por toda a disponibilidade e facilidade concebida durante a realização desta dissertação de mestrado.
Manifesto o meu sincero agradecimento ao Professor Doutor Bruno Colaço, Orientador Cientifico desta dissertação, pelo apoio e pela amizade incondicional que recebi. Pela leitura crítica da presente dissertação e interpretação de resultados. Por todo o incentivo, encorajamento e entusiasmo presentes durante todo o período de preparação deste trabalho. Agradeço-lhe a simpatia e a disponibilidade sempre prestada, e o entusiasmo e a dedicação que me transmitiu.
Ao Professor Doutor Pedro Gomes, Co-Orientador desta dissertação, agradeço todo o apoio prestado, motivação, incentivo e boa disposição, o meu muito obrigado.
À Professora Doutora Rita Ferreira, pela oportunidade e pela forma amiga como me acolheu na Universidade de Aveiro.
À Professora Doutora Maria João Pires pela disponibilidade sempre prestada e ajuda na análise bioquímica das amostras.
Ao Professor Doutor Jorge Colaço agradeço todo o apoio prestado no tratamento estatístico dos resultados.
De uma forma especial quero agradecer à Doutora Sara Durão toda a sua simpatia, dedicação e ajuda que prestou nas cirurgias. Sem o seu contributo não teríamos realizado com sucesso a parte experimental.
À Talita e à Carla pela ajuda na manutenção dos animais durante todo o ensaio experimental.
Ao José Carlos, agradeço a sua ajuda e alegria prestada em todas as cirurgias.
À Catarina Teixeira não posso deixar de reconhecer a simpatia e apoio no laboratório da Universidade de Aveiro.
À minha mãe, pelo esforço e sacrifício que fez para que nada me faltasse e chega-se até aqui. Pelo amor, carinho, compreensão e apoio, que nunca me faltou.
vi
Ás minhas três irmãs, que sempre me ajudaram e acarinharam. Por ouvirem os meus desabafos e desesperos, durante a elaboração deste trabalho de mestrado.
vii
RESUMO
A osteoporose é uma doença óssea metabólica caracterizada pela diminuição de densidade mineral óssea e deterioração da microarquitetura do tecido ósseo. Trata-se de uma patologia que atinge milhões de pessoas de todas as idades, e afeta ambos os sexos, mas sobretudo mulheres na fase de pós-menopausa. Este estudo tem como principal objetivo a análise de parâmetros séricos para a caracterização da resposta sistémica à regeneração óssea local num modelo de osteoporose experimental.
Neste estudo foram utilizados 64 ratos fêmeas da estirpe Wistar, dos quais 32 foram submetidos a uma ovariectomia bilateral (OVX) e os restantes sujeitos a uma cirurgia simulada (Sham). Dois meses após o primeiro procedimento cirúrgico, criou-se em todos os animais um defeito circular de 4 mm de diâmetro e espessura total, localizado no ramo da hemi-mandíbula direita. Em metade dos grupos aplicou-se sobre o defeito uma membrana de colagénio (Evolution Std, OsteoBiol®, Tecnoss, Italy), e nos restantes grupos utilizou-se a mesma membrana em conjunto com uma pasta óssea de preenchimento (Putty, OsteoBiol®, Tecnoss, Italy). Os animais foram sacrificados aos três ou seis meses, sendo recolhido soro para avaliar a atividade e expressão de diversos marcadores séricos.
Os animais dos grupos OVX apresentaram um aumento de peso corporal e uma diminuição do peso uterino, do fígado e do rim direito quando comparado com os respetivos grupos Sham. Observou-se também uma diminuição da atividade sérica da TRAP e da razão TRAP/FAT (p<0,05) nos grupos OVX. Estes resultados demonstram que a TRAP pode ser um marcador útil na osteoporose para a avaliação de mudanças no tecido ósseo. Verificamos também que a expressão CRP, IL-6 e OPN estavam aumentadas nos grupos OVX aos 3 e 6 meses em comparação com os respetivos grupos controlo. Na osteoporose pós-menopáusica, a reabsorção óssea bem como formação óssea estão aumentados, levando ao aumento de expressão da OPN, nos grupos OVX. Observamos correlações negativas entre a TRAP e os marcadores CRP (r=-0,30), IL-6 (r=-0,73) e OPN (r=-0,69). Podemos concluir que a osteoporose conduz a importantes variações na atividade sérica da TRAP e da expressão sérica da CRP, IL-6 e OPN. No entanto, diferenças no processo de regeneração local parecem não induzir alterações sistémicas significativas na atividade e expressão dos marcadores séricos estudados.
viii
ABSTRACT
Osteoporosis is a metabolic bone disease characterized by decreased bone mineral density and bone tissue microarchitectural deterioration. This pathology affects millions of people of all ages, of both sexes, but especially in postmenopausal women. The aim of this study was to analyze serum parameters to characterize the systemic response to local bone regeneration in an experimental model of osteoporosis.
In this study were used 64 female Wistar rats, of which 32 were subjected to a bilateral ovariectomy (OVX) and the remaining were submitted to a sham surgery (Sham). Two months after the first surgical procedure, was created in all animals a 4 mm diameter circle and overall thickness defect, located on the right ramus of the mandible. In half of the experimental groups, to cover this defect was applied a collagen membrane (Evolution Std, OsteoBiol®, Tecnoss, Italy), and on the remaining groups was used a combination of the same membrane with a bone paste (Putty, OsteoBiol®, Tecnoss, Italy). The animals were sacrificed at three or six months, and serum was collected to evaluate serum markers expression and activity.
The animals from the OVX groups presented an increase in body weight and a decrease in uterine, right kidney and liver weight. It was observed a decrease in TRAP activity and TRAP/FAT ratio (p<0,05) in the OVX groups. These results show that TRAP can be useful marker for detecting changes in the bone tissue status in osteoporosis. We also observed that CRP, IL-6 and OPN expression was increased in OVX groups at 3 and 6 months when compared with the respective control groups. In postmenopausal osteoporosis, bone resorption and bone formation are increased leading to higher OPN expression, in the OVX groups. We observed negative correlations between TRAP markers and CRP (r = -0.30), IL-6 (r = -0.73) and OPN (r = -0.69). We can conclude that osteoporosis leads to significant variations in the TRAP serum activity and CRP, IL-6 and OPN serum expression. However, differences in local regeneration process do not seem to induce significant systemic changes in the activity and expression of the studied serum markers.
ix
ÍNDICE
AGRADECIMENTOS ... v
RESUMO ... vii
ABSTRACT ... viii
ÍNDICE DE FIGURAS ... xii
ÍNDICE DE QUADROS ... xiv
ABREVIATURAS E SÍMBOLOS ... xv
I I.. RREEVVIISSÃÃOOBBIIBBLLIIOOGGRRÁÁFFIICCAA ... 1
1. Introdução ... 1
1.1. Tecido ósseo ... 1
1.1.1. Estrutura do tecido ósseo ... 2
1.1.2. Matriz Extracelular ... 3
1.1.3. Células do tecido ósseo ... 4
1.2. Remodelação óssea ... 6
1.2.1. Papel das citocinas pró-inflamatórias na remodelação óssea ... 8
1.3. Osteoporose ... 9
1.3.1. Fisiopatologia da osteoporose ... 10
1.3.2. Fatores de riscos ... 12
1.3.3. Diagnóstico ... 12
1.3.3.1. Avaliação clínica do metabolismo ósseo ... 12
1.3.3.1.1. Interpretação dos resultados ... 13
1.3.3.2. Avaliação laboratorial do metabolismo ósseo ... 13
1.3.4. Marcadores de formação óssea ... 14
1.3.4.1. Osteopontina ... 15
1.3.5. Marcadores de reabsorção óssea ... 17
1.3.5.1. Fosfatase ácida ... 18
x
1.3.6. Tratamento e prevenção ... 19
1.4. Modelo Animal... 20
1.4.1. Modelos animais em estudos de osteoporose ... 20
1.4.2. Métodos de indução da osteoporose em modelos animais ... 21
1.5. Biomateriais na regeneração óssea ... 23
I III. . OOBBJJEETTIIVVOOS ... 25 S I IIIII. . MMAATTEERRIIAAIISSEEMMÉÉTTOODDOOSS ... 26 3.1. Animais ... 26 3.2. Condições experimentais ... 26 3.3. Protocolo experimental ... 27 3.4. Procedimento experimental ... 28 3.4.1. Anestesia ... 28 3.4.2. Indução da osteoporose ... 29
3.4.3. Criação de defeito e aplicação do biomaterial na mandíbula ... 31
3.5. Grupos experimentais ... 34
3.6. Sacrifício dos animais ... 34
3.6.1. Colheita de sangue para avaliação de parâmetros no soro ... 35
3.6.2. Recolha de tecidos ... 35
3.7. Análise da atividade sérica da FAT e TRAP ... 36
3.8. Análise por imunoblotting de proteínas envolvidas na regeneração e inflamação ... 36
3.9. Percentagem de peso ganho e índice de homogeneidade ponderal ... 37
3.10. Análise Estatística ... 37
I IVV.. RREESSUULLTTAADDOOS ... 38 S 4.1. Variação do peso corporal ... 38
4.2. Consumo de comida e de água ... 40
4.3. Peso dos órgãos ... 41
4.4. Avaliação global dos parâmetros séricos ... 44
xi
4.4.1.1. Fosfatase ácida total ... 44
4.4.1.2. Fosfatase ácida resistente ao tartarato ... 45
4.4.1.3. Razão (TRAP/FAT) ... 46
4.4.2. Proteínas envolvidas na regeneração e inflamação ... 46
4.4.2.1. Proteína C reativa ... 47
4.4.2.2. Interleucina-6 ... 47
4.4.2.3. Osteopontina ... 48
4.5. Correlação linear simples dos marcadores séricos ... 49
V V. . DDIISSCCUUSSSSÃÃO ... 50 O V VII.. CCOONNCCLLUUSSÕÕEESS ... 57 V VIIII. . RREEFFEERRÊÊNNCCIIAAS ... 58 S
xii
ÍNDICE DE FIGURAS
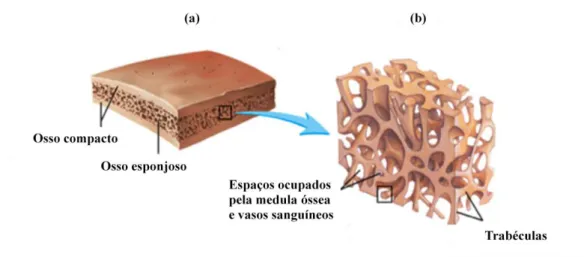
Figura 1: Representação da estrutura de um osso achatado (a), e das trabéculas do osso esponjoso (b).
Adaptado de Seeley et al.(1997). ... 2
Figura 2. Deposição da matriz extracelular pelos osteoblastos (adaptado de Alberts et al., 2008). ... 5 Figura 3. Representação do processo de remodelação óssea e dos fatores envolvidos (adaptado de
Petersen e Pedersen (2005), Nakagawa et al. (1998) e WordPress (2010)). ... 7
Figura 4. Ação de componentes hormonais sobre osteoblastos e maturação dos osteoclastos (adaptado
de Rianchoe Delgado-Calle (2011)). ... 11
Figura 5. Representação de algumas características da OPN. São indicados os domínios de ligação do
cálcio e heparina, domínio RGD, domínio aspartato, domínio ɑ9β1/ɑ4β1 e domínio de clivagem da
trombina e MMPs. O fragmento terminal COOH permite a ligação a CD44 e regula vários eventos celulares. (Adaptado de Denhardt et al. (2001)). ... 15
Figura 6. Esquema representativo do papel das integrinas mediando as interações entre a matriz
extracelular (substrato revestido por proteínas com sequência RGD) e o citoesqueleto celular. .. 16
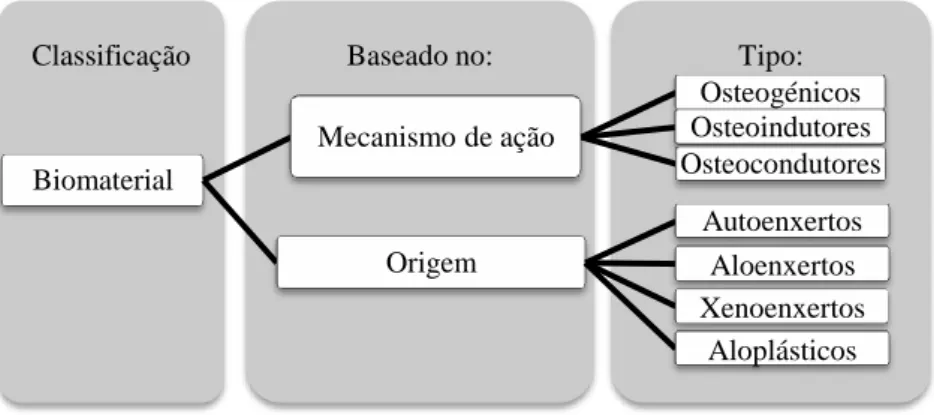
Figura 7. Classificação dos biomateriais de acordo com seu mecanismo de ação e origem (adaptado
de Ilan and Ladd (2002) e Salgado et al.(2011)). ... 23
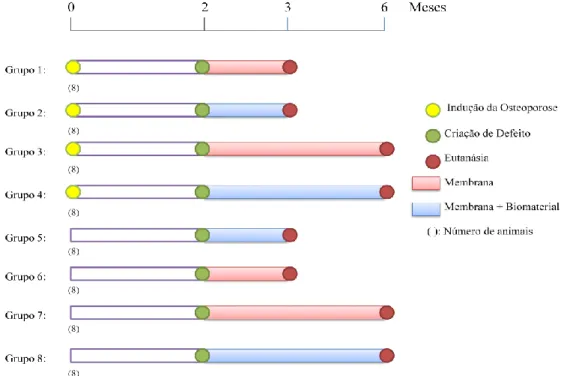
Figura 8. Cronograma do protocolo experimental. ... 28 Figura 9. Anestésico e analgésico aplicado nos animais de laboratório. (A) Imalgene® 1000, um
anestésico injetável utilizado em animais de laboratório, composto por 100mg de ketamina. (B) Rompun®, contém xilazina como princípio ativo, funciona como sedativo, analgésico e relaxante muscular dependendo da dose administrada. ... 29
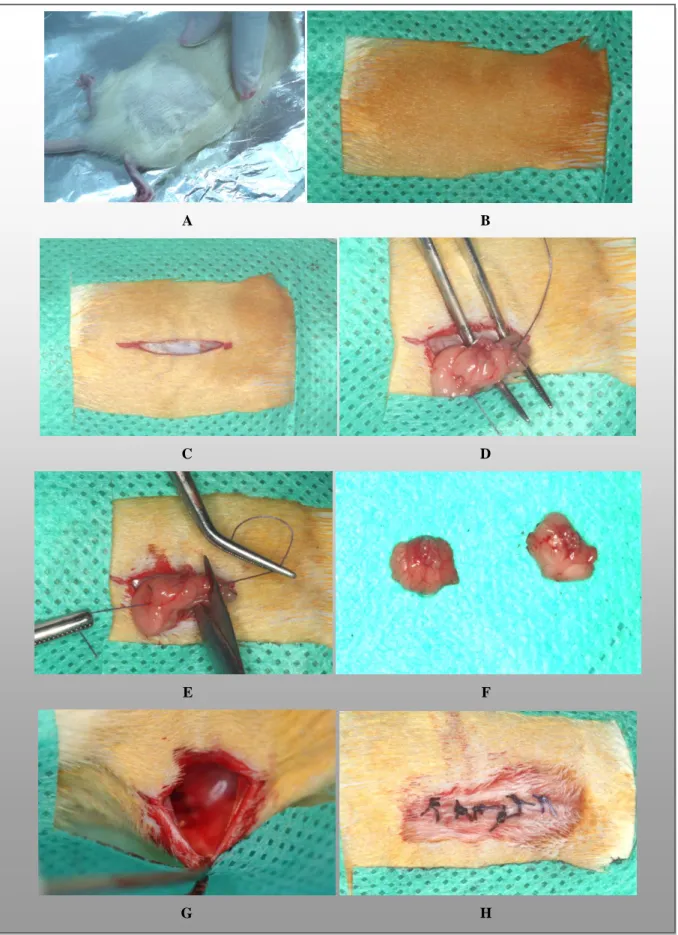
Figura 10. Etapas do procedimento cirúrgico de ovariectomia nos animais de laboratório. A-
Tricotomia; B- Anti-sepsia; C- Incisão da região dorsal; D- Exposição do ovário; E- Remoção do ovário dos animais do grupo OVX; F- Ovários removidos do animal do grupo OVX; G- Sutura simples interrompida da superfície interna; H- Sutura simples interrompida da pele. ... 30
Figura 11. Transformador (Miniplex de TriplexMaterial®) e broca Ø 4.0/2.9 mm, para criação de defeito no ramo da hemi-mandíbula direita. ... 31
Figura 12. Materiais aplicados no segundo procedimento cirúrgico. A- Biomaterial (Putty,
OsteoBiol®, Tecnoss, Italy) aplicado no defeito circular; B- Membrana (Evolution Std, OsteoBiol®, Tecnoss, Italy) utilizada no revestimento do defeito circular. ... 32
Figura 13. Etapas do procedimento cirúrgico de criação do defeito nos animais de laboratório. A-
Anti-sepsia e incisão da pele e masséter; B- Disseção do ramo da hemi-mandíbula direita; C- Criação de um defeito circular no ramo da hemi-mandíbula; D- Colocação da membrana hidratada; E- Preenchimento do defeito com o biomaterial; F- Envolvimento da membrana sobre
xiii
a hemi-mandíbula; G- Sutura simples interrompida do masséter; H- Sutura simples interrompida da pele. ... 33
Figura 14. Etapas do processo de colheita de sangue por punção cardíaca. A- Punção do coração do
animal; B- Transferência do sangue colhido para tubos de separação de soro. ... 35
Figura 15. Evolução do peso corporal dos animais do grupo OVX (grupo 1, 2, 3 e 4) e do grupo Sham
(grupo 5, 6, 7 e 8). * Estatisticamente significativo do grupo Sham em todos os meses, exceto no basal (p<0,05). ... 40
Figura 16. Variação média da atividade da TRAP, e variação média da densidade ótica por proteína
(DO/proteína) da CRP, IL-6 e OPN no grupo OVX e Sham. A DO é expressa em unidades arbitrárias (U.A). *Estatisticamente significativo do grupo Sham (p<0,05). ... 44
Figura 17. Variação da atividade da FAT nos respetivos grupos experimentais. *Estatisticamente
significativo do grupo OVX_(M)6m e grupo Sham_(M+B)6m (p<0,05). ... 45
Figura 18. Variação da atividade da TRAP nos respetivos grupos experimentais. * - Diferença
estatisticamente significativa do grupo OVX_(M+B)3m, grupo OVX_(M)6m e do grupo OVX_(M+B)6m (p˂0,05); ** - Diferença estatisticamente significativa do grupo OVX_(M)6m (p˂0,05). ... 45
Figura 19. Razão entre a atividade da TRAP e a atividade da FAT nos diferentes grupos
experimentais. a- Diferença estatisticamente significativa do grupo Sham_(M+B)3m, grupo Sham_(M)6m e do grupo Sham_(M+B)6m (p˂0,05); b - Diferença estatisticamente significativa do grupo Sham_(M)3m (p˂0,05). ... 46
Figura 20. Representação da análise de slot-blot e medição da densidade ótica por proteína da CRP
nos diferentes grupos experimentais. ... 47
Figura 21. Representação da análise de slot-blot e medição da densidade ótica por proteína da IL-6
nos diferentes grupos experimentais. ... 48
Figura 22. Representação da análise de slot-blot e medição da densidade ótica por proteína da OPN
xiv
ÍNDICE DE QUADROS
Quadro 1. Classificação de osteoporose e osteopenia segundo a OMS, baseado no T-score da técnica
de DEXA. ... 13
Quadro 2. Marcadores bioquímicos da formação e reabsorção óssea. ... 14
Quadro 3. Técnicas de indução de osteoporose em modelos animais... 22
Quadro 4. Aditivos nutricionais por Kg de ração Mucedola S.R.L ®. ... 27
Quadro 5. Grupos experimentais formados de acordo com o material aplicado e o período experimental. ... 34
Quadro 6. Fórmula para o cálculo da percentagem de peso ganho e índice de massa percentual. ... 37
Quadro 7. Média do peso corporal inicial e final, diferença de pesos, %PG e IHP dos respetivos grupos.* Estatisticamente significativo do grupo Sham (p<0,05). ... 38
Quadro 8. Média do peso corporal dos diferentes grupos experimentais, obtidos no estado basal e durante 6 meses após processo cirúrgico de ovariectomia.(ap<0,05 vs em relação todos os outros meses; bp<0,05 vs basal e 1ºMês; cp<0,05 vs basal e 3ºMês; dp<0,05 vs 4ºMês ep<0,05 vs 2ºMês; f p<0,05 vs 5ºMês; gp<0,05 vs 6ºMês; hp<0,05 vs basal. ... 39
Quadro 9. Consumo médio de comida e água consumida por rato por semana. a - Estatisticamente significativo dos grupos 5 e 6 (p˂0,05).b,c - Estatisticamente significativo do grupo 7 (p˂0,05). . 41
Quadro 10. Média do peso absoluto dos órgãos dos grupos experimentais. ... 42
Quadro 11. Peso médio relativo dos órgãos dos grupos experimentais. *- Estatisticamente significativo do grupo Sham (p˂0,05).** - Diferença estatisticamente significativa do grupo 6 (p˂0,05). ... 43
Quadro 12. Resultados do coeficiente de correlação de Pearson entre os diferentes marcadores séricos.*Estatisticamente significativo em relação à TRAP (p<0,05). ... 49
xv
ABREVIATURAS E SÍMBOLOS
% - Percentagem
- Média
AAT- Alfa-1-antitripsina (do inglês, Alpha 1-antitrypsin) ACPs- Fosfatase ácida (do inglês, Acid phosphatases) BMP- Proteínas morfogenéticas
Ca10(PO4)6(OH)2 - Fórmula da hidroxiapatite
Ca2+- Ião cálcio
CRP- Proteína C reativa (do inglês, C reactive protein) DMO- Densidade mineral óssea
DO-Densidade ótica DP- Desvio-padrão
DXA- Densitometria por absorção de raio-X de dupla energia (do inglês, Dual Energy X-ray
Absorptiometry)
ERs- Recetores específicos de estrógeno (do inglês, Estrogen receptor)
Eta-1-Fator de ativação-1 precoce de linfócitos T (do inglês, Early T-lymphocyte activation 1 protein) FAT- Fosfatase ácida total
g- Grama
g/cm2- Grama por centímetro quadrado
IFN - Interferões (do inglês: Interferon) IHP- Índice de homogeneidade ponderal IL- Interleucina
kDa - Quilo-Dalton (do inglês: kiloDalton) Kg- Quilograma
l – Litro
M-CSF- Fator Estimulador de Colónias de Macrófagos (do inglês: Macrophage Colony-Stimulating
Factor)
MEC- Matriz extracelular mg- Miligramas
mL- mililitros mm- Milímetros
MMPs- Metaloproteínases da matriz (do inglês, Matrix metalloproteínases) n – Número
xvi
NK- Natural Killer
NO- Óxido Nítrico (do inglês: Nitric Oxide) ºC- Grau Célsius
OC- Osteocalcina
OMS – Organização Mundial de Saúde OPG- Osteoprotegerina
OPN- Osteopontina (do inglês, Osteopontin) OVX- Ovariectomizado
Pf- Peso medio final PG- Peso Ganho Pi- Peso medio inicial Pma- Peso medio mais alto Pmb- Peso medio mais baixo PO4
-3
- Ião fosfato
PTH- Hormona paratiroide (do inglês, Parathyroid hormone)
RANKL - Recetor ativador do fator nuclear-kB ligante (do inglês, Receptor activator of nuclear
factor kappa-B ligand)
RGD- Domínio arginina-glicina-ácido aspártico Rpm- Rotações por minuto
SERPINs- Inibidores de serina protease (do inglês: Serine protease inhibitors) Sham- Operação simulada
SIBLING-Small Integrin-Binding Ligand, N-linked Glycoprotein
SPP1- Fosfoproteína secretada 1 (do inglês, Specific Secreted Phosphoprotein-1) SPSS- Statistical Pachage for the Social Sciences
TBS-T – Tampão Tris contendo Tween 20 (do inglês, Tris-buffered saline with Tween 20) TNF- Fator de necrose tumoral (do inglês, Tumor necrosis factor)
TRAP- Fosfatase ácida resistente ao tartarato (do inglês, Tartrate resistant acid phosphatase) TRE- Terapia de reposição estrogénica
U.A- Unidades arbitrárias U/L- Unidades por litro
UBMs - Unidades básicas multicelulares UI- Unidades internacionais
μL- Micrólitros μm- Micrómetro
1
I
I
.
.
R
R
E
E
V
V
I
I
S
S
Ã
Ã
O
O
B
B
I
I
B
B
L
L
I
I
O
O
G
G
R
R
Á
Á
F
F
I
I
C
C
A
A
1. Introdução
A osteoporose é conhecida como um importante problema de saúde pública, que afeta milhões de pessoas em todo o mundo, de todas as idades e de ambos os sexos, interferindo significativamente na qualidade de vida, gerando custos pessoais e sociais, consequentes do aumento substancial da morbilidade, incapacidade e mortalidade (Kamel et al., 2000; Leslie et al., 2012). As fraturas geradas pela osteoporose resultantes da baixa densidade óssea, em consonância com a longevidade humana, têm despertado um enorme interesse científico nas últimas décadas. Em Portugal 19,1% da população tem 65 ou mais anos de idade, o que vai conduzir a um aumento da incidência de casos de fraturas osteoporóticas (Instituto Nacional de Estatística, 2011).
A osteoporose é uma doença óssea metabólica caracterizada pela diminuição de densidade mineral óssea e deterioração da microarquitetura do tecido ósseo, consequente de um desequilíbrio entre a atividade dos osteoblastos e osteoclastos (World Health Organization, 1994; Schrager, 2003; Queiroz, 2006; Marcu et al., 2011). A perda de massa óssea torna os ossos porosos e frágeis, originando uma deformação significativa, conduzindo ao aumento do risco de fraturas (World Health Organization, 1994).
As fraturas osteoporóticas podem ocorrer em qualquer osso, contudo surge maioritariamente em locais do esqueleto rico em osso esponjoso, como em vértebras, extremidade distal radio e cúbito, úmero proximal e colo do fémur (Kansis et al., 2008; Chun, 2011). As fraturas osteoporóticas causam dor, perda de função e uma diminuição da qualidade de vida. A recuperação é lenta e a reabilitação muitas vezes incompleta.
Para compreender esta patologia é necessário conhecer o tecido ósseo, os seus constituintes e principais funções.
1.1.
Tecido ósseo
O tecido ósseo é o principal componente do esqueleto humano. É dos tecidos mais rígidos e resistentes do corpo humano e, embora com uma estrutura relativamente leve, a sua
2
arquitetura permite suportar forças consideráveis, resultantes do peso do corpo e da tensão muscular. O tecido ósseo forma os elementos do esqueleto que dão suporte aos tecidos moles, nomeadamente a musculatura, funcionam como alavancas que ampliam as forças geradas pela contração muscular, por conseguinte, participam no movimento, nomeadamente a locomoção (Taichman, 2005). Os elementos do esqueleto delimitam cavidades que alojam órgãos vitais assumindo função de proteção. Para além disso, fornecem um ambiente para a hematopoiese no interior das cavidades medulares, e têm a capacidade de armazenar minerais, como o cálcio e o fósforo, que são essenciais em vários processos realizados pelo organismo (Taichman, 2005; Alberts et al., 2008).
1.1.1. Estrutura do tecido ósseo
Os ossos são órgãos do sistema esquelético que podem ser classificados em dois tipos: compacto ou cortical e o trabecular ou esponjoso (Seeley et al., 1997). O osso compacto é composto por uma camada mais densa de tecido ósseo, e geralmente encontra-se na periferia dos ossos, e é limitado externamente pelo periósteo e internamente pelo endósteo (Clarke, 2008). A camada interna do osso é constituída por osso trabecular, que ao contrário ao osso compacto, possui uma estrutura porosa (figura 1). No interior da camada interna há uma cavidade, o canal medular, onde se encontra a medula óssea (Clarke, 2008; Schindelera et al., 2008).
Figura 1: Representação da estrutura de um osso achatado (a), e das trabéculas do osso esponjoso (b). Adaptado
de Seeley et al.(1997).
O tecido ósseo, sendo uma estrutura especializada de tecido conjuntivo, é constituído por matriz extracelular e células do tecido ósseo.
3
1.1.2. Matriz Extracelular
A matriz extracelular (MEC), também designada matriz óssea, é constituída por duas componentes, 65% do peso da matriz constitui a parte inorgânica e 35% constitui parte orgânica (Seeley et al., 1997).
Na parte orgânica da matriz predominam as fibras de colagénio tipo I constituindo 90 a 95% da matéria orgânica da matriz (Watts, 1999). A restante parte é constituída por glicoproteínas não colagéneas, proteoglicanos e glicosaminoglicanos. Das glicoproteínas não colagénias encontra-se a fibronectina, a vitronectina, a osteopontina, a sialoproteína óssea, a osteocalcina (proteína Gla) e a osteonectina. Estas glicoproteínas desempenham um papel importante no processo de mineralização da matriz extracelular, principalmente nos processos de adesão de células ósseas (Takami M, 1999). As proteínas de adesão da matriz não só promovem a adesão celular como também estimulam a migração celular, devido à existência de recetores celulares. Existem vários recetores celulares, no entanto os que desempenham funções mais importantes na reabsorção óssea são as integrinas. Existem pelo menos, quatro tipos diferentes de integrinas (αvβ3, αvβ5, α2β1, αvβ1) envolvidas na interação osteoclasto/matriz óssea. Entre elas, a integrina αvβ3, também reconhecida por recetor de vitronectina, tem merecido especial atenção devido ao efeito inibitório na reabsorção óssea. A integrina αvβ3 é uma molécula de adesão localizada na membrana celular (proteína transmembranar). Exercem um papel essencial nos processos de adesão à matriz/substrato, migração, diferenciação, apoptose das células e que regulam a transferência de informação da matriz para o interior da célula, e vice-versa. As integrina αvβ3 podem ser encontrada maioritariamente em células originárias do mesenquima, e na qual possui grande afinidade por inúmeras proteínas adesivas, de entre elas destaca-se a osteopontina, a sialoproteína do osso e fibronectina (Miyauchi et al., 1991; Clarke, 2008; Fong et al., 2009).
Na parte inorgânica da matriz predominam os iões de cálcio (Ca2+) e fosfato (PO43-), que se encontram na forma de cristais de fosfato de cálcio denominado hidroxiapatite (Ca10(PO4)6(OH)2) (Seeley et al., 1997; Clarke, 2008). Podem ser encontrados em menor quantidade outros iões, nomeadamente, sódio, flúor, magnésio, bicarbonato, cobre, alumínio e chumbo (Clarke, 2008). A associação dos cristais de hidroxiapatite (parte inorgânica) às fibras de colagénio (parte orgânica) confere a dureza e resistência do tecido ósseo (Seeley et al., 1997).
4
1.1.3. Células do tecido ósseo
Os componentes celulares do osso são as células osteogénicas, os osteoblastos, as células de revestimento ósseo (“bone lining cells”), osteócitos e osteoclastos.
As células osteogénicas diferenciam-se em osteoblastos e encontram-se na porção interna do periósteo e no endósteo (Seeley et al., 1997).
Os osteoblastos são células rugosamente cuboides que derivam das células tronco mesenquimatosas indiferenciadas e pluripotentes (Taichman, 2005). Localizadas na superfície do tecido ósseo em crescimento, dispõem-se lado a lado, formando uma só camada que lembra um epitélio simples, mas com células que se unem através de prolongamentos citoplasmáticos (Seeley et al., 1997; Alberts et al., 2008).
Os osteoblastos são considerados as células chave do processo de formação óssea (Alberts et al., 2008; Gallagher and Sai, 2010). Os osteoblastos sintetizam a parte orgânica da matriz óssea, nomeadamente, colagénio tipo I, proteoglicanos e outras glicoproteínas tais como a osteocalcina (também conhecida por proteína Gla) que participa nos processos de mineralização da matriz e a osteonectina que se liga ao colagénio formando um complexo que se une aos cristais de hidroxiapatite, participando nos processos de adesão dos elementos constituintes deste tecido (Takami M, 1999). A matriz recém-sintetizada deposita-se em torno do osteoblasto, envolvendo-o e antes de sofrer o processo de mineralização, esta matriz denomina-se osteóide (figura 2). Os osteóides são compostos principalmente por colagénio tipo I, e são rapidamente convertidos em matriz óssea pela deposição, sobre si, de cristais de fosfato de cálcio (Alberts et al., 2008). A membrana plasmática do osteoblasto é rica em fosfatase alcalina, que aliada à osteocalcina, criam o ambiente favorável para a mineralização da matriz (Alberts et al., 2008).
5
Figura 2. Deposição da matriz extracelular pelos osteoblastos (adaptado de Alberts et al., 2008).
À medida que os osteoblastos sintetizam os componentes da matriz óssea ficam envolvidos por essa matriz, afastando-se dos osteoblastos vizinhos, mas permanecendo ligados entre si através de prolongamentos citoplasmáticos. Em simultâneo, os osteoblastos vão perdendo a capacidade de síntese dos componentes da matriz e passam a designar-se osteócitos (Alberts et al., 2008; Clarke, 2008). Os osteoblastos além de sintetizarem e realizarem a deposição de proteínas da matriz extracelular óssea, são responsáveis pela síntese e secreção de moléculas que iniciam e controlam a diferenciação dos osteoclastos (Alberts et al., 2008).
As células de revestimento do tecido ósseo são células achatadas e alongadas, que se originaram a partir de osteoblastos que não foram envolvidos pela MEC óssea, na fase de formação de tecido ósseo. Tratam-se assim de osteoblastos inativos que revestem toda a superfície óssea, funcionando como barreiras epitelial de determinados iões (Wongdee et al., 2010).
Os osteócitos são as células mais abundantes no osso (Gallagher and Sai, 2010), e diferenciam-se a partir dos osteoblastos. Localizam-se nas lacunas da matriz óssea, e possuem prolongamentos citoplasmáticos longos e finos que alcançam outros prolongamentos citoplasmáticos de osteócitos vizinhos, permitindo desta forma, a difusão de nutrientes e produtos catabólicos com o sangue (Seeley et al., 1997). Os osteócitos têm assim, um papel fundamental na manutenção da matriz óssea, e a morte destas células leva à reabsorção da matriz pelos osteoclastos (Gu et al., 2005). A apoptose dos osteócitos ocorre em situações de deficiência de estrogénios, corticoterapia, envelhecimento e após agressão no tecido ósseo (O'Brien et al., 2004).
6
No tecido ósseo surge uma outra linhagem de células, os osteoclastos. Os osteoclastos têm origem a partir de células da linhagem monocítica-macrofágica (percursores mononucleados) da medula óssea (Suda et al., 1992; Roodman, 1999). São células de grandes dimensões, multinucleadas, que desempenham um papel importante na remodelação óssea e na homeostasia (Alberts et al., 2008). Os osteoclastos apresentam pregas na membrana plasmática que aderem à matriz óssea, criando microambiente fechado, para onde segregam ácidos, colagenases e fosfatase ácida resistente ao tartarato (TRAP- do inglês, tartrate resistant acid phosphatase) que degradam a parte orgânica da matriz e dissolvem os cristais de hidroxiapatite (Roodman, 1999; Hollberg et al., 2002). A solubilidade da parte inorgânica da matriz, conduz à libertação de iões de cálcio da matriz para a corrente sanguínea, intervindo desta forma na homeostasia de cálcio sanguíneo (Seeley et al., 1997). Para além disso, a membrana dos percursores dos osteoclastos e dos osteoclastos maduros possuem recetores para os estrogénios e para a calcitonina, um poderoso inibidor hormonal da reabsorção óssea (Oursler et al., 1994; Lee et al., 1995; Roodman, 1999).
1.2.
Remodelação óssea
O osso é um tecido metabolicamente ativo que, está em permanente remodelação de modo a manter as propriedades mecânicas e metabólicas adaptadas aos diferentes estímulos a que está sujeito.
A remodelação óssea é uma função normal e essencial do osso que assegura o equilíbrio do metabolismo do cálcio e do fósforo e também a reparação de microdanos do osso, permitindo assim, manter a microestrutura óssea, garantindo a sua constante adaptação às exigências mecânicas e funcionais do esqueleto. A remodelação óssea é um processo cíclico e contínuo, assegurada pelo equilíbrio entre atividades coordenadas das unidades básicas multicelulares (UBMs) que consistem em osteoblastos, osteoclastos e osteócitos. Embora com origens de diferentes linhagens celulares, estas células interagem entre si e possuem funções opostas dentro a cascata de remodelação óssea (Clarke, 2008).
O processo de remodelação óssea é regulado indiretamente por hormonas e citocinas, que controlam a maturação dos osteoclastos a partir de percursores hematopoiéticos, atuando também sobre as células osteoblasticas e, em alguns casos, sobre as células do sistema imunitário (Martin and Udagawa, 1998; Taichman, 2005). Resumidamente, o processo de remodelação é composta por quatro fases sequenciais. A 1º fase consiste na ativação de
7
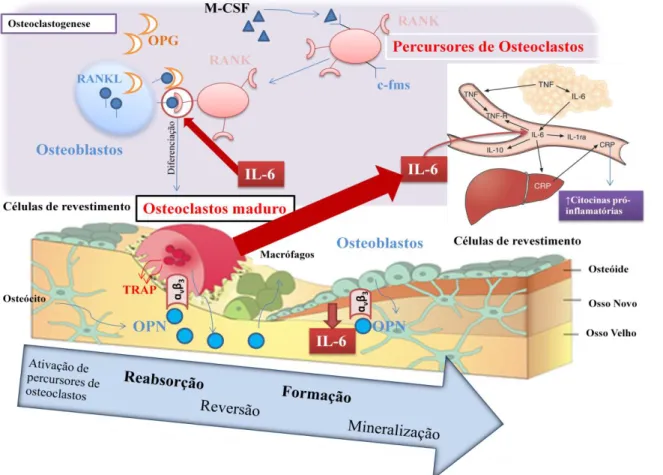
células percursoras de osteoclastos, a 2º fase é a reabsorção do osso pelos osteoclastos maduros, já a 3º fase consiste na reversão da reabsorção, seguida da 4ºfase, com a formação de novo osso pela ação dos osteoblastos (figura 3) (Gallagher and Sai, 2010).
Figura 3. Representação do processo de remodelação óssea e dos fatores envolvidos (adaptado de Petersen e
Pedersen (2005), Nakagawa et al. (1998) e WordPress (2010)).
Na primeira etapa da remodelação os osteoclastos têm que ser formados e serem informados do local onde devem reabsorver osso e em que quantidade. Estas informações podem provir de sinais produzidos no local da lesão ou pela morte dos osteócitos que definem a localização e a extensão da lesão (O'Brien et al., 2004). A ativação de células percursoras de osteoclastos é definida por um processo de osteoclastogénese.
A regulação da osteoclastogénese depende da presença dos osteoblastos, do fator de estimulação das colónias de macrófagos (M-CSF), da expressão do ligando do recetor ativador do fator nuclear kappa (RANKL- do inglês, receptor activator of nuclear factor kappa-B ligand), da osteoprotegerina (OPG) proteína solúvel, e do receptor RANK (Martin and Udagawa, 1998; Nakagawa et al., 1998; Taichman, 2005; Gallagher and Sai, 2010; Mackiewicz et al., 2011). A diferenciação direta dos osteoclastos só é assim possível,
8
mediante a apresentação da RANKL e M-CSF pelos osteoblastos maduros (Alberts et al., 2008; Matsuo and Irie, 2008).
O processo inicia-se pela ligação do M-CSF ao recetor c-fms, presente na membrana das células percursoras de osteoclastos, estimulando a proliferação e fusão entre células. A RANKL presente na membrana dos osteoblastos (Roux et al., 2002), quando estimulado pelo M-CSF, liga-se ao seu receptor RANK, localizado na membrana das células precursoras dos osteoclastos (Roux et al., 2002), estimulando a diferenciação do precursor do osteoclasto em osteoclasto maduro (Nakagawa et al., 1998; Takami et al., 1999; Clarke, 2008). Em contraste, a OPG produzida pelo osteoblasto, bloqueia a formação de osteoclastos, ligando-se ao RANKL (Alberts et al., 2008), com o qual tem grande afinidade, impedindo que RANK se ligue ao RANKL e inibindo a osteoclastogénese (Roux et al., 2002). O balanço entre a produção de RANKL e de OPG determina a quantidade de osso que e reabsorvida (Nakagawa et al., 1998; Roux et al., 2002).
A segunda fase da remodelação só é iniciada após os osteoclastos sofrerem maturação. O osteoclasto cria assim um microambiente isolado, acidificado pela secreção de iões de hidrogénio via H+-ATPase, da enzima catepsina K, da TRAP e metaloproteínases da matriz (MMPs), induzindo a destruição da matriz orgânica e inorgânica (Chambers, 2000; Delaisse et al., 2003; Clarke, 2008; Gallagher and Sai, 2010). Após terminar o processo de reabsorção, surgem na mesma superfície os osteoblastos, que preenchem as lacunas de reabsorção produzidas pelos osteoclastos com nova matriz óssea, inicialmente não mineralizada, designada por osteóide (Alberts et al., 2008). Alguns dos osteoblastos são encapsulados na matriz orgânica extracelular e diferenciam-se em osteócitos (Khosla et al., 2008). Os restantes osteoblastos continuam a sintetizar novo osso e revestem completamente a superfície óssea recentemente formada (Roodman, 1999).
1.2.1. Papel das citocinas pró-inflamatórias na remodelação óssea
No processo de remodelação óssea intervêm também citocinas pró-inflamatórias, aquando de uma resposta inflamatória. A resposta inflamatória é uma sequência complexa de acontecimentos que envolve muitas substâncias químicas e células (Seeley et al., 1997), que agem contra uma agressão microbiana, física ou química (Seeley et al., 1997; Pinto, 2009). A inflamação pode ser local ou sistémica. A resposta inflamatória local pode ser acompanhada
9
por uma resposta sistémica conhecida por resposta de fase aguda (Petersen and Pedersen, 2005; Pinto, 2009).
Citocinas, como IL-1, IL-6 e TNF-ɑ, são produzidas no local de inflamação e desempenham papel crucial na resposta de fase aguda, induzindo a produção de proteínas de fase aguda pelos hepatócitos. A IL-6 é uma glicoproteína produzida pelos osteoclastos, tecido adiposo, linfócito B e T, células do estroma e células da linhagem monócito-macrófago (Kishimoto, 1989; Heinrich et al., 1990; Roodman, 1999). A IL-1 e IL-6 são potentes fatores indutores de reabsorção óssea que prolonga a sobrevivência e induz a maturação dos osteoclastos (Jimi et al., 1999; Roodman, 1999). Particularmente, a IL-1 da mesma forma que o TNF-ɑ, estimula a expressão dos recetores c-fms nos percursores de osteoclastos (Roodman, 1999), e este efeito é inibido pelos estrogénios (Jimi et al., 1999; Michael et al., 2005). Tanto as IL-1 e IL-6 como o TNF-ɑ estimulam/aumentam a reabsorção óssea, modulando-a em parte através do sistema RANK-RANKL (Suda et al., 1997; Kominea et al., 2001; Srivastava et al., 2001). Para além disso, a IL-6 possui a capacidade de ativar a OPN e pode atuar diretamente nos hepatócitos induzindo a síntese e secreção de proteínas de fase aguda (proteína C reativa (CRP- do inglês, C reactive protein) e complemento) e que pode afetar diretamente o processo de crescimento de tecido ósseo (Heinrich et al., 1990; Moshage, 1997; Pinto, 2009). A síntese e secreção da CRP, também pode ser estimulada pela resistina (proteína secretada pelos adipócitos) (Calabro et al., 2005; Yeh, 2005).
Qualquer fator que interfira no mecanismo de remodelação óssea alterando o equilíbrio entre a reabsorção e a formação, conduzindo à perda de tecido ósseo, está implicado na etiologia e fisiopatologia da osteoporose (Armada et al., 2006).
1.3.
Osteoporose
A osteoporose é definida como uma doença óssea metabólica caracterizada pela diminuição de densidade mineral óssea (unidade de massa/volume) e deterioração da microarquitectura do tecido ósseo (World Health Organization, 1994; Schrager, 2003; Raisz, 2005; Queiroz, 2006; Marcu et al., 2011). Pode ser classificada em osteoporose primária ou secundária. A osteoporose primária, a mais comum, subdivide-se em tipo I ou pós-menopausa e tipo II ou senil (Queiroz, 2006; Adler, 2012; Jiang et al., 2012). A osteoporose pós-menopausa afeta principalmente mulheres com idades compreendidas entre os 50 e os 70 anos e está relacionada com a deficiência de estrogénios (Kanis, 1996; Adler, 2012). A
10
osteoporose tipo II está associada ao processo natural de envelhecimento do osso e afeta ambos os sexos com idades superiores a 70 anos (Adler, 2012). Na osteoporose secundária a perda óssea pode ser causada pelo efeito adverso de determinados medicamentos, desordens endócrinas e gastrointestinais, distúrbios alimentares, problema renal, cancro, entre outros fatores (Fitzpatrick, 2002; Schrager, 2003; Adler, 2012).
1.3.1. Fisiopatologia da osteoporose
A fisiopatologia da osteoporose é definida como um desequilíbrio entre a reabsorção e formação óssea, consequente da atividade maioritária dos osteoclastos em relação aos osteoblastos (Seeley et al., 1997; Raisz, 2005).
O crescimento ósseo é influenciado por hormonas de crescimento, hormona paratiróide (PTH) e hormonas sexuais, nomeadamente os estrogénios (hormona sexual feminina) e testosterona (hormona sexual masculina) (Michael et al., 2005; Ono et al., 2012). Estas hormonas são muito importantes para o organismo, nomeadamente ao nível da atividade metabólica óssea, em que são responsáveis pela fixação do cálcio nos ossos (Sambrook and Cooper, 2006).
Os estrogénios são hormonas produzidas pelos folículos ováricos em maturação. A produção inicia-se na adolescência e termina na fase de menopausa, que surge entre os 45 e os 55 anos, embora possa surgir muito cedo, entre os 20 e os 40 anos, ou tardiamente, depois dos 60 anos (Bord et al., 2004). Após a menopausa, é maior o risco de determinados problemas médicos, como doenças cardíacas, acidentes vasculares cerebrais e osteoporose (Raisz, 2005).
Os estrogénios têm a capacidade de diminuir a diferenciação das células progenitoras dos osteoclastos (Sato et al., 2001) e inibirem a atividade de reabsorção óssea dos osteoclastos já diferenciados (Raisz, 2005). Os estrogénios ligam-se aos osteoblastos, induzindo aumento da produção de OPG de forma a suprimir a produção de RANKL, por conseguinte, impede a maturação dos osteoclastos, controlando desta forma a perda óssea (figura 4) (Bord et al., 2004; Sambrook and Cooper, 2006).
No entanto, no período seguinte à menopausa, ocorre um declínio na produção/secreção de estrogénio pela gonada feminina. Surge um aumento descontrolado na produção de M-CSF, da RANKL e de citocinas (como a IL-1, IL-6 e o TNF-ɑ), que agem na diferenciação de células percursoras em osteoclastos maduros funcionalmente ativos (Raisz, 2005; Sambrook and Cooper, 2006).
11
Figura 4. Ação de componentes hormonais sobre osteoblastos e maturação dos osteoclastos (adaptado de
Rianchoe Delgado-Calle (2011)).
Embora os recetores específicos de estrógeno (ERs-do inglês, Estrogen Receptors) estejam presentes tanto nos osteoblastos como nos osteoclastos, a principal atuação dos estrogénios é na reabsorção óssea, uma vez que, os ER se encontram maioritariamente nos osteoclastos (Braidman et al., 2001).
Existem outros agentes participantes na regulação e manutenção do mecanismo de remodelação óssea, nomeadamente a PTH e a vitamina D, que regulam o comportamento dos osteoblastos (figura 4) (McSheehy and Chambers, 1986; Martin and Udagawa, 1998; Raisz, 2005). A PTH, principal reguladora dos níveis de cálcio no sangue, liga-se aos recetores de PTH presentes na membrana dos osteoblastos, e estimulam a produção de M-CSF e IL-6 que agem sobre os osteoclastos. A vitamina D activa, pode estimular a proliferação de precursores dos osteoclastos, não pode actuar sobre o osteoclasto maduro (Qin et al., 2004; Ono et al., 2012). Se o cálcio sanguíneo diminui, a secreção da PTH aumenta, estimulando a produção de M-CSF e IL-6 activando os osteoclastos, o que resulta num aumento da degradação do tecido ósseo e dos níveis sanguíneos de cálcio. A PTH regula também a absorção de cálcio pelo intestino delgado, pela estimulação da formação de vitamina D nos rins. Contudo, a ação da vitamina D ainda depende do metabolismo dos seus precursores a nível hepático e da ativação deste no rim (Watkins et al., 2011).
A calcitonina, segregada pela tiroide, é uma hormona inibidora da reabsorção óssea (Seeley et al., 1997; Martin and Udagawa, 1998). Ao interagir com os recetores de calcitonina existentes na membrana dos osteoclastos, vai diminui a atividade desta células (Turner et al., 2011). O aumento dos níveis sanguíneos de cálcio estimula a tiroide a segregar calcitonina, que inibe a atividade dos osteoclastos (Martin and Udagawa, 1998).
12
1.3.2. Fatores de riscos
A Associação Nacional contra a Osteoporose (APOROS, 2012) define a osteoporose como uma “doença silenciosa e progressiva”, que afeta maioritariamente as mulheres pós-menopáusicas (Kanis, 1996; Schorlemmer et al., 2003; Schrager, 2003; APOROS, 2012). Porém são também fatores de risco indivíduos com idade superior a 70 anos, de raça branca, com antecedentes familiares de osteoporose, e estilos de vida pouco saudáveis (Kanis et al., 1994; Kamel et al., 2000; Queiroz, 2006). A menopausa precoce (antes dos 40 anos) e hipogonadismo (a falta de hormonas masculinas no homem)(Surampudi et al., 2012), bem como o tratamento prolongado com glicocorticóides, baixa ingestão de cálcio na dieta, fraca exposição solar e o hipertiroidismo são também fatores de risco para a osteoporose (Schrager, 2003; Lewiecki et al., 2004; Sambrook and Cooper, 2006; Veigel et al., 2011).
1.3.3. Diagnóstico
O diagnóstico precoce da osteoporose é muito importante para evitar danos colaterais. Na maioria dos casos a perda de densidade óssea é gradual e os sinais da doença só são visíveis numa fase já avançada, muitas vezes a primeira manifestação da doença é a fratura (Raisz, 2005). Para avaliar o estado da doença, os médicos recorrem inicialmente a uma avaliação clinica global seguida da avaliação laboratorial (Patsch et al., 2011).
1.3.3.1. Avaliação clínica do metabolismo ósseo
A história clinica do paciente é muito importante não só para avaliar o estado da doença como para recomendar o tratamento adequado.
Um dos critérios de diagnósticos precoces da osteoporose proposto pela Organização Mundial de Saúde (OMS) é a medida da densidade mineral óssea (DMO) por meio da densitometria óssea. A densitometria é hoje o exame de referência para o diagnóstico da osteoporose. É um método capaz de avaliar a quantidade de minerais em uma área ou volumes definidos em valores absolutos (g/cm2). A medida da DMO, quando expressa como unidade de desvio-padrão (DP) a partir da média para o adulto jovem, é chamado de “T- score” (Chun, 2011). A técnica indicada para medir a DMO é a densitometria por absorção de raio-X de dupla energia (DXA-do inglês, Dual Energy X-ray Absorptiometry)(World Health
13
Organization, 1994). Trata-se de um método não invasivo, que fornece informação da matriz e da estrutura óssea, baseada na emissão de 2 feixes de energia a partir de uma fonte de raio-x, de forma a corrigir a atenuação provocada pelos tecidos moles.
1.3.3.1.1.
Interpretação dos resultados
De forma a diferenciar a osteoporose da osteopenia, em 1994 a Organização Mundial da Saúde (OMS) desenvolveu parâmetros, com base na avaliação da DMO, possibilitando uniformidade na documentação. A OMS define osteoporose se o valor da DMO for inferior a 2,5 desvio-padrão em relação à média para o adulto jovem (pico de massa óssea), osteopenia se DMO apresentar-se entre - 2,5 e - 1 desvios-padrão e normal se DMO estiver acima de – 1 desvio-padrão (quadro 1) (Kanis et al., 1994; World Health Organization, 1994; NOF, 2011; Jiang et al., 2012).
Quadro 1. Classificação de osteoporose e osteopenia segundo a OMS, baseado no T-score da técnica de DEXA.
Definição segundo OMS Normal Osteopenia Osteoporose T- score > – 1 >-2,5 e ≤-1 < - 2,5
Na interpretação de resultados também é considerada a idade do paciente, o sexo, a doença de base, o local examinado e o erro de precisão. No entanto é referido na literatura que a DMO é uma medida pontual estática, não monitorizando as alterações que surgem no tecido ósseo de outra estrutura óssea (Jiang et al., 2012).
Entretanto, tem vindo a desenvolver-se marcadores bioquímicos específicos do metabolismo ósseo que se podem quantificar por métodos laboratoriais não invasivos.
1.3.3.2. Avaliação laboratorial do metabolismo ósseo
As células envolvidas no metabolismo ósseo produzem e/ou levam à formação e degradação de diferentes substâncias, que podem ser utilizadas como marcadores de formação e reabsorção óssea. A quantificação e comparação dos elementos envolventes na formação e reabsorção óssea, permitem monitorizar mais rapidamente pequenas mudanças no metabolismo ósseo. A dinâmica do metabolismo ósseo pode ser analisada de forma não
14
invasiva, com precisão, sensibilidade e especificidade através da utilização de marcadores bioquímicos específicos do metabolismo ósseo (Coleman et al., 2008).
Recentemente, com o reconhecimento da importância clínica da osteoporose, têm sido desenvolvidos e aperfeiçoados ensaios bioquímicos envolvidos na determinação da quantidade e/ou atividade dessas diferentes substâncias. Através dos marcadores bioquímicos do metabolismo ósseo é possível diagnosticar a osteoporose na sua fase inicial, e por conseguinte, dar uma resposta terapêutica precoce e rápida, evitando que a doença evolua (Coleman et al., 2008; Sousa et al., 2011).
Os marcadores bioquímicos do metabolismo ósseo são usualmente divididos em duas categorias (quadro 2): marcadores de formação óssea, que refletem a atividade dos osteoblastos; e marcadores de reabsorção óssea, que expressam a atividade dos osteoclastos (Coleman et al., 2008).
Quadro 2. Marcadores bioquímicos da formação e reabsorção óssea.
Marcadores de Formação Óssea Marcadores de Reabsorção Óssea
Fosfatase alcalina óssea (BALP-do inglês, bone alkaline phosphatase);
Fosfatase alcalina total (tALP);
Osteocalcina (OC);
Osteopontina (OPN);
Propeptídeo do colagénio tipo I (pró-peptídeo C-terminal do colagéneo tipo I (PICP-do inglês, procollagen type-I
C-terminal propeptide) e pró-peptídeo
N-terminal do colagéneo tipo I (PINP-do inglês, procollagen type-I
N-terminal propeptide)).
C-telopeptídeo de ligação inter-fibras colagénias (CTx);
Desoxipiridinolina (DPD)
Excreção urinária de cálcio;
Fosfatase ácida resistente ao tartarato tipo 5b (TRAP 5b);
Hidroxiprolina urinária;
N-telopeptídeo de ligação inter-fibras colágenas (NTx);
Piridinolina (PYD- do inglês,
Pyridinoline);
Sialoproteina óssea (BSP-do inglês, bone
sialoprotein).
1.3.4. Marcadores de formação óssea
A atividade dos osteoblastos pode ser monitorizada através da quantificação de marcadores específicos. São vários os marcadores utilizados na avaliação da atividade dos osteoblastos, de entre estes a osteopontina, que tem sido um dos biomarcadores de formação mais estudados.
15
1.3.4.1. Osteopontina
A osteopontina (OPN) é uma glicoproteína fosforilada ácida que esta envolvida em vários eventos fisiológicos e patológicos, incluindo sobrevivência celular, sinalização e adesão celular, inflamação, imunidade mediada por células, regeneração óssea e metástase (Denhardt et al., 2001; Standal et al., 2004). Apesar de ser amplamente conhecida como OPN, essa proteína também pode ser denominada como fosfoproteína secretada 1 (SPP1- do inglês: Specific Secreted Phosphoprotein-1), fosfoproteína de cálculos urinários, uropontina e também designada por fator de ativação-1 precoce de linfócitos T (Eta-1).
A OPN é um dos membros da família de proteínas SIBLING (Small Integrin-Binding Ligand, N-linked Glycoprotein) que está envolvida na comunicação célula e célula-matriz (Fisher et al., 2001). É uma proteína ácida que contém cerca de 300 aminoácidos (297 em rato e 314 em humanos)(Standal et al., 2004; Wang and Denhardt, 2008).
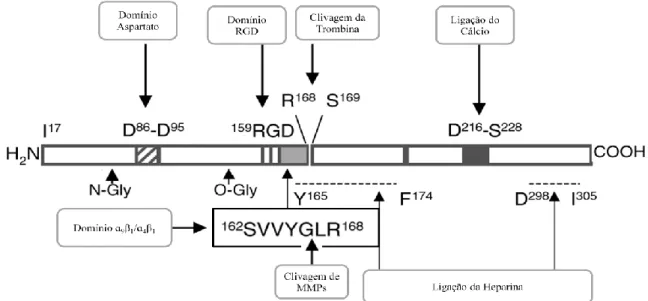
Estruturalmente, a OPN apresenta múltiplos domínios funcionais (figura 5) nomeadamente um domínio para o aspartato, um domínio de ligação para ao cálcio e heparina, um local de clivagem para a trombina e MMPs, um domínio RGD de ligação à integrina e apresenta locais específicos de fosforilação de serina (Sodek et al., 2000; Denhardt et al., 2001; Scatena et al., 2007; Lund et al., 2009).
Figura 5. Representação de algumas características da OPN. São indicados os domínios de ligação do cálcio e
heparina, domínio RGD, domínio aspartato, domínio ɑ9β1/ɑ4β1 e domínio de clivagem da trombina e MMPs. O fragmento terminal COOH permite a ligação a CD44 e regula vários eventos celulares. (Adaptado de Denhardt et
16
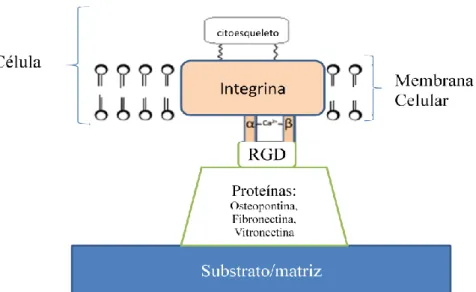
A OPN é constituída por uma sequência de aminoácidos arginina-glicina-aspartato, vulgarmente conhecida por RGD (Sodek et al., 2000). Esta sequência RGD liga-se a recetores de integrinas de outras células (figura 6), incluindo a integrina ɑvβ3, atuando como mediador quimiotático e permitindo que as células ósseas adiram/interajam com a matriz mineralizada (Aarden et al., 1996; Denhardt et al., 2001). Porém, a sequência RGD pode adotar várias conformações em diferentes proteínas. Esta flexibilidade conformacional pode estar na base da especificidade de ligação a diferentes integrinas, justificando diferentes destinos de diferenciação celular (Denhardt et al., 2001).
Figura 6. Esquema representativo do papel das integrinas mediando as interações entre a matriz extracelular
(substrato revestido por proteínas com sequência RGD) e o citoesqueleto celular.
A OPN é expressa por células em vários tecidos, incluindo osso e rim onde expressa maior concentração, mas também nas células epiteliais de revestimento, dentina, cérebro, músculo liso, rim, placenta, tumores e fluidos corporais (leite, sangue e urina)(Giachelli and Steitz, 2000; Scatena et al., 2007). A OPN é uma das proteína não colagénia da matriz extracelular mais abundantes no osso, é sintetizada e libertada a partir de células diferenciadas, nomeadamente os osteoblastos e osteócitos (McKee and Nanci, 1996; Sodek et al., 2000; Morinobu et al., 2003) e também pelos osteoclastos (Yamate et al., 1997). Porém a OPN também é expressa por células fibroblásticas, odontoblastos, algumas células da medula óssea, condrócitos (Merry et al., 1993), células endoteliais, células inflamatórias, células epiteliais renais e células do ouvido interno (Scatena et al., 2007; Uaesoontrachoon et al., 2008; Lund et al., 2009).
Alguns estudos indicam que OPN está envolvida na regulação do processo de formação e remodelação de tecido mineralizado no entanto, a sua ação ainda não é bem compreendida. Segundo Clarke (2008) e Steitz et al. (2002) uma das funções da OPN é inibir
17
a mineralização celular e remodelação. A OPN possui a capacidade de se acumular na matriz óssea mineralizada, e suporta a ligação de células à superfície da matriz óssea e inibe a formação de cristais de hidroxiapatite (Pampena et al., 2004). Além disso, a OPN gerar sinais intracelulares aos osteoclastos para exercerem a sua função normal no tecido ósseo (Merry et al., 1993; Denhardt et al., 2001; Lund et al., 2009). Em cultura de células osteoblásticas, a OPN é expressa durante a fase inicial de diferenciação, e a expressão é mantida com níveis elevados até o estado final de mineralização (Denhardt et al., 2001).
A expressão da OPN é elevada em resposta a citocinas pró-inflamatórias e à fadiga mecânica do osso (Denhardt et al., 2001). A vitamina D3 é particularmente um potente estimulador da síntese de OPN (Yamate et al., 1997).
A OPN no processo inflamatório possui ação/papel anti e pró-inflamatória. Como um agente pró-inflamatório, age como quimiotático, facilita a adesão, a migração e modula as funções das células T, células NK (do inglês Natural Killer Cell) monócitos e macrófagos (Liaw et al., 1998; Lund et al., 2009). Como um agente anti-inflamatório, inibe a produção de óxido nítrico (NO) e prostaglandina E2, que pode estimular ou inibir a atividade osteoclástica de acordo com a sua concentração (Denhardt et al., 2001). A sua expressão é aumentada em resposta a citocinas pró-inflamatórias no início da resposta imunológica e também pelo estímulo mecânico, como traumas dentários (Denhardt et al., 2001; Lund et al., 2009).
Caracterizado por ser um estimulador quimiotático de macrófagos e citocinas pró inflamatórias, a OPN tem um papel importante em várias desordens inflamatórias, como artrite reumática (Xu et al., 2005), aterosclerose (Isoda et al., 2003) e inflamação hepática (Ramaiah and Rittling, 2008).
1.3.5. Marcadores de reabsorção óssea
Existe atualmente uma vasta gama de marcadores de reabsorção óssea que são produtos resultantes da degradação de osso. Na investigação de doenças é importante que o marcador escolhido seja suficientemente sensível e específico, o que torna a escolha difícil. A TRAP é uma das enzimas importantes para a avaliar a reabsorção do tecido ósseo.
Apesar de a TRAP não ser inteiramente específica dos osteoclastos é um marcador bastante útil para a identificação da atividade dos osteoclastos.
18
1.3.5.1. Fosfatase ácida
As fosfatase ácidas (Acp- do inglês, Acid phosphatases) são uma familia de enzimas que pertecem à classe das hidrolases (Bull et al., 2002). As Acp estão presentes em vários tecidos, nomeadamente, próstata, fígado, estômago, músculo, baço, eritrócitos, plaquetas e osso (Bull et al., 2002). As Acp são constituídas por diferentes isoenzimas, que podem ser separadas por eletroforese em gel de poliacrilamida (Janckila and Yam, 2009). As isoenzimas diferenciam-se umas das outras pelo seu pH ótimo, peso molecular, origem cromossómica, homologia de aminoácidos, extensão da sequência, e pelos seus inibidores (Janckila and Yam, 2009). São encontradas cinco importantes isoformas de Acp em humanos: isoenzima eritrocitária (Acp1), isoenzima prostática (Acp2), isoenzima lisossomal (Acp3), isoenzima macrofágica (Acp5) e isoenzima resistente ao tartarato (Acp5) (Lam et al., 1982; Bull et al., 2002). Todas estas isoenzimas possuem apenas em comum o facto de catalisarem a hidrólise de monoésteres ortofosfato sob condições ácidas (Bull et al., 2002).
1.3.5.2. Fosfatase ácida resistente ao tartarato
A TRAP, também denominada Acp5, é uma isoenzima do tipo 5 da fosfatase ácida (Hollberg et al., 2002). A TRAP distingue-se de todas as outras fosfatases ácidas pelas suas propriedades únicas como a sua resistência à inibição pelo tartarato, à sua rápida mobilidade eletroforética (identificada na banda 5) (Li et al., 1970) e pela sua cor púrpura característica (Halleen et al., 1998).
A TRAP é expressa de forma mais intensa nos ossos e baço, mas também, em menor concentração no pulmão, fígado, timo, colon e rim (Lang and Andersson, 2005).
O soro humano contém duas isoformas estruturalmente relacionadas da TRAP tipo 5: 5a e 5b (Lam et al., 1978). Ambas as isoformas são codificadas pelo mesmo gene, no entanto apenas a isoforma 5b é encontrada no osso e derivada dos osteoclastos (Halleen et al., 2000; Janckila et al., 2001) e a isoforma 5a deriva de macrófagos e células dendríticas (Hayman et al., 2000). A única diferença estrutural entre as duas isoformas é que a TRAP 5a contém resíduos de ácido siálico que não são encontrados na TRAP 5b (Halleen et al., 2000; Kawaguchi et al., 2008).
A regulação da atividade da TRAP ocorre através da redução de iões ferro no centro da enzima, encontrando-se ativa quando reduzida e inativa quando oxidada (Halleen et al.,
19
1998). Um dos iões encontra-se associado a um resíduo de tirosina que o estabiliza, enquanto que o outro ião está sujeito a mudanças no estado redox, regulando assim a atividade desta enzima (Halleen et al., 1998). A regulação da atividade da TRAP através de iões ferro promove alterações da sua coloração em função da sua atividade. Apresenta cor púrpura na sua forma oxidada (inativa), cor rosa na sua forma reduzida (ativa) e sem cor quando está fortemente reduzida (Halleen et al., 1998; Bull et al., 2002).
TRAP 5b tem sido considerado o único biomarcador relevante dos osteoclastos no metabolismo e patologia de doenças ósseas (Janckila and Yam, 2009). A TRAP 5b permite avaliar a reabsorção óssea associada à atividade dos osteoclastos (Halleen et al., 2000; Janckila et al., 2001; Hannon et al., 2004). No entanto, na prática a avaliação da atividade da TRAP 5b em amostras de soro humano, é contaminada pela atividade da TRAP 5a, embora o ajuste do pH ótimo para a TRAP 5b aumente a sua especificidade (Kawaguchi et al., 2008). A pH6,1 a isoforma 5b encontra-se permanentemente ativa, ao passo que a 5a fica inativa (Janckila and Yam, 2009). A avaliação sérica da TRAP 5a é unicamente aplicado como um marcadores da atividade de macrófagos e células dendríticas em doenças inflamatórias crónicas (Janckila and Yam, 2009). A TRAP 5a correlaciona-se positivamente com a doença inflamação crónica associada à CRP, ferritina e triglicéridos (Janckila and Yam, 2009).
Segundo o estudo de Alatalo et al.(2003), a TRAP 5a no soro de rato encontra-se completamente inativo, e apenas a atividade da TRAP5b é detetada com o imunoensaio.
A especificidade das análises bioquímicas da TRAP no soro podem ser reduzidas (Bull et al., 2002), pois tanto a OPN, como a sialoproteina óssea e a osteonectina são fosfoproteínas da matriz óssea que podem atuar como substrato para a TRAP (Ek-Rylander et al., 1994).
1.3.6. Tratamento e prevenção
O tratamento da osteoporose está direcionado primordialmente para a prevenção ou restauro do tecido ósseo, de forma a reduzir a incidência de fraturas. Os fármacos aplicados no tratamento da osteoporose classificam-se em osteoformadores e inibidores da reabsorção óssea. Segundo Queiroz (2006), o fármaco ideal, ainda inexistente, deveria estimular a formação óssea e diminuir a reabsorção óssea, sem interferir na mineralização e sem originar efeitos adversos extra esqueléticos significativos.
Há relativamente pouco a fazer contra o processo natural de envelhecimento dos ossos. No entanto, a prática de exercícios apropriados, a exposição solar e dieta são métodos
20
não farmacológicos, que auxiliam o tratamento e prevenção da osteoporose (Kanis, 1996; Schrager, 2003; Sambrook and Cooper, 2006). A abstenção tabágica, alcoólica e cafeína são também fatores importantes na evolução do tratamento (Queiroz, 2006; Sambrook and Cooper, 2006).
Dos tratamentos farmacológicos é conhecido a terapia de reposição hormonal (Compston, 1997), a utilização de bisfosfonatos (Kanis, 1996; Hochberg et al., 1999), moduladores seletivo do recetor de estrogénio (SERM) (como é o caso do raloxifeno, bazedoxifeno e lasofoxifeno)(Boonen et al., 2012), denosumab (Miller et al., 2008; Boonen et al., 2012), isoflavonas de soja (Brzezinski and Debi, 1999; Devareddy et al., 2006), risedronato de sódio e calcitonina sintética (Simposium Terapêutico, 2002).
1.4. Modelo Animal
Existem diversos modelos experimentais descritos, desde as culturas de células e tecidos (estudos in vitro) (Zhang et al., 2011), animais de laboratório (estudos in vivo), modelos anatómicos (estudos em tecidos de cadáveres de seres humanos)(Marcu et al., 2011) e modelos computacionais/matemáticos (Martin and Buckland-Wright, 2004; Be'ery-Lipperman and Gefen, 2005).
A utilização de animais como modelo de estudo e a transposição para a fisiologia humana foi introduzido por Claude Bernard, por volta de 1865, contribuindo para um importante avanço na investigação científica (citado por Bernard C. 1865 em (Fagundes and Taha, 2004)).
Devido ao alto impacto social, surgiram inúmeras sociedades de proteção de animais. Em 1959, o zoologista William M.S. Russell e o microbiologista Rex L. Burch publicaram um livro “The principles of humane experimental tecnique”, onde estabeleceram o princípio dos 3R’s da experimentação animal: Replace (substituir), Reduce (reduzir) e Refine (refinar)(Fink et al., 2009; Holmes et al., 2010; MB Research Laboratories, 2010).
1.4.1. Modelos animais em estudos de osteoporose
Os modelos animais são utilizados com inúmeros propósitos na investigação da osteoporose, como o estudo da remodelação óssea, de fraturas, na caracterização de mecanismos celulares, biomecânicos, bioquímicos, moleculares e, em especial, para avaliar a