Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
Morus nigra: novo biocatalisador para obtenção de compostos de interesse
industrial
Morus nigra: new biocatalyst for obtaining compounds of industrial interest
DOI:10.34117/bjdv6n7-837
Recebimento dos originais:08/06/2020 Aceitação para publicação:30/07/2020
Rogério Aparecido Minini dos Santos
Doutor em Ciência Farmacêutica
Instituição: Universidade Cesumar – UNICESUMAR Endereço: Av. Guedner, nº 1610, MARINGÁ – PR, Brasil
E-mail: rogerio.santos@unicesumar.edu.br
Gabrielli Furlan
Discente do curso de Farmácia. Centro Universitário de Maringá – UNICESUMAR Instituição: Universidade Cesumar – UNICESUMAR
Endereço: Av. Guedner, nº 1610, MARINGÁ – PR, Brasil E-mail: gabriellifurlan@gmail.com
RESUMO
A síntese de compostos enantiomericamente puros é cada vez mais requisitada pelas indústrias farmacêutica, cosmética e agroalimentar, bem como está estabelecido a importância da quiralidade na atividade e propriedades biológicas de muitos compostos. Desta forma a biocatálise tornou-se uma alternativa viável na produção de compostos de interesse indústria. Assim o objetivo do presente estudo é avaliar as capacidades de biotransformação das folhas Morus nigra do terpenoide (+)-carvona, bem como determinar as condições biocatalíticas ideiais. Foram testadas as variáveis biomassa, concentração de substrato e pH do meio, sendo possível inferir que para todas as condições testadas as folhas de Morus nigra foram capazes de realizar hidrogenação do alceno ativado, bem como a redução da carbonila para álcool quiral. Estes resultados demonstram que a
Morus nigra é uma potencial ferramenta biocatalítica para a obtenção de compostos de interesse
industrial.
Palavras-chave: biocatálise, (+)-carvona, compostos quirais. ABSTRACT
The synthesis of enantiomerically pure compounds are increasingly required by the pharmaceutical, cosmetic and agrifood industries, as well as the importance of chirality in the activity and biological properties of many compounds. Thus, biocatalysis has become a viable alternative in the production of compounds of interest to industry. Thereby, the objective of the present study is to evaluate the biotransformation capacities of Morus nigra leaves of the terpenoid (+)-carvone, as well as to determine the ideal biocatalytic conditions. The variables biomass, substrate concentration and pH of the medium were tested, and it is possible to infer that for all conditions tested, the leaves of M.
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
carbonyl to chiral alcohol. These results demonstrate that M. nigra is a potential biocatalytic tool for obtaining compounds of industrial interest.
Keywords: biocatalysis, (+)-carvone, chiral compounds.
1 INTRODUÇÃO
Os terpenos compreendem uma classe altamente diversificada de produtos naturais, da qual derivam diversos sabores comerciais, fragrâncias e medicamentos. Esses valiosos compostos são comumente isolados de plantas, micro-organismos e organismos marinhos (DEWICK, 2009).
Dentre estes terpenos destaca-se a D-carvona ou (4S)-(+)-carvona, que apresenta um cheiro de cominho/endro, sendo o principal constituinte dos óleos de sementes de alcaravia (Carum carvi) e endro (Anethum graveolens) (de CARVALHO; da FONSECA, 2006). São amplamente empregados pela indústria e como substratos em reações biocatalíticas, devido as várias aplicações, como fragrância e flavours, inibidor de brotos de batata e agente antimicrobiano, juntamente com sua relevância no campo médico (SOUZA et al., 2013). Dentre as aplicações na área da saúde já foi observado que a carvona inibe a patogenicidade da Candida albicans (MCGEADY et al, 2002).
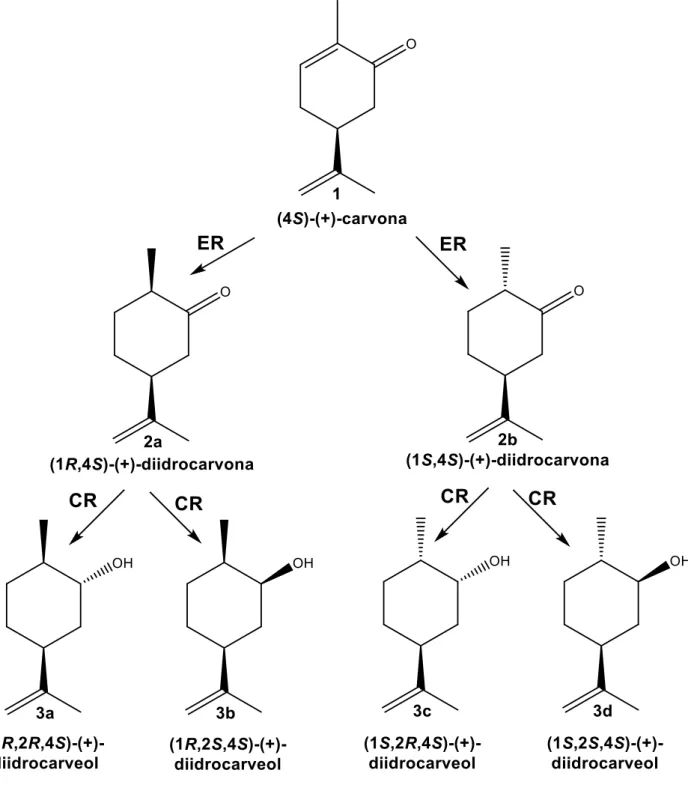
Além disso, os produtos de hidrogenação da ligação dupla C=C ativada da D-carvona, as 2-metil-5-(1-metiletenil)-ciclo-hexanona (diidrocarvona) (2a e 2b) (Figura 1) são considerados blocos de construção renováveis atraentes em todo o mundo, que podem ser aplicados como compostos de partida quirais na síntese de poliésteres, produtos naturais (por exemplo, ácido estriatênico, ácido pechueloico), medicamentos antimaláricos e valiosos quirais sintons. (WINKLER et al., 2012; JIANG et al., 2007; ZHANG et al., 2008). Como exemplo, pode ser citado a utilização da diidrocarvona como precursor biossintético do dispiro-1,2,4,5-tetraoxano, um antimalárico (DONG et al., 2010), precursores quirais para síntese de pirazóis (de ROUVILLE et al., 2009) e valerolactonas (KRAWCZYK et al., 2007).
Mediante a redução da carbonila da diidrocarvona, é possível obter os álcoois 2-metil-5-(1-metiletenil)-ciclo-hexanol (dihidrocarveóis) (3a, 3b, 3c e 3d) (Figura 1), os quais são fragrâncias usados em cosméticos decorativos, fragrâncias finas, shampoos, sabões e outros produtos de higiene, bem como em produtos domésticos, como produtos de limpeza e detergentes (BHATIA et al., 2008).
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
Figura 1: Possíveis rotas biocatalíticas da (4S)-(+)-carvona; ER = ene-redutase; CR = carbonil redutase
Nos últimos anos, culturas de células vegetais e células vegetais inteiras têm sido estudadas como potenciais agentes para reações de biotransformação, como Machado et al. (2006) que observaram a capacidade de fragmentos de tecido de várias plantas, como as de Manihot dulcis,
Manihot esculenta (mandioca), Solanum melongena (berinjela), Daucus carota (cenoura), Colocasia esculenta e Ipomoea batatas, em realizar reduções de cetonas e aldeídos aromáticos em
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
(2016) empregando cultura de células em suspensão de Catharanthus roseus, promoveu reações de hidroxilação e glicosilação do Δ9-tetrahidrocanabinol com o intuito de aumento de polaridade para facilitação em incorporação em formulações farmacêuticas.
A utilização de órgãos inteiros vegetais, sem qualquer preparação preliminar ou transformação, tem sido considerada (BRUNI et al., 2002; VANDENBERGHE et al., 2013). Esta metodologia oferece vantagens em termos de biodisponibilidade e economia de tempo, uma vez que não são necessárias etapas exigentes de preparação, extração, purificação e multiplicação do biocatalisador, promovendo assim a preservação de uma atividade catalítica máxima das enzimas (FONSECA et al., 2009; STRYJEWSKA et al., 2013). Além disso, este tipo de biocatalizador é eco-compatível, uma vez que as reações são realizadas em meio aquoso, à temperatura ambiente e geram apenas resíduos biodegradáveis (CORDELL et al., 2007). No entanto, as plantas e, portanto, suas enzimas não foram extensivamente estudadas para transformações de substratos xenobióticos para fins sintéticos. As enzimas presentes nas células das plantas podem ter propriedades desconhecidas e interessantes que permitiriam novas abordagens na biocatálise (BIROLLI et al., 2015; CORDELL et al., 2007).
Dentre estes subprodutos da agricultura estão as partes não comestíveis da amoreira (Morus sp). Este vegetal é o principal hospedeiro dos bichos-da-seda (Bombyx mori L.), e é explorada em escala comercial para a produção de seda. O gênero Morus tem muitas espécies em todo o mundo sendo a maioria encontrada na Ásia, especialmente na China e no Japão (MAMRUTHA et al., 2010). Este gênero é constituído de aproximadamente 24 espécies, uma subespécie, sendo descrito pelos menos 100 variedades (MACHII et al., 2000; TUTIN et al., 1996).
Neste estudo, as folhas de Morus nigra foram utilizadas como biocatalisador na redução de (4S)-(+)-carvona em sistema tampão para obtenção de diidrocarvonas e diidrocaveois. As condições operacionais para a reação biocatalítica, tais como biomassa do biocatalisador, massa de substrato e pH foram avaliadas, a fim de melhorar tanto a conversão quanto os valores de excesso diastereoisomérico dos produtos.
2 MATERIAL E MÉTODOS
Produtos químicos
O substrato (4S)-(+)-carvona foi obtido da Sigma-Aldrich; o sulfato de sódio anidro, NaH2PO4, KH2PO4 e solventes são Synth.
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
Redução química da (4S)-(+)-carvona
Com a finalidade de obter alcoóis racêmicos para serem utilizados como padrões nas análises de CG/EM, o substrato foi reduzido com NaBH4 de acordo com metodologia descrita e adaptada
por Ward e Rhee (1989). Em um balão de fundo rendondo de 50,0 mL foi adicionado 0,1 g do substrato diluído em 10,0 mL de álcool etílico 95° e resfriado a 0 °C, seguido da adição lenta de 0,1 g de NaBH4. O meio reacional foi mantido sob agitação durante 60 minutos. Após este período, foi
adicionado 20,0 mL de solução saturada de NH4Cl e promovido a extração em funil de separação
com duas porções de 20,0 mL de CH2Cl2. A fase orgânica foi seca sobre Na2SO4 anidro. O solvente
foi evaporado sob pressão reduzida num evaporador rotativo. Os produtos foram analisados por cromatografia em camada delgada (CCD) e cromatografia gasosa acoplada à espectrometria de massa (CG/EM).
Análise por CG/EM
Foi utilizado um CG/EM Agilent Technologies 5977-A, equipado com uma coluna HP-5MS (30 mx 0,25 mm x 0,250 µm). O gás carreador foi o hélio (vazão 1,0 mL/min); o injector no modo
split (20:1) a 220 ºC 1:20; detector quadrupolo à 400 ºC; Impacto de elétrons: 70 eV; temperatura
de fonte de íons à 230 ºC; linha de transferência à 250 ºC; a foi coluna programada com uma rampa de 60-90 °C (3 °C/min) e 90-285 °C (50 °C/ min). O volume injetado foi de 2 μL. A identificação dos produtos foi feita usando o índice de retenção de Kovats (Adams, 2012) e a comparação com a NIST 11.0 library spectra.
Avaliação quantitativa da seletividade do biocatalisador
A conversão (c) dos substratos em produtos foi calculada através da razão entre as áreas dos picos correspondente ao substrato e seus respectivos produtos (Equação 1) e o excesso diastereoisomérico (e.d.) através da Equação 2 (GORETTI et al, 2009; COLLINS, 2014):
Equação 1
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
Reação biocatalítica
As folhas frescas da Morus nigra foram obtidas com produtores da cidade de Mandaguaçu-PR (Brazil), as quais foram lavadas em água corrente, secas com papel filtro e cortadas em pedaços (0,5 cm2) e descontaminadas em solução de NaClO a 1% (MACHADO et al., 2006; CHANG et al., 2010).
Com o objetivo de avaliar a melhor condição biocatalítica, as variáveis biomassa, concentração de substrato e pH foram testadas: em Erlenmeyer de 250 mL contendo 50 mL de solução tampão Sφrensen (Na2HPO4 -KH2PO4) (pH 4, 7 ou 9), foi adicionado a biomassa da M.
nigra (1, 2 ou 3 g) e o substrato (10 ou 20 µL). Os frascos reacionais foram mantidos sob agitação
de 120 rpm à 28°C por 5 dias. Após este período foi realizado filtração e extração dos produtos obtidos com duas porções de 10 mL de acetato de etila. Os extratos resultantes foram concentrados sob pressão reduzida e analisados CCD e CG/EM.
3 RESULTADOS E DISCUSSÃO
As possíveis rotas de biotransformação da cetona α,β-insaturadas, (4S)-(+)-carvona, catalisada pela Morus nigra podem ser observadas nas Figuras 1. Estas rotas são possíveis devido a presença das enzimas ene-redutases (ERs), pertencentes à família “Old Yellow Enzyme” flavina dependentes, extensivamente estudadas por sua capacidade de catalisar a hidrogenação assimétrica de alcenos eletronicamente ativados, como C=C da (4S)-(+)-carvona (GORETTI et al., 2012; WINKLER et al., 2012). A redução da carbonila para álcool quiral pode ser justificada pela presença de carbonil redutases, dependentes de NADH ou NADPH (NI; XU, 2012; WINKLER et al., 2012). Como pode ser observado na Tabela 1, estas rotas metabólicas foram observadas para todas condições biocatalíticas testadas, demonstrando a capacidade das células M. Nigra em realizar reações de biotranformação.
Observa-se na Tabela 1 e na Figura 2, que a variável na qual mais influenciou na eficiência biocatalítica foi a biomassa, ou seja, quanto maior a massa de vegetal utilizada, maior a capacidade de conversão observada. Além disso, a proporção de biomassa e substrato mostrou-se importante na reação, ou seja, maior quantidade do vegetal e menor concentração de substrato, demonstrou maior capacidade em realizar as reações biocatalíticas. Uma possíel explicação é o fato que a alta concentração do substrato pode promover inibição de diferentes enzimas presentes nas células, além disso alguns compostos podem ser tóxicos para a maioria das células vivas (SILVA et al., 2013). Este resultado era esperado mediante observação de outros estudos, como Chang et al. (2010) que promoveram a redução da acetofonona utilizando diversos vegetais, na qual empregaram várias
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
concentrações de substrato (10 a 50 mmol/L), sendo observado que a menor concentração de acetofenona também favoreceu um maior rendimento reacional.
Tabela 1: Bioconversão de (4S)-(+)-carvona por folhas frescas de Morus nigra. Variáveis
% de conversãoa
% dos produtos formados (e.d.)b
Exp. N° Biomassa (g) Substrato (mg) pH 2a 2b 3a 3b 3c 1 1 10 4 45 16 29 (28) - - - 2 1 20 4 13,8 1,3 12,5(81) - - - 3 2 10 4 97 5,4 18,6(55) 3,6 69(88) 0,8 4 2 20 4 59 19,7 40(34) 3,5 30(79) - 5 3 10 4 100 4,3 4,4(1) 7 82,5(81) 1,8 6 3 20 4 85 13,3 38(48) - 7,8(100) - 7 1 10 7 48 3,7 22,5(78) - 1,8(100) - 8 1 20 7 28 6 22(75) - - - 9 2 10 7 80,6 12 66(69) - 2,6(100) - 10 2 20 7 78,2 9 52(70) 1 16,2(88) - 11 3 10 7 99,8 14,7 82(70) - 3,1(100) - 12 3 20 7 75,5 12,5 63(67) - - - 13 1 10 9 47,3 10 21,7(37) 1,8 7,3(16) 3 14 1 20 9 18 5 13(44) - - - 15 2 10 9 85 29,5 38,8(14) 6 10,5(27) - 16 2 20 9 73 23,5 45(31) - 3,3(100) - 17 3 10 9 88,5 19,8 22,5(6) 7,8 26,9(43) 3 18 3 20 9 45,5 20,5 22,8(5) 12,7 30,4(41) -
a Conversão da reação de biocatálise determinada por CG. b Excesso diastereoisomérico
Figura 2: Bioconversão de (4S)-(+)-carvona versus biomassa da Morus nigra.
Fonte: Dados da pesquisa
A construção de compostos quirais contendo um ou mais estereocentros é certamente um dos desafios mais atraentes e importantes da química orgânica sintética contemporânea (HANESSIAN et al., 2013). De encontro a esta realidade, pode ser observado na Tabela 1 que ocorreu a reação de hidrogenação do alceno ativado em todos os protocolos testados, com
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
prevalência da formação da (1S,4S)-diidrocarvona, ou seja, ocorreu trans-hidrogenação. Este resultado foi semelhante ao trabalho realizado por Maczka et al. (2018), que utilizaram diferentes vegetais para biocatalizar a (4S)-(+)-carvona.
Este resultado é extremamente relavante, pois a (4S)-carvona possui três ligações não saturadas e um centro estereogênico em C-5, o que pode proporcionar muitos problemas de seletividade: quimioseleção entre os grupos funcionais C=C e C=O; regioselectividade entre a ligação C=C conjugada e isolada; e diastereosseletividade cis versus trans em relação ao substituinte C-5 nas reduções de ligações C=O e C=O (CHEN et al., 2012). Sem controle sobre a seletividade, são possíveis 8 produtos de hidrogenação diferentes.
A síntese assimétrica de compostos quirais enantioméricos pode ser alcançada com uma ampla gama de enzimas com excelentes perfis de especificidade e seletividade. Em 2010, foi relatado que 70% das substâncias ativas em formulações farmacêuticas eram compostos quirais (BEZBORODOV; ZAGUSTINA, 2016). Logo, a M. nigra representa um possível biocatalizador quiral para obteção de álcoois quirais, pois como pode ser observado na Tabela 1, o diastereoisômero preponderante foi o (1R,2S,4S)-(+)-diidrocarveol (3b).
Em alguns protocolos testados (Tabela 1), foi obtido um excesso diastereoisomérico (e.d.) de 100% no experimento 6, 7, 9, 11 e 16. Desta forma, não é possível inferir qual foi a viariável que influenciou no e.d. Entretanto, é possível afirmar que a enzima foi Prelog estereoespecíficas, ou seja, o íon hidreto do NAD(P)H foi transferido para a face Re da cetona proquiral, produzindo o (S)-álcool (ITOH, 2014).
4 CONCLUSÃO
Ficou demonstrado que a folha em pedaços da Morus nigra apresenta atividade biocatalítica satisfatória, além de apresentar muitas vantagens em relação aos métodos químicos e bioquímicos clássicos: baixo custo, boa enantio- e diastereosseletividade, condições reacionais brandas e resíduos menos poluentes. Portanto, é possivel afirmar que a biocatálise representa uma ferramenta promissora para produção de álcoois opticamente ativos e pode despertar o interesse pela indústria química e farmacêutica.
AGRADECIMENTOS
A Universidade Cesumar – Unicesumar pelo suporte financeiro e estrutural para o desenvolvimento desta pesquisa.
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
REFERÊNCIAS
ADAMS, R. P. Identification of essential oil components by Gas Chromatography/Mass
Spectrometry, 4a edição, Illinois: Allued Books, 2012.
AKHTAR, M. T.; MUSTAFA, N. R.; VERPOORTE, R. Hydroxylation and glycosylation of Δ9
-tetrahydrocannabinol by Catharanthus roseus cell suspension culture. Biocatalysis and
Biotransformation, p. 1-8, 2016. DOI: 10.3109/10242422.2016.1151006
BEZBORODOV, A. M.; ZAGUSTINA, N. A. Enzymatic Biocatalysis in Chemical Synthesis of Pharmaceuticals (Review). Applied Biochemistry and Microbiology, v. 52, n. 3, p. 237-249, 2016. DOI: 10.1134/S0003683816030030
BHATIA, S. P.; MCGINTY, D.; LETIZIA, C. S.; API, A. M. Fragrance material review on laevocarveol. Food and Chemical Toxicology, v. 46, p. S88-S90, 2008. DOI: 10.1016/j.fct.2008.06.055
BIROLLI, W. G.; FERREIRA, I. F.; ALVARENGA, N.; SANTOS, D. A.; MATOS, I. L.; COMASSETO, J. V.; PORTO, A. L. M. Biocatalysis and biotransformation in Brazil: An overview.
Biotechnology Advances, v. 33, p. 481-510, 2015. DOI: 10.1016/j.biotechadv.2015.02.001
BRUNI, R.; FANTIN, G.; MEDICI, A.; PEDRINIB, P.; SACCHETTIB, G. Plants in organic synthesis: an alternative to Baker’s yeast. Tetrahedron Lett., v. 43, p. 3377-3379, 2002. DOI: 10.1016/S0040-4039(02)00514-2
de CARVALHO, C. C. C. R.; da FONSECA, M. M. R. Carvone: Why and how should one bother to produce this terpene. Food Chemistry, v. 95, p. 413-422, 2006. DOI: 10.1016/j.foodchem.2005.01.003
CHANG, X.; YANG, Z.; ZENG, R.; YANG, G.; YAN, J. Production of chiral aromatic alcohol by asymmetric reduction with vegetable catalyst. Chinese Journal of Chemical Engineering, v. 18, n. 6, p. 1029-1033, 2010. DOI: 10.1016/S1004-9541(09)60164-6
COLLINS, C. H. Fundamentos de Cromatografia. Campinas: Editora Unicamp, 2014.
CORDELL, G. A.; LEMOS, T. L. G.; MONTE, F. J. Q.; DE MATTOS, M. C. Vegetables as chemical reagents. J Nat Prod, v. 70, p. 478–92, 2007. DOI: 10.1021/np0680634
CHEN, X.; GAO, X.; WU, Q.; ZHU, D. Synthesis of optically active dihydrocarveol via a stepwise or one-pot enzymatic reduction of (R)- and (S)-carvone. Tetrahedron: Asymmetry, v. 23, p. 734-738, 2012. DOI: 10.1016/j.tetasy.2012.05.019
DEWICK, P. M. Medicinal natural products: a biosynthetic approach, 3ed, Reino Unido: John Wiley & Sons, 2009.
DONG, Y.; MCCULLOUGH, K. J.; WITTLIN, S.; CHOLLET, J.; VENNERSTROM, J. L. The structure and antimalarial activity of disp.iro-1,2,4,5-tetraoxanes derived from (+)-dihydrocarvone.
Bioorganic & Medicinal Chemistry Letters, v. 20, p. 6359-6361, 2010. DOI:
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
FONSECA, A. M.; MONTE, F. J. Q.; DE OLIVEIRA, M.; DE MATTOS, M., CORDELL, G.; BRAZ-FILHO, R.; LEMOS, T. L. G. Coconut water (Cocos nucifera L.) - a new biocatalyst system for organic synthesis. J. Mol. Catal. B: Enzym, v. 57, p. 78-82, 2009. DOI: 10.1016/j.molcatb.2008.06.022
GORETTI, M.; BRANDA, E.; TURCHETTI, B.; CRAMAROSSA, M. R.; ONOFRI, A.; FORTI, L.; BUZZINI, P. Response surface methodology as optimization strategy for asymmetric bioreduction of (4S)-(+)-carvone by Cryptococcus gastricus. Bioresource Technology, v. 121, p. 290-297, 2012. DOI: 10.1016/j.biortech.2012.06.070
GORETTI, M.; PONZONI, C.; CASELLI, E.; MARCHEGIANI, E.; CRAMAROSSA, M. R.; TURCHETTI, B.; BUZZINI, P.; FORTI, L. Biotransformation of electron-poor alkenes by yeasts: asymmetric reduction of (4S)-(+)-carvone by yeast enoate reductases. Enzyme and Microbial
Technology, v. 45, p. 463–468, 2009. DOI: 10.1016/j.enzmictec.2009.09.004
HANESSIAN, S.; GIROUX, S.; MERNER, B. L. Design and strategy in organic synthesis. 1st ed. Weinheim: Wiley-VCH; 2013.
ITOH, N. Use of the anti-Prelog stereospecific alcohol dehydrogenase from Leifsonia and
Pseudomonas for producing chiral alcohols. Appl. Microbiol. Biotechnol., v. 98, p. 3889-3904,
2014. DOI: 10.1007/s00253-014-5619-5
JIANG, C.; BHATTACHARYYA, A.; SHA, C. Enantiospecific total synthesis of (−)-bakkenolide III and formal total synthesis of (−)-bakkenolides B, C, H, L, V, and X. Organic Letters, v. 9, n. 17, p. 3241-3243, 2007. DOI: 10.1021/ol071124k
KRAWCZYK, H.; SLIWINSKI, M.; KEDZIA, J.; WOJCIECHOWSKI, J.; WOLF, W. M. Asymmetric synthesis of enantiomerically pure 7-isopropenyl-4a-methyl-3- methyleneoctahydrochromen-2-ones. Tetrahedron Asymmetry, v. 18, p. 2712-2718, 2007. DOI: 10.1016/j.tetasy.2007.10.039
MACHADO, L. L.; SOUZA, J. S. N.; MATTOS, M. C.; SAKATA, S. K.; CORDELL, G. A.; LEMOS, T. L. G. Bioreduction of aldehydes and ketones using Manihot species. Phytochemistry, v. 67, p. 1637-1643, 2006. DOI: 10.1016/j.phytochem.2006.02.008
MACHII, H.; KOYAMA, A.; YAMANOUCHI, H. FAO Eletronic Conference: Mulberry for animal production, 2000. Disponível em http://www.fao.org/livestock/agap/frg/mulberry
MACZKA, W.; SOŁTYSIK, D.; WINSKA, K.; GRABARCZYK, M.; SZUMNY, A. Plant-Mediated Biotransformations of S(+)- and R(–)-Carvones. Appl. Sci., v. 8, 2018. DOI: 10.3390/app8122605
MAMRUTHA, H. M.; MOGILI, T.; JHANSI LAKSHMI, K.; RAMA, N.; KOSMA, D.; KUMAR, M. U.; JENKS, M. A.; NATARAJA, K. N. Leaf cuticular wax amount and crystal morphology regulate post-harvest water loss in mulberry (Morus species). Plant Physiology and Biochemistry, v. 48, p. 690-696, 2010. DOI: 10.1016/j.plaphy.2010.04.007
Braz. J. of Develop.,Curitiba, v. 6, n. 7, p.53403- 53413 jul. 2020. ISSN 2525-8761
MCGEADY, P.; WANSLEY, D. L.; LOGAN, D. A. Carvone and perillaldehyde interfere with the serum-induced formation of filamentous structures in Candida albicans at substantially lower concentrations than those causing significant inhibition of growth. Journal of Natural Products, v. 65, p. 953-955, 2002. DOI: 10.1021/np010621l.
NI, Y.; XU, J. Biocatalytic ketone reduction: A green and efficient access to enantiopure alcohols.
Biotechnology Advances, n. 30, p. 1279-1288, 2012. DOI: 10.1016/j.biotechadv.2011.10.007
ROUVILLE, H. J.; VIVES, G.; TUR, E.; CRASSOUS, J.; RAPENNE, G. Synthesis and analytical resolution of chiral pyrazoles derived from (5R)-dihydrocarvone. New J. Chem., v. 33, p. 293-299, 2009. DOI: 10.1039/b812123k
SILVA, V. D.; CARLETTO, J. S.; CARASEKA, E.; STAMBUKB, B. U.; NASCIMENTO, M. G. Asymmetric reduction of (4S)-(+)-carvone catalyzed by baker’s yeast: A Green method for monitoring the conversion based on liquid–liquid–liquid microextraction with polypropylene hollow fiber membranes. Process Biochemistry, v. 48, p. 1159–1165, 2013. DOI: 10.1016/j.procbio.2013.05.010
SOUZA, F. V. M.; ROCHA, M. B.; SOUZA, D. P.; MARÇAL, M. R. (-)-Carvone: Antispasmodic effect and mode of action. Fitoterapia, v. 85, p 20-24, 2013. DOI: 10.1016/j.fitote.2012.10.012 STRYJEWSKA, A.; KIEPURA, K.; LIBROWSKI, T.; LOCHYÑSKI, S. Biotechnology and genetic engineering in the new drug development. Part III. Biocatalysis, metabolic engineering and molecular modelling. Pharmacological Reports, n. 65, p. 1102-1111, 2013. DOI: 10.1016/S1734-1140(13)71468-3
TUTIN, G. T.; BURGES, N. A.; CHATER, A. O.; EDMONDSON, J. R.; HEYWOOD, V. H.; MOORE, D. M.; VALENTINE, D. H.; WALTERS, S. M.; WEBB, D. A. Morus L. In Flora
Europa. Psilotaceae to Platanaceae. vol 1. Australia: Cambrigde University Press, 1996.
VANDENBERGHE, A.; MARKÓ, I. E.; LUCACCIONI, F.; LUTTS, S. Enantioselective hydrolysis of racemic 1-phenylethyl acetate by an enzymatic system from fresh vegetables.
Industrial Crops and Products, v. 42, p. 380-385, 2013. DOI: 10.1016/j.indcrop.2012.06.003
WARD, D. E.; RHEE, C. K. Chemoselective reductions with sodium borohydride. Can. J. Chem., v. 67, p. 1206-1211, 1989. DOI: 10.1080/00397918808068259
WINKLER, C. K., TASNÁDI, G., CLAY, D., HALL, M., FABER, K. Asymmetric bioreduction of activated alkenes to industrially relevant optically active compounds. Journal of Biotechnology, v. 162, n. 4, p. 381-389, 2012. DOI: 10.1016/j.jbiotec.2012.03.023
ZHANG, C. X.; ZHANG, C. X.; FANG, L. J.; BI, F. Q.; LI, Y. L. An enantioselective formal synthesis of (−)-thujopsene. Chinese Chemical Letters, v. 19, n. 3, p. 256-258, 2008. DOI: 10.1016/j.cclet.2008.01.009