Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
Transferibilidade de marcadores SSR, diversidade e estrutura genética em
Syagrus oleracea
Transferibility of SSR markers, diversity and genetic structure in Syagrus
oleracea
DOI:10.34117/bjdv6n8-417Recebimento dos originais:08/07/2020 Aceitação para publicação:20/08/2020
Sandy Karolline Souza Santos
Mestre em Biotecnologia pela Universidade Estadual de Montes Claros (Unimontes) Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: sandykarolline@gmail.com
Júlia Rodrigues Ortega
Mestranda em Biotecnologia pela Universidade Estadual de Montes Claros (Unimontes) Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: juliarortegar@gmail.com
Gabriella Pereira Rocha
Graduada em Ciências Biológicas pela Universidade Estadual de Montes Claros (Unimontes) Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: gabriellapereirarocha@gmail.com
Afrânio Farias de Melo
Doutor em Engenharia Florestal pela Universidade de Lavras Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: afraniofariasdemelo@gmail.com
Dario Alves de Oliveira
Doutor em Fitotecnia (Produção Vegetal) pela Universidade Federal de Viçosa Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
Murilo Malveira Brandão
Doutor em Ecologia Aplicada pela Universidade Federal de Lavras Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: murilomalveira@yahoo.com.br
Vanessa de Andrade Royo
Doutora em Produtos Naturais e Sintéticos pela Universidade de São Paulo Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: vanroyo31@gmail.com
Elytania Veiga Menezes
Doutora em Genética pela Universidade de São Paulo Instituição: Universidade Estadual de Montes Claros (Unimontes)
Endereço: Campus Universitário Professor Darcy Ribeiro. Avenida Rui Braga, S/Nº Vila Mauricéia – Montes Claros-MG, Brasil
E-mail: menezes.elytania@gmail.com
RESUMO
Syagrus oleracea é uma espécie nativa do Brasil, pertencente à família Arecaceae. É a única palmeira entre as exploradas comercialmente no país que possui palmito com sabor amargo, além disso possui potencial cosmético e também é indicada para apicultura e recuperação de áreas degradadas. A diversidade dessa espécie se encontra ameaçada devido ao avanço do desmatamento em suas populações naturais e ao extrativismo predatório. Este trabalho teve como objetivo estudar a estrutura e a variabilidade genética dessa planta utilizando como ferramenta a transferibilidade de marcadores microssatélites desenvolvidos para as espécies de Cocus nucifera e Bactris gasipaes. Foram avaliados 54 indivíduos provenientes de 4 populações do norte do estado de Minas Gerais através de 6 marcadores SSR que foram transferidos com sucesso possibilitando estudar a diversidade e a estrutura genética. Os resultados obtidos indicaram que há moderada diversidade genética para as populações avaliadas. O número médio de alelos para as populações foi 4 e a heterozigosidade observada teve valor de 0,233, inferior ao esperado 0,597, demonstrando possível excesso de homozigotos, os valores de heterozigosidade provocada pela endogamia (Fis = 0,603), heterozigosidade provocada pela deriva genética (Fst = 0,091) e heterozigosidade total (Fit = 0,639); todos dentro do intervalo de confiança a 99%. Estes resultados demonstram que há necessidade de implementação de estratégias de conservação dessa espécie sendo observado indícios de elevado grau de parentesco entre os indivíduos.
Palavras-chave: Arecaceae, Cerrado, Conservação genética, Palmeira, Primers, Gueroba,
Variabilidade genética.
ABSTRACT
Syagrus oleracea is a species native to Brazil, belonging to the family Arecaceae. It is the only palm tree among those commercially exploited in the country that has a bitter heart of palm, besides it has cosmetic potential and is also indicated for beekeeping and recovery of degraded areas. The diversity of this species is threatened due to the advance of deforestation in its natural populations and predatory extraction. This work aimed to study the structure and genetic variability of this plant
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
using as a tool the transferability of microsatellite markers developed for the species of Cocus nucifera and Bactris gasipaes. 54 individuals from 4 populations in the north of the state of Minas Gerais were evaluated using 6 SSR markers that were successfully transferred, making it possible to study diversity and genetic structure. The results obtained indicated that there is moderate genetic diversity for the evaluated populations. The mean number of alleles for the populations was 4 and the observed heterozygosity was 0.233, lower than expected 0.597, demonstrating a possible excess of homozygotes, the values of heterozygosity caused by inbreeding (Fis = 0.603), heterozygosity caused by genetic drift (Fst = 0.091) and total heterozygosity (Fit = 0.639); all within the 99% confidence interval. These results demonstrate that there is a need to implement conservation strategies for this species, with evidence of a high degree of kinship between individuals.
Keywords: Arecaceae, Cerrado, Conservation genetics, Palm tree, Primers, Gueroba, Genetic
variability.
1 INTRODUÇÃO
Syagrus oleracea é uma espécie monocotiledônea pertencente à família Arecaceae, subfamília Arecoideae (DRANSFIELD et al., 2008), nativa do Brasil ocorrendo frequentemente nos Estados da Bahia, Minas Gerais, Goiás, Mato Grosso do Sul e São Paulo (HIANE et al., 2011). Possui palmito amargo, muito saboroso, tradicionalmente utilizado na culinária (MATEUCCI et al., 1995), seus frutos e castanhas podem ser consumidos, possuem polpa fibrosa contendo amêndoa sólida, dura, branca e bastante oleaginosa (SANTELLI, 2006) e o óleo tem um alto valor comercial demonstrando potencial para cosméticos (DIAS, LAUREANO, E MING, 2014), as folhas também podem ser usadas na alimentação animal por apresentar composição química e degradabilidade adequados para ruminantes (DE OLIVEIRA et al., 2015), seu caule é único e o ponto de colheita possui grande variabilidade, sendo capaz de ser colhidas após dois anos e meio até seis anos (NASCENTE et al., 2006), essa espécie também possui potencial apícula e indicação para recuperação de áreas degradadas (MODRO et al., 2015).
S. oleracea é a única palmeira entre as exploradas comercialmente no Brasil que possui palmito com sabor amargo (DOS REIS et al., 2011) e por isso apresenta importância relevante na culinária de várias regiões e por ser uma espécie não domesticada (CLEMENT, 2001) as informações sobre a caracterização morfológica de acessos que possam ser utilizados em programas de melhoramento são escassas. O extrativismo dessa cultura tem sido principalmente de árvores de crescimento natural, o que levou a um declínio de suas populações nativas (DE AGUIAR e DE ALMEIDA, 2000) e que pode ocasionar perdas irrecuperáveis de variabilidade genética em áreas de ocorrência natural, com isso mais atenção deve ser direcionada a estudos relacionados à caracterização do comportamento ecológico, variabilidade genética, conservação de germoplasma, seleção de genótipos superiores e desenvolvimento de métodos eficientes de propagação, a fim de
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
proporcionar condições para o desenvolvimento de futuros trabalhos de melhoramento genético (SILVA-CARDOSO, 2017).
Para descrição de padrões da variabilidade genética em populações naturais de plantas, os marcadores moleculares são bastante utilizados. Essas ferramentas tornam possível a detecção de variações no genoma em qualquer estágio de desenvolvimento das plantas (KAMADA et al., 2009). Há diversas classes de marcadores que podem ser utilizados para estimar a variabilidade genética, os mais utilizados em plantas perenes são os marcadores moleculares, devido a uma série de características que possuem, dentre elas o fato de serem independentes do estádio fisiológico da planta, o que os tornam ideais para caracterização de recursos genéticos de espécies como S. oleracea (MILACH, 1998). Os marcadores microssatélites destacam-se como um dos mais úteis marcadores moleculares para avaliação de fluxo gênico, diversidade genética e estrutura populacional em espécies vegetais (XIAO et al., 2014). Microssatélites ou SSR (Sequências Simples Repetidas) são sequências de 1 a 6 nucleotídeos, chamados de motivos, repetidos em tandem (LITT e LUTY, 1989).
Marcadores microssatélites são altamente informativos, o que permite serem utilizados em estudos de conservação, na investigação de processos microevolutivos que ocorrem nas populações, entre outros (HEYWOOD & IRIONDO, 2003). Marcadores microssatélites apresentam muitas características desejáveis, no entanto, isolar e desenvolver pares de primers para regiões específicas tem como fator limitante a necessidade de conhecer a sequência de DNA para delimitar o loco microssatélite. Desenvolver marcadores microssatélites é um trabalho que demanda mão de obra qualificada, dispõem de custo elevado e tempo (FERREIRA & GRATTAPAGLIA, 1998).
Os marcadores microssatélites específicos em S. oleracea estão ausentes, com isso a transferência de loci heterólogos representa uma alternativa viável para inferir o fluxo gênico entre populações e a seleção de áreas prioritárias para a conservação da diversidade genética, levando em conta o alto custo e o tempo dispensado para o desenvolvimento de marcadores microssatélites, a estratégia de análise de transferibilidade desses marcadores de uma espécie para outra é bastante oportuna, principalmente em espécies importantes econômica, social e ambientalmente.
A transferência de microssatélites entre espécies vem sendo estudada e realizada com sucesso no gênero Syagrus contudo fazem-se necessários novos estudos, uma vez que existem inúmeras espécies que ainda não possuem marcadores microssatélites desenvolvidos, portanto este trabalho teve como objetivo avaliar a transferibilidade de seis primers SSR desenvolvidos para as espécies Cocus nucifera e Bactris gasipaes em S. oleracea e com isso estimar a diversidade genética
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
e a estrutura de populações naturais de S. oleracea (Mart.) Becc. para que os resultados adquiridos possam ser utilizados como subsídios em estratégias de conservação e uso sustentável da espécie.
2 MATERIAL E MÉTODOS
2.1 AMOSTRAGEM
Foram amostradas quatro populações para a realização de análises genéticas coletadas aleatoriamente folhas de plantas adultas de 54 indivíduos. As coordenadas “Universal Transversa de Mercator” (UTM) de todos os indivíduos de Syagrus oleracea amostrados foram obtidos com utilização de equipamento de identificação de posição de coordenadas “Global Positioning System” (GPS).
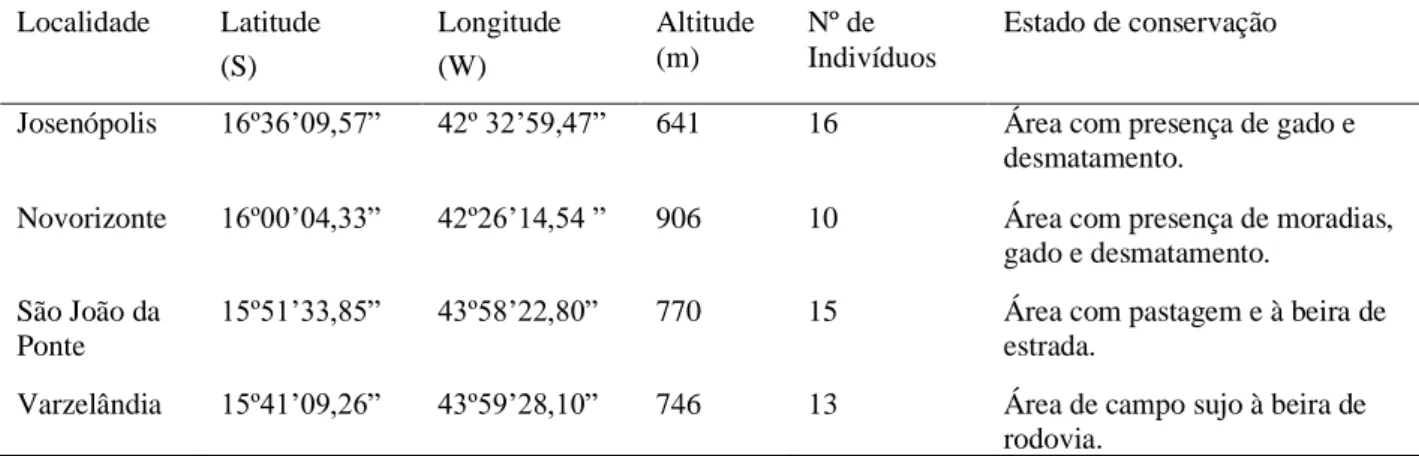
As amostras de S. oleracea foram obtidas de quatro municípios localizados no norte do estado de Minas Gerais, sudeste do Brasil: Josenópolis, Novorizonte, São João da Ponte e Varzelândia (Tabela 1).
Tabela 1. Fitofisionomia das áreas amostradas em municípios do norte do estado de Minas Gerais para caracterização
da diversidade genética de Syagrus oleracea.
2.2 EXTRAÇÃO E QUANTIFICAÇÃO DO DNA
A extração do DNA genômico dos folíolos foi realizada no Laboratório de Bioprospecção e Recursos Genéticos da Universidade Estadual de Montes Claros (UNIMONTES), Montes Claros, Minas Gerais, de acordo com a metodologia CTAB (“cetyl trimethyl ammonium bromide”) proposta por Doyle e Doyle (1987)). Os folíolos foram macerados com nitrogênio líquido em almofariz de porcelana. Em seguida foi adicionado 700 μL de tampão de lise (Tris – HCl 1M pH 8,0; EDTA 0,25M pH 8,0; NaCl 5M; H2O destilada; CTAB 5%; PVP sólido e β-mercaptoetanol). Os macerados
foram transferidos para microtubos e mantidos em banho-maria (65°C) durante uma hora. Após a incubação foi realizada a desproteinização por meio de adição de 600 μL de clorofórmio-álcool isoamílico (24:1). Posteriormente, as amostras foram agitadas, centrifugadas e o sobrenadante de
Localidade Latitude (S) Longitude (W) Altitude (m) Nº de Indivíduos Estado de conservação
Josenópolis 16º36’09,57” 42º 32’59,47” 641 16 Área com presença de gado e desmatamento.
Novorizonte 16º00’04,33” 42º26’14,54 ” 906 10 Área com presença de moradias, gado e desmatamento.
São João da Ponte
15º51’33,85” 43º58’22,80” 770 15 Área com pastagem e à beira de estrada.
Varzelândia 15º41’09,26” 43º59’28,10” 746 13 Área de campo sujo à beira de rodovia.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
cada amostra foi transferido para tubos de 1,5 mL, adicionado 400 μL de álcool isopropílico, agitados e levados para o freezer durante 1 hora. Após centrifugação, o sobrenadante foi transferido para um novo tubo e adicionou-se 400 μL de etanol 70%. Os tubos foram agitados e centrifugados. O etanol 70% foi desprezado e adicionado a mesma proporção (400 μL) de etanol 100% que foi centrifugado e descartado o sobrenadante. Em seguida o pellet de DNA foi deixado para secar naturalmente e no dia seguinte ressuspendido em 100 μL de TE 1X. O DNA nas amostras foi constatado por meio do teste de DNA total realizado com utilização de eletroforese em gel de agarose e em seguida o DNA foi armazenado em freezer à -20°C.
A quantificação do DNA foi feita por comparação com DNA padrão em gel de agarose 1% (p/v) corado com Brometo de Edítio 0,5µg/mL. Para cada amostra, em um microtubo foi adicionado 5 µL de DNA e 3 µL de tampão de amostra, as amostras foram inseridas nos poços do gel com micropipeta. Em seguida foi aplicado voltagem de 100v durante 1:30horas para separação dos fragmentos. Posteriormente o gel foi examinado através de radiação ultra violeta em fotodocumentador comparando com DNA ladder e fotografado.
2.3 AMPLIFICAÇÃO E GENOTIPAGEM DO DNA
Para a amplificação foram testados seis primers desenvolvidos para as espécies de Cocus nucifera (Rivera et al., 1999) e Bactris gasipaes (Billotte et al., 2004; Rodrigues et al., 2004), todas pertencentes à família Arecaceae (Tabela 2). Para a reação foram utilizados 2,6 µL de Tampão 10X KAPA Taq Buffer B (KapaBiosystems); 0,5 µL de forward e reverse primers a 10µM/µL; 0,9 µL de dNTP’s a 2,5mM; 0,9 µL de Taq – polimerase (KapaBiosystems) a 5U/µL; 1,5 µL de amostra de DNA e água ultrapura até o volume final de 25 µL. A PCR foi realizada utilizando termociclador Veriti 96 (Applied Biosystems) com o seguinte programa de termociclagem: uma etapa inicial de desnaturação a 95 °C por 5 minutos, seguido de 35 ciclos de desnaturação a 94 °C por 1 minuto, anelamento de acordo com a temperatura testada ( 50º, 52º, 53º e 56ºC) por 1 minuto e extensão a 72 ° C por 1 minuto, mais uma etapa final de extensão a 72 ° C por 30 minutos.
Tabela 2. Sequência dos primers.
Primers Sequência (5’- 3’)
Bg 02-10 F: ATT GGG TCC AGA TCC TCT TT
R: GTG GCA CAC ATG GGG TTC
CNZ03 F: CAT CTT TCA TCA TTT AGC TCT
R: AAA CCA AAA GCA AGG AGA AGT
CNZ44 F: CAT CAG TTC CAC TCT CAT TTC
R: CAA CAA AAG ACA TAG GTG GTC
CNZ57 F: AGT GAC AGC TCA AAG CAG TAT
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
mBgCIRO53 F: TTC AGT TAA GAC CAC CTA TCA
R: ACG AAG AAA TCG AAC CAT AC
mBgCIRO66 F: GCA TGT TGC ATT GAC TA
R: GAA TCC TGG TTC AGA TAC T
Os produtos da PCR foram genotipados em sequenciador ABI 3130 (Applied Biosystems®). Os cromatogramas produzidos foram analisados pelo programa STRand v. 2.2.30 (University of California), através dos tamanhos dos fragmentos foi criada uma planilha para cada população para posterior análise estatística.
2.4 ANÁLISE DOS DADOS
Foi realizada uma análise preliminar para identificar e corrigir erros de genotipagem utilizando o software Micro-Checker v. 2.2.3 (VAN OOSTERHOUT et al., 2004). Para análise da diversidade e estrutura genética foram utilizados os programas Genetic Data Analysis - GDA 1.1 (LEWIS e ZAYKIN, 2001) e FSTAT 2.9.4 (GOUDET, 2003). Através do programa GDA foi quantificado o número de alelos por locus (NA) e número de alelos por população (A), heterozigosidade esperada (He), heterozigosidade observada (Ho) sobre o equilíbrio de Hardy-Weinberg e o índice de fixação de Wright (ƒ). A estrutura genética foi avaliada pelas estatísticas de F pelo método de Weir e Cockerham (1984) com base nas frequências observadas e esperadas de heterozigotos com utilização do programa FSTAT 2.9.4 com correção de Bonferroni. Os valores da estatística F de Wright são amplamente utilizados por biólogos populacionais para avaliar níveis de estruturação em amostras de populações naturais. O FIS mede o déficit de heterozigotos nas
populações (coeficiente de endogamia), o FST mede o déficit de heterozigotos entre as populações e
o FIT mede o déficit global de heterozigotos (WRIGHT, 1921, 1969). Foram testadas 1.000
permutações para análise da significância dos componentes da variância com os intervalos de confiança a 95%.
3 RESULTADOS
A transferibilidade dos seis marcadores microssatélites desenvolvidos para Cocus nucifera e Bactris gasipaes testados em S. oleracea foi realizada com sucesso, possibilitando estudar a diversidade e a estrutura genética da espécie nas populações de Josenópolis, Novorizonte, São João da Ponte e Varzelândia, norte do estado de Minas Gerais. As populações apresentaram valores significativos de endogamia, baixa heterozigosidade e maior diversidade genética dentro das populações do que entre as populações.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761 3.1 TRANSFERIBILIDADE DOS PRIMERS
Os seis primers testados foram transferidos com sucesso, geraram produtos de amplificação e foram polimórficos. Os primers exigiram ajustes na temperatura de anelamento conforme Tabela 3, apresentaram como média do número de alelos por locus o valor de 6,33 e o tamanho dos fragmentos variaram de 50-350pb.
Tabela 3. Primers SSR testados em Syagrus oleracea. Ta (ºC) descrita = temperatura de anelamento descrita na literatura; Ta (ºC) ajustada = temperatura de anelamento ajustada; NA = número de alelos por locus.
3.2 DIVERSIDADE GENÉTICA
As heterozigosidades médias observadas para as populações de S. oleracea testadas foram inferiores às heterozigosidades esperadas, com excesso de homozigotos em relação quando em Equilíbrio de Hardy-Weinberg, tendo como média o valor de 0,233. O número médio de alelos por populações variou entre 3,33 e 4,5, tendo como média 4,00 (Tabela 4).
Tabela 4. Parâmetros de diversidade genética das quatro populações de Syagrus oleracea baseadas em seis loci
microssatélites. He = heterozigosidade esperada; Ho = heterozigosidade observada; ƒ = coeficiente de endogamia; A = número médio de alelos por população. Para f valores seguidos de * são significativos [IC 95%].
3.3 ESTRUTURA GENÉTICA
Os valores das estimativas das estatísticas F de Wright se encontram na Tabela 5, no qual todos se encontram dentro do intervalo de confiança a 95% e a 99%. Os intervalos de confiança
Primer Repetições Ta (ºC) descrita Ta (ºC) ajustada NA Bg 02-10 CT(10)TT(CT)5 64 53 5 CNZ03 (GA)7 51 53 8 CNZ44 (GA)15 53 50 4 CNZ57 (GT)x(GA)y 50 52 8 mBgCIRO53 (GA)14 52 56 7 mBgCIRO66 (GA)19 52 50 6 População He Ho f A Josenópolis 0.570 0.100 0.832* 3.33 Novorizonte 0.626 0.255 0.600* 4.50
São João da Ponte 0.581 0.308 0.481* 3.67
Varzelândia 0.611 0.271 0.565* 4.50
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
foram calculados através de procedimentos de reamostragem do tipo bootstrap sobre os loci para a média dos mesmos. Através dessas estatísticas pode-se constatar que há maior variabilidade genética dentro das populações (Fst = 0,091) do que entre as populações (Fis = 0,603).
Tabela 5. Estimativas das estatísticas F de Wright em Syagrus oleracea.
Fis (IC 95%) Fst (IC 95%) Fit (IC 95%)
Todos locos 0.603 (0.324 a 0.929) 0.091 (0.024 a 0.155) 0.639 (0.345 a 0.940)
4 DISCUSSÃO
4.1 TRANSFERIBILIDADE DOS PRIMERS
Entre tantos marcadores desenvolvidos, os marcadores microssatélites se destacam em estudos de variação genética por possuírem alguns atributos que fazem com que sejam altamente informativos e de fácil utilização apresentando elevado polimorfismo, alelos múltiplos, padrão de herança codominante, abundância e ampla distribuição ao longo do genoma (FERREIRA & GRATTAPAGLIA, 1998). Têm-se observado que pode ocorrer a conservação de regiões flanqueadoras de microssatélites entre espécies relacionadas sendo possível, portanto, utilizar primers denominados heterólogos, que foram desenvolvidos para uma espécie e empregá-los nas demais espécies do gênero (BARBARÁ et al., 2007), proporcionando assim um aumento no número de dados que podem ser obtidos a partir desses marcadores, principalmente em relação às espécies frutíferas do Cerrado, para as quais não existem sequências disponíveis em bancos de dados (MIRANDA, 2014).
Os seis primers testados, desenvolvidos para espécies de outros gêneros, Cocus nucifera e Bactris gasipaes, geraram produtos polimórficos de amplificação em S. oleracea após serem ajustadas as temperaturas de anelamento. A transferibilidade de loci microssatélites é bastante desigual dependendo de qual nível taxonômico as espécies alvo da transferibilidade estão inseridas (família – gênero – espécie) (BARBARÁ et al., 2007).
Alguns trabalhos na literatura relatam dificuldades na transferência de loci SSR entre espécies de gêneros distintos. Fortes et al. (2016) encontraram taxa de transferibilidade com primers desenvolvidos para Phoenix dactylifera para palmeira Astrocaryum vulgare a igual a 0%; Kpaténon et al. (2020) ao testarem a transferência de oitenta marcadores microssatélites para palmeira africana Borassus aethiopum apenas dezoito geraram produtos de amplificação; Mistura et al. (2012) obtiveram 40% de sucesso ao transferir loci desenvolvidos para Cocus nucifera em Butia odorata.
Para espécies relacionadas a taxa de transferibilidade pode chegar a mais de 60% de sucesso (BARBARÁ et al.,2007). O gênero Syagrus apesar de ainda não possui marcadores específicos
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
validados os primers de espécies da mesma família mostrou-se eficiente neste trabalho, detectando uma média de 6,33 alelos por locus.
Os amplicons para os marcadores transferidos apresentam tamanhos diferentes em comparação com os relatados na espécie original (LAINDORF et al., 2019), neste estudo os tamanhos dos fragmentos variaram de 50 a 350pb, diferindo dos tamanhos descritos na literatura. A diferença de tamanho entre os fragmentos amplificados permite detectar o polimorfismo, essa diferença se deve ao número de repetições dentro dos microssatélites (RALLO et al., 2000).
4.2 DIVERSIDADE GENÉTICA
A heterozigosidade ou diversidade genética é a medida mais importante e a mais utilizada para estimar a variabilidade genética e menos sensível às variações no tamanho da amostra (BROWN e WEIR, 1983). A heterozigosidade observada neste trabalho foi bem abaixo que a heterozigosidade esperada com média de 0,233 variando entre 0,100 e 0,308; sendo a heterozigosidade esperada igual a 0,597 e o número médio de alelos para as quatro populações estudadas igual a 4.
As populações de Josenópolis e Novorizonte são utilizadas como pasto, o que não é bom para a regeneração natural da planta devido o pisoteamento do gado e por se alimentarem das plantas jovens, já as populações de São João da Ponte e Varzelândia além da presença de pastagem estão localizadas em áreas muito próximas a estrada e rodovia.
Os indivíduos de S. oleracea estão localizados em pequenos fragmentos isolados, resultando em coeficientes de endogamia significativo para todas as populações, com média de 0,617, demonstrando possível excesso de homozigotos devido ao cruzamento com indivíduos aparentados.
Resultados semelhantes aos encontrados neste trabalho foram encontrados com a espécie Acrocomia emensis também na região norte do estado de Minas Gerais, que obteve heterozigosidade bem inferior ao esperado, sendo justificada pelo vasto desmatamento da região para pastagem e plantação de Eucalyptus spp. (NEIVA et al.,2016). Outro estudo com a palmeira S. romanzoffiana em populações naturais coletadas no sul do Brasil a heterozigosidade observada também apresentou valores bem inferiores dos esperados (LAINDORF et al., 2019); já para palmeira S. coronata, estudo realizado com três populações no estado da Bahia encontrou média do número de alelos por locus no valor de 9,8 e heterozigosidade observada superior à esperada (SIMPLICIO et al., 2017), porém não foram descritas as condições de conservação das áreas em que foram coletadas as amostras.
Estudo realizado com S. oleracea com amostras coletadas no estado de Minas Gerais demonstrou de média a baixa diversidade genética dessa espécie na região (DE SOUZA et al.,
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
2019), corroborando com os valores encontrados neste trabalho, concluindo que ainda há diversidade genética nas populações dessa palmeira — apesar dos fatores propiciarem a endogamia — que necessitam de um manejo correto para conservação da espécie e futuro melhoramento genético.
O conhecimento da diversidade genética entre os progenitores é importante para o melhoramento de plantas, principalmente para identificar combinações híbridas de maior heterozigosidade e maior efeito heterótico, pois permite conhecer o germoplasma disponível (Domiciano et al., 2015).
Segundo Teixeira (1996) a exploração comercial de S. oleracea é vista como uma atividade extrativista, realizada de maneira irracional, sem controle e sem preocupação com sua regeneração natural. Dessa maneira, as reservas naturais da espécie sofreram uma redução, o que futuramente pode acarretar em grandes dificuldades para sua exploração, particularmente, devido ao seu uso indiscriminado, podendo até mesmo levá-la à extinção.
Deve-se ressaltar que a atividade extrativista promove, primeiramente, a coleta do palmito das plantas mais vigorosas, as quais tendem a ser mais precoces. Isso impede que estas se propaguem, pois não há rebrota e muito menos perfilhamento, prática que conduz a uma seleção negativa, uma vez que apenas as plantas menos vigorosas é que vão ficar para reprodução (DOS REIS et al., 2016), sendo mais uma justificativa da importância de mais estudos voltados a conservação e gestão dessa palmeira.
4.3 ESTRUTURA GENÉTICA
Por meio da estatística de F é possível diferenciar a diminuição da heterozigosidade provocada pela endogamia (Fis) da provocada pela deriva genética (Fst) (MCMANUS et al., 2010). Resultados de Fst = 0 indicam que as populações têm frequências de alelos idênticas e Fst = 1 indicam que as populações fixaram alelos diferentes, o valor encontrado neste trabalho de Fst para todos os loci foi de 0,091, podendo ser interpretado como moderada diferenciação genética de acordo com o sugerido por Wright (1978), no qual valores de Fst de 0,00 a 0,05 indicam baixa diferenciação genética, valores de 0,05 a 0,15 indicam média diferenciação genética e valores de 0,15 a 0,25 indicam alta diferenciação genética.
Os resultados encontrados neste trabalho também mostraram que existe maior diversidade dentro das populações do que entre as populações, sendo constatado pelo valor de Fis — déficit de heterozigotos nas populações — maior do que o valor de Fst — déficit de heterozigotos entre as populações — Fis = 0,603, Fst = 0,091. Valores semelhantes, de maior diversidade dentro das
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
populações do que entre as populações, também foram encontrados para espécie Acrocomia emensis, Fis = 0,784 e Fst = 0,069 (NEIVA et al., 2016). Segundo Hu et al., (2010) na maioria das vezes, espécies alógamas, apresentam valores de diversidade genética maiores dentro das populações, em relação a espécies autógamas, o que foi constado neste trabalho. A palmeira S. oleracea em estudo anterior também demonstrou que a divergência genética entre as populações é mais baixa do que a divergência genética dentro das populações (DE SOUZA et al., 2019), semelhante aos resultados em estudo com a palmeira Butia capitata no sul do Brasil (BÜTTOW et al.,2010).
A existência de maior variabilidade dentro das populações do que entre elas é típico de espécies que apresentam mecanismos eficientes de dispersão de pólen e de sementes (LOVELESS e HAMRICK,1984), como é o caso das palmeiras por possuírem frutos muito apreciados por mamíferos, aves e répteis (MIRANDA et al., 2001; GALETTI et al., 2003), o que sugere ser este o caso da espécie deste estudo, por ser indicada ao uso de recuperação de áreas degradadas pela atratividade à fauna.
S. oleracea pertence a uma família que constitui um componente importante das comunidades de plantas nas florestas tropicais pela rede de interações com seus polinizadores e dispersores (PIRES, 2006). Estudo com S. romanzoffiana corrobora essas afirmações, no qual constata que em área de proteção houve maior riqueza alélica entre os indivíduos e os coeficientes de consanguinidade tiveram valores mais baixos do que em áreas defaunadas (GIOMBINI et al., 2017).
5 CONCLUSÕES
Os loci desenvolvidos para Cocus nucifera e Bactris gasipaes Bg 02-10, CNZ03, CNZ44, CNZ57, mBgCIRO53, mBgCIRO66 mostraram-se transferíveis para S. oleracea e revelaram ser eficientes para estimar a diversidade e estrutura genética e identificar o polimorfismo entre os indivíduos nas populações de Josenópolis, Novorizonte, São João da Ponte e Varzelândia – Norte de Minas Gerais – por isso podem ser indicados para estudos de caracterização molecular.
Os resultados apresentaram elevado grau de parentesco e diversidade genética que se mostrou distribuída principalmente dentro das populações, o que evidencia a necessidade de conservação da espécie. Estimar a diversidade genética de espécies ameaçadas e exploradas é um passo importante no sentido da conservação e manejo sustentado, portanto as informações obtidas neste trabalho podem servir para subsidiar a maneira de extrativismo da espécie e para estudos genéticos populacionais, contribuindo para a sua conservação.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
REFERÊNCIAS
BARBARÁ, T., PALMA-SILVA, C., PAGGI, G. M., BERED, F., FAY, M. F., & LEXER, C. Cross-species transfer of nuclear microsatellite markers: potential and limitations. Molecular
Ecology, v. 16, n. 18, p. 3759–3767, 2007. https://doi.org/10.1111/j.1365-294X.2007.03439.x
BILLOTTE, N.; COUVREUR, T.; MARSEILLAC, N.; BROTTIER, P.; PERTHUIS, B.; VALLEJO, M.; NOYER, J. L.; JACQUEMOUD‐COLLET, J. P.; RISTERUCCI, A. M.; PINTAUD, J. C. A new set of microsatellite markers for the peach palm (Bactris gasipaes Kunth); characterization and across-taxa utility within the tribe Cocoeae. Molecular Ecology Notes, v. 4, n. 4, p. 580-582, 2004. https://doi.org/10.1111/j.1471-8286.2004.00741.x
BROWN, A. H. D.; WEIR, B. S. Measuring genetic variability in plant populations. In: TANKSLEY, S. D.; ORTON, T. J. (Eds.). Isozymes in plant genetics and breeding. Part A. Amsterdan: Elsevier Science Publishers, p.73-86, 1983.
BÜTTOW, M. V., CASTRO, C. M., SCHWARTZ, E., TONIETTO, A., & BARBIERI, R. L. Caracterização molecular de populações de Butia capitata (Arecaceae) do sul do Brasil através de marcadores AFLP. Revista Brasileira Fruticultura, v. 32, n. 1, p. 230-239, 2010. https://doi.org/10.1590/S0100-29452010005000001
CLEMENT, C. R. Melhoramento de espécies nativas {Improvement of native species}. In: NASS, L. L.; VALOIS, A. C. C.; MELO, I. S.; VALADARESINGLIS, M. C. (Ed.). Recursos genéticos
& melhoramento: plantas, Rondonópolis: Fundação de Apoio à Pesquisa Agropecuária de Mato
Grosso, p. 423-441, 2001.
DE AGUIAR, J. L. P.; DE ALMEIDA, S. P. Gueroba (Syagrus oleracea Becc.) nas comunidades rurais II – Sistema de produção e avaliação econômica. Documento 24. Ministério da Agricultura e do Abastecimento ‐ MAPA/Empresa Brasileira de Pesquisa Agropecuária – EMBRAPA/CERRADOS, Planaltina ‐ DF, 2000
DE OLIVEIRA, E. R.; MONÇÃO, F. P.; GABRIEL, A. M. A.; SANTOS, R. A.; MOURA, L. V.; SANTOS, M. V.; SILVA, L. V. M. Valor nutricional dos resíduos industriais da guariroba (Syagrus oleracea) para ruminantes. Revista Brasileira de Ciências Agrárias. Recife, v. 10, n. 2, p. 334-339, fev. 2015.
DE SOUZA, L. R.; MELO JÚNIOR, A. F.; ROYO, V. A.; SOARES, H. F.; BRANDÃO, M. M.; OLIVEIRA, D. A.; RIBEIRO, S. L. R.; MENEZES, E. V. Genetic Diversity and Fine-Scale Genetic Structure in Syagrus oleracea (Mart.) Becc.: A Survivor Palm Species of the Semiarid. Journal of
Agricultural Science; Vol. 11, No. 6; 2019. https://doi.org/10.5539/jas.v11n6p373
DIAS, J. E.; LAUREANO, L. C.; MING, L. C. Production chain for gueroba oil (Syagrus oleracea): Generating income for small Family farms and promoting agrobiodiversity. Revista Brasileira de
Agroecologia, v. 9, p. 122–133, 2014.
DOMICIANO, G. P.; ALVES, A. A.; LAVIOLA, B. G.; CONCEIÇÃO, L. D. H. C. S. da. Parâmetros genéticos e diversidade em progênies de Macaúba com base em características morfológicas e fisiológicas. Ciência Rural, v. 45, p. 1599-1605, 2015. https://doi.org/10.1590/0103-8478cr20140909
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
DOS REIS, E. F.; NUNES, H. F.; PINTO, J. F. N. Dissimilaridade genética entre genótipos de guariroba originados de três municípios do estado de Goiás. Revista Agrotecnologia, Lavras, v.2, n.1, p.1-18, 2011. http://dx.doi.org/10.12971/2179-5959.v02n01a01
DOYLE, J. J.; DOYLE, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin, v.19, p.11-15, 1987.
DRANSFIELD, J. Genera Palmarum: the evolution and classification of palms. Kew Publishing,
Royal Botanical Garden, Londres, 2008.
HEYWOOD, V. H. & IRIONDO, J. M. Plant conservation: Old problems, new perspectives.
Biological Conservation, v.113, p.321-335, 2003.
FERREIRA, M. E. & GRATTAPAGLIA, D. Introdução ao uso de marcadores moleculares em análise genética. 3.ed. Brasília: Embrapa. 1998.
FORTES, A. C. R.; DE OLIVEIRA, M. S. P.; DE OLIVEIRA, N. P.; SANCHES, E. N. M.; CUNNHA, E. F. M. Transferibilidade de locos microssatélites desenvolvidos em outras espécies de palmeiras para Astrocaryum vulgare Mart. Revista de Ciências Agrárias. v. 59, n. 1, p. 80-86, jan./mar. 2016. http://dx.doi.org/10.4322/rca.1844
GALETTI, M.; PIZO, M. A.; MORELLATO, P. Fenologia, frugivoria e dispersão de sementes. Métodos de estudos em biologia da conservação e manejo da vida silvestre. Curitiba, p.395-422, 2003.
GIOMBINI, M. I.; BRAVO, S. P.; SICA, Y. V.; & TOSTO, D. S. Early genetic consequences of defaunation in a large-seeded vertebrate-dispersed palm (Syagrus romanzoffiana). Heredity, v. 118, n. 6, p. 568–577, 2017. https://doi.org/10.1038/hdy.2016.130
GOUDET, J. FSTAT, A program to estimate and test population genetics parameters (Version 2.9.4). (2003). Disponível em [https://www2.unil.ch/popgen/softwares/fstat.htm]
HIANE, P. A.; FERREIRA, V. A.; RAMOS FILHO, M. M.; RAMOS, M. I. L.; CAMPOS, R. P. Caracterização química do palmito guariroba in natura e congelado. Ciência Rural, v.41, n.6, p.1082-1087, 2011. https://doi.org/10.1590/S0103-84782011005000063
HU, Y.; WANG, L.; XIE, X.; YANG, J.; LI, Y.; ZHANG H. Genetic diversity of wild populations of Rheum tanguticum endemic to China as revealed by ISSR analysis. Biochemical Systematics
and Ecology 38(3): 264-274, 2010.
KAMADA, T.; PICOLI, E. A. T.; ALFENAS, A. C.; CRUZ, C. D.; VIEIRA, R. F.; OTONI, W. C. Diversidade genética de populações naturais de Pfaffia glomerata (Spreng.) Pedersen estimada por marcadores RAPD. Acta Scientiarum. Agronomy, Maringa, v. 31, n. 3, p. 403-409, 2009. https://doi.org/10.4025/actasciagron.v31i3.548
KPATÉNON, M. J.; SALAKO, V. K.; SANTONI, S.; ZEKRAOUI, L.; LATREILLE, M.; TOLLON-CORDET, C.; MARIAC, C.; JALIGOT, E.; BEULÉ, T.; ADÉOTI, K. Transferability, development of Single Sequence Repeat (SSR) markers and application to the analysis of genetic
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
diversity and population structure of the African fan palm (Borassus aethiopum Mart.) in Benin.
bioRxiv, 2020. https://doi.org/10.1101/2020.01.30.926626
LAINDORF, B. L.; METZ, G. F.; KÜSTER, M.C.T.; LUCINI, F.; DE FREITAS, K. E. J.; VICTÓRIA, F.C. AND PEREIRA, A. B. Transfer of microsatellite markers from other Arecaceae species to Syagrus romanzoffiana (Arecaceae). Genetics and Molecular Research, v. 18, n. 3, 2019. http://dx.doi.org/10.4238/gmr18183
LEWIS, P. O. and ZAYKIN D. Genetic Data Analysis: Computer Program for the Analysis of Allelic Data. (2001). Disponível em: [http://www.softsea.com/download/GDA-Genetic-Data-Analysis.html].
LITT, M.; LUTY, J. A. A. Hypervariable Microsatellite Revealed by In Vitro Amplification of a Dinucleotide Repeat within the Cardiac Muscle Actin Gene. American Journal of Human
Genetics, v. 44, p. 397–401, 1989.
LORENZI, H. Palmeiras brasileiras e exóticas cultivadas. – Nova Odessa, SP. Instituto Plantarum, ISBN 85-86714-20-8. 2004
LOVELESS, M. D.; HAMRICK, J. L. Ecological determinants of genetic structure in plant populations. Annual Review of Ecology and Systematic, v. 15, p. 65-95, 1984.
MCMANUS, C.; PAIVA, S.; CORRÊA, P.; SEIXAS, L.; & MELO, C. Estatísticas para descrever genética de populações. INCT: Informação Genético-Sanitária da Pecuária Brasileira SÉRIE TÉCNICA: GENÉTICA, 2010.
MATEUCCI, M. B. A.; GUIMARÃES, N. N. R.; DUARTE, J. B. & TIVERON FILHO, D. Determinação do melhor tratamento para superação da dormência em guariroba – Syagrus oleracea (Mart) Becc. Anais das Escolas de Agronomia E Veterinária, v. 25, n. 2. P. 149-153. 1995. MILACH, S. C. K. Marcadores de DNA. Biotecnologia Ciência e Desenvolvimento, n.5, p. 14-17, 1998.
MIRANDA, E. A. G. C. Transferibilidade e validação de marcadores microssatélites derivados de EST para duas espécies de Campomanesia (myrtaceae) do Cerrado. Dissertação de Mestrado, Universidade Federal de Goiás, Goiânia-GO, 103p, 2014.
MIRANDA, I. P. A.; RABELO, A.; BUENO, C. R.; BARBOSA, E. M.; RIBEIRO, M. N. S. Frutos de palmeiras da Amazônia. Manaus: Ministério de Ciência e Tecnologia, Instituto Nacional de pesquisa da Amazônia, 120p. 2001.
MISTURA, C. C.; BARBIERI, R. L.; CASTRO, C. M.; PRIORI, D.; VILLELA, J. C. B. Transferibilidade de marcadores microssatélites de coco (Cocos nucifera) para butiá (Butia odorata). Magistra, v. 24, n. 4, p. 360-369, 2012.
MODRO, A. F. H. Espécies florestais com potencial apícola utilizadas para recuperação de áreas degradadas na Zona da Mata Rondoniense. Cadernos de Agroecologia, v. 10, n.3, 2015. ISSN 2236-7934
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
NASCENTE, A.S.; PEIXOTO, N.; SANTOS, C. W. F. Peso de sementes e emergência de plântulas de Guariroba (Syagrus oleracea Becc.). Pesquisa Agropecuária Tropical, Goiânia, v. 30, n. 2, 2000. NEIVA, D. S.; MELO JÚNIOR, A. F.; OLIVEIRA, D. A.; ROYO, V. A.; BRANDÃO, M. M.; MENEZES, E. V. Acrocomia emensis (Arecaceae) genetic structure and diversity using SSR molecular markers. Genetics and Molecular Research, v. 15, n. 1, 2016. http://dx.doi.org/10.4238/gmr.15017785
PIRES, A S. Perda de diversidade de palmeiras em fragmentos de Mata Atlântica: padrões e processos. Tese de Doutorado, Instituto de Biociências da Universidade Estadual Paulista, Rio Claro, 108p, 2006.
RALLO, P.; DORADO, G.; MARTIN, A. Development of simple sequence repeats (SSRs) in olive tree (Olea europaea L.). Theoretical and Applied Genetics, v. 101, p. 984–989, 2000.
RIVERA, R.; EDWARDS, K. J.; BARKER, J. K.; ARNOLD, G.; AYAD, G.; HODGKIN, T.; KARP, A. Isolation and characterization of polymorphic microsatellites in Cocos nucifera L.
Genome, v. 42, n. 4, p. 668-675, 1999. https://doi.org/10.1139/g98-170
RODRIGUES, D. P.; VINSON, C.; CIAMPI, A. Y.; FARIAS, I. P.; LEMES, M. R.; ASTOLFI-FILHO, S.; CLEMENT, C. R. Novel microsatellite markers for Bactris gasipaes (Palmae).
Molecular Ecology Notes, v. 4, n. 4, p. 575-576, 2004.
https://doi.org/10.1111/j.1471-8286.2004.00739.x
SANTELLI, P.; CALBO, M. E. R.; CALBO, A. G. Fisiologia pós-colheita de frutos da palmeira Syagrus oleracea (Mart.) Becc. (Arecaceae). Acta botânica brasilica, Porto Alegre, v. 20, n. 3, p. 523-528, 2006.
SILVA-CARDOSO, I. M. de A.; DE SOUZA, A. M.; SCHERWINSKI-PEREIRA, J. E. The palm tree Syagrus oleracea Mart. (Becc.): A review. Scientia Horticulturae, v. 225, p. 65–73, jun. 2017. https://doi.org/10.1016/j.scienta.2017.06.054
SIMPLICIO, R. R.; PEREIRA, D.G.; WALDSCHMID, A. M. Transferability of microsatellite markers in Syagrus coronata (Mart.) Becc. (Arecaceae), an iconic palm tree from the Brazilian semiarid region. Genetics and Molecular Research, v. 16, n. 2, 2017. http://dx.doi.org/10.4238/gmr16029699
TEIXEIRA, C.G. Palmito: fino vegetal brasileiro é industrializado em condições precárias.
Tecnologia de Alimentos e Bebidas, 2(3), 12-13, 1996.
VAN OOSTERHOUT, C., HUTCHINSON, W. F., WILLS, D. P. M., & SHIPLEY, P. MICRO-CHECKER: software for identifying and correcting genotyping errors in microsatellite data.
Molecular Ecology Notes, v. 4, n. 3, p. 535-538, 2004.
https://doi.org/10.1111/j.1471-8286.2004.00684.x
WRIGHT, S. Systems of mating. Genetics, v. 6, p. 111–178, 1921.
WRIGHT, S. Evolution and the genetics of populations. II. The theory of gene frequencies, volume 2. University of Chicago Press, 1969.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 59931-59947 aug. 2020. ISSN 2525-8761
WRIGHT, S (1978). Evolution and genetics of populations. Chicago: University of Chicago Press. XIAO. Y.; ZHOU, L.; XIA, W.; MASON, A. S.; YANG, Y.; MA, Z. & PENG, M. Exploiting transcriptome data for the development and characterization of gene-based SSR markers related to cold tolerance in oil palm (Elaeis guineensis). BMC Plant Biology, v.14, p. 384-396, dez. 2014. https://doi.org/10.1186/s12870-014-0384-2