CAROLINA MAIA SILVÉRIO DE CASTRO TAVARES
“EBOLAVIRUS, PRESENTE, PASSADO E FUTURO”
UNIVERSIDADE FERNANDO PESSOA PORTO, SETEMBRO DE 2015
CAROLINA MAIA SILVÉRIO DE CASTRO TAVARES
“EBOLAVIRUS, PASSADO, PRESENTE E FUTURO”
UNIVERSIDADE FERNANDO PESSOA PORTO, SETEMBRO DE 2015
CAROLINA MAIA SILVÉRIO DE CASTRO TAVARES
“EBOLAVIRUS, PASSADO, PRESENTE E FUTURO”
____________________________
Trabalho apresentado à Universidade Fernando Pessoa como parte dos requisitos para a obtenção do grau de Mestre em Ciências Farmacêuticas.
SUMÁRIO
O vírus Ébola causa uma doença hemorrágica grave com alta taxa de letalidade. Foi descoberto em 1976 no Zaire e foi responsável por alguns surtos em África sendo o mais grave o surto de 2014. Os morcegos da fruta são os hospedeiros do vírus e a sua transmissão é feita pelo contacto direto com sangue, secreções ou fluídos de pessoas portadoras do vírus bem como pela ingestão e contacto direto de animais infetados. A doença pode apresentar sinais e sintomas até 21 dias após a sua exposição sendo os primeiros sintomas a febre, dores musculares, dor de garganta e de cabeça, seguido por vómitos, diarreias, disfunção renal, disfunção hepática e nos casos mais graves hemorragias. A hidratação oral ou com fluídos via intravenosa melhora a sobrevida dos pacientes. Existem uma variedade de potenciais tratamentos para a doença e este ano, em 2015, uma vacina é destacada pelos bons resultados, a rVSV-EBOV. Os surtos provocados pelo vírus Ébola podem ser prevenidos se houver informação para tal existindo então medidas preventivas, tais como evitar o contacto com animais infetados, com pessoas infetadas, ter boas práticas de higiene e evitar o contacto com objetos que possam ter tido contacto com sangue ou fluídos contaminados.
ABSTRACT
The Ebola virus causes a severe hemorrhagic disease with a high rate of mortality. It was discovered in 1976 in Zaire and was responsible for some outbreaks in Africa and the most severe outbreak happens in 2014. The fruit bats are the hosts of the virus and its transmission is by direct contact with blood, secretions or fluids of people with virus as well as by direct ingestion and contact infected animals. The disease may show signs and symptoms up to 21 days after exposure and the first symptoms are fever, muscle pain, sore throat and headache, followed by vomiting, diarrhea, kidney dysfunction, liver dysfunction and in severe cases bleeding. The oral rehydration or intravenous fluids improves survival of patients. There are a variety of potential treatments for the disease and this year, in 2015, a vaccine is highlighted by the good results, the rVSV-EBOV. Outbreaks caused by Ebola virus can be prevented if there is information for that and exist preventive measures, such as avoiding contact with infected animals with infected people, have good hygiene practices and avoid contact with objects that may have had contact with blood or contaminated fluids.
AGRADECIMENTOS
Agradeço à minha mãe que apesar de todas as adversidades nunca deixou de acreditar em mim e com a sua dedicação e esforço conseguiu com que eu não desistisse do meu futuro. Sem ela nada disto seria possível.
Obrigada ao meu irmão que à sua maneira está lá sempre.
Ao Bruno por ser o meu pilar. Obrigada por partilhares a vida comigo e por ainda continuarmos a ser diferentes!
Agradeço ao meu orientador, Professor Doutor Ricardo Magalhães por todo apoio prestado, rigor, espírito crítico e disponibilidade que foram fundamentais para a realização deste trabalho.
Obrigada aos meus amigos e colegas de curso, em especial à Raquel, Cláudia, Ivo, Carolina e Joana que passaram estes maravilhosos cinco anos comigo, com os quais partilhei momentos que nunca esquecerei, cresci e aprendi muito.
ÍNDICE
SUMÁRIO ... v
ABSTRACT ... v
AGRADECIMENTOS ... vii
ÍNDICE DE FIGURAS ... x
ÍNDICE DE TABELAS ... xii
I. VÍRUS ... 1
1.1. EBOLAVIRUS ... 1
i. EXPRESSÃO GÉNICA ... 2
ii. ESTRUTURA DA GLICOPROTEÍNA DO VÍRUS ÉBOLA E ORGANIZAÇÃO FUNCIONAL ... 4
iii. INTERAÇÃO COM O SISTEMA IMUNITÁRIO ... 4
iv. HEMORRAGIA E COAGULAÇÃO INTRAVASCULAR DISSEMINADA (CID) 4 v. ESTABILIDADE DO VIRUS ... 5 II. HISTÓRIA ... 6 III. DISTRIBUIÇÃO ... 9 IV. TRANSMISSÃO ... 11 4.1. HOSPEDEIRO ... 11 4.2. MECANISMOS DE TRANSMISSÃO ... 13
i. MECANISMO DE TRANSMISSÃO DO VÍRUS NA NATUREZA ... 13
ii. TRANSMISSÃO ENTRE HOSPEDEIROS SUSCETÍVEIS ... 14
iii. FATORES DE RISCO ... 14
V. EPIDEMIOLOGIA ... 17
5.1. EPIDEMIAS ANTES DO SURTO DE 2014 ... 17
i. SURTOS ASSOCIADOS A CASOS EXPORTADOS E A EXPOSIÇÃO EM
LABORATÓRIO. ... 22
VI. DOENÇA ... 24
6.1. MECANISMOS MOLECULARES DO VÍRUS: A MORTE CELULAR ... 24
i. A ENTRADA DO VÍRUS ... 24
ii. EVENTOS PATOGÉNICOS INDUZIDOS PELO ÉBOLA ... 26
6.2. MANIFESTAÇÕES CLÍNICAS ... 28
6.3. EFEITOS A LONGO PRAZO ... 30
6.4. DIAGNÓSTICO ... 30
i. RESPOSTA IMUNOLÓGICA ... 32
VII. PREVENÇÃO ... 34
VIII. TRATAMENTO ... 39
8.1. ANTIVIRAIS ... 39
8.2. TERAPIAS À BASE DE ANTICORPOS ... 43
8.3. VACINAS ... 44
i. rVSV-EBOV ... 45
IX. CONCLUSÃO ... 49
ÍNDICE DE FIGURAS
Figura 1 – Virião ... 2
Figura 2 – Genoma do vírus Ébola ... 3
Figura 3 – Vítima pelo vírus com hemorragia ... 5
Figura 4 – Doentes com o vírus ... 8
Figura 5 – Número de casos e óbitos registados a 19 de julho de 2015 ... 8
Figura 6 – Distribuição geográfica da doença provocada pelos filovirus em África em 2004 ... 9
Figura 7 – Mudanças na população nacional para os países de risco previstos para a transmissão do vírus Ébola ... 10
Figura 8 – Morcego da fruta ... 11
Figura 9 – Mecanismo de transmissão do Ebolavirus na natureza... 12
Figura 10 – Carne crua de animais selvagens é um dos vetores de transmissão do EBOV ... 15
Figura 11 – Transmissão do vírus Ébola ... 16
Figura 12 – a) Vítima do Ébola; b) Staff médico com vítima de Ébola ... 20
Figura 13 – Distribuição geográfica dos casos de Ébola na África Ocidental, até 19 de julho de 2015 ... 20
Figura 14 – Entrada do vírus Ébola nas células... 25
Figura 15 – Funções imunes inatas atingidas pela infeção do vírus Ébola ... 27
Figura 16 – Funções imunes adquiridas atingidas pela infeção do vírus Ébola ... 28
Figura 17 – Sintomas do Ébola... 29
Figura 18 – a) Exposição de técnicos de laboratório ao Ébola, b) Laboratório móvel na Guiné-Bissau ... 32
Figura 19 – Entrada do EBOV no organismo e a suas consequências ... 34
Figura 21 – Roupa especial usada por quem cuida de pacientes contaminados pelo
Ébola ... 38
Figura 22 – Estruturas do BCX4430 e do BCX-1777 ... 40
Figura 23 – Estrutura do Favipiravir ... 41
Figura 24 – Vias metabólicas do T-705 ... 42
Figura 25 – a) Vacina rVSV ZEBOV-GP; b)Armazenamento da vacina; c) Soro que é preparado a partir das células vermelhas; d) Primeira pessoa a receber a vacina ... 47
ÍNDICE DE TABELAS
Tabela 1 – Nível de risco para a transmissão do vírus do Ébola ... 15 Tabela 2- Surtos da doença do vírus ébola de 1976 a 2013 ... 18 Tabela 3 – Casos acumulados por vírus Ébola, até 19 de julho, em todo o mundo ... 21 Tabela 4 – Número de casos de ébola e óbitos em profissionais de saúde, nos países afetados, até 19/07/15 ... 22 Tabela 5 – Resumo dos casos de DVE exportado e de infeções adquiridas em
laboratório ... 23 Tabela 6 – Testes de diagnóstico para detetar o vírus Ébola ... 31
ÍNDICE DE ABREVIATURAS
BEBOV - Bundibugyo ebolavirus
CCDP – Centro de Controle de Doenças e Prevenção CAR – República Centro-Africana
CATB – Catepsina β CATL – Catepsina L
CIEBOV - Cote d’lvoire ebolavirus DC – Células dendríticas
DNA - Ácido desoxirribonucleico DVE – Doença do vírus Ébola EBOV – Ebolavirus
ELISA – Enzyme-linked immunosorbent assay EUA – Estados Unidos da América
GP – Glicoproteína de superfície GTP- Guanosina trifosfato GlycGP – GP-glicosilada
HIV- Vírus da Imunodeficiência Humana HCV- Vírus da Hepatite C
IFA – Teste de imunofluorescência IgG – Imunoglobulina G
IgM – Imunoglobulina M ITF – Interferon tipo I ITFα – Interferon α L – RNA polimerase
NK- Células “natural killer” NP – Nucleoproteína.
NPC1 – Niemann-Pick C1
OMS – Organização Mundial de Saúde PI3K – Fosfatidilinositol 3’cinase
RDC – República Democrática do Congo REBOV - Reston ebolavirus
RESTV – Estirpe asiática do Ebolavirus RNA - Ácido ribonucleico
RT-PCR – Reação da transcriptase reversa seguida de reação em cadeia da polimerase SARS- Severe Acute Respiratory Syndrome
SEBOV - Sudan ebolavirus sGP – Glicoproteína GP solúvel TEBOV - Taï Forest ebolavirus TAFV - Taï Forest virus
VP35,VP40, VP30 e VP24 – Proteínas estruturais VSV – Vírus da estomatite vesicular
I.
VÍRUS
Os vírus são organismos biológicos de dimensões muito pequenas com grande capacidade de multiplicação. Como alguns fungos e parasitas, os vírus são microrganismos parasitas intercelulares obrigatórios, ou seja, utilizam uma célula hospedeira para se replicarem, isto porque não têm capacidade de sintetizar proteínas, bem como não dependem da obtenção de energia para sobreviverem. O seu genoma é constituído apenas por um tipo de ácido nucleico, ou DNA ou RNA, revestidos por uma camada proteica designada de cápside. (Cruickshank, 1966). A cápside tem como principais funções a proteção contra diversos tipos de agentes, sejam estes, químicos, físicos ou enzimáticos, e também a ligação a recetores celulares que contribui para a entrada do vírus na célula hospedeira. A cápside é constituída por subunidades proteicas que se designam de protómeros e às unidades que estão na superfície dá-se o nome de capsómeros. A estes constituintes, no seu conjunto são designados de virião. (Cruickshank, 1966).
1.1. EBOLAVIRUS
A doença provocada pelo vírus Ébola é uma doença hemorrágica causada por uma infeção com uma das estirpes do vírus Ébola, podendo causar doenças em seres humanos e primatas não-humanos (macacos, gorilas, chimpanzés). (Thomson, 2014). O vírus foi descoberto pela primeira vez perto do rio Ébola, onde se situa atualmente a República Democrática do Congo. (Groseth et al, 2007).
O Ebolavirus (EBOV) pertence à família Filoviridae. A esta família também pertencem os géneros Cuevavirus e Marburgvirus. (www.ictvonline.org). Tem uma estrutura filiforme, ou seja, é comprido e fino e está subdividido em cinco diferentes espécies. (Cristina et al, 2014).
As espécies existentes do EBOV são:
Zaire ebolavirus (ZEBOV) – É a espécie mais letal com taxa de letalidade de 90% que causou vários surtos na República Democrática do Congo.
Sudan ebolavirus (SEBOV) – Com taxa de letalidade de 50% causando surtos no Uganda e Sudão.
Taï Forest ebolavirus (TEBOV) – Que está associado apenas a um caso não
mortal.
Bundibugyo ebolavirus (BEBOV) – Espécie mais recentemente descoberta que causou um surto no Uganda em 2007 com taxa de letalidade de 25%.
Reston ebolavirus (REBOV) – Causou surtos em primatas e suínos nas Filipinas não parecendo ser patogénico para o ser humano. (Muyembe-Tamfum et al., 2012).
i. EXPRESSÃO GÉNICA
A morfologia do vírus Ébola é pleomórfica, ou seja, pode surgir com diferentes formas. Normalmente tem a forma de “U” ou baciliforme mas também pode apresentar-se de forma circular. (Takada e Kawaoka, 2001).
Figura 1 – Virião
(adaptado de www.viralzone.expasy.org)
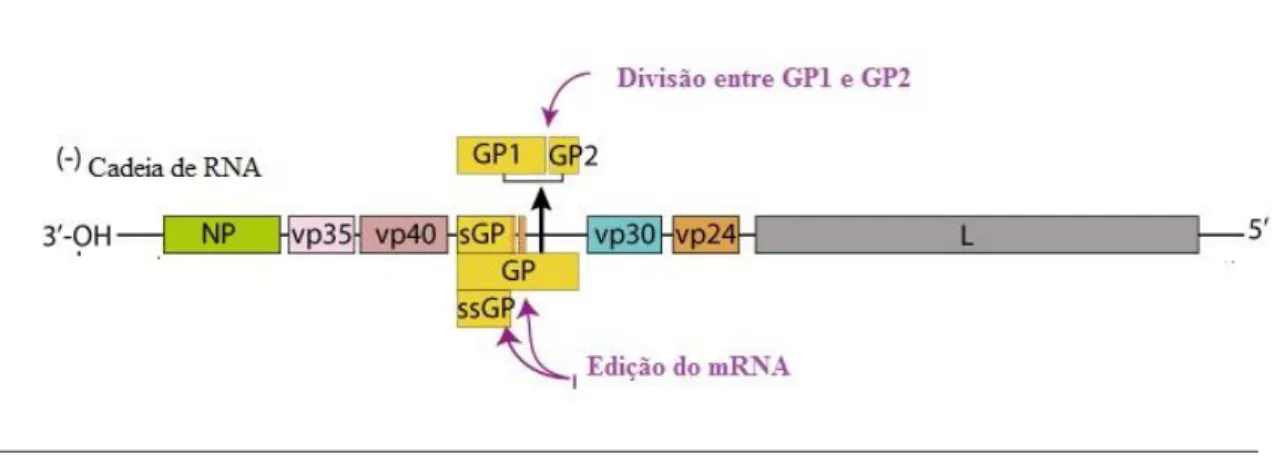
Como se pode ver na figura 1 o vírus possui uma nucleocápside helicoidal estriada e é revestido por uma lipoproteína (NP). Esta membrana lipoproteica tem alongamentos em forma de espinhos. O vírus penetra nas células por ligação de uma glicoproteína (GP), que existe na superfície, a recetores membranares da célula hospedeira. Depois da penetração ocorre a tradução e o vírus obtém estruturas necessárias à sua proliferação. (Takada e Kawaoka, 2001).
Tem um genoma de RNA, de cadeia linear negativa de aproximadamente 19 kb, que codifica sete proteínas, a NP, VP35, VP40, GP, VP30, VP24 e L. (Figura 2). (Cristina et al, 2014). Quatro destas proteínas (NP, VP30, VP35 e L) são conhecidas por se ligarem
diretamente ao sentido negativo do RNA. As restantes três proteínas estruturais incluem a GP, VP40 e VP24. (Elshabrawy et al, 2015).
Figura 2 – Genoma do vírus Ébola (adaptado de www.viralzone.expasy.org)
A NP é a proteína que reveste o virião sendo esta a sua função. (Takada e Kawaoka, 2001). Estudos realizados mostram que a VP35 é o cofator de polimerase que se associa ao RNA viral e atua como antagonista do tipo I do interferon (IFN), fazendo com que o sistema imunitário não possua resposta adaptativa eficaz para o combater, o que seria uma forma eficaz de controlar a infeção viral. (Elshabrawy et al, 2015; Basler et al, 2000). A VP40 e VP24 interagem com as proteínas do envelope e nucleocápside viral servindo de moléculas de ponte. Além disso, um percursor não-estrutural da proteína GP é produzido e subsequentemente clivada originado a sGP. (Elshabrawy et al, 2015). Estudos mostraram que a VP40 é capaz de formar partículas virais filamentosas e, quando expressada com a proteína GP, esta localiza a superfície do virião, sugerindo que ambas as proteínas controlam a forma do virião e a sua morfologia. A VP24 funciona como um regulador de transmissão e replicação viral. Quando o vírus entra no organismo, a VP24 liga-se a uma proteína hospedeira, a KPN-α. Esta proteína perde a capacidade de transportar uma proteína imunológica muito importante, a STAT1, havendo a inibição da sinalização do IFN. (Elshabrawy et al, 2015).
O quarto gene a partir da extremidade 3’ do genoma do EBOV codifica duas proteínas, a GP e a sGP. A GP é a responsável pela ligação ao recetor e pela fusão com as células do hospedeiro e a sGP é excretada a partir de células infetadas. (Takada e Kawaoka, 2001). O L é um gene que codifica a RNA polimerase sendo importante na infecciosidade do
EBOV uma vez que a polimerase é a responsável pela síntese de novas cadeias do genoma viral. (Cristina et al, 2014).
ii. ESTRUTURA DA GLICOPROTEÍNA DO VÍRUS ÉBOLA E ORGANIZAÇÃO FUNCIONAL
A subunidade GP1 contém a ligação ao recetor e media a interação com o recetor da célula hospedeira, interage com e preserva a conformação da subunidade GP2. A subunidade GP2 contém a maquinaria necessária para a fusão do vírus com a célula hospedeira. (Elshabrawy et al, 2015).
A subunidade GP1 consiste em três domínios: a) a metade N-terminal é altamente conservada e forma a base que interage com a GP2; b) a cabeça que contém a sequências de ligação ao recetor e c) o domínio C-terminal. (Elshabrawy et al, 2015).
iii. INTERAÇÃO COM O SISTEMA IMUNITÁRIO
A infeção provocada pelo EBOV provoca nos pacientes infetados uma incapacidade para desenvolver respostas imunológicas adequadas. Esta incapacidade pode ser atribuída à infeção dos fagócitos mononucleares e do sistema reticular fibroblástico, uma vez que são fundamentais com a associação dos nódulos linfáticos a aumentar respostas imunes. A infeção destas células poderia interromper a produção adequada de citocina, resultando de um inadequado desenvolvimento de imunidade. Outra razão para esta falta de capacidade de defesa pode estar na circulação de macrófagos e monócitos que transmitem o vírus a outros tecidos. (Chippaux, 2014)
Assim, como consequência, uma apoptose de leucócitos do sangue é inevitável provocando um desfecho fatal para a doença, que em apenas três dias leva à invasão do sistema endotelial. (Takada e Kawaoka, 2001; Chippaux, 2014).
iv. HEMORRAGIA E COAGULAÇÃO INTRAVASCULAR DISSEMINADA (CID)
A hemorragia e a coagulação intravascular disseminada são consequências da infeção pelo EBOV. Há uma rápida libertação de vários agentes, como citocinas, quimiocinas,
histaminas e peroxidases a partir de monócitos e células endoteliais infetados que podem provocar um choque como o CID. Para além de haver esta circulação de agentes vasoativos, níveis elevados de ITF-α seguido de um aumento de permeabilidade do endotélio podem contribuir também para a indução do choque circulatório. (Takada e Kawaoka, 2001).
As hemorragias provocadas pela infeção são atribuídas a este defeito de coagulação estando representada pela figura 3 uma vítima disso mesmo. (Takada e Kawaoka, 2001).
7
Figura 3 – Vítima pelo vírus com hemorragia (adaptado de www.md-health.com)
v. ESTABILIDADE DO VIRUS
O vírus Ébola é muito resistente conseguindo sobreviver durante vários dias em forma liquida ou seca, fluídos como as fezes, sangue ou vómito. (Leroy et al, 2014). São estáveis à temperatura ambiente e podem resistir a temperaturas de 4ºC ou mesmo a -70ºC. O vírus consegue tolerar múltiplas ações congelamento-descongelamento e mesmo assim são cultivados com sucesso em células Vero, isto é, células de linhagem contínua isoladas do epitélio renal de Macaco verde africano (Ceropithecus aethiopus). (Kuhn e Calisher, 2008).
Também foi observada a estabilidade da atual estirpe do EBOV que provocou o último surto em três superfícies clinicamente relevantes, o aço inoxidável, plástico e placas Tyvek. Além disso também é estável em água, sangue seco humano e de primatas não humanos. (Hoenen et al, 2014).
II.
HISTÓRIA
O vírus do Ébola foi descoberto em 1976 no Zaire e foi responsável por alguns surtos em África, antes do surto atual, que ocorreu na África Ocidental que iniciou em dezembro de 2013. (Chippaux, 2014). O Ebolavirus só foi assim registado na história da humanidade nos últimos 50 anos. (Weyer et al, 2015).
A relação deste vírus com o de Marburg como vírus zoonóticos foi conhecida nos anos 70. Os surtos das populações humanas estavam associados quando havia mortes em chimpanzés ou quando estas tinham estado em contacto com animais selvagens mortos. A primeira evidência neste sentido foi feita com a descoberta do CIEBOV em 1994, e em seguida, nos surtos de 1996 no Gabão e em 2001 na República do Congo. (Weyer et al, 2015).
Os primeiros surtos de febre hemorrágica provocado pelo vírus ocorreram quase simultaneamente em 1976, como foi referido, no sul do Sudão e a noroeste do Zaire, hoje República Democrática do Congo. Estes surtos foram provocados por duas espécies diferentes, designadas de SEBOV e ZEBOV. O primeiro caso no Sudão foi de um trabalhador numa fábrica de algodão que posteriormente foi a fonte de transmissão nosocomial no hospital de Maridi. Foram registados 284 casos com uma taxa de letalidade de 53%. (Muyembe-Tamfum et al, 2012). Mais tarde ocorreu numa vila perto do rio Ébola, a partir do qual a doença leva o seu nome. (www.who.int).
No Zaire, o primeiro caso reporta-se a um instrutor numa escola católica que adoeceu depois de ter ingerido antílope fresco e defumado e carne de macaco numa das viagens que costumava fazer. Aqui foram registados 318 casos com taxa de letalidade de 88%. (Muyembe-Tamfum et al., 2012).
Em 1979, o Sudão foi novamente atingido por um pequeno surto, com 34 casos e 22 mortes. (Heymann et al, 1980).
Entre 1980 e 1993, não ocorreram surtos do vírus mas a partir daqui foram registados vários focos. A maior parte deles foram provocados por ZEBOV e SEBOV, mas alguns deles foram causados por outras espécies como CIEBOV e BEBOV. (Muyembe-Tamfum et al, 2012). Passo assim a descrever algumas situações mais importantes:
Em 1994, chimpanzés do Parque Nacional Tai na Costa do Marfim foram detetados com o vírus Ébola., tendo sido infetado um patologista quando fazia uma autópsia a um chimpanzé morto. Foi tratado no hospital Abidjan como sendo um caso de malária, sem sucesso, e não houve casos secundários. Foi descoberto assim uma nova espécie, a CIEBOV e foi o primeiro surto documentado em primatas não-humanos e o primeiro na África Ocidental. (Le Guenno et al, 1995).
No Gabão, nos anos de 1994, 1996, 1997, 2001 e 2002, registaram-se diversos surtos de febre hemorrágica viral que foram associados à caça de primatas não-humanos. O surto de 1994 foi confundido com febre-amarela afetando mineiros na floresta de Minkebé que tinham morto um gorila infetado para se alimentarem. (Muyembe-Tamfum et al, 2012).
Na República Democrática do Congo o primeiro surto de Ébola aconteceu em 2001-2002, reemergindo em 2003. Foram identificados três casos diferentes, independentes dos episódios de caça e contacto com gorilas. Nesta situação prevaleceu a transmissão entre pessoas do que a transmissão nosocomial, mas mesmo assim três profissionais de saúde foram infetados. O último surto documentado no país foi em 2005, e envolveu 11 pessoas havendo 9 mortes. (Nkoghe et al, 2011).
Em 2007, na região de Mweka, na República Democrática do Congo, um novo surto apareceu estando envolvidos 264 casos e 187 óbitos, com uma taxa de letalidade de 72%. O surto foi aparentemente associado a uma migração elevada de morcegos da fruta para esta região. Neste caso, profissionais de saúde foram pouco afetados. (Leroy et al, 2004).
No Uganda, a febre hemorrágica provocada pelo SEBOV, foi registada em 2000, 2007 e 2011. Em 2000, a região mais afetada foi a de Gulu, propagando-se também para outras cidades, com um total de 425 casos e 224 óbitos, com uma taxa de letalidade de 52%. Este foi o maior surto no Uganda, afetando muitas pessoas onde a transmissão nosocomial aumentou bastante os casos. Uma nova espécies, a BEBOV, provocou mortes em 2007. (Muyembe-Tamfum et al, 2012).
No Sudão, o primeiro caso foi registado em 2004, sendo este um pequeno surto com 17 casos. Foram estabelecidas medidas de controlo da infeção, graças ao precoce reconhecimento do foco pelo instituto de pesquisa Kenya Medical. (Muyembe-Tamfum et al, 2012).
Figura 4 – Doentes com o vírus (adaptado de www.nodisinfo.com)
O atual surto na África Ocidental, aparecendo os primeiros casos em março de 2014, é o maior e o mais complexo surto de Ébola, desde que este foi descoberto. Houve mais casos e mortes, neste surto, do que em todos os outros juntos. (Figura 5). O que provocou esta situação foi o facto de esta vez, o surto se ter espalhado entre países. Da Guiné por via terrestre chegou à Libéria, à Serra Leoa e ao Senegal e por via aérea à Nigéria. (www.who.int).
De entre estes países, a Guiné, Serra Leoa e Libéria têm sistemas de saúde muito fracos, que não dispõem de recursos humanos e infra-estruturas adequadas, tendo apenas, recentemente, saído de longos períodos de conflito e instabilidade. A Diretora Geral da Organização Mundial da Saúde (OMS), a 8 de agosto de 2014, declarou este surto de emergência de âmbito internacional de saúde pública. (www.who.int).
Figura 5 – Número de casos e óbitos registados a 19 de julho de 2015 (adaptado de www.who.int) 3783 10672 13250 1 8 20 1 1 1 4 27741 2512 4808 3949 0 6 8 0 0 0 1 11284
NÚMERO DE CASOS E ÓBITOS ATÉ 19 JULHO 2015
III.
DISTRIBUIÇÃO
Foi usada uma modelagem do nicho ecológico de surtos e casos esporádicos da febre hemorrágica associada à família Filoviridae para fornecer uma perspetiva em grande escala sobre a geografia e distribuição ecológica do vírus Ébola. Previu-se que ia ocorrer em toda a zona da África tropical. A febre hemorrágica provocada pelo Ébola iria a ser prevalente na floresta húmida tropical do centro e na África Ocidental. Também está presente no sudeste da Ásia e das Filipinas com o REBOV. (Peterson et al, 2004). Os filovirus mostram claramente uma geografia relacionada com a estrutura filogeográfica, isto é, sinais genéticos do vírus foram geograficamente estudados. (Peterson et al, 2004).
A figura 6 mostra um resumo da localização geral dos filovirus em África em 2004. A distribuição geográfica da doença está espalhada fundamentalmente pelos países húmidos. A figura 6 a) dá-nos os locais onde ocorreram casos de febre hemorrágica provocada pelos filovirus de espécies diferentes. Na figura 6 b) está representada a projeção geográfica do nicho ecológico com base em todas doenças conhecidas provocadas pelos filovirus ocorridas em África e na figura 6 c) apenas só está representada as ocorridas provocadas pelo Ébola. Já na figura d) é o vírus Marburg que se faz representar. (Peterson et al, 2004)
Figura 6 – Distribuição geográfica da doença provocada pelos filovirus em África em 2004 (Adaptado de Peterson et al, 2004)
O atual surto de Ébola, que começou em março de 2014, foi anunciado pelo Centro de Controle de Doenças e Prevenção (CCDP), como o maior da história. Os últimos 40 anos de surtos foram acompanhados por mudanças consideráveis nos padrões demográficos em toda a África. Tem havido um grande aumento no tamanho da população juntamente com o aumento da urbanização e as populações africanas têm-se tornado mais ligadas internamente como internacionalmente. Estas mudanças só recentemente foram demonstradas como uma influência na transmissão da doença ao longo das diferentes escalas temporais e espaciais. Mudanças no uso da terra e penetração em áreas anteriormente remotas da floresta tropical, faz com que os humanos tenham contacto com novos potenciais reservatórios, enquanto que as mudanças na mobilidade humana pode ter impacto profundo sobre a dispersão dos casos de Ébola durante os surtos. Estas duas condições têm um papel importante na definição do cenário para o surto atual. (Pigott et al, 2014).
Durante o período de 40 anos desde a descoberta do vírus, a população total que vive nestes países que estão previstos estar dentro do nicho zoonótico quase triplicou, passou de 230 milhões para 639 milhões, como mostra a Figura 7. Este gráfico mostra as mudanças na população nacional para os países de risco previstos para a transmissão do vírus Ébola. Para cada país a população (em milhões) é apresentada por três períodos de tempo; 1976, 2000 e 2014, com três barras. Cada barra representa a população rural (a verde) e a urbana (a azul) de cada país. O retângulo cinzento destaca os países em que o risco previsto de transmissão é maior e a diferença percentual da população entre 1976 e 2014 está representada em cima de cada conjunto de barras. (Pigott et al, 2014).
Figura 7 – Mudanças na população nacional para os países de risco previstos para a transmissão do vírus Ébola (adaptado de Pigott et al, 2014)
IV.
TRANSMISSÃO
4.1. HOSPEDEIRO
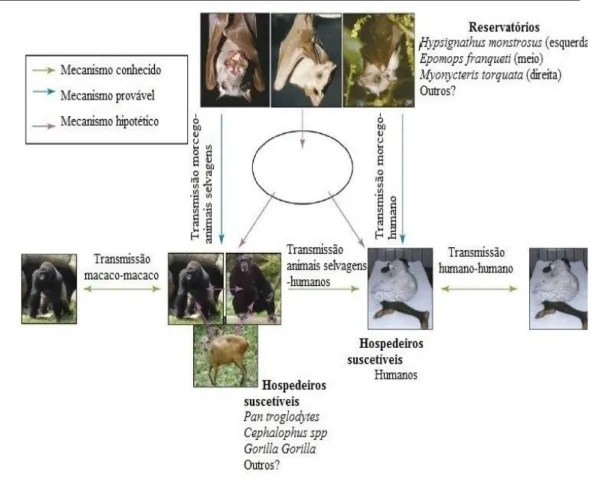
Há muito tempo que os cientistas apostam na hipótese que o EBOV persiste em reservatórios zoonóticos, nas áreas endémicas. Dado que os macacos ficam doentes, esta espécie não é considerada como um reservatório clássico. Assim, na sequência da descoberta do EBOV em 1976, e novamente após o caso de 1994 na Costa do Marfim e o surto de 1995, na República Democrática do Congo, foram feitos esforços intensivos para identificar o reservatório natural do vírus. Mais tarde, num relatório foi indicado a deteção de RNA de ZEBOV em roedores na República Central Africana e surgiu a hipótese de que fossem o reservatório. Este caso teria implicações na transmissão por contacto direto com os roedores infetados, como foi no caso do vírus Lassa, mas estes resultados não foram confirmados por uma metodologia alternativa, como a deteção do antigénio ou isolamento do vírus, ou por outros grupos de pesquisa. (Groseth et al, 2007). Mais recentemente, foram capturados um pequeno grupo de pequenos vertebrados durante o surto de 2001 e 2003 no Gabão e RDC, que evidenciaram infeção assintomática em três espécies de morcegos da fruta, a Hypsignathus monstrosus, Epomops franqueti e
Myonycteris torquata. (Figura 8). (Groseth et al, 2007).
Figura 8 – Morcego da fruta (adaptado de www.md-health.com)
Neste estudo, o RNA do ZEBOV foi encontrado em amostras de fígado e baço, enquanto em que outras amostras foram detetados no soro, em antigénios específicos para o EBOV, indicando talvez que um primeiro grupo de animais tenha sido infetado e ainda não tenha desenvolvido respostas imunes. Foram detetados anticorpos IgG específicos para o
EBOV em 5% dos morcegos destas três espécies, tanto em regiões endémicas como não-endémicas, o que sugere que os vírus circulou em ambas as regiões. (Groseth et al, 2007). Mesmo com estes novos dados sobre o papel dos morcegos na transmissão do EBOV, ainda se deve ter como hipótese outros reservatórios ou potenciais hospedeiros (Figura 9). As setas verdes representam uma transmissão conhecida, as azuis prováveis e as roxas como mecanismos hipotéticos. (Groseth et al, 2007).
O vírus infeta humanos pelo contacto com sangue, secreções, órgãos ou outros fluídos corporais de animais infetados como o chimpanzé, gorilas, morcegos frugívoros, macacos, antílopes e porcos-espinho encontrados mortos ou doentes em florestas tropicais. (www.who.int).
Figura 9 – Mecanismo de transmissão do Ebolavirus na natureza (adaptado de Groseth et al, 2007)
4.2. MECANISMOS DE TRANSMISSÃO
i. MECANISMO DE TRANSMISSÃO DO VÍRUS NA NATUREZA
É claro que uma vez que os seres humanos são infetados, subsequentemente a transmissão do EBOV contínua de pessoa para pessoa principalmente como resultado do contacto próximo com sangue, secreções ou tecidos a partir de doentes. (Groseth et al, 2007). Num estudo para testar a letalidade animal em regiões de febre hemorrágica provocada pelo EBOV, 14 dos 34 cadáveres de animais encontrados foram positivos (dez gorilas, três chimpanzés e um antílope). No entanto, como o vírus é inicialmente passado para os seres humanos, primatas não humanos e/ou outras espécies suscetíveis, outros fatores podem estar envolvidos nesta transmissão. (Groseth et al, 2007).
Considerando a região geográfica inicialmente restrita em que os filovirus são encontrados e os enormes esforços investidos ao longo das últimas três décadas para identificar um reservatório, parece provável que qualquer que seja o reservatório, a transmissão é regulada por condições específicas. Assumindo que o morcego tem um papel importante na transmissão, é importante examinar o papel que os fatores fisiológicos sazonais, ambientais ou temporais têm na replicação do vírus e subsequente transmissão para outras espécies. (Groseth et al, 2007).
Foi observado que o aumento da letalidade em macacos sensíveis pode resultar no final da estação das chuvas e/ou no início da estação seca. Assim, estas mudanças sazonais podem contribuir para a hipótese de transmissão uma vez que na época de estação da chuva há uma proximidade destas espécies com membros da mesma, uma vez que competem por um fornecimento de alimentos, dado que é mais escasso, e se estiverem infetados maior a probabilidade de contaminar outros elementos. No entanto, numa época seca de novembro a fevereiro, que é uma época de abundância de fruta no Gabão, surge a hipótese também de um aumento da interação entre estas espécies com a dos morcegos, uma vez que são morcegos da fruta como foi referido anteriormente. Por sequência, as mudanças da função imunológica nas espécies reservatório, como resultado do stress quer devido à escassez de alimento, ou mudanças fisiológicas como a gravidez, também têm sido indicados como um fator importante na transmissão. (Groseth et al, 2007).
Estas mudanças poderiam desencadear surtos, com efeito os morcegos fêmeas grávidas têm mostrado maior taxas de soroprevalência, isto é, maior quantidade de anticorpos contra o vírus, do que os morcegos fêmeas não-grávidas, e isto juntamente com a baixa soroprevalência dos morcegos juvenis, sugere uma maior hipótese de transmissão horizontal em vez de vertical, embora não seja claro que não possa ocorrer. Se a gravidez está envolvida na transmissão, em seguida, o contacto com tecido da placenta contaminada e/ou fluído aumenta a probabilidade de transmissão. (Groseth et al, 2007).
ii. TRANSMISSÃO ENTRE HOSPEDEIROS SUSCETÍVEIS
Atualmente existem duas teorias para explicar a transmissão dos filovirus entre os hospedeiros suscetíveis na natureza. O primeiro sugere que, como acontece com muitos vírus zoonóticos patogénicos clássicos, o vírus é mantido numa região endémica dentro de um hospedeiro e a sua transmissão ocorre quando há contacto entre o hospedeiro e os seres humanos ou primatas não humanos. No entanto, há outro mecanismo estudado, em que o vírus foi introduzido em populações suscetíveis de uma forma progressiva através de um hospedeiro indefinido. (Groseth et al, 2007).
O período de incubação, período entre a infeção e os primeiros sintomas, é geralmente de 4 a 10 dias, mas pode ser tão curto quanto 2 dias podendo chegar aos 21 dias e a via aérea está descartada no modo de como se transmite o vírus. (Rewar, S e Mirdha, D., 2014).
iii. FATORES DE RISCO
Tem-se observado que os doentes infetados com o filovirus, tendem a ser doentes cujo trabalho os leva à floresta, cavernas ou minas e, em particular, doentes que eram caçadores que tiveram contacto direto com animais selvagens infetados. Além disso, embora não seja muito claro que os surtos tenham surgido pelo contacto direto dos humanos com morcegos, estudos de comportamento humano como um indicador de seropositividade para o EBOV, nos Camarões, associaram um risco aumentado de infeção de EBOV com o consumo de morcegos. (Groseth et al, 2007). Não há nenhuma evidência que os mosquitos ou outros insetos possam transmitir o vírus.
Figura 10 – Carne crua de animais selvagens é um dos vetores de transmissão do EBOV (adaptado de www.md-health.com)
Apenas algumas espécies de mamíferos (por exemplo, seres humanos, morcegos, macacos e símios) demonstram capacidade de se tornarem infetados e transmitir a doença. (Rewar, S e Mirdha, D., 2014). De pessoa para pessoa a transmissão progride com relativa facilidade afetando um elevado número de pessoas apresentando um número básico de reprodução (r0) entre 1,5 e 2,5. (Althaus, 2014). Foi provado também que a infeção tanto nos primatas como nas pessoas foi provocada pela ingestão de primatas infetados. (Figura 10). (Rewar, S e Mirdha, D., 2014).
Quando ocorre uma infeção em humanos, o vírus pode ser espalhado por várias formas, transmitido, por contacto direto:
De sangue com fluidos corporais (incluindo mas não limitado à urina, saliva, suor, fezes, vómito, leite materno e sémen) de uma pessoa que está doente com Ébola; Objetos (como agulhas e seringas) que tenham sido contaminadas;
Morcegos da fruta e primatas. (Rewar, S e Mirdha, D., 2014). Tabela 1 – Nível de risco para a transmissão do vírus do Ébola
O Ébola não se propaga através do ar ou por água. As principais rotas da infeção são através das membranas mucosas em contato por exemplo com feridas na pele. Há relato de casos de profissionais de saúde que estão em meio hospitalar que adquiriram a doença que não foi provocado pela via percutânea mas sim esfregando um olho depois de cuidar de um paciente com infeção clínica. (Rewar, S e Mirdha, D., 2014).
Não há nenhuma evidência de transmissibilidade durante o período de incubação com indivíduos assintomáticos não febris e o risco de transmissão aumenta significativamente com o contacto com o infetado durante a fase aguda da doença. Foram encontrados casos isolados de transmissão entre indivíduos que estavam no mesmo meio domiciliário a qual se atribui a infeção por contacto sexual. (Rewar, S e Mirdha, D., 2014).
Os profissionais de saúde têm suportado o peso do surto de Ébola no oeste africano, não só trabalhando incansavelmente para tratar os doentes, mas arriscando as suas vidas. Um novo relatório da OMS em infeções nos trabalhadores descobriu que os profissionais de saúde apresentam entre 21 e 32 vezes mais probabilidade de serem infetados com Ébola do que as pessoas na população geral. Também demonstrou que tais infeções podem ser evitadas havendo uma diminuição considerável das taxas de infeção através de medidas de prevenção. (www.who.int).
Figura 11 – Transmissão do vírus Ébola (adaptado de www.brasilpost.com.br)
V.
EPIDEMIOLOGIA
5.1. EPIDEMIAS ANTES DO SURTO DE 2014
O extenso surto de doença pelo vírus Ébola (DVE) que ocorreu em 2014 na África Ocidental resultou em mais casos e mortes do que todos os surtos anteriores. Houve uma elevada transmissão e letalidade para os profissionais de saúde. A transmissão nosocomial tem sido uma das principais causas de morbidade e letalidade na doença desde os primeiros surtos descritos no Sudão e no Zaire, atual RDC, em 1976. Apesar dos conhecimentos na transmissão do vírus e da informação clara da OMS e outras estruturas, até ao final do ano de 2014, o atual surto tem documentado que 660 profissionais de saúde foram afetados com 375 mortes entre eles. Além disso a transmissão nosocomial pode significar transmissão para os familiares dos profissionais como dentro da própria comunidade de serviços de saúde. (Shears, P. e O’Dempsey, T., 2015).
Os primeiros surtos registados da doença do vírus Ébola ocorreram em junho de 1976 no Sudão do Sul e em julho de 1976 nas imediações de um hospital missionário em Yambuku, Zaire. Embora os surtos tenham ocorrido quase em simultâneo e na mesma área geográfica, nenhuma ligação entre eles foi estabelecida e, posteriormente, estudos virológicos demonstraram diferenças entre as duas espécies, sendo assinaladas duas espécies diferentes, a ZEBOV e a SEBOV. (Weyer et al, 2015).
O surto no Sudão do Sul começou a 400km da capital regional Juba, na cidade de Nzara, e afetou trabalhadores de uma fábrica de algodão. Um caso sintomático foi transferido para o hospital distrital de Maridi, onde ocorreu uma enorme transmissão nosocomial. No espaço de quatro semanas, um terço dos 220 funcionários do hospital tinham adquirido a infeção e 41 morreram. Nesta altura não havia informação sobre o modo de transmissão desta “nova” doença, e não havia medidas de controlo da infeção ou equipamentos de proteção individual. Neste hospital registaram-se até ao final do surto, 284 casos e 151 mortes. (Shears, P. e O’Dempsey, T., 2015).
Dois meses após o primeiro caso em Nzara, uma doença semelhante tornou-se evidente num hospital em Yambuku, no Zaire, onde as infeções iniciais foram detetadas em pacientes que tinham realizado ambulatório no hospital. Presume-se que transmissão tenha ocorrido através de injeções parentéricas com seringas não esterilizadas entre
pacientes, a partir de um doente suspeito. Foram registados 318 casos com 280 mortes, com taxa de letalidade de 88%. Neste hospital, 11 das 17 pessoas que faziam parte do corpo clinico morreram. Nenhum paciente cujo contacto foi exclusivamente por injeção parentérica sobreviveu e o doente suspeito terá comido carne de animais selvagens durante uma viagem florestal recente. (Shears, P. e O’Dempsey, T., 2015).
Tabela 2- Surtos da doença do vírus ébola de 1976 a 2013 (adaptado de Shears, P. e O’Dempsey, T., 2015)
TL- Taxa de Letalidade 1. Floresta/Área remota
2. Centro Hospitalar, com propagação à comunidade 3. Comunidade e Hospitalar
Depois dos surtos de 1976 no Sudão do Sul e Zaire, foram documentados 18 surtos da doença antes do surto de 2014 na África Ocidental. A nível epidemiológico estes surtos fazem parte de três grupos: aqueles que acorrem em áreas remotas de floresta ligados diretamente ao consumo de carne de animais selvagens; com poucos casos; aqueles centrados a nível hospitalar, com transmissão hospitalar e por último aqueles que ocorrem nas povoações rurais, com transmissão na comunidade. (Shears, P. e O’Dempsey, T., 2015).
Ano País Espécie Casos
reportados TM (%) Situação epidemiológica 1976 Sudão SEBOV 284 53 2 1976 Zaire (RDC) ZEBOV 318 88 2 1979 Sudão SEBOV 34 65 3 1994 Gabão ZEBOV 52 60 1
1994 Costa do Marfim CIEBOV 1 0 1
1995 RDC ZEBOV 315 81 2
1996 Gabão ZEBOV 37 57 1
1996 Gabão ZEBOV 60 74 1
2000 - 2001 Uganda SEBOV 425 53 2
2001 - 2002 Gabão ZEBOV 65 82 1
2001 - 2002 Républica do Congo ZEBOV 57 75 1 2002 - 2003 Républica do Congo ZEBOV 143 89 1
2003 Républica do Congo ZEBOV 35 83 1
2004 Sudão SEBOV 17 41 3
2005 Républica do Congo ZEBOV 12 80 1
2007 RDC ZEBOV 364 71 1, 3 2007 - 2008 Uganda BEBOV 149 25 3 2008 - 2009 RDC ZEBOV 32 47 1 2012 Uganda SEBOV 11 36 3 2012 RDC BEBOV 36 36 1, 3 2012 - 2013 Uganda SEBOV 6 50 3
Os surtos que ocorreram numa área florestal foram no Gabão, República do Congo e República Democrática do Congo, com a exceção de dois grandes surtos na República do Congo e RDC, onde a taxa de letalidade foi de 57% a 83%, mas estiveram associados ao consumo de morcegos da fruta. (Shears, P. e O’Dempsey, T., 2015).
A nível hospitalar foram registados dois grandes surtos, um na RDC em 1995 e outro no Uganda em 2000. Na RDC, o hospital afetado foi o de Kikwit, com 350 camas, afetando 80 profissionais de saúde espalhando-se depois para outros hospitais devido à transferência de um paciente. No Uganda, aconteceu no distrito de Gulu, e afetou dois hospitais e comunidades vizinhas. Houve 425 casos e 224 morte, incluindo 17 funcionários do hospital. (Weyer et al, 2015).
Em 2007, uma nova espécie do vírus foi identificado num surto no distrito de Bundibugiyo, Uganda, resultando em 147 casos relatados, mas com uma taxa de letalidade menor que a espécie do Zaire ou Sudão. Esta espécie, o BEBOV, causou um surto também na RDC em 2012, apesar de não haver ligação entre a zona original do vírus com esta nova. (Shears, P. e O’Dempsey, T., 2015).
Antes de o surto de 2014 surgir, houve uma exceção no que toca à localização, uma vez que em 2014 o surto foi na África Ocidental, mas em 1994, foi relatado também um surto nesta zona, na Costa do Marfim. A infeção ocorreu num zoólogo depois de ter realizado uma autópsia a um chimpanzé na área florestal de Tai. (Weyer et al, 2015).
5.2. SURTO DE 2014
Antes de 2014, os surtos da DVE foram caracterizados como de ocorrência aleatória, que acontece após períodos de aparente silêncio epidemiológico. Esta doença tem sido considerada como de baixa importância para a saúde pública em África comparativamente com outras doenças infeciosas como a malária, tuberculose e HIV (Vírus da Imunodeficiência Humana). (Weyer et al, 2015).
Em março de 2014, a OMS declarou a doença do vírus Ébola (DVE) como emergência, anunciando que se tornaria o mais considerável, fatal e prolongado surto de DVE na história. Desde 15 de dezembro de 2014 até abril de 2015, 18464 suspeitos (com 11699
casos confirmados) associados a 6841 mortes, foram registados abrangendo três países da África Ocidental: Guiné, Serra Leoa e Libéria. (Weyer et al, 2015).
A 8 de agosto de 2014, a OMS declarou o surto de emergência de âmbito internacional de saúde pública e pediu apoio multinacional de forma mais intensa para a contenção do surto. (Weyer et al, 2015). As Nações Unidas solicitaram cerca de 1 bilião de dólares para ajudar a conter a propagação do surto. Em setembro de 2014, os Estados Unidos da América forneceram 500 milhões de dólares e enviaram 3000 militares na região de forma a prestar auxílio no controle da infeção. (Meyer et al, 2015).
a) b)
Figura 12 – a) Vítima do Ébola (adaptado de www.telegraph.co.uk); b) Staff médico com vítima de Ébola (adaptado de www.telegraph.co.uk)
Embora o surto seja descrito como o surto mais fatal até à data, a taxa de letalidade na Guiné nunca é a mesma. Este valor tem oscilado entre os 30 e 60% nos últimos meses e certamente irá continuar a oscilar devido ao melhoramento dos cuidados de saúde que contribuirão para uma maior taxa de sobrevivência. (Meyer et al, 2015).
Figura 13 – Distribuição geográfica dos casos de Ébola na África Ocidental, até 19 de julho de 2015 (adaptado de www.who.int)
Até 19 de julho de 2015 foram notificados pela Organização Mundial de Saúde, em 10 países (Guiné-Conacri, Libéria, Serra Leoa, Mali, Nigéria, Senegal, Espanha, Itália, Reino Unido e EUA), 27 741 casos de doença por vírus Ébola, incluindo 11 284 óbitos (Figura 5), correspondendo a uma taxa de letalidade cerca de 40%. (www.ebola.dgs.pt). A Libéria foi declarada livre de Ébola a 9 de maio de 2015. No entanto, foi identificado um novo caso a 29 de junho. Até 12 de julho foram confirmados mais 5 casos de doença, todos contactos do primeiro. A 3 de setembro de 2015 a OMS volta a declarar a Libéria livre da doença encontrando-se neste momento num período de 90 dias sob vigilância reforçada. (www.who.int)
A tabela 3 compila os casos acumulados da doença até 19 de julho de 2015. Tabela 3 – Casos acumulados por vírus Ébola, até 19 de julho, em todo o mundo
(adaptado de www.ebola.dgs.pt)
Na tabela 4 pode-se ver o número de casos de Ébola e de óbitos ocorridos em profissionais de saúde, até 19 de julho de 2015, nos países afetados da África Ocidental.
Tabela 4 – Número de casos de ébola e óbitos em profissionais de saúde, nos países afetados, até 19/07/15
(adaptado de www.ebola.dgs.pt)
A conclusão é que a natureza, sem precedente, do atual surto na África Ocidental, não é atribuída a fatores virais exclusivos, como o aumento da virulência e transmissibilidade. (Weyer et al, 2015).
É amplamente reconhecido que o surto está a ser afetado por fatores sócio-económicos dos países afetados. Os países em causa estiveram sujeitos a guerras civis que provocaram, entre outros, uma taxa muito baixa de alfabetização e problemas nas infra-estruturas hospitalares. As más condições hospitalares perturbaram o surto, espalhando a doença para aqueles que procuraram tratamento. (Weyer et al, 2015).
i. SURTOS ASSOCIADOS A CASOS EXPORTADOS E A EXPOSIÇÃO EM LABORATÓRIO.
Antes de 2014, o EBOV só tinha sido exportado para a África do Sul, como mostra a tabela 5. O caso envolveu um médico que cuidava de pacientes em Libreville durante o surto do Gabão em 1996. Viajou para a África do Sul para tratamento médico de uma febre aguda e uma enfermeira que cuidou dele também adoeceu e quadro clínico era compatível com a febre hemorrágica, sendo confirmado o caso pelo Instituto Nacional de Doenças Transmissíveis na África do Sul. (Weyer et al, 2015).
O EBOV foi exportado para o Senegal, Espanha, Nigéria, EUA e Mali ao longo de vários meses, enquanto que o surto de DVE estava a progredir na África Ocidental. Nestes países conseguiu-se conter o vírus devido a medidas eficazes que fizeram com que os pacientes estivessem bem isolados e não houvesse a propagação do mesmo. (Weyer et al, 2015). Um total de 3 casos de EBOV adquirido em laboratório foram registados em 38 anos de surtos de DVE. Todos os 3 incidentes ocorreram em laboratórios totalmente preparados
e com boas instalações, apenas uma infeção foi adquirida através de picada de agulha. (Weyer et al, 2015).
Tabela 5 – Resumo dos casos de DVE exportado e de infeções adquiridas em laboratório (adaptado de Weyer et al, 2015)
A chamada estirpe asiática do Ebolavírus, a RESTV, tem sido levada por numerosas ocasiões para as Filipinas através da translocação de macacos cinomolgos, uma espécie de macacos asiática. (Weyer et al, 2015).
O primeiro relatório de RESTV foi durante uma quarentena de macacos cinomolgos (Macaca fascicularis) capturados, importados das Filipinas, numa instalação de detenção de animais em Reston, Virginia, EUA, em 1989. Alguns dos animais em quarentena sofriam de uma doença altamente fatal com características semelhantes à febre hemorrágica símia. (Weyer et al, 2015).
A exportação de macacos das Filipinas foi associada com seis surtos semelhantes em macacos cinomolgos relatados nos EUA, Itália e Filipinas. Curiosamente, apesar de menos virulento que o EBOV, o RESTVé também patogénico em humanos e macacos. (Weyer et al, 2015).
VI.
DOENÇA
6.1. MECANISMOS MOLECULARES DO VÍRUS: A MORTE
CELULAR
A DVE provoca a disfunção de múltiplos órgãos com uma letalidade até 90%. O primeiro ataque é feito aos macrófagos e às células dendríticas. A reação imune inata é caracterizada por uma cascata de citocina, com a secreção de numerosas citocinas pró-inflamatórias, o que induz uma enorme quantidade de sinais contraditórios e provoca agressões no sistema imunitário, bem como a outros tecidos. Existem outros vírus altamente patogénicos que também desencadeiam uma reação das citocinas, mas os filovirus são particularmente letais porque afetam uma enorme diversidade de tecidos. Além do sistema imunitário, o EBOV ataca o baço e os rins, onde mata as células que ajudam o corpo a regular o equilíbrio de líquidos e as células que produzem proteínas que ajudam o sangue a coagular. (Falasca et al, 2015).
O vírus também faz com que o fígado e os pulmões percam as suas funções e impede que os vasos sanguíneos levem o sangue para os tecidos. (Falasca et al, 2015).
i. A ENTRADA DO VÍRUS
Despois de entrar no nosso organismo o vírus ataca muitos órgãos, na verdade, o vírus é capaz de invadir quase todas as células humanas utilizando diferentes mecanismos de fixação para cada tipo de célula, com a exceção dos linfócitos. (Falasca et al, 2015). Foram estudadas várias formas de entrada do vírus nas células, usando diferentes formas como a endocitose mediada por recetor ou macropinocitose. Estudos recentes mostraram que as proteínas do citoesqueleto e o envolvimento da via classe I de fosfatidilinositol 3’-cinase (PI3K), enzimas envolvidas em várias funções celulares, são críticas para a entrada do EBOV. (Falasca et al, 2015).
O tamanho das partículas do EBOV têm um diâmetro uniforme de 80nm, variando de comprimento entre 600-1400nm e as partículas com maior infecciosidade são aquelas com tamanho 850nm. Assim, o tamanho das partículas do EBOV permitem a entrada na célula hospedeira formando pequenas invaginações (50 a 100nm) na membrana do
hospedeiro ou por depressões canónicas revestidas por claritina (200nm). Outro grupo de proteínas envolvidas na entrada do EBOV são as β1-integrinas que estão envolvidas na captação de uma variedade de vírus. (Falasca et al, 2015).
A entrada do EBOV nas células é mediada pela glicoproteína viral GP, fazendo ligar-se aos recetores superficiais das células. No entanto, há outros fatores que fazem com que as partículas virais passem da membrana plasmática do hospedeiro para o compartimento endossomal porque, após a fixação do vírus, este utiliza a via endossomal. Assim sendo, o vírus fixa-se através de macropinocitose e é levado para os compartimentos endossomais, onde as protéases de cisteína, a catepsina β (CATB) e a catepsina L (CATL) digerem a GP dando origem à forma de GP2. Dentro do endossoma a GP2 interage com a proteína NPC1 (Niemann-Pick C1) permitindo a fusão da membrana viral com a do endossoma. Após a fusão, a nucleocápside viral é libertada para o citoplasma, onde o seu genoma é replicado. (Figura 14). (Falasca et al, 2015).
Figura 14 – Entrada do vírus Ébola nas células (adaptado de Falasca et al, 2015)
ii. EVENTOS PATOGÉNICOS INDUZIDOS PELO ÉBOLA
A complexa matriz de eventos patogénicos envolvidos nas graves manifestações clínicas do Ébola derivam vários mecanismos. Estes incluem efeitos diretos nas células, que provoca a destruição das células infetadas, e em efeitos indiretos, que representam um efeito de ampliação levando à destruição de várias funções fundamentais do organismo, como aquelas desempenhadas pela imunidade inata e adaptativa bem como funções endoteliais. (Falasca et al, 2015).
Análises feitas a cadáveres humanos ou a animais infetados indicaram que monócitos/macrófagos, células dendríticas (DC), fibroblastos, hepatócitos, células supra-renais e células epiteliais podem ser infetadas pelo vírus em grande escala, sendo que os monócitos/macrófagos e as células dendríticas são aonde o vírus preferencialmente se replica durante a infeção. Estas células também têm um papel importante na disseminação do vírus por migrarem para fora do baço, nódulos linfáticos e para outros tecidos. (Falasca et al, 2015).
Os vários mecanismos imunológicos que o organismo possui, como o inato e o adaptativo, respondem à infeção. Em particular, a desregulação da imunidade inata envolve a inibição do IFN Tipo I, a perturbação da rede de citocinas/quimiocinas e o comprometimento funcional das células dendríticas e células “natural killer” (NK), como se faz representar pela Figura 15. Assim a infeção pelo EBOV é capaz de impedir a produção do IFN Tipo I através de células infetadas e bloquear a resposta do IFN para células não infetadas (Figura 15 a); a infeção é capaz de induzir a produção massiva de citocinas/quimiocinas pelos monócitos/macrófagos (Figura 15 b); a infeção é capaz de prejudicar a maturação das células dendríticas e desregular a produção de citocinas (Figura 15 c) e a infeção é também capaz de induzir a apoptose massiva das células NK, limitando assim a sua função, prejudicando a maturação das células dendríticas (Figura 15 d). (Falasca et al, 2015).
Figura 15 – Funções imunes inatas atingidas pela infeção do vírus Ébola (adaptado de Falasca et al, 2015)
A desregulação do sistema imune adquirido envolve tanto a imunidade humoral como a imunidade celular. (Falasca et al, 2015). A produção de anticorpos aumenta exponencialmente durante a infeção. Duas diferentes formas da glicoproteína viral GP, do EBOV, a GP solúvel (sGP) e a GP-glicosilada (GlycGP) são capazes de induzir ao bloqueio dos anticorpos. (Figura 16 a). (Falasca et al, 2015).
A imunidade celular fica afetada no sentido que a infeção das células dendríticas resulta numa desregulação na sinapse célula DC/célula-T, caracterizada por uma interação efetiva do complexo de histocompatibilidade MHC com o recetor da célula T (TCR), sendo este o sinal 1. Resulta também num ambiente inflamatório, sinal 3 desregulado, e na ausência de moléculas estimuladoras na superfície das células dendríticas havendo assim um sinal 2 ineficaz (Figura 16 b). A interação inapropriada DC/célula-T induz à apoptose das células T, evita a expansão clonal das células T CD4, e bloqueando assim as funções de ajuda das CD4, como a citotoxicidade mediadas pelas células T CD8 e a produção de anticorpos pelas células B. (Falasca et al, 2015).
Figura 16 – Funções imunes adquiridas atingidas pela infeção do vírus Ébola (adaptado de Falasca et al, 2015)
6.2. MANIFESTAÇÕES CLÍNICAS
Clinicamente, a DVE, que é a doença humana causada por qualquer uma das cinco espécies do vírus Ébola, pode apresentar manifestações de sinais e sintomas até 21 dias após a sua exposição.(Figura 17). (Matua, 2015).
Os primeiros sintomas incluem uma dor de cabeça frontal severa, febre aguda, ultrapassando os 39ºC, fraqueza, dores na região cervical, lombar e nas articulações. No exame físico, os doentes com Ébola apresentam um olhar doente apresentando um rosto não expressivo com olhos encovados. A estes sinais e sintomas vem associada uma rápida e severa perda de peso devido à perda de apetite, disfagia resultante das fortes dores de garganta e dos sintomas severos que esta doença provoca. (Matua, 2015).
Após 2 ou 3 dias, os doentes começam a ter sintomas gastrointestinais, incluindo grave dor abdominal, hematémese (vómito com sangue), náuseas e diarreia com sangue. No quarto dia, os doentes normalmente apresentam dores de garganta, piorando ainda mais a disfagia. Pelo quinto dia, os doentes apresentam conjuntivite, dores no peito, tosse, falta de ar, corrimento nasal, desidratação e sintomas hemorrágicos, que podem variar de uma hematoquezia (fezes pretas) a um corrimento de sangue nas gengivas nos casos mais graves. (Matua, 2015).
Depois de 6 a 8 dias, o sistema nervoso central fica afetado manifestando-se sintomas como a sonolência, delírio e coma. Há também uma grave perturbação metabólica na
coagulação. Neste período os doentes também apresentar melhorias como pioram repentinamente com a falência de órgãos havendo um choque no sistema. (Matua, 2015). Em casos não fatais, os sintomas são geralmente menos graves, exceto a febre que persiste durante vários dias. Estes doentes começam a mostrar sinais de recuperação ao fim da primeira semana, coincidindo com o aparecimento da resposta imune humoral. No entanto, em casos fatais, o quadro clínico é mais agudo, com sinais e sintomas a manifestarem-se antes da primeira semana. Com o desenvolvimento das semanas, os doentes severamente afetados podem sangrar do nariz, gengivas, vagina, ânus, uretra e até mesmo ter episódios de hematémese. Outros doentes podem desenvolver prurido, erupções cutâneas generalizadas, icterícia, hematúria, amenorreia e anúria. Muitos doentes gravemente afetados também podem desenvolver hepatoesplenomegalia, pancreatite, edema facial e normalmente morrem entre o sexto dia e o décimo sexto devido à falha de múltiplos órgãos e ao choque hemorrágico. (Matua, 2015).
Nos doentes que sobrevivem, a recuperação é lenta, geralmente com a duração de várias semanas a vários meses, e associada a uma incapacitação severa, perda de peso, dores de cabeça persistentes, falta de apetite, fraqueza e líbido reduzida. Também podem experimentar distúrbios psicóticos que normalmente duram entre 3 a 9 meses após a infeção, caracterizados por episódios de confusão mental, ansiedade, fadiga, depressão, agitação e agressividade. (Matua, 2015).
Em mulheres gravidas os abortos são comuns e os médicos apontam para um aumento do risco de morte em crianças de mães infetadas, possivelmente pela transmissão do vírus através do leite materno ou por contacto direto com a mãe. (Matua, 2015).
6.3. EFEITOS A LONGO PRAZO
Foi demonstrado que os sobreviventes ao vírus Ébola têm sequelas até dois anos após a infeção ter sido eliminada. Infeções agudas causadas por vírus, tais como o EBOV, são caracterizadas pela rápida produção de partículas infeciosas virais seguida pela resolução e eliminação da infeção. No entanto, sintomas crónicos podem persistir por um longo tempo após a infeção ter desaparecido. (Clark et al, 2015).
Assim sendo, houve consequências para a saúde a longo prazo identificadas em sobreviventes de surtos anteriores de Ebolavirus, tais como, dor nas articulações e músculos, perda de visão e audição, dor abdominal, sangramento, mal-estar e problemas psicológicos. Alguns destes pacientes não conseguiram voltar à sua rotina até 1 ano. (Clark et al, 2015).
Estas consequências nos sobreviventes do Ebolavirus foram estudadas em detalhe para o surto de 2007 de Budibugyo ebolavirus no Uganda. 49 sobreviventes foram contactados 29 meses após o surto dos quais obtiveram amostras de sangue para um estudo mais aprofundado de onde se obteve informação sobre o seu estado de saúde e também foi analisada a sua capacidade funcional. Os controlos para o estudo foram contactos soro negativos. Os resultados mostraram que os sobreviventes estavam em risco significativamente maior que os controlos para os problemas de saúde a longo prazo. Estes incluíam problemas oculares (dor, visão turva), perda de audição, dificuldade em dormir e dor nas articulações. Outras questões são a dor abdominal e nas costas, fadiga, impotência, dores de cabeça, problemas de memória e confusão. Entre osdois grupos não se observou diferenças nos resultados a nível sanguíneo. (Clark et al, 2015).
Não se conhece o que provoca estas complicações mas provavelmente será uma consequência de danos no tecido devido à replicação viral e à resposta imunológica. A presença do vírus nos pacientes não foi determinada no entanto sabe-se que pode persistir nos testículos e olhos depois de estar ausente no soro. (Clark et al, 2015).
6.4. DIAGNÓSTICO
O vírus é geralmente detetável no sangue de pacientes infetados no momento do início dos sintomas de febre, embora os níveis de RNA, no início dos sintomas seja baixo e, em
alguns doentes podem não ser fiavelmente detetável durante os primeiros três dias de doença. (www.cdc.gov).
O RNA viral pode ser detetado estando na fase aguda da doença ou de convalescença a partir da pele do doente (usando-se uma cotonete na mão que recolhe a amostra), saliva, fezes, leite materno, lágrimas e fluído seminal mas não na urina, vómito, expetoração e suor. O vírus é capaz de se manter nos fluídos corporais por vários dias e varia conforme o tipo de líquido sendo que a persistência máxima registada do RNA viral foi até 101 dias após o início dos sintomas no sémen de um sobrevivente de Ébola, até 33 dias a partir da secreção vaginal, 22 dias a partir de cotonete com lágrima, 21 dias no sangue, 15 dias no leite materno, 8 dias na saliva e 6 dias a partir da pele. (www.cdc.gov).
O diagnóstico clínico da DVE é indicado após a ocorrência de variados casos com febre, tendência de sangramento e transmissão de pessoa para pessoa, que está frequentemente associada a perda de peso, diarreia e erupções cutâneas. O diagnóstico laboratorial da doença pode ser confirmado utilizando soro da fase aguda para medir o nível de resposta imunitária especifica ou para detetar antigénios virais e o RNA viral.
A imunoglobulina M (IgM) e a imunoglobulina G (IgG), que são os anticorpos formados contra a doença, podem ser medidas usando o teste de imunofluorescência (IFA), o Western Blot ou por ELISA (Enzyme-linked Immunosorbent Assay). O antigénio viral e o RNA viral podem ser também detetados usando o teste de imuno-histoquímica, IFA, ELISA e RT-PCR (reação da transcriptase reversa seguida de reação em cadeia da polimerase). (Matua, 2015). Regra geral os testes laboratoriais utilizados no diagnóstico do Ébola (Tabela 6).
Tabela 6 – Testes de diagnóstico para detetar o vírus Ébola (adaptado de www.cdc.gov)
A deteção direta de partículas virais pode ser realizada através de microscopia eletrónica. No entanto, como regra geral e para garantir a segurança, é extremamente importante que toda a análise laboratorial ocorra num nível elevado de segurança, garantindo a máxima contenção biológica, a fim de reduzir o risco de infeção do pessoal do laboratório. (Matua, 2015).
a) b)
Figura 18 – a) Exposição de técnicos de laboratório ao Ébola, b) Laboratório móvel na Guiné-Bissau (adaptado de www.ultimahora.com e de www.rr.sapo.pt respetivamente)
i. RESPOSTA IMUNOLÓGICA
A resposta imune humoral ao vírus Ébola pode ser detetada tão cedo quanto 10 – 14 dia após a infeção. Os anticorpos específicos formados contra o vírus são dirigidos em primeiro lugar contra as glicoproteínas superficiais virais. (Matua, 2015).
A rápida resposta imunológica com direcionamento para as glicoproteínas virais pode levar à sobrevida do doente. Este facto foi baseado em estudos realizados em sobreviventes no surto de 1996, no Gabão, que concluíram que uma rápida resposta imune pode ser a chave para sobrevivência ao vírus. (Matua, 2015).
A disseminação do EBOV aos hepatócitos, células da suprarrenal e células endoteliais contribui para a coagulopatia que pode resultar num choque hemorrágico. A lesão hepática provocada pelo vírus reduz a produção dos fatores de coagulação, enquanto que, a infeção na glândula suprarrenal reduz a produção das hormonas que regulam a pressão arterial como está representado na Figura 19. Além disso, os monócitos e macrófagos infetados produzem mediadores pró-inflamatórios (IL-1b, IL-6, IL-8, IL-10, MIP-1b e
INF), espécies reativas de oxigénio, óxido nítrico e fator tecidual (TF), que promove o esvaziar endotelial. (Messaoudi e Basler, 2015).
Nas fases iniciais da infeção, os sobreviventes têm a tendência a ter níveis elevados de IgG e IgM, que têm a função de se ligarem às glicoproteínas virais e estão associadas a uma intensa resposta inflamatória, incluindo a presença de interleucina β, interleucina 6 e o TNFα (fator de necrose tumoral). Esta resposta é seguida pela eliminação dos antigénios virais circulantes e ativação das células T citotóxicas. Os doentes que morrem com Ébola têm concentrações elevadas de interferon α (ITFα) e as suas células do sangue periférico tiveram uma morte celular mais extensa do que os sobreviventes. (Matua, 2015).
Uma resposta inflamatória antecipada e bem regulada é caracterizada por níveis baixos de interferons e das espécies reativas de oxigénio e nitrogénio que indicam elevadas hipóteses de recuperação. Em contraste, elevadas concentrações sanguíneas de óxido nítrico, resultante de uma resposta inapropriada às partículas virais, pode resultar em morte. Se a resposta humoral tiver uma deficiência de IgG e IgM, há uma incapacidade de controlar a replicação do vírus, conduzindo assim, este facto, à morte. (Matua, 2015). Portanto, a sobrevivência ao vírus está fortemente relacionada com uma boa resposta imunológica, quer a humoral quer a celular, por parte do organismo. (Matua, 2015).
Figura 19 – Entrada do EBOV no organismo e a suas consequências (adaptado de Messaoudi e Basler, 2015)
VII.
PREVENÇÃO
A OMS reforça a ideia de que é necessário tornar mais resistentes os sistemas de saúde para episódios de epidemias emergentes como no caso do Ébola. Para se conseguir isso deve-se enfrentar a pobreza, fortalecer os serviços de saúde com apoio técnico e financeiro assim como desenvolver infra-estruturas adequadas. (Fallah et al, 2015). Antes do último surto, o financiamento dos cuidados de saúde era apoiado, em grande parte, por doadores. Na falta de uma economia forte, não há reservas financeiras disponíveis para circunstâncias normais ou situações de emergência, sendo um exemplo a falta de equipamento de proteção para os profissionais de saúde como aconteceu neste surto. Um obstáculo para o progresso económico é a ausência de infra-estruturas básicas como a existência de transportes inadequados que fazem com que a Libéria rural esteja